蛋白质含量检测PPT教学课件
合集下载
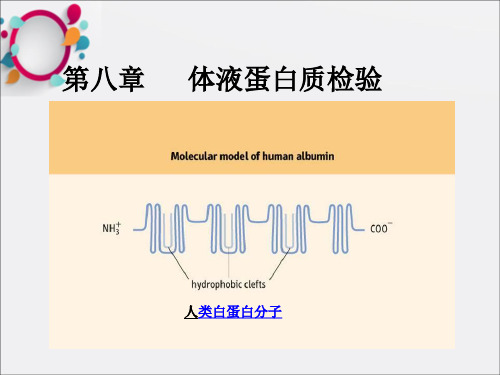
实验一血清蛋白质测定(共51张PPT)

【注意事项】
1.测定的血清以新鲜为宜,但在冰箱保存而不混 浊的标本也可应用,高脂血症混浊血清会干扰比 色,可采用下述方法消除:取2支带塞试管或离 心管,各加待测血清,再加蒸馏水和丙酮10ml, 塞紧并颠倒混匀10次后离心,倾去上清液,将试 管倒立于滤纸上吸去残余液体。向沉淀中分别加 入双缩脲试剂及双缩脲空白试剂,再进行与上述 相同的其他操作和计算。
-----------------
-----------------
标准
A 血红蛋白和BCG产生与白蛋白相等的颜色强度,血红蛋白在1g/L以下无明显干扰,2g/L使吸光度增高3.
2.10mmol/L BCG贮存液
标准
3.叠氮钠贮存液
4.聚氧化乙烯月桂醚(Brij-35)贮存液
5.BCG试剂
实验一 血清蛋白质测定
但本法的检出限为~,这相当于70g/L的血清3~24μl,已能满足临床生化检验的需要,成为临床实验室血清TP首选的最方便,实用的常规方法。 酚酞、溴磺酞钠在碱性溶液中呈色,影响测定结果,右旋糖酐可使测定管混浊亦影响结果,理论上这些干扰均可用相应的标本空白管来消除。 3.在波长630nm处用空白管调零,用定量加液器加BCG试剂,与测定管血清混合后,立即在30±3s内,读取吸光度。 4%,4g/L使吸光度增高7. 2 桌面,边台,水池,窗台,仪器要一尘不染,请值日生用抹布擦干净。 4(显蓝绿色),受酸、碱影响较大,故所用的器材必须无酸、碱污染,BCG工作液的pH必须精确度监测,务必使其保持在限度内。 手工操作参数:波长540nm,光径1cm; 用双缩脲法测定血清标本中总蛋白浓度,用溴甲酚绿法测定血清白蛋白浓度, 蛋白质测定方法很多,常用的有: 丽春红蛋白结合法测得的结果与凯氏定氮法相符,并且显色后在室温可稳定24小时; 1.黄疸血清,溶血,高糖,酚酞等干扰用样本空白来消除。 由于血红蛋白本身能与双缩脲试剂反应,产生与血清白蛋白和球蛋白相近的显色效价,故应注意高血红蛋白的影响。 取试管4支,标明测定管(U)、标准管(S)、标本空白管(B)、试剂空白管(RB)。 双缩脲法测定血清总蛋白
蛋白质的测定课件参考.ppt

1.装水至 2/3 容积 处,加甲 基橙数滴 及硫酸数 毫升以保 持酸性
4.NaOH 溶液
4.5.6 5.水洗漏 步操 斗数次 作要 6.夹好漏斗 迅速 夹,水封。
2.管下端 插入液面 下(瓶内先 装硼酸液 及混合指 示剂2滴)
7.水蒸气蒸馏至指示剂变绿色 开始计时,蒸馏10min,将管
8.吸收液用0.01000mol/L HCl标准溶液滴定至
总蛋白质含量 氨基酸组成 蛋白质的营养价值
精选课件
2
5、蛋白质的测定方法
利用蛋白质共性的方法
凯氏定氮法 杜马斯法
福林酚法
利用特定氨基酸残基法
染色法
精选课件
3
第二节 蛋白质的定性测定
一、蛋白质的一般显色反应
电泳或纸层析之后用一些染料与蛋白质结合并 变色。书中列举了 5 种染料。
二、复合蛋白质的显色反应
第一节 概述
1.蛋白质的元素组成(The elements of protein)
▪ C:50-55% N:15-18% O:20-23%
▪ H:6-8% S:0-4%
▪ 微量元素:P、Fe、Zn、Cu
2、基本结构单位:氨基酸
3、蛋白质的变性作用。
精选课件
1
4、蛋白质分析的重要性
▪ 生物活性测定 ▪ 功能性质调查 ▪ 营养标签
精选课件
17
操作方法
▪ 1、制作标准曲线 取10支干试管分成两组,按下表平行操作:
0ቤተ መጻሕፍቲ ባይዱ
1
2
3
4
标准蛋白液/ml
0.2 0.4 0.6 0.8
蛋白浓度 /(mg/ml)
2.0 4.0 6.0 8.0
蒸馏水/ml
4.NaOH 溶液
4.5.6 5.水洗漏 步操 斗数次 作要 6.夹好漏斗 迅速 夹,水封。
2.管下端 插入液面 下(瓶内先 装硼酸液 及混合指 示剂2滴)
7.水蒸气蒸馏至指示剂变绿色 开始计时,蒸馏10min,将管
8.吸收液用0.01000mol/L HCl标准溶液滴定至
总蛋白质含量 氨基酸组成 蛋白质的营养价值
精选课件
2
5、蛋白质的测定方法
利用蛋白质共性的方法
凯氏定氮法 杜马斯法
福林酚法
利用特定氨基酸残基法
染色法
精选课件
3
第二节 蛋白质的定性测定
一、蛋白质的一般显色反应
电泳或纸层析之后用一些染料与蛋白质结合并 变色。书中列举了 5 种染料。
二、复合蛋白质的显色反应
第一节 概述
1.蛋白质的元素组成(The elements of protein)
▪ C:50-55% N:15-18% O:20-23%
▪ H:6-8% S:0-4%
▪ 微量元素:P、Fe、Zn、Cu
2、基本结构单位:氨基酸
3、蛋白质的变性作用。
精选课件
1
4、蛋白质分析的重要性
▪ 生物活性测定 ▪ 功能性质调查 ▪ 营养标签
精选课件
17
操作方法
▪ 1、制作标准曲线 取10支干试管分成两组,按下表平行操作:
0ቤተ መጻሕፍቲ ባይዱ
1
2
3
4
标准蛋白液/ml
0.2 0.4 0.6 0.8
蛋白浓度 /(mg/ml)
2.0 4.0 6.0 8.0
蒸馏水/ml
蛋白质的研究方法优秀课件.ppt

就是利用SDS的这种结合在整个蛋白分子上,并使蛋白 完全变性的特性。
这样经过SDS变性的蛋白质在电场中完全按大小分离开。
蛋白质的研究方法优秀课件
18
非离子去污剂:
相对温和,一般不会使蛋白质变性。只是将蛋白质 分子从膜上溶解下来而已。
➢当[去污剂]<其CMC值的时候,去污剂分子与膜蛋 白表面的疏水区域结合,使蛋白质在水溶液中溶解 而不聚集。 ➢当[去污剂]≧其CMC值的时候,去污剂分子将与膜 磷脂一起形成混合微团,膜蛋白以整合在微团中的 形式存在。
蛋白质的研究方法优秀课件
22
细胞碎片的去除——离心( centrifugation)
原理:悬浮在溶液中的两个或多个不同质量或密度 的颗粒(如细胞、细胞器、大分子复合体、或分子 等)沉降到试管的底部的速度是不一样的,质 量越大、或密度越高沉降的速度越快。
沉淀:固体性的细胞碎片和细胞器沉降到离心管的 底部形成;
蛋白质颗粒表面有一层水膜,也称水化层。水化层 的存在使蛋白质颗粒相互隔开,不会聚集成大颗粒 而沉淀。
蛋白质有两性解离性质。如果溶液的PH值偏离了PI, 所有分子都带相同电荷,又会进一步增进它们的分 散能力。
蛋白质的研究方法优秀课件
25
#
蛋白质的研究方法优秀课件
26
等电点(PI):
1.能破坏蛋白质分子水化作用 2.是减弱分子间同性相斥作用的因子
蛋白质的研究方法优秀课件
5
制备过程中注意事项:
要求自始至终保持在天然状态
• 避免一切过激因素如:过酸或过碱,高温, 重金属等的影响。
2. 通常都在低温条件下操作。
3. 尽可能使样品中蛋白质的浓度维持在较高
水平。
蛋白质的研究方法优秀课件
这样经过SDS变性的蛋白质在电场中完全按大小分离开。
蛋白质的研究方法优秀课件
18
非离子去污剂:
相对温和,一般不会使蛋白质变性。只是将蛋白质 分子从膜上溶解下来而已。
➢当[去污剂]<其CMC值的时候,去污剂分子与膜蛋 白表面的疏水区域结合,使蛋白质在水溶液中溶解 而不聚集。 ➢当[去污剂]≧其CMC值的时候,去污剂分子将与膜 磷脂一起形成混合微团,膜蛋白以整合在微团中的 形式存在。
蛋白质的研究方法优秀课件
22
细胞碎片的去除——离心( centrifugation)
原理:悬浮在溶液中的两个或多个不同质量或密度 的颗粒(如细胞、细胞器、大分子复合体、或分子 等)沉降到试管的底部的速度是不一样的,质 量越大、或密度越高沉降的速度越快。
沉淀:固体性的细胞碎片和细胞器沉降到离心管的 底部形成;
蛋白质颗粒表面有一层水膜,也称水化层。水化层 的存在使蛋白质颗粒相互隔开,不会聚集成大颗粒 而沉淀。
蛋白质有两性解离性质。如果溶液的PH值偏离了PI, 所有分子都带相同电荷,又会进一步增进它们的分 散能力。
蛋白质的研究方法优秀课件
25
#
蛋白质的研究方法优秀课件
26
等电点(PI):
1.能破坏蛋白质分子水化作用 2.是减弱分子间同性相斥作用的因子
蛋白质的研究方法优秀课件
5
制备过程中注意事项:
要求自始至终保持在天然状态
• 避免一切过激因素如:过酸或过碱,高温, 重金属等的影响。
2. 通常都在低温条件下操作。
3. 尽可能使样品中蛋白质的浓度维持在较高
水平。
蛋白质的研究方法优秀课件
最新实验一蛋白质含量测定ppt课件

生物化学与分子生物学基础实验
TU1800 紫外可见分光光度计
波长范围:200-1100nm 钨灯:340-1100nm
测光系统:单光束
氘灯:200-340nm
功能指标:光度测量 光谱扫描 定量测量
生物化学与分子生物学基础实验
注意事项
1 测紫外吸收要用石英比色皿 ! 2 定量实验取液要准确。 3 从低浓度到高浓度依次测量,比色皿不要润 洗。 因此3ml溶液足够测定。 4 测量完毕,请把光度计的盖打开 ! 5 每次实验时提交上一次的实验报告。
生物化学与分子生物学基础实验
生物化学与分子生物学基础实验
Folin-酚试剂法(Lowry法)
实验步骤
0 1234567
标准蛋白(1mg/ml)ul 0 20 40 80 120 160 200 0
待测样品 ul
-
- - - - - - 200
蒸馏水 ul
1000 980 960 920 880 840 800 800
Folin-酚试剂甲 ml
3、所有的样品(包括标准样品),都必须在规定时间 内测试。时间过长,得到的吸光值会有变化,导致测出 的样品浓度与实际的浓度不符。
生物化学与分子生物学基础实验
722型光栅分光光度计
光 源
单 色
样
光
读
品
电
数
器
池
源
单
件元
测量完毕,请把光度计的盖打开 !
讲解完毕后,每个组出一个同学去 127听老师讲解仪器使用。
生物化学与分子生物学基础实验
Folin-酚试剂法(Lowry法)
• 酸、铜离子螯合剂(如EDTA、柠檬酸等)、还原剂(如巯基乙 醇、DTT、苯酚等)干扰本反应。
《血清蛋白质测定》PPT课件
• ⑹血浆蛋白质广泛应用于组织和细胞的培养,血浆中含有各总细胞刺激因子 和抑制因子,它们对稀薄啊的活力、增殖、分化、胞内酶的合成及细胞特殊 功能起者特殊的作用。
• ⑺在人类不少疾病,包括两种常见的疾病——动脉粥样硬化及肿瘤的发病学 研究,以及最常见的糖尿病及其并发症的发病机制中,血浆蛋白质均有广泛 涉及。
• 补体蛋白类 • 补体蛋白C • B因子 • D因子 • 备解素
• P因子又称备解素(properdin),是替代途径中除C3以外最 先发现的一种血浆蛋白。现已探明,P因子以聚合体形式而 存在:即三聚体(54%)、二聚体(26%)和四聚体(20%) 都有,但特异活性的顺序依次为:四聚体>三聚体>二聚体。 P因子为由4条相同的肽链(分子量各55kDa)组成的四聚体 分子,链间以非共价键相连接,分子量为220kDa。P因子的 生物学活性是以高亲和力与c 3bBb和C 3bnBb相结合,结合 后通过发生构象改变而加固C3b与Bb间的结合力,从而可使 其半衰期由2分钟延长至26分钟。另外,P因子还可封闭H因 子的抑制作用,更增加了上述两种酶的稳定性及活性,有利 于促进替代途径级联反应的继续进行。因此,P因子实际上 是替代途径中的一个重要的正调节分子。因其常成为c 3bBb 和C3bnBb复合物中的组成成分之一,故将其作为补体系统的 固有成分在此一并描述。此外,在膜增生性肾小球肾炎病人 血清中发现有一种C3肾炎因子(C3nephritic factor,C3NeF) 实际为C 3bBb的自身抗体,也可与C3bBb结合而增加c 3bnBb 的稳定性,使其半衰期处长10-30倍。
• ⑵生理学家与病理生理学家;注重蛋白质的生理 功能,研究其胶体性质、缓冲性质和生理作用, 运输、结合功能等。
• ⑶血浆蛋白质 具有遗传的变异:如Hp、TFP等在不 同的人群中常见有结构上的差异,以及某些蛋白质 的缺乏表现出一定的临床症状,具有临床意义;遗 传学家利用蛋白质结构上的差异作为研究人群与家 族遗传特征的标志。
ppt牛奶中蛋白质含量的检测

考核评价
自我评价(30%) 小组评价(30%) 教师评价(40%)
谢谢聆听!
敬请批评指正
八、小结
步骤 湿法消化
碱化蒸馏 硼酸吸收 盐酸滴定
反应前后颜色变化
凯氏烧瓶:样品无色(加硫酸前)→加硫 酸炭化黑色→消化后红棕色→ 棕褐色→消 化终点蓝绿色/墨绿色→淡蓝色(冷却后溶
液) 反应室:深蓝色或黑色沉淀
紫红色→绿色
甲基红和溴甲酚绿混合指示剂:绿色→灰色 甲基红和亚甲基蓝混合液:绿色→蓝紫色
硼酸溶液(20g/L)1L怎么配制?
氢氧化钠溶液(400g/L)1L怎么配制? 盐酸标准滴定溶液(0.0500mol/L)2L怎么配 制?(注意) 混合指示剂:甲基红1+溴甲酚绿5
四、实验准备
硼酸溶液(20g/L):称取20g硼酸,加水溶解后并 稀释至1000mL。
氢氧化钠溶液(400g/L):称取40g氢氧化钠加水 溶解后,放冷,并稀释至100mL。
任务1 牛奶中蛋白质含量的检测0102 Nhomakorabea03
04
检查学生的 出勤情况
工作服穿 戴情况
学习用具 是否齐全
本次任务的 安全培训
实验安全最重要, 操作规则记心上。 个人防护有意识, 职业素养即养成。 防电,防烫,防硫酸!!
一、实验目的 二、相关知识 三、实验仪器及试剂 四、实验准备
五、实验步骤
六、数据分析及处理 七、注意事项
五、实验步骤
1.样品消化处理
• (1)称取10~25g试样,移入干燥的消 化管中,加入0.2g 硫酸铜、6g硫酸钾及 20mL浓硫酸,置于控温消化炉上。
• (2)小心加热,待内容物全部炭化,泡 沫完全停止后,加强火力,并保持瓶内 液体微沸,至液体呈蓝绿色并澄清透明 后,再继续加热0.5~1h。取下冷却备用 。同时做空白试验
蛋白质检测方法ppt课件

✓优点:极高的显色灵敏度 和良好的检出限
✓缺点:水合茚三酮和不同 的氨基酸显色程度有所差 异,蛋白质水解程度的不 同容易对测量结果造成较 大误差。此外,茚三酮显 色剂的稳定性较差,不利 于长期存储
15
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
18
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
4
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
免疫印迹法检 测样品中特异 蛋白质的基本 流程
5
样品的凝胶电泳 蛋白印迹 封闭反应
与特异性抗体(一抗)孵育 与酶耦联的二抗孵育 显色或化学发光显影 观察和记录结果
✓ 优点:简便、灵敏、快速,不消耗样品,测定后能回 收
✓ 缺点:准确度较差、专一性差、干扰物质多,若样品中 含有嘌呤、 嘧啶及核酸等能吸收紫外光的物质,会出 现较大的干扰
7
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
16
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
近红外光谱法
✓ 原理:当红外光照射样品分子时,极性共价键选择性地吸 收某些波长的光后产生振动能级跃迁,吸收光子的频率与跃 迁前后的能量差相关,吸收的强度取决于化学键振动的非谐 性。分子的基频振动产生的吸收谱带位于波长2500-25000nm 的中红外区域,发生780-1100nm 的短波近红外区11002500nm 的长波近红外区的吸收谱带对应着基频振动的倍频 和组合频。含氢基团(X-H)的振动跃迁非谐性常数最高, 其在有机物的近红外吸收光谱中占主导地位。 ✓ 优点:绝大多数的有机物都有吸收响应,所以测量时几乎 无需进行样品前处理 ✓ 缺点:吸收系数小,其检测限通常不到 0.1%,不利于对蛋 白质的衡量分析
✓缺点:水合茚三酮和不同 的氨基酸显色程度有所差 异,蛋白质水解程度的不 同容易对测量结果造成较 大误差。此外,茚三酮显 色剂的稳定性较差,不利 于长期存储
15
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
18
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
4
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
免疫印迹法检 测样品中特异 蛋白质的基本 流程
5
样品的凝胶电泳 蛋白印迹 封闭反应
与特异性抗体(一抗)孵育 与酶耦联的二抗孵育 显色或化学发光显影 观察和记录结果
✓ 优点:简便、灵敏、快速,不消耗样品,测定后能回 收
✓ 缺点:准确度较差、专一性差、干扰物质多,若样品中 含有嘌呤、 嘧啶及核酸等能吸收紫外光的物质,会出 现较大的干扰
7
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
16
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
近红外光谱法
✓ 原理:当红外光照射样品分子时,极性共价键选择性地吸 收某些波长的光后产生振动能级跃迁,吸收光子的频率与跃 迁前后的能量差相关,吸收的强度取决于化学键振动的非谐 性。分子的基频振动产生的吸收谱带位于波长2500-25000nm 的中红外区域,发生780-1100nm 的短波近红外区11002500nm 的长波近红外区的吸收谱带对应着基频振动的倍频 和组合频。含氢基团(X-H)的振动跃迁非谐性常数最高, 其在有机物的近红外吸收光谱中占主导地位。 ✓ 优点:绝大多数的有机物都有吸收响应,所以测量时几乎 无需进行样品前处理 ✓ 缺点:吸收系数小,其检测限通常不到 0.1%,不利于对蛋 白质的衡量分析
分光光度法检测蛋白质含量课件

实验一
分光光度技术及蛋白含量测定
•分光光度法检测蛋白质含量
• 理论 掌握分光光度技术的基本原理 了解分光光度计的基本构造
• 实验: 利用分光光度技术进行蛋白质含量测定 1.双缩脲法测定蛋白质含量 2.考马斯亮兰结合法测定蛋白质含量 3.紫外分光光度法测定蛋白质含量
•分光光度法检测蛋白质含量
分光光度技术(Spectrophotography)
标准曲线使用注意事项
❖标准曲线范围在测定浓度的一半到二倍之间。 ❖吸光度在0.05~1.0范围内。 ❖所作标准曲线仅供短期使用。 ❖标准曲线制作与测定管测定应在同一台仪器上进行,
避免误差产生。
•分光光度法检测蛋白质含量
5.应用中注意的问题***
❖ Lambert-beer’s law的偏离:该定律只适应于一定浓度 范围,A宜在0.05~1.0之间;
一、概念 利用物质特有的吸收光谱来鉴别物质或测定其含
量的一项技术 。 应用:定性、定量 优点:灵敏度高 精确度高 操作简便、快速
•分光光度法检测蛋白质含量
二、工作原理
❖物质对光线有选择性吸收作用。 ❖每种物质都具有其特征性的吸收光谱。 ❖在一定条件下,物质对光的吸收程度与该物质
的浓度成正比。
分光光度法所使用的光谱范围: 200nm ~ 10µm
优点:灵敏度高,1-5μg;测定速度快;干扰物质少。
•分光光度法检测蛋白质含量
【操作步骤】
1.取试管3支,编号按下表操作
试 剂(ml)
空白 标准
生理盐水
0.1
蛋白标准液(50ug/ml)
0.1
样品
0.1
考马斯亮蓝试剂 5.0 5.0
标本 5.0
2.混匀,放置5分钟,在波长595nm处,以空白管调“0”,测 定各管的吸光度。
蛋白质含量的测定 考马斯亮蓝染色法(共20张PPT)

光源
0.575
单色器
吸收池
检测器 显示器
第6页,共20页。
➢ 光源
不同的光源都有其特有的发射光谱,因此可采用不同的发光体作为仪器的光源
钨灯的发射光谱:钨灯光源所发出的320~1100nm波长的光谱,光通过三棱镜折射
后,可得到由红、橙、黄、绿、蓝、靛、紫组成的连续色谱;该色谱可作为 可见光分光光度计的光源
吸收光谱,可以鉴别溶液中所含的物质 Ø当光线通过某种物质的溶液时,透过的光的强度减弱。因为有一部分光在溶液的表面反射,一 部分光被组成此溶液的物质所吸收,只有一部分光可透过溶液,则:
入射光=反射光+吸收光+透过光
Ø如果我们用蒸馏水(或组成此溶液的溶剂)作为“空白”去校正反射等因素造成的入射光 的损失,则:
入射光=吸收光+透过光
第4页,共20页。
Ø朗伯-比尔(Lambert-Beer)光吸收定律
u设 I0为经过空白校正后入射光的强度,I t为透过光的强度 u根据实验得知:It= I0 ·10-εbc,式中:c 表示吸收物质的摩尔浓度;b表示吸收物质的光径, 用cm表示;ε表示吸收物质的摩尔消光系数,它表示物质对光的吸收特性,不同物 质的ε数值不同,所以 It/ I0= 10-εbc u令 T(透射比)= It/ I 0 , 则T=10-εbc ,lg(1 / T)=εbc ulg(l / T)为物质的吸光度(A),则A = 1g(1 / T)=εbc,此式说明了物质的吸光度 与吸收物质的浓度和光程成正比,这就是Lambert-Beer光吸收定律
蛋白质含量的测定 考马斯亮光光度技术的一般原理
ü学习722型可见光分光光度计的操作 ü熟悉考马斯亮蓝G-250染色法测定蛋白质含量的原理和方法
卫生检验蛋白质ppt课件

③酚试剂法:灵敏度高达双缩脲法的100倍,有利于检出微量蛋白质, 较合适于单一蛋白质检测。
④紫外分光光度法:利用蛋白质在280nm处有吸收峰的特点,常用 于测定较纯的酶和免疫球蛋白。
⑤染料结合法:常用氨基黑、丽春红、考马斯亮蓝、邻苯三酚红钼 等,前三者主要用于蛋白电泳,邻苯三酚红钼可用于尿液和脑脊 液中蛋白质的测定,简便快速、灵敏,但不同蛋白质结合力不一 样,且试剂对比色杯有吸附作用。
(3).A/G比值 正常为1.5-2.5/1,ALB减少和/或球蛋白升高, A/G降低,严 重者A/G﹤1.0,称为A/G比值 倒置。
(4).先天性ALB缺乏症:ALB合成障碍,极少见。
13
4.溴甲酚绿法测定ALB 注意事项
(1).BCG是一种PH指示剂,变色域PH3.8(黄色)-5.4(蓝绿色),控制反应液 PH是本方法的关键。
1
一 .蛋白质代谢检查 二 .糖代谢检查 三 .离子测定
2
(一)TP测定:方法、原理、操作、临床意义及注意义、注意 事项
3
1. TP测定方法简介: TP测定时常利用蛋白质的一些特性,如重复的肽键结构;酪氨 酸和色氨酸残基对酚试剂反应或紫外光吸收;与色素结合 的能力;沉淀后的浊度;电泳的迁移率大小等来设计蛋白质 的测定方法。经典和常见的方法分述如下:
9
2.双缩脲法测定TP 方法特点
(1).双缩脲显色反应仅和蛋白质中肽键数成正比,与蛋白质种类,分子量及 氨基酸组成无明显关系,各种蛋白质显色程度基本相同,显色稳定性好,试剂 单一。
(2).双缩脲法重复性好,RCV4%,CCV3.9%;线性范围0-140g/L,干扰少,使用
单一的稳定试剂,操作简单、快速,适于手工操作及自动化分析,为TP测定的 参考方法。 (3).唯一的缺点是灵敏度较低,比酚试剂法低约100倍,但能满足临床生化 检验需要,对血清总蛋白定量较为适用;对蛋白质含量很低的其他体液如脑 脊液、胸腹水和尿液等,不是合适的定量方法。
④紫外分光光度法:利用蛋白质在280nm处有吸收峰的特点,常用 于测定较纯的酶和免疫球蛋白。
⑤染料结合法:常用氨基黑、丽春红、考马斯亮蓝、邻苯三酚红钼 等,前三者主要用于蛋白电泳,邻苯三酚红钼可用于尿液和脑脊 液中蛋白质的测定,简便快速、灵敏,但不同蛋白质结合力不一 样,且试剂对比色杯有吸附作用。
(3).A/G比值 正常为1.5-2.5/1,ALB减少和/或球蛋白升高, A/G降低,严 重者A/G﹤1.0,称为A/G比值 倒置。
(4).先天性ALB缺乏症:ALB合成障碍,极少见。
13
4.溴甲酚绿法测定ALB 注意事项
(1).BCG是一种PH指示剂,变色域PH3.8(黄色)-5.4(蓝绿色),控制反应液 PH是本方法的关键。
1
一 .蛋白质代谢检查 二 .糖代谢检查 三 .离子测定
2
(一)TP测定:方法、原理、操作、临床意义及注意义、注意 事项
3
1. TP测定方法简介: TP测定时常利用蛋白质的一些特性,如重复的肽键结构;酪氨 酸和色氨酸残基对酚试剂反应或紫外光吸收;与色素结合 的能力;沉淀后的浊度;电泳的迁移率大小等来设计蛋白质 的测定方法。经典和常见的方法分述如下:
9
2.双缩脲法测定TP 方法特点
(1).双缩脲显色反应仅和蛋白质中肽键数成正比,与蛋白质种类,分子量及 氨基酸组成无明显关系,各种蛋白质显色程度基本相同,显色稳定性好,试剂 单一。
(2).双缩脲法重复性好,RCV4%,CCV3.9%;线性范围0-140g/L,干扰少,使用
单一的稳定试剂,操作简单、快速,适于手工操作及自动化分析,为TP测定的 参考方法。 (3).唯一的缺点是灵敏度较低,比酚试剂法低约100倍,但能满足临床生化 检验需要,对血清总蛋白定量较为适用;对蛋白质含量很低的其他体液如脑 脊液、胸腹水和尿液等,不是合适的定量方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/12/10
8
(三)、操作(标准曲线制作) :
取7支试管按下表操作:
空白 待测 标1 标2 标3 标4 标5
标准蛋白 (微升)
待测样品2(微升)
生理盐水(微升) 100
CBB-G250(ml)
5.0
20. 40. 60. 80. 100. 5.0
95 80 60 40 20 0.0 5.0 5.0 5.0 5.0 5.0 5.0
最终蛋白浓度(微克/毫升)
4.0 8.0 12 16.0 20.0
混匀,室温放置3分钟,在595nm测定各管O.D
值并以蛋白浓度为横坐标,以O.D值为纵坐标绘制标准曲
线.
2020/12/10
9
❖以Bradford法测定血清和层析分离 蛋白内的蛋白浓度
取2支试管分别从血清样品和层析样品 中各取20.0ul,加入生理盐水20ul,最后加入 考马斯亮蓝G-250溶液5.0ml,混匀,以 595nm 波长测定二者光密度,在标准曲线上 查出其蛋白浓度。
E.移液管
2F02.0试/12/1管0 与试管架来自2(2)、试剂
A. 9 g/L NaCl 溶液 B. 标准牛血清白蛋白溶液
牛血清白蛋白0.1克加生理盐水定容 至 100毫升。 C. 待测血清样品 取兔血清0.1毫升,用生理盐水稀释 至 20毫升。
2020/12/10
3
3、操作
取3支试管按下表操作:
液中,然后加入100毫升 850 ml/L 磷酸,最后加蒸馏
2水020定/12/1容0 至1000毫升。
7
❖ (2)0.14mol/L 氯化钠溶液(生理盐水)
❖ (3)标准蛋白质溶液(1mg/ml): 精确称取100毫克牛血清白蛋白,用生理
盐水定容至100毫升。 (4) 血清样品(已稀释4倍) (5) 层析样品(前次层析实验分离的原液)
2020/12/10
10
PPT精品课件
谢谢观看
Thank You For Watching
11
也可 分别测定各管280nm处的O.D值,以蛋白浓度 为横坐标,以O.D值为纵坐标绘制标准曲线。
根据未知蛋白的O.D 值,可在标准曲线上查出该蛋 白的浓度。
2020/12/10
5
二、Bradford法
(一)、原理:
考马斯亮蓝G250 ( CBB- G-250)与蛋白质结合后 形成蓝色的化合物,在595nm有最大吸收峰,且
Triton X-100等对其有干扰,此影响可通过选择
适20当20/1的2/10 对照品来消除。
6
(二)器材及试剂
1、器材 A. 分光光度计 B. 微量加样器 C. 移液管、试管及试管架 D. 坐标纸
2. 试剂
(1)考马斯亮蓝G-250溶液:
称取CBB- G-250 100毫克 溶于 50 ml 950ml/L乙醇溶
空白 标准 测定
标准蛋白 (1 mg/ml) 0 0.5 0
待测样品1 (ml)
0 0 0.5
生理盐水 (ml)
4.0 3.5 3.5
轻轻混匀放置3分钟,在280nm处以空
白调零,测定各管光密度,计算蛋白含量.
2020/12/10
4
计算公式:
测定O.D/标准O.D X 标准浓度X稀释倍数 =待测样品蛋白浓度(mg/ml)
实验四、
紫外吸收法和Bradford法 检测蛋白质浓度
2020/12/10
1
一、紫外吸收法
1、原理: 蛋白质分子中含有共轭双键,在280nm处有
最大吸收值,其吸光度与蛋白浓度成正比。以标 准蛋白作参比即可求得未知蛋白浓度。
2、器材与试剂
(1)、器材
A.紫外分光光度计
B.坐标纸
C.恒温水浴
D.微量加样器
蓝色的深浅与蛋白浓度成正比。这是一种快速、准
确、重复性好的蛋白质定量方法。
该方法快速、准确、干扰因素少。CBB- G-250
在2分钟内即可完全与蛋白结合,并在2小时内保
持稳定,该反应几乎不受钠、钾等阳离子的干扰,
更不受蔗糖等碳水化合物的干扰。但较高浓度的十
二烷基硫酸钠(Soldium dodecyl sulfate),
