蛋白质的定量测定方法PPT课件
合集下载
《蛋白质的测定》PPT课件

选择蒸馏时间四—五分钟,自 动完成蒸馏;
滴定,计算氮及蛋白含量。
计算公式
WcV0.014F100 m
W—蛋白质的质量分数,%; c—盐酸规范液的浓度,mol/L; V—试剂滴定耗费规范液量,mL; m—样质量量,g; 0.014—氮的毫摩尔质量,g/mmol; F—蛋白质系数,6.25。
三、微量凯氏定氮法
原理与常量凯氏定氮法一样
设备安装
步骤
采样〔固体采样、液体采样〕 样品预处置 样品分析 样品数据处置 撰写分析报告
2NH2(CH)2COOH + 13H2SO4 = (NH4)2SO4 + 6CO2 + 12SO2 + 16H2O
2NaOH+ (NH4)2SO4= 2NH3↓+ Na2SO4 + 2H2O
2NH3 + 4H3BO3=(NH4)2B4O7+5H2O
(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3
2、仪器和试剂
① 500ml凯氏烧瓶
② 定氮蒸馏安装
ቤተ መጻሕፍቲ ባይዱ
硫酸铜 ;
硫酸钾;
硫酸;
40g∕L硼酸溶液:
混合指示剂:〔国标〕1g∕L甲基红乙醇溶液与1g∕L 甲基蓝乙醇溶液,临用时按2:1的比例混合。
或者1g∕L甲基红乙醇溶液与1g∕L溴
甲酚绿乙醇溶液,临用时按1:5的比例混合;
400g∕L氢氧化钠;
蛋白质的测定
一、测定食品中蛋白质含量的意义 二、常量凯氏定氮法 三、微量凯氏定氮法 四、自动凯氏定氮仪
一、概述
〔一〕测定意义 1、蛋白质作为三大供能物质,是食品的重要
营养目的。 2、人体组织的构成成分。 3、构成体内各种重要物质 4、蛋白质不是越多越好〔添加肾负担,骨质
滴定,计算氮及蛋白含量。
计算公式
WcV0.014F100 m
W—蛋白质的质量分数,%; c—盐酸规范液的浓度,mol/L; V—试剂滴定耗费规范液量,mL; m—样质量量,g; 0.014—氮的毫摩尔质量,g/mmol; F—蛋白质系数,6.25。
三、微量凯氏定氮法
原理与常量凯氏定氮法一样
设备安装
步骤
采样〔固体采样、液体采样〕 样品预处置 样品分析 样品数据处置 撰写分析报告
2NH2(CH)2COOH + 13H2SO4 = (NH4)2SO4 + 6CO2 + 12SO2 + 16H2O
2NaOH+ (NH4)2SO4= 2NH3↓+ Na2SO4 + 2H2O
2NH3 + 4H3BO3=(NH4)2B4O7+5H2O
(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3
2、仪器和试剂
① 500ml凯氏烧瓶
② 定氮蒸馏安装
ቤተ መጻሕፍቲ ባይዱ
硫酸铜 ;
硫酸钾;
硫酸;
40g∕L硼酸溶液:
混合指示剂:〔国标〕1g∕L甲基红乙醇溶液与1g∕L 甲基蓝乙醇溶液,临用时按2:1的比例混合。
或者1g∕L甲基红乙醇溶液与1g∕L溴
甲酚绿乙醇溶液,临用时按1:5的比例混合;
400g∕L氢氧化钠;
蛋白质的测定
一、测定食品中蛋白质含量的意义 二、常量凯氏定氮法 三、微量凯氏定氮法 四、自动凯氏定氮仪
一、概述
〔一〕测定意义 1、蛋白质作为三大供能物质,是食品的重要
营养目的。 2、人体组织的构成成分。 3、构成体内各种重要物质 4、蛋白质不是越多越好〔添加肾负担,骨质
蛋白质的测定课件参考.ppt

1.装水至 2/3 容积 处,加甲 基橙数滴 及硫酸数 毫升以保 持酸性
4.NaOH 溶液
4.5.6 5.水洗漏 步操 斗数次 作要 6.夹好漏斗 迅速 夹,水封。
2.管下端 插入液面 下(瓶内先 装硼酸液 及混合指 示剂2滴)
7.水蒸气蒸馏至指示剂变绿色 开始计时,蒸馏10min,将管
8.吸收液用0.01000mol/L HCl标准溶液滴定至
总蛋白质含量 氨基酸组成 蛋白质的营养价值
精选课件
2
5、蛋白质的测定方法
利用蛋白质共性的方法
凯氏定氮法 杜马斯法
福林酚法
利用特定氨基酸残基法
染色法
精选课件
3
第二节 蛋白质的定性测定
一、蛋白质的一般显色反应
电泳或纸层析之后用一些染料与蛋白质结合并 变色。书中列举了 5 种染料。
二、复合蛋白质的显色反应
第一节 概述
1.蛋白质的元素组成(The elements of protein)
▪ C:50-55% N:15-18% O:20-23%
▪ H:6-8% S:0-4%
▪ 微量元素:P、Fe、Zn、Cu
2、基本结构单位:氨基酸
3、蛋白质的变性作用。
精选课件
1
4、蛋白质分析的重要性
▪ 生物活性测定 ▪ 功能性质调查 ▪ 营养标签
精选课件
17
操作方法
▪ 1、制作标准曲线 取10支干试管分成两组,按下表平行操作:
0ቤተ መጻሕፍቲ ባይዱ
1
2
3
4
标准蛋白液/ml
0.2 0.4 0.6 0.8
蛋白浓度 /(mg/ml)
2.0 4.0 6.0 8.0
蒸馏水/ml
4.NaOH 溶液
4.5.6 5.水洗漏 步操 斗数次 作要 6.夹好漏斗 迅速 夹,水封。
2.管下端 插入液面 下(瓶内先 装硼酸液 及混合指 示剂2滴)
7.水蒸气蒸馏至指示剂变绿色 开始计时,蒸馏10min,将管
8.吸收液用0.01000mol/L HCl标准溶液滴定至
总蛋白质含量 氨基酸组成 蛋白质的营养价值
精选课件
2
5、蛋白质的测定方法
利用蛋白质共性的方法
凯氏定氮法 杜马斯法
福林酚法
利用特定氨基酸残基法
染色法
精选课件
3
第二节 蛋白质的定性测定
一、蛋白质的一般显色反应
电泳或纸层析之后用一些染料与蛋白质结合并 变色。书中列举了 5 种染料。
二、复合蛋白质的显色反应
第一节 概述
1.蛋白质的元素组成(The elements of protein)
▪ C:50-55% N:15-18% O:20-23%
▪ H:6-8% S:0-4%
▪ 微量元素:P、Fe、Zn、Cu
2、基本结构单位:氨基酸
3、蛋白质的变性作用。
精选课件
1
4、蛋白质分析的重要性
▪ 生物活性测定 ▪ 功能性质调查 ▪ 营养标签
精选课件
17
操作方法
▪ 1、制作标准曲线 取10支干试管分成两组,按下表平行操作:
0ቤተ መጻሕፍቲ ባይዱ
1
2
3
4
标准蛋白液/ml
0.2 0.4 0.6 0.8
蛋白浓度 /(mg/ml)
2.0 4.0 6.0 8.0
蒸馏水/ml
高级生化试验-实验一蛋白质定量分析ppt课件

计算
〔1〕规范管法〔规范比较法〕 实践测定过程中,用一知浓度的测定物
按测定管同样处置显色,读出吸光度,再根 据前式计算。
A规范/A样品= KC规范/ KC样品 C样品=A样品/A规范×C规范
A:吸光度;K:吸光系数;C:溶液浓度;L: 液层厚度
〔2〕规范曲线法
配制一系列知不同浓度 的测定物溶液,按测定 管同样方法处置显色, 分别读取各管吸光度。
测定管
0.1
5.0
实验三 紫外分光光度法
【根本原理】 Tyr and Trp包含不饱和的共轭双键,因此蛋白质具
有吸收紫外光的性质,吸收峰在280nm波优点, 可利用该吸收峰值估计蛋白质浓度; 核苷酸是蛋白质样品中的主要污染成分, 其在280nm 处也有吸收峰, 但最大吸收峰值出如今 260nm;
Protein Conc (mg/ml)=1.45A280-0.74A260; A280/A260>1.5 (核苷酸的污染可以接受) ; 不够准确,但较为简便,样品可回收利用; 灵敏度:50-100μg
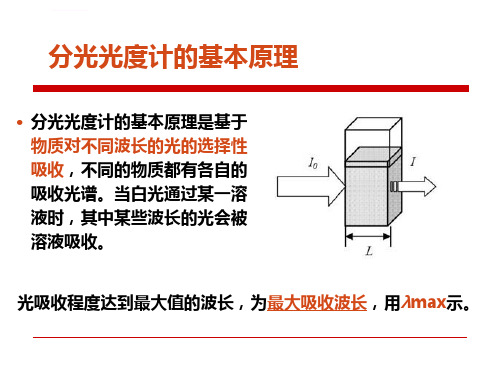
2.比尔〔Beer〕定律 一束单色光经过一光吸收介质时,其光强度随吸收光介
质的浓度的添加呈指数减少。 LgI0/I=KC
I0 :入射光强度; I :透射光强度;C :介质浓度 K:吸光系数
mbert-beer’s law
一束单色光经过某溶液时,光波被溶液吸收一部分, 吸收多少与溶液中溶质的浓度和溶液厚度成正比。
2. 在试管架上有3中蛋白质样品 a. 规范血清,浓度70 mg/ml. 在Improved Lowry Assay中,用于 制备不同浓度的规范样品; b. 用于 Improved Lowry Assay的未知样品; c. 用于 Bradford assay的未知样品(勿稀释).。
蛋白质的定量测定方法PPT课件

以光密度为纵座标,标准蛋白溶液浓度为横座标,绘 制出标准曲线。
2.测定未知样品
取样品溶液4毫升,加蒸馏水4mL混匀,在280nm下 测定其光密度值。
【实验结果】
根据样品溶液的光密度值,在绘制好的标准曲线图中 查出样品溶液的蛋白质含量。
第8页/共24页
【实验目的】
三、微量凯氏定氮法
学习凯氏定氮法的原理和操作技术。
蛋白质染料复合物具有很高的吸光值,因此大大提高了蛋白质测定 的灵敏度,最低检出量为1μg蛋白。染料与蛋白质结合迅速,大约为2 分钟,结合物的颜色在1小时内稳定。所以本法操作简便,快速,灵敏 度 高 , 稳 定 性 好 , 是 一 种 测 定 蛋第白20质页/含共量24页的 常 用 方 法 。
【实验材料】
2. 测定未知样品:取2支试管,分别准确吸取1毫升样品溶液,各加
5毫升Fo1in酚试剂甲,摇匀,室温放置10分钟后,再各加1毫升 Fo1in酚试剂乙,立即摇匀,放置30分钟,在500nm处测定光密度值 。
【实验结果】
根据未知样品溶液的光密度值,在绘制好的标准曲线图中查出样品
溶液中的蛋白质含量。
第5页/共24页
Folin酚试剂法操作简便,灵敏度高,样品中蛋白
质含量高于5μg即可测得,是测定蛋白质含量应用得最
பைடு நூலகம்
广泛的方法之一。
第2页/共24页
【实验材料】
1.实验器材
100毫升容量瓶2只;移液管1毫升4支,5毫升2支;分光光度计。
2.实验试剂
(1)Fo1in酚试剂甲:将lg碳酸钠溶于/L氢氧化钠溶液中,再把 硫酸铜(CuSO4∙5H2O)溶于100mL1%酒石酸钾(或酒石酸钠)溶液,然后 将前者50mL与后者lmL混合。混合后1日内使用有效。
2.测定未知样品
取样品溶液4毫升,加蒸馏水4mL混匀,在280nm下 测定其光密度值。
【实验结果】
根据样品溶液的光密度值,在绘制好的标准曲线图中 查出样品溶液的蛋白质含量。
第8页/共24页
【实验目的】
三、微量凯氏定氮法
学习凯氏定氮法的原理和操作技术。
蛋白质染料复合物具有很高的吸光值,因此大大提高了蛋白质测定 的灵敏度,最低检出量为1μg蛋白。染料与蛋白质结合迅速,大约为2 分钟,结合物的颜色在1小时内稳定。所以本法操作简便,快速,灵敏 度 高 , 稳 定 性 好 , 是 一 种 测 定 蛋第白20质页/含共量24页的 常 用 方 法 。
【实验材料】
2. 测定未知样品:取2支试管,分别准确吸取1毫升样品溶液,各加
5毫升Fo1in酚试剂甲,摇匀,室温放置10分钟后,再各加1毫升 Fo1in酚试剂乙,立即摇匀,放置30分钟,在500nm处测定光密度值 。
【实验结果】
根据未知样品溶液的光密度值,在绘制好的标准曲线图中查出样品
溶液中的蛋白质含量。
第5页/共24页
Folin酚试剂法操作简便,灵敏度高,样品中蛋白
质含量高于5μg即可测得,是测定蛋白质含量应用得最
பைடு நூலகம்
广泛的方法之一。
第2页/共24页
【实验材料】
1.实验器材
100毫升容量瓶2只;移液管1毫升4支,5毫升2支;分光光度计。
2.实验试剂
(1)Fo1in酚试剂甲:将lg碳酸钠溶于/L氢氧化钠溶液中,再把 硫酸铜(CuSO4∙5H2O)溶于100mL1%酒石酸钾(或酒石酸钠)溶液,然后 将前者50mL与后者lmL混合。混合后1日内使用有效。
蛋白质组学定量研究常见方法-PPT课件

辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
4:化学标记法—ICAT
ICAT法的缺点: (1)它不能用于标记不含半胱氨酸或半胱氨酸含量低的蛋白质。 (2)ICAT分子量相对较大(约500Da),与蛋白质连接后可能会造成分子 的空间位阻 (3)ICAT分子量相对较大(约500Da),由于在MS分析中标签仍保留在每 个肽上,使得在碰撞诱导解吸(CID)条件下,很容易被片段化,那么标签特 异化的片段离子就会使串联质谱分析标记肽段的过程复杂化, (4) ICAT分子量相对较大(约500Da),这对小肽而言是一个较大的修饰 物,会增加数据库搜索的复杂性 (5)标记时通常需要延长时间来保证ICAT与蛋白质充分结合,这可能会造 成赖氨酸、组氨酸、色氨酸、酪氨酸发生氨基酸局部衍化。 (6)与原子结合的硫醚键化学稳定性较低,可能会自发发生β -消除反应 使部分标签断裂。
蛋白质组学定量研究常见方法
辉骏生物:fitgene/
免费服务热线:400-699-1663
蛋白质组学定量研究常见方法
1:常规双向电泳 2:DIGE 3:15N等同位素标记 4:ICAT 5:iTRAQ 6:SILAC
辉骏生物:fitgene/
免费服务热线:400-699-1663
BCA法测定蛋白质含量ppt课件
C测=A测/ A标×C标
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
2.利用标准曲线法进行换算测定物浓度(标准曲线法)
❖ 配制一系列的
A
标准管,然后
绘出标准曲线。
A待测
❖ 再测出测定管 的吸光度,在 标准曲线上查 找到对应浓度。
二.实验原理
A562∝M蛋白质
紫蓝色
562nm
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
二.实验原理
采用标准曲线法计算待测液含量
作图人:
仪器型号:722型分光光度计
时间:
A待测
波长:562nm
45°
二.实验原理
在碱性条件下,蛋白质将Cu2+还原为Cu+, Cu+与两分子 BCA(二辛可酸)反应形成紫蓝色的络合物,测定其在 562nm处的吸光度值,并与标准曲线对比,即可计算待测
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
5 测定管
m(ug)
0 15 30 45 60 75
吸光度 (A)
仪器名称、型号编号: 波长: 测定日期: 测定人:
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
四.注意事项
1、实验分组,两人一组 2、试剂盘的摆放:专管专用,防止污染 3、准确量取试剂,正确使用吸量管 4、正确操作722型分光光度计,此次由于 溶液体积较少,比色皿不需要待测溶液润洗 5、正确绘制标准曲线,标明名称、仪器、 作图人、时间等 6、实验原始数据书写规范,三线表 7、待测液(小牛血清)已经稀释了500倍,
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
2.利用标准曲线法进行换算测定物浓度(标准曲线法)
❖ 配制一系列的
A
标准管,然后
绘出标准曲线。
A待测
❖ 再测出测定管 的吸光度,在 标准曲线上查 找到对应浓度。
二.实验原理
A562∝M蛋白质
紫蓝色
562nm
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
二.实验原理
采用标准曲线法计算待测液含量
作图人:
仪器型号:722型分光光度计
时间:
A待测
波长:562nm
45°
二.实验原理
在碱性条件下,蛋白质将Cu2+还原为Cu+, Cu+与两分子 BCA(二辛可酸)反应形成紫蓝色的络合物,测定其在 562nm处的吸光度值,并与标准曲线对比,即可计算待测
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
5 测定管
m(ug)
0 15 30 45 60 75
吸光度 (A)
仪器名称、型号编号: 波长: 测定日期: 测定人:
在 日 常 生 活 中,随 处都可 以看到 浪费粮 食的现 象。也 许你并 未意识 到自己 在浪费 ,也许 你认为 浪费这 一点点 算不了 什么
四.注意事项
1、实验分组,两人一组 2、试剂盘的摆放:专管专用,防止污染 3、准确量取试剂,正确使用吸量管 4、正确操作722型分光光度计,此次由于 溶液体积较少,比色皿不需要待测溶液润洗 5、正确绘制标准曲线,标明名称、仪器、 作图人、时间等 6、实验原始数据书写规范,三线表 7、待测液(小牛血清)已经稀释了500倍,
最新实验一蛋白质含量测定ppt课件

生物化学与分子生物学基础实验
TU1800 紫外可见分光光度计
波长范围:200-1100nm 钨灯:340-1100nm
测光系统:单光束
氘灯:200-340nm
功能指标:光度测量 光谱扫描 定量测量
生物化学与分子生物学基础实验
注意事项
1 测紫外吸收要用石英比色皿 ! 2 定量实验取液要准确。 3 从低浓度到高浓度依次测量,比色皿不要润 洗。 因此3ml溶液足够测定。 4 测量完毕,请把光度计的盖打开 ! 5 每次实验时提交上一次的实验报告。
生物化学与分子生物学基础实验
生物化学与分子生物学基础实验
Folin-酚试剂法(Lowry法)
实验步骤
0 1234567
标准蛋白(1mg/ml)ul 0 20 40 80 120 160 200 0
待测样品 ul
-
- - - - - - 200
蒸馏水 ul
1000 980 960 920 880 840 800 800
Folin-酚试剂甲 ml
3、所有的样品(包括标准样品),都必须在规定时间 内测试。时间过长,得到的吸光值会有变化,导致测出 的样品浓度与实际的浓度不符。
生物化学与分子生物学基础实验
722型光栅分光光度计
光 源
单 色
样
光
读
品
电
数
器
池
源
单
件元
测量完毕,请把光度计的盖打开 !
讲解完毕后,每个组出一个同学去 127听老师讲解仪器使用。
生物化学与分子生物学基础实验
Folin-酚试剂法(Lowry法)
• 酸、铜离子螯合剂(如EDTA、柠檬酸等)、还原剂(如巯基乙 醇、DTT、苯酚等)干扰本反应。
蛋白质的测定PPT课件

杜马斯法(燃烧法)
样品在高温下(700-800℃)燃烧,释放的氮 气由带热导检测器(TCD)的气相色谱仪测定。 测得的含氮量转换成样品中的蛋白质含量。
几种蛋白质测定方法比较
原理 装置 溶剂
时间 灵敏 度 干扰
凯式定氮法 双缩脲
总氮量
蛋白氮
凯式定氮装置 分光光度计
浓硫酸
用量较少
长
较低
简单快速 低
较小
▪ Y为标准曲线查得蛋白质得浓度(mg/ml) ▪ N为稀释倍数 ▪ c为样品原浓度(mg/ml)。
福林-酚法(双缩脲法的发展)
▪ 两步反应
(1)在碱性条件下,蛋白质与铜离子作用生成蛋 白质—铜络合物。
(2)此络合物将试剂磷钼酸—磷钨酸(Folin试剂) 还原,混合物深蓝色(磷钼蓝和磷钨蓝混合物) 。
0.0 4.0
A540
取两组测定的A540值的平均值,即A540为纵坐标,蛋 白质浓度为横坐标,绘制标准曲线。
2、样品测定
取4支试管分成两组,按下表平行操作:
0Байду номын сангаас
1
样品稀释液/ml
0.5
蒸馏水/ml
1.0
0.5
双缩脲试剂/ml
4.0
4.0
A540
3、计算
▪ 取两组测定的平均值计算:
固体样品蛋白质的含量(%) Y N 100% c
第四节 氨基酸定量测定
一、甲醛滴定法
氨基酸本身有碱性-NH2基,又有酸性COOH基,成中性内盐,加入甲醛溶液后, 与-NH2结合,碱性消失,再用强碱来滴定 -COOH基。
总蛋白质含量 氨基酸组成 蛋白质的营养价值
5、蛋白质的测定方法
利用蛋白质共性的方法 利用特定氨基酸残基法
实验四 蛋白质的定量测定方法共26页PPT

实验四 蛋白质的定量测定方法
16、自己选择的路、跪着也要把它走 完。 17ห้องสมุดไป่ตู้一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
16、自己选择的路、跪着也要把它走 完。 17ห้องสมุดไป่ตู้一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
实验二蛋白质定量测定22页PPT

40、人类法律,事物有规律,这书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
实验二蛋白质定量测定
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
实验二蛋白质定量测定
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
蛋白质定性定量分析ppt课件

2021/6/15
29
2、利用微电极直接测定凝胶表面的p H而得知样品的等电点;
3、将凝胶切成等距离(5nm)的小块, 浸于水中,用精密试纸测定pH。以凝 胶块距正极的距离为横坐标,pH为纵 坐标作用图得出胶的pH梯度曲线。根 据待测样品在凝胶中的位置而得出蛋
白质样品的等电点。
2021/6/15
30
与标准蛋白比较,得出样品蛋白的含量。
2021/6/15
31
2021/6/15
32
2021/6/15
33
2021/6/15
34
免疫印迹技术的基本操作(例PKC)
1、细胞裂解物的制备 2、细胞裂解液蛋白含量测定 3、细胞裂解物SDS-PAGE电泳 4、蛋白质转膜 5、目的蛋白的检测
2021/6/15
转变为硫酸铵。
Pr+H2SO4
CO2+H2O+(NH4)2SO4
(NH4)2SO4+2NaOH NH4OH+HCl
NH4OH+H2SO4 NH4Cl+H2O
2021/6/15
3
2021/6/15
4
2021/6/15
5
2021/6/15
6
凯氏法的评价: 优点:
1、适用于一切形态的样品; 2、不用比色,对混浊不透明的样品也可 进行分析; 3、结果的精、准度较高。
其它蛋白质定性定量分析技
术
蛋白质的电泳染色定量分析
特定蛋白质在总蛋白中所点比例的分析:最
早应用于血浆蛋白电泳分离后白蛋白和球蛋
白的比例测定。其方法有二,其一是将染色
后的蛋白区带剪下,用适当的溶剂提取后比
色测定;其二用反射扫描仪处理后,计算各
蛋白质含量的测定(共4张PPT)

第三页,共4页。
样品的测定
吸取提取液和稀释250倍的血清液各1.0mL于试管中(三次重复),分别 加5.0mL试剂甲,放置10分钟后,加试剂乙0.5mL,立即混匀,恒温37度 反应20分钟,测A750的值。
管号
1 2 3
小白 菜
T或A
管号
1 2 3
血清 T或A
☆小白菜用mg/g,血清用mg/mL。
/mL)
μg
1 样品(小白菜)液的提取
其中双缩脲法和Folin-酚法
0
1.0 0
2 以1号为参比,测A750的值。
0.2 0.8 50
进—一Fo步lin掌-酚握试分剂光法光(度L法ow—ry—法求3)标和准考曲马线斯、0亮.准蓝4确法测(定Br未od知0fo.样rd6品法、)正100
4 其中双缩脲法和Folin-酚法
蓝色反应(钼蓝和钨蓝的混合物)。由于蛋白质中含有带酚基
的酪氨酸,故有此颜色反应。因此,用Folin-酚法测定蛋白质 含量灵敏度较高。
第二页,共4页。
实验步骤 1.标准曲线的制作:按下表操作
管
BSA
H2O Pr.
蓝色反应(钼蓝和钨蓝的混号合物)。(300μg
含量
样品(小白菜)液的提取 是一般实验室中经常使用的方法。
蛋白质含量的测定
—Folin-酚试剂法(Lowry法)和考马斯亮蓝法
(Brodford法)
一 Folin-酚试剂法(Lowry法) 目的和要求
学习Folin-酚法测定蛋白质含量的原理和方法。
进一步掌握分光光度法——求标准曲线、准确测定未知样品、正 确使用仪器
第一页,共4页。
原理
蛋白质浓度可以从它们的物理化学性质,如折射率、比重、紫 外吸收等测定而得知:或用化学方法,如定氮、双缩脲反应、 Folin-酚试剂反应等方法来求算。其中双缩脲法和Folin-酚法
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)标准蛋白质溶液:用分析天平精密称取牛(或人)血清白蛋 白100毫克,用少量蒸馏水完全溶解后,转移至100毫升容量瓶 中,准确稀释至刻度,使蛋白质浓度1mg/mL。
(4)样品溶液:配制约0.5mg/mL的酪蛋白溶液作为未知样品 溶液。
.
5
【实验操作】
1. 绘制标准曲线 取7支试管,按下表分别加入各试剂
(2)Folin酚试剂乙:在1.5L容积的磨口回流瓶中加入100g钨酸钠
(Na2WO4∙2H2O)、25g钼酸钠(Na2MoO4∙2H2O)、700mL蒸馏水、50mL85%磷酸及 100mL浓盐酸,充分混匀后回流10h。回流完毕,再加150g硫酸锂、50mL蒸
馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴,冷却后定
.
2
【实验原理】
该呈色反应在30分钟内即接近极限,并且在一定浓度 范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故可用 比色的方法确定蛋白质的含量。进行测定时要根据蛋白质 浓度的不同选用不同的测定波长:若蛋白质含量高时 (25100μg)在500nm波长处进行测定,含量低时(525μg) 在755nm波长处进行测定。最后根据预先绘制的标准曲线 求出未知样品中蛋白质的含量。
(2)样品溶液:配制约0.5mg/mL的酪蛋白溶液作为 未知样品溶液。
.
8
【实验操作】
1. 绘制标准曲线
取 7 支试管按下列各表加入各试剂:
试剂加完后摇匀,在紫外分光光度计上,于280nm处以0 号管为对照,分别测定各管溶液的光密度值。
以光密度为纵座标,标准蛋白溶液浓度为横座标,绘制 出标准曲线。
紫外吸收法可测定0.1-0.5mg/ml的蛋白质溶液,此操作简 便,测定迅速,不消耗样品,低浓度盐类不干扰测定。因 此,此法在蛋白质的制备中广泛应用。
.
7
【实验材料】
1.实验器材
试管及试管架;50毫升容量瓶2只;移液管;紫外 分光光度计。
2.实验试剂
(1)标准蛋白质溶液:精确配制2mg/mL的酪蛋白 溶液。
容到1000mL。过滤,如显绿色,可加溴水数滴使氧化至溶液呈淡黄色。置
于棕色瓶中暗处保存。.
4
【实验材料】
使用前用标准氢氧化钠溶液滴定,酚酞为指示剂,以标定该试 剂的酸度,一般为2mol/L左右(由于滤液为浅黄色,滴定时滤 液需稀释100倍,以免影响滴定终点的观察)。使用时适当稀释 (约1倍),使最后浓度为lmol/L酸。
2.测定未知样品
取样品溶液4毫升,加蒸馏水4mL混匀,在280nm下测定其 光密度值。
【实验结果】
根据样品溶液的光密度值,在绘制好的标准曲线图中查 出样品溶液的蛋白质含量。
.
9
【实验目的】
三、微量凯氏定氮法
学习凯氏定氮法的原理和操作技术。
【实验原理】
凯氏定氮法用于测定有机物的含氮量,若蛋白质的含氮量已知时, 则可用此法测定样品中蛋白质的含量。
实验 蛋白质的定量测定方法
【实验预习】
1.试比较Folin酚法与考马斯亮蓝染料结合比色法 的优缺点。
2 .试比较二喹啉甲酸法与Folin酚法的优缺点。
3.凯氏定氮法中在消化样品时,加入浓硫酸,硫 酸钾和硫酸铜粉末的目的是什麽?
4.紫外吸收法测定蛋白质含量的原理是什麽?
.
1
一、Folin酚试剂法(Lowry法)
。
【实验结果】
根据未知样品溶液的光密度值,在绘制好的标准曲线图中查出样品
溶液中的蛋白质含量. 。
6
二、紫外吸收法
【实验目的】
1. 学习紫外吸收法测定蛋白质含量的原理。
2. 掌握紫外分光光度计的操作方法。
【实验原理】
大多数蛋白质分子结构中含有芳香族氨基酸(酪氨酸和色 氨酸)残基,使蛋白质在280nm的紫外光区产生最大吸收, 并且这一波长范围内的吸收值与蛋白质浓度的成正比,利 用这一特性可定量测定蛋白质的含量。
当蛋白质与浓硫酸共热时,其中的碳、氢两元素被氧化成二氧化碳 和水,而氮则转变成氨,并进一步与硫酸作用生成硫酸铵。此过程 通常称为“消化”。但是,这个反应进行得比较缓慢,通常需要加 入硫酸钾或硫酸钠以提高反应液的沸点,并加入硫酸铜作为催化剂, 以促进反应的进行。
.
10
消化完成后,在凯氏定氮仪中加入浓碱,可使消化液中的 硫酸铵分解,游离出氨,借助水蒸汽蒸馏法,将产生的氨 蒸馏到一定量、一定浓度的硼酸溶液中,硼酸吸收氨后, 氨与溶液中氢离子结合,使溶液中的氢离子浓度降低,指 示剂颜色改变,然后用标准无机盐酸滴定,直至恢复溶液 中原来的氢离子浓度为止。根据所用标准盐酸的量可计算 出待测物中的总氮量。
【实验目的】
1.学习Folin 酚试剂法测定蛋白质含量的原理。
2.掌握Folin酚试剂法测定蛋白质含量的方法和操作。
【实验原理】
蛋白质中含有酪氨酸和色氨酸残基,能与Folin酚试剂起氧化还 原反应。反应过程分为两步,第一步:在碱性溶液中,蛋白质分子 中的肽键与碱性铜试剂中的Cu2+作用生成蛋白质Cu2+复合物;第二 步:蛋白质Cu2+复合物中所含的酪氨酸或色氨酸残基还原酚试剂中 的磷钼酸和磷钨酸,生成蓝色的化合物。
蛋白质的含氮量为16%,即1克蛋白质中的氮相当于6.25克 蛋白质,用凯氏定氮法测出的含氮量乘以6.25,即得样品 中蛋白质的含量。
.
11
【实验材料】 1.实验器材 微量凯氏定氮仪1套;50mL凯氏烧瓶4个;移液管;锥形瓶;试管;小玻璃珠 2.试验试剂 (1)浓硫酸;30%氢氧化钠溶液;2%硼酸溶液;标准盐酸溶液(0.01mol/L)。 (2) 粉末硫酸钾—硫酸铜混合物: K2SO4与CuSO4∙5H2O以3:1配比研磨混合。 (3)混合指示剂(田氏指示剂):由50mL0.1%甲烯蓝乙醇溶液与200mL0.1%甲 基红乙醇溶液混合配成,贮于棕色瓶中备用。 (4)样品溶液:配制3mg/mL的牛血清白蛋白溶液作为样品。
Folin酚试剂法操作简便,灵敏度高,样品中蛋白质含
量高于5μg即可测得,是测定蛋白质含量应用得最广泛的方法之一。 Nhomakorabea.
3
【实验材料】
1.实验器材
100毫升容量瓶2只;移液管1毫升4支,5毫升2支;分光光度计。
2.实验试剂
(1)Fo1in酚试剂甲:将lg碳酸钠溶于50mL0.lmol/L氢氧化钠溶液中, 再把0.5g硫酸铜(CuSO4∙5H2O)溶于100mL1%酒石酸钾(或酒石酸钠)溶液, 然后将前者50mL与后者lmL混合。混合后1日内使用有效。
各管加入Fo1in酚试剂乙后,立即摇匀,放置30分钟后比色,在
500nm处记下各管光密度,以0号管为对照,以光密度为纵坐标,标
准蛋白质溶液浓度为横坐标,绘制标准曲线。
2. 测定未知样品:取2支试管,分别准确吸取1毫升样品溶液,各加
5毫升Fo1in酚试剂甲,摇匀,室温放置10分钟后,再各加1毫升
Fo1in酚试剂乙,立即摇匀,放置30分钟,在500nm处测定光密度值
(4)样品溶液:配制约0.5mg/mL的酪蛋白溶液作为未知样品 溶液。
.
5
【实验操作】
1. 绘制标准曲线 取7支试管,按下表分别加入各试剂
(2)Folin酚试剂乙:在1.5L容积的磨口回流瓶中加入100g钨酸钠
(Na2WO4∙2H2O)、25g钼酸钠(Na2MoO4∙2H2O)、700mL蒸馏水、50mL85%磷酸及 100mL浓盐酸,充分混匀后回流10h。回流完毕,再加150g硫酸锂、50mL蒸
馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴,冷却后定
.
2
【实验原理】
该呈色反应在30分钟内即接近极限,并且在一定浓度 范围内,蓝色的深浅度与蛋白质浓度呈线性关系,故可用 比色的方法确定蛋白质的含量。进行测定时要根据蛋白质 浓度的不同选用不同的测定波长:若蛋白质含量高时 (25100μg)在500nm波长处进行测定,含量低时(525μg) 在755nm波长处进行测定。最后根据预先绘制的标准曲线 求出未知样品中蛋白质的含量。
(2)样品溶液:配制约0.5mg/mL的酪蛋白溶液作为 未知样品溶液。
.
8
【实验操作】
1. 绘制标准曲线
取 7 支试管按下列各表加入各试剂:
试剂加完后摇匀,在紫外分光光度计上,于280nm处以0 号管为对照,分别测定各管溶液的光密度值。
以光密度为纵座标,标准蛋白溶液浓度为横座标,绘制 出标准曲线。
紫外吸收法可测定0.1-0.5mg/ml的蛋白质溶液,此操作简 便,测定迅速,不消耗样品,低浓度盐类不干扰测定。因 此,此法在蛋白质的制备中广泛应用。
.
7
【实验材料】
1.实验器材
试管及试管架;50毫升容量瓶2只;移液管;紫外 分光光度计。
2.实验试剂
(1)标准蛋白质溶液:精确配制2mg/mL的酪蛋白 溶液。
容到1000mL。过滤,如显绿色,可加溴水数滴使氧化至溶液呈淡黄色。置
于棕色瓶中暗处保存。.
4
【实验材料】
使用前用标准氢氧化钠溶液滴定,酚酞为指示剂,以标定该试 剂的酸度,一般为2mol/L左右(由于滤液为浅黄色,滴定时滤 液需稀释100倍,以免影响滴定终点的观察)。使用时适当稀释 (约1倍),使最后浓度为lmol/L酸。
2.测定未知样品
取样品溶液4毫升,加蒸馏水4mL混匀,在280nm下测定其 光密度值。
【实验结果】
根据样品溶液的光密度值,在绘制好的标准曲线图中查 出样品溶液的蛋白质含量。
.
9
【实验目的】
三、微量凯氏定氮法
学习凯氏定氮法的原理和操作技术。
【实验原理】
凯氏定氮法用于测定有机物的含氮量,若蛋白质的含氮量已知时, 则可用此法测定样品中蛋白质的含量。
实验 蛋白质的定量测定方法
【实验预习】
1.试比较Folin酚法与考马斯亮蓝染料结合比色法 的优缺点。
2 .试比较二喹啉甲酸法与Folin酚法的优缺点。
3.凯氏定氮法中在消化样品时,加入浓硫酸,硫 酸钾和硫酸铜粉末的目的是什麽?
4.紫外吸收法测定蛋白质含量的原理是什麽?
.
1
一、Folin酚试剂法(Lowry法)
。
【实验结果】
根据未知样品溶液的光密度值,在绘制好的标准曲线图中查出样品
溶液中的蛋白质含量. 。
6
二、紫外吸收法
【实验目的】
1. 学习紫外吸收法测定蛋白质含量的原理。
2. 掌握紫外分光光度计的操作方法。
【实验原理】
大多数蛋白质分子结构中含有芳香族氨基酸(酪氨酸和色 氨酸)残基,使蛋白质在280nm的紫外光区产生最大吸收, 并且这一波长范围内的吸收值与蛋白质浓度的成正比,利 用这一特性可定量测定蛋白质的含量。
当蛋白质与浓硫酸共热时,其中的碳、氢两元素被氧化成二氧化碳 和水,而氮则转变成氨,并进一步与硫酸作用生成硫酸铵。此过程 通常称为“消化”。但是,这个反应进行得比较缓慢,通常需要加 入硫酸钾或硫酸钠以提高反应液的沸点,并加入硫酸铜作为催化剂, 以促进反应的进行。
.
10
消化完成后,在凯氏定氮仪中加入浓碱,可使消化液中的 硫酸铵分解,游离出氨,借助水蒸汽蒸馏法,将产生的氨 蒸馏到一定量、一定浓度的硼酸溶液中,硼酸吸收氨后, 氨与溶液中氢离子结合,使溶液中的氢离子浓度降低,指 示剂颜色改变,然后用标准无机盐酸滴定,直至恢复溶液 中原来的氢离子浓度为止。根据所用标准盐酸的量可计算 出待测物中的总氮量。
【实验目的】
1.学习Folin 酚试剂法测定蛋白质含量的原理。
2.掌握Folin酚试剂法测定蛋白质含量的方法和操作。
【实验原理】
蛋白质中含有酪氨酸和色氨酸残基,能与Folin酚试剂起氧化还 原反应。反应过程分为两步,第一步:在碱性溶液中,蛋白质分子 中的肽键与碱性铜试剂中的Cu2+作用生成蛋白质Cu2+复合物;第二 步:蛋白质Cu2+复合物中所含的酪氨酸或色氨酸残基还原酚试剂中 的磷钼酸和磷钨酸,生成蓝色的化合物。
蛋白质的含氮量为16%,即1克蛋白质中的氮相当于6.25克 蛋白质,用凯氏定氮法测出的含氮量乘以6.25,即得样品 中蛋白质的含量。
.
11
【实验材料】 1.实验器材 微量凯氏定氮仪1套;50mL凯氏烧瓶4个;移液管;锥形瓶;试管;小玻璃珠 2.试验试剂 (1)浓硫酸;30%氢氧化钠溶液;2%硼酸溶液;标准盐酸溶液(0.01mol/L)。 (2) 粉末硫酸钾—硫酸铜混合物: K2SO4与CuSO4∙5H2O以3:1配比研磨混合。 (3)混合指示剂(田氏指示剂):由50mL0.1%甲烯蓝乙醇溶液与200mL0.1%甲 基红乙醇溶液混合配成,贮于棕色瓶中备用。 (4)样品溶液:配制3mg/mL的牛血清白蛋白溶液作为样品。
Folin酚试剂法操作简便,灵敏度高,样品中蛋白质含
量高于5μg即可测得,是测定蛋白质含量应用得最广泛的方法之一。 Nhomakorabea.
3
【实验材料】
1.实验器材
100毫升容量瓶2只;移液管1毫升4支,5毫升2支;分光光度计。
2.实验试剂
(1)Fo1in酚试剂甲:将lg碳酸钠溶于50mL0.lmol/L氢氧化钠溶液中, 再把0.5g硫酸铜(CuSO4∙5H2O)溶于100mL1%酒石酸钾(或酒石酸钠)溶液, 然后将前者50mL与后者lmL混合。混合后1日内使用有效。
各管加入Fo1in酚试剂乙后,立即摇匀,放置30分钟后比色,在
500nm处记下各管光密度,以0号管为对照,以光密度为纵坐标,标
准蛋白质溶液浓度为横坐标,绘制标准曲线。
2. 测定未知样品:取2支试管,分别准确吸取1毫升样品溶液,各加
5毫升Fo1in酚试剂甲,摇匀,室温放置10分钟后,再各加1毫升
Fo1in酚试剂乙,立即摇匀,放置30分钟,在500nm处测定光密度值
