抗体酶
抗体酶

抗体酶的研究,为人们提供了一条合理途径去 设计适合于市场需要的蛋白质,即人为地设计 制作酶。它是酶工程的一个全新领域。利用动 物免疫系统产生抗体的高度专一性,可以得到 一系列高度专一性的抗体酶,使抗体酶不断丰 富。随之出现大量针对性强、药效高的药物。 立体专一性抗体酶的研究,使生产高纯度立体 专一性的药物成为现实。以某个生化反应的过 渡态类似物来诱导免疫反应,产生特定抗体酶, 以治疗某种酶先天性缺陷的遗传病。抗体酶可 有选择地使病毒外壳蛋白的肽键裂解,从而防 止病毒与靶细胞结合。抗体酶的固定化已获得 成功,将大大地推进工业化进程。
其它名称 反应可逆 二烯合成 [4+2]环加成 二烯 dienes 亲二烯体 dienophiles
环己烯衍生物
R
O C R(H) W CO2R(H) CN NO2
(吸电子基)
有利因素:
G
OR NHR
(给电子基)
Diels-Alder反应机理
G W + G G
六员环过渡态 协同机理
G
G W
W
2、抗体结合位点化学修饰法: 抗体酶和酶一样也可以用化学修 饰法加以改造。对抗体酶进行结 构修饰的关键是找到一种温和的 方法在抗体结合位置或附近引入 具有催化功能的基团。游离巯基 就是适合的基团之一,它具有高 亲核性,易于氧化,及能通过二 硫化物进行交换反应或亲电反应 而选择性修饰的特点
3 . 引入辅助因子法
结果按这种设想所得到的抗体不仅使酯 的水解速度增加了103~104倍,而且还具 备专一性、 pH依赖性及被抑制剂抑制等 酶的基本特性。抗体酶的催化活性虽然 仍比天然酶小,但这意味着可按人的意 愿来设计和生产具有已知结合专一性的 蛋白质,在理论上和实践上均有重要意 义。美国已将抗体酶技术商品化,在第 一批具有应用价值的抗体酶中有与蛋白 酶相似的抗体,可在特定的氨基酸序列 上切割蛋白质,从而建立具有各种专一 性的切割蛋白质抗体酶库,就像限制性 核酸内切酶库一样供研究者选用。
抗体酶
制备方法
• 1、杂交瘤技术 • 经体内免疫后再进行细胞融合是制备抗体酶的一种传统方法。 杂交瘤技术的基本原理是用不能在培养液中生长的但能产生抗 体的脾脏细胞,与能在培养液中生长的骨髓瘤细胞进行融合, 融合得到的杂交细胞既能产生抗体又能在体外培养,通过选择 培养,以获取能产生单克隆抗体的杂交瘤细胞。再把这些细胞 单克隆化,即繁殖成母体的同一细胞或形成菌落。这些菌落能 够产生单一均匀的抗体,可用于进行单克隆抗体的扩大生产。 对这些菌落用酶联免疫吸附法等方法加以筛选。该制备方法的 关键是要有合适而稳定的过渡态模拟物作半抗原,以产生与过 渡态高度亲和的抗体酶。由于大多数反应过渡态类似物的分子 量较低,即所谓的半抗原,他们本身免疫原性很弱,必须与某 种载体偶联才能表现免疫原性。本方法所得到的抗体酶的催化 能力的高低,在很大程度上取决于化学模型物的设计,现在应 用的设计策略包括:诱导和转化设计,反应免疫,“潜过渡态” 半抗原设计等等。
• 2、抗体结合部位修饰法 • 将催化基团或辅助因子引入到抗体的抗原结合部位,一 般可采用两种方法:即选择性化学修饰法和基因工程定 点突变法。抗体酶和酶一样也可以用化学修饰的方法加 以改造。对抗体酶进行结构修饰的关键,是找到一种吻 合的方法在抗体结合位置或附近引入酶的催化基 空间排布恰到好处,就能产生高活力的抗体酶。为提高 抗体酶的催化能力,可采用邻近效应,静电催化,应变, 功能团催化等方法,在抗体结合位点引入催化基团。基 因工程定点突变法是利用位点专一性突变引起抗体结合 部位氨基酸的改变,能在抗体结合部位换上有催化作用 的氨基酸,进而改变抗体酶的催化效率。目前,定点突 变的方法己成为提高抗体酶活性的一种常规方法。
• 3、克隆免疫反应因子的基因 • 通过PCR技术克隆出全套免疫球蛋白的可变位点 使它们随机地将基因的轻重链结合,这些含上利用了免疫因子的多样性, 通过这种方法我们可从上百万种可能性中选择 抗体酶。[1]
抗体酶

抗体酶综述陈璇【摘要】抗体酶是一类以过渡态类似物,为半抗原,可诱导免疫系统产生具有类似天然酶催化活性的免疫球蛋白。
抗体酶既具有抗体的高效选择性,又能像酶那样高效催化化学反应,开创了催化剂研究的崭新领域。
本文从抗体酶的发展历史、作用原理、制备、应用及研究展望多个角度进行综述。
【关键词】抗体酶;发现史;作用原理;制备;现状及应用前景抗体酶抗体酶(abzyme),又称催化抗体(cat·alytic antibody),是指通过一系列化学与生物技术方法制备出的具有催化活性的抗体,它除了具有相应免疫学性质,还类似于酶,能催化某种活性反应。
抗体与酶相似,它们都是蛋白质分子.酶与底物的结合及抗体与抗原的结合都是高度专一性的,但这两种结合的基本区别在于酶与高能态的过渡态分子相结合,而抗体则与抗原(基态分子)相结合。
抗体与天然酶相比,最大的优点在于抗体的种类是巨大的,免疫系统可以拥有10 种抗原特异性不同的抗体分子。
制备成功的抗体酶不但能催化一些天然酶能催化的反应,而且还能催化一些天然酶不能催化的反应。
抗体酶的发现早在l948年,美国斯坦福大学荣誉退休化学教授l』_波林(LinusPaulin'f)就提出过渡态理论(transition state theory) [2]。
这一理论认为,酶之所以具有催化能力,是因为它与反应分子(底物)的牢固结合的方式,有利于反应中的过渡态(transition state)的结构。
而这种结构会迅速重新排列成该反应的产物。
任何有利于过渡态,而不是其它可能的结构的因素,都能加快化学反应速度。
1 969年,布兰戴斯大学生物化学家w ·詹克斯(w ·Jenks)进一步发展了这一理论。
他和几位美国科学家认为,如果波林的观点是正确的话,那么利用某一反应过渡态的模拟物作为免疫原,则会得到催化该反应的抗体。
这种抗体能特异地识别化学反应的过渡态,并利用其结合能降低反应的活化能。
抗体酶及其应用2016年

抗体酶及其应用左摘要:抗体酶(abzyme),又叫催化抗体(catalytic antib),是具有催化活性的免疫球蛋白。
自1986年成功获得抗体酶后,相关研究激增。
但由于抗体酶的催化效率低,制备困难,研究热情渐渐消退。
一开始的研究目的主要是工业应用,但抗体酶催化效率太低而放弃了。
现有的研究主要集中在抗体酶在临床医学方面的应用,因其具有高特异性、长半衰期、低免疫源性和高可塑性。
关键词:抗体酶催化抗体免疫球蛋白1.抗体酶的出现抗体酶就是有催化活性的抗体。
抗体指机体的免疫系统在抗原刺激下,由B淋巴细胞或记忆细胞增殖分化成的浆细胞所产生的、可与相应抗原发生特异性结合的免疫球蛋白。
鲍林(Pauling) 在1946 年用过渡态理论阐明了酶催化的实质,即酶之所以具有催化活力是因为它能特异性结合并稳定化学反应的过渡态(底物激态),从而降低反应能级。
1984年Lerner设想可以通过对过渡态类似物产生抗体,抗体会诱导底物进入过渡态,使反应进行。
根据这个设想,Lener和P. C. Schultz分别独立地证明:对所酸酯水解的过渡态类似物产生的抗体有催化相应羧酸酯和碳酸酯的反应。
这种有催化活性的抗体被命名为抗体酶(abzyme)或催化抗体(catalyticantibody)。
2.抗体酶的制备我们简单地把抗体酶的制备分为生物学方法和化学方法(Figure 1)。
Figure 1抗体酶制备化学方法就是设计反应的过渡态类似物,把类似物作为半抗原,连接到恰当的载体上,形成抗原,通过动物免疫作用产生抗体,再筛选。
生物学方法主要有两种,一种是用酶做抗原,筛选出与酶特异性结合的抗体,用该抗体作为抗原,再产生能和底物过渡态结合的抗体。
相当于把酶拷贝了一份。
所以又称之为拷贝法。
另一种是用酶的抑制剂做抗原,产生的抗体可能和底物结合。
另外还有一些方法,如定点突变蛋白设计抗体;化学修饰抗体;抗体基因组合文库法等等。
3.抗体酶的应用随着研究的深入,尽管抗体酶的催化效率(k cat/K M)不断提高,但是抗体酶的催化效率(102-104 M-1s-1)远低于天然酶(106-108 M-1s-1)(Xu et al. 2004; Rao and Wootla2007)。
抗体酶及其应用

抗体酶是具有催化性质的抗体,它同时具备抗体和酶的特征,可催化多种化学反应,如酰基转移、酯水解、酰胺水解、重排反应、光诱导反应、氧化还原分应、金属螯合反应等。
用人工方法合成的抗体酶,可作为研究酶作用机理的有力工具,用于催化大量天然酶不能催化的立体专一性反应,更为开发具有高度选择性的药物指明了方向。
本文对抗体酶的研究开发思路和历史、催化反应类型、制备方法及发展前景作了综述。
关键词抗体酶过渡态类似物催化反应抗体酶是具有催化性质的抗体。
1986年,Lerner和Schultz [1] 同时在美国《Science》周刊上发表了他们各自独立领导的研究组对抗体酶的研究报告,并将之命名为Abzyme。
Abzyme 本质为免疫球蛋白(Ig),只是在易变区被赋予了酶的属性,故又被称为催化抗体(Catalytic antibody)。
抗体有极高的亲和力,解离常数在10 ~10 mol/L,这与酶相似,但无催化活力。
酶的催化机制在于它能结合底物产生过渡态,降低能垒,改变化学反应的速度。
抗体酶同时具备了抗体和酶的特征,应用前景十分广阔。
一、抗体酶设计的研究思路及历史过程1946年,Pauling用过渡态理论阐明了酶催化的实质,即酶之所以具有催化活力是因为它能特异性结合并稳定化学反应的过渡态(底物激态),从而降低反应能级。
他指出,酶通过某种方式与高能、短寿命的过渡态结合而起催化作用。
这个过渡态构型中某些键在形成,另一些键在断裂,存在时间极短,半衰期约为10 ~10 s,实际中极难捕获。
同时,Pauling又指出酶和抗体的根本不同在于前者选择性的结合一个化学反应的过渡态,而抗体则是结合一个基态分子。
既然过渡态分子难以捕获,而过渡态类似物是能够模拟一个酶催化反应过渡态的结构的稳定物质,于是人们就设想,只要寻找到与反应中决定性步骤的相应酶紧密结合的酶竞争性抑制剂,就等于发现了过渡态类似物;还有一种思路,就是这种类似物也能根据化学反应机制推测设计出来。
抗体酶

抗体的精细识别使其能结合几乎任何天然的或合 成的分子 抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具稳定性。 脱羧反应中介质效应:有机溶剂引起脱羧反应速率增 加。
ห้องสมุดไป่ตู้
酰基转移反应中介质效应 :在疏水溶剂中,活性较高。
抗体酶的制备
将抗体转变为酶可通过诱导法、拷贝法、引入法、化学修饰法等 途径。
1999年,Okamoto报道多克隆 的抗体酶41s-2-L能够特异识别艾 滋病病毒gp41的一段十分保守的 氨基酸序列并将其降解。 2010年,Haggag阐明了DNA酶 的抗体酶中分子模型中结构和功能 之间的关系。 如今,抗体酶已经在新肿瘤药物的 开发,手性药物的拆分,毒品的戒 除,复杂天然产物的合成方面显示 出巨大的潜在价值
Thank you!
用酶作为抗原免疫动物得到抗 酶的抗体,再将此抗体免疫动 物并进行单克隆化,获得单克 隆的抗抗体。 对抗抗体进行筛选,获得具有 原来酶活性的抗体酶。
引入法
用基因工程方法改造和制备全新的抗体酶是一种很 有前途和发展潜力的抗体酶制备方法。 将催化基因引入到特异抗体的抗原结合位点上,也 可以针对性地改变抗体结合区的某些氨基酸序列, 以获得高效的抗体酶。
—— 洪维剑, 蔡发国, 朱丽如. 抗体酶研究的新进展[J]. 饲料研究, 2009,(10)
1) 存在的问题及解决策略: 问题1:目前, 抗体酶技术工业化面临的最大困难是生产 出的一些抗体酶的底物专一性、反应选择性和催化效率不 如天然酶。 抗体酶催化活性较低的可能原因是:
1.设计出的半抗原与真实过渡态之间总会存在细微的差别; 2.抗体酶的结合位点易受底物抑制和环境因素的影响; 3.同一种类的不同细胞产生的抗体酶的活性有差异,多数特异性的 抗体酶并不是单一的分子种类,这使得抗体酶的分离纯化较为困难。 4.抗体酶多为鼠源性的单克隆抗体, 在诱导中机体内可能会产生抗 催化抗体的蛋白, 使抗体酶失活。
抗体酶知识讲解

第七章 抗体酶 Chapter 7 Abzyme
第七章 抗体酶
一 概述 二 机制 三 制备 四 应用
一、抗体酶的发现与研究思路
酶的催化机理是降低活化能。
1946年,诺贝尔奖二次得主 美国化学家Linus Pauling 提 出酶催化反应的过渡态理论。
在酶催化的反应中,与酶的活性中心形成复合物 的实际上是底物形成的过渡状态,
基因工程的技术使得建立抗体基本的组合,并 根据需要构建适当序列的基因片段已成为可能。利用抗 体库技术,在将来也许有可能绕开免疫,产生完全由基 因工程构建的全新抗体酶。
(3) 拷贝法
用已知酶作为抗原免疫动物,通过单克隆技术, 制得抗该种酶的抗体。再以此种抗体免疫动物,再次采 用单克隆技术,经筛选与纯化,就可获得具有原来酶活 性的抗体酶(因为抗原与该抗产生的抗体具有互补性,经 过上述两次拷贝,就把酶的活性部位的信息翻录到抗体 酶上,使该抗体酶能高选择性地催化原酶所催化的反应)。
寻找过渡态类似物作为半抗原产生的抗体
可能具有酶活性
以稳定的过渡态类似物作为半抗原,诱导与其互补 构像的抗体,这样产生的抗体就能识别反应过程的真正过 渡态,该抗体即有酶催化反应的基本特征,可能成为一种
具有酶活性的抗体。
半抗原:能与对应抗体结合出现抗原-抗体反应、又不 能单独激发人或动物体产生抗体的抗原。它只有反应原 性,不具免疫原性,又称不完全抗原。
2、有更强的专一性和稳定性 抗体的精细识别使其能结合几乎任何天然的或合成的 分子
抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具稳定性。 脱羧反应中介质效应:有机溶剂引起脱羧反应速率增加。 酰基转移反应中介质效应 :在疏水溶剂中,活性较高。
抗体酶

抗体酶的研究,为人们提供了一条合理途径去设 计适合于市场需要的蛋白质,即人为地设计制作 酶。它是酶工程的一个全新领域。 构建有别于天然功能酶的新酶类,是酶工程研究 的又一前沿领地。
2013-11-13
拷贝法
用已知酶作为抗原免疫动物,通过单克 隆技术,制得抗该种酶的抗体。再以此种抗 体免疫动物,再次采用单克隆技术,经筛选 与纯化,就可获得具有原来酶活性的抗体酶 (因为抗原与该抗产生的抗体具有互补性, 经过上述两次拷贝,就把酶的活性部位的信 息翻录到抗体酶上,使该抗体酶能高选择性 地催化原酶所催化的反应)。 这种方法对自然界来源稀少的紧缺酶, 不失为一种有价值的有潜力的方法。
2013-11-13
既然过渡态分子难以捕获,而过渡态类似物 是能够模拟一个酶催化反应过渡态的结构的 稳定物质,于是人们就设想,只要寻找到与 反应中决定性步骤的相应酶紧密结合的酶竞 争性抑制剂,就等于发现了过渡态类似物; 还有一种思路,就是这种类似物也能根据化 学反应机制推测设计出来。然后,以过渡态 类似物为半抗原,利用哺乳动物的免疫系统, 诱导与其互补构象的抗体产生,这种抗体即 具有催化活性——这就是 1969 年Jencks 提出的,他发展了 Pauling 的理论;接着, Kohler 和Milstein 于 1975 年发明了具有 历史意义的单克隆技术,使抗体酶的生产成 为可能。
2013-11-13
诱导法
诱导法是选择适当的化学模型物与载 体蛋白连接后给动物免疫,通过杂交瘤技术 筛选和分离单克隆抗体(所得抗体催化效果 的好坏很大程度上取决于化学模型物的设 计)。
2013-11-13
基因工程法
对于已经获得的单抗,分析其氨基酸 序列和相应基因的碱基序列,将抗原结合部 位的基因换上编码有催化作用的氨基酸的基 因,这就是基因工程法制备抗体酶的主要内 容。为可能。利用抗体库技术,在将来也 许有可能绕开免疫,产生完全由基因工程构 建的全新抗体酶。
综述_抗体酶的研究进展_

中山大学研究生学刊(自然科学、医学版)第34卷第3期JOURNAL OF THE GRADUATES VOL.34ɴ32013SUN YAT-SEN UNIVERSITY(NATURAL SCIENCES、MEDICINE)2013综述《抗体酶的研究进展》*陆诗淼(1.中山大学中山医学院免疫学专业)【内容提要】抗体酶又称催化性抗体,是具有催化活性的免疫球蛋白,在其可变区赋予了酶的属性,是抗体的高度选择性和酶的高效催化能力巧妙结合的产物,它可促进许多用普通化学方法很难完成,或者天然酶尚未能催化的新奇转变,特别是自然界不存在的高效催化剂,对生物学、化学和医学等多种学科有重要的理论意义和实用价值。
文章综合介绍了抗体酶研究的历史过程、催化抗体的结构、性质、催化的反应类型原理、制备、应用及研究的最新进展。
【关键词】催化抗体;抗体酶;酶学特征;应用进展抗体酶是具有催化性质的抗体。
从1883年Payen和Personz发现第一个酶以来,自从1986年Schultz和Lerner首次证实由过渡态类似物为半抗原,通过杂交瘤技术产生的抗体具有类似酶的催化活性以来,直至20世纪80年代初期,整整一个半世纪,发现的酶已经超过了4000种。
1986年,Schultz和Lerner同时在美国《Science》周刊上发表了他们各自独立领导的研究组对抗体酶的研究报告,并将之命名为Abzyme。
Abzyme本质为免疫球蛋白(Ig),只是在易变区被赋予了酶的属性,故又被称为催化抗体(Catalytic antibody)。
抗体有极高的亲和力,解离常数在10-4 10-14mol/L,这与酶相似,但无催化活力。
酶的催化机制在于它能结合底物产生过渡态,降低能垒,改变化学反应的速度。
抗体酶显示出在许多领域的潜在应用价值,包括许多困难和能量不利的有机合成反应,前药设计,临床治疗,材料科学等多个方面。
抗体酶这种兼具抗体和酶的性质的崭新物质,它集生物学、免疫学、化学于一身,它的发现打破了只有天然酶才有的分子识别和加速催化反应的传统观念,为酶工程学开创了新的领域,同时也为验证天然酶的催化机制,进行酶的人工摸拟,以及研究天然酶催化作用的起源提供了很好的帮助。
抗体酶在生物催化领域的应用

抗体酶可催化趋向性反应及非趋向性反应, 后者可能分为两种情况:一 是在放热分解反应中控制反应构象, 使多产物反应转变为单产物生成为主的 反应;另一种情况是降低反应中过渡态能障。但抗体酶缺少天然酶的韧性或 扭曲性, 没有天然酶所具有的底物去稳作用, 而可能只起稳定过渡态的作用。
LICME
资料仅供参考,不当之处,请联系改正。
经筛选和纯化就可获得具有原来酶活性的抗体酶。因为抗原与该抗原 产生的抗体具有互补性, 经两次拷贝, 就把酶的活性部位的信息翻录到 抗体酶上了, 使该抗体酶活性中心的空间结构与原酶的形状完全一致, 保证了对同底物的特异性。
LICME
资料仅供参考,不当之处,请联系改正。
(3) 抗体结合部位修饰法
将催化基团或辅助因子引入到抗体的抗原结合部位,一般 可采用两种方法: 即选择性化学修饰法和基因工程定点突变法 。
抗体结构 LICME
资料仅供参考,不当之处,请联系改正。
二.抗体酶的作用原理
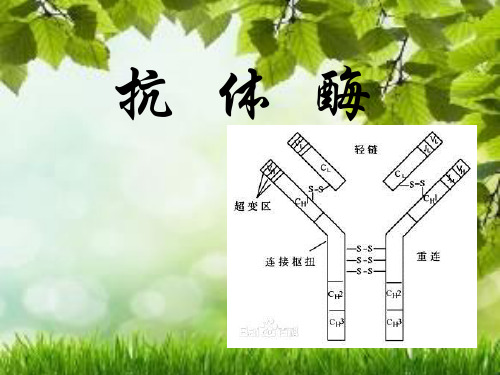
抗体酶是生物体受抗原诱导产生的具有催化能力的抗体, 其在结构上与 抗原高度互补并能与之特异结合。通过设计化学反应过渡态或中间体类似物 作为半抗原, 诱导机体产生抗体, 产生的抗体能特异性地识别过渡态分子, 降低反应的活化能, 达到催化反应的目的。抗体酶和所有的抗体一样, 都 是由两条轻链和两条重链构成, 抗原与轻链和重链的可变区特异性结合, 因 此可变区的氨基酸的排列顺序决定了抗体分子的特异性, 其本质是一类具 有催化活性的免疫球蛋白, 可变区赋予其酶的属性, 所以也称为催化抗体
酶工程催化抗体

•30
Schultz小组制备了水解甲基对硝 基苯基碳酸酯的抗体48G7与其半抗原 p-硝基苯基-4-羧丁基磷酸酯的复合物 的晶体,并对其进行了X-射线衍射分 析,发现抗体结合部位的共有模块含 有碱性残基,它能与磷酸氧发生静电 相互作用产生所谓氧阴离子洞 (Oxyanion hole)。
抗原具有较强的免疫原性; 催化抗体与半抗原的亲和力:一般认为结合常数
Ki应小于10-6mol/L,容易获得高效催化抗体; 诱导羧酸酯、酰胺水解的催化抗体,可以利用具
有四面体结构的过渡态类似物作为半抗原; 半抗原的设计应考虑催化反应的环境与反应机制。
•10
自从抗体酶制备成功以来,迄今已成 功地开发出天然酶所催化的六种酶促反应 和数十种类型的常规反应的抗体酶。
•13
抗体酶的出现,意味着有可 能出现简单有效的方法,从而人 们可凭主观愿望来设计蛋白质。
——这一发现是利用生物学与化学成果在 分子水平上交叉渗透研究的产物。由于抗 体酶对于多学科展示了较高的理论和实用 价值,已引起科学界广泛的关注。
•14
抗体
抗体是由B细胞受抗原刺 激后所分泌的蛋白质
结 合 区: 抗体分 子上有两个抗原结 合区
•28
结构和动力学数据都说明抗体酶 的水解机理与丝氨酸蛋白酶极为相似。 抗体酶结合部位含有一个Ser-His二 体结构,靠近结合抗原的磷原子,这 与丝氨酸蛋白水解酶的电荷中继系统 Ser-His-ASP成分中的二个相似。
•29
抗体结合部位中还含有Lys残基, 用于稳定负氧离子形成和识别底物的 疏水口袋。
抗体酶:20世纪80年代以来出现 的一种具有催化活性的蛋白质,是利 用生物学和化学的成果在分子水平上 交叉渗透研究的产物;其本质上是免 疫球蛋白,只是在其易变区被赋予了 酶的属性,因此抗体酶又称为催化抗 体(Catalytic Antibody)。
抗体酶

获得活化能的多少与反应的 速- 度成正比。
过渡态理论
过渡态理论认为,酶与底物的结合经历了一个 易于形成产物的过渡态,实际上是降低了反应 所需的活化能。
-
与反应过渡状态结合作用
在酶催化的反应中,与酶的活性中心形成复合物 的实际上是底物形成的过渡状态,
酶与过渡状态的亲和力要大于酶与底物或产物的 亲和力。
-
拷贝法
用酶作为抗原免疫动物得到抗酶的抗体,再将此抗体免疫 动物并进行单克隆化,获得单克隆的抗抗体。
对抗抗体进行筛选,获得具的抗原特异性标志 独特型是单克隆的,其抗原决定簇位于V区
酯酶催化反应的过渡态类似物设计(方框内为半抗原)
-
用一个带有电荷的半抗原作为免疫原,在免疫进化过程中 诱异抗体结合部位的一个氨基酸残基带有互补的电荷,使 其具有酸、碱或亲核催化的能力。
Janda等根据此原理,以带电 的半抗原1为诱导,得到7个 能催化和半抗原1结构类似的 底物3水解的单克隆,而结构 相同但不带电的半抗原2(作 为比较)却未得到有催化活性 的单克隆。
用过渡态类似物诱导的抗体所催化的反应并非该 类似物本身,而是与其相似的另一种反应。
-
抗体酶的特性
一种对酶促反应过渡态特异的抗体 结合了酶与抗体的优点,既可以起酶促催化作用, 又可以起抗体的选择性和专一性结合抗原的作用。
1、能催化一些天然酶不能催化的反应 有许多化学反应还没有已知酶催化进行 抗体的多样性决定了抗体酶催化反应类型多样性 抗体酶可以根据需要人工裁制
化学修饰法对抗体进行化学修饰,使抗体与催化基团 相连。
-
诱导法
设计半抗原 选择合适的反应过渡态类似物作为化学模型物
用设计好的半抗原,与载体蛋白(如牛血清白蛋白) 偶联制成抗原;将此抗原进行免疫,使宿主针对抗原 产生抗体。
抗体酶简介及医学上的应用

抗体酶简介及医学上的应用谢祚宜2013级学号1131702027摘要:抗体酶又称催化性抗体,是具有催化活性的免疫球蛋白,在其可变区赋予了酶的属性,是抗体的高度选择性和酶的高效催化能力巧妙结合的产物,它可促进许多用普通化学方法很难完成,或者天然酶尚未能催化的新奇化学转变,对生物学、化学和医学等多种学科有重要的理论意义和实用价值。
在医学、工业、农业等众多领域具有广泛的应用前景和潜在的应用价值。
该文综合介绍了抗体酶研究的历史过程、催化抗体的结构、性质、催化的反应类型、抗体酶的制备以及在医学领域的应用及研究进展。
关键词:抗体酶; 应用1.抗体酶的发现与定义抗体与酶(指P酶)本质上都是蛋白质, 都能与相应的抗原或底物特异性结合, 差别在于酶是能与反应过渡态选择结合的催化物质, 抗体是和基态紧密结合的物质。
抗体酶(abzyme)又称催化抗体(catalytic antibody), 是一类集抗体高度特异性与酶高效催化活性于一身的蛋白质分子。
1986年,Schultz和Lerner同时在美国《Science》周刊上发表了他们各自独立领导的研究组对抗体酶的研究报告,并将之命名为Abzyme。
Abzyme 本质为免疫球蛋白( Ig ) ,只是在易变区被赋予了酶的属性,故又被称为催化抗体( Catalytic antibody) 。
抗体有极高的亲和力,解离常数在10-4~10-14mol /L,这与酶相似,但无催化活力。
酶的催化机制在于它能结合底物产生过渡态,降低能垒,改变化学反应的速度。
抗体酶显示出在许多领域的潜在应用价值,包括许多困难和能量不利的有机合成反应,前药设计,临床治疗,材料科学等多个方面。
抗体酶的结构与抗体分子相似, 不同之处在于其可变区除了具有抗原特异的结合能力外, 还被赋予了酶的催化活性, 因此本质上抗体酶是一类具有催化活性的免疫球蛋白。
早期的抗体酶结构类似于免疫球蛋白, 含有两条轻链和两条重链, 每条链都含有不变区和可变区。
抗体酶

酯酶催化反应的过渡态类似物设计(方框内为半抗原)
a
24
用一个带有电荷的半抗原作为免疫原,在免疫进化过程中 诱异抗体结合部位的一个氨基酸残基带有互补的电荷,使 其具有酸、碱或亲核催化的能力。
Janda等根据此原理,以带电 的半抗原1为诱导,得到7个 能催化和半抗原1结构类似的 底物3水解的单克隆,而结构 相同但不带电的半抗原2(作 为比较)却未得到有催化活性 的单克隆。
化学修饰法对抗体进行化学修饰,使抗体与催化基团
相连。
a
20
诱导法
设计半抗原
选择合适的反应过渡态类似物作为化学模型物
用设计好的半抗原,与载体蛋白(如牛血清白蛋白) 偶联制成抗原;将此抗原进行免疫,使宿主针对抗原 产生抗体。
产生抗体的脾脏细胞与骨髓瘤细胞相融合,得到的杂 交瘤细胞既能产生抗体又能在体外培养;
a
25
拷贝法
用酶作为抗原免疫动物得到抗酶的抗体,再将此抗体免疫 动物并进行单克隆化,获得单克隆的抗抗体。
对抗抗体进行筛选,获得具有原来酶活性的抗体酶。
a
26
酶反应有两个主要的特征:
高催化效率、高选择性
1946年,Pauling用过渡态理论阐明酶催化的实 质
酶之所以具有催化活力是因为它能特异性结合 并稳定化学反应的过渡态(底物激态),从而降 低反应能级。
a
7
过渡态理论
过渡态理论是解释酶催化原理的经典理论。
对任何化学反应,反应物在 变为产物之前,必须获得一 定的能量,成为活化态或称 过渡态。过渡态处于最高能 阶上。
7、光诱导反应
8、氧化还原反应
9、脱羧反应
10、顺反异构化反应
a
18
抗体酶的特性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1986年Schultz以对硝基苯酚磷酸胆碱酯(PNPPC) 作为相应的羧酸二酯的过渡态类似物。 诱导产生的抗体酶使水解反应速度加快12000倍。
抗体酶
抗体酶(Abzyme)或催化抗体(Catalytic antibody)
一种具有催化功能的抗体分子,在其可变区赋 予了酶的属性。 它是利用现代生物学与化学的理论与技术交叉 研究的成果,是抗体的高度选择性和酶的高效 催化能力巧妙结合的产物。
酯酶催化反应的过渡态类似物设计(方框内为半抗原)
用一个带有电荷的半抗原作为免疫原,在免疫进化过程中 诱异抗体结合部位的一个氨基酸残基带有互补的电荷,使 其具有酸、碱或亲核催化的能力。
Janda等根据此原理,以带电
的半抗原1为诱导,得到7个
能催化和半抗原1结构类似的 底物3水解的单克隆,而结构 相同但不带电的半抗原2(作 为比较)却未得到有催化活性
化学修饰法
抗体酶和酶一样也可以用化学修饰法加以改造。
对抗体酶进行结构修饰的关键是找到一种温和 的方法在抗体结合位置或附近引入具有催化功 能的基因。
游离巯基就是适合的基团之一,它具有高亲
核性,易于氧化,能通过二硫化物进行交换 反应或亲电反应而选择性修饰的特点。
抗体酶的应用前景
1、 抗体酶在帮助戒毒方面的应用
前药 ( prodrug)是指由具有生物活性的药物 经化学修饰后转变为体外无活性的化合物。这 种化合物在体内经酶或非酶作用,脱去保护基, 释放出母体药物而发挥治疗作用。
静脉给药后,当药物扩散至肿瘤细胞的表面或附 近,抗体酶就会将前药迅速水解释放出抗肿瘤药 物,从而提高肿瘤细胞局部药物浓度,增强对肿 瘤的杀伤力,达到提高肿瘤化疗效果的目的。 当然前药只能被抗体酶水解而不能被内源性酶水 解,抗原还要尽量减少免疫原性 。
的单克隆。
拷贝法
用酶作为抗原免疫动物得到抗酶的抗体,再将此抗体免疫 动物并进行单克隆化,获得单克隆的抗抗体。 对抗抗体进行筛选,获得具有原来酶活性的抗体酶。
独特型
每个免疫球蛋白分子所特有的抗原特异性标志
独特型是单克隆的,其抗原决定簇位于V区
同一个体中不同B细胞克隆所产生的Ig可变区 所具有的抗原特异性标志,由Ig超变区特有的 氨基酸序列和构型所决定。
抗体酶 (Abzyme)
内容
抗体酶概念 抗体酶产生的理论基础 抗体酶的制备方法 抗体酶的应用
抗体
由抗原诱导产生的,在结构上与抗原高度互补并 与抗原具有特异结合功能的免疫球蛋白。
抗体的最显著的特征是
多样性和专一性
酶是生物催化剂
酶是一类具有催化功能的生物分子 酶反应有两个主要的特征:
4、酰胺合成反应
5 Diels-Alder反应 6、转酯反应 7、光诱导反应 8、氧化还原反应
9、脱羧反应
10、顺反异构化反应
抗体酶的特性
2、有更强的专一性和稳定性
抗体的精细识别使其能结合几乎任何天然的或合成 的分子
抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具 稳定性。
独特型可由多个抗原决定簇组成,这些决定簇称 为独特位。
抗独特型抗体
Ab2α
抗Ab1V区骨架部分,具有封闭相应BCR或Ig分 子的抗原结合点,抑制相应B细胞克隆的活化 抗Ab1V区CDR部分,具有类似相应抗原的分子 构象,可模拟抗原与相应B细胞克隆受体结合 并使之激活,故称为抗原的内影像
Ab2β
Landry等用可卡因水解的过渡态类似物-磷酸 单酯为半抗原,产生的单克隆抗体能催化可卡 因的分解,其催化活性和血液中催化可卡因的 丁酰胆碱酯酶差不多,水解后的可卡因片断失 去可卡因刺激功能。 因此,用人工抗体酶的被动免疫也许能阻断可 卡因上瘾,达到戒毒目的 。
抗体酶用于肿瘤治疗
目前正在发展一种称为抗体介导前药治疗(ADEPT) 技术,即将能水解前药释放出肿瘤细胞毒剂的酶 和肿瘤专一性抗体相偶联,这样酶就会通过和肿 瘤结合的抗体而存在于细胞的表面。
随着噬菌体抗体库技术的完善,可根据需要构建适当序列 的基因片断,绕过免疫学方法,构建全新的抗体酶。 噬菌体展示技术将组建亿万种不同特异性抗体可变区基因 库和抗体在大肠杆菌中功能性表达,与高效快速的筛选手 段结合起来,彻底改变了抗体酶生产的传统途径。 用工程抗体催化法生产抗体酶,不需要进行细胞融合以获 得杂交瘤细胞,并且可筛选具有特定功能的未知结构,具 有生产简单、价格低、抗体的免疫原性较低的优点,并易 获得稀有的抗体。
过渡态理论与抗体酶
如果使抗原最大限度地接近某一特定反应的过渡 态,就可能使诱导的抗体在与之结合时发挥催化 作用。 实际所采用的过渡态抗原知识推测而设计的过渡 态类似物。 用过渡态类似物诱导的抗体所催化的反应并非该 类似物本身,而是与其相似的另一种反应。
抗体酶的特性
一种对酶促反应过渡态特异的抗体
抗体酶的研究,为人们提供了一条合理途径去设 计适合于市场需要的蛋白质,即人为地设计制作 酶。它是酶工程的一个全新领域。
构建有别于天然功能酶的新酶类,是酶工程研究 的又一前沿领地。
诱导法
设计半抗原
选择合适的反应过渡态类似物作为化学模型物
用设计好的半抗原,与载体蛋白(如牛血清白蛋白) 偶联制成抗原;将此抗原进行免疫,使宿主针对抗原 产生抗体。
产生抗体的脾脏细胞与骨髓瘤细胞相融合,得到的杂 交瘤细胞既能产生抗体又能在体外培养;
将杂交瘤细胞克隆优点,既可以起酶促催化作用, 又可以起抗体的选择性和专一性结合抗原的作用。
1、能催化一些天然酶不能催化的反应
有许多化学反应还没有已知酶催化进行
抗体的多样性决定了抗体酶催化反应类型多样性
抗体酶可以根据需要人工裁制
抗体酶的催化反应类型
1、转酰基反应
2、水解反应 3、Claisen重排反应
利用过渡态类似物制备抗体酶示意图
诱 导法
动物免疫技术和杂交瘤技术有机结合而产生的一 种新方法。 利用这种方法所得到的抗体酶催化效果的好坏很 大程度上取决于化学模型物的设计。
反应过渡态类似物,即半抗原的设计。
抗体酶用于有机酯的水解,过渡态类似物磷酸盐 和磷酸酯作为免疫原诱导产生的单克隆抗体催化 水解反应比未催化反应快104倍。
引入法
用基因工程方法改造和制备全新的抗体酶是一种很有前途 和发展潜力的抗体酶制备方法。 将催化基因引入到特异抗体的抗原结合位点上,也可以针 对性地改变抗体结合区的某些氨基酸序列,以获得高效的 抗体酶。
对于已产生的单抗,分析抗体结合部位的氨基酸顺序 或对应的碱基顺序。然后通过对抗体酶结合部位氨基 酸对应的基因序列进行定点突变,希望能在抗体结合 部位换上有催化作用的氨基酸。进而改变抗体酶的催 化效率。
能与化学反应中过渡态结合的抗体,可能具有 酶的活性,催化反应的进行。
1986年Lerner和Schultz证实了这一设想。
抗体酶的发现
Lerner和Schultz分别领导各自的研究小组首次观 察到了抗体具有选择性的催化活性。 1986年美国Lerner和Schultz两个实验室同时在 Science上发表论文,报道他们成功地得到了具有 催化活性的抗体。 并将这类具催化能力的免疫球蛋白称为催化抗体, 即抗体酶。
过渡态理论
过渡态理论认为,酶与底物的结合经历了一个 易于形成产物的过渡态,实际上是降低了反应 所需的活化能。
与反应过渡状态结合作用
在酶催化的反应中,与酶的活性中心形成复合物 的实际上是底物形成的过渡状态, 酶与过渡状态的亲和力要大于酶与底物或产物的 亲和力。
抗体酶设想
1969年Jencks根据抗体结合抗原的高度特异性, 与天然酶结合底物的高度专一性相类似的特性, 在过渡态理论的基础上首先提出设想:
抗体酶具有典型的酶反应特性
与配体(底物)结合的专一性,包括立体专一性, 抗体酶催化反应的专一性可以达到甚至超过天然 酶的专一性;
具有高效催化性,一般抗体酶催化反应速度比非 催化反应快102~106倍,有的反应速度已接近于天 然酶促反应速度;
抗体酶还具有与天然酶相近的米氏方程动力学及 pH依赖性等。
高催化效率、高选择性
1946年,Pauling用过渡态理论阐明酶催化的实质
酶之所以具有催化活力是因为它能特异性结合 并稳定化学反应的过渡态(底物激态),从而降 低反应能级。
过渡态理论
过渡态理论是解释酶催化原理的经典理论。
对任何化学反应,反应物在 变为产物之前,必须获得一 定的能量,成为活化态或称 过渡态。过渡态处于最高能 阶上。 过渡态与反应物的能阶之差 称为活化能。 获得活化能的多少与反应的 速度成正比。
脱羧反应中介质效应:有机溶剂引起脱羧反应速 率增加。 酰基转移反应中介质效应 :在疏水溶剂中,活 性较高。
抗体酶的制备
将抗体转变为酶可通过诱导法、拷贝法、引入法、化学 修饰法等途径。
诱导法是利用反应过渡态类似物为半抗原制作单克隆 抗体,筛选出具高催化活性的单抗即抗体酶。 拷贝法主要根据抗体生成过程中抗原-抗体互补性来 设计的。 引入法则借助基因工程和蛋白质工程将催化基因引入 到特异抗体的抗原结合位点上,使其获得催化功能。 化学修饰法对抗体进行化学修饰,使抗体与催化基团 相连。
