Toll样受体的结构及免疫功能探究
TLR4促进肿瘤细胞免疫逃逸和凋亡抵抗的分子机制研究

TLR4促进肿瘤细胞免疫逃逸和凋亡抵抗的分子机制研究一、本文概述随着对肿瘤发生发展机制的深入研究,越来越多的证据表明,肿瘤细胞能够利用多种机制逃避宿主免疫系统的攻击,从而实现免疫逃逸。
其中, toll样受体4(TLR4)作为一种重要的模式识别受体,在肿瘤免疫逃逸和凋亡抵抗中发挥了关键作用。
本文旨在深入探讨TLR4在肿瘤细胞免疫逃逸和凋亡抵抗中的分子机制,以期能为肿瘤免疫治疗提供新的思路和方法。
我们将对TLR4的基本结构和功能进行简要介绍,明确其在天然免疫和适应性免疫中的重要作用。
然后,我们将详细阐述TLR4如何被肿瘤细胞利用,通过调控免疫细胞的功能,实现免疫逃逸。
这包括但不限于抑制抗原提呈细胞的成熟和活化,抑制T细胞的增殖和活化,以及促进免疫抑制性细胞的生成和功能等。
接下来,我们将关注TLR4在肿瘤细胞凋亡抵抗中的作用。
我们将从凋亡信号通路的角度,探讨TLR4如何调控凋亡相关分子的表达,从而抵抗凋亡。
这包括但不限于抑制凋亡诱导信号的传递,下调凋亡执行分子的表达,以及促进抗凋亡分子的表达等。
我们将对TLR4在肿瘤免疫治疗中的潜在应用进行探讨。
我们将结合目前的研究进展,分析以TLR4为靶点的肿瘤免疫治疗策略的优点和挑战,以及未来的发展方向。
通过本文的综述,我们期望能够更深入地理解TLR4在肿瘤细胞免疫逃逸和凋亡抵抗中的分子机制,从而为肿瘤免疫治疗提供新的理论支持和实践指导。
二、TLR4与肿瘤免疫逃逸肿瘤免疫逃逸是指肿瘤细胞通过一系列机制逃避宿主免疫系统的攻击,从而得以在体内生长和扩散。
近年来,越来越多的研究表明,TLR4在这一过程中发挥着重要作用。
TLR4,即 Toll样受体4,是一种模式识别受体,能够识别并响应多种病原体相关分子模式(PAMPs)以及损伤相关分子模式(DAMPs),进而激活下游信号通路,诱导免疫应答。
在肿瘤微环境中,肿瘤细胞可以通过多种方式上调TLR4的表达。
这些方式包括但不限于基因突变、表观遗传学改变以及微环境信号的影响。
TOLL样受体
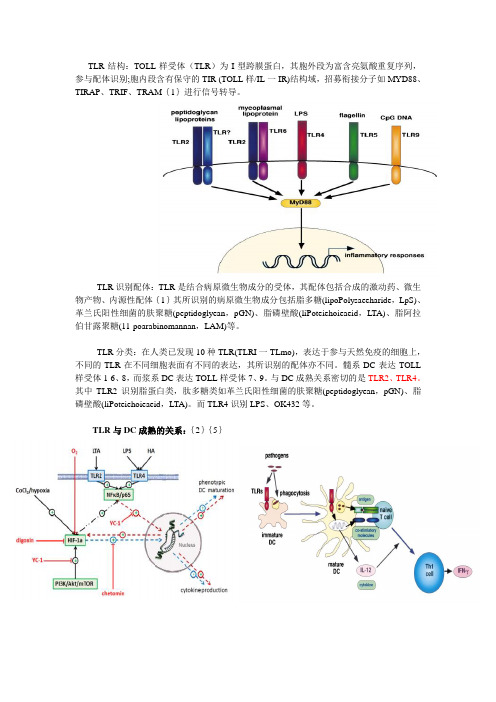
TLR结构:TOLL样受体(TLR)为I型跨膜蛋白,其胞外段为富含亮氨酸重复序列,参与配体识别;胞内段含有保守的TIR (TOLL样/IL一IR)结构域,招募衔接分子如MYD88、TIRAP、TRIF、TRAM{1}进行信号转导。
TLR识别配体:TLR是结合病原微生物成分的受体,其配体包括合成的激动药、微生物产物、内源性配体{1}其所识别的病原微生物成分包括脂多糖(lipoPolysaeeharide,LpS)、革兰氏阳性细菌的肤聚糖(peptidoglyean,pGN)、脂磷壁酸(liPoteiehoieaeid,LTA)、脂阿拉伯甘露聚糖(11-poarabinomannan,LAM)等。
TLR分类:在人类已发现10种TLR(TLRI一TLmo),表达于参与天然免疫的细胞上,不同的TLR在不同细胞表面有不同的表达,其所识别的配体亦不同。
髓系DC表达TOLL 样受体1-6、8,而浆系DC表达TOLL样受体7、9。
与DC成熟关系密切的是TLR2、TLR4。
其中TLR2识别脂蛋白类,肽多糖类如革兰氏阳性细菌的肤聚糖(peptidoglyean,pGN)、脂磷壁酸(liPoteiehoieaeid,LTA)。
而TLR4识别LPS、OK432等。
TLR与DC成熟的关系:{2}{5}TLR信号转导机制:{3}TLR受体激动药在肿瘤微环境下的免疫调节作用:{1}TLR基因定位:{4}特异性引物序列:TLR2(forward GCAAACGCTGTTCTGCTCAG) (reverse AG GCGTCTCCCTCTA TTGTA TT) TLR4 (forward ATGGCATGGCTTACACCACC) (reverse GA GGCCAA TTTTGTCTCCACA)细胞筛选机制:{1}Toll-like receptor agonists in cancer therapy{2}Roles of Toll-like receptors in innate immune responses{3}生物谷图库{4}Modulation of TNFSF expression in lymphoid tissue inducer cells by dendritic cells activatedwith Toll-like receptor ligands{5}Effects of TLR Agonists on the Hypoxia-Regulated Transcription Factor HIF-1a andDendritic Cell Maturation under Normoxic Conditions。
免疫细胞表面的TLR9及其免疫调节作用

免疫细胞表面的TLR9及其免疫调节作用前言Toll样受体9(TLR9)是Toll样受体家族的成员之一,其可被病原体来源的非甲基化磷酸胞苷鸟苷DNA(CpG DNA)或人工合成的含非甲基化CpG的寡核苷酸(CpG ODN)激活,并通过其下游信号传导直接或间接启动固有免疫反应,从而抵抗病原体的入侵。
长期以来,TLR9一直被认为是位于内溶酶体中的细胞内DNA传感器。
然而,随着研究的深入,发现TLR9也可以在细胞膜表面表达,如中性粒细胞、B细胞甚至红细胞,被称为表面TLR9(sTLR9)。
此外,细胞免疫反应的激活可以在细胞内外的这两个TLR9位点启动,TLR9在细胞膜上的定位有助于激活内体TLR9(eTLR9)介导的信号通路。
sTLR9的存在可能有利于某些细胞类型或组织中的宿主反应,例如红细胞可以通过sTLR9介导巨噬细胞等先天免疫细胞的激活,从而在炎症状态下加速自身的清除。
因此,深入了解sTLR9的结构特征、sTLR9与CpGDNA的关系,以及sTLR9在免疫细胞中的免疫调节作用,将为TLR9激动剂的临床应用提供理论参考。
sTLR9的结构sTLR9的结构并不特别清楚,它是否与eTLR9相同也存在争议。
众所周知,eTLR9属于I型跨膜蛋白,由细胞外、跨膜和细胞内区域组成。
eTLR9的胞外区位于内体中,由25个富含亮氨酸的重复序列(LRR)组成,其N-末端和C-末端分别称为TLR9-N和TLR9-C。
TLR9-N和TLR9-C可以通过天冬氨酸内切酶释放,该内切酶作用于eTLR9中间的LLR14和LLR15之间的Z环结构域,形成TLR9-N+C复合物,这是eTLR9的活性形式。
然而,sTLR9的结构尚不清楚。
一项研究表明,与TLR9-N 结合的抗体完全不能与人外周中性粒细胞上的sTLR9结合,这可能表明这些中性粒细胞的sTLR9不是TLR9-N+C复合物的活性形式。
而抗全长TLR9和抗TLR9-N的抗体都能识别B 细胞上的sTLR9,这表明全长TLR9和TLR9-N存在于B细胞上。
tlr信号转导原理

tlr信号转导原理引言:tlr信号转导是指Toll样受体(Toll-like receptor,TLR)家族在免疫系统中起到信号传导的重要作用。
TLR是一类跨膜受体,主要存在于免疫细胞表面,能够识别和结合到病原体的分子模式,并启动相应的免疫应答。
本文将介绍TLR的结构特点、信号转导机制以及其在免疫应答中的重要作用。
一、TLR的结构特点TLR是一类由多个跨膜蛋白组成的受体家族,目前已经发现了十多种不同的TLR。
这些TLR的结构特点有以下几个方面:1. 跨膜结构:TLR大部分由一个跨膜蛋白组成,跨膜区域具有保守的氨基酸序列。
2. 外显区域:TLR的外显区域分为N端和C端两部分,N端是TLR 家族的保守结构域,能够识别和结合到病原体的分子模式。
3. 受体配体:不同的TLR能够识别和结合到不同的病原体分子模式,如TLR2能够识别和结合到细菌的脂多糖,TLR3能够识别和结合到病毒的双链RNA等。
二、TLR的信号转导机制TLR的信号转导机制主要包括三个关键步骤:识别和结合、信号传导和免疫应答。
1. 识别和结合:TLR的外显区域能够识别和结合到病原体的分子模式,如细菌的脂多糖、病毒的双链RNA等。
2. 信号传导:识别和结合后,TLR能够激活下游信号分子,启动信号传导通路。
TLR主要通过两条信号传导通路进行信号转导:MyD88依赖通路和TRIF依赖通路。
a. MyD88依赖通路:大部分TLR通过MyD88依赖通路传递信号。
在这条通路中,TLR与MyD88蛋白结合,激活下游信号分子,最终激活核转录因子NF-κB和IRF,促进炎症因子和抗病毒因子的产生。
b. TRIF依赖通路:少数TLR通过TRIF依赖通路传递信号。
在这条通路中,TLR与TRIF蛋白结合,激活下游信号分子,最终激活IRF和NF-κB,促进抗病毒因子的产生。
3. 免疫应答:信号传导通路的激活会引起一系列的免疫应答,包括炎症反应、抗病毒应答和抗肿瘤应答等。
toll样受体名词解释

toll样受体名词解释
Toll样受体是一类重要的蛋白质受体,也被称为Toll-like receptors(TLRs)。
它们是一类存在于人类和其他动物的免疫系统中的受体分子,起着识别和应答外来微生物的关键作用。
Toll样受体最早是在果蝇(Drosophila)的免疫系统中被发现的,后来在人类和其他脊椎动物中也被发现。
它们的命名源自于果蝇的Toll受体,因为人类的TLRs在结构和功能上与果蝇的Toll受体相似。
TLRs主要存在于免疫细胞表面,如巨噬细胞、树突状细胞和B 淋巴细胞等。
它们通过结合微生物的特定分子模式(例如细菌的脂多糖、病毒的核酸等)来识别和区分病原体。
一旦TLRs与这些微生物分子结合,它们会激活免疫细胞,并引发一系列的免疫反应。
TLRs的激活会触发多种信号传导途径,包括NF-κB和MAPK等途径,从而导致炎症反应和免疫细胞的活化。
这些反应有助于清除病原体、增强免疫应答,并最终保护机体免受感染。
除了对微生物的识别,TLRs还参与了一些非感染性疾病的发生
和发展,如自身免疫性疾病、癌症和慢性炎症等。
因此,研究TLRs
的功能和调控机制对于理解免疫系统的工作原理以及相关疾病的治
疗具有重要意义。
总结起来,Toll样受体是一类存在于免疫细胞表面的受体分子,通过识别微生物的特定分子模式来激活免疫反应。
它们在免疫应答
中起着重要作用,并参与了多种疾病的发生和发展。
Toll样受体简介及TLR2在类风湿关节炎中的研究进展

Toll样受体简介及TLR2在类风湿关节炎中的研究进展Toll样受体(Toll like receptors,TLRs)作为天然免疫分子的成员已经成为目前免疫学研究的热点,迄今为止人类TLR家族至少包括有11个成员[1],主要表达在单核细胞和树突状细胞,它们参与多种免疫反应,对类风湿关节炎(rheumatoid arthritis,RA)的发病也有突出影响。
TLR2是Toll样受体家族的重要成员,本文就TLRs做一简介,并对TLR2在RA中的研究进展做一综述。
1 Toll样受体简介Toll样受体最早是在研究果蝇的胚胎发育中发现的,称为Toll受体,它们不仅是果蝇胚胎发育过程中的必须成份蛋白,同时也能介导天然免疫,抵抗微生物的感染[2]。
1997年Janeway[3]等首次发现与果蝇同源的人的Toll蛋白,并命名为TLRs。
1.1 TLRs的结构和分布哺乳动物的TLRs均为Ⅰ型跨膜蛋白受体,主要由三个功能区构成:胞外区、跨膜区和胞内区。
胞外区含有18-31个富含亮氨酸的重复序列(leucine rich repeats,LRR),研究发现TLR家族成员胞外区的同源性差,提示不同的TLR成员与不同的配体结合[4],亦即表示LRR具有决定TLRs与配体结合部位的特异性。
TLR的胞内区与人白介素-Ⅰ受体(IL-IR)胞内区结构相似,故称为TIR结构域(Toll/IL-IR domain,TIR)[5],TIR结构负责向下游进行信号转导,它是TLR和IL-IR向下游转导信号的核心元件,其关键位点的突变或序列缺失会阻断信号下传。
TLRs分布广泛,大部分组织至少表达一种TLR,有些甚至表达全部,其中所有淋巴组织都有TLRs的表达,在外周血白细胞中表达水平最高,单核/巨噬细胞、B细胞、T细胞及DC都表达TLR mRNA。
1.2 TLRs的配体TLRs是一类Ⅰ型跨膜形式识别受体(pattern recognition receptors,PRR),它主要识别广泛存在于病原体细胞表面的分子标志,即病原相关分子模式(pathogen associated molecular patterns,PAMPs),从而迅速激活免疫反应的。
细胞表面受体的功能及其在免疫系统中的应用

细胞表面受体的功能及其在免疫系统中的应用细胞表面受体是细胞表面上的一种分子,它们是细胞与环境、其他细胞之间通信的关键。
不同类型的受体会响应不同的信号物质,从而调控细胞内信号传递通路,影响细胞生长、分化、存活以及攻击病原体和肿瘤等功能。
本文将介绍一些常见的细胞表面受体,以及它们在免疫系统中的应用。
1. Toll样受体(TLRs)TLRs是能识别病原微生物模式分子的一类跨膜受体。
它们主要存在于宿主免疫系统的细胞表面上,包括淋巴细胞、巨噬细胞、树突细胞等。
当微生物入侵机体时,TLRs会识别并结合它们表面的PAMPs (pathogen-associated molecular patterns,即病原微生物模式分子),激活宿主的天然免疫防御机制。
TLRs和PAMPs之间的结合能够激活转录因子NF-κB,从而促进炎症因子的生成,增强巨噬细胞、树突细胞和T细胞的活性,最终消灭入侵的微生物。
2. 细胞因子受体细胞因子受体是能够识别并结合不同类型的细胞因子的跨膜受体。
它们的作用是调控细胞之间的相互作用、细胞增殖、分化、凋亡以及炎症反应等生物过程。
常见的细胞因子受体包括IL-1受体、IFN感受器、IL-2受体、IL-4受体、IL-12受体、TNF受体等。
这些受体能够识别不同类型的细胞因子,激活相关的信号通路,从而改变细胞的功能和相互作用。
在免疫系统中,细胞因子受体与细胞因子的相互作用是非常关键的。
例如,IL-2受体是T细胞增殖和生存所必需的,而TNF受体则是炎症反应的关键调节因子。
3. T细胞受体(TCR)TCR是T细胞表面的一种膜受体,它能够识别并与MHC分子上的肽段结合。
在机体抵抗病原微生物和肿瘤时,TCR是T细胞识别和消灭目标细胞的重要途径。
同时,TCR还能够判定机体自身组织是否被外界攻击,从而发挥着重要的自身免疫作用。
TCR的结构包括α链和β链,α链和β链每个都是由V、D、J三个可变区域组成。
每个可变区域都有多种不同的基因段可以选择,因此TCR的多样性非常高。
Toll样受体及其信号通路研究进展

Toll样受体及其信号通路研究进展摘要:Toll样受体(TLRs)是一类模式识别受体,可以识别微生物并对其作出反应。
TLRs家族成员在免疫系统中起着重要作用,既是参与先天免疫的重要分子,也是连接先天免疫和特异性免疫的桥梁。
该受体可以特异性地识别微生物,并启动免疫应答。
本文对TLRs结构、功能和信号通路等方面进行综述。
关键词:Toll样受体免疫系统信号通路在天然免疫系统的研究中,Toll样受体的发现是最重要的进展之一。
TLRs 最早是1980年在果蝇胚胎中发现的,此基因决定了果蝇背腹侧的分化[1]。
1991年Gay等发现,TLRs蛋白的结构与哺乳动物中IL-1具有同源性[2]。
随后,TLRs 被发现能够激活获得性免疫[3]。
至今,已经发现21种TLRs,其中人13种(TLR1-13),小鼠12种(TLR1-9及TLR11-13),斑马鱼18种(TLR1-9、TLR11-14和TLR18-22)。
1、TLRs的结构TLRs结构由三部分组成,胞外区、跨膜区和胞浆区。
胞外区是亮氨酸富集的重复序列,识别病原体细胞表面的分子;跨膜区富含半胱氨酸;胞浆区与哺乳动物IL-1受体高度同源,称为TIR[5]。
TIR的构型与病原识别相关,不同种类TLRs,识别不同种类的微生物。
2、TLRs的功能TLRs是抵御感染性疾病的第一道屏障,在免疫系统中起识别微生物的作用。
TLRs通过TIR识别相应的配体来激活免疫反应。
TLR1可识别细菌的三酰脂肽;TLR2可识别革兰氏阳性细菌的脂蛋白、肽聚糖等;TLR3主要识别dsDNA;TLR4能识别革兰氏阴性菌的脂多糖;TLR5特异识别细菌的鞭毛蛋白;TLR6主要识别细菌的肽聚糖;TLR7、TLR8可识别单链RNA病毒;TLR9可识别CpGDNA。
另外树突细胞可表达TLRs。
TLRs在识别脂多糖、肽聚糖、脂蛋白及病毒后,树突细胞被活化并成熟,提供获得性免疫的共刺激信号。
TLRs是微生物成分引起树突细胞活化的桥梁。
toll样受体

Toll样受体Toll样受体(Toll-like receptors, TLR)是I型跨膜蛋白质,识别侵入体内的微生物进而激活免疫细胞的应答。
被认为在先天性免疫系统中起关键作用。
类Toll受体是模式识别受体(pattern recognition receptors,PRR)的一类,识别与宿主不同的病原体分子。
这些分子被统称为病原相关分子模式(pathogen-associated molecular patterns,PAMP)。
但是,也有一些例外情况。
在脊椎动物(包括鱼类、两栖类、哺乳类、鸟类、爬虫类)以及无脊椎动物(如昆虫果蝇已被广泛研究)发现有类Toll受体。
在细菌和植物以及更高的生物界中也发现有类Toll 受体。
所以,类Toll受体是最古老最保守的免疫系统的组成部分。
TLR 家族成员(TLR3 除外)诱导的炎症反应都经过一条经典的信号通路(图1),该通路起始于TLRs 的一段胞内保守序列—Toll/IL-1 受体同源区(Toll/IL-1receptor homologousregion,TIR).TIR可激活胞内的信号介质—白介素1受体相关蛋白激酶(IL-1R associated kinase,IRAK) IRAK-1 和IRAK-4、肿瘤坏死因子受体相关因子6(TNFR-associated factor 6, TRAF-6)、促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和IκB激酶(IκB kinase,IκK),进而激活核因子κB(nuclear factor κB,NF-κB),诱导炎症因子的表达。
本信号转导涉及的信号分子主要包括:CD14,MD-2,TRAM,TRIF,TIRAP,MyD88,TLR1,TLR2,TLR3,TLR4,TLR5,TLR6,TLR7,TLR8,TLR9,IRAK-1,IRAK-2,IRAK-4,IRAK-M,TRAF6,TRIAD3A,ST2L,SOCS1,RIG-I,FADD,TOLLIP,RIP1,A20,UEV1A,Ubc13,ECSIT,MEKK-1,TAK1,TBK1,MKK3/6,p38,TAB1/2,MKK4/7,JNK,IKK α,IKKβ,IKKγ,IKKε,NEMO,IκBα,NF-κB,p65/RelA,Casp-8,IRF-3,IRF-7,MAVS等Toll-like Receptors (TLRs) Pathway。
toll样受体及其研究进展

Toll样受体、信号通路及其免疫的研究Toll样受体最早是在研究果蝇胚胎发育过程中发现的,它不仅是果蝇胚胎发育过程中的必需蛋白,而且在免疫应答过程中具有重要作用[1]。
Toll 样受体(TLRs)是一个模式识别受体家族,它们在进化上高度保守,从线虫到哺乳动物都存在TLRs,它能识别病原微生物进化中保守分子,如脂多糖(LPs)、肽聚糖、酵母多糖以及病原微生物的核酸等等.脂多糖受体TLR4是发现的第一个TLRs,至今在动物中已经发现15种TLRs(在人体已经发现11个成员,即TLRl~TLRl0和TLRl4,小鼠不表达TLR10,但发现了TLR11—13[2],在鸡中发现了TLR15[3]。
哺乳动物的TLRs同果蝇的TLRs 一样,同属于I型跨膜蛋白,主要由3个功能区构成:胞外区、跨膜区和胞内区。
胞外区具有富含亮氨酸的重复序列,能够特异识别病原微生物进化中保守的抗原分子——病原相关分子模式(pathogen-associated molecular patterns,PAMPs)[4]。
为了有效地抵抗入侵的病原体,机体需要对多种PAMPs产生适当的免疫应答, TLRs可以通过识别PAMPs诱发抵抗病原体的免疫反应。
而且TLRs也参与识别有害的内源性物质.1. Toll样受体1.1 Toll样受体的发现Toll是在昆虫中发现的一个受体蛋白,参与昆虫胚胎发育时背腹肌极性的建立。
进一步研究发现,Toll胞内区与哺乳动物中自介素-1受体(IL-1R)的胞内区具有很高的同源性,下游的信号转导通路通过NF—kB样因子发挥作用。
IL-1R是免疫相关分子,而且昆虫中抗微生物的多肽基因上游大多有NF—kB样因子结合位点,是否Toll蛋白也参与昆虫的天然免疫反应调控?研究证实Toll 参与昆虫的抗真菌免疫.真菌感染时果蝇Toll 通路被激活,诱导大量的抗真菌肽Drosomycin,Toll的突变导致果蝇极易受到真菌的感染[1]。
Toll样受体介导的细胞内信号通路及其免疫调节功能

Toll样受体介导的细胞内信号通路及其免疫调节功能Toil样受体(TLR)通过富亮氨酸重复序列识别不同病原体表面共有且进化高度保守的特定分子结构,引发细胞内信号传导及炎症递质释放,启动宿主的免疫反应,而TLR介导的牙髓细胞内信号通路对机体的免疫反应具有重要的调控作用。
本文就TLR在牙髓组织中的表达,TLR信号通路,TLR在牙髓炎症治疗中的应用前景等研究进展作一综述,以期丰富牙髓炎的发生机制,为牙髓炎的临床药物研发提供新的思路。
标签:Toll样受体;免疫调节;牙髓炎【文献标志码】AToll样受体(Toll-likereceptor,TLR)是一类重要的天然免疫识别受体,属于I型跨膜糖蛋白,由富含亮氨酸重复片段的细胞外区(leucine-richrepeat,LRR)、跨膜区和细胞内区(Toll/inter-leukin-1receptor domain,TIR)三部分组成。
TLR通过LRR识别不同病原体表面共有且进化高度保守的病原相关分子模式,如细菌胞壁成分脂磷壁酸(lipoteichoic acid,LTA)和脂多糖(lipopolysac-charide,LPS)等,引发细胞内信号传导及炎症递质释放,启动宿主的免疫反应。
TLR一旦与特异的病原相关分子模式结合后,将会改变自身的异构形态,以利于TIR 结合衔接分子。
TLR通过磷酸化和遍在蛋白化或蛋白质与蛋白质间的交互作用激活下游信号通路,最大程度地激活炎性转录因子,调节炎性基因表达,参与介导宿主炎症或免疫防御反应。
迄今为止,已发现10个TLR家族成员。
1TLR在牙髓组织中的表达人体各器官包括口腔组织均存在着TLR,且TLR与牙髓炎密切相关。
Staquet 等通过反转录聚合酶链反应和基因测序证实,TLR-2、3和4均表达于牙髓组织内的成牙本质样细胞和成纤维细胞,其表达水平与LTA、双链RNA和LPS等特异性细菌产物相关。
牙髓细胞受革兰阳性细菌感染后,细胞内TLR-2mRNA 表达上调,在9h达最高水平,至72h表达水平持续降低,故TLR-2在牙髓炎症早期发挥调控作用。
TOLL样受体的研究进展及其与自身免疫性疾病的关系

如果封 管方法得 当, 不仅可以防止并发
择靠近神经、 韧带、 节部位的血管 , 关 以选上肢头静脉、 贵要 静脉、 肘正中静脉为宜。
32 与季节和时间关 系 夏季天气炎热 , . 皮脂腺分泌 汗液 增多是引发留置针感染的一个重要 因素 , 以在夏 季输液前 所
症发生 , 而且还可 以延 长 留置 时间。如果封 管不当, 可造成 局部血栓形成 导致堵管 , 或渗漏诱 发浅表静脉炎 。因此, 应 在确保病人 安全舒适 的情况下 , 选择合适封 管液及 方法, 同
技术的执行情况也是发生感染的主要因素。所 以洗手、 带无 菌手套和严格的消毒对 减少感染 尤为重要 。另外静脉 留置 针操作过程 中应特别注 意无 菌操作 , 尽量缩短 留置时 间, 以
不 超过 7 为 宜 。 2h
3 1 与 部 位关 系 由 上 表 可 以看 出手 背 、 部 静 脉 炎 发 生 . 踝
针保 留天 数 一般 以不 超过 5d夏 季 不 超 过 3d 宜 。 , 为
3 7 与化学性及机械性刺激关 系 化学性及机械性刺激均 . 可诱发感染和静脉炎症 , 以皮肤消毒时 , 所 消毒剂不宜过多 ,
以免消毒剂通过皮肤 与血管 间的窦道传人血管, 造成 化学性
33 与敷贴更 换关 系 通过上表显示 , . 频繁更换敷贴 也是 引发感染的一个因素 , 留置期 间粘贴 牢 固, 减少粘贴与皮肤 问缝隙, 保证敷贴 清洁、 干燥 , 敷贴视污染 状况随时更换。更 换敷贴消毒时 由内向外 作 圆周 状 消毒 , 保持足 够 的消毒时 间, 勿用手触摸到消毒部位 以防感染 , 消毒液不 宜接触针孔 以免引发静脉炎。拔针前消毒 , 应掀开粘贴 , 7 %酒精消 用 5
冲洗管路。
Toll样受体-是参与非特异性免疫(天然免疫)的一类重要蛋白质分子

Toll样受体-是参与非特异性免疫(天然免疫)的一类重要蛋白质分子Toll样受体-是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。
Toll样受体是单个的跨膜非催化性蛋白质,可以识别来源于微生物的具有保守结构的分子。
当微生物突破机体的物理屏障,如皮肤、黏膜等时,Toll样受体可以识别它们并激活机体产生免疫细胞应答。
学术术语来源---紫癜性肾炎患者外周血单个核细胞Toll样受体3和4的信号转导途径文章亮点:1 文章的特点在于应用荧光定量PCR和流式细胞技术检查了TLR3和TLR4在外周血单个核细胞的表达量及相关性,分析了过敏性紫癜患儿有肾脏损伤和无肾脏损伤的免疫紊乱情况。
2 结果提示Toll样受体4活化可能是导致过敏性紫癜免疫功能紊乱的始动因素之一,Toll 样受体4的过度活化与过敏性紫癜的肾脏损伤有关。
关键词:器官移植|器官移植基础实验|过敏性紫癜|紫癜性肾炎|单个核细胞|Toll样受体3|Toll样受体4|髓样细胞分化因子88|髓样分化蛋白2|白细胞介素类|省级基金主题词:紫癜,过敏性;Toll样受体3;Toll样受体4;白细胞介素类摘要背景:目前关于Toll样受体3和Toll样受体4介导的信号转导通路在紫癜性肾炎的发病机制中的作用尚不清楚。
目的:分析Toll样受体3和Toll样受体4在过敏性紫癜和紫癜性肾炎发病机制中的作用。
方法:选取过敏性紫癜患儿64例,分为过敏性紫癜无肾损害组36例及过敏性紫癜性肾炎组28例,另选健康儿童30例作为正常对照组。
实时荧光定量PCR检测外周血单核细胞Toll样受体3、Toll样受体4、髓样分化蛋白2、髓样细胞分化因子88、白细胞介素1β、白细胞介素6、白细胞介素12 mRNA的基因相对表达量;应用流式细胞术检测外周血单核细胞Toll样受体3、Toll样受体4蛋白表达率。
结果与结论:①过敏性紫癜患儿Toll样受体4 mRNA及蛋白表达显著高于正常对照组(P <0.05)。
Toll样受体

概述
• Toll样受体(Toll-like receptors, TLR)是参与非特异性免 疫(天然免疫)的一类重要蛋白质分子,也是连接非特异 性免疫和特异性免疫的桥梁。 • TLR是单个的跨膜非催化性蛋白质,可以识别来源于微生 物的具有保守结构的分子。当微生物突破机体的物理屏障, 如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免 疫细胞应答。 • 新近研究发现,TLR能结合机体自身产生的一些内源性分 子(即内源性配体)。免疫佐剂可增强抗肿瘤免疫,其分子 和细胞机制得到进一步阐明TLR也在其中扮演重要角色。 由于肿瘤在发生发展过程中可以产生一些能被TLR识别的 内源性配体,所以TLR在肿瘤免疫监视中可能发挥了一定 作用。
Toll样受体 Toll-like receptor;TLR
Tolቤተ መጻሕፍቲ ባይዱ样受体
• 定义1:果蝇Toll受体同源物,属固有免疫 中的模式识别受体(PRR)。胞外结构域由多 个亮氨酸重复序列组成,识别病原体相关 分子模式;胞内段为TIR结构域,参与启动 信号转导。 • 定义2:果蝇Toll受体同源物。是一类细胞 表面和细胞内受体。可识别各种微生物产 物,与配体结合后可起始信号传递途径, 因不同细胞而引起不同反应。
• 1996年,Jules A. Hoffmann和他的同事们发现 Toll在果蝇对真菌感染的免疫中起着重要作用,从 而确立了Toll的免疫学意义。 • 翌年,Charles Janeway和Ruslan Medzhitov阐明 了一种Toll样受体(后来被命名为TLR4)能够激 活与适应性免疫有关的基因。Bruce A. Beutle随 后发现TLR4能够探测LPS的存在。后来他们又发 现,如果使小鼠中的TLR4突变而丧失功能,小鼠 不会对LPS起反应。 • 后来,科学家们用基因打靶的方式使其他各种 TLR丧失功能进行了研究。结果人们认为,每种 TLR可识别不同的一类分子。
toll样受体作为模式识别受体在先天免疫中的作用

模式识别受体在先天免疫中的作用:Toll样受体最新研究进展Toll样受体作为识别病原保守结构的成分,其发现大大促进了我们对机体是如何感知病原入侵、引起先天免疫反应并启始针对特定病原的适应性免疫反应的认识。
尽管TLRs对宿主防御是很关键的,但已经越来越明确,TLR信号传递负性调节的缺失,以及TLRs对宿主自身分子的识别,都与炎症反应和自身免疫疾病的发病机理有密切的关系。
而且,现在已经清楚的知道,TLRs和最近证实的胞浆先天免疫感受器的相互作用,对发动有效的免疫反应是至关重要的。
本文将阐述TLR在宿主防御和疾病中的生物学作用的最新研究进展。
在过去的十年中,人们对先天性免疫识别细菌成分以及它在宿主抵抗感染中的关键作用的认识,已经取得了极大的进步。
早期的观点认为先天性免疫反应非特异性识别细菌;然而,在19世纪90年代中期,TLRs的发现表明:先天性免疫对病原的识别实际上是特异的,它依赖由生殖细胞编码的PRRs,PRRs已经进化为识别涉及病原相关分子模式(PRRs)的外源病原成分。
TLRs是I型跨膜蛋白,包括富含亮氨酸重复区的胞外区、跨膜区和胞内区。
胞外区介导PAMPs的识别;胞内区的TIR结构域是信号向下游转导所必需的。
截至目前,已经分别在人和小鼠身上发现了10种和12种可以发挥功能的TLRs,其中的TLR1-TLR9是二者共有的。
由于一种逆转录病毒的插入,小鼠的TLR10并不发挥作用,而TLR11、TLR12和TLR13已经在人的基因组中丢失。
对每一种TLR缺陷型小鼠的研究表明,它们各自在PAMPs识别和免疫反应中发挥不同的作用。
几种TLR胞外区晶体结构的说明为证实一些PAMPs可以充当TLRs的配体提供了结构上的认识。
TLRs可以识别来自于细菌、病毒、真菌和寄生虫等微生物的包括脂质、脂蛋白、蛋白和核酸等成分。
PAMPs可在细胞的不同部位被TLRs识别,这些部位包括胞浆膜、内噬体、溶酶体和内噬溶酶体。
toll样受体

Toll样受体Toll样受体(也称作TLR,即Toll-like receptor)是一类重要的受体蛋白,它可以识别和结合一些特定的分子,从而激活免疫系统的应答。
这些分子通常是一种称为模式识别受体(PRRs)的受体所能识别的,它们在宿主防御机制中起着至关重要的作用。
概述Toll样受体是一类跨膜蛋白,属于PRRs家族的一种。
它们通过其外在结构上的高度保守的Leucine-rich repeat(LRR)结构域来识别和结合特定的分子,例如细菌的毒素、细菌的表面成分以及病毒的核酸。
目前已经发现了多种TLR,它们在不同的细胞类型和组织中表达,并参与多种的生理和病理过程。
TLR的结构每个TLR蛋白含有多个LRR结构域,这些结构域通过丰富的β折叠片层连接在一起,形成蛋白的外在结构。
这种结构不仅赋予了TLR以警戒细菌入侵的能力,还可以通过结合配体从而触发下游信号通路的激活。
此外,TLR还包含一个胞浆端的富含精氨酸的TIR(Toll/interleukin-1 receptor)结构域,这个结构域在TLR的信号转导中起着重要的作用。
当TLR与其配体结合后,TIR 结构域会与下游信号分子结合,从而激活信号转导通路。
TLR的功能TLR的主要功能是发挥免疫系统的免疫应答。
当TLR识别到特定的分子(也称为TLR配体)时,它可以通过激活下游信号通路来启动免疫应答。
这种应答包括产生和释放一系列的细胞因子、促发炎因子和抗病毒因子,进一步引发炎症反应和免疫细胞的活化。
此外,TLR还可以调节免疫系统的平衡,以对抗侵袭性病原体的攻击。
通过TLR的激活,免疫系统可以更加快速和有效地识别和清除病原体,从而维护机体的健康。
TLR与疾病由于TLR在免疫应答中的重要作用,TLR功能的异常调节可能会导致多种疾病的发生和发展。
例如,TLR的过度激活可能导致慢性炎症的产生,进而导致一些自身免疫性疾病的发生,如类风湿关节炎和系统性红斑狼疮。
此外,一些病原体也可以通过干扰TLR的功能来逃避宿主的免疫应答。
Toll样受体的信号转导与免疫调节

Toll样受体的信号转导与免疫调节一、本文概述Toll样受体(Toll-like receptors,TLRs)是一类在免疫系统中起着至关重要作用的蛋白质受体。
自发现以来,TLRs已成为生物学和医学研究领域的一个热点。
它们能够识别多种病原体相关的分子模式(Pathogen-Associated Molecular Patterns,PAMPs),从而启动先天免疫反应,并在适应性免疫应答中发挥关键作用。
本文旨在深入探讨TLRs的信号转导机制以及它们在免疫调节中的重要作用,从而为理解人体免疫防御体系提供新的视角和思路。
我们将概述TLRs的基本结构和特性,包括它们的分布、配体识别能力以及信号转导通路。
随后,我们将重点讨论TLRs信号转导的具体过程,包括配体与受体结合后的信号传递、关键信号分子的激活以及下游基因的表达调控。
在此基础上,我们将进一步探讨TLRs在免疫调节中的功能,包括它们在炎症反应、免疫细胞活化和分化以及适应性免疫应答中的作用。
我们将总结TLRs在免疫系统中的重要性,以及它们在疾病发生和发展过程中的潜在作用。
通过深入研究TLRs的信号转导与免疫调节机制,我们有望为开发新型免疫疗法和药物提供理论依据和实践指导,为改善人类健康水平做出贡献。
二、Toll样受体的结构与分类Toll样受体(Toll-like receptors,TLRs)是一类在进化上高度保守的模式识别受体,它们在免疫系统中起着至关重要的作用。
TLRs通过识别微生物特有的病原体相关分子模式(Pathogen-Associated Molecular Patterns,PAMPs)来启动和调节先天免疫反应。
它们还能识别损伤相关分子模式(Damage-Associated Molecular Patterns,DAMPs),从而在组织损伤和炎症反应中发挥作用。
结构上,TLRs是一类跨膜蛋白,由胞外区、跨膜区和胞内区三部分组成。
胞外区富含亮氨酸重复序列(Leucine-Rich Repeats,LRRs),这些重复序列使得TLRs能够识别多种不同类型的PAMPs和DAMPs。
Toll样受体结构和分布特点

Toll样受体结构和分布特点
Toll样受体结构和分布特点
TLR为I型跨膜糖蛋白,胞外结构域由19—25个前后相连的片段所组成,各片段包括24~29个氨基酸残基,带有x-L-x-x-L-x-L-x-x 基序(L为亮氨酸,x为任意氨基酸),称为富含亮氨酸的重复体(1eucine-richrepeat,LRR),简称亮氨酸重复序列(图7-5A)。
整个胞外结构域弯曲成马鞍状,其中的LRR部分构成配体结合区。
TLR跨膜分子胞内段为TlR结构域(TIR:T oll/IL-1 receptor),为所有TLR及IL-1R分子胞内段所特有,此为IL-IR和TLR共属一个家族的原因。
但IL-1R胞外区不带有LRR,而是由三个Ig样结构域所组成。
TIR结构域有三个保守的氨基酸序列,称为1、2、3框(box)。
借此,该结构域可以与胞内其他带有相同TlR结构域的分子发生相互作用,由后者启动信号传递。
TLR表达于各种免疫细胞,如Mv、DC、B细胞和某些T细胞,也见于非免疫细胞如成纤维细胞和表皮细胞。
其表达可受病原体、细胞因子及应激因素的调变。
人类中已发现了11种TLR,各自识别PAMP中的不同成分和分子。
TLR及其与PAMP结合特点的研究揭示两点:一是所有TLR因表达部位不同而分成两类:表达于胞膜的TLR 和表达于胞质内体和吞噬溶酶体膜的TLR。
这方面,表7-2中已一一指明。
其中出现于胞内区室中的一类TLR,往往识别第二类PAMP分子即病毒和细菌胞核成分,如CpC~DNA、单链和双链RNA。
第二,胞膜TLR通常以二聚体形式发挥作用,相组合的TLR往往识别同类配体分子。
胞内区室中的TLR为单体还是二聚体尚待确定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Toll样受体的结构及免疫功能探究发表时间:2011-09-06T11:23:55.560Z 来源:《中国健康月刊(学术版)》2011年第7期供稿作者:何玉林刘小双叶狄[导读] TLR是一类从线虫到哺乳动物序列高度保守的模式识别受体。
何玉林刘小双叶狄基金项目:贵州省遵义医学院博士启动基金 (F-332号)作者简介:何玉林(1969-),男,甘肃天水人,副教授,博士【摘要】Toll样受体(Toll-like receptors,TLRs)是天然免疫系统中特异的Ⅰ型跨膜受体及病原体模式识别受体,它通过识别病原体,能立即启动先天性免疫,并能通过信号传导启动获得性免疫,在急性炎症反应、细胞信号转导和细胞凋亡中起重要作用。
目前已发现TLR家族共有13个受体,分布于各个器官脏器,针对不同的病原体发挥其识别作用。
该文对TLRs的结构和分布、相应配体及免疫功能等方面作简要综述。
【关键词】Toll样受体(TLRs);配体;天然免疫应答;免疫功能【中图分类号】R441【文献标识码】A【文章编号】1005-0515(2011)07-0002-02TLR是一类从线虫到哺乳动物序列高度保守的模式识别受体。
最早的Toll基因是在研究果蝇背腹极性时发现的,因与果蝇的Toll分子高度同源而得名。
后来的研究发现Toll在果蝇的天然免疫应答中扮演了重要角色。
TLR通过识别外源性微生物,启动先天性免疫反应,清除侵入的病原微生物。
同时活化的TLR也能激活T细胞,启动获得性免疫反应。
TLR在天然免疫方面的特殊意义及在沟通天然免疫和获得性免疫方面的桥梁作用,使生物学界和医学界对其投入了极大的热情。
随后,人类和小鼠中先后克隆出多个Toll的同源蛋白,共同构成Toll受体家族。
目前为止,已经鉴定了至少13种TLRs,其中TLR1TLR9是人类与老鼠共有,TLR似乎只在人类中有功能,而TLR11TLR13为小鼠所特有。
1TLRs的生物特点1.1TLR的结构:TLRs属于Ⅰ型跨膜糖蛋白,是具有类似结构的跨膜型式识别受体(pattern recongnition receptors,PRR),由胞外区、跨膜区和胞质区组成。
胞外区是由1831个串联的富含亮氨酸的重复基序(leucine-rich repeat,LRR)形成的亮氨酸结构域,空间结构如马蹄形且高度保守,其中亮氨酸在三维空间的一侧排列形成疏水界面,该区为序列多变的Ig样结构域,与宿主对感染反应的特异性有关,其空间结构的细微变化就会影响TLR对病原相关分子模式(pathogen associated molecular pattern,PAMP)的识别;跨膜区是富含半胱氨酸结构域,一般认为跨膜结构域决定了TLRs分子的亚细胞定位;胞质区和白介素受体-1受体(interleukin-1 receptor,IL-1R)家族的胞质区有高度的同源性,称为TIR(Toll/IL-1R)结构域,约200个氨基酸组成。
TLRs识别存在于各种病原体细胞表面分子,如酵母细胞壁的甘露糖以及细菌细胞壁的脂多糖、多肽糖及胞壁酸等各种成分,统称病原体相关的分子模式(PAMP).1.2TLR的分布:1.2.1细胞分布和亚细胞定位:TLRs是固有免疫细胞膜上的识别系统中重要组成部分,他们分布于各种组织的细胞膜上,分布十分广泛。
如TLR1广泛表达于单核细胞、T和B淋巴细胞、树突状细胞(dendritic cell,DC)、多形核白细胞、NK细胞;TLR2/4/5主要分布于除T、B、NK细胞以外的免疫细胞;TLR3主要表达于未成熟的DC等。
但TLR因其识别的PAMP性质不同人在细胞中有不同的分布区。
TLR1/2/4/6分布于细胞表面,并能聚集到接触微生物的吞噬体上;TLR3/7/8/9则定位在细胞内,尤其是内质网上,并用于识别核酸。
1.2.2组织分布:不同的TLR在各种组织中有不同程度的表达,其中在淋巴组织尤其是脾和外周血的白细胞中表达最强。
TLR1广泛分布且表达明显,如卵巢、脾脏;TLR2在肺、心脏、脑和肌肉组织可测到TLR2mRNA的表达;TLR3主要表达于胎盘和胰腺;TLR4表达于胎盘组织等;TLR5表达与前列腺和外周血单核细胞;TLR6、TLR9广泛表达于多种细胞;TLR10主要表达于淋巴样组织和脾脏细胞。
2TLR的配体虽然TLR家族具有相似的结构,但TLR通过识别相应的配体来激活免疫反应。
不仅外来病原体的产物,而且宿主自身的某些物质也可以是不同的TLR的配体。
配体包括脂多糖(LPS)、病毒蛋白F、透明质酸酶、硫酸肝素、纤维蛋白原、酵母多糖、白色念珠菌以及宿主来源的热休克蛋白60(HSP-60)、纤维连接蛋白等。
TLR1能识别细菌的三酰脂肽;TLR2识别的配体包括G+细菌、分支杆菌、疏密螺旋体、酵母菌和支原体的某些成分,如脂蛋白、脂肽、脂磷壁酸、肽聚糖和酵母多糖等;TLR3构成同源二聚体或与TLR4形成异源二聚体,识别鞭毛蛋白,还可识别多聚肌苷胞苷(poly riboinosinic polyribocytidylic acid, poly I:C);TLR4形成同源二聚体,识别LPS及牛型结核杆菌胞壁的骨架、链球菌来源的脂质酸;TLR5特异识别细菌的鞭毛蛋白,有选择的识别渗透过肠上皮的细菌,并引起反应;TLR6主要识别细菌的肽聚糖和脂肽;TLR7、TLR8均能识别单链RNA病毒;TLR9主要识别细菌中非甲基化的胞嘧啶鸟嘌呤二核苷酸(CpG DNA);TLR11能识别来源于尿路细菌的配体。
除了同型二聚体表现出来的功能外,TLR的一些功能也来自于异型二聚体。
3TLR的免疫功能美国免疫学家Janeway(2000年)首次提出固有免疫细胞识别模式理论,被科学家观察杂志列为2001年十大生物科学重要进展之一。
固有免疫细胞膜上不表达特异性抗原受体,但他们具有模式识别受体(PRR),能直接识别并结合各种病原微生物表达的固有保守基序的分子,即PAMPS,其中TLRs是固有免疫细胞膜上最重要的模式识别受体。
天然免疫细胞借助PRR中TLR,识别各种病原微生物的相关分子模式(PAMPs)。
因此,天然免疫细胞可以区分自身和非自身成分,识别PAMPs后的天然免疫细胞,迅速被活化,无需这些细胞再克隆分化增殖,此时巨噬细胞通过胞内氧依赖性杀菌系统和氧非依赖行杀菌系统,杀伤病原体。
同时把一些具有免疫原性的小分子抗原肽,借助主要组织相容性复合体(major histocompatibility complex,MHC)提供各相应T细胞,启动获得性免疫应答,分泌多种细胞因子,参与免疫调节或杀伤肿瘤细胞等生物学功能。
因此,把天然免疫和获得性免疫紧密联系起来。
尽管目前所发现的TLR家族成员种类有限,但同一细胞或不同细胞间TLRs各成员间的相互组合及不同协助蛋白共同作用,组织有效的天然免疫应答,对相对广泛的病原微生物进行特异性识别,引起一系列特异的天然免疫和获得性免疫反应,以对抗微生物感染乃至慢性炎症(如哮喘)及自身免疫性疾病(如类风湿性关节炎等)。
4展望近年来随着对TLR研究的展开和深入,人们对TLR在免疫中的作用有了更多的认识和了解。
TLR在识别侵入的病原、早期启动机体的先天性免疫反应、诱导多种炎症介质和细胞因子的产生有着重要的作用;同时通过抗原呈递和对T细胞的致敏,接到获得性免疫反应的发生。
因此,TLR可为人类的抗感染免疫、免疫耐受、自身免疫、超敏反应及疫苗佐剂提供新的切入点和生长点并通过对TLR多态性的研究,对于TLT与感染性疾病、败血症性休克、病毒性感染和自身免疫性疾病等多种疾病的发生有了进一步的认识,并为疾病的治疗提供了新的思路。
目前TLR热方兴未艾,今后的研究内容主要可能有以下几个方面:模式生物和经济生物TLR家族成员的探明;新的TLR配基的不断挖掘;TLR与各种疾病的关系及相关药物与疫苗的研制与开发;新TLR信号通道的发现;TLR的起源与进化及在物种起源和进化研究中的价值等。
参考文献[1]Jun Zhou,Huazhang An,Hongmei Xu,Heat shock up-regulates expression ofToll-like receptor-2 andToll-like receptor-4 in human monocytes via p38 kinase ignal pathway. Immunology,2004.114,522-530[2]王建华.Domestic Animal Medicine 中国农业出版社.第三版,266-270[3]蔡基忠.福建畜牧兽医.2000年第5期. 龙海市畜牧兽医站[4]任美玉,吴欣怡.Toll样受体的研究进展.现代免疫学,2006,26(4):340-342[5]陈慰峰.医学免疫学.第4版.北京:人民卫生出版社,2004:89-92[6]何维,高晓明,曹雪涛,等.医学免疫学.北京:人民卫生出版社,2005:143-149[7]林怡,熊思东.Toll样受体在亚单位疫苗分子设计中研究进展.现代免疫学,2006,26(5)2:427-430[8]王海坤;韩代书 Toll样受体(TLRs)的信号转导与免疫调节生物化学与生物物理进展 2006年第09期[9]王平忠;黄长形;王九平 Toll样受体介导的抗病毒天然免疫细胞与分子免疫学杂志 2008年第05期[10]任卫聪;李传友 Toll样受体及其在抗结核感染免疫中的作用国际呼吸杂志 2009年第17期[11]吕烽,宋勇;Toll样受体在脂多糖耐受性机制作用中的研究进展[J];中国危重病急救医学;2005年04期[12]俞秀丽,李兰娟. Toll样受体家族信号转导的研究进展. 国际流行病学传染病学杂志,2006年第02期作者单位:519041遵义医学院珠海校区免疫学与病原生物学教研室。
