2014醇和醚(1)全解
醇和醚
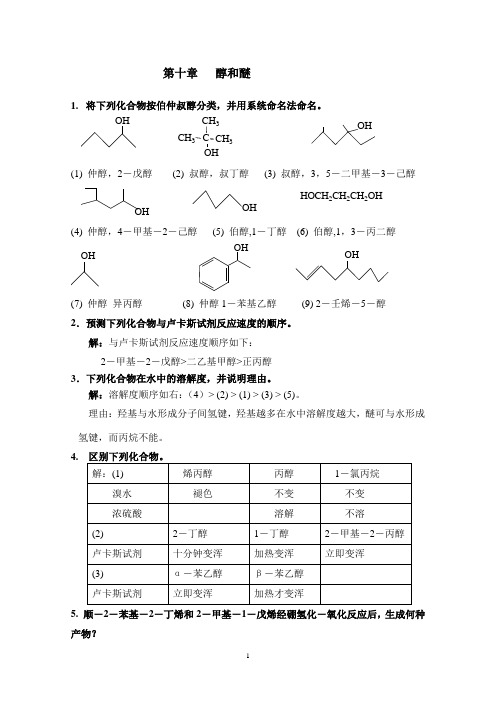
第十章醇和醚1. 将下列化合物按伯仲叔醇分类,并用系统命名法命名。
CH3CH3C CH3OHOHOH(1) 仲醇,2-戊醇(2) 叔醇,叔丁醇(3) 叔醇,3,5-二甲基-3-己醇OH OHHOCH2CH2CH2OH(4) 仲醇,4-甲基-2-己醇(5) 伯醇,1-丁醇(6) 伯醇,1,3-丙二醇OH OHOH(7) 仲醇异丙醇(8) 仲醇1-苯基乙醇(9) 2-壬烯-5-醇2.预测下列化合物与卢卡斯试剂反应速度的顺序。
解:与卢卡斯试剂反应速度顺序如下:2-甲基-2-戊醇>二乙基甲醇>正丙醇3.下列化合物在水中的溶解度,并说明理由。
解:溶解度顺序如右:(4)> (2) > (1) > (3) > (5)。
理由:羟基与水形成分子间氢键,羟基越多在水中溶解度越大,醚可与水形成氢键,而丙烷不能。
4.5. 顺-2-苯基-2-丁烯和2-甲基-1-戊烯经硼氢化-氧化反应后,生成何种产物?解:CH3C=C CH3 HC6H52622C6H5CHCHOH3CH3CH3HOCH2CHCH2CH2CH3CH3CH2CH2CH2CH2622 6. 写出下列化合物的脱水产物。
7.比较下列各组醇和溴化氢反应的相对速度。
解:(1) 反应速度顺序:对甲基苄醇> 苄醇> 对硝基苄醇。
(2) 苄醇> β-苯基乙醇> a-苯基乙醇。
8.(1)3-丁烯-2-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:CH2=CH CHCHOHHBrCH2=CH CHCHOH+2=CH CHCHOH2+2CH2=CH CHCH3+CH2CH=CHCH3+Br--BrCH2CH=CHCH3+BrCH2=CH CHCH3BrCH2=CH CHCH3BrCH2CH=CHCH3(2)2-丁烯-1-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:HOCH2CH=CHCH HBr BrCH2CH=CHCH3+CH2=CHCHCH3OHHOCH 2CH=CHCH 3+H 2O +CH 2CH=CHCH 3H 2O2CH=CHCH 3+CH 2=CHCHCH 3+--BrCH 2CH=CHCH 3CH 2=CHCHCH 3OH9. 应历程解释下列反应事实。
有机化学-醇和醚

* 脱水反应 ● 分子内脱水 ● 分子间脱水:
上述反应,低温有利于取代反应而生成醚, 高温有利于消除反应生成烯。醇脱水的消除反应 取向也符合查依采夫规则。
* 与无机酸的反应 醇可与硫酸、硝酸、磷酸等无机酸作用得
到无机酸酯。
得到的两种无机酸酯都是常用的烷基化试 剂,因有剧毒,使用时要注意安全。
甘油三硝酸酯是一种炸药;磷酸三丁酯用 作萃取剂和增塑剂。
* 性质 ● 弱酸性(酸性比醇大)
后两个反应不仅可用来鉴定硫醇,而且 可用作重金属Pb、Hg、Sb等中毒的解毒剂。
● 氧化反应 氧化剂:H2O2、 NaIO、I2或O2
这个反应可以定量进行,因此可用来测定巯基 化合物的含量。
● 酯化反应: ● 分解反应 :
此反应工业上可用来脱硫。
第二节 醚
一、 醚的分类,命名和同分异构 * 分类
醇分子中coh键角为1089氧原子最外层有6个电子在成键时发生不等性杂化它以一个sp杂化轨道和碳原子的sp化轨道形成co键另一个sp杂化轨道和氢原子的is轨道形成0h键剩下两个sp杂化轨道被两对未共用电子对占据由于两对未共用电子对的相互排斥和挤压使醇分子中coh键角小于1095
第九章 醇 和 醚
第一节 醇 第二节 醚
a. 选择含有羟基的最长碳链为主链,支链看作 取代基,编号从靠近羟基的一端开始。
b. 不饱和醇的系统命名: 选择同时含有羟基和不饱和键的最长链为主
链,编号时尽可能使羟基位次最小。
c. 芳醇命名时可把芳基作为取代基。
d. 多元醇命名尽可能选包括多个羟基在内的最长 链为主链,称“二醇”,“三醇"等
命名举例:
● 过氧化物的生成 醚长期与空气接触,可被空气氧化生成
过氧化物。如:
有机化学醇和醚详解演示文稿

(CH3)3CCOOH ② H+,H2O
(CH3)3CCH2OH
H5C2OOC(CH2)8COOC2H5 Na,C2H5OH HOCCH2(CH2)8CH2OH
73-75%
第十页,共55页。
四、醇的物理性质: 沸点较高,低级醇易溶于水;
Hydrogen bond
第十一页,共55页。
五、醇的化学性质:
立即浑浊
CH3
CH3
H
H
H5C2
C
OH
ZnCl2/HCl room temperature
H5C2 C Cl
CH3
CH3
几分钟变浑浊
CH3CH2CH2CH2OH ZnCl2/HCl
CH3CH2CH2CH2Cl
几乎无现象
第十六页,共55页。
醇与HX作用机理的SN1 反应机理:
CH3
快
CH3H
Step 1 H3C C O H + H
RCH2 OH + Br P Br
( 1 or 2 )
Br
RCH2
O
PBr2
BrSN2
H
RCH2
Br + HOPBr2
HCl
O
RCH2 OH +Cl S Cl
RCH2 S O
O ( 1 or 2 )
Cl
R Cl + SO2
第十九页,共55页。
3、 醇与无机含氧酸反应
CH2OH CHOH 3HNO3 CH2OH
CH3CH2CH2OH CH2=CHCH2OH
OH
Propanol
2-propenol cyclohexanol
CH3CH2CH2OH
第十章_醇和醚

RCH2
Br + HOPBr2
H
HCl
O
RCH2 OH +Cl S Cl
RCH2 S O
O ( 1 or 2 )
Cl
R Cl + SO2
3、 醇与无机含氧酸反应
CH2OH CHOH CH2OH
3HNO3 H2SO4 100℃
CH2ONO2 CHONO2 CH2ONO2
CH3CH2CH2CH2OH POCl3/pyridine (CH3CH2CH2CH2O)3PO
饱和醇:CH3CH2CH2OH 不饱和醇:CH2 CHCH2OH
芳香醇:
CH2OH
根据羟基数目
一元醇:CH3CH2OH
二元醇:CH2 OH
CH2 OH
(乙二醇)
多元醇:CH2 CH CH OH OH OH
(丙三醇)
1.4 命名
1)普通命名法 将相应烷烃名称前的“烷”改为“醇”
CH3 CH3 CH CH2OH
1 C2H5ONa + 2 H2
(CH3)2CHO 3Al
+
1
1 2
H2
ROH的反应活性1°>2°>3°
相对酸性
H2O > ROH.>RC CH > H2 > NH3 > RH
相对碱性
R- > NH2- > H- > RC C- > RO- > OH-
2 ROH 2Na RONa H2O
2 RONa H2 ROH NaOH
H5C2 C Cl
CH3
几分钟变C浑H3浊
CH3CH2CH2CH2OH ZnCl2/HCl
CH3CH2CH2CH2Cl
第八章 醇和醚

10
CO2 ONa
15.7 16~19
OH +NaHCO3
44
本次您浏览到是第四十四页,共八十二页。
Table 10.1 pKa value of Substituent
Sub.-G. op-henolsm-
p-
NO2
7.22 8.39
7.15
Cl8.48 ຫໍສະໝຸດ .029.38H10.0 10.0 10.0
OH OH
29
本次您浏览到是第二十九页,共八十二页。
2 、 邻二醇被四醋酸铅氧化
CH3 CH3 H2SO4
CH3
H3C C
C
CH3 HCl
H3C
C
C
CH3
OH OH
CH3O
OH OH
四醋酸铅 OHOH Pb(OOCCH3)4 O O
Pb(OOCCH3)3 O + O 30
本次您浏览到是第三十页,共八十二页。
16
本次您浏览到是第十六页,共八十二页。
(三)亲核取代反应 Nucleophilic substitution
(1)、醇和氢卤酸的反应
反应式
ROH + HX 醇的活性比较:
RX + H2O
苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH
17
本次您浏览到是第十七页,共八十二页。
6
本次您浏览到是第六页,共八十二页。
不饱和醇,表示重键位置的数字放在烯字或炔字的前面,这 样得到母体的名称,再于母体名称前面加取代基的名称和位 置,称为某烯(炔)醇。
多元醇命名选取含有尽可能多的带羟基的碳链作主链,羟 基的数目写在醇字的前面,用二、三、四等来表示:
醇和醚知识点详解

5.1.1 醇的分类和命名
一、醇的分类
1)根据羟基所连的烃基的结构不同,可分为脂肪醇、脂环醇 和芳香醇,又可分为饱和醇和不饱和醇。
脂肪醇: H3C OH
醇 脂环醇:
OH
甲醇 环己醇
芳香醇:
CH 2 OH
苯甲醇
2)按羟基所连碳原子的类型分:
O
3.用途
a. 选择性络合金属离子 分离提存贵金属
18-冠-6—K+ 12-冠-4—Li+
像西方的皇冠
b 作为相转移催化剂
冠醚 R Br + KCN
KCN和冠醚一起进入有机相 K+被固定,CN-亲核性大增。
5.2.6 环氧化合物 (Epoxides)
1、结构
C C 环醚 O
2、环氧化物的反应
张力 (Strain)
1).由格氏试剂制备 2).由醛酮还原
3).由烯烃加水
4).由RX水解
一、 醚的分类与命名 二、 醚的结构和物理性质 三、 醚的化学反应 四、 醚的制备方法 五、醚的来源和用途 六、冠醚 七、环氧化合物 八、硫醇与硫醚
5.2.1 醚的分类与命名
1、醚的分类
醚键:C-O-C 单醚: Et2O 混醚:CH3-O-C(CH3)3 环醚:
亲核取代反应
Nu: H2O, ROH, NH3及 Grignard试剂 (RMgX)
H2C CH2 + ROH O
RO CH2 CH2 O ROH RO CH2 CH2 OH
碱催化,亲核试剂进攻取代基较少的碳原子
CH3CH2O- + H2C CHCH3 O
CH3CH2OH
第十章醇和醚(一)醇醇是脂肪烃分子中的氢原子被羟基(—OH)

CH3CH2OHOH CH2CH2OH 第十章醇和醚一醇醇是脂肪烃分子中的氢原子被羟基—OH取代的衍生物也可看作是水中的氢原子被脂肪烃基取代的产物。
10.1 醇的分类和命名1醇的分类根据羟基所连烃基的结构可把醇分为脂肪醇、脂环醇、芳香醇羟基连在芳烃侧链上的醇等。
例如脂肪醇脂环醇芳香醇根据羟基所连烃基的饱和程度可把醇分为饱和醇和不饱和醇。
例如CH3CH2CH2OH CH2CH—CH2OH 饱和醇不饱和醇根据分子中羟基的数目可把醇分为一元醇、二元醇和多元醇。
饱和一元醇的通式为CnH2n2O。
在二元醇中两个羟基连在相邻碳原子上的称为邻二醇两个羟基连在同一碳原子上的称为胞二醇不稳定。
例如一元醇二元醇二元醇邻二醇根据羟基所连碳原子的类型可把醇分为伯醇一级醇、仲醇二级醇和叔醇三级醇。
例如伯醇一级醇仲醇二级醇叔醇三级醇2醇的命名结构简单的醇可用普通命名法命名即在“醇”字前加上烃基的名称“基”字一般可以省去。
例如异丁醇仲丁醇烯丙醇苄醇结构复杂的醇则采用系统命名法命名。
首先选择连有羟基的最长碳链为主链从距CH3CHCH3OHCH2CH2OHOHCH2CH2CH2OHOHCH3CHCH2OHCH2CHCH2OHC H3CH3CH2CHCH3OHRCH2OHRCH2CHROHRCROHR123。
CH2OHCH3CH2OHCHCH2CHCH2CHCH2CH2OHOHOHCH3CCH3CH2CCH3CHCH3 OH羟基最近的一端给主链编号按主链所含碳原子的数目称为“某醇”取代基的位次、数目、名称以及羟基的位次分别注于母体名称前。
例如CH3CH3CH3CCH2OHCH3CH3CC2H5OHCH3CHCHCH3 3—甲基—2—戊醇244—三甲基—2—戊醇命名不饱和醇时主链应包含羟基和不饱和键从距羟基最近的一端给主链编号按主链所含碳原子的数目称为“某烯醇”或“某炔醇” 羟基的位次注于“醇”字前。
例如2—甲基—3—丁烯—1—醇Z—34—二甲基—3—己烯—2—醇命名芳香醇时将芳环看作取代基。
有机化学基础知识点整理醇和醚

有机化学基础知识点整理醇和醚有机化学基础知识点整理:醇和醚一、引言有机化学是研究碳和碳氢化合物的科学,广泛应用于医药、农业、材料科学等领域。
本文将重点介绍有机化学中的两个基础知识点:醇和醚。
醇和醚是碳氢氧元素组成的化合物,具有重要的化学性质和应用价值。
我们将对它们的结构、命名方法、制备和反应进行详细介绍。
二、醇的结构和分类醇是由一个或多个羟基(-OH)取代碳链的有机化合物。
根据羟基取代的碳原子数量,醇可以分为一元醇、二元醇、三元醇等。
一元醇中只有一个羟基,如乙醇(CH3CH2OH),二元醇中有两个羟基,如丙二醇(HOCH2CH(OH)CH3),三元醇中有三个羟基,如甘油(HOCH2CH(OH)CH2OH)。
醇的结构可以用分子式表示,也可以用结构式表示。
分子式如CnH2n+1OH,其中n为碳原子数。
结构式则显示出羟基所连接的碳原子和其它原子间的连接方式。
三、醇的命名方法醇的命名方法主要根据主链的碳原子数和羟基的位置确定。
一般情况下,选择主链中最长的一段作为醇的命名依据。
羟基的位置通常用数字表示,同时需要标明其在主链上的位置。
例如,乙醇的主链为两个碳原子,因此它的命名为ethyl alcohol。
而2-丙醇的主链为三个碳原子,羟基连接在第二个碳原子上,因此命名为2-propanol。
在有机化合物命名中还需要注意烷基的前缀和后缀。
烷基是指碳链中的一个或多个碳原子组成的基团。
在醇的命名中,烷基的前缀表示羟基所连接的碳原子数,后缀为-yl。
比如,乙醇中没有烷基,所以是ethyl alcohol;而在2-丙醇中,主链为丙烷,所以命名为2-propanol。
四、醇的制备方法醇的制备方法多种多样,常见的有以下几种:1. 通过醚的水解反应得到醇。
这种方法适用于醚和水反应生成醇的情况,反应条件一般是在酸性或碱性条件下进行。
2. 通过烷基卤化物和金属的反应制得醇。
烷基卤化物和金属反应生成相应的烷基金属化合物,再与水反应生成醇。
醇和醚知识点详解

醇和醚知识点详解醇和醚是有机化合物中常见的两类化合物。
它们在许多领域具有重要的应用,如有机合成、溶剂、药物和香料等。
本文将详细介绍醇和醚的定义、性质、制备方法和应用等知识点。
一、醇的定义和性质醇是一类含有氢氧基(-OH)的有机化合物。
根据氢氧基的位置,醇可以分为一次醇、二次醇和三次醇。
一次醇中,氢氧基连接在碳链上,如甲醇(CH3OH)和乙醇(C2H5OH)。
二次醇中,有两个氢氧基连接在碳原子上,如乙二醇(HOCH2CH2OH)。
三次醇则有三个氢氧基连接在碳原子上。
醇分子中的氢氧基使其具有一些特殊性质,如溶解性和酸碱性。
1. 溶解性:醇一般可溶于水。
较短的醇(一次醇和二次醇)溶解性较高,而较长的醇溶解性较差。
这是因为水分子能与醇分子的氢键形成氢键,使其能够相互溶解。
2. 酸碱性:醇可作为酸或碱。
在适当条件下,醇的氢氧基可以脱去质子成为负离子(醇的碱性),也可以接受质子成为正离子(醇的酸性)。
二、醇的制备方法1. 氢氧化物的还原:将醛或酮用还原剂(如氢气与催化剂)还原即可得到相应的醇。
2. 同分异构体的合成:对一些具有同分异构体的化合物,通过适当的反应条件,可以选择性地将其转化为某一种醇。
3. 环氧化合物的开环:将环氧化合物与酸或碱反应,使其开环而生成相应的醇。
4. 卤代烃的取代反应:醇也可以通过将卤代烃与水反应来获得。
三、醇的应用1. 溶剂:醇在许多化学反应中可以作为溶剂使用,如乙醇常用于制备药物和香料。
2. 酯的制备:醇与酸酐反应,通常可以生成酯。
酯在食品工业、香料工业和制药工业中有广泛的应用。
3. 脱水剂:由于醇分子中含有活泼的氢氧基,因此醇在一些有机合成反应中可以作为脱水剂使用。
四、醚的定义和性质醚是一类含有两个烷基或芳基团的有机化合物,其通式为R-O-R',其中R和R'可以是烷基或芳基团。
根据醚分子中氧原子在碳链上的位置,可以分为对称醚和非对称醚。
1. 对称醚:两个烷基或芳基团相同,例如乙醚(CH3OCH3),是最简单的醚。
有机化学课件-第五章醇和醚

03
醚不溶于水,但可溶于 有机溶剂。
04
醚的稳定性相对较高, 但在强酸或强碱的作用 下可以发生水解反应。
04
醇和醚的反应
醇的反应
氧化反应
醇可以被氧化生成醛、酮、羧酸等化合物, 如用氧化剂如铬酸、硝酸或过氧化氢等处 理醇,可将其转化为相应的醛或酮。
脱水反应
醇在浓硫酸或高温下可发生脱水反应,生 成烯烃。例如,乙醇在170℃下脱水生成
醛和酮是含有羰基的有机化合物,而醌则是一种具有特殊结 构的有机化合物。这些化合物在化学性质和反应方面有着重 要的应用。
第七章 羧酸及其衍生物
羧酸是含有羧基的有机化合物,其衍生物包括酯、酸酐、酰 胺等。这些化合物在化学工业、食品、医药等领域有着广泛 的应用。
THANKS
感谢观看
醇和醚的结构多样,可以根据 连接的碳原子数、取代基的类 型等进行分类。
醚的性质和反应
醚也是一类含有氧的有机化合物 ,其化学性质与醇类似,但也有 其独特之处,如稳定性较高。
醇和醚的应用
醇和醚在日常生活和工业生产中有 着广泛的应用,如乙醇可以用于消 毒、燃料等,而乙醚则常用于麻醉 。
下章预告
第六章 醛、酮和醌
有机化学课件-第五章醇 和醚
• 引言 • 醇的分类和结构 • 醚的分类和结构 • 醇和醚的反应 • 醇和醚的应用 • 结论
01
引言
醇和醚的简介
醇
是含有羟基的有机化合物,其官能团 为$- OH$。根据与羟基所连碳原子的 类型,醇可分为伯醇、仲醇和叔醇。
醚
是含有醚键的化合物,其官能团为 $R-O-R'$。根据醚键所连碳原子的个 数,醚可分为单醚和双醚。
醇和醚的重要性
醇在日常生活和工业生产中具有广泛 的应用,如乙醇可作为消毒剂、燃料 添加剂和溶剂,而某些高级醇可用于 化妆品和润滑剂的制造。
醇和醚

醇的物理性质、 第四节 醇的物理性质、光谱特征 一 物理性质
醇分子之间能形成氢键。 醇分子之间能形成氢键。 固态,缔合较为牢固。液态, 固态,缔合较为牢固。液态,形成氢键和氢键的解离 均存在。气态或在非极性溶剂的稀溶液中,醇分子可以单 均存在。气态或在非极性溶剂的稀溶液中, 独存在。 独存在。 由于醇分子之间能形成氢键, 由于醇分子之间能形成氢键,沸点较相应分子量的烷 烃高。 烃高。 由于醇分子与水分子之间能形成氢键, 由于醇分子与水分子之间能形成氢键,三个碳的醇和 叔丁醇能与水混溶。 叔丁醇能与水混溶。
光谱特征(参见第八章) 二 光谱特征(参见第八章)
醇化物(结晶醇) 三 醇化物(结晶醇)
低级醇与一些无机盐形成的结晶状分子化合物称之为结晶 低级醇与一些无机盐形成的结晶状分子化合物称之为结晶 也称之为醇化物 醇化物。 醇,也称之为醇化物。 MgCl2 6CH3OH 注意 许多无机盐 不能作为醇 的干燥剂。 的干燥剂。 CaCl2 4C2H5OH 工业乙醚常杂有 少量乙醇, 少量乙醇,加入 CaCl2可使醇从 乙醚中沉淀下来。 乙醚中沉淀下来。
HOCH2CHCH2OH OH
HOCH2CH2OH
二
R C R'
OH OH
-H2O
R R'
C O
RCH
OH OH
-H2O
RCHO
OH R C OH OH
-H2O
RCOOH
第二节 醇的命名 衍生物命名法(看作甲醇的衍生物) 一 衍生物命名法(看作甲醇的衍生物)
CH3 (CH3)2CHCHOH
甲基异丙基甲醇 甲基异丙基甲醇
CH3
HBr
H H
Br Br CH3
(dl) ) H+
第6章 醇和醚

C CHCH2CHCH3 CH3 OH
5-苯基 己烯 醇 苯基-4-己烯 苯基 己烯-2-醇 5-phenyl-4-hexen-2-ol
6/33
(三)俗名:根据来源进行命名。 三 俗名 根据来源进行命名。 俗名:
CH3OH
H HOCH2 C OH H C C
木醇 wood alcohol
H C CH2OH 山梨醇
饱和醇 烯醇 炔醇
不饱和醇 根据烃 基不同 脂环醇
芳香醇
•羟基与不饱和键相连的醇大多不稳定, 羟基与不饱和键相连的醇大多不稳定, 羟基与不饱和键相连的醇大多不稳定 分子易异构,转变成相应的醛酮, 分子易异构,转变成相应的醛酮,所以 醇一般限于羟基与饱和碳相连的化合物。 醇一般限于羟基与饱和碳相连的化合物。
不同结构的醇与金属钠反应的速度是: 不同结构的醇与金属钠反应的速度是: 甲醇>伯醇 仲醇 叔醇、 甲醇 伯醇>仲醇 叔醇、 伯醇 仲醇>叔醇 原因:与醇的酸性次序一致。 原因:与醇的酸性次序一致。
诱导效应解释:
R O H
2、醇中碳-氧键断裂 、醇中碳 氧键断裂
羟基被取代(亲核取代反应 羟基被取代 亲核取代反应) 亲核取代反应
第6章 章
醇和酚
醇可用通式ROH表示,醇的官能团 表示, 醇可用通式 表示 为羟基(hydroxyl group); 为羟基 ; 酚是芳环上的氢被羟基代的化合物, 酚是芳环上的氢被羟基代的化合物, 酚中的羟基称为酚羟基。 酚中的羟基称为酚羟基。醇中的羟基 称醇羟基. 称醇羟基
第一节 醇
一、分类: :
伯醇分子间的脱水为SN2机理
叔醇易生成正碳离子,主要产物为烯。
如果两种不同的伯醇之间脱水, 如果两种不同的伯醇之间脱水,则得到三种 醚的混合物。因此, 醚的混合物。因此,这种方法只适合制备单 而不适合制备混醚。 醚,而不适合制备混醚。混醚的制备可利用 伯卤代烃与醇钠反应。 伯卤代烃与醇钠反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ar
CH2 CH2
NaHCO3, H2O
CH2 CH2 OH OH
3. Grignard试剂与醛、酮、酯和环氧乙烷的反应
(1) R H2C O O R' C R" (2) H2O O R' C OEt (2) H2O O R' MgX R (2) H2O (1) R MgX R CH2 OH R' C R" MgX R R' C R OH R (2) H2O CH2 C H R' OH + EtOH OH
酮
叔醇
MgX -MgXL L R
O C R'
R' MgX O R C R'
R' MgX R' H2O R R' MgX OH C R' R'
4. 烯烃的硼氢化——氧化反应
Hydroboration-Oxidation
6 R
CH
B2H6 CH2 2 (R
H C
CH2)3B
H2O2 OH
6 R
CH H
CH2OH HOCH2 C CH2OH CH2OH
2,2- 二羟甲基 -1,3- 丙二醇 季戊四醇
二.醇的制备
1. 烯烃水合
例
H2O, H3PO4 H3C CH CH3 H3C C CH2 CH2 170 C, 10MPa H2SO4 CH3 H3 C C CH3 H2 O H3 C CH3 C OH CH3
叔丁醇
新戊醇
② 系统命名法
a. 选主链 选连有羟基的最长碳链为主链,主链上各种支链作为取代基。
命名按主链中的碳原子数称“ X 醇 ”。
羟基的位置如不在 1 位 则 应标出位置。
环醇要按环中碳原子数叫“ 环 X 醇 ”。
CH3CH2CH2CH2OH
丁醇 2-丁醇
OH
环己醇
CH3CH2CHCH3 OH
优先羟基编号,命名时主链碳数体现在不饱和烃的名称中,
最后标出羟基的位置。
4
5
3 6
2
1
CH3CH2CH2 CH CH2 CH2 CH2OH CH CH2 4-丙基-5-己烯-1-醇
CH3 CH CH2 CH CH3 CH CH2 OH
4-甲基-5-己烯-2-醇 2-丁炔-1-醇
CH3 C C CH2OH
命名:结构简单的醇可用习惯法来命名。①Fra bibliotek习惯命名法
适合低级一元醇,只需在相应烃基名后
加“醇”即可。异构体分别用正、异、仲、叔、新等来表示 其结构。
CH3CH2CH2CH2OH
正丁醇
CH3 CH2CHCH2OH
异丁醇
CH3CH2CHCH3 OH
仲丁醇
CH3 CH3 CH3 C CH3 CH3 C CH2 OH CH3 OH
第九章
醇 和 醚(1)
主要内容
醇类化合物,类型及命名 醇类化合物的制备(复习:烯烃水合、卤代烃水解, 醛酮酯与Grignard试剂的加成等) 烯烃的羟汞化——还原(脱汞)反应 烯烃的硼氢化——氧化反应
H C H H sp
3
一.醇的分类和命名
O H
R
OH
醇 (Alcohols)
R' R' OH R C OH
o
H2O, H+ R CH CH2 R
OH CH CH3
OH H3C CH CH3
适合工业生产
OSO3H
方法的局限性:
• 反应可逆,产率不高。 • 反应有重排(亲电加成机理,通过正碳离子中间体) • 反应无立体选择性。 • 只能制备仲醇和叔醇,不能制备伯醇(Markovnikov加成规则)
2. 卤代烃水解
b. 主链编号
开链醇应从靠近羟基的一侧开始编号,使羟基有最小的位 置,环醇则从连有羟基的碳原子开始编号。
CH3CH2 CH CH CH3 CH3 OH
3-甲基-2-戊醇
CH3 OH
3-甲基环己醇
CH3CHCH2CHCH2CH3 CH3 OH
5 -甲基- 3 -己醇
c. 分子中含不饱和键 选主链时则选含不饱和键并连有羟基的最长碳链为主链,
d.
含有芳基
一般将苯基看作取代基。
CH2OH
苯(基)甲醇
OH
1-苯乙醇
CH2OH
3-苯基-2-丙烯-1-醇
e. 多元醇
羟基数目用中文二、三、四表示,位置用1,2,3……表
示,位次间用逗号隔开。
CH2 CH2 OH OH
1,2-乙二醇
甘醇
CH2 CH CH2 OH OH OH
1,2,3-丙三醇
甘油
R B O O H R OR
H2O2
OH
(RCH2CH2O)3B
H2O
HO
RCH2CH2OH
伯醇
烯烃的硼氢化氧化反应是另一个可以由烯烃制备伯醇 的反应。
硼氢化——氧化反应区域选择性举例
1. B2H6 OH OH
CH3CH2 CH
CH2 2. H2O2 / OH
CH3(CH2)3 CH2 CH2 + CH3(CH2)3 CH CH3 93 % CH3 CH3 C H CH OH 98 % OH (H3C)2HC CH2 CH CH3 57 % 7% CH3 CH3 + CH3 C OH 2% CH2 CH3
醇的分类
R CH2 OH R CH
一元醇
伯醇(一级醇)
仲醇(二级醇)
R'' 叔醇(三级醇)
多元醇
C OH
(C)n
C OH
C OH
C OH
邻二醇
:
:
第一部分
醇
烯醇(Enols)
OH C C
互变异构
C H C
O
烯醇式 不稳定
酮式
注意区分
OH
特点: 羟基与芳环相连
酚 (Phenol)
醇类的命名
CH2 OH
硼氢化
H 三烷基硼
氧化
反应的特点:
• 产率较高。 • 区域选择性反应(主要为反Markovnikov规则取向)。 • 无重排产物生成。
δδ+
烷基硼在碱性条件下与过氧化氢作用生成醇的反
应称为烷基硼的氧化反应
硼酸酯
R CH CH2
R B R + H2O2 R OHR
B 2H 6
R B R
(RCH2CH2)3B
1o 醇 2o 醇(R' = H) 3o 醇
(1) 2 R
3o 醇
(1) R
MgX
1o 醇(R' = H) 2o 醇
反应能否控制在中
羧酸衍生物与RMgX的反应
O R C L O R'MgX R C R' 1. R'MgX
间产物——酮?
OH R 2. H2O C R' R'
取代
酰氯、酸酐、酯
机理:
O R C L R O C
CH3 CH3 C CH CH3
1. B2H6 2. H2O2 / OH
(H3C)2HC C H C
H
1. B2H6 2. H2O2 / OH
+ HO (H3C)2HC CH CH2 CH3 43 %
CH3
OH R X or H2O
SN2 或 SN1 机理 (复习,第四章)
R
OH
方法的局限性:
• 有副反应——消除反应。 • 存在两种机理,立体化学不确定。 • 一般由醇制备卤代烃(因醇易得)。
有合成意义的例子:
NBS CH3 (PhCOO)2 X2 , H2O CH2 CH2 X OH NaOH Ar CH2 Br Ar CH2 OH
