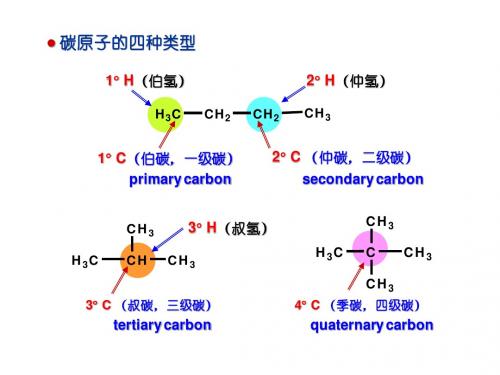
碳正离子PPT课件
5.烯烃(3)
同上条件
二酮、二酸 二酮、 或酮酸
R'(H)
② 烯烃氧化成酮或醛(臭氧氧化) 烯烃氧化成酮或醛(臭氧氧化)
R C R' C H R" (1) O3 (2) H2O, Zn R C R' O + O C H R"
H
R
补充:苄基和烯丙基碳正离子的相对稳定性: 补充:苄基和烯丙基碳正离子的相对稳定性:
3o > PhCH2 , 2o , > 1o
1130
CH2=CHCH2
1071
> CH3
1316
H (KJ/mol)
970
1000
1040
烷基对碳正离子的稳定作用——(诱导) 烷基对碳正离子的稳定作用——(诱导)给电子效应
CF3
C
CCl3
C
很不稳定
诱导) (诱导)吸电 子效应
O C C C NO2
(共轭)吸电 共轭) 子效应 π-p 共轭
不饱和(吸电子)基团 不饱和(吸电子)
碳正离子的重排性
H H3CH2C C H CH2
~H
H3CH2C C H
H CH2
H3CH2C
δ+ HC H
δ+ CH2
1, 2H 迁移 2
迁移动力: 迁移动力:生成更稳定的正碳离子
CH3 H b
消除
H3C b δ HO3SO C H3C H
CH3 C C δ+
CH3 H3C CH3
CH3 C CH3 CH C
CH3 CH3
过渡态有较大的排斥力, 过渡态有较大的排斥力,不稳定
分子内二聚 例:
H3C CH3 CH3 CH3 CH3 H H3 C H3C
碳正离子

LOGO
LOGO
共轭效应可以明显稳定碳正离子
缺电子的p-Π共轭 共轭 缺电子的
LOGO
3.2 空间效应 中心碳原子连接的基团越大,则张力越大, 中心碳原子连接的基团越大,则张力越大,有利于碳正 离子的形成。 离子的形成。
LOGO
3.3 溶剂效应 溶剂化在形成碳正离子的过程中起着重要作用。 溶剂化在形成碳正离子的过程中起着重要作用。 3.4 芳构化效应 根据休克尔规则,共面、 根据休克尔规则,共面、 共轭, 电子数等于4n+2 共轭,π电子数等于 的环状体系具有芳香性, 的环状体系具有芳香性, 因此也比较稳定。 因此也比较稳定。
LOGO
4.与烯烃加成生成更大的碳正离子 卤素,氢卤酸, 卤素 氢卤酸,水、硫酸、有机酸、 氢卤酸 硫酸、有机酸、 醇、酚,次卤酸与烯烃加成
LOGO
5. 重排反应,如Wagner-Meerwein重排,Demyanov 重 排,频哪醇重排生成更稳定的碳离子
(1)瓦格涅尔-米尔外因重排反应(Wagner-Meerwein重排) 是醇失水反应中,中间体碳正离子发生1,2-重排反应,并伴随有 氢、烷基或芳基迁移的一类反应 当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原 子)时,在酸催化脱水反应中,常常会发生重排反应,得到重排产物:
R3C:X →R3C++XLOGO
所形成的碳正离子R 一个正电荷,配位数为3, 所形成的碳正离子 3C+,一个正电荷,配位数为 ,中 心原子以三个sp 杂化轨道和三个原子成键, 心原子以三个 2杂化轨道和三个原子成键,三个键轴构 成平面,空着的p轨道垂直于平面 正电荷集中在p轨道上 轨道垂直于平面, 轨道上。 成平面,空着的 轨道垂直于平面,正电荷集中在 轨道上。 取代基R的共轭效应 诱导效应和立体效应, 的共轭效应, 取代基 的共轭效应,诱导效应和立体效应,以及烷基的 超共轭效应都能对碳正离子其稳定作用。 超共轭效应都能对碳正离子其稳
碳碳双键的加成反应ppt课件

亲核取代
CHO
CH3
O
CH3CH2CCH=CH2 (CH3)3CO-
O CH2CHO
Michael加成
CH3 CH2 C CH2
O CH3
OH-
CH3
Robinson反应
O 36
课外作业
• P78: 5, • 6, (1) (2) (6) •7
37
H+ (CH3)2C CH(CH3)2 重排
OH
①Hg(OAc)2, H2O
② NaBH4, OH-
(CH3)3CCHCH3 OH 94%
20
4.2.5 硼氢化反应
顺式的反马氏加成(形式与结果),事实上是马氏
加成。
δ +δ CC
+
δ-δ+ H BH2
H
H BH2
CC H
π-络合物
H BH2 CC
H BH2 CC
价碳原子,它是一种亲电试剂,与烯烃反应得环丙烷
衍生物,分为单线态和三线态。
23
H
C H
p轨道 sp2杂化轨道
sp2杂化 单线态卡宾
pp轨轨道道
H
C
H
三线态卡宾
(双自由基形式)
sp杂化
24
单线态与烯烃加成时的立体化学为顺式加成(立体
专一性反应)。
Et
H
C=C
+ CCl2
H
Et
反式
Cl Cl
C
Et
H
8
OH
H2/PtO2 AcOH
O
COOEt
H2/PtO2 CH3OH
4.2 亲电加成反应
H COOEt
H
碳正离子

结构
ቤተ መጻሕፍቲ ባይዱ
碳正离子与自由基一样,是一个活泼的中间体。碳正离子有一个正电荷,最外层有6个电子。带正电荷的碳原 子以sp2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。碳原子剩余的P轨道与 这个平面垂直。碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。 根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。 碳正离子的结构与稳定性直接受到与之相连接的基团的影响。它们稳定性的一般规律如下: (1)苄基型或烯丙型一般较稳定; (2)其它碳正离子是:3°>2°>1°; 而烯丙型,苄基型的碳正离子与二级碳正离子的稳定性比较,尚有争论。 (可以用超共轭解释不同碳正离子的稳定性) 碳正离子越稳定,能量越低,形成越容易。
第一个溶液中稳定的碳正离子的NMR图谱在1958年时由Doering等人所发表.其为七甲基苯离子 (heptamethylbenzenium ion),由六甲基苯加上氯化铝、氯甲烷所制成.Story等人于1960制备出稳定的7norbornadienyl阳离子,借由norbornadienyl chloride与-80℃下溶于液态二氧化硫的四氟硼酸银反应产 生.此NMR图谱显示出一个非传统的中间物(第一个发现的非传统稳定离子) 1962年,Olah借由核磁共振直接发现 三级丁基碳阳离子跟溶于魔酸(magic acid)里的三级丁基氟一样稳定.Norbornyl阳离子的NMR图谱最先由 Schleyer等人发表,而Saunders等人则显示出屏障间质子抢夺的过程.
形成过程
碳正离子的形成过程大概是这样的: C+上原本连有一个电负性较大的或者吸电子的基团(如-Br, -OH等) 那么这个基团就会将它连接的碳上的电子吸引过去使该碳稍微显正电性吸电子基团在适当溶液中还可能带着一对 电子离去(例如Br- ),那么剩下的烃基就形成了碳正离子。
碳正离子中间体机理
烯烃的化学性质
24
总结
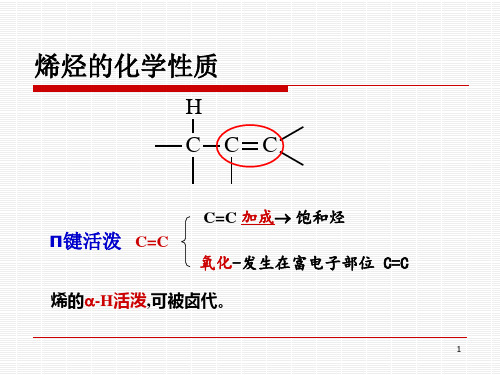
烯烃的化学性质:催化加氢、亲电加成、烯 烃α-氢卤代反应、氧化反应和裂化异构化。
环氧化反应
冷稀高锰酸钾(OsO4) 强烈条件下(加热或酸性)
臭氧
反式邻二醇 顺式邻二醇 酮或羧酸。 酮或醛。
25
H3C CH CH2
CCl4
HBr
HBr Peroxide
Br H H3C C CH2 Br
11
2. 烯烃的化学性质
(3)氧化反应
2)高锰酸钾氧化( 同OsO4 )
冷稀的碱性高锰酸钾水溶液, 与烯烃或其衍生物反应, 生 成 顺式邻二醇。例如:
cold MnO4-
OO
Mn
O
O-
H2O / OH-
OH OH
此反应使高锰酸钾的紫色消失, 故可用来鉴别含有碳
碳双键的化合物;收率低,一般不用于合成。
碳正离子;马氏规则; 顺式;2o或3o醇
环正离子;马氏规则; 反式;
离子对;反马氏规则; 顺式;
26
总结
环烷烃的化学性质:催化加成和氧化反应
环烷烃与不对称烃加成时,断裂含H最多和 最少的键。符合马氏规则。
27
巩固练习:
A
D
H3C
H2 H2 HC C C H
Cl
28
B C A D
29
OH
OH
碳负离子半径和碳正离子半径

碳负离子半径和碳正离子半径
碳正离子是带正电荷的碳原子,以SP2杂化轨道与3个原子或原子团结合,形成3个σ键,与碳原子处于同一个平面,是平面结构,碳正离子是一个活泼的中间体。
碳负离子是带负电荷的具有偶数价电子的物种,其负电荷(未共用电子对)定域在一个碳原子上,一般能迅速发生反转呈现为平衡,这类碳负离子的稳定性顺序(按荷负电原子类型)为伯>仲>叔。
正碳离子和碳负离子的半径大小主要取决于最外层电子数和原子核内质子数,当最外层电子少时,半径较小,当最外层电子多时,半径较大。
离子半径是化学研究中一个重要的概念,对于理解物质的性质和反应机理具有重要意义。
如果你想了解更多关于离子半径的信息,可以查阅相关的化学文献或咨询化学专家。
高等有机化学 第二章 有机反应中的活性中间体

.
44
② 碱性条件下脱羧(C—C键异裂)
CN
碱
C 2H 5C COOH
C 6H 5
CN C 2H 5C
C 6H 5
29.04.2020
.
45
(2)负离子对不饱和键的加成
H C C H+O C H 3
C HC HO C H 3 H O C H 3
C H 2 C HO C H 3 + O C H 3
29.04.2020
.
37
5
4 3
SN2
6
1
OBs
exo- 2
54 3
1 6+2
SN1 +
endo-
+
OBs
而内型的几何形状不具备背面进攻的条件,即-
OBs基团阻碍了C-6对C-2的背面进攻,反应按
SN1历程进行,因此速度小,但内型化合物生
成C正离子后能迅速转变成同样的非经典的C正
离29.子04.20,20 因此产物相同。 .
29.04.2020
.
46
(3)来自金属有机化合物 RMgX、RLi、R2CuLi、RZnX
2 R M g XR 2 M g + M g X 2 R 2 M g M g X 2
OEt2 R Mg X
OEt2 R Mg R
OEt2 X Mg X
29.04.2020
OEt2
OEt2
.
OEt2
47
2. 碳负离子的结构 ~109°28′
环庚三烯正离子
环戊二烯正离子
有芳香性,特别稳定 反芳香性,很不稳定
29.04.2020
.
19
空间效应 碳正离子中心碳原子必须sp2杂化,才较稳定。 ①平面构型有利于电荷离域; ②空p轨道的两瓣在平面两侧均可溶剂化。
高等有机化学PPT课件

CH3CONHNH2 HNO2 CH3CON3
CH3NCO
X
O
C=NOH
CH3NCO
X
O
O
C N O C NHCH3
乃春在芳环邻位是不饱和支链时,极易环化成五元环,这一 性质对杂环的合成具有重要意义:
AX B
H N:
A BX
N
H
第三节:自由基
自由基是共价键发生均裂,每个碎片各保留一个电子,是带 单电子的三价碳的化合物。
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
化合物)和叶立德
第二章 官能团的选择性互变
第一节 还原反应 第二节 氧化反应
第三章 官能团的保护
第一节: 羟基的保护(醇、酚羟基的保护) 第二节:烯键的保护 第三节:羰基的保护(用醇保护) 第四节:羧基的保护-酯化 第五节:胺基的保护-酰化或成盐
(六)生物有机化学( Bioorganic Chemistry) (七)元素和金属有机化学(Element and Metal Organic Compounds Chemistry) (八)有机化学中的一些重要应用研究
碳正离子的杂化类型

碳正离子的杂化类型碳正离子是一种带正电荷的碳离子,具有很高的反应活性和化学惰性。
在化学反应中,碳正离子可以与其他离子或分子发生反应,形成新的化合物。
为了进一步改善碳正离子的性质和应用,研究人员发展了不同的碳正离子的杂化类型。
以下将介绍几种常见的碳正离子的杂化类型。
1. 碳正离子与有机化合物的杂化碳正离子与有机化合物的杂化是最常见的碳正离子杂化类型之一。
在这种杂化中,碳正离子与有机化合物中的碳原子发生反应,形成新的化合物。
这种反应通常是通过碳正离子的亲电性与有机化合物中的亲核性发生的。
杂化后的化合物具有更丰富的化学性质和应用前景。
2. 碳正离子与无机化合物的杂化碳正离子与无机化合物的杂化也是一种常见的杂化类型。
在这种杂化中,碳正离子与无机化合物中的离子或原子发生反应,形成新的化合物。
这种反应可以用于合成新型无机材料或改善材料的性能。
例如,碳正离子与金属离子杂化可以形成金属有机骨架材料,具有良好的催化性能和吸附性能。
3. 碳正离子与生物分子的杂化碳正离子与生物分子的杂化是一种新兴的杂化类型。
在这种杂化中,碳正离子可以与生物分子如蛋白质、核酸等发生反应,形成新的生物功能分子。
这种杂化具有重要的生物学和医学应用。
例如,通过将碳正离子杂化到药物分子上,可以提高药物的生物利用度和疗效。
4. 碳正离子与半导体材料的杂化碳正离子与半导体材料的杂化是一种前沿的杂化类型。
在这种杂化中,碳正离子可以与半导体材料如石墨烯、碳纳米管等发生反应,形成新的杂化材料。
这种杂化材料具有独特的电子性质和应用潜力,可以用于电子器件、能源储存等领域。
总结起来,碳正离子的杂化类型包括与有机化合物、无机化合物、生物分子和半导体材料的杂化。
这些杂化类型可以改善碳正离子的性质和应用,推动碳正离子在化学、生物学和材料科学等领域的研究和应用。
随着杂化技术的不断发展,碳正离子的杂化类型将会更加多样化,为科学研究和工业应用提供更多的可能性。
第五讲 高等有机碳正离子

R''
R' R
sp2杂化,平面型结构
sp3杂化,角锥型结构
66-19
碳正离子大多采取sp2 杂化的平面型结构,这可能是 空间效应及电子效应共同作用的结果:
平面型结构使与中心碳相连的三个基团相距较远; sp2杂化较sp3杂化含有更多的s成分,更靠近原子核; sp2杂化中,空的2p轨道上下两瓣都可以发生溶剂化作用。 通过拉曼光谱、核磁共振及红外光谱等可以证明,简 单的烷基碳正离子均为平面结构。
66-25
②间接离子化
质子或其他带正电荷的原子或基团与不饱和体系的 一个原子(通常为碳、氮、氧原子)加成,使得相邻 的碳原子带上正电荷。
C
Z
+
E+
C +
Z
E
Z = C, O, NR等 E = H等
66-26
芳香族亲电取代、碳 - 碳双键的亲电加成,以及 Lewis 酸体系或质子催化下碳氧双键的加成中都包括 这一过程。
66-16
5.2 碳正离子
碳正离子是有机化学反应中常见的活性中间体,对 它的稳定性和反应活性的研究对某些有机反应历程的阐 明是十分重要的,同时对碳正离子稳定性的研究,有助
于判断反应是按何种反应历程进行,有助于推断反应所 生成的主要产物。
66-17
碳正离子(Carbocation)的分类与定义
经典碳正离子 (碳正离子、碳宾离子) (Carbenium Ions) 非经典碳正离子 (碳鎓离子) (Carbonium Ions) 碳原子带有一个正电荷的 三价物种,如(CH3)3C+
NMe 2
孔雀绿
晶紫 (龙胆紫,甲紫)
第七章-重排反应PPT课件

1、史帝文斯重排(Stevens)
——季铵盐在碱作用下,烃基从氮迁移到邻近 的负碳离子上得到胺。
例如:
CH3 NCH+ C2PHh2CBHr- CH2 CH3
C4H9OK
CH2Ph
+-
CH3 N CH CH CH2
CH3
CH2ph
CH3 N CH CH CH2
CH3
.
形成叔胺 型化合物
22
C H 2R CH3 N+ R'
X
两处的碳负离子谁易形成?
容易
但后者除了进行分子内取代外,另有变化
.
30
✓分子内取代:
O
-OR
R
CH3
O
-
O
R
R
CH3
这个结构 不予成立
以原先与卤素 相连处断开
问题二 如果该结构式成立的话,就有二个分离 可能,但事实上只有一种。
O C OR R CH CH CH3
ROH
.
O C OR R CH CH2 CH3
1
重排反应的分类:
➢(1)以重排范围分类
分子内重排:(以此为主) 分子间重排:(是以后发展的方向)
➢(2)以重排发生的距离分类
1,2-重排:邻位重排(*) 1,3-重排:间位重排 各种位置之间的重排
重排反应的特点:
➢(1)剧烈性:与上述所说的不稳定性有关, 瞬间性
.
2
➢(2)复杂性:不可测性
许多重排的产物复杂; 许多重排的机理尚不十分明了,尚无定论
CH2N2 重氮甲烷
RO O C CH R
可用于生成 酯、酸、酰胺
+-
ROH, H2O, NH3
碳正离子.ppt

2020/1/31
11
B. 1,2-H原子位移:
CC H
CC H
CC H
总之,由于在SN1反应中生成了C+,因此 引发了重排,可以说碳架的重排是SN1反应的另 一特点。
2020/1/31
12
5. Markovnikov’s Rule
在不对称的烯烃中, HX 可以按照不同的方式加成, 但只 有一个是占优势的 如果反应只在一个方向上进行, 为区域专一性的 (regiospecific)反应,如果同时得到不同方向的反应 产物,但以一种为主,则为区域选择性 (regioselective)反应 Markovnikov 在十九世纪发现 在烯烃的HX加成中,H 总是加在含氢较多的碳上,称为Markovnikov’s rule
碳正离子
2020/1/31
1
1. 碳正离子的结构特点及其形成
碳原子外层轨道含有6个电 子,需要接受一对电子才能满 足C原子外层的稳定结构,因 而它是非常活泼的反应中间体, 是非常强的Lewis酸。结构如 右图:
2020/1/31
2
2. 碳正离子的稳定性
以溴代烷为例,不同结构的溴代烷的C—Br键异 裂,生成C+,所需能量如下:
CC H
CC H
总之,由于在SN1反应中生成了C+,因此引发了重
排,可以说碳架的重排是SN1反应的另一特点。
2020/1/31
9
4. SN1反应的速度与烷基结构的关系
O
R W + CF3COOH H W + ROCCF3
CH3
CH3
CH3 C W > CH3 CH W > CH3 CH2 W > CH3 W
第五讲 高等有机碳正离子

66-31
66-32
(3) 超上 的正电荷分散,碳正离子趋于稳定,其稳定
H
C
: +
C
C H3
H 3C σ,p - 超共轭效应
性次序与供电子效应一致。
环丙基取代基有相当的给电子效应,由于三元环张力的存 在,使弯曲键电子具有比正常σ键电子高的能量,可以与带电 中心碳原子形成碳-碳超共轭效应,使得环丙基的性质与双键类 似,甚至比双键更为有效。
H3C C H3C CH 2 + H
+
HF/SbF5
H3C H3C C + CH 3 SbF 6-
66-27
③其它生成的途径
由其它较容易获得的碳正离子转换成较稳定的难以获得 的碳正离子。常见的有重氮基正离子脱氮而生成碳正离子。
66-28
④ 气相中碳正离子的形成
由于没有使碳正离子稳定化的溶剂,气相中的热反应一般 不生成碳正离子,气相中主要涉及的是均裂,产生自由基,但 在质谱仪中气相有正离子生成。在产生分子正离子的同时,还 产生相当量的碎片离子。
NMe 2
孔雀绿
晶紫 (龙胆紫,甲紫)
起初都是碱性阳离子染料,后发现多种药理活性,如龙 胆紫能抑制革兰氏阳性菌、白色念珠菌,在民间,它广泛用 于皮肤、黏膜炎症和鹅口疮的局部治疗,亦有内服驱蛲虫的 报道。20世纪70年代以来,发现孔雀绿、龙胆紫均有致癌作 用,在有多种外用药可供选择的情况下,限制它们的使用 。
-20℃可以 稳定存在
(CH3)3CF + SbF5
(CH3)3C+SbF 6-
氢谱只是在 δ4.3 ppm有一单峰,显示强烈的去屏蔽效应。 碳谱中叔碳原子的化学位移为335.2,比正常叔碳原子向低场移 动了300,也显示很强的去屏蔽效应,显然是叔碳原子的正电荷 以及叔碳原子由sp3杂化轨道变为sp2杂化轨道所致。这一实验结 果确定无疑地证明了所观察到的是叔丁基碳正离子。
第九章-亲电加成反应-课件
CC = alkene
键
C键 C
烯烃活泼的原因: 电子受核束缚力小,容易极化
3
1.1 亲电加成反应的历程
1.烯烃的亲电加成反应可用通式表示如下:
历程有两种可能:一步历程,试剂的两部分E+和Nu-同时 分别加到两个双键碳原子上;两步历程,首先E+加到双 键的一个碳原子上,然后Nu-加到双键的另一个碳原子上。
实验结果表明,反应是分步进行的。
烯烃与溴的加成反应
这一结果说明:反应不是一步历程,因为Br2分子中的两 个Br原子相距非常近,不可能同时从C=C双键所在平面 的两侧加到双键的两个碳原子上,即不可能通过一步完 成反式加成。
5
双分子历程 动力学研究表明,不同的亲电试剂与烯烃的加 成表现出两种不同的反应级数,一种是二级反 应,另一种是三级反应。双分子亲电加成动力 学上表现为二级反应,可用AdE2表示。这一 类反应历程还可以分为两种情况,即生成碳正 离子中间体和环状鎓离子中间体两种历程:
CH3 CH3 H OH
顺式 45%
CH3 H
H CH3
OH CH3
CH3 OH
反式 55%
15
问题:
解释双键碳原子上连有苯基的烯烃与溴加成时,顺式加成产物增多。如:溴与反-1-苯 基丙烯反应所得反、顺式加成产物之比为88:12;当双键碳原子所连的苯基上有给电子 基团时,顺式加成产物的比例也明显升高。
26
27
4. 邻基参与
(1)当双键邻位有带未共用电子对的基团存在时,该基团会 对碳正离子中间体进行亲核进攻
X
H2C CH CH2X Br2
H2C CH CH2X Br Br
H2C CH CH2
Br
有机反应中间体
常见的超酸
与100%H2SO4的酸性比较
HSO3F (氟硫酸) HSO3F - SbF5 (魔酸) HF-SbF5
1000倍 1000倍 1016倍
叔丁醇在下列条件下完全转变成叔丁基正离子:
CH3 H3C C OH
CH3
HSO3F - SbF5-SO2 - 60 oC
CH3 H3C C +
CH3
SO3F- + H2O + SbF5 +
❖ 如:反应在CS2中进行时,产物1/2比例为106,而当 溶剂为苯时,则降至49.
CH3 CH3
hv
H3C H
CH3 H
Cl2
CH3 CH3
H3C
CH3 +
H Cl
1
CH3 H3C
H
CH3 CH2Cl
H
2
四、卡宾
❖ 也叫碳烯,是一类缺电子的中性活性中间体,其中 包含一个只有六个价电子的两价碳原子。是1959年 利用光谱研究确定的。
d、乙烯型碳正离子: H2C CH
HC R
C
H
C原子进行sp2杂化, p轨道 用于形成π键,空着的是sp2
+ 杂化轨道,使正电荷集中。 因此不稳定。
苯基正离子:
结构同乙烯型正碳离子,正电荷 集中在sp2杂化轨道上。
此两类碳正离子稳定性极差。
e、溶剂效应:
1) 溶剂的诱导极化作用,利于底物的解离。
SO2
很多正碳离子的结构与稳定性的研究都是在超酸介质中进行的。
4、非经典碳正离子
1) π键参与的非经典碳正离子 实验表明:
反-7-原冰片烯基对甲苯磺酸酯在乙酸中的溶剂解的 速度比相应的饱和化合物大1011倍。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
-6.63 -3.40 -9.15 -13.3 -2.3 +4.7 +3.1
C+ C+ H
+
C+
C
.
+ +
8
China Pharmaceutical University
给电子取代基促进碳正离子的稳定:
[ (CH3)2N
] 3 C+
4,4’,4’’-三(二甲氨基)-三 苯基甲基正离子
pKR+=+ 9.36
连有诱导推电子的基团时的稳定性(+I):
连有诱导吸电子的基团时的稳定性(-I):
.
10
China Pharmaceutical University
2) 共轭效应(Conjugative effect):
a) p- σ共轭效应 稳定性次序:叔碳正离子> 仲碳正离子> 伯碳正离子
如:
+
+
+
(CH3)3C > CH3CH2CHCH3 > CH3CH2CH2CH2
pKR+=log[R+]/[ROH] + HR
当反应达到平衡、 [R+]=[ROH]时,pKR+ = HR (酸度函数) ;
pKR+ 愈大, 碳正离子愈稳定。
.
7
China Pharmaceutical University
一些碳正离子的pKR+值
碳正离子
三苯基甲基 4-甲氧基三苯基甲基 4-硝基三苯基甲基 二苯基甲基 三环丙基甲基 环庚三烯正离子 三苯基环丙烯基
[ CH3O
] 3 C+
4,4’,4’’-三甲氧基三 苯基甲基正离子
pKR+=+ 0.82
[ O2N
] 3 C+
4,4’,4’’-三硝基三 苯基甲基正离子
pKR+=-16.27
.
9
影响碳正离子稳定性的因素:
1)诱导效应(Inductive effect):离域或分散C+正电荷将 有利于碳正离子的稳定
因此,极性溶剂有助于碳正. 离子的形成和稳定
18
6)空间效应(Steric effect) 对于桥头碳正离子,张力大,稳定性差。
形成碳正离子的相对反应速度:
(CH3)3CBr
Br
K =1
10 -3
Br
10 -6
如:环丙烯基
+
⊕
4n+2=2, n=0
卓正离子
+
⊕
4n+2=6, n=1
.
17
4) 不同价键状态
举例: CH3-C+H2 > CH2=C+H
sp2
sp
S特性增加,吸电性增强,不利于C+稳定。
5)溶剂效应 举例:
在气相中,电离活化能为836.8 kJ/mol; 在水溶液中,电离活化能为83.7kJ/mol。
举例:
FSO3H -SbF5 -SO2
CH3CH2CH2CHOH
。
-60 C
裂 解 ,重 排
OH CH3CH2CHCH3
FSO3H -SbF5 -SO2
。
-60 C 裂 解 ,重 排
(CH3)3COH
FSO3H-SbF5 -SO2
。
-60 C
[ CH3CH2CH2CH2
OH + ]
H
+ (CH3)3C
China Pharmaceutical University
c) p-p 共轭效应
碳正离子中心碳原子p空轨道与邻位杂原子的未共用电 子对的p电子共轭,稳定碳正离子。
如:
+
CH3O CH2
+ CH3O CH2
+
+
CH3O
CH2
CH3O
CH2
.
16
3)芳香性(Aromaticity)
具有芳香性的平面环状正离子稳定
甲基推电子基通过C-Hσ键与C+的空轨道共轭。
.
11
σ共轭效应的研究 在超酸催化下进行 超酸:强的质子给予体,强度用哈米特酸度H°表示
超酸特点:1) 给质子能力强,亲核性低; 2) 凝固点低; 3) 粘度小。
.
12
China Pharmaceutical University
在超酸介质中可得到热力学最稳定的碳正离子
NO2
+ H2SO4
.
4
China Pharmaceutical University
2、结构
经典碳正离子(Carbenium ion):
中心碳原子sp2 杂化 与其他三个基团或原子以σ键相连 形成具平面的构型
.
5
China Pharmaceutical University
。 一些情形下,键角不是120,或者不是平面结构。
HO H
+ [ CH3CH2CHCH3 ]
+ (CH3)3C
+ (CH3)3C
.
13
超酸可将质子给予:
(a)具有σ–电子对的化合物, 使得烷烃中的C-H及C-Cσ–键对超酸表现出σ–碱性。
在超酸的作用下,C-H或C-C键的σ-电子对与质子的空 轨道作用形成缺电性的三中心两电子键,用虚线表示。
(b)具有π-电子对的化合物,如烯、炔、芳香化合物等
(c)具有未共用电子对的化合物,如醇、醚、醛、酮、酯等
.
14
China Pharmaceutical University
b) p-π共轭效应
碳正离子中心碳原子p空轨道与π电子共轭,分散正电荷, 稳定碳正离子。
+ Ph C Ph >
Ph
+
Ph C Ph > H
+ PhCH2
+
CH2
CH
CH2
.
15
.
1
1922年,Meerwein发现萜类化合物重排与C+有关
1962年,Olah在超酸中检测到C+
G. A. Olah, N. obel 1994
2
China Pharmaceutical University
产生碳正离子的反应举例:
1) 脂肪族化合物的亲核取代反应
CH3 H3C C Cl
CH3 H3C C+
CH3 OH
H3C C OH
CH3
CH3
CH3
2) 烯烃的亲电加成反应
H3C CH CH
H3C
CH2 + HCl
H3C
+
CH CH CH3
H3C
重 排 H3C + C CH2 CH3
- H3C
Cl
H3C
CCl CH2 CH3
.
H3C
3
3) 芳香化合物的亲电取代反应
+
+ NO2
O2N H +
HSO4
如:
H3C
。
+
>120
CH
H3C
+
C
=
HH
.
6
China Pharmaceutical University
3、稳定性及研究方法
碳正离子的相对稳定性可由其pKR+来定量表示:
R+ + H2O
ROH + H+
, [ROH][H+ ]
KR+ =
p KR+ = log
[R+]
[R+]
+ p [H+]
[ROH]
第三章 亲核取代反应及碳正离子
(Nucleophilic Substitution and Carbocations)
一、碳正离子的产生、结构和稳定性 1、产生及类型:有机反应中产生的活性中间体的一种。
是Intermediate, 而不是Transition state 碳正离子能在一定条件下存在且被分离出
