烃的含氧衍生物知识点总结
烃的含氧衍生物醛、酮、酸、酯

一、醛和酮的性质和应用自然界中常见的醛自然界中常见的酮醛基羰基与氢原子相连构成醛基,醛基上C、O、H三个原子构成一平面。
酮基羰基与烃基相连构成酮基,与羰基直接相连的原子位于同一平面。
醛类:醛基与烃基直接相连所得的化合物。
下述化合物中属于醛的有哪些?醛的分类按醛基个数分:一元醛、二元醛、多元醛按烃基是否饱和:饱和醛和不饱和醛按烃基类别:脂肪醛和芳香醛饱和一元醛的组成通式:C n H2n O饱和一元酮通式为:C n H2n O醛的同分异构体碳链异构:由于醛基只能连在碳链的一端,所以属于醛的同分异构体,只是烃基碳链异构所致。
官能团异构(类别异构):含碳原子数相同的醛、酮和烯醇等互为同分异构体。
如:C3H6O的同分异构请写出分子式为C5H10O的属醛同分异构体醛、酮的命名(1)选主链选择含有羰基的最长的碳链为主链,并根据主链上的碳原子个数,确定为“某醛”或“某酮”。
(2)编号码从靠近羰基一端开始编号。
(3)写名称与烷烃类似,不同的是要用阿拉伯数字表明酮羰基的位置。
请给下列物质命名常见的醛:甲醛:HCHO是最简单的醛,为无色、有刺激性气味的气体,它的水溶液(又称福尔马林)具有杀菌、防腐性能。
乙醛:乙醛是一种没有颜色,有刺激性气味的液体,密度比水小,沸点20.8℃,易挥发易燃烧,易溶于水及乙醇、乙醚、氯仿等有机溶剂。
醛类物质的化学性质(1)加成反应注意:碳氧双键与碳碳双键不同,一般情况下,只与H2发生加成反应,不与Br2、HBr、H2O等物质发生加成反应。
(2)氧化反应①燃烧反应:②催化氧化:③被弱氧化剂氧化:含醛基的物质:醛、甲酸、甲酸酯及其盐、葡萄糖等。
做银镜反应的注意几个事项:1.试管内壁应洁净2.必须用水浴加热,不能用酒精灯加热。
3.加热时不能振荡试管和摇动试管。
4.须用新配制的银氨溶液;配制银氨溶液时,氨水不能过多或过少[只能加到AgOH 棕色沉淀刚好消失]5.乙醛用量不可太多;浸泡,再用水洗6.实验后,银镜用HNO3乙醛与Cu(OH)的反应注意的地方2应现配现用;1.Cu(OH)22.成功条件:碱性环境、加热练习1、请写出下列反应的化学方程式CH3CH2CHO与银氨溶液的反应甲醛与银氨溶液的反应练习2、某8.8g饱和一元醛和足量的银氨溶液反应,结果析出43.2gAg,则该醛为()A.甲醛B.乙醛C.丙醛D.丁醛练习3、某3g饱和一元醛和足量的银氨溶液反应,结果析出43.2gAg,则该醛为A.甲醛B.乙醛C.丙醛D.丁醛有机反应中氧化还原反应的概念有机物发生加氧或去氢的反应称为氧化反应有机物发生加氢或去氧的反应称为还原反应例如:乙醛既可以被氧化又可以被还原练习、下列四种变化有一种与其他三种反应类型不同的是()银氨溶液和菲林试剂都可以检验醛基的存在,讨论:哪些有机物通过化学反应使溴水褪色?①、含C=C或C≡C键的有机物;②、醛哪些有机物可使酸性KMnO4溶液褪色?①、含C=C或C≡C键的有机物②、苯的同系物③、醇、醛练习:为了鉴别已烯、甲苯、苯酚溶液、乙醛溶液四种无色的液体,可以使用下列试剂合理的一组是()A .KMnO4酸性溶液和溴水B .银氨溶液和KMnO4酸性溶液C. 新制Cu(OH)2和溴水D .新制Cu(OH)2和FeCl3溶液有机物结构简式为下列对其性质的判断中,不正确的是()A.能被银氨溶液氧化B.能使KMnO酸性溶液褪色4C.1mol该有机物只能与1molBr发生加成反应2D.1mol该有机物只能与1molH发生加成反应2甲醛的另外一个性质:制取酚醛树脂缩聚反应: 单体间除缩合生成一种高分子化合物外, 还生成一种小分子(如H2O、NH3等)化合物.加聚反应:只生成一种高分子化合物.羧酸自然界和日常生活中的有机酸1、羧酸的定义:由烃基(或氢原子)与羧基相连构成的有机化合物。
人教化学选修5第3章《烃的含氧衍生物》归纳提升
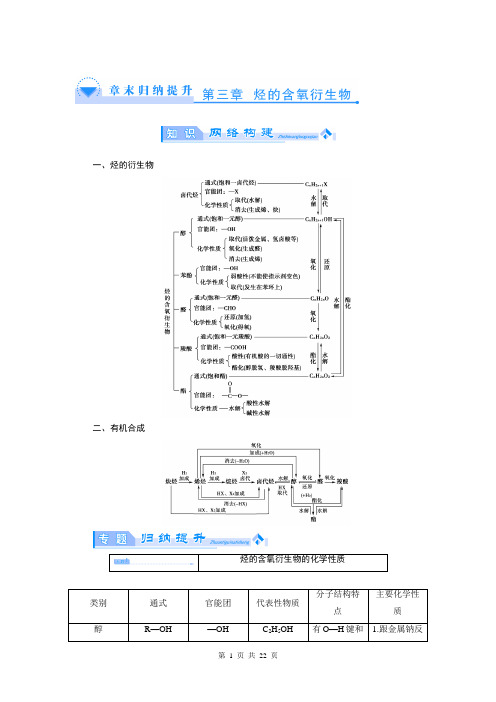
一、烃的衍生物二、有机合成(2013·长安一中高二期末)2011年西安世园会期间对大量盆栽鲜花施用了诱抗素剂,以保持鲜花盛开。
诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羧基、酯基三种官能团B .1 mol 该物质在催化剂加热条件下最多可与4 mol H 2发生加成反应C .1 mol 该有机物与足量的溴水反应能消耗4 mol Br 2D .该分子中所有碳原子可能位于同一平面上【解析】 该分子含有碳碳双键、羧基和羰基三种官能团,A 项错误;1 mol 该有机物最多消耗3 mol Br 2,C 项错误;分子内部有饱和碳原子,D 项不正确;分子中三个碳碳双键和羰基能够与H2发生加成反应,—COOH中的碳氧双键不能与H2反应,B项正确。
【答案】 B醇、由于与—OH相连的基团不同,—OH受相连基团的影响也不同,这些羟基上的氢原子活性也就不同,表现在性质上也就有较大差异。
如下表:2332 ROH。
(2012·上海高考)过量的下列溶液与水杨酸(COOHOH)反应能得到化学式为C7H5O3Na的是()A.NaHCO3溶液B.Na2CO3溶液C.NaOH溶液D.NaCl溶液【解析】由于酸性:COOH>H2CO3>OH,可知水杨酸与NaHCO3溶液反应时只是—COOH作用转化为—COONa,产物的分子式为C7H5O3Na,A项正确;水杨酸与Na2CO3溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,B项错误;水杨酸与NaOH溶液反应时—COOH、—OH均反应,生成产物的分子式为C7H4O3Na2,C项错误;与NaCl溶液不反应,D项错误。
【答案】 A现有4种液态有机物A、B、C、D,分子式均为C3H6O2,请根据下表所给出的实验结果,判断这4种物质为何物质(写出结构简式)。
A________;B________;C________;D________。
第三节烃的含氧衍生物考点(二)醛、酮-课件新高考化学一轮复习

2.最简单的酮——丙酮 (1)物理性质:无色透明的液体,沸点 56.2 ℃,易挥发,能与水、乙醇等互 溶。 (2)化学性质:丙酮不能被银氨溶液,新制的 Cu(OH)2 等弱氧化剂氧化,在 催化剂条件下,可与 H2 发生加成 反应,生成 2-丙醇,反应的方程式为
3.酮的应用 酮是重要的有机溶剂和化工原料。如丙酮可以做化学纤维等的溶剂,还用 于生产有机玻璃、农药和涂料等。 [微点拨] 酮和同碳原子数的醛属于同分异构体,如丙酮和丙醛互为同分异构体。
式
CH3COONa+Cu2O↓+3H2O
[微点拨] 乙醛与银氨溶液或者新制氢氧化铜反应均在碱性环境中,所以乙 醛被氧化后的乙酸均以羧酸盐的形式存在。
③催化氧化 乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式
催化剂 为 2CH3CHO+O2 ―△―→ 2CH3COOH 。
[微点拨] —CHO 具有明显的还原性,能被酸性高锰酸钾溶液等强氧化剂氧 化为—COOH,故能使酸性高锰酸钾溶液褪色。
[题点全盘查] 1.判断正误(正确的打“√”,错误的打“×”)。
(1)
属于饱和一元醛
(2)乙醛是无色体,不溶于水
(3)乙醛既能发生氧化反应又能发生还原反应
(4)能发生银镜反应的有机物都属于醛类有机物
(5)甲醛常温下为气体,其水溶液可用于浸制生物标本
答案:(1)× (2)× (3)√ (4)× (5)√
⑥银镜可用稀 HNO3 浸泡洗涤除去
色沉淀,这是 Cu(OH)2 受热分解生 成 CuO 所致
【解析】
A. O
B. P
C. Mn
D. Cr
D. 自由电子受外力作用时能迅速传递能量
谢 谢观
【答案】D
烃的含氧衍生物

拓展思维: 乙醛也能和一些极性试剂发生加成反应。请写出乙醛与氢化氰HCN反应化学方程式。
甲醛的结构 甲醛的化学性质
甲醛的氧化反应 1 mol HCHO~4 mol Cu(OH)2~2 mol Cu2O
计算题:
1. 3 g某醛和足量的银氨溶液反应,结果析出43.2 g Ag,则该醛为
A.甲醛 B.乙醛
②催化氧化 乙醇在铜或银作催化剂加热的条件下与空气中的氧气反应生成乙醛
有机化合物分子中失去氢原子或加入氧原子的 反应叫做氧化反应。 得氧去氢
2CH3CH2OH+O2―C――u或―△―A―→g 2CH3CHO+2H2O
③醇还能被KMnO4酸性溶液或K2Cr2O7酸性溶液氧化
CH3CH2OH ――氧―化―→ CH3COOH
根据工业废水中苯酚的处理流程填空
①流程图设备Ⅰ中进行的操作是 萃取、分液
(填操作名称)。
②由设备Ⅱ进入设备Ⅲ的物质A是 C6H5ONa 。由设备Ⅲ进入设备Ⅳ的物 质B是 NaHCO。3
③在设备Ⅲ中发生反应的化学方程式为
为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是
苯酚乳浊液,静置分层,最后通过分液即可得到苯酚
归纳总结
(1)苯酚在水中可发生微弱的电离
苯酚的水溶液呈弱酸性。
(2)由于酸性:H2CO3>苯酚> HCO- 3 , 向苯酚钠溶液中通入CO2,无论是否过量,只能生成NaHCO3。
(2)取代反应 羟基影响苯环 向盛有少量苯酚稀溶液的试管中滴加过量的饱和溴水,现象为 有白色沉淀生成 。
乙醚是一种优良溶剂。
讨论:1-丙醇、2-丙醇和乙醇分子间脱水生成醚的可能产物
以乙烯为基本原料,合成六元环状化合物D(C4H8O2)de部分反应如下(部分试剂、产物及反应条件略去)
201x高考化学总复习 11 有机化学基础(选学)(38)烃的含氧衍生物(3) 新人教版

第38讲 烃的含氧衍生物Βιβλιοθήκη 考点三 烃的衍生物间的转化关系及应用
.
知识梳理
.
1.各类烃的衍生物的主要性质
.
2.醇、醛氧化反应的定量关系
.
3.酯化反应类型
.
.
.
特别提醒:同位素示踪法是科学家经常使用的研究化学反应历程的手段之一。将 CH3COOH 和 CH3CH128OH 发生酯化反应,发生反应的化学方程式为:CH3COOH+ CH3CH128OH浓H△2SO4CH3CO18OCH2CH3+H2O。将乙酸乙酯与 H128O 混合后,加入硫酸 并加热的化学方程式为:CH3COOCH2CH3+H128OH2△SO4CH3CO18OH+CH3CH2OH。
。
(2)B 的化学式为 C3H8O,核磁共振氢谱为三组峰,峰面积比为 6∶1∶1,则 B 的结构简
式为 CH3CH(OH)CH3,名称为 2-丙醇。(3)D 的化学式为 C7H8O2,其苯环上仅有两种不
同化学环境的氢,1 mol D 可与 1 mol NaOH 或 2 mol Na 反应,则苯环上有一个酚羟基和
.
(3)观察 G 的结构简式可知,反应⑤是 E 中氨基上的氢原子与
中的氯原子结
合成 HCl,同时生成 F,据此可写出反应⑤的化学方程式。该反应中有 HCl 生成,而吡
.
(4)①的反应类型为__________;②的反应类型为__________。 (5)F 的结构简式为_______________________________________。 (6)E、J 有多种同分异构体,写出符合下列条件的 4 种同分异构体的结构简式 _______________________________________。 ①与 E、J 属同类物质; ②苯环上有两个取代基;
烃的含氧衍生物 文档

第十章 烃的含氧衍生物10.1 醇、酚高考考点:醇、酚的性质与结构是高考的重点和热点,在有机合成与推断中处于中心枢纽位置。
一.烃的含氧衍生物1. 定义:从结构上说,可以看作是烃分子里的氢原子被含氧原子的原子团取代而衍生二.乙醇1.分子结构:结构式:电子式:分子式:C 2H 6O 结构简式:CH 3CH 2OH 官能团:-OH(羟基)2.物性:无色透明有特殊香味的液体,ρ(CH 3CH 2OH )>ρ(H 2O )易挥发,沸点78.5℃ 熔点:-117.3℃ 能与水以任意比互溶,能溶解多种有机物和无机物,工业酒精含乙醇96%,用工业酒精与生石灰混合蒸馏可制取无水酒精 3.化学性质:(1)与活泼金属反应2CH 3CH 2OH+2Na 3CH 2ONa+H 2↑ (2)氧化反应: CH 3CH 2OH+O 2 2+3H 2O 2CH 3CH 2OH+O 2 3CHO+2H 2O乙醇可以使酸性KMnO 4溶液褪色,能与酸性重铬酸钾(K 2Cr 2O 7)溶液反应,被直接氧化成乙酸。
(3)消去反应: ↑+H 2OCH 3CH 2OH(4)取代反应: CH 3CH 2 2Br +H 2O (浓氢溴酸)CH 3CH 2OH+CH 3COOH CH 3COOCH 2CH 3+H 2O2CH 3CH 23CH 2OCH 2CH 3 +H 2O4.工业制法:CH 2=CH 2 CH 3CH 2OH发酵法:淀粉 3CH 2OH+2CO 2 三.醇类1. 2. 分类※ 乙二醇、丙三醇都是无色粘稠、有甜味的液体,易溶于水和乙醇3. 物理性质:饱和一元醇(C n H 2n+2O )随着碳原子数的递增沸点逐渐升高4. 化学性质:与乙醇相似能与活泼金属反应、氢卤酸反应、能发生氧化反应和消去反应。
※ 催化氧化:-OH 在端上氧化成醛、在链中氧化成酮、与-OH 相连的C 上无氢则不能被催化氧化。
消去反应:CH 3-CH=CH-CH 3 +H 2O (查依采夫规则)10.1‘酚一.苯酚(石炭酸)1.分子结构分子式:C6H6O 结构简式:或C6H5OH2.物理性质:纯净的苯酚是无色的晶体,但放置时间较长的苯酚往往是粉红色,这是由于部分苯酚被空气中氧气氧化所致。
备战2021年高考化学考点 烃的含氧衍生物

考点烃的含氧衍生物一、醇类1.醇类(1)定义:羟基与烃基或苯环侧链上的碳原子相连形成的化合物称为醇。
(2)醇的分类注意啦:饱和一元醇的通式是C n H2n+1OH,饱和一元醚的通式为C n H2n+2O,所以碳原子数相同的饱和一元醇和饱和一元醚互为同分异构体,如丁醇和乙醚互为同分异构体。
碳原子数相同的芳香醇及酚互为同分异构体。
(3)醇的物理性质和化学性质物理性质递变规律密度一元脂肪醇的密度一般小于1g·cm-3直链饱和一元醇的沸点随着分子中碳原子数的递增而升高沸点醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小化学性质由于醇类都以羟基为官能团,所以醇类的化学性质与乙醇相似,即能与活泼金属反应,能发生酯化反应、消去反应、取代反应、氧化反应等。
注意啦:在二元醇或多元醇的分子中,两个或两个以上的羟基结合在同一个碳原子上时,物质不能稳定存在(如:→)。
在写二元醇或多元醇的同分异构体时,要避免这种情况。
(4)重要的醇的用途①甲醇:有毒,饮用约10 mL就能使人双目失明。
工业酒精中含甲醇,甲醇是重要的化工原料和车用燃料。
②乙二醇和丙三醇:都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
乙二醇还用作汽车防冻液,丙三醇用于配制化妆品。
2.脂肪醇、芳香醇、酚和芳香醚的比较类别脂肪醇芳香醇酚芳香醚实例CH3CH2OH C6H5CH2OH C6H5OH C6H5OCH3官能团—OH—OH—OH—O—结构特点—OH与链烃基相连—OH与芳香烃侧链相连—OH与苯环直接相连氧原子连接2个烃基主要化学性质①与钠反应②取代反应③脱水反应④氧化反应⑤酯化反应等①弱酸性②取代反应③显色反应④加成反应等______特性红热铜丝插入醇中有刺激性气味(生成醛或酮)与FeCl3溶液反应显紫色______二、酚1.酚的概念和结构特征羟基与苯环直接相连而形成的化合物称为酚。
烃的含氧衍生物

CH3CH2CH2OH
CH2-OH
CH2-OH CH-OH CH2OH
体,都易溶于水和乙醇,是重要的化工原料。
乙二醇可用于汽车作防冻剂,丙三醇可用于配
制化妆品。
2、乙醇的结构
从乙烷分子中的 1 个 H 原 子 被 —OH (羟基)取代衍变成 乙醇
分子式 C2H6O 结构式 结构简式 CH3CH2OH 或C2H5OH 官能团 —OH (羟基)
烃分子中的氢原子可以被羟基(—OH)取 代而衍生出含羟基化合物。
羟基与烃基或苯环侧链上的碳原子相连的 化合物称为醇;羟基与苯环直接相连而形成的 化合物称为酚。 OH OH CH3CHCH3 CH3CH2OH CH3 OH
乙醇 2—丙醇 苯酚 邻甲基苯酚
一、醇 1.醇的分类
1)根据羟基所连烃基的种类
CH4 +Cl2
光照
CH3Cl+ HCl
2)不饱和烃与HX或X2加成 CH2==CH2+Br2 CH2BrCH2Br
△
3)醇与HX取代
C2H5OH + HBr
C2H5Br + H2O
③引入羟基(—OH) 1)烯烃与水的加成
催化剂
CH2==CH2 +H2O
加热加压
CH3CH2OH
2)醛(酮)与氢气加成
4、化学性质 1)弱酸性
苯酚能与碱反应,体现出它的弱酸性。因此, 苯酚俗称石炭酸。
ONa
OH
+CO2+H2O
+NaHCO3
说明:苯酚酸性很弱,比碳酸还弱。 2)与溴反应 OH + 3Br2 Br Br
OH
Br↓+3HBr
3)苯酚的显色反应
第三节 烃的含氧衍生物

教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
结束
2.现有以下物质:
①② , ③⑤ , (1)其中属于脂肪醇的有______ 属于芳香醇的有______ 属
④⑤ 。 于酚类的有________
教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
结束
④⑤ 。 (2)其中物质的水溶液显酸性的有________
CH3COOH+ _______________
CH3COOH (浓 硫酸)
① ____
浓H2SO4 取代 ____反应 CH3CH2OH △ ____________________
CH 3COOCH2CH3+H2O _______________________
教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
烃的含氧衍生物
结束
第三节 烃的含氧衍生物
教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
结束
3.1 教材复习
——打牢基础,基稳才能楼高
教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
结束
知识点 一 醇、酚
教
材
复
习
高
考
研
究
课下高考达标练
烃的含氧衍生物
结束
1.概念 (1)醇:羟基与烃基或苯环侧链上的碳原子相连的化合物称 为醇,饱和一元醇的组成通式为 CnH2n+1OH 或 CnH2n+2O 。 (2)酚:羟基与苯环 直接 相连而形成的化合物,最简单的酚
高中化学第3讲 烃的含氧衍生物(教案)

第3课时必备知识——烃的含氧衍生物[基本概念]①醇和酚;②醛和酮;③羧酸和酯;④酯化反应;⑤氧化反应和还原反应;⑥显色反应[基本规律]①醇类的催化氧化反应规律;②醇类的消去反应规律;③酯化反应的类型及规律;④烃的衍生物之间的转化及规律知识点1醇和酚的结构与性质一、醇的结构与性质1.醇的概念醇是羟基(—OH)与烃基或苯环侧链上的碳原子相连构成的化合物,饱和一元醇分子的通式为C n H2n+1OH或R—OH。
2.醇的分类3.醇的物理性质物理性质递变规律密度一元脂肪醇的密度一般小于1 g·cm-3沸点①直链饱和一元醇的沸点随着分子中碳原子数的递增而升高②醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小4.醇的化学性质由断键方式理解醇的化学性质(以乙醇为例),乙醇分子中可能发生反应的部位如下,填写表格内容:条件断键位置反应类型化学方程式Na ①置换反应2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑HBr,△②取代反应CH3CH2OH+HBr―→CH3CH2Br+H2OO2(Cu),△①③氧化反应2CH3CH2OH+O2――→Cu△2CH3CHO+2H2O浓硫酸,170 ℃②④消去反应CH3CH2OH――→浓硫酸170 ℃CH2===CH2↑+H2O浓硫酸,140 ℃①或②取代反应2CH3CH2OH――→浓硫酸140 ℃C2H5OC2H5+H2OCH3COOH/ (浓硫酸) ①酯化反应CH3CH2OH+CH3COOH浓H2SO4△CH3COOC2H5+H2O2.苯酚的物理性质3.苯酚的化学性质由于苯环对羟基的影响,使酚羟基比醇羟基活泼;由于羟基对苯环的影响,使苯酚中羟基邻、对位的氢比苯中的氢活泼而易取代。
[通关2] (2020·湖南长郡中学检测)咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。
《烃的含氧衍生物》课件

化学性质 氧化反应:可被多种氧化剂氧化
H 催化氧化:R-C-OH
H
与羟基相连的碳 原子有两个H
官能团:羟基(—OH)
醇 (乙醇)
与钠反应:与Na等活泼金属反应生成氢气 取代反应:与卤化氢、醇等发生取代反应
化学性质 氧化反应:可被多种氧化剂氧化
H 催化氧化:R-C-O-H
O R-C-H
H
官能团:羟基(—OH)
醇 (乙醇)
与钠反应:与Na等活泼金属反应生成氢气 取代反应:与卤化氢、醇等发生取代反应
化学性质 氧化反应:可被多种氧化剂氧化
H 催化氧化: R1-C-OH
R2
与羟基相连的碳 原子有一个H
官能团:羟基(—OH)
醇 (乙醇)
与钠反应:与Na等活泼金属反应生成氢气 取代反应:与卤化氢、醇等发生取代反应
酚 (苯酚)
化学性质
弱酸性:醋酸 > 碳酸 > 苯酚 > 碳酸氢根离子
取代反应:羟基的邻、对位氢原子易被取代
OH
H
H
H
官能团:羟基(—OH)
酚 (苯酚)
化学性质
弱酸性:醋酸 > 碳酸 > 苯酚 > 碳酸氢根离子 取代反应:羟基的邻、对位氢原子易被取代 显色反应:遇FeCl3溶液显紫色
官能团:羟基(—OH)
消去反应:与强碱的醇溶液共热, 脱去卤化氢,生成不饱和烃
-C-C- H Br
C=C
官能团:羟基(—OH)
醇 (乙醇)
与钠反应:与Na等活泼金属反应生成氢气
-C-C-O H
H2
化学性质
官能团:羟基(—OH)
醇 (乙醇)
与钠反应:与Na等活泼金属反应生成氢气 取代反应:与卤化氢、醇等发生取代反应
烃的含氧衍生物

(一)乙酸
1、乙酸的结构 C2H4O2
H O
分子式:
结构式
H
C C O H
H
O
结构简式
甲异丙醚
O CH3
第二节 醛和酮
O R(H/Ar) C H
O R(Ar) C R'(Ar')
醛基
酮基
醛、酮是一类重要的有机化合物,广泛分布于 自然界,其中有些是植物药中的有效成分。醛、酮 的化学性质非常活泼,也是有机合成中常见的中间 体,在工业生产、动植物生命活动中占有重要作用。
一、醛
醛类中具有代表性的醛-乙醛
(二)羧酸 结构: ①一元羧酸通式:R—COOH ②饱和一元羧酸的通式: CnH2n+1COOH 或 CnH2nO2 ③多元羧酸中含有多个羧基。 化学性质: (1)酸性 (2)酯化反应
第四节 酯和油脂
一、酯
酸跟醇起反应脱水后生成的一类化合物。 O →来自酸 1、酯类的结构: R-C-O-R′
来自醇
第六章
烃的含氧衍生物
学习目标
1、掌握乙醇、苯酚、乙醛和乙酸的主要化学性质。 2、理解醇、醛、酮、羧酸的命名方法。
3、了解酯和油脂的性质。
4、能进行乙醇、苯酚、乙醛、丙酮和乙酸的鉴别。
第一节 醇、酚、醚
醇、酚和醚都是烃的含氧衍生物。醇和酚在结构中都 含有相同的官能团——羟基(-OH)。醇可看作是脂肪烃、 脂环烃或芳香烃侧链上的氢原子被羟基取代而得的衍生物; 酚可看作是芳香环上的氢原子被羟基取代而得的衍生物。醇 中的羟基可称为醇羟基,是醇的官能团;酚中的羟基可称为 酚羟基,是酚的官能团。醚可看作是醇或酚分子中羟基上的
烃的含氧衍生物-醇

① 相对分子质量相近的醇和烷烃相比,醇的沸点 高于烷烃(醇中存在氢键)。 ② 饱和一元醇,随C原子数↗,沸点↗。
③ C原子数相同时,羟基数↗,沸点↗。
2)溶解性
① 低级醇(甲醇、乙醇、丙醇、乙二醇、丙三醇) 与水任意比互溶。 ②饱和一元醇,随C原子数↗,溶解性↘。
氢键
由于醇分子中羟基的氧原子与另一醇分子羟基 的氢原子间存在着相互吸引作用,这种吸引作 用叫氢键。
R R H H
O
H H O R H
O
H
O
H O R H
O
醇分子间的氢 键示意图
醇分子和水分子间的氢 键示意图
三、醇的命名(与烯烃相似)
(1)选主链 选含—OH的最长碳链为主链 (2)编号位 从离—OH最近的一端起编号 (3)写名称 取代基位置— 取代基名称 — 羟基位
置— 母体名称(羟基位置用阿拉伯数 字表示;羟基的个数用“二”、“三” 等表示。) CH2OH CH2OH CHOH CH2OH 1,2,3—丙三醇 (或甘油、丙三醇)
⑤
H
① ② H
H―C―C―O―H ③ ④H H
反应
与金属钠反应 Cu或Ag催化氧化 浓硫酸加热到170℃
断键位置
① ①③ ②④ ① 、② ① ②
浓硫酸加热到140℃ 浓硫酸条件下与乙酸加热
与HX加热反应
6、混合液颜色如何变化?为什么? 烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。 在加热的条件下,无水酒精和浓硫酸混合物的反 应除可生成乙烯等物质以外,浓硫酸还能将无水 酒精氧化生成碳的单质等多种物质,碳的单质使 烧瓶内的液体带上了黑色。
7、为何可用排水集气法收集? 因为乙烯难溶于水,密度比空气密度略小。 8、为何使液体温度迅速升到170℃? 因为无水酒精和浓硫酸混合物在170℃的温度下 主要生成乙烯和水,而在140℃时乙醇将以另一 种方式脱水,即分子间脱水,生成乙醚。
高考理综高三一轮高考化学复习 第11章 第3讲 烃的含氧衍生物

第3讲烃的含氧衍生物[考纲要求] 1.认识醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点,知道它们的转化关系。
2.结合生产、生活实际了解某些烃的衍生物对环境和健康可能产生的影响,关注有机化合物的安全使用问题。
考点一醇、酚1.醇、酚的概念(1)醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分子通式为C n H2n+1OH(n≥1)。
(2)酚是羟基与苯环直接相连而形成的化合物,最简单的酚为苯酚()。
(3)醇的分类2.醇类物理性质的变化规律(1)溶解性低级脂肪醇易溶于水。
(2)密度一元脂肪醇的密度一般小于1 g·cm-3。
(3)沸点①直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高。
②醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
3.苯酚的物理性质(1)纯净的苯酚是无色晶体,有特殊气味,易被空气氧化呈粉红色。
(2)苯酚常温下在水中的溶解度不大,当温度高于65_℃时,能与水互溶,苯酚易溶于酒精。
(3)苯酚有毒,对皮肤有强烈的腐蚀作用,如果不慎沾到皮肤上应立即用酒精洗涤。
4.醇和酚的化学性质(1)由断键方式理解醇的化学性质如果将醇分子中的化学键进行标号如图所示,那么醇发生化学反应时化学键的断裂情况如下表所示:(2)由于苯环对羟基的影响,酚羟基比醇羟基活泼;由于羟基对苯环的影响,苯酚中苯环上的氢比苯中的氢活泼。
①弱酸性电离方程式为C6H5OH C6H5O-+H+,俗称石炭酸,但酸性很弱,不能使石蕊试液变红。
写出苯酚与NaOH反应的化学方程式:。
②苯环上氢原子的取代反应苯酚与浓溴水反应,产生白色沉淀,化学方程式为。
③显色反应苯酚跟FeCl3溶液作用显紫色,利用这一反应可检验苯酚的存在。
深度思考1.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是__________,属于酚类的是__________。
答案CE BD2.设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
高中化学第三章烃的含氧衍生物知识点总结

学习必备欢迎下载醇酚一、认识醇和酚羟基与相连的化合物叫做醇;羟基与直接相连形成的化合物叫做酚。
二、醇的性质和应用1.醇的分类(1)根据醇分子中羟基的多少,可以将醇分为饱和一元醇的分子通式:(2)根据醇分子中羟基所连碳原子上氢原子数目的不同,可以分为2.醇的命名(系统命名法)一元醇的命名:选择含有羟基的最长碳链作为主链,把支链看作取代基,从离羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某醇” ,羟基在 1 位的醇,可省去羟基的位次。
多元醇的命名:要选取含有尽可能多的带羟基的碳链作为主链,羟基的数目写在醇字的前面。
用二、三、四等数字表明3.醇的物理性质(1)状态: C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇(Glycol )。
甲醇有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷。
且随着碳原子数的增多而。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
4.乙醇的结构分子式: C2H6O结构式:结构简式: CH3CH2OH5.乙醇的性质(1)取代反应A .与金属钠反应化学方程式:化学键断裂位置:对比实验:乙醇和 Na 反应现象:水和钠反应现象:乙醚和钠反应:无明显现象结论:①②B.与 HX 反应化学方程式:断键位置:实验(教材P68 页)现象:实验注意:烧杯中加入自来水的作用:C.乙醇的分子间脱水化学方程式:化学键断裂位置:〖思考〗甲醇和乙醇的混合物与浓硫酸共热生成醚的种类分别为D .酯化反应温度计必须伸入化学方程式:断键位置:(2)消去反应化学方程式:断键位置:实验装置: ( 如图 )注:乙醇的消去反应和卤代烃的消去反应类似,都属于β-消去,即羟基的β碳原子上必须有 H 原子才能发生该反应(3)氧化反应A .燃烧点燃CH 3CH 2OH + 3O2C x H y O z+O2[ 思考 ]某饱和一元醇与氧气的混合气体,经点燃后恰好完全燃烧,反应后混合气体的密度比反应前减小了1/5,求此醇的化学式(气体体积在105℃时测定)B.催化氧化化学方程式:断键位置:说明:醇的催化氧化是羟基上的H 与α- H 脱去[ 思考 ] 下列饱和一元醇能否发生催化氧化,若能发生,写出产物的结构简式CH3OH CH 3CH3 C CH2CH CH3CH3 C OH CH 3CH3(CH2)5CH2OH CH 3A B C结论:伯醇催化氧化变成仲醇催化氧化变成叔醇C.与强氧化剂反应乙醇能使酸性KMnO 4溶液褪色三、其它常见的醇(1)甲醇结构简式:物理性质:甲醇俗称木精,能与水任意比互溶,有毒,饮用10 毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
