卫生部颁药品标准(新药转正标准西药第八册)
新药转正标准目录(1-76册)
舒心口服液 复方羊角胶囊 潞党参膏滋 山海丹胶囊 绞股蓝总甙 绞股蓝总甙片 大黄通便冲剂 前列舒丸 静灵口服液 壬苯醇醚阴道片(壬苯醇醚外用片) 硝酸甘油气雾剂 注射用头孢唑肟钠 十一酸睾酮注射液 十一酸睾丸素注射液<曾用名> 布洛芬缓释胶囊 对乙酰氨基酚泡腾颗粒剂 扑热息痛泡痛颗粒剂 比沙可啶 比沙可啶片 醋酸麦迪霉素颗粒剂 美欧卡霉素干糖浆<曾用名> 复方氯乙烷气雾剂 注射用甲磺酸酚妥拉明 盐酸雷尼替丁注射液 盐酸可乐定滴眼液 硝酸异山梨酯乳膏 青蒿素 蛇胆陈皮液 华山参滴丸 发酵虫草菌粉 百令胶囊 ?莶通栓丸<<郗>> 藿香正气软胶囊 阿胶(液体) 桂灵片 小儿速泻停冲剂 羚羊角口服液 桂龙咳喘宁胶囊 黄连胶囊 速溶阿胶冲剂 蛇胆陈皮口服液 洋参保肺口服液 复方电解质葡萄糖注射液-M3A 复方电解质葡萄糖注射液-M3B 复方电解质葡萄糖注射液-R4A 盐酸纳洛酮 盐酸纳洛酮注射液 氢溴酸右美沙芬片 盐酸倍他啶口服液<曾用名> 盐酸倍他司汀口服液 柳氮磺吡啶栓 复方甘油注射液<曾用名> 甘油氯化钠注射液 诺氟沙星滴眼液 复方苯甲酸酊 诺氟沙星葡萄糖注射液 硝酸异山梨酯气雾剂 吲哚美辛搽剂 甲磺酸双氢麦角毒碱片 银杏叶口服液
麻仁胶囊 磺胺嘧啶锌 磺胺嘧啶锌软膏 复方卡托普利片 青蒿琥酯片 枸橼酸铋钾片 复方氨基酸注射液(15-HBC) 盐酸氟桂利嗪 盐酸氟桂利嗪胶囊 木芴醇 色甘酸钠滴眼液 安尔克注射液 吡罗昔康注射液 泊洛沙姆 萘普生注射液 盐酸氯米帕明 盐酸氯丙咪嗪 盐酸氯米帕明片 盐酸氯丙咪嗪片 止嗽定喘口服液 胃肠安丸 消食退热糖浆 银翘解毒冲剂 肾炎舒片 复方牵正膏 参芪片 止咳橘红口服液 三黄珍珠膏 骨刺消痛涂膜剂 香连片 铁笛口服液 肾炎温阳片 肾炎消肿片 桂附地黄口服液 维参锌胶囊 预胶化淀粉 可压性淀粉<曾用名> 阿昔洛韦片 注射用阿昔洛韦 吲达帕胺 吲达帕胺片 富马酸氯马斯汀 富马酸氯马斯汀片 盐酸马普替林 盐酸马普替林片 吲哚美辛乳膏 消炎痛乳膏 磺胺嘧啶速释片 碳酸锂缓释片 氯氟舒松涂剂 哈西缩松涂膜 氯硝西泮注射液 葛根芩连微丸 益气复脉口服液 止咳宝片 江南卷柏片 江南卷柏 江南卷柏干浸膏 妇炎康复片 心痛康胶囊
新药转正标准

新药转正标准新药的研发是医药行业的重要环节,而新药转正标准则是评价一种新药是否能够正式上市的重要依据。
在我国,新药转正标准的设定对于保障患者的用药安全、促进医药科研技术的发展具有重要意义。
因此,科学、合理地制定新药转正标准对于医药行业的发展具有重要的意义。
首先,新药转正标准应当充分考虑患者的用药安全。
患者的用药安全是医药行业的首要任务,因此新药转正标准的制定应当以患者的用药安全为核心。
新药的临床试验数据、药物毒理学数据、药代动力学数据等都应当得到充分的评估,并且需要进行全面的安全性评价,确保新药在市场上的使用不会对患者造成不良反应或其他安全隐患。
其次,新药转正标准应当充分考虑新药的疗效和有效性。
新药的疗效和有效性是患者选择药物的重要因素,因此新药转正标准的制定应当充分考虑新药在临床上的疗效和有效性。
临床试验数据、药物药效学数据等都应当得到充分的评估,并且需要进行全面的疗效评价,确保新药在市场上的使用能够达到预期的治疗效果。
此外,新药转正标准还应当充分考虑新药的生产工艺和质量控制。
新药的生产工艺和质量控制是保障新药质量的重要环节,因此新药转正标准的制定应当充分考虑新药的生产工艺和质量控制。
生产工艺的合理性、质量控制的可行性等都应当得到充分的评估,并且需要进行全面的生产工艺和质量控制评价,确保新药在市场上的使用能够保持稳定的质量。
综上所述,新药转正标准的制定应当充分考虑患者的用药安全、新药的疗效和有效性、新药的生产工艺和质量控制等多个方面,确保新药在市场上的使用能够达到预期的效果,并且不会对患者造成安全隐患。
只有科学、合理地制定新药转正标准,才能够推动医药科研技术的发展,保障患者的用药安全,促进医药行业的健康发展。
因此,新药转正标准的制定是医药行业的重要任务,需要引起各方的高度重视。
国家药品标准

药品管理法:国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。
第一百三十六条国家药品标准,是指国家食品药品监督管理局颁布的《中华人民共和国药典》、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。
药品注册标准,是指国家食品药品监督管理局批准给申请人特定药品的标准,生产该药品的药品生产企业必须执行该注册标准。
药品注册标准不得低于中国药典的规定
1.药典标准
2.卫生部中药成方制剂一至二十一册
3.卫生部化学、生化、抗生素药品第一分册
4.卫生部药品标准(二部)一册至六册;
5.卫生部药品标准藏药第一册、蒙药分册、维吾尔药分册;
6.新药转正标准1至88册(正不断更新)
7.国家药品标准化学药品地标升国标一至十六册;
8.国家中成药标准汇编内科心系分册、内科肝胆分册、内科脾胃分册、内科气血津液分册、内科肺系(一耳鼻喉皮肤科分册、经络肢体脑系分册;)、(二)分册、内科肾系分册、外科妇科分册、骨伤科分册、口腔肿瘤儿科分册、眼科
9.国家注册标准(针对某一企业的标准,但同样是国家药品标准)
10.进口药品标准
1级标准:就是《中国药典》(中华人民共和国药典),是药典委员会制定,每5 年修订一次。
2010年新版中国药典分3部,一部中药标准,二部化学药标准,三部生物制剂标准。
另外2010年版第一增补本自2012年10月1日起施行。
2级标准:是局颁标准(国家药监局)或部颁标准(卫生部),药品标准开头字母WS是卫生部批准的,药品标准开头字母
YB是国家药监局批准的。
3级标准:基本已经废除,一般是指各省、自治区、直辖市制定的中药炮制或中药饮片标准。
在药。
第15册卫生部颁药品标准(新药转正标准西药)(可编辑)

新药转正西药标准卫生部颁药品标准(新药转正标准西药第十五册)12种复方盐酸阿米洛利片拼音名:Fufang Yansuan Amiluoli Pian英文名:Compound Amiloride Hydrochloride Tablets书页号:x15-71 标准编号:WS1?X?220?98Z批准文号:(90)卫药准字X-138号(90)卫药准字X-138-2号本品每片含盐酸阿米洛利C6H8ClN7O?HCl应为2.25~2.75mg;含氢氯噻嗪C7H8ClNO4S2应为22.5~27.5mg。
【处方】盐酸阿米洛利 2.5g 氢氯噻嗪 25g 制成 1000片【性状】本品为类白色片。
【鉴别】在含量测定项下记录的色谱图中,供试品峰的保留时间应与对照品峰的保留时间一致。
【检查】含量均匀度取本品1片,置50ml 量瓶中,照含量测定项下的方法测定,应符合规定中国药典1995年版二部附录Ⅹ E。
溶出度取本品,照溶出度测定法中国药典1995年版二部附录Ⅹ C第一法,以0.1mol/L盐酸溶液900ml为溶剂,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml,滤过,滤液备用。
盐酸阿米洛利取上述溶液,照分光光度法中国药典1995年版二部附录Ⅳ A在365nm的波长处测定吸收度,另取经100℃减压干燥3小时的盐酸阿米洛利对照晶适量,加0.1ml/L盐酸溶液制成每1ml含2.5μg的溶液,同法测定吸收度,计算出每片的溶出量,限度为标示量的80%,应符合规定。
氢氯噻嗪取上述溶液1ml,置10ml量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀,照分光光度法中国药典1995年版二部附录Ⅳ A,在272nm波长处测定吸收度。
另取经105℃干燥1小时的氢氯噻嗪对照品,加0.1mol/L盐酸溶液制成每1ml含2.5μg的溶液;同法测定吸收度,计算出每片的溶出量,限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定中国药典1995年版二部附录Ⅰ A。
新药转正标准

新药转正标准随着科技的不断进步,新药的研发和上市已成为医药行业的重要环节。
然而,新药的研发和上市并非易事,需要经过严格的审批和评估。
在新药研发完成后,如何确定其转正标准成为了一个备受关注的问题。
本文将就新药转正标准进行探讨,以期为相关人士提供一些参考和借鉴。
首先,新药转正标准应当充分考虑其临床疗效。
临床疗效是新药能否转正的重要指标之一。
新药在临床试验中应当表现出显著的疗效,能够有效改善患者的症状,减轻疾病的痛苦,提高生活质量。
临床疗效的评价需要依据科学的临床试验数据和统计分析结果,确保评价的客观性和科学性。
其次,新药转正标准还应当考虑其安全性和耐受性。
安全性和耐受性是评价新药是否适合上市的重要指标之一。
新药在临床试验中应当表现出良好的安全性和耐受性,不会对患者造成严重的不良反应和副作用。
安全性和耐受性的评价需要依据充分的临床试验数据和统计分析结果,确保评价的客观性和科学性。
此外,新药转正标准还应当考虑其药物代谢和药动学特性。
药物代谢和药动学特性是评价新药是否适合上市的重要指标之一。
新药在临床试验中应当表现出良好的药物代谢和药动学特性,能够在人体内发挥出预期的药理作用,达到治疗的预期效果。
药物代谢和药动学特性的评价需要依据充分的临床试验数据和统计分析结果,确保评价的客观性和科学性。
综上所述,新药转正标准应当充分考虑其临床疗效、安全性和耐受性、药物代谢和药动学特性等因素,确保新药能够在上市后发挥出预期的治疗效果,为患者带来更多的福祉。
希望相关部门和专家学者能够共同努力,制定科学合理的新药转正标准,推动我国医药行业的健康发展,为人民群众提供更好的医疗保障。
国家药品标准新药转正标准

国家药品标准新药转正标准国家药品标准新药转正标准是指新药在经过临床试验并证实其安全性和有效性后,按照国家相关规定转为正式药品的标准。
新药转正标准的制定,对于保障人民群众用药安全、促进药品创新和发展具有重要意义。
首先,国家药品标准新药转正标准应当严格遵循科学、严谨、公正的原则。
在制定新药转正标准时,需要充分考虑药物的药理学、药代动力学、毒理学等方面的科学数据,并结合临床试验结果进行评估和分析,确保新药的安全性和有效性。
同时,还需要充分尊重专业机构和专家的意见,确保标准的科学性和公正性。
其次,国家药品标准新药转正标准应当注重与国际接轨。
随着全球化进程的加快,药品研发和监管已经越来越趋向于国际化。
因此,制定新药转正标准时,需要参考国际上先进的药品标准和规范,借鉴国际经验,促进我国药品标准与国际接轨,提高我国药品的国际竞争力。
再次,国家药品标准新药转正标准应当注重透明和公开。
在制定新药转正标准的过程中,应当建立健全的标准制定程序和机制,确保相关部门和专家的公正、透明和公开,接受社会各界的监督和评价。
同时,还需要建立健全的标准修订机制,及时对新药转正标准进行修订和更新,以适应新药研发和监管的需要。
最后,国家药品标准新药转正标准应当注重风险评估和管理。
在新药转正标准的制定过程中,需要充分考虑新药可能存在的风险和不确定性,建立健全的风险评估和管理体系,制定相应的风险控制措施,确保新药的安全性和有效性。
综上所述,国家药品标准新药转正标准的制定是一个复杂而严谨的过程,需要各方共同努力,确保新药转正标准的科学性、公正性和透明性,促进我国药品创新和发展,保障人民群众用药安全。
希望相关部门和专家能够加强合作,共同推动国家药品标准新药转正标准的制定和完善,为我国药品监管工作提供有力支持。
第21册 卫生部颁药品标准(新药转正标准西药)

新药转正西药标准卫生部颁药品标准(新药转正标准西药第二十一册)(15种)阿法骨化醇拼音名:Afa Guhuachun英文名:Alfacalcidol书页号:X21-584 标准编号:WS1-(X-081)- 2000ZC27H44O2 400.65本品为9,10-开环胆甾-5,7,10(19)-三烯-1,α,3β-二醇。
含C27H44O2应为标示量的97.5%~102.0%。
【性状】本品为白色结晶性粉末;无臭,无味。
遇光、湿、热均易变质。
本品在乙醇或二氯甲烷中易溶,在乙醚中溶解,在水中几乎不溶。
熔点本品的熔点(中国药典2000年版二部ⅥC)为137~142℃,熔融时同时分解。
比旋度取本品,精密称定,加无水乙醇溶解并定量稀释制成每1ml中含1.25mg的溶液,依法测定(中国药典2000年版二部附录ⅥE),比旋度为+46.0°至52.0°。
吸收系数取本品,精密称定,加无水乙醇溶解并定量稀释制成每1ml中约含10μg的溶液,照分光光度法(中国药典2000年版二部附录ⅣA),在265nm的波长处测定吸收度,吸收系数(E1% 1cm)为420~447。
【鉴别】(1)取本品约0.02mg,加氯仿0.2ml溶解后,加醋酸3滴与硫酸1滴,振摇,初显黄色,瞬间变红色,渐成黄绿色。
(2)本品的红外光吸收图谱(中国药典2000年二部附录ⅣC)应与对照品的图谱一致(3)在含量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品主峰的保留时间相同。
【检查】有关物质取本品,加流动相分别制成每1ml中含0.1mg的供试品溶液,与每1ml 中含1.5μg的对照溶液,照含量测定项下的色谱条件试验。
取对照溶液20μl,注入液相色谱仪进行预试,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的10%;再精密量取上述两种溶液各20μl,分别注入色谱仪,记录色谱图至主成分峰保留时间的2倍。
供试品溶液色谱图中如有杂质峰,量取各杂质峰面积的和,不得大于对照溶液主峰的峰面积(1.5%)。
新药转正标准

新药转正标准随着医学技术的不断进步,新药的研发和上市已成为医药行业的重要环节。
然而,新药的研发上市并非易事,需要经历严格的审批和转正标准。
本文将就新药转正标准进行探讨,以期为相关人士提供参考和指导。
首先,新药的转正标准需符合国家相关法律法规的规定。
国家药品监督管理局对新药的转正标准有着明确的规定,包括药物的安全性、有效性、质量控制等方面的要求。
只有符合国家法规的新药才能获得转正资格,才能在市场上合法销售和使用。
其次,新药的转正标准需要经过临床试验的验证。
临床试验是新药研发过程中至关重要的一环,只有通过临床试验并证明其安全有效,新药才能获得转正资格。
临床试验需要进行多阶段、多中心的研究,确保新药在不同人群和不同病情下的安全性和有效性。
除此之外,新药的转正标准还需考虑其与现有药物的比较。
新药需要证明其在疗效、安全性、用药方案等方面与现有药物相比具有明显优势,才能获得转正资格。
这也是为了保障患者的用药安全和疗效,避免新药的上市对患者造成不良影响。
另外,新药的转正标准还需考虑其生产工艺和质量控制。
新药的生产工艺需要符合国家药典的规定,确保药物的质量稳定可控。
同时,新药的质量控制也需要符合相关标准,包括原料药的质量、制剂的稳定性等方面的要求。
总的来说,新药的转正标准是一个综合性的评价体系,需要考虑药物的安全性、有效性、质量控制、临床试验、与现有药物的比较等多个方面。
只有符合这些方面的要求,新药才能获得转正资格,才能在市场上合法上市和销售。
因此,新药的研发和转正标准需要相关人士慎重对待,确保新药的安全有效,为患者的用药提供更多的选择和希望。
希望本文对新药转正标准有所帮助,谢谢阅读。
国家药品西药标准(化学药品地标升国标第八册)

国家药品西药标准国家药品西药标准(化学药品地标升国标第八册)(98种)阿司匹林双嘧达莫片拼音名:Asipilin Shuangmidamo Pian英文名:Aspirin and Dipyridamole Tablets书页号:D8-95 标准编号:WS-10001-(HD-0716)-2002本品含阿司匹林(C9H8O4)和双嘧达莫(C24H40N8O4)均应为标示量的90.0%~110.0%【处方】阿司匹林75g双嘧达莫25g辅料适量────────────────────制成1000片【性状】本品为肠溶衣与薄膜衣的双层包衣片,内层含阿司匹林,外层含双嘧达莫。
【鉴别】(1)取本品内层的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品内层的细粉适量(约相当于阿司匹林0.5g),加碳酸钠试液10ml,振摇后,放置5分钟,滤过,滤液煮沸2分钟,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)取本品外层的细粉适量(约相当于双嘧达莫25mg)加氯仿10ml搅拌,溶解,滤过,滤液置水浴上蒸干,取残渣溶于乙醇中,即显绿色荧光,加酸后,荧光消失。
(4)取双嘧达莫含量测定项下的溶液,照分光光度法(中国药典2000年版二部附录ⅣA)测定,在234nm和284nm波长处有最大吸收。
【检查】水杨酸照高效液相色谱法(中国药典2000年版二部附录ⅤD)测定色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(23:5:5:61)为流动相;检测波长为304nm。
理论板数按水杨酸峰计算应不低于2000。
测定法取本品10片,精密称定,研细,精密称取适量(约相当于阿司匹林25mg)置25ml量瓶中,加流动相适量,振摇使溶解,加流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;另取水杨酸对照品,加流动相制成每1ml中约含30μg的溶液,作为对照品溶液。
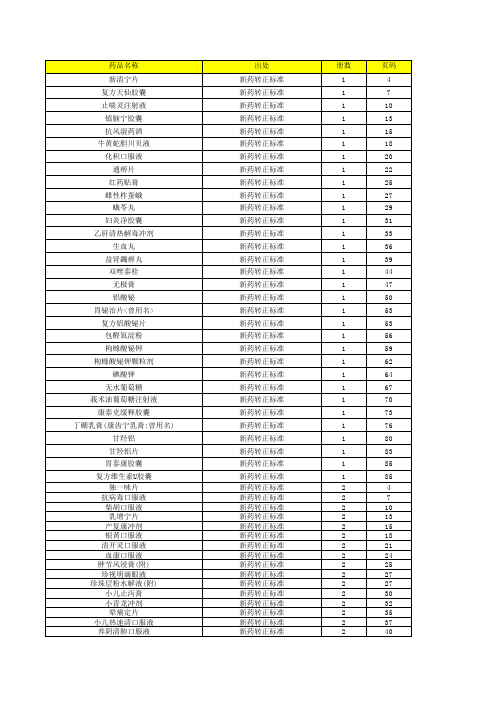
[精选]卫生部颁药品标准(新药转正标准西药第九册)资料
![[精选]卫生部颁药品标准(新药转正标准西药第九册)资料](https://img.taocdn.com/s3/m/6e750db85022aaea988f0f2c.png)
新药转正西药标准卫生部颁药品标准(新药转正标准西药第九册)(15种)对乙酰氨基酚滴剂拼音名:Duiyixian※anjifen Diji英文名:Paracetamol Drops书页号:X9-60 标准编号:WS1-(X-123)-96Z批准文号:(92)卫药准字X-76号(93)卫药准字X-160号本品含对乙酰氨基酚(C3H9NO2)应为标示量的90.0~110.0%。
【性状】本品为淡红色或红色的澄清液体;臭芳香,味微苦,可加适宜调味剂。
【鉴别】在含量测定项下记录的色谱图中,供试品峰的保留时间应与对照品峰的保留时间一致。
【检查】对氨基酚取本品,加水制成每1ml中含对乙酰氨基酚2.0mg 的供试品溶液;另取对氨基酚对照品,加水制成每1ml中含10μg的对照品溶液。
照含量测定项下的色谱条件,用外标法(中国药典1995年版二部附录ⅤD)测定,精密量取上述两种溶液各10μl,分别注入液相色谱仪,记录色谱图。
供试品溶液的色谱图中如出现与对照品溶液相应的对氨基酚峰,其峰面积不得大于对照品溶液主成分峰的峰面积(0.5%)。
相对密度本品的相对密度(中国药典1995年版二部附录ⅥA)为1.070 ~1.150。
pH值应为4.7~7.0(中国药典1995年版二部附录ⅥH)。
装量取本品,依法检查(中国药典1995年版二部附录ⅩF),应符合规定。
【含量测定】照高效液相色谱法(中国药典1995年版二部附录ⅤD)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,甲醇-0.05mol/L醋酸铵溶液(15:85)为流动相,检测波长为257nm。
理论板数按对乙酰氨基酚峰计算应不低于5000,对乙酰氨基酚峰与内标物质峰的分离度应符合要求。
内标溶液的制备取茶碱,加水制成每1ml中含1.0mg的溶液,摇匀,即得。
测定法精密量取本品适量,加水定量稀释制成每1ml中约含对乙酰氨基酚0.6mg的溶液,精密量取此溶液与内标溶液各5ml,置50ml量瓶中,用水稀释至刻度,摇匀,取10μl注入液相色谱仪,记录色谱图;另精密称取在105℃干燥至恒重的对乙酰氨基酚对照品适量,加水溶解并定量稀释制成每1ml中约含0.6mg的溶液,同法测定。
第03册 卫生部颁药品标准(新药转正标准西药)

新药转正西药标准卫生部颁药品标准(新药转正标准西药第三册)(15种)阿昔洛韦片拼音名:Axiluowei Pian英文名:TABELLAE ACICLOVIRI书页号:X3-52 标准编号:WS1-(X-033)-93Z批准文号:(90)卫药准字X-46号本品含阿昔洛韦(C8H11N5O3)应为标示量的93.0~107.0%。
【性状】本品为白色片。
【鉴别】(1) 取本品的细粉适量(约相当于阿昔洛韦10mg),加水10ml,振摇,滤过,取滤液加氨制硝酸银试液数滴,即产生白色絮状沉淀。
(2) 取本品的细粉适量(约相当于阿昔洛韦25mg),加氢氧化钠液(0.1mol/L)-甲醇(1:4)10ml,振摇,使阿昔洛韦溶解,滤过,取滤液作为供试品溶液;另取阿昔洛韦对照品,用氢氧化钠液(0.1mol/L)-甲醇(1∶4)制成每1ml中含2.5mg的溶液,作为对照品溶液,照薄层色谱法(按中国药典1990年版二部附录30页)试验,吸取上述两种溶液各5μl,分别点于同一硅胶GF<[254]>薄层板上,以氯仿-甲醇-水(70:29:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的位置应与对照品溶液的主斑点相同。
(3) 取含量测定项下的溶液,照分光光度法(中国药典1990年版二部附录24页)测定,在252nm的波长处有最大吸收。
【检查】应符合片剂项下有关的各项规定(中国药典1990年版二部附录3页)。
【含量测定】取本品20片,精密称定,研细,精密称出适量(约相当于阿昔洛韦40mg),置烧杯中先加热水约20ml,充分搅拌使阿昔洛韦溶解,置250ml量瓶中,再用热水约180ml分次洗涤烧杯,洗液并入量瓶中,放冷至室温,加水稀释至刻度,摇匀,滤过,弃去初滤液,精密量取续滤液5ml,置100ml量瓶中,加水稀释至刻度,摇匀,照分光光度法(中国药典1990年版二部附录24页),在252nm 的波长处测定吸收度,按C8H11N5O3的吸收系数(E1%1cm)为622计算,即得。
卫生部颁药品标准(新药转正标准西药第八册)

新药转正西药标准卫生部颁药品标准〔新药转正标准西药第八册〕(15种)复方氯化钾颗粒拼音名:Fufang Lühuajia Keli英文名:Compound Potassium Chloride Granules书页号:X8-50标准编号:WS1-(X-107)-96Z批准文号:〔91〕卫药准字X-158号本品含钾(K+)总量,按枯燥品计,应为标示量的90.0~110.0%。
【处方】氯化钾898g碳酸氢钾137gL-赖氨酸盐酸盐250g辅形剂适量矫味剂适量─────────────────────全量1600g【性状】本品为类白色或微黄色颗粒,加水溶解即有气泡产生。
【鉴别】(1)取本品约50mg,加水5ml使溶解,加茚三酮约5ml,加热即产生蓝紫色。
(2)取本品约1g,加水适量使溶解,加稀硫酸即泡沸,发生二氧化碳气;此气通入氢氧化钙试液中,即发生白色沉淀。
(3)本品的水溶液显钾盐与氯化物(中国药典1995年版二部附录Ⅲ)的鉴别反响。
【检查】总氯量取本品约0.3g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml与荧光黄指示液8滴,用硝酸银滴定液(0.1mol/L)滴定至溶液由黄绿色变为微红色。
每1ml的硝酸银滴定液(0.1mol/L)相当于3.545mg的Cl。
本品含氯量应为26.7~32.7%。
枯燥失重取本品,在60℃减压枯燥至恒重,减失重量不得过4.0%(中国药典1995年版二部附录ⅧL)。
其他应符合颗粒剂项下有关的各项规定(中国药典1995年版二部附录ⅠN)。
【含量测定】对照溶液的制备精密称取105℃枯燥至恒重的氯化钾0.2g,置500ml量瓶中,加水适量使溶解,并稀释至刻度,摇匀,精密量取上述溶液25ml,置100ml量瓶中,加水至刻度,摇匀,精密量取0.2、0.4、0.6、0.8、1.0ml,分别置25ml量瓶中,加水至刻度,摇匀。
供试品溶液的制备取本品10包,精密称定,研细,精密称取适量(约相当于钾1g)置1000ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加水稀释至刻度,摇匀。
11卫生部颁药品标准(新药转正标准中药第十一册)

新药转正中药标准卫生部颁药品标准(新药转正标准中药第十一册)(15种)阿胶补血口服液拼音名:Ejiao Buxue Koufuye英文名:书页号:X11-20 标准编号:WS3-74(Z-64)-96(Z)批准文号:(92)卫药准字Z-22号【处方】阿胶熟地黄党参黄芪枸杞子白术【性状】本品为深棕色液体;味微甜。
【鉴别】取本品5ml,加水15ml,搅匀,滤过,取滤液2ml,加茚三酮试液2滴,置沸水浴中加热5分钟,显紫红色。
【检查】相对密度应不低于1.05(中国药典1995年版一部附录ⅦA)。
pH值应为4.0~6.0(中国药典1995年版一部附录ⅦG)。
其他应符合合剂项下有关的各项规定(中国药典1995年版一部附录ⅠJ)。
【含量测定】精密量取本品0.2ml,照氮测定法(中国药典1995年版一部附录ⅨL第二法)测定,总氮量应不少于7.0mg/ml。
【功能与主治】滋阴补血,补中益气,健脾润肺。
用于久病体弱,血亏目眩,虚痨咳嗽。
【用法与用量】口服,一次20ml,早晚各一次或遵医嘱。
【规格】每支20ml【贮藏】密封,置阴凉处。
【使用期限】2年。
阿胶颗粒拼音名:Ejiao Keli英文名:书页号:X11-11 标准编号:WS3-88(Z-13)-96(Z)批准文号:(92)卫药准字Z-01号本品为阿胶经干燥、粉碎,制成的颗粒。
【性状】本品为棕色颗粒或粉末;气香,味微甘。
【检查】水分取本品1g,精密称定,照水分测定法(中国药典1995年版一部附录ⅨH烘干法)测定,不得过7.0%。
总灰分取本品1g,精密称定,照灰分测定法(中国药典1995年版一部附录ⅨK)测定,不得过1.1%。
重金属砷盐应符合阿胶项下有关的各项规定(中国药典1995年版一部513页)。
挥发性碱性物质精密称取本品5g,置100ml量瓶中,加水使溶解并稀释至刻度,摇匀,精密量取5ml置凯式蒸馏瓶中,立刻加1%氢氧化镁混悬溶液5ml,迅速密塞,通入水蒸气进行蒸馏,以2%硼酸溶液5ml为接收液,加甲基红-溴甲酚绿混合指示液5滴,从滴出第一滴凝结水珠时起,蒸馏7分钟停止,馏出液照氮测定法(中国药典1995年版一部附录ⅨL第二法)滴定,即得。
新药转正标准

新药转正标准
新药转正标准是指新药从临床试验阶段成功转化为市场上销售的标准。
新药的研发和上市是一个复杂而又严格的过程,其中新药转正标准是至关重要的一环。
本文将从药物临床试验、药物质量标准、药物生产工艺等几个方面来探讨新药转正标准的相关内容。
首先,药物临床试验是新药转正的重要环节。
临床试验是指在人体上进行的药物试验,其目的是评价药物的安全性和有效性。
在临床试验阶段,药物需要经历临床前研究、临床试验设计、临床试验执行和临床试验报告等多个环节。
只有经过严格的临床试验,并获得相关部门的批准,药物才能进入下一阶段的生产制造。
其次,药物质量标准也是新药转正的重要考量因素。
药物质量标准是指药物在生产过程中应符合的一系列标准和规定,包括药物的纯度、稳定性、溶解度等多个方面。
只有符合相关的药物质量标准,药物才能保证在生产和使用过程中的质量和安全。
此外,药物生产工艺也是新药转正的关键环节之一。
药物生产工艺是指药物从原料到成品的整个生产过程,包括原料的采购、生产工艺的设计、生产设备的选择等多个方面。
在药物生产工艺中,需要严格按照相关的法规和标准进行操作,确保药物的生产过程符合规范,从而保证药物的质量和安全。
综上所述,新药转正标准涉及到药物临床试验、药物质量标准、药物生产工艺等多个方面,是一个综合性的考量。
只有在这些方面都符合相关的标准和规定,新药才能成功转正并投放市场。
因此,对于新药的研发和上市,需要严格遵循相关的法规和标准,确保新药的质量和安全,为人们的健康提供保障。
新药转正标准

新药转正标准新药转正标准是指新药从临床试验阶段成功转化为正式上市销售的标准。
在医药领域,新药的研发和上市流程是一个复杂而严谨的过程,而新药转正标准则是其中至关重要的一环。
新药的转正标准不仅关乎药品的质量和安全,更关系到患者的生命和健康,因此,对新药转正标准的制定和执行必须十分慎重和严格。
首先,新药转正标准需要符合国家相关法律法规的要求。
国家药品监督管理局制定了一系列关于新药上市的法规和标准,新药必须符合这些法规和标准才能获得批准上市。
这些法规和标准包括对药物的质量、疗效、安全性等方面的要求,确保新药在临床应用中能够达到预期的治疗效果,并且不会对患者造成不良反应。
其次,新药转正标准还需要考虑到临床试验的结果。
在新药研发过程中,需要进行临床试验来验证药物的疗效和安全性。
新药转正标准要求对临床试验结果进行全面、客观的评估,确保新药的疗效和安全性能够得到可靠的验证。
只有在临床试验结果符合要求的情况下,新药才能获得转正的资格。
此外,新药转正标准还需要考虑到药物的生产工艺和质量控制。
新药的生产工艺和质量控制是保证药品质量稳定的关键环节,也是新药转正标准的重要内容。
药品生产工艺应符合国家药典的规定,确保药品的生产过程符合质量管理的要求。
同时,药品的质量控制需要建立完善的体系,对药品进行全面、系统的监控,确保药品的质量稳定可靠。
最后,新药转正标准还需要考虑到药品的市场需求和竞争情况。
新药上市后,将面临着市场的竞争和患者的需求,因此新药转正标准也需要考虑到这些因素。
新药需要符合市场的需求,满足患者的治疗需求,并且在竞争激烈的市场中具有一定的竞争优势,才能够获得成功的转正。
综上所述,新药转正标准是一个综合性的标准体系,需要考虑到法律法规、临床试验、生产工艺、质量控制、市场需求等多个方面的因素。
只有在这些方面都符合要求的情况下,新药才能成功转正并上市销售。
因此,对新药转正标准的制定和执行必须高度重视,确保新药在上市后能够为患者带来更多的治疗选择,提高患者的生活质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新药转正西药标准卫生部颁药品标准(新药转正标准西药第八册)(15种)复方氯化钾颗粒拼音名:Fufang Lühuajia Keli英文名:Compound Potassium Chloride Granules书页号:X8-50标准编号:WS1-(X-107)-96Z批准文号:(91)卫药准字X-158号本品含钾(K+)总量,按干燥品计,应为标示量的90.0~110.0%。
【处方】氯化钾898g碳酸氢钾137gL-赖氨酸盐酸盐250g辅形剂适量矫味剂适量─────────────────────全量1600g【性状】本品为类白色或微黄色颗粒,加水溶解即有气泡产生。
【鉴别】(1)取本品约50mg,加水5ml使溶解,加茚三酮约5ml,加热即产生蓝紫色。
(2)取本品约1g,加水适量使溶解,加稀硫酸即泡沸,发生二氧化碳气;此气通入氢氧化钙试液中,即发生白色沉淀。
(3)本品的水溶液显钾盐与氯化物(中国药典1995年版二部附录Ⅲ)的鉴别反应。
【检查】总氯量取本品约0.3g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml与荧光黄指示液8滴,用硝酸银滴定液(0.1mol/L)滴定至溶液由黄绿色变为微红色。
每1ml的硝酸银滴定液(0.1mol/L)相当于3.545mg的Cl。
本品含氯量应为26.7~32.7%。
干燥失重取本品,在60℃减压干燥至恒重,减失重量不得过4.0%(中国药典1995年版二部附录ⅧL)。
其他应符合颗粒剂项下有关的各项规定(中国药典1995年版二部附录ⅠN)。
【含量测定】对照溶液的制备精密称取105℃干燥至恒重的氯化钾0.2g,置500ml量瓶中,加水适量使溶解,并稀释至刻度,摇匀,精密量取上述溶液25ml,置100ml量瓶中,加水至刻度,摇匀,精密量取0.2、0.4、0.6、0.8、1.0ml,分别置25ml量瓶中,加水至刻度,摇匀。
供试品溶液的制备取本品10包,精密称定,研细,精密称取适量(约相当于钾1g)置1000ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加水稀释至刻度,摇匀。
精密量取0.6ml,置25ml量瓶中,加水稀释至刻度,摇匀。
测定法取对照溶液及供试品溶液,照原子吸收分光光度法(中国药典1995年版二部ⅣD),在766.5nm的波长处分别测定吸收度,计算,即得。
【作用与用途】电解质补充药。
用于治疗低钾血症及洋地黄中毒引起的心律失常。
【用法与用量】口服一次1~2包一日3~6包【注意】肾功能不全者慎用。
【规格】 1.6g(相当于钾0.5244g)。
【贮藏】密封,在干燥处保存。
【有效期】2年。
注:曾用名为氯化钾颗粒。
阿莫西林片拼音名:Amoxilin Pian英文名:Amoxincillin Tablets书页号:X8-48标准编号:WS1-(X-106)-96Z批准文号:(88)卫药准字X-27号本品含阿莫西林(C16H19N3O5S)应为标示量的90.0~110.0%。
【性状】本品为白色或类白色片。
【鉴别】照阿莫西林项下的鉴别法(1)(2)(3)(4)项(中国药典1995年版二部332页)试验,显相同的结果。
【检查】应符合片剂项下有关的各项规定(中国药典1995年版二部附录ⅠA)。
【含量测定】取本品10片,精密称定,研细,精密称取适量,照阿莫西林项下的方法(中国药典1995年版332页)测定,即得。
【作用与用途】抗生素类药。
用于敏感菌引起的上呼吸道感染、咽炎、扁桃体炎急慢性支气管炎、肺炎、支气管扩张症、尿路感染、皮肤及软组织感染等。
【用法与用量】口服一次0.5~1g一日3~4次小儿每日每公斤体重50~100mg,分3~4次服用。
【注意】对青霉素过敏者禁用。
用前需做青霉素钠的皮内敏感试验, 阳性反应者禁用。
【规格】按C16H19N3O5S计算(1)0.125g(2)0.25g【贮藏】遮光,密封保存。
【有效期】2年注:曾用名为羟氨苄青霉素片氨酚待因片(Ⅱ)拼音名:Anfendaiyin Pian(Ⅱ)英文名:Paracetamol and Codeine Phosphate Tablets(Ⅱ)书页号:X8-71标准编号:WS1-(X-115)-96Z批准文号:(93)卫药准字X-138-2号本品每片中含对对乙酰氨基酚(C8H9NO2)应为270~330mg;含磷酸可待因(C18H21NO3·H3PO4·1 1/2H2O)13.5~16.5mg。
【处方】对乙酰氨基酚300g磷酸可待因15g辅料适量───────────────────────制成1000片【性状】本品为白色片。
【鉴别】(1)取本品的细粉约0.1g,加水10ml,振摇,使对乙酰氨基酚溶解,滤过,滤液中加三氯化铁试液,即显著紫色。
(2)取本品的细粉约0.5g,加水5ml,振摇,使磷酸可待因溶解,滤过,滤液置分液漏斗中,滴加氨试液使成碱性,再加氯仿10ml,振摇,分取氯仿液,置水浴上蒸干,残渣中加含亚硒酸2.5mg的硫酸0.5ml,立即显绿色,渐变为蓝色。
(3)取本品的细粉约0.2g,置具塞锥形瓶中,加甲醇25ml,振摇,使对乙酰氨基酚和磷酸可待因溶解,滤过,取续滤液作为供试品溶液。
另取对乙酰氨基酚和磷酸可待因加甲醇溶解,制成每1ml中含对乙酰氨基酚6mg,含磷酸可待因0.3mg的溶液,作为对照溶液,照薄层色谱法(中国药典1995年版二部附录ⅤB)试验。
吸取上述两种溶液各5μl,分别点于同一硅胶GF<[254]>薄层板上,以醋酸乙酯-甲醇-浓氨溶液(85:10:5)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品所显两种成分的主斑点暗斑的位置,应与对照溶液的主斑点相同。
当再喷以稀碘化铋钾试液时,供试品溶液应显一个与对照溶液磷酸可待因位置与颜色相同的色斑。
【检查】含量均匀度磷酸可待因取本品1片,置小烧杯中,加水研磨溶解,用水分次洗入50ml量瓶中,超声溶解10分钟,加水稀释至刻度,摇匀,经滤膜(孔径不得大于0.45μm)滤过,精密量取续滤液5ml,置25ml量瓶中,加流动相稀释至刻度,摇匀,作为供试品溶液;另取在105℃干燥至恒重的磷酸可待因对照品约15mg,精密称定,置50ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取5ml,置25ml量瓶中,加流动相稀释至刻度,摇匀,作为对照品溶液,照含量测定项下的方法测定,计算,应符合规定(中国药典1995年版二部附录ⅩE)。
溶出度磷酸可待因,对乙酰氨基酚取本品,照溶出度测定法(中国药典1995年版二部附录ⅩC第一法),以水900ml为溶剂,转速为每分钟100转,依法操作。
经30分钟时,取溶液2ml,用滤膜(孔径不得大于0.45μm)滤过,取续滤液作为供试品溶液。
对照品溶液同含量测定项下对照品溶液的制备方法。
取供试品溶液20μl,对照品溶液10μl,照含量测定项下的方法测定,计算出每片的溶出量。
限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定(中国药典1995年版二部附录ⅠA)。
【含量测定】照高效液相色谱法(中国药典1995年版二部附录ⅤD)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,以0.05mol/L 磷酸二氢钾-甲醇-四氢肤喃(800:100:37.5)为流动相;检测波长为280nm;理论板数按磷酸可待因计算应不低于2500,对乙酰氨基酚和磷酸可待因的分离度应符合要求。
对照品溶液的制备取在105℃干燥至恒重的磷酸可待因对照品约15mg,精密称定,置50ml量瓶中,加水溶解,并稀释至刻度,摇匀,作为磷酸可待因对照品溶液。
另取对乙酰氨基酚对照品30mg,精密称定,置25ml量瓶中,加甲醇约1ml溶解后,精密加入磷酸可待因对照品溶液5ml,用流动相稀释至刻度,摇匀,即得。
供试品溶液的制备取本品20片,精密称定,研细,精密称取适量(约相当于磷酸可待因15mg,对乙酰氨基酚300mg),置50ml量瓶中,加水30ml,置超声波发生器中超声10分钟,加水至刻度,摇匀,用滤膜(孔径不得大于0.45μm)滤过,精密量取续滤液5ml,置25ml量瓶中,加流动相稀释至刻度,摇匀,即得。
测定法精密量取对照品溶液和供试品溶液10μl,分别注入液相色谱仪, 根据对应的各自峰面积计算含量,即得。
在计算磷酸可待因含量时,应代入换算系数1.068。
【作用与用途】镇痛药。
用于各种手术后疼痛,中度癌症疼痛,亦可用于头痛、神经痛、骨关节痛、牙痛及痛经等。
【用法与用量】口服,成人一次1片,一日3次。
中度癌症疼痛,必要时可由医生决定适当增加。
7岁以上小儿用量酌减,连续使用一般不超过5天,7岁以下小儿不宜使用。
【注意】长期用药可致依赖性。
对病因未确诊的疼痛慎用,肝、肾功能不全患者、孕妇及小儿慎用。
【贮藏】遮光、密闭保存。
【有效期】3年。
丙戊酸镁拼音名:Bingwusuanmei英文名:Magnesium Valproate书页号:X8-59标准编号:WS1-(X-110)-96Z批准文号:(89)卫药准字X-67号C16H30MgO4=310.72本品为2-丙基戊酸镁。
按干燥品计算,含丙戊酸镁(C16H30MgO4)不得少于98.0%。
【性状】本品为白色结晶性粉末或颗粒,微有丙戊酸臭。
本品在稀酸中略溶,在水及乙醇中微溶。
【鉴别】(1)取本品约0.1g,加水10ml,加热使溶解后,加苯1ml,1%醋酸氧铀溶液1~2滴与罗丹明B饱和苯溶液1~2滴,摇匀,苯层即显粉红色,在紫外光灯下显橙色荧光。
(2)取本品约2g,加水50ml,加热使溶解,放冷,加稀硫酸约5ml,使溶液呈酸性,再加乙醚15ml,振摇,放置使分层,水溶液显镁盐的鉴别反应(中国药典1995年版二部附录Ⅲ)。
(3)取本品约0.1g,加水10ml,振摇15分钟,滤过,滤液蒸干,残渣的红外光吸收图谱应与对照的图谱(光谱集66图)一致。
【检查】碱度取本品1.0g,加水20ml溶解后,依法测定(中国药典1995年版二部附录ⅥH),pH值应为8.0~10.0。
有关物质取鉴别(2)项下的乙醚提取液,挥干,残渣照气相色谱法(中国药典1995年版二部附录ⅥE),加1%磷酸,硅烷化白色担体色谱柱(用丙戊酸计算的塔板数应不低于1000),在柱温160±10℃下测定,记录色谱图至主成分峰保留时间的2倍,计算杂质峰面积不得超过总峰面积的1.5%。
干燥失重取本品,在105℃干燥至恒重,减失重量不得过2.0%(中国药典1995年版二部附录ⅧL)。
重金属取本品1.0g,加稀盐酸10ml与水20ml,加热煮沸,放冷,置分液漏斗中,加乙醚15ml,振摇,静置使分层。
分取水层,加氨试液至呈中性,置水浴上浓缩至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml,依法检查(中国药典1995年版二部附录ⅧH第一法),含重金属不得超过百万分之二十。
