微观模型与分子动理论
大学物理-气体分子动理论

v
v1 v2 v3 … …
N ΔN1 ΔN2 ΔN3 … …
速率为 vi 的概率为:
Pi
Ni N
长时间“观测”理想气体分子的速率 v :
v
0 ~ +∞ 连续分布
速率为 v → v + dv 的概率为:
Pv~vdv
dNv N
0
???
速率分布函数
Pv~vdv
dNv N
f (v)dv
f (v) dNv Ndv
刚性双原子分子的动能
分子动能
平动动能
t x
t y
t z
转动动能
r
r
t x
t y
t z
r
r
1 kT 2
t x
t y
t z
r
r
5 kT 2
温度较高时,双原子气体分子不能看作刚性分子,分子
平均能量更大,因为振动能量也参与能量均分
理想气体分子的平均能量
分子模型 刚性单原子分子 刚性双原子分子 刚性多原子分子
每个分子频繁地发生碰撞,速度也因此不断变化;
二、压强形成的微观解释
单个分子与器壁碰撞 冲力作用瞬间完成,大小、位置具有 偶然性;
大量分子(整个气体系统)与器壁碰撞 气体作用在器壁上是一个持续的、不 变的压力;
压强是气体分子给容器壁冲量的 统计平均量
三、理想气体的压强公式
建立三维直角坐标系 Oxyz
vz i N
气体处于平衡态时,气体分子沿各个方向运动的机会均等。
vx vy vz
气体分子速率平方的平均值
v v1 v2 v3 … …
N ΔN1 ΔN2 ΔN3 … …
v
新高考物理考试易错题易错点30分子动理论内能附答案

易错点30 分子动理论 内能易错总结1.与阿伏加德罗常数相关的物理量宏观量:摩尔质量M 、摩尔体积V mol 、物质的质量m 、物质的体积V 、物质的密度ρ; 微观量:单个分子的质量m 0、单个分子的体积V 0其中密度ρ=m V =M V mol ,但是切记ρ=m 0V 0是没有物理意义的.2.微观量与宏观量的关系 (1)分子质量:m 0=M N A =ρV molN A.(2)分子体积:V 0=V mol N A =MρN A (适用于固体和液体).(对于气体,V 0表示每个气体分子所占空间的体积) (3)物质所含的分子数:N =nN A =m M N A =VV mol N A .3.两种分子模型 (1)球体模型固体和液体可看作一个一个紧挨着的球形分子排列而成,忽略分子间空隙,如图甲所示.d =36V 0π=36V molπN A (V 0为分子体积). (1)立方体模型气体分子间的空隙很大,把气体分成若干个小立方体,气体分子位于每个小立方体的中心,每个小立方体是每个气体分子平均占有的活动空间,忽略气体分子的大小,如图乙所示.d =3V 0=3V molN A (V 0为每个气体分子所占据空间的体积). 4.扩散现象(1)扩散现象是由物质分子的无规则运动产生的.(2)气体物质的扩散现象最显著;常温下物质处于固态时扩散现象不明显.(3)扩散现象发生的显著程度与物质的温度有关,温度越高,扩散现象越显著,这表明温度越高,分子运动得越剧烈. (4)分子运动的特点 ①永不停息;②无规则.5.布朗运动(1)微粒的大小:做布朗运动的微粒是由许多分子组成的固体颗粒而不是单个分子.其大小直接用人眼观察不到,但在光学显微镜下可以看到(其大小在10-6 m的数量级).(2)布朗运动产生的原因:液体分子不停地做无规则运动,不断地撞击微粒.如图,悬浮的微粒足够小时,来自各个方向的液体分子撞击作用力不平衡,在某一瞬间,微粒在某个方向受到的撞击作用较强,在下一瞬间,微粒受到另一方向的撞击作用较强,这样,就引起了微粒的无规则运动.(3)实质及意义:布朗运动实质是由液体分子与悬浮微粒间相互作用引起的,反映了液体分子的无规则运动.(4)影响因素①悬浮的微粒越小,布朗运动越明显.②温度越高,布朗运动越激烈.6.热运动(1)分子的“无规则运动”,是指由于分子之间的相互碰撞,每个分子的运动速度无论是方向还是大小都在不断地变化.(2)热运动是对于大量分子的整体而言的,对个别分子无意义.(3)分子热运动的剧烈程度虽然受到温度影响,温度高分子热运动快,温度低分子热运动慢,但分子热运动永远不会停息.7.气体压强的产生单个分子碰撞器壁的冲力是短暂的,但是大量分子频繁地碰撞器壁,就会对器壁产生持续、均匀的压力.所以从分子动理论的观点来看,气体的压强等于大量气体分子作用在器壁单位面积上的平均作用力.8.决定气体压强大小的因素(1)微观因素①与气体分子的数密度有关:气体分子数密度(即单位体积内气体分子的数目)越大,在单位时间内,与单位面积器壁碰撞的分子数就越多,气体压强就越大.②与气体分子的平均速率有关:气体的温度越高,气体分子的平均速率就越大,每个气体分子与器壁碰撞时(可视为弹性碰撞)给器壁的冲力就越大;从另一方面讲,分子的平均速率越大,在单位时间内器壁受气体分子撞击的次数就越多,累计冲力就越大,气体压强就越大.(2)宏观因素①与温度有关:体积一定时,温度越高,气体的压强越大.②与体积有关:温度一定时,体积越小,气体的压强越大.9.气体压强与大气压强的区别与联系气体压强大气压强区别①因密闭容器内的气体分子的数密度一般很小,由气体自身重力产生的压强极小,可忽略不计,故气体压强由气体分子碰撞器壁产生②大小由气体分子的数密度和温度决定,与地球的引力无关③气体对上下左右器壁的压强大小都是相等的①由于空气受到重力作用紧紧包围地球而对浸在它里面的物体产生的压强.如果没有地球引力作用,地球表面就没有大气,从而也不会有大气压强②地面大气压强的值与地球表面积的乘积,近似等于地球大气层所受的重力值③大气压强最终也是通过分子碰撞实现对放入其中的物体产生压强联系两种压强最终都是通过气体分子碰撞器壁或碰撞放入其中的物体而产生的10.分子力、分子势能与分子间距离的关系(如图所示)分子间距离r r=r0r>r0r<r0分子力F 等于零表现为引力表现为斥力分子力做功W 分子间距增大时,分子力做负功分子间距减小时,分子力做负功分子势能E p最小随分子间距的增大而增大随分子间距的减小而增大由分子间的相对位置决定,随分子间距离的变化而变化.分子势能是标量,正、负表示的是大小,具体的值与零势能点的选取有关.12.分子势能的影响因素(1)宏观上:分子势能跟物体的体积有关.(2)微观上:分子势能跟分子间距离r有关,分子势能与r的关系不是单调变化的.13.内能的决定因素(1)宏观因素:物体内能的大小由物质的量、温度和体积三个因素决定,同时也受物态变化的影响.(2)微观因素:物体内能的大小由物体所含的分子总数、分子热运动的平均动能和分子间的距离三个因素决定.14.温度、内能和热量的比较(1)温度宏观上表示物体的冷热程度,是分子平均动能的标志.(2)内能是物体中所有分子的热运动动能与分子势能的总和.(3)热量指在热传递过程中,物体吸收或放出热的多少.15.内能和机械能的区别与联系易错类型:对物理概念理解不透彻1.(2021·全国高三课时练习)以下所述现象中,属于通过热传递改变了物体内能的是()A.将一段铁丝反复弯折,弯折处会发热B.放在空气中的一杯热水会冷却C.在转动的砂轮上磨车刀,车刀发热D.电流通过电阻丝【答案】B【详解】弯折铁丝是用力对物体做功,在转动的砂轮上磨车刀是摩擦力做功,电流通过电阻丝做功,三者都是通过做功改变物体的内能,热水放在空气中,通过热辐射等方式向外传递了热量,自身的内能减少,温度下降,是通过热传递方式改变的内能。
分子动理论的基本内容

分子动理论的基本内容
分子动理论是研究物质微观结构和宏观性质之间关系的理论,它是热力学和统计物理学的基础,对于理解物质的热力学性质和运动规律具有重要意义。
分子动理论的基本内容包括分子的运动状态、分子间的相互作用以及与宏观性质的关联等方面。
首先,我们来看分子的运动状态。
根据分子动理论,分子具有三种基本的运动状态,即平动、转动和振动。
平动是指分子沿各个方向做直线运动,转动是指分子围绕自身中心进行旋转运动,振动是指分子内部原子相对位置的周期性变化。
这些运动状态决定了物质的宏观性质,如固体、液体和气体的状态。
其次,分子间的相互作用也是分子动理论的重要内容。
分子之间存在各种相互作用力,包括范德华力、静电力、共价键和离子键等。
这些相互作用力决定了物质的热力学性质,如融化点、沸点、热容等。
此外,分子间的相互作用还决定了物质的化学性质,如溶解度、反应活性等。
最后,分子动理论还涉及到分子与宏观性质之间的关联。
根据分子动理论,宏观性质可以通过分子的平均运动状态来描述,如温度可以看作是分子平均动能的度量,压强可以看作是分子对容器壁的撞击力。
因此,分子动理论为我们提供了一种从微观角度理解宏观性质的方法,为热力学和统计物理学的发展提供了重要的理论基础。
总之,分子动理论是研究物质微观结构和宏观性质之间关系的重要理论,它涉及到分子的运动状态、分子间的相互作用以及与宏观性质的关联。
通过深入理解分子动理论的基本内容,我们可以更好地理解物质的性质和行为,为科学研究和工程实践提供理论指导。
分子动力学的理论及应用

分子动力学的理论及应用分子动力学是一种重要的计算化学方法,用来模拟复杂分子体系的动力学行为。
它从微观角度描述了分子系统的运动和相互作用,可应用于化学、材料学、生物学等多个领域。
本文将介绍分子动力学的基本理论和应用。
一、分子动力学的理论分子动力学核心在于牛顿第二定律,即F=ma。
该定律强调了物体所受到的力和它所产生的加速度之间的关系。
在分子动力学中,分子作为物体,其受力情况和加速度可通过势能函数来描述。
分子系统的能量可通过哈密顿量求得,其中包括分子所受到的所有势能和动能。
为了求解分子的动力学行为,需要进行时间演化。
具体地,需要在短时间内求解分子所受到的力,在此基础上根据分子的质量和加速度来更新分子的位置和速度。
这一过程类似于在离散时间点上计算微分方程。
在分子动力学中,最关键的参数是分子势能函数。
势能函数的形式多种多样,包括经验关系式、量子化学方法和经验分子力场等。
其中,经验分子力场最为常见,其包含了许多常见分子的实验数据,并将这些数据拟合到一个函数形式上。
二、分子动力学的应用分子动力学应用范围极广,常用于计算化学、材料学和生物学等领域。
以下是三个领域的典型应用:1. 计算化学多数化学反应的步骤很难通过实验分析。
分子动力学为计算化学提供了一种可靠的方法,可模拟和计算反应的中间态和过渡态。
这种方法可以为了解化学反应的机理提供深入的视角。
2. 材料学分子动力学也可用于研究材料的物理特性。
例如,可通过模拟来研究硅材料的分子运动、固态异质性等。
这种方法对于材料表面和表面处理技术的研究相当重要。
3. 生物学生物体系是极其复杂的,分子动力学可用于揭示生物分子之间的相互作用和运动。
例如,分子动力学模拟可以被用来研究蛋白质的折叠过程、膜生物学等。
特别是在新药开发中,分子动力学可为药物分子的设计和优化提供有价值的信息。
三、结论综上所述,分子动力学是一种强大的计算化学方法,用于预测分子系统和化学反应的医学性能。
分子动力学理论和技术的不断发展,使其在化学、材料学和生物学等多个领域具有重要的应用。
大学物理第16章气体动理论

pA
lim N
NA N
1 2
抛硬币的 统计规律
2020/1/15
DUT 余 虹
4
16.1 理想气体的压强
一、分子的作用力与压强
总数N 个,分子质量m ,摩尔质量,
体积V,温度T。
F
气体分子频繁碰撞 容器壁——给容器
壁冲量。大量分子在t 时间内给予I
的冲量,宏观上表现为对器壁的平均
vf
v
d
v
0
f
vd v
0
vf
v d
v
麦克斯韦分布律
v 1.60 RT
2020/1/15
DUT 余 虹
21
(3)方均根速率 v 2
一段速率区间v1~v2的方均速率
f v
v122
v2 v 2 d N N v v2 2 f v d v
v1 v2 d N
作用力
F I t
气体对容器壁的压强
P F I S S t
2020/1/15
DUT 余 虹
5
二、P 与微观量 的关系
分子按速度区 间分组
第i 组: 速度 近vi 似~ 认vi 为 都dv是i v i
分子数N
i ,分子数密度
ni
Ni V
考察这组分子给面元A的冲量
一 碰壁前速度 vix viy viz
一、速率分布函数
处于平衡态的气体,每个分子 朝各个方向运动的概率均等。
可是大量分子速度分 量的方均值相等。
一个分子,某一时刻速度
v
通常 v xv y v z
v
分子动理论知识点总结

分子动理论知识点总结分子动理论知识点总结11.分子动理论(1)物质是由大量分子组成的分子直径的数量级一般是10-10m。
(2)分子永不停息地做无规章热运动。
①扩散现象:不同的物质相互接触时,可以彼此进入对方中去。
温度越高,扩散越快。
②布朗运动:在显微镜下看到的悬浮在液体(或气体)中微小颗粒的无规章运动,是液体分子对微小颗粒撞击作用的不平衡造成的,是液体分子永不停息地无规章运动的宏观反映。
颗粒越小,布朗运动越明显;温度越高,布朗运动越明显。
(3)分子间存在着相互作用力分子间同时存在着引力和斥力,引力和斥力都随分子间距离增大而减小,但斥力的改变比引力的改变快,实际表现出来的是引力和斥力的合力。
2.物体的内能(1)分子动能:做热运动的分子具有动能,在热现象的讨论中,单个分子的动能是无讨论意义的,重要的是分子热运动的平均动能。
温度是物体分子热运动的平均动能的标识。
(2)分子势能:分子间具有由它们的相对位置决断的势能,叫做分子势能。
分子势能随着物体的体积改变而改变。
分子间的作用表现为引力时,分子势能随着分子间的距离增大而增大。
分子间的作用表现为斥力时,分子势能随着分子间距离增大而减小。
对实际气体来说,体积增大,分子势能增加;体积缩小,分子势能减小。
(3)物体的内能:物体里全部的分子的动能和势能的总和叫做物体的内能。
任何物体都有内能,物体的内能跟物体的温度和体积有关。
(4)物体的内能和机械能有着本质的区分。
物体具有内能的`同时可以具有机械能,也可以不具有机械能。
3.转变内能的两种方式(1)做功:其本质是其他形式的能和内能之间的相互转化。
(2)热传递:其本质是物体间内能的转移。
(3)做功和热传递在转变物体的内能上是等效的,但有本质的区分。
4.★能量转化和守恒定律5★.热力学第肯定律(1)内容:物体内能的增量(U)等于外界对物体做的功(W)和物体汲取的热量(Q)的总和。
(2)表达式:W+Q=U(3)符号法那么:外界对物体做功,W取正值,物体对外界做功,W取负值;物体汲取热量,Q取正值,物体放出热量,Q取负值;物体内能增加,U取正值,物体内能减削,U取负值。
气体分子运动论

第一章 气体动理论§1 理想气体的压强和温度 一.理想气体的微观模型1.忽略分子大小(看作质点)分子线度分子间平均距离2.忽略分子间的作用力(分子与分子或器壁碰撞时除外) 3.碰撞为完全弹性4.分子服从经典力学规律二.平衡态理想气体分子的统计假设 1.按位置的均匀分布分子在各处出现的概率相同(重力不计)。
容器内各处分子数密度相同:n = dN/dV = N/V2.速度按方向的分布均匀由于碰撞,分子往各方向运动的概率相同2222310vv v v v v v z y x z y x ======其中⎺v 2x = (v 21x + v 22x + … + v 2N x )/N⎺v 2 = ⎺v 2x +⎺v 2y +⎺v 2z三.理想气体压强公式:分子平均平动动能:分子质量:分子数密度其中22213231v n n v n P t tμεμεμ===v i推导: 速度分组:数密度的数密度:∑=+→ii i i i n n v d v v n ρρρ一个分子碰壁一次对壁的冲量ix v μ2面光滑在y,z 方向冲量=0 全部分子在dt 时间内对dA 的冲量()()∑=∑=∑=>iixi ixall ix i ix ix ix i ix v n dtdA v dtdA v n v v dtdA v n v I d 222μμμ压强2222223131v n p v n v n n v n n v n dtdA I d P x iixi iixi μμμμμ===∑∑=== 压强与平均平动动能的关系tt n P v εμε32212==压强是大量分子碰撞器壁单位面积作用力的统计平均值 四.温度的微观含义1.温度和平均平动动能的关系kTnkTP n P t t2332===εε 2.温度的统计意义标志分子无规运动的剧烈程度 只能用于大量分子的集体 3.方均根速率-分子速率的一种描述MRT kT v kTv t 33232122====μμε§2 能量均分定理,理想气体的内能 一.自由度● 决定物体空间位置所需独立坐标的数目 ● 自由质点:平动自由度t = 3 ● 刚体绕通过质心轴的转动:转动自由度 r= 3二. 能量按自由度的均分定理1.定理(用经典统计可证明)在温度为T 的热平衡态下,物质(气体,液体和固体)分子的每个自由度都具有相同的平均动能 kT 21.● 平均平动动能xyz θφψθ, φ :轴方向ψ :自转角度()kTkT v v v v v v t kT kT t z y x z y x z y x t 21212121213,232222222===========εεεμμμε ● 平均转动动能kT r r 2=ε● 平均振动能(动能+势能):假定是简谐振动:平均动能=平均势能kT S kT S kT S v 2222=+=ε● 总自由度s r t i 2++=其中t —平动自由度r —转动自由度 s —振动自由度● 总能量:kT i 2=ε2.重要情况● 单原子分子(He ,Ar ):kTkT i t i 2323====ε ● 刚性双原子分子(H 2,O 2):绕对称轴的转动无意义不计ψ自由度kTr t i 255232r ==+=+==ε● 刚性多原子分子(H 2O ):kTr t i 3633==+=+=ε ● 晶格点阵上的离子:kTs i 36322==⨯==ε 二.理想气体的内能1.内能:分子动能,分子中原子间的势能和分子间势能的总和 2.理想气体内能分子间势能为零内能只包括分子的平动,转动,振动动能和振动势能.内能只与T 有关。
专题04 分子动理论与微观粒子(解析版)
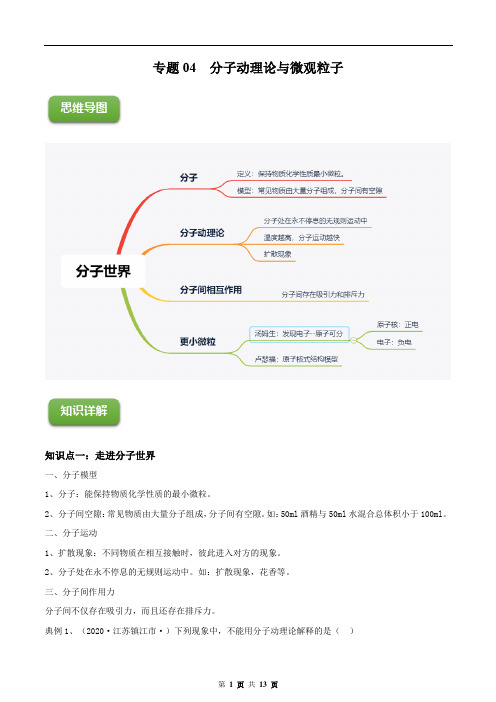
专题04 分子动理论与微观粒子思维导图知识详解知识点一:走进分子世界一、分子模型1、分子:能保持物质化学性质的最小微粒。
2、分子间空隙:常见物质由大量分子组成,分子间有空隙。
如:50ml酒精与50ml水混合总体积小于100ml。
二、分子运动1、扩散现象:不同物质在相互接触时,彼此进入对方的现象。
2、分子处在永不停息的无规则运动中。
如:扩散现象,花香等。
三、分子间作用力分子间不仅存在吸引力,而且还存在排斥力。
典例1、(2020·江苏镇江市·)下列现象中,不能用分子动理论解释的是()A.海绵很容易被压缩B.湿衣服在阳光下逐渐晒干C.春天,校园里花香扑鼻D.高压下,油罐里的油能从罐壁渗出【答案】A【解析】A.海绵很容易被压缩,是海绵受力时形状发生改变,是宏观物体的运动,与分子动理论没有关系,故A 符合题意;B.湿衣服在阳光下晾晒时,由于温度较高,衣服上的水分子运动速度加快,所以衣服逐渐变干,与分子动理论有关,故B不符合题意;C.校园里花香扑鼻,是花香分子扩散到空气中的结果,与分子动理论有关,故C不符合题意;D.分子之间存在间隙,所以在高压下,油罐里的油从罐的分子间渗出,与分子动理论有关,故D不符合题意。
故选A。
典例2、(2020·江苏徐州市·九年级其他模拟)新冠肺炎疫情期间戴口罩能有效预防飞沫传播,要勤洗手,做好消毒工作,下列说法正确的是()A.新冠病毒随飞沫传播是一种分子运动B.口罩有效是因为制作材料分子间没有空隙C.闻到酒精消毒液的气味是因为分子运动D.内层吸水层能够有效吸收呼出的水蒸气,说明分子之间存在斥力【答案】C【解析】A.分子很小,直接用肉眼看不到,飞沫是肉眼可以看到的;所以新冠病毒随飞沫传播是机械运动,不是分子的运动,故A错误;B.由分子热运动可知分子之间存在间隙,所以口罩材料分子之间也有空隙,故B错误;C.可以闻到酒精味,是由于酒精分子在不停地做无规则运动,故C正确;D.内层吸水层能够有效吸收呼出的水蒸气分子,吸收作用体现的是分子间存在引力,而不是斥力,故D 错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 3 m 28.9 10 1% 0.289 10 kg Ar质量 3
m3 0.289 0.007 摩尔数 v3 M mol 3 40
1mol空气在标准状态下的内能
i3 i1 i2 E v1 RT v2 RT v3 RT 2 2 2 1 (i1v1 i2 v2 i3v3 ) RT 2
理想气体系统由氧气组成,压强P =1 atm,温度T = 27℃。求(1)单位体积内的分子数;(2)分子 的平均平动动能和平均转动动能;(3)单位体积 中的内能。
解(1) 根据
p nkT
p 1.013105 25 3 n 2 . 45 10 m kT 1.3810 23 300
n dN N dV V
平衡态分子速度取向各方向等概率
vx v y vz
2 2 1 v2 vx v2 v y z 3
分子数目很大,满足大概率事件
三、理想气体压强公式
器 壁
气体分子
总的效果是一个持续的平均作用力
研究对象:一定质量处于平衡态的理想气体 宏观:大量分子频繁撞击容器壁的结果 微观:容器壁单位时间、单位面积所受的平均冲力
度的转动能量相等,而且均等于 kT 2
在温度为T 的平衡态下,气体分子的每一个自
由度都平均地具有 kT/2 的动能。
3. 理想气体的内能
动能 • 热力学系统的内能
相互作用势能
化学能、核能
•理想气体内能-----分子平动动能与转动= kT N A RT 2 2
二、 研究分子运动规律的方法
研究对象:热力学系统(宏观系统) 包含大量分子、 原子构成的系统 分为孤立系统、封闭系统和开放系统 热 力 学 研究方法:
分子动理论
宏观量 ( Macroscopic quantity ) 表征系统整体的物理量,可直接测量 如气体质量、体积、压强、温度等 广延量(可加性) 强度量(无可加性) 微观量 (Microscopic quantity) 描述微观粒子个体的物理量,一般不易直接测量 如分子质量、直径 、速度 、动量 、能量等
摩尔理想气体的内能
i E= RT 2
理想气体内能仅是温度的函数
在一个具有活塞的容器中盛有一定的气体。如果压 缩气体并对它加热,使它的温度从27℃升到177 ℃ ,体积减少一半,求:
(1)气体压强变化多少? (2)这时气体分子的平均平动动能变化多少?
解:
(1)
p1V1 p2V2 T1 T2 由已知 : V1 2V2 , T1 273 27 300 K , T2 273 177 450 K
一、 理想气体状态方程 1. 平衡态(Equilibrium
state )
热力学系统------大量微观粒子(分子、原子等) 组成的宏观物体 热平衡态-----在不受外界影响的条件下,系统宏观
性质不随时间改变的状态
平衡条件: (1)系统与外界宏观上无能量和物质交换
(2)系统宏观性质不随时间改变
条件:气体质量不变
R 8.31J mol1 K -1
m pV RT vRT M
23 1
R 23 -1 玻尔兹曼常数 k 1.3810 J K NA m N 假设N为体积为V 内的气体分子数总数 v
N A 6.02310 mol
M
NA
p nkT
n 单位体积中的分子数
i tr3
双原子分子 平动自由度 t =3 转动自由度 r =2
y
x z
C ( x, y, z )
y
i tr5
三原子分子
平动自由度 t=3 转动自由度 r=3
z
C ( x, y, z )
x
平动 t 转动 r 0 2 3
i tr6
单原子分子:He… 双原子分子:O2… 多原子分子:NH3 … 3 3 3
1 分子的平均平动动能 t m0 v 2 2
说明:
统计关系式
宏观可测量量
2 p n t 3
微观量的统计平均值
1)物理意义: 揭示了压强的统计意义
表明了压强的两个影响因素
2)适应范围: 含有大量分子的热力学系统 3)动态影响: T不变,V↓→p↑ V不变,T↑→p↑
2. 温度的统计解释
2. 状态参量
(State Quantity )
在热学、热力学系统中,表示物体宏观性质 的物理量------状态参量
p 气体对单位面积容器壁的正压力 (Pa)
(力学参量)
V
气体所能达到的空间 (几何参量)
宏观上表示物体的冷热程度 微观上反映分子运动的剧烈程度 (热力学参量)
(m )
3
T
(K)
3. 理想气体状态方程 p1V1 p2V2 T1 T2 一般形式
混合气体总压强等于组成该混合气体各成分气 体的分压强之和。
解:容器内不同气体的温度相同,分子的平均平动动能也相同。
t1 t 2
分子数密度满足
ti
tn
n ni
2 2 2 P n tk ni ti ni ti Pi 3 3 3
1 3 3kT 3RT m0 v2 kT v2 2 2 m0 M
四、能量均分定理与理想气体内能 1. 自由度 i 确定一个物体的空间位置所需要的独立坐标数目。
单原子分子
双原子分子
多原子分子
以刚性分子(分子内原子间距离保持不变)为例
单原子分子
平动自由度 t =3
z
C ( x, y, z )
1 (5 0.789 5 0.208 3 0.007) 8.31 273 2 3 5.68 10 J
本次课小结
1.理想气体的状态方程
m pV RT vRT M
p nkT
2.压强、温度与平均平动动能的关系
2 p n 3
1 t m0 v 2 2
二、理想气体微观模型
1.理想气体分子模型(力学性质假设)
质点 (线度<<间距),服从牛顿定律 除碰撞瞬间,分子间、分子与器壁无相互作用
分子间、分子与器壁间的碰撞为完全弹性碰撞
弹性 自由运动 质点 模型
在压力不太大、温度不太低时,与实际附合很好
2.理想气体分子性质(分子集体统计性假设)
同种气体分子大小、性质相同 无外场时,平衡态分子按位置均匀分布
2 mol 水 2 mol 氢气 1 mol 氧气
UH2O 6RT UH2 5RT
U O2 5 RT 2
U
H2
U O 2 U H 2O U H 2O
7.5 6 25% 6
就质量而言,空气是由76%的N2,23%的O2和1%的Ar 三种气体组成,它们的分子量分别为28、32、40。空气 的摩尔质量为28.910-3kg,试计算1mol空气在标准状态 下的内能。
热运动(thermal motion)
3. 分子间存在着吸引力与排斥力
C1 C2 表 达 式: F m n r r ( m n)
C1 rm
平衡位置: r0 1010 m 吸引力
r r0
C2 rn
分子间作用力曲线
排斥力 r r0
分子力是短程力,有效作用距离: 102d
Chap.5 Kinetic Theory of Molecular
理想气体状态方程
理想气体压强公式
能量均分定理 理想气体内能 重点:气态方程、压强与温度的微观本质 难点:统计概念与方法
第一节 物质的微观模型
一、气体动理论的基本观点 1. 物质是由大量的原子或分子组成,分子间存在间隙 2. 分子或原子都在做永不停息的无规则运动 特点:小、多、快、乱
研究方法:
单个分子 对容器壁 的平均作 用力 所有分子 对容器壁 的平均作 用力 利用压强 定义与统 计求平均
利用等概
率原理
理想气体 压强
1.理想气体压强公式 考察单个分子i 对A2面的作用力
N个同类气体分子,每个分子质量均为m
考虑第 i 个分子,其速度 vi vixi viy j viz k y
N
N
2 v ix
利用统计平均概念 平均值
v v v v = N N
2 x 2 1x 2 2x 2 Nx
p nm0 v
2 x
等概率原理:分子沿各个方向运动的机会均相等
vx v y vz
2 2 2
2
2
2
1 2 vx v y vz v 3
2 1 2 1 2 2 p nm0 v n ( m0 v ) n t 3 3 3 2
V1T2 2V2 450 p2 p1 3 p1 V2T1 V2 300
(2) 3 kT 2
3 t 2 t1 k (T2 T1 ) 2 3 1.38 1023 (450 300) 3.111021 J 2
利用理想气体的压强公式推到Dalton 分压定律。
宏观量总是微观量的统计平均值
分子热运动的无序性及统计规律性
•单个分子的运动具有无序性 •大量分子的运动具有规律性 统计规律是指大量偶然事 件整体所遵循的规律。方 法——求统计平均值 统计规律特点: (1)只对大量偶然的事件才有意义 (2)它是不同于个体规律的整体规律 (3)总是伴随着涨落
第二节 理想气体分子动理论
2
单位时间单个分子施于器壁A2的平均作用力
I i m0 v ix Fix t l1
所有分子对A2面的平均作用力
