名词解释 第一章 蛋白质的结构与功能
生物化学名词解释

生物化学名词解释第一章蛋白质的结构和功能等电点(isoelectric point, pI):氨基酸分子带有相等正、负电荷时,溶液的pH值称为该氨基酸的等电点肽键(peptide bond) : 是由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合而形成的化学键。
肽键平面(peptide bond) :由于肽键具有部分双键的性质,使参与肽键构成的六个原子被束缚在同一平面上,这一平面称为肽键平面模体(motif) :在蛋白质分子中,若干具有二级结构的肽段在空间上相互接近,形成具有特殊功能的结构区域,称模体结构域(domain) :在一级结构上相距较远的氨基酸残基,通过三级结构的形成,多肽链的弯折,彼此聚集在一起,从而形成一些在功能上相对独立的,结构较为紧凑的区域,称为结构域(domain)。
亚基(subunit):就是指参与构成蛋白质四级结构的、每条具有三级结构的多肽链变构效应(allosteric effect): 由于蛋白质分子构象改变而导致蛋白质分子功能发生改变的现象称为变构效应。
蛋白质的变性(denaturation):在某些物理或化学因素的作用下,蛋白质严格的空间结构被破坏(不包括肽键的断裂),从而引起蛋白质若干理化性质和生物学性质的改变,称为蛋白质的变性。
第二章核酸遗传密码(coden):mRNA分子中每三个相邻的核苷酸组成一组,在蛋白质翻译合成时代表一个特定的氨基酸,这种核苷酸三联体称为遗传密码。
核酶(ribozyme):某些小分子RNA具有催化特定RNA降解的活性,这种具有催化作用的小RNA被称为核酶(ribozyme)。
DNA的变性(denaturation): 在理化因素作用下,DNA双螺旋的两条互补链松散而分开成为单链,从而导致DNA的理化性质及生物学性质发生改变,这种现象称为DNA 的变性。
融解温度(melting temperature, Tm):加热DNA溶液,使其对260nm紫外光的吸收度突然增加,达到其最大值一半时的温度,就是DNA的变性温度(融解温度)。
生化名词解释与简答题

第一章蛋白质的结构与功能(一)名词解释1. 肽键2. 结构域 3. 蛋白质的等电点4. 蛋白质的沉淀5. 蛋白质的凝固(三)问答题1. 何谓蛋白质变性?影响变性的因素有哪些?2. 蛋白质变性后,为什么水溶性会降低?3. 举例说明一级结构决定构象。
答案(一)1.肽键:一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合所形成的结合键,称为肽键。
2.构域:蛋白质在形成三级结构时,肽链中某些局部的二级结构汇集在一起,形成发挥生物学功能的特定区域称为结构域。
3.蛋白质的等电点:蛋白质分子净电荷为零时溶液的pH值称为该蛋白质的等电点。
4.蛋白质的沉淀:蛋白质分子从溶液中析出的现象称为蛋白质的沉淀。
5.蛋白质的凝固:蛋白质经强酸、强碱作用发生变性后,仍能溶解于强酸或强碱中,若将pH调至等电点,则蛋白质立即结成絮状的不溶解物,此絮状物仍可溶解于强酸或强碱中。
如再加热则絮状物可变成比较坚固的凝块,此凝块不再溶于强酸或强(三)问答题1. 蛋白质在某些物理因素或化学因素的作用下,蛋白质分子内部的非共价键断裂,天然构象被破坏,从而引起理化性质改变,生物活性丧失,这种现象称为蛋白质变性。
蛋白质变性的实质是维系蛋白质分子空间结构的次级键断开,使其空间结构松解,但肽键并未断开。
引起蛋白质变性的因素有两方面:一是物理因素,如紫外线照射等,一是化学因素如强酸、强碱、重金属盐、有机溶剂等。
2. 三级结构以上的蛋白质的空间结构稳定主要靠疏水键和其它副键,当蛋白质在某些理化因素作用下变性后,维持蛋白质空间结构稳定的疏水键、二硫键以及其它次级键断裂,空间结构松解,蛋白质分子变为伸展的长肽链,大量的疏水基团外露,导致蛋白质水溶性降低。
3. 牛胰核糖核酸酶溶液加入尿素和巯基乙醇后变性失活,其一级结构没有改变。
当用透析法去除尿素和巯基乙醇后,牛胰核糖核酸酶自发恢复原有的空间结构与功能,此例充分说明一级结构决定构象。
碱中,这种现象称为蛋白质的凝固作用。
生物化学名词解释总结

第一篇生物分子的结构与功能第一章蛋白质的结构与功能1.蛋白质的二级结构:多肽链主链骨架原子的相对空间位置,不涉及氨基酸残基侧链等等构象。
2.肽键:是一个氨基酸α-羧基与另一个氨基酸α-氨基脱水缩合形成的键,本质是一种酰胺键。
3.肽单元:在多肽链中,参与形成肽键的六个原子——Ca1、Ca2、C、O、N、H六个原子固定在同一个刚性平面上,又称为肽键平面4.蛋白质的一级结构:多肽链中从N-端到C-端氨基酸残基的排列顺序5.蛋白质的等电点:pI。
当蛋白质溶液处于某一pH值时,其分子不解离或解离成正负离子的趋势相等,即净电荷为零,成为兼性离子,此时该溶液的pH值称为该蛋白质的等电点6.蛋白质的变性:在某些理化因素的作用下,是蛋白质的空间结构发生变化,导致理化性质改变和生物学活性丧失称为蛋白质变性7.蛋白质的复性:去除变性因素后,变性蛋白质可自发恢复其原有空间结构和生物学功能,称为复性第二章核酸的结构与功能*1.Tm值:即解链温度,又称溶解温度,指DNA接连过程中A260值达到最大的50%时的温度2.核酸:由单核苷酸通过磷酸二酯键连接而成的高分子化合物3.DNA变性:在某些理化因素作用下,DNA双链互补碱基对之间的氢键断裂,解链成两条单链的过程4.DNA复性:当变性条件缓慢的除去后,两条解离的互补链可重新配对,恢复原来的双螺旋结构的现象5.核酸的杂交:不同来源的DNA单链之间或RNA与DNA单链之间,只要存在着一定程度的碱基互补配对关系,就有可能形成杂化双链,这个过程称为核酸的杂交6.DNA的一级结构:是指DNA分子中脱氢核苷酸从5’-末端到3’-末端的排列顺序第三章酶*1.酶:是由活细胞合成对特异的底物起高效催化作用的蛋白质,是体内催化各种代谢反应最主要的催化剂2.酶的活性中心:必需基团在空间上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合转化为产物,这一区域称为酶的活性中心3.同工酶:是提催化相同的反应,但酶蛋白的分子结构、理化性质乃至免疫学特征不同的一组酶4.核酶:具有催化活性的RNA5.Km值:酶的特征常数,最大反应速度一半时的底物浓度第四章维生素1.维生素:维持人体正常功能所必须的营养素,是人体内不能合成或合成量不足,必须由食物供给的一类低分子有机化合物2.脂溶性维生素:一类不溶于水,而溶于有机溶剂的维生素,在食物中与脂类共存,在肠道吸收时需胆汁酸协助,吸收后在肝内储存。
最新第七版生物化学名词解释

第七版生物化学名词解释第一章蛋白质的结构与功能(1)肽键:蛋白质中前一氨基酸的α-羧基与后一氨基酸的α-氨基脱水形成的酰胺键。
(2)多肽链:由许多氨基酸借肽键连接而形成的链状化合物。
(3)肽键平面:肽键中的C-N键具有部分双键的性质,不能旋转,因此,肽键中的C、O、N、H 四个原子处于一个平面上,称为肽键平面。
(4)蛋白质分子的一级结构:蛋白质分子的一级结构是指构成蛋白质分子的氨基酸在多肽链中的排列顺序和连接方式。
(5)亚基:在蛋白质分子的四级结构中,每一个具有三级结构的多肽链单位,称为亚基。
(6)蛋白质的等电点:在某-pH溶液中,蛋白质分子可游离成正电荷和负电荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的pH值称为该蛋白质的等电点。
⑺蛋白质变性:在某些理化因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变和生物学活性的丧失的现象。
⑻协同效应: 一个亚基与其配体结合后,能影响另一亚基与配体结合的能力。
(正、负)如血红素与氧结合后,铁原子就能进入卟啉环的小孔中,继而引起肽链位置的变动。
⑼变构效应: 蛋白质分子因与某种小分子物质(效应剂)相互作用而致构象发生改变,从而改变其活性的现象。
⑽分子伴侣:分子伴侣是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域和整体蛋白质的正确折叠。
细胞至少有两种分子伴侣家族——热休克蛋白和伴侣素。
第二章核酸的化学结构与功能(1) 核酸变性:在某些理化因素的作用下,核酸双链间氢键断裂,双螺旋解开,变成无规则的线团,此种作用称核酸的变性。
(2) DNA的复性作用:变性的DNA在适当的条件下,两条彼此分开的多核苷酸链又可重新通过氢键连接,形成原来的双螺旋结构,并恢复其原有的理化性质,此即DNA的复性。
(3) 杂交:两条不同来源的单链DNA,或一条单链DNA,一条RNA,只要它们有大部分互补的碱基顺序,也可以复性,形成一个杂合双链,此过程称杂交。
生物化学重点总结归纳

第一章蛋白质的结构与功能一、名词解释肽键:一个氨基酸的a--羧基与另一个氨基酸的a--氨基脱水缩合所形成的结合键,称为肽键。
等电点:蛋白质分子净电荷为零时溶液的pH值称为该蛋白质的等电点。
蛋白质的一级结构:是指多肽链中氨基酸的排列顺序。
三、填空题1,组成体内蛋白质的氨基酸有20种,根据氨基酸侧链(R)的结构和理化性质可分为①非极性侧链氨基酸;②极性中性侧链氨基酸:;③碱性氨基酸:赖氨酸、精氨酸、组氨酸;④酸性氨基酸:天冬氨酸、谷氨酸。
3,紫外吸收法(280 nm)定量测定蛋白质时其主要依据是因为大多数可溶性蛋白质分子含有色氨酸,苯丙氨酸,或酪氨酸。
5,蛋白质结构中主键称为肽键,次级键有氢键、离子键、疏水作用键、范德华力、二硫键等,次级键中属于共价键的有范德华力、二硫键第二章核酸的结构与功能一、名词解释DNA的一级结构:核酸分子中核苷酸从5’-末端到3’-末端的排列顺序即碱基排列顺序称为核酸的一级结构。
DNA双螺旋结构:两条反向平行DNA链通过碱基互补配对的原则所形成的右手双螺旋结构称为DNA的二级机构。
三、填空题1,核酸可分为 DNA 和 RNA 两大类,前者主要存在于真核细胞的细胞核和原核细胞拟核部位,后者主要存在于细胞的细胞质部位2,构成核酸的基本单位是核苷酸,由戊糖、含氮碱基和磷酸 3个部分组成6,RNA中常见的碱基有腺嘌呤、鸟嘌呤,尿嘧啶和胞嘧啶7,DNA常见的碱基有腺嘌呤、鸟嘌呤、胸腺嘧啶和胞嘧啶四、简答题1,DNA与RNA 一级结构和二级结构有何异同?4,叙述DNA双螺旋结构模式的要点。
DNA双螺旋结构模型的要点是:1,DNA是一平行反向的双链结构,脱氧核糖基和磷酸骨架位于双链的外侧,碱基位于内侧,两条链的碱基之间以氢键相交接触。
腺嘌呤始终与胸腺嘧啶配对存在,形成两个氢键(A=T),鸟嘌呤始终与胞嘧啶配对存在,形成三个氢键(G≡C),碱基平面与线性分子的长轴相垂直。
一条链的走向是5’→3’,另一条链的走向就一定是3’→5’;2,DNA是一右手螺旋结构;3,DNA双螺旋结构稳定的维系横向靠两条链间互补碱基的氢键维系,纵向则靠碱基平面间的疏水性堆积力维持。
生物化学名词解释

生物化学名词解释第一章蛋白质结构与功能1.肽单元(peptide unit):参与肽键的6个原子—Cα1,C,O,N,H,Cα2位于同一平面,Cα1和Cα2在平面上所处的位臵为反式(trans)构型,此同一平面上的6个原子构成肽单元。
2.模体(motif):由二个或三个具有二级结构的肽段,在空间上相互接近,形成一个特殊的空间构象, 并发挥特殊的功能,如锌指结构,β α β等。
模体通常有其特征性的氨基酸序列。
有的模体仅由几个氨基酸残基组成,如RGD (Arg-Gly-Asp)模体。
3.结构域(domain):分子量较大的蛋白质常可折叠成多个结构较为紧密的区域,并各行其功能,称为结构域。
4.蛋白质等电点(Isoelectric point, pI):在某一pH溶液中,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,其所带的净电荷为零,此时溶液的pH值称为该蛋白质的等电点。
5.蛋白质的变性(denaturation of protein):在某些物理和化学因素(如加热,强酸,强碱,有机溶剂, 重金属离子等)作用下,蛋白质的特定空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,称为蛋白质的变性。
变性不涉及一级结构中氨基酸序列的改变。
第二章酶1.酶的活性中心(active center of enzyme):酶分子中与酶活性密切相关的基团(必需基团)在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合,并将其转变为产物,该区域称酶的活性中心。
辅酶参与酶活性中心的组成。
2.同工酶(isoenzyme):催化相同的化学反应,但酶蛋白的分子结构、理化性质及免疫学性质不同的一组酶。
3.变构酶和变构调节(allosteric enzyme and allosteric regulation):一些代谢物(变构效应剂)可与酶蛋白分子活性中心外的某一部位可逆地结合,使酶发生变构而改变其催化活性。
(完整)生物化学名词解释

生物化学名词解释第一章蛋白质的结构与功能1。
肽键:一分子氨基酸的氨基和另一分子氨基酸的羧基通过脱去水分子后所形成的酰胺键称为肽键。
2. 等电点:在某一pH溶液中,氨基酸或蛋白质解离成阳离子和阴离子的趋势或程度相等,成为兼性离子,成点中性,此时溶液的pH称为该氨基酸或蛋白质的等电点。
3. 模体:在蛋白质分子中,由两个或两个以上具有二级结构的肽段在空间上相互接近,形成一个特殊的空间构象,并发挥特殊的功能,称为模体。
4. 结构域:分子量较大的蛋白质三级结构常可分割成多个结构紧密的区域,并行使特定的功能,这些区域被称为结构域.5。
亚基:在蛋白质四级结构中每条肽链所形成的完整三级结构。
6. 肽单元:在多肽分子中,参与肽键的4个原子及其两侧的碳原子位于同一个平面内,称为肽单元。
7. 蛋白质变性:在某些理化因素影响下,蛋白质的空间构象破坏,从而改变蛋白质的理化性质和生物学活性,称之为蛋白质变性。
第二章核酸的结构与功能1。
DNA变性:在某些理化因素作用下,DNA分子稳定的双螺旋空间构象破环,双链解链变成两条单链,但其一级结构仍完整的现象称DNA变性.2。
Tm:即溶解温度,或解链温度,是指核酸在加热变性时,紫外吸收值达到最大值50%时的温度.在Tm时,核酸分子50%的双螺旋结构被破坏。
3. 增色效应:核酸加热变性时,由于大量碱基暴露,使260nm处紫外吸收增加的现象,称之为增色效应.4. HnRNA:核内不均一RNA。
在细胞核内合成的mRNA初级产物比成熟的mRNA分子大得多,称为核内不均一RNA。
hnRNA在细胞核内存在时间极短,经过剪切成为成熟的mRNA,并依靠特殊的机制转移到细胞质中.5。
核酶:也称为催化性RNA,一些RNA具有催化能力,可以催化自我拼接等反应,这种具有催化作用的RNA分子叫做核酶。
6. 核酸分子杂交:不同来源但具有互补序列的核酸分子按碱基互补配对原则,在适宜条件下形成杂化双链,这种现象称核酸分子杂交.第三章酶1. 酶:由活细胞产生的具有催化功能的一类特殊的蛋白质。
分子生物学名词解释

第一章蛋白质的结构与功能分子病:由蛋白质分子发生变异导致的疾病,为基因突变所致。
一级结构:蛋白质分子中氨基酸的排列顺序。
二级结构:蛋白质主链的局部空间结构,不涉及氨基酸残基侧链构象。
三级结构:整条肽链中所有原子在三维空间的排列位置。
四级结构:肽链与肽链之间靠非共价键维系的布局与相互作用。
即各亚基间的空间排列。
超二级结构:二级结构单元相互聚集形成有规律的更高一级的但又低于三级结构的结构,现在已知的超二级结构有三种基本的组合形式:αα,βαβ,ββ。
结构域:多肽链在二级结构或超二级结构的基础上形成三级结构的局部折叠区,它是相对独立的紧密球状实体。
等电点:对于一种蛋白质而言,当在某一pH时,其所带正负电荷恰好相等(静电荷为零),这一pH值成为该蛋白质的等电点。
层析:按照在移动相和固定相之间的分配比例将混合成分分开的技术。
离子交换层析:使用带有固定的带电集团的聚合树脂或凝胶层析柱分离离子化合物的层析方法。
凝胶过滤层析:一种利用带孔凝胶珠作基质,按照分子大小分离蛋白质或其他分子混合物的层析技术。
亲和层析:利用共价连接有特异配体的层析介质分离蛋白质混合物中能特异结合配体的目的蛋白或其他分子的层析技术。
蛋白质组学:研究各种生物基因组在细胞(包括正常细胞、癌细胞等)和组织中表达的全部蛋白质的分子结构、功能及其相互作用。
最终目的为发现新药。
别构效应:也称为变构效应。
当某些寡聚蛋白与别构效应剂发生作用时,可以通过蛋白质构象的变化来改变蛋白质的活性,这种改变可以是活性的增加或减少。
这里的别构效应剂可以是蛋白质本身的作用物也可以是作用物以外的物质。
协同效应:别构效应的一种特殊类型,是亚基之间的一种相互作用。
它是寡聚蛋白的某一亚基与配基(蛋白质本身的作用物)结合时可改变蛋白质其它亚基的构象,进而改变蛋白质的生物活性的现象。
锌指结构:锌指(zinc finger):一种常出现在DNA结合蛋白中的一种结构基元。
是由一个含有大约30个氨基酸的环和一个与环上的4个Cys或2个Cys和2个His配位的Zn2+构成,形成的结构像手指状。
生物化学名词解释

生物化学名词解释第一章蛋白质的结构与功能1.肽键:一分子氨基酸的氨基和另一分子氨基酸的羧基通过脱去水分子后所形成的酰胺键称为肽键。
2.等电点:在某一pH溶液中,氨基酸或蛋白质解离成阳离子和阴离子的趋势或程度相等,成为兼性离子,成点中性,此时溶液的pH称为该氨基酸或蛋白质的等电点。
3.模体:在蛋白质分子中,由两个或两个以上具有二级结构的肽段在空间上相互接近,形成一个特殊的空间构象,并发挥特殊的功能,称为模体。
4.结构域:分子量较大的蛋白质三级结构常可分割成多个结构紧密的区域,并行使特定的功能,这些区域被称为结构域。
5.亚基:在蛋白质四级结构中每条肽链所形成的完整三级结构。
6.肽单元:在多肽分子中,参与肽键的4个原子及其两侧的碳原子位于同一个平面内,称为肽单元。
7.蛋白质变性:在某些理化因素影响下,蛋白质的空间构象破坏,从而改变蛋白质的理化性质和生物学活性,称之为蛋白质变性。
第二章核酸的结构与功能1. DNA变性:在某些理化因素作用下,DNA分子稳定的双螺旋空间构象破环,双链解链变成两条单链,但其一级结构仍完整的现象称DNA变性。
2. Tm:即溶解温度,或解链温度,是指核酸在加热变性时,紫外吸收值达到最大值50%时的温度。
在Tm时,核酸分子50%的双螺旋结构被破坏。
3.增色效应:核酸加热变性时,由于大量碱基暴露,使260nm处紫外吸收增加的现象,称之为增色效应。
4. HnRNA:核内不均一RNA。
在细胞核内合成的mRNA初级产物比成熟的mRNA分子大得多,称为核内不均一RNA。
hnRNA在细胞核内存在时间极短,经过剪切成为成熟的mRNA,并依靠特殊的机制转移到细胞质中。
5.核酶:也称为催化性RNA,一些RNA具有催化能力,可以催化自我拼接等反应,这种具有催化作用的RNA分子叫做核酶。
6.核酸分子杂交:不同来源但具有互补序列的核酸分子按碱基互补配对原则,在适宜条件下形成杂化双链,这种现象称核酸分子杂交。
第七版生物化学名词解释

第七版生物化学名词解释第一章蛋白质的结构与功能(1)肽键:蛋白质中前一氨基酸的α-羧基与后一氨基酸的α-(2)(3)肽键平面:肽键中的C-N键具有部分双键的性质,不能旋转,因此,肽键中的C、O、N、H(4)蛋白质分子的一级结构:蛋白质分子的一级结构是指构成蛋白质分子的氨基酸在多肽链中的排列顺序和连接方式(5)(6)蛋白质的等电点:在某-pH溶液中,蛋白质分子可游离成正电荷和负电荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的pH⑺蛋白质变性:在某些理化因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变和生物学活性的丧失的现象。
⑻协同效应:一个亚基与其配体结合后,能影响另一亚基与配体结合的能力。
(正、负)如血红素与氧结合后,铁原子就能进入卟啉环的小孔中,继而引起肽链位置的变动。
⑼变构效应:蛋白质分子因与某种小分子物质(效应剂)相互作用而致构象发生改变,从而改变其活性的现象。
⑽分子伴侣:分子伴侣是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域和整体蛋白质的正确折叠。
细胞至少有两种分子伴侣家族——热休克蛋白和伴侣素。
第二章核酸的化学结构与功能(1)核酸变性:在某些理化因素的作用下,核酸双链间氢键断裂,双螺旋解开,变成无规则的线团,此(2)DNA的复性作用:变性的DNA在适当的条件下,两条彼此分开的多核苷酸链又可重新通过氢键连接,形成原来的双螺旋结构,并恢复其原有的理化性质,此即DNA的复性。
(3)杂交:两条不同来源的单链DNA,或一条单链DNA,一条RNA,只要它们有大部分互补的碱基顺序(4)增色效应:DNA变性时,A260(5)解链温度:在DNA热变性时,通常将DNA变性50%时的温度叫解链温度用Tm表示。
(6)DNA的一级结构:DNA的一级结构是指DNA链中,脱氧核糖核苷酸的组成,排列顺序第三章酶学(1)辅酶:与酶蛋白结合的较松,用透析等方法易于与酶分开。
辅基:与酶蛋白结合的比较(2)酶的活性中心:必需基团在酶分子表面的一定区域形成一定的空间结构,直接参与了将作用物转变为产物的反应过程,这个区域叫酶的活性中心。
生物化学名词解释
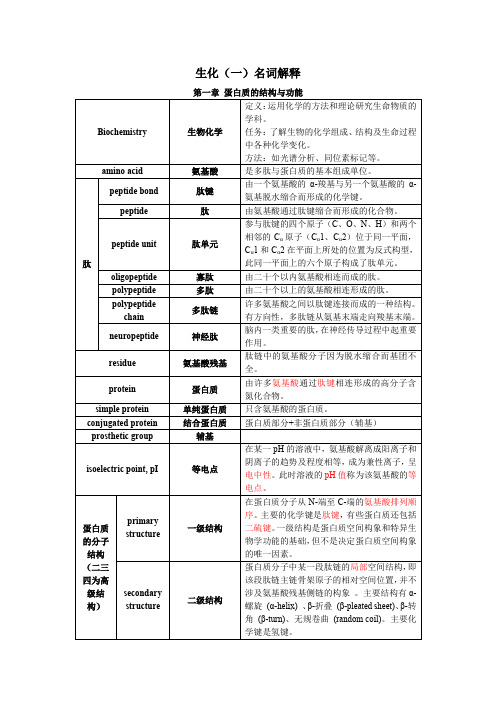
生化(一)名词解释
第二章酶
第三章糖代谢
第四章脂质代谢成混合微团
CM 乳糜微粒由
合成的
醇共同组装成三酯和胆固醇。
Essentialfattyacid 必需脂肪酸机体自身不能合成,必须从食物中获得的多价不饱和脂肪酸,主要包括亚油酸,亚麻酸,花生四烯酸。
胆固醇胆固醇的得名源于它最先是从动物胆石中分离出的、
胆固醇及其酯以及游离脂肪酸。
apo 载脂蛋白载脂蛋白指血浆脂蛋白中的蛋白质部分。
HDL
础,发病机理十分复杂。
高脂血症血脂高于正常人上限,即为高脂血症。
第五章生物氧化
第六章氨基酸代谢
第十五章肝的生物化学。
生化英文名词解释

名词解释Glossary第一章蛋白质的结构与功能Chapter 1 Structure and Function of Proteinpeptide bond(肽键):a covalent bond linking the α- amino group of one amino acid and theα-carboxyl group of another in a protein molecule.peptide(肽):a molecule containing two or more amino acids linked by peptide bond. primary structure of protein(蛋白质的一级结构):the amino acid sequence of a polypeptide.secondary structure of protein(蛋白质的二级结构):the spatial arrangement of local portions of a polypeptide chain.tertiary structure of protein(蛋白质的三级结构):the spatial arrangement of all the atoms of a protein or a subunit.quaternary structure of protein(蛋白质的四级结构):the spatial arrangement of a protein that consists of more than one folded polypeptide chain or subunit.subunit(亚基):an individual polypeptide chain that associates with one or more separate chains to form a complete protein.motif(模序):a substructure formed with two or more secondary-structure peptide segments that are drawn close to each other.domain(结构域):a region within a protein, particularly within a large polypeptide, that functions in a semi-independent manner.positive cooperativity(正协同效应):an effect that the binding of one ligand to a protein facilitates the subsequent ligand binding.allosteric effect(变构效应):an effect that a small molecule, called an effector, noncovalently binds to a protein and alters its activity.isoelectric point(pI)of protein (蛋白质的等电点):the pH at which a protein has an equal number of positive and negative charges and hence bears no net charge. denaturation of protein(蛋白质变性): the disruption of the natively folded structure of a protein caused by exposure to heat, radiation, or chemicals, or change in pH, that leads to an alteration of chemical, physical and biological properties of the第二章核酸的结构与功能Chapter 2 Structure and Function of Nucleic Aciddenaturation of DNA(DNA的变性):the disruption of the native conformation of DNA by separation of the DNA double helix into its two component strands, due to heat, chemicals, or change in pH, etc.hyperchromic effect(增色效应):the increase in ultraviolet absorbance of a DNA while the DNA is denatured.melting temperature(Tm, 融解温度):the temperature corresponding to half the maximal increase in ultraviolet absorbance of a thermally denatured DNA.annealing(退火):the process of returning a thermally denatured DNA to its original native structure when it is cooled gradually.第三章酶Chapter 3 Enzymessimple enzyme(单纯酶):an enzyme that consists of only polypeptide chain(s). conjugated enzyme(结合酶):an enzyme with its polypeptide portion(apoenzyme) linked to one or more substance other than amino acids, such as metals or small organic molecules.holoenzyme(全酶):a complete enzyme consisting of the apoenzyme portion plus the cofactor component.essential group(必需基团): a chemical group on the side chain of amino acid residue of an enzyme that is closely related to the activity of the enzyme.active center / active site(活性中心):the region of an enzyme molecule that contains the substrate binding site and the catalytic site for converting the substrate(s) into product(s).activation energy(活化能):the threshold energy that must be overcome to produce a chemical reaction.absolute specificity(绝对特异性):the extreme selectivity of an enzyme that allows it to catalyze only the reaction with a single substrate in the case of a monomolecular reaction, or the reaction with a single pair of substrates in the case of a bimolecularrelative specificity(相对特异性):the relative selectivity of an enzyme that allows it to catalyze the reaction with one type of reactants or one type of chemical bond. stereospecificity(立体异构特异性):the selectivity of an enzyme for a particular stereoisomer.zymogen(酶原):the inactive precursor of an enzyme.zymogen activation(酶原激活):the process in which a zymogen is converted to an active enzyme by limited proteolysis and subsequently the active center of the enzyme is formed or exposed.isoenzyme(同工酶):multiple forms of an enzyme that catalyze the same reaction but differ from one another in one or more of the properties, such as structural, physical, chemical and even immunological properties.第四章糖代谢Chapter 4 Carbohydrate Metabolismglycolysis(糖酵解): the anaerobic degradation of carbohydrate whereby a molecule of glucose is converted to two molecules of lactic acid.substrate-level phosphorylation(底物水平磷酸化):the synthesis of ATP from ADP by the phosphorylation of ADP coupled with exergonic breakdown of a high-energy organic substrate molecules.Pastuer effect(巴斯德效应):the phenomenon that the glycolytic pathway is inhibited under aerobic conditions.glycogen(糖原): a highly branched polymer of glucose residues primarily in 1,4 linkage but with 1,6 linkage at branchpoints.gluconeogenesis(糖异生): the synthesis of glucose or glycogen from noncarbohydrate molecules, i.e., lactic acid, glycerol, glucogenic amino acids, etc.第五章脂类代谢Chapter 5 Lipid Metabolismessential fatty acids(必需脂肪酸): the fatty acids, including linoleic acid, linolenic acid, and arachidonic acid, which can not be synthesized in the mammalian body and must be obtained from diet.mobilization of fat(脂肪动员): a process of lipolysis in which the fat stored in adipose tissues is converted to free fatty acids and glycerol, which are consequently released into blood so that they can be used in other tissues.β-oxidation of fatty acid(脂肪酸的β-氧化): a process in which a fatty acid is degraded through a sequential removal of two-carbon fragments from the carboxyl end and therefore acetyl CoA is formed as the bond between the α- and β-carbon atoms is broken.ketone bodies(酮体): a group of molecules, i.e., acetone, acetoacetate, and β–hydroxybutyrate, that are synthesized in the liver from acetyl CoA.第六章生物氧化Chapter 6 Biological Oxidationrespiratory chain (呼吸链)/ electron transfer chain(电子传递链): a series of electron carriers responsible for the transport of reducing equivalent from metabolite to molecular oxygen, with the net results of capturing energy for use in ATP synthesis, and of the reduction of oxygen to water.P/O ratio(P/O比值): the number of molecules of Pi consumed in ATP formation for each oxygen atom reduced to H2O.oxidative phosphorylation(氧化磷酸化): the process in which the phosphorylation of ADP to yield ATP is coupled to the electron transport through respiratory chain. uncoupler(解偶联剂): a molecule, such as dinitrophenol, that uncouples ATP synthesis from electron transport.第七章氨基酸代谢Chapter 7 Amino Acid Metabolismessential amino acids(必需氨基酸): the amino acids,including valine, leucine, isoleucine, threonine, phenylalanine, tryptophan methionine and lysine, that cannot be synthesized by animal body and must therefore be supplied by diet. transdeamination(联合脱氨基作用): the coupled action of an aminotransferase and a glutamate dehydrogenase involved in deamination of the majority of amino acids. transamination(转氨基作用): a reaction catalyzed by an aminotransferase, in which an amino group is transferred from an amino acid to a keto acid.ketogenic amino acids(生酮氨基酸): the amino acids that can be converted to ketone bodies, i.e., leucine and lysine.glucogenic and ketogenic amino acids(生糖兼生酮氨基酸): the amino acids, i.e., isoleucine, phenylalanine, tyrosine, threonine and tryptophan, that can be converted to either ketone bodies or carbohydrates.one carbon units(一碳单位)/ one carbon groups(一碳基团): organic groups, including methyl(—CH3), methylene(—CH2—), methenyl(—CH=), formyl(—CHO) and formimino(—CH=NH) groups, each containing only one carbon atom generated through catabolisms of some amino acids.第八章核苷酸代谢Chapter 8 Nucleotide Metabolismthe de novo pathway of nucleotide synthesis(核苷酸的从头合成途径): a pathway through which nucleotides are synthesized by using simple molecules, such as ribose 5-phosphate, amino acids, one carbon units and carbon dioxide.the salvage pathway of nucleotide synthesis(核苷酸的补救合成途径): a pathway through which nucleotides are synthesized by using the existing nitrogenous bases or nucleosides.第九章物质代谢的联系与调节Chapter 9 Integration and Regulation of Metabolismkey enzyme(关键酶)/ pacemaker enzyme(限速酶)/ regulatory enzyme(调节酶):an enzyme that sets the rate for the entire biochemical pathway, usually catalyzes the slowest and irreversible step, and can be regulated by a number of metabolites and effectors in addition to its substrates.allosteric regulation(变构调节): a regulatory mechanism through which a specific low-molecular-weight molecule, called an effector or a modulator, noncovalently binds to a regulatory site outside the active center of a regulatory enzyme and alters the conformation and activity of the enzyme.chemical modification(化学修饰调节): a regulatory mechanism through which enzyme activities are regulated by means of reversible interconversion between the active and inactive forms of the enzyme resulted from enzyme-catalyzed covalent modificationto a specific amino acid residue.第十章 DNA的生物合成(复制)Chapter 10 Biosynthesis of DNA (Replication)replication(复制):a process in which an exact copy of parental DNA is synthesized by using each polynucleotide strand of the parental DNA as templates. semiconservative replication(半保留复制): duplication of DNA after which the daughter duplex carries one parental strand and one newly synthesized strand.DNA polymerase(DNA聚合酶):any of various enzymes, with the full name of DNA dependent DNA polymerase, that catalyzes the formation of polynucleotides of DNA using an existing strand of DNA as a template.point mutation(点突变):a mutation that causes the replacement of a single base pair with another, including nonsense mutation, missense mutation and silent mutation. frameshift mutation(框移突变):a mutation of insertion or deletion of a genetic material that leads to a shift in the translation of the reading frame, resulting in a completely different translation.reverse transcriptase(逆转录酶):any of various enzymes, with the full name of RNA dependent DNA polymerase, that catalyzes the formation of polynucleotides of DNA using an existing strand of RNA as a template.telomeres(端粒): structures that occur at the ends of eukaryotic chromosomes that prevent the unraveling of DNA.第十一章 RNA的生物合成(转录)Chapter 11 Biosynthesis of RNA (Transcription)RNA polymerase(RNA聚合酶):any of various enzymes, with the full name of DNA dependent RNA polymerase, that catalyzes the formation of polynucleotides of RNA using an existing strand of DNA as a template.promoter(启动子): a DNA sequence immediately before a gene that is recognized by RNA polymerase and signals the start point of transcription.intron(内含子): a noncoding intervening sequence in a split or interrupted gene that is missing in the final RNA product.exon(外显子): the region in a split or interrupted gene that codes for RNA which endup in the final product (e.g., mRNA).ribozyme(核酶):ribonucleic acid with catalytic ability whose substrate is ribonucleic acid.第十二章蛋白质的生物合成(翻译)Chapter 12 Biosynthesis of Proteins (Translation)reading frame(阅读框): a group of three nonoverlapping nucleotides that is read asa codon during protein synthesis. The reading frame begins with the initiator codonAUG.molecular chaperon (分子伴侣):a sort of intracellular conservative protein, which can recognize the unnatural conformation of peptide and assist in the accurate folding of domains or the whole protein.signal peptide(信号肽): a sequence of amino acid residues located at the N-terminal portion of a nascent secretory protein, which marks the protein for translocation across the rough endoplasmic reticulum.第十三章细胞信息转导Chapter 13 Cell Signalingprimary messenger(第一信使): an extracellular signaling molecule that is released from the signaling cell and can regulate the physiological activity of the target cell.secondary messenger(第二信使): a small intracellular molecule, such as Ca2+,cAMP, cGMP, diacylglycerol (DAG), inositol triphosphate (IP3), ceramide, or arachidonic acid (AA), etc., that is formed at the inner surface of the plasma membrane in response to a primary messenger.receptor (受体): a molecular structure on the surface or interior of the target cell that specifically binds signaling molecule and initiates a response in the cell. ligand(配体): a biologically active molecule that can bind to its specific receptor.G protein (G蛋白)/ guanylate binding proteins (鸟苷酸结合蛋白):a trimeric guanylatebinding protein in the cytoplasmic side of plasma membrane that acts as a switch to turn activities on and off by interconversion between its monomeric GTPase andtrimeric GDP binding form.hormone response element (激素反应元件,HRE):a specific DNA sequence that binds hormone-receptor complex; The binding of a hormone-receptor complex either enhances or diminishes the transcription of a specific gene.第十四章血液的生物化学Chapter 14 Biochemical Aspects of Bloodnon-protein nitrogen(非蛋白氮):nitrogen contained in urea, creatine, creatinine, uric acid, bilirubin, and ammonia.acute phase protein(急性时相蛋白质):a protein whose plasma concentration can be altered when acute inflammation or a certain type of tissue damage occurs.2,3-bisphosphoglyerate shunt(2,3-二磷酸甘油支路):the pathway in erythrocyte glycolysis in which glycerate 1,3-bisphosphate(1,3-BPG) is isomerized to 2,3-bisphosphoglyerate(2,3-BPG) and the latter is consequently hydrolyzed to form 3-phosphoglycerate. The importance of 2,3-BPG in the erythrocyte lies in its ability to alter the extent to which hemoglobin binds with oxygen.第十五章肝的生物化学Chapter 15 Biochemical Aspects of the Liverbiotransformation(生物转化): a series of enzyme-catalyzed processes through which non-nutritional molecules, which are usually hydrophobic, are converted into more soluble metabolites.jaundice(黄疸): a clinical manifestation of hepatic disease, featuring yellow discolration of the plasma, skin, and mucous membranes, caused by bilirubin accumulation and staining.欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
蛋白质的结构与功能

多肽链具有方向性:头端为氨基端(N端),尾端为羧基端(C端)。
第二节 蛋白质的分子结构
一、蛋白质的一级结构
蛋白质的一级结构(primary structure)是 指蛋白质分子中,从N-端到C-端氨基酸残基 的排列顺序。 主要的化学键
肽键,有些蛋白质还包括二硫键。
牛胰岛素的一级结构
二、蛋白质的二级结构
② 化学因素:强酸、强碱、有机溶剂、重金属盐
等。
变性蛋白质的性质改变: ① 物理性质:旋光性改变,溶解度下降,沉降率 升高,粘度升高,光吸收度增加等; ② 化学性质:官能团反应性增加,易被蛋白酶水 解。 ③ 生物学性质:原有生物学活性丧失,抗原性改
变。
蛋白质变性的可逆性:
a)
蛋白质在体外变性后,绝大多数情况下是不能
为β-折叠的PrPsc,从而致病。 PrPc α-螺旋 正常 PrPsc β-折叠 疯牛病
要点:
蛋白质结构与功能的关系
一级结构与功能的关系:一级结构是空间构象的基础,一级结构相
似的蛋白质具有相似的高级结构与功能;一级结构不同的蛋白质 具有不同的高级结构与功能。 空间结构与功能的关系:蛋白质正常的生物功能依赖其完整的空间
要点:
蛋白质的四级结构(quaternary structure):就是指蛋白质分子
中亚基的立体排布,亚基间的相互作用与接触部位的布局。维系
蛋白质四级结构的主要是氢键、盐键、等非共价键。 亚基(subunit):就是指参与构成蛋白质四级结构的、每条具有 三级结构的多肽链。
第 三 节蛋白质结构与功能的关系
蛋白质的二级结构(secondary structure)是 指蛋白质多肽链主链原子局部的空间结构,
但不包括与其他肽段的相互关系及侧链构象
生物化学名词解释

生物化学名词解释第一章蛋白质的结构与功能模体:蛋白质分子中具有特定空间构象和特定功能的结构成分,一个结构模体总具有其特定的氨基酸序列,并发挥特定功能。
结构域:分子量较大的蛋白质常可折叠呈多个结构较为紧密且稳定的区域,并各行其功能,称为结构域。
蛋白质的等电点:蛋白质处于某-p时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,静电荷为零,此时溶液的pH 值称为蛋白质的等电点。
肽单元:参与肽键的6个原子Ca1、C、0、N、H、Ca2位于同一平面,Cal和Ca2在平面上所处的位置为反式构型,此同一平面上的6个原子构成了所谓的肽单元肽键:一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水而形成的酰胺键。
亚基:体内许多功能性蛋白质含有两条或两条以上多肽链,每一条多肽链都有其完整的三级结构,称为亚基。
第二章核酸的结构与功能核酶:也称为催化性小RNA,是细胞内具有催化功能的一类小分子RNA统称,具有催化特定降解的活性,在RNA合成后的剪接修饰中具有重要作用。
Tm值:在利用升温进行DNA双链解链过程中,紫外吸光度A2的变化值达到最大变化值的一半时所对应的温度定义为DNA的解链温度TDNA的复性:把变性条件缓慢地除去后,两条解离的DNA互补链可重新互补配对形成DNA双链,恢复原来的双螺旋结构,这一现象称为复性。
核小体:核小体是染色质的基本组成单位。
它是由双链DNA 和5种组蛋白(histon)共同构成。
两个分子的组蛋白H2A,H2B,H3和H4分子构成一个八聚体,长度约146bpDNA双链在组蛋白八聚体的表面上盘绕175圈形成核小体的核心颗粒。
增色效应:加热使DNA变性并达到一定温度时,DNA分子的两条链会快速的分开,成为单链,由此时大量碱基暴露,使260mm的吸收值迅速增加,称为增色反应。
第三章酶酶:酶是催化特定反应的蛋白质,是一种生物催化剂。
同工酶:催化相同的化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
生物化学名词解释

生物化学名词解释第一章蛋白质结构与功能isoelectric point, pI:氨基酸的等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH值称为该氨基酸的等电点。
Peptide bond:肽键:由一个氨基酸的羧基与另一个氨基酸的氨基脱水缩合而形成的酰胺键。
Glutathione,GSH:谷胱甘肽:由谷氨酸,半胱氨酸,甘氨酸组成的三肽,是体内重要的还原剂。
peptide unit:肽单元:参与肽键的6个原子Cα1、C、O、N、H、Cα2位于同一平面,Cα1和Cα2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成了所谓的肽单元。
peptide plane:肽平面:肽链主链的肽键C-N具有部分双键的性质,因而不能自由的旋转,使连接在肽键上的六个原子共处于一个平面上,此平面称为肽单位平面,又称酰胺平面。
通常是反式的。
α-helix:α-螺旋:常见的蛋白质二级结构之一。
为具有最大氢键联系的右手螺旋,侧链伸向螺旋外侧,每3.6个氨基酸残基螺旋上升一圈,螺距0.54nm。
motif:模体:在一个或几个蛋白质中出现的2个或2个以上二级结构元件的不同折叠形式,又称折叠或超二级结构。
也是在DNA中对特殊序列的描述。
zinc finger:锌指结构:一种常见的模体。
由1个α-螺旋和2个反平行的β-折叠共3个肽段组成,形似手指, 能够结合锌离子,锌指具有结合DNA的功能。
Domain:结构域:大分子蛋白质的三级结构常可分割成一个或数个球状或纤维状的区域,折叠得较为紧密,各行使其功能,称为结构域(domain) 。
Molecular chaperon:分子伴侣:是细胞内一类可识别肽链的非天然构象、促进各功能域和整体蛋白质正确折叠的保守蛋白质。
Cooperativity:协同效应:一个寡聚体蛋白质的一个亚基与其配体结合后,能影响此寡聚体中另一个亚基与配体结合能力的现象,称为协同效应。
生物化学与分子生物学名词解释

生物化学与分子生物学名词解释名词解释第一章蛋白质的结构与功能1.等电点PI:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH值称为该氨基酸的等电点。
2.肽键(pep-tidebond):是由一个氨基酸的羧基与另一个氨基酸的氨基脱水缩合而形成的化学键。
3.肽单元(pep-tideunit):参与肽键的6个原子C1、C、O、N、H、C2位于同一平面,此同一平面上的6个原子构成了所谓的肽单元4.模体(motif):二个或三个具有二级结构的肽段,在空间上相互接近,形成一个特殊的空间构象,称为模体.5.结构域(domain):分子量较大的蛋白质常可折叠成多个结构较为紧密且稳定的区域,并各行其功能,称为结构域.6.亚基(ub-unit):许多功能性蛋白质分子含有2条或2条以上多肽链。
每一条多肽链都有完整的三级结构,称为蛋白质的亚基(ub-unit)第二章核酸的结构和功能1.核酸(nucleicacid):是以核苷酸为基本组成单位的生物大分子,携带和传递遗传信息。
2.开放阅读框:位于起始密码子和终止密码子之间的核苷酸序列称为开放阅读框,决定了多肽链的氨基酸序列第三章酶1.酶:是一类由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质。
2.酶的活性中心:是酶分子中能与底物特异地结合并催化底物转变为产物的具有特定三维结构的区域。
3.同工酶:是指催化相同的化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
4.别构调节:一些代谢物可与某些酶分子活性中心外的某部分可逆地结合,使酶构象改变,从而改变酶的催化活性,此种调节方式称别构调节。
第六章糖代谢1糖异生(gluconeogenei):非糖化合物(乳糖、甘油、生糖氨基酸等)转变为葡萄糖或糖原的过程2有氧氧化:机体利用氧将葡萄糖彻底氧化成H2O和CO2的反应过程,称为糖的有氧氧化(aerobico某idation)是体内糖分解供能的主要方式。
名词解释,简答和论述题模板

一. 名词解释(多数为理解为主)第一章蛋白质的结构与功能1.蛋白质一级结构:蛋白质分子中氨基酸的排列顺序称蛋白质的一级结构。
一级结构的主要化学键是肽键,有的还包含二硫键。
一级结构是蛋白质空间构象和特异生物学功能的基础。
5.生物活性肽:具有生物学活性的寡肽或多肽。
例如谷胱甘肽等。
2. 蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
蛋白质二级结构包括α-螺旋、β-折叠、β-转角和无规卷曲。
维持蛋白质二级结构的化学键是氢键3.蛋白质四级结构:由两条或两条以上多肽链组成的蛋白质,每一条多肽链都有其完整的三级结构,称为蛋白质的亚基,亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接,这种蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
4.肽单元(peptide unit):参与肽键的6个原子——C-α1,C,O,N,H,C-α2。
位于同一平面,C-α1和C-α2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成肽单元。
5. 盐析:指将硫酸铵、硫酸钠等无机盐类加入蛋白质溶液,破坏蛋白质在溶液中的稳定性因素而沉淀,各种蛋白质盐析时所需的盐浓度及pH均不同。
6.氨基酸的等电点:在某一pH值的溶液中,氨基酸解离成阴/阳离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的pH值称该氨基酸的等电点。
7.glutathine:即谷胱甘肽,是由谷、半胱和甘氨酸组成的三肽,分子中半胱氨酸的巯基是其主要功能基因,具有还原性和嗜核特性,故谷胱甘肽可保护机体免遭氧化剂和毒物的损害。
10.蛋白质变性:在某些物理或化学因素的作用下,蛋白质的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,称蛋白质的变性。
8.肽平面:参与肽键形成的6个原子(C-α1,C,O,N,H,C-α2)位于同一平面,C-α1和C-α2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成肽平面,即肽单元(peptide unit)。
生物化学名词解释

生物化学名词解释第一章蛋白质的结构与功能1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
2.必需氨基酸:指人体(和其它哺乳动物)自身不能合成,机体又必需,需要从饮食中获得的氨基酸。
编码氨基酸:构成人体蛋白质的氨基酸有20种,这20中氨基酸都具有特异的遗传密码,称为编码氨基酸3. 氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的PH 值,用符号PI表示。
4.稀有氨基酸:指存在于蛋白质中的20 种常见氨基酸以外的其它罕见氨基酸,它们是正常氨基酸的衍生物。
5.非蛋白质氨基酸:指不存在于蛋白质分子中而以游离状态和结合状态存在于生物体的各种组织和细胞的氨基酸。
6.构型:指在立体异构体中不对称碳原子上相连的各原子或取代基团的空间排布。
构型的转变伴随着共价键的断裂和重新形成。
7.蛋白质的一级结构:指蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。
8.构象:指有机分子中,不改变共价键结构,仅单键周围的原子旋转所产生的原子的空间排布。
一种构象改变为另一种构象时,不涉及共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
9.蛋白质的二级结构:指在蛋白质分子中的局部区域内,多肽链沿一定方向盘绕和折叠的方式。
10.结构域(STRUCTURAL DOMAIN)是指蛋白质亚基结构中明显分开的紧密球状结构区域,可被特定分子识别和具有特定功能。
11.蛋白质的三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
12.氢键:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
13.蛋白质的四级结构:指多亚基蛋白质分子中各个具有三级结构的多肽链以适当方式聚合所呈现的三维结构。
14.离子键:带相反电荷的基团之间的静电引力,也称为静电键或盐键。
15.超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
生物化学名词解释

⽣物化学名词解释第⼀章蛋⽩质的结构与功能第⼀节、蛋⽩质的分⼦组成1.⽣物体直接⽤于合成蛋⽩质的仅有20种,且均属于L-α-氨基酸(除⽢氨酸外)。
2.氨基酸的理化性质:两性解离、紫外线吸收、能与茚三酮反应⽣成蓝紫⾊化合物。
3.连接两个氨基酸的酰胺键成为肽键。
第⼆节、蛋⽩质的分⼦结构1.蛋⽩质复杂的分⼦结构分成4个层次:⼀级、⼆级、三级、四级结构,后三者统称为⾼级结构或空间构象。
并⾮所有的蛋⽩质都由四级结构,由⼀条肽链形成的蛋⽩质只有⼀级、⼆级和三级结构,由2条或2条以上肽链形成的蛋⽩质才有四级结构。
2.氨基酸的排列顺序决定蛋⽩质的⼀级结构。
概念:在蛋⽩质分⼦中,从N-端到C-端的氨基酸排列顺序称为蛋⽩质的⼀级结构。
主要化学键是肽键与⼆硫键。
3.多肽链的局部主链构象为蛋⽩质的⼆级结构。
概念:蛋⽩质的⼆级结构是指蛋⽩质分⼦中某⼀段肽链的局部空间结构,也就是该段肽链主链⾻架原⼦的相对空间位置,并不涉及氨基酸残基侧链的构象。
蛋⽩质的⼆级结构主要包括α-螺旋、β-折叠、β-转⾓和⽆规卷曲。
其中α-螺旋是常见的蛋⽩质⼆级结构。
超⼆级结构:在许多蛋⽩质分⼦中,可由2个或2个以上具有⼆级结构的肽段在空间上相互接近,形成⼀个有规则的⼆级结构组合。
模体是蛋⽩质分⼦中具有特定的空间构想和特定功能的结构划分。
4.多肽链在⼆级结构基础上进⼀步折叠形成三级结构。
概念:蛋⽩质的三级结构是指整条肽链中全部氨基酸残基的相对空间位置,也就是整条肽链所有原⼦在三维空间的排布位置。
结构域:分⼦量较⼤的蛋⽩质常可折叠成多个结构较为紧密且稳定的区域,并各⾏其功能。
5.含有两条或两条以上多肽链的蛋⽩质具有四级结构。
概念:体内许多功能性蛋⽩质含有2条或2条以上多肽链。
每⼀条多肽链都具有其完整的三级结构,称为亚基。
亚基与亚基之间呈特定的三维空间排布,并以⾮共价键相连接。
蛋⽩质的分⼦中各个亚基的空间排布以及亚基接触部位的布局和相互作⽤,称为蛋⽩质的四级结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物化学名词解释
第一章蛋白质
1.amino acid:An organic acid with an α-carbon atom linked to a carboxylic acid, an
amino group, a hydrogen atom, and a side chain (the R group). Twenty different amino acids are the building blocks of proteins.
2.peptide bond: A covalent linkage formed between the α-carboxyl group of one amino
acid and the α- amino group of another. Also known as an amide bond.
3.peptide: Two or more amino acids covalently joined by peptide bonds.
4.polypeptide: A long chain of amino acids linked by peptide bonds; the molecular weight
is generally less than 10,000.
5.Configuration. The spatial arrangement in which atoms are covalently linked in a
molecule.
6.Conformation. The spatial arrangement of atoms in a protein is called its conformation.
7.primary structure :In a polymer, the sequence of amino acids and any interchain and
intrachain disulfide bonds of a protein. This sequence is specified by genetic information.
8.secondary structure:The localized conformation of a protein. As the polypeptide chain
folds, it forms certain localized arrangements of adjacent amino acids .
9.peptide unit: The six atoms of the peptide group (Cα1、C、O、N、H、Cα2) lie in a single
plane, with the oxygen atom of the carbonyl group and the hydrogen atom of the amide nitrogen trans to each other.
10.T ertiary structure :The overall three-dimensional conformation of a protein in its
native folded state.
11.The molecular chaperones are large, multisubunit proteins that accelerate the folding
process by providing a protected environment where polypeptides fold into native conformations and form quaternary structures.
12.quaternary structure:In proteins containing more than one polypeptide chain, the
spatial arrangements of those chains (subunits) and the nature of contacts among them.
13.subunit: The independently three-dimensional structure in a protein with quaternary
structure.
14.allosteric effect:an effect that a small molecule, called an effector, noncovalently binds to
a protein and alters its activity.
15.Bohr effect : increase in the concentration of H+ and Pco2 reduces oxygen affinity to
hemoglobin
16.isoelectric point of protein: The pH at which a protein solute has no net electric charge
and thus does not move in an electric field.
17.denaturation of protein : Many physical and chemical reagents (urea or SDS, etc.) that
break noncovalent bonds disrupt secondary, tertiary, and quaternary structure of protein with attendant loss of biologic activity.。
