南航无机化学考研真题 (1)
无机化学2017年南京航空航天大学硕士研究生考试真题

南京航空航天大学2017年硕士研究生入学考试初试试题(A卷)科目代码:813满分:150 分科目名称:无机化学注意:①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、判断题(填写√或╳,20分)1. 隔离系统的热力学能恒定不变。
()2. 温度不变时,系统既不吸热也不放热。
()3. 冰在室温下自动溶化成水,是熵增起了主要作用。
()4. H2S溶液中,c(H+) = 2 c(s2-) ()5. 在氧化还原反应中,若两个电对的θE值相关越大,则反应进行得越快。
()6. 共价键的键长等于成键原子共价半径之和。
()7. 离子晶体具有脆性,是由于阳离子和阴离子交替排列,不能错位的缘故。
()8. I-可被F e3+氧化,但加入F-后就不被Fe3+氧化。
()9. 用浓氨水可检测氯气管道是否漏气。
()10. 加热CuCl2・2H2O时得不到无水的CuCl2。
()11. 焊接金属时,常用浓ZnCl2溶液处理金属表面。
()12. 镧系元素的原子核都是稳定的,锕系都是放射性的。
()13. 日常生活中,衣服上沾的铁锈可用高锰酸钾清洗。
()14. Cr2(SO4)3和Na2S溶液反应的主要产物是Cr(OH)3和H2S。
()15. 氨和空气的混合物在800 o C下通过铂铑丝网后,其主要产物为NO2。
()16. 溶液与沉淀分离的方法常用过滤法、离心分离法、蒸发法。
()17. 实验室常用的干燥剂变色硅胶失效后呈现红色。
()18. 白色的NH4VO3加热后变成棕色,是因为生成了V2O5。
()19. PCl4+的空间构型是正八面体。
()20. Fe(OH)3、Al(OH)3、Cr(OH)3均是难溶的氢氧化物,分离它们必须利用它们的溶解性和氧化还原性。
()二、填空题(20分)1. 滴定时如酸溶液滴在锥形瓶内壁上,应用少量蒸馏水把酸溶液洗下,否则会导致实验结果 。
《无机化学》考研复习题库(五套)-各校通用

D. pA = nRT/VA
12.气相反应 A(g)=B(g),某温度时 GA = GB ,则相应温度下该反应的平衡常数( )。
A. K = 0
B. K = 1 C. K = 10
D.无法确定
13.反应 PCl5(g) =PCl3(g)+ Cl2(g)平衡时 PCl5 分解率为 50%,平衡后体系总压力为 p,
A. 恒温下,增加反应物浓度;
B. 升高温度;
C. 恒温下,加催化剂;
D. 恒温下,改变总压力
4. H2 (g)+Br2 (g) 是:( )
2HBr(g) 在 800K 时 Kθ=3.8×105,1000K 时 Kθ=1.8×103,则此反应
A. 吸热反应; B. 放热反应;C. 无热效应的反应; D. 无法确定是吸热反应还是放热反 应
A. ClO2﹣、 PCl3、SO2 C. NO3﹣ 、 CO32﹣、 BCl3
B. NO3﹣、SO3、CO32﹣ D. CO2、H2O、NH3
9.Cu2+ CuCl 0.137 Cu
Cu2+ 0.158 Cu+ 0.522 Cu
Cu(OH)2 -0.080 Cu2O –0.358 Cu
A.①②③⑤B.①②③④C Nhomakorabea②③④⑥
D.③④⑤⑥
7. 依照酸碱电子理论,反应 Ag++2NH3=Ag(NH3)2+中(
)。
A.Ag+是酸,NH3 是碱
B. Ag(NH3)2+是酸碱配合物
C.Ag+是盐,NH3 是配位体
D. Ag(NH3)2+是盐
8. 下列各组分子或离子,中心原子都为 sp2 杂化的是( )
无机化学2013年南京航空航天大学硕士研究生考试真题

南京航空航天大学2013年硕士研究生入学考试初试试题A 卷科目代码: 813科目名称:无机化学满分: 150分注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、填空题(共20分,每空0.5分)1. 已知反应 2N 2O 5(g)4NO 2(g)+ O 2(g)的m r H ∆﹤0,则增加总压反应速率_____,平衡移动方向 ________,升高温度反应速率_____。
2. 对于电极反应Cr 2O 72- + 14H + + 6e = 2Cr 3+ + 7H 2O ,其他条件不变,随着氢离子浓度的降低,Cr 2O 72-的氧化性将 (增强,减弱,不变)。
3. 在配合物[CoCl 2(en)2]Cl 中,形成体是________,其配位原子是________,配位数是______,配位化合物应该读作________________。
4. 实验测得[Cr(NH 3)6]3+配离子的磁矩为 3.9 B.M.,则该配合的空间构型为______,属于____型配合物(填内轨或外轨),中心离子的杂化类型为_____。
5. 最难溶的硫化物是____,它可溶于_____和_____。
6. 已知 Mn 的元素电势图如下图所示:Mn Mn Mn MnO MnO MnO V V V V V ⎯⎯→⎯⎯⎯→⎯⎯⎯→⎯⎯⎯→⎯⎯⎯→⎯−+++++−+−18.1250.1396.0227.22456.04从该电势图判断在水中可以稳定存在的离子是 和 。
7. 用H 2O 2溶液漂白已变黑的古画,其原理是(化学方程式) 。
8. 三氯化铁蒸汽中含有的分子化学式为 ,其结构与金属 的氯化物相似。
9. 在AgNO 3溶液中,加入K 2CrO 4溶液,生成 色的 沉淀,将该沉淀加入氨水生成 ,再加入KBr 溶液,生成 色的 沉淀,将沉淀加入Na 2S 2O 3溶液,有 配离子生成。
【考研资料】2019年无机化学试题及答案(推荐下载)

北京市联合命题2019年硕士学位研究生入学考试试题(无机化学)√需使用计算器 □不使用计算器一、选择题(每小题 2分,共 30 分)1. 在室温和标准态时,下列反应均为非自发反应,在高温时仍为非自发的是 。
A .Ag 2O(s)→2Ag(s)+21O 2(g);B .N 2O 4(g)→2NO 2(g);C .Fe 2O 3(s)+23C(s)→2Fe(S)+23CO 2(g);D .6C(s)+6H 2O(g)→C 6H 12O 6(s)。
2. 以下列化学式表示的物质的溶度积都相同,其溶解度最大的是 。
A . MX ;B . M 3X ;C . M 2X ;D . MX 2。
3. 常温下,在50ml 0.1 mol/L HAc 溶液中加入等体积的水稀释,对稀释后的水溶液而言,下列叙述正确的是 (已知25o C 时,HAc 的解离常数为1.8×10-5)。
A .HAc 的解离度α增大,溶液pH 值增大;B .HAc 的解离度α减小,溶液pH 值减小;C .HAc 的解离度α增大,溶液pH 值减小;D .HAc 的解离度α增大,HAc 的解离常数增大。
4. NH 3分子和NF 3分子相应键角大小关系正确的是 。
A. ∠HNH >∠FNF ;B. ∠HNH < ∠FNF ;C. ∠HNH =∠FNF ;D. 不能确定。
5. 二氧化铅具有强氧化性的原因是。
A. Pb4+的有效核电荷大;B. Pb2+易形成配离子;C. Pb原子含有惰性电子对;D. Pb2+盐难溶于水。
6.若将N原子的排布式写为1s2,2s2,2p2x ,2p1y,则其违背了。
A.最低能量原理;B.洪特规则;C.泡利不相容原理;D.能量守恒原则。
7. 在实验室中,如何存放白磷。
A. 放在水中;B. 放在CS2中;C. 放在棕色玻璃瓶中;D. 放在棕色塑料瓶中。
8. 下列各电对中,标准电极电势值最大的是。
A.φ ([Ag(CN)2]-/Ag);B.φ ([Ag(NH3)2]+/Ag);C.φ ([Ag(S2O3)2]3-/Ag);D.φ (Ag+/Ag)。
考研无机化学真题答案解析

考研无机化学真题答案解析在考研过程中,无机化学是一门重要的科目,也是很多考生感到困惑和焦虑的科目之一。
对于无机化学的真题解析,能够帮助考生更好地理解和掌握无机化学的知识。
在本篇文章中,将为考生解析一些经典的考研无机化学真题。
第一道题目涉及的是配位化合物的光谱。
题目要求考生分析一种配位化合物在紫外-可见光区域的吸收光谱图。
在此之前,我们先来了解一下配位化合物及其光谱。
配位化合物是由一个或多个配位基通过与中心金属离子形成配位键而构成的化合物。
当配位基发生轨道杂化后与金属离子形成配位键时,会产生吸收光谱。
这是因为配位化合物的电子能级间隙在紫外-可见光区域。
要解析这道题目,需要先了解配位体的极化能力和计算晶体场理论。
配位体的极化能力越强,其分裂能越大,其在紫外-可见光区域的吸收峰就会更靠近短波长端。
而计算晶体场理论可以通过场可视化方法分析复合物的配位键类型以及配位离子的电子结构。
第二道题目涉及的是金属络合物的稳定常数和配位键特性。
在无机化学中,金属络合物的稳定常数是描述配位基与金属离子形成的配位键稳定性的量。
了解金属络合物的稳定常数和配位键特性,有助于我们理解金属离子与配位基的相互作用。
解析这道题目需要先了解配体的选择性和金属离子的选择性。
配体的选择性越大,表示其与金属离子形成的配位键稳定性越强。
而金属离子的选择性表示其容易离去的配位基。
题目中给出了一个金属络合物的配位键特性表,要结合该表分析金属离子与配位基形成的配位键稳定性。
首先需要根据配位基的选择性,确定哪个配位基在配位物中起主要作用。
然后根据金属离子的选择性,确定金属离子容易离去的配位基。
最后,根据金属离子和配位基的选择性,可以得出配位键的稳定性大小。
第三道题目涉及的是金属离子活性和氧化还原反应。
在无机化学中,金属离子的活性是指金属离子在氧化还原反应中的一种特性,它与金属离子的电子亲和力和离子半径有关。
了解金属离子的活性可以预测金属离子在氧化还原反应中的行为。
南京航空航天大学2012年813无机化学考研(试题)

南京航空航天大学2012年硕士研究生入学考试初试试题( A 卷) 科目代码: 813 科目名称: 无机化学 满分: 150 分注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、填空题(20分)1. 根据酸碱质子理论,PO 43-的共轭酸是 ;NH 4+的共轭碱是 。
2. 已知()()()32CaCO s CaO s CO g Δ⎯⎯→+的1m(298K) 178.32r H kJ mol θ−Δ=⋅,-11m (298K) =160.6r S J mol K θ−Δ⋅⋅,则反应的分解温度为 K 。
3. 已知某化学反应的速率常数为6.29×10-41s −,则此反应为 级反应,半衰期为 s 。
4. 放热反应的E a (正) E a (逆)(填大于,小于或等于)。
5. 某封闭系统从环境吸收100 J 的热量,并对外做功200 J ,则此系统热力学能的变化为 。
6. 已知12sp 24(Ag CrO ) 1.110K θ−=×,则该温度下该物质的溶解度为 mol ·L -1。
7. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),则六种物质中还原性最强的是 。
8. 第26号元素原子的电子排布是 。
9. 根据杂化轨道理论,N 与F 形成NF 3 时,采取 杂化,其分子构型为 。
10. H 3BO 3是 元弱酸,请写出相应的化学方程式 。
11. H 2S 在充足的空气中燃烧的化学方程式为 。
813无机化学第 1 页 共 4 页12. 在酸性的K 2Cr 2O 7溶液中,加入Pb 2+离子,可生成的沉淀物质是 。
13. 某溶液和Cl -离子作用,生成白色沉淀,加氨水后变黑,则该溶液可能存在的离子是 。
14. K 4[Fe(CN)6]的系统命名是______________________,中心离子采取的杂化方式为 。
2015-2018年南京航空航天大学考研试题813无机化学

其原因是为了增大液体压力。 11. 在实验操作中,蒸发皿和启普发生器都可以用来加热液体。 12. 用 NaOH 标准溶液滴定 HCl 溶液至终点时,酚酞变红,放置一会后红色消失,原因是
溶液吸收了空气中的 CO2,碱性减弱。 13. 实验操作中,不慎把苯酚溅到手上,应立即用 70℃以上的热水冲洗。 14. 酸度计长期不用时,复合电极应如何保存 3mol/l KCl 溶液中。 15. 在符合朗伯一比尔定律的范围内,有色物质的浓度,最大吸收波长,吸光度三者的关系
H3PO4
的
K
θ a1
=
6.7 ×10−3
K
θ a2
=
6.2 ×10−8
K
θ a3
=
4.5 ×10−13
2. 某溶液中含 Cl-和 CrO42-,它们的浓度分别是 0.10 mol·L-1 和 0.0010 mol·L-1,通过计算证
明,逐滴加入 AgNO3 试剂,哪一种沉淀先析出。当第二种沉淀析出时,第一种离子是否被
南京航空航天大学
科目代码: 科目名称:
2015 年硕士研究生入学考试初试试题ď A 卷 Đ
813 无机化学
满分: 150 分
注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无
效;③本试题纸须随答题纸一起装入试题袋中交回!
一、填空题(20 分)
1. 按 试 剂 所 含 杂 质 的 多 少 , 我 国 通 用 试 剂 纯 度 的 等 级 标 准 分 为 四 级 , 分 别 为 优 质
纯、
、
、实验试剂。
南京高校化学考研真题试卷

南京高校化学考研真题试卷一、选择题(每题2分,共40分)1. 化学计量学中,摩尔质量的单位是:A. 千克/摩尔B. 克/摩尔C. 千克D. 克2. 根据元素周期表,下列元素中原子半径最大的是:A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)3. 以下化合物中,属于非电解质的是:A. 硫酸B. 氯化钠C. 乙醇D. 氢氧化钠...二、填空题(每空2分,共20分)1. 根据阿伏加德罗定律,1摩尔任何物质都含有相同的_______。
2. 化学反应中,能量变化通常表现为_______和_______两种形式。
3. 有机化学中,碳原子的四个价电子可以形成_______个共价键。
...三、简答题(每题10分,共30分)1. 简述化学平衡的概念及其特点。
2. 描述原子吸收光谱法的基本原理。
3. 阐述什么是酸碱中和反应,并给出一个具体的化学方程式。
...四、计算题(每题15分,共30分)1. 已知某化合物的摩尔质量为40克/摩尔,求1千克该化合物的物质的量。
2. 某化学反应的平衡常数Kc=10,反应物A和B的初始浓度分别为0.1摩尔/升和0.2摩尔/升,求平衡时生成物C的浓度。
3. 某溶液的pH值为3,求该溶液的[H+]浓度。
...五、实验题(每题10分,共20分)1. 描述如何使用滴定法测定溶液的酸碱度,并说明实验中应注意的事项。
2. 简述如何通过实验确定一个未知有机化合物的分子式。
...六、论述题(每题30分,共30分)1. 论述绿色化学的重要性,并举例说明如何在实验室中实施绿色化学原则。
...【注】:本试卷仅供模拟练习使用,具体考试内容以实际考试为准。
【结束语】希望本试卷能够对同学们的化学考研复习有所帮助,通过不断的练习和学习,相信每位同学都能够在化学考研中取得优异的成绩。
祝各位考生考试顺利,前程似锦。
无机化学考研试题(含答案,已经整理好的)

⽆机化学考研试题(含答案,已经整理好的)⼀、单选题第2章热化学1、在下列反应中,Q p =Q v 的反应为()(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔⽣成焓的是()(A )2H(g)+ O 2(g)→H 2O (l )(B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g)3、由下列数据确定CH 4(g)的为() C(⽯墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1(A )211 kJ·mol -1;(B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1;(D )缺条件,⽆法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g),(2)= -393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是()(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为()(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,⽽系统失去5kJ 的热量给环境,则系统的内能变化为()(A )-15kJ (B ) 5kJ (C )-5kJ (D ) 15kJ7、表⽰CO 2⽣成热的反应是()(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (⾦刚⽯)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (⾦刚⽯)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (⽯墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1⼆、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧⽣成液态H 2O 和⽓态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。
南京航空航天大学-2018年-硕士研究生入学考试初试试题(A卷)-813无机化学

科目代码:813科目名称:无机化学 第1页 共3页 南京航空航天大学 2018年硕士研究生入学考试初试试题( A 卷 ) 科目代码:813 满分: 150分 科目名称: 无机化学 注意: ①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、填空题(30分)1. 镧系与锕系元素水合离子的颜色是由________引起的。
2. 根据酸碱质子理论,HNO 3的共轭酸是 ,NH 2-的共轭碱是 。
3. 硫的同素异形体中,室温稳定态是________,每个硫原子以________杂化轨道成键。
4. 按离子极化作用大小排列 FeCl 3,FeCl 2,KCl ,CaCl 2____________________________。
5. 既可以用来鉴定Fe 3+,也可以用来鉴定Co 2+的试剂是________,既可以用来鉴定Fe 3+,也可以用来鉴定Cu 2+的试剂是________。
6. 在配离子[Fe(CN)6]3-中,中心离子以d 2sp 3杂化与配体形成配位键,那么配离子的空间构型为 。
7. 溶液与沉淀分离的方法常用 、 、 。
8. 化学元素中,第一电离能最小的是 ,最大的是 。
9. 已知反应 2N 2O 5(g) 4NO 2(g)+ O 2(g)的m r H ∆﹤0,则增加总压反应速率_____,平衡移动方向________,升高温度反应速率_____。
(填增大或减小;正向或逆向)10. 在ⅢA--Ⅴ A 各族中,第四到第六周期元素最高氧化态氧化物的水合物,酸性最强的是________,碱性最强的是________。
11. 白色的NH 4VO 3加热后变成棕色,是因为生成了 。
12. 金在王水中溶解的反应方程式为 。
13. 第81号元素的离子在水中较稳定的氧化态是 ,原因是 。
14. 320o C 下,一级反应)()()(2222g Cl g SO g Cl SO +→的半衰期为s 4105.4⨯,则16.2 h 后,剩余的SO 2Cl 2的质量分数是 。
南京航空航天大学813无机化学2012-2018年考研专业课真题试卷

17. 对于电极反应 Cr2O72- + 14H+ + 7e = 2Cr3+ + 7H2O,其他条件不变,随着氢离子浓度的降低,Cr2O72-
的氧化性将
(填增强,减弱,不变)。
18. 用 H2O2 溶液漂白已变黑的古画,其原理是(化学方程式)
。
科目代码:813 科目名称:无机化学 第 1 页 共 3 页
5. 已知 E (HCN / H2 ) 0.545V ,试计算 ka (HCN) 。
6. 已知反应:
N2
g
2H
2
g
N2
H4
l
r
H
m,1
298.15K
50.63kJ
mol
1
H2
g
1 2
O2
g
H2O l
r
Hm ,2
298.15K
精都教育——全国 100000 考生的选择
我们的梦想,为成就更多人的梦想
南 京 航 空 航 天 大 学 研 究 生 入 学 考 试 试 题
原版考研真题试卷
更多考研真题、笔记、模拟、题库、讲义资料就上精都考研网 /
南京航空航天大学2018年考研专业课真题试卷(原版)
3. 试求 300 mL 0.50 mol·L-1 H3PO4 和 500 mL 0. 50 mol·L-1 NaOH 的混合溶液的 pH 值。已知 H3PO4 的 pKθa1=2.12;pKθa2=7.21;pKθa3=12.67。
4. 25℃时,晴纶纤维生产的某种溶液中,c(SO42-)为 6. 0×10-4 mol·L-1。若在 40.0 L 该溶液中,加入 0.010 mol·L-1BaCl2 溶液 10.0 L,问是否能生成 BaSO4 沉淀?如果有沉淀生成,问能生成 BaSO4 多少克?最 后溶液中 c(SO42-)是多少?已知 ksp (BaSO4 ) 1.11010
无机化学考试试卷及
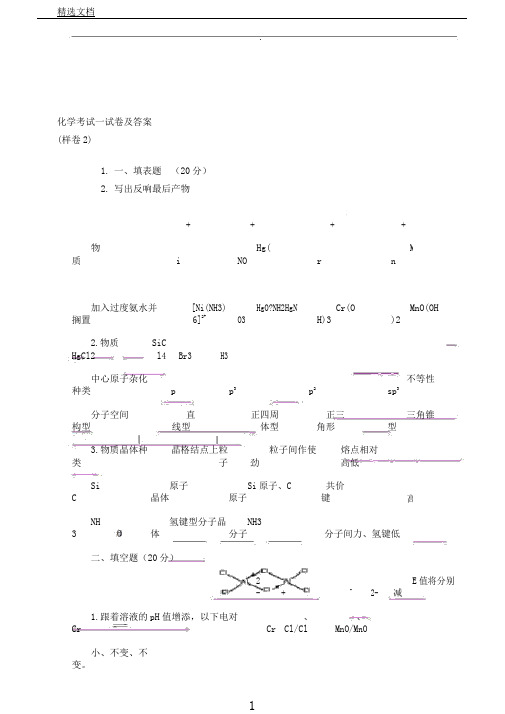
.化学考试一试卷及答案(样卷2)1.一、填表题(20分)2.写出反响最后产物物质Ni2++Cr3+2+Hg(NOMn3加入过度氨水并搁置[Ni(NH3)6]2+HgO?NH2HgNO3Cr(OH)3MnO(OH)22.物质HgCl2SiCl4BBr3PH3中心原子杂化种类spsp3sp2不等性sp3分子空间构型直线型正四周体型正三角形三角锥型3.物质晶体种类晶格结点上粒子粒子间作使劲熔点相对高低Si C原子晶体Si原子、C原子共价键高NH 3氢键型分子晶体NH3分子分子间力、氢键低二、填空题(20分)2 -4-2-E值将分别减1.跟着溶液的pH值增添,以下电对Cr/Cr+2的O、Cl/Cl、MnO/MnO小、不变、不变。
2.Na2SO3与__硫粉__共热可制得Na2S2O3,Cl2可将Na2S2O3氧化为__Na2SO4_。
依据θ24-2++2+,能够判断在构成电对的六种物质.E E4(Sn/Sn (PbO/PbSO)>(MnO/Mn)>中,氧化性最强的是,复原性最强的是Sn2+。
PbO-2+构成的原电池,其正极反响为-+5e2+ 4.用电对MnO/Mn,Cl/Cl MnO+8H→Mn+444H2O,负极反响为2Cl--2e→Cl,电池的电动势等于0.15V,电池符号为-2++θ-2+;-)(-)Pt,Cl 2p)Cl44E(Cl‖MnO,Mn,HPt(+)。
(E(MnO/Mn)=1.51V/Cl)=1.36V以下各溶液浓度均为0.1mol?L-1,按pH值从小到大次序摆列NH4NO3,NH4F,NH4OAc,KCN,Na2CO3。
KCN,NHF,NHOAc,NHNO,NaC O。
4Kθ323KθKθ(已知2×5(HF)=6.6×4(HCN)=6.2×11, -5(NH?HO)=1.81-71-11Kθ(HOAc) =1.8×,Kθ23×Kθ23×) 1(HCO)=4.41(HCO)=4.816 .已知EA/272-+1.36Cr+-0.41Cr+-0.86Cr,则Eθ22-2+,CrO(CrO/Cr)=0.917VCr2+可否发生歧化反响不可以。
考研_2017江苏南京航空航天大学无机化学考研真题

2017江苏南京航空航天大学无机化学考研真题一、判断题(填写 或╳,20 分)1. 隔离系统的热力学能恒定不变。
()2. 温度不变时,系统既不吸热也不放热。
()3. 冰在室温下自动溶化成水,是熵增起了主要作用。
()4. H2S 溶液中,c(H+) =()5. 在氧化还原反应中,若两个电对的值相关越大,则反应进行得越快。
()6. 共价键的键长等于成键原子共价半径之和。
()7. 离子晶体具有脆性,是由于阳离子和阴离子交替排列,不能错位的缘故。
()8. I-可被氧化,但加入 F-后就不被 Fe3+氧化。
()9. 用浓氨水可检测氯气管道是否漏气。
()10. 加热 CuCl2・2H2O 时得不到无水的 CuCl2。
()11. 焊接金属时,常用浓 ZnCl2 溶液处理金属表面。
()12. 镧系元素的原子核都是稳定的,锕系都是放射性的。
()13. 日常生活中,衣服上沾的铁锈可用高锰酸钾清洗。
()14. Cr2(SO4)3 和 Na2S 溶液反应的主要产物是 Cr(OH)3 和 H2S。
()15. 氨和空气的混合物在800下通过铂铑丝网后,其主要产物为。
()16. 溶液与沉淀分离的方法常用过滤法、离心分离法、蒸发法。
()17. 实验室常用的干燥剂变色硅胶失效后呈现红色。
()18. 白色的加热后变成棕色,是因为生成了。
()19. 的空间构型是正八面体。
()20. Fe(OH)3、Al(OH)3、Cr(OH)3 均是难溶的氢氧化物,分离它们必须利用它们的溶解性和氧化还原性。
()二、填空题(20 分)1. 滴定时如酸溶液滴在锥形瓶内壁上,应用少量蒸馏水把酸溶液洗下,否则会导致实验结果___________。
(填写偏高或偏低)2. 碘化物溶液中加入氯水和 CCl4,经振荡后溶液颜色变为___________色。
3. 在 BN(立方),FeCo,LiH,BBr3 四个晶体中,熔点最低的是___________。
4. 用电对组成的原电池,其正极反应为___________,负极反应为___________,电池的电动势等于___________,电池符号为___________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习题1:为什么N2 的电离能大于N的电 离能,而O2的电离能小于O的电离能? 又为何N2的电子亲和能小于N的电子亲 和能,而O2的电子亲和能也小于O的电 子亲和能?
习题2:为什么由非极性键构成的O3分 子却具有极性?
习题4:碲(Te)在地壳中的含量比Se 少很多, 但Se在自然界中一般与硫化 物共生而很少有独立矿物,碲却有很 多独立矿物,为什么?
O O O
1 1 6 .8 °
中心O采用sp2杂化。从结构分析,无成单 电子,具有抗磁性;由于三个O原子对大π 键贡献不同,加之三个氧原子上孤对电子 数不同,使得偶极矩不能完全抵消,因而 O3具有偶极矩(µ=1.93×10-30C·m),它 具有偶极矩( ),它 × ), 是唯一有偶极矩的单质。 是唯一有偶极矩的单质。
(2)性质
1.不稳定性:H2O2=H2O+1/2O2 Mn2+加速分解 光照及少量
2.氧化还原性:由于H2O2中氧的氧化数处于中 间,所以其既显氧化性又显还原性,但以氧化 性为主。 H2O2+2H++2e-=2H2O φ=1.77V PbS+4H2O2=PbSO4+4H2O 原 反应常用于古画复
O2+2H++2e-=H2O2 φ=0.68V 2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2 +K2SO4+8H2O 用于H 用于H2O2浓度测定。 由于H2O2氧化或还原产物为O2或H2O,不 给系统带进杂质,故为常用氧化剂或还原 剂之一。 3.弱酸性:H2O2显弱酸性,与强碱发生中 和反应。 H2O2+Ba(OH)2=BaO2+2H2O
2、亚硫酸及其盐 、 (1) 不稳定性(对酸): SO32-+2H+=H2SO3=SO2+H2O (2)氧化还原性:由于S(Ⅳ)氧化 态处于中间,故其既显氧化性,又显 还原性,一般以还原性为主: SO2(aq)+4H++4e-=S(s)+2H2O(l) φ=0.50V SO42-(aq)+H2O(l)+4e-=SO32(aq)+2OH-(aq) φ=-0.94V
(1) Na2O2与过量的冷水作用 (2) 几滴热水滴在Na2O2固体上 (3) 电解硫酸和硫酸氨的混合溶液 (4) 将难溶于水和酸的Al2O3变成可溶性 的硫酸盐 (5) 无氧条件Zn粉还原酸式亚硫酸钠溶液 (6) 将SeO2溶于水然后通入SO2气体 (7) 用盐酸酸化多硫化铵溶液 (8) 在中等酸度的钛(Ⅳ)盐溶液中加入H2O2
,
Na2S2O3、Na2S2O6其标签已脱落, 设计一种简便方法鉴别它们。
5.完成并配平下列方程式. .完成并配平下列方程式.
(1) (2) (3) (4) (5) (6) (7) (8) (9) (10) S + NaOH→ H2S + H2O2→ H2S + O2→ H2S + ClO3 + H+→ S2- + SO32-+H+→ Na2S2O3 + I2→ SO2+ H2O + Cl2→ H2O2 + MnO4- + H+→ Na2O2 + CO2→ KO2 + H2O→
.8.有一白色固体A,加入油状无色液 体酸B,可得紫黑色固体C,C微溶于水, 加入A后C的溶解度增大,成棕色溶液D, 将D分成两份,一份加入无色溶液E, 另一份不断通入气体F,两份都褪色变 成无色透明溶液。E溶液遇酸有淡黄色 的沉淀,将气体F通入溶液E,在所得 溶液中加入BaCl2 溶液有白色沉淀,后 者难溶于HNO3。问A~F各为什么物质? 写出各反应方程式。
3CuS+8HNO3=3Cu(NO3)2+3S↓+2NO↑+ 4H2O (4)不溶于HNO3 而溶于王水,如: HgS,Ksp=10-54 ,一般为氧化还原平衡和 配 位 平 衡 代 替 沉 淀 平 衡 。 如 : 3HgS+2HNO3+12HCl=3H2[HgCl4]+3S↓+2N O↑+4H2O (5)溶于硫化钠或多硫化钠溶液中, 如SnS、SnS2、Sb2S3、Sb2S5 SnS2+Na2S=Na2[SnS3]
O3+CN-=OCN-+O2 ; 2OCN-+3O3+H2O=2HCO3- +N2+3O2
四、硫化物 由于S2-变形性很大,如果阳离子的价 电子构型为18,18+2,9~17e- 构型, 则由于它们具有较大的极化能力,与 硫离子间有强烈的相互极化作用,从 而使硫化物由离子键向共价键过渡, 因而生成难溶的有色硫化物,此为硫 化物最重要的特点。
元素部分二
二、氢化物 1、H2O2 、 (1)制备:电解 )制备:电解60%的H2SO4,减压 的 蒸馏得H 水解得H 蒸馏得 2S2O8,水解得 2O2。 H2S2O8 +2H2O = 2H2SO4 +H2O2
2. H2+O2 = H2O2 (2-乙基蒽醌,钯催化剂) (2)实验室: a.Na2O2+H2SO4+10H2O= Na2SO4·10H2O+H2O2(低温) b. BaO2+H2SO4=BaSO4+H2O2(低温)
酸性溶液中存在主要物种是SO2 , 而不是H2SO3 。SO2 在酸性溶液中是个 好的氧化剂,SO32- 在碱性中主要为还 原剂。如: 2Na2SO3+O2=2Na2SO4 SO32-+Cl2+H2O=SO42-+2Cl-+2H+ SO32-+2H2S+2H+=3S↓+3H2O H2SO3+2H2S=3S↓+3H2O
13.试将以下分子或离子的OSO键角按 由大到小的顺序排列,并简述理由。 SO2, SO3, SO32-, SO42-
14.指出下列分子或离子是否含有特殊 键型(离域π键、d-pπ配键,并指出是 哪种键型及数目。 O3, SO2, SO3, SOCl2, H2SO4, H2S2O3,H2S2O8,H2S4O6 15.硫代硫酸钠在药剂中常用作解毒剂, 可解卤素单质、重金属离子及氰化物 中毒。试说明其作用原理,并写出反 应方程式。
Байду номын сангаас
习题5:比较含有-S-S-键和-O-O-键化 合物的性质和分子结构。
练 习
1.
题
回答下列问题.
(1)为什么O 2具有顺磁性,而O3却具有反磁性? (2)油画放置久了,为什么会发黑.发暗?如何恢 复? (3) 为 什 么 SOCl 2 既 可 以 做 Lewis 酸 又 可 以 做 Lewis碱? (4)给出重水和重氧水的分子式 (5)为什么向FeCl3溶液中注入H2S没有Fe2S3生成?
氧族元素 氧族元素的通性: 一、氧族元素的通性 O, S, Se, Te, Po 价电子构型为ns2np4, 氧化态为-2,0,+2,+4,+6 氧一般是-2氧化态,自然界许多金属 矿石都是以氧化物或硫化物形式存在 的,故氧族元素又称为成矿元素。电 离能是从上到下递减。O,S为非金属 ;Se,Te是半金属;Po为典型金属, 是一个完整系列。
(3)亚硫酸钠与硫作用,可生成 硫代硫酸钠: Na2SO3+S Na2S2O3 3、硫代硫酸及其盐 、 •(1)对酸不稳定性: • S2O32-+2H+=SO2↑+S↓+H2O •(2)还原性: 2Na2S2O3+I2=Na2S4O6+2NaI • 碘量分析法基础
(3)配位性: AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr 此反应用于感光片的定影。 • (4)S2O32-的鉴定:在中性介质中 ,和过量的AgNO3作用,得到沉淀颜色 由白→黄→棕→黑,这是鉴定S2O32-的 特殊方法,具体反应为: 2Ag++S2O32-=Ag2S2O3↓(白) Ag2S2O3+H2O=Ag2S↓(黑)+H2SO4
(2)性质: 是一还原剂,其水溶液易被空气氧化 ,不能长久保存,H2S易与金属形成硫 化物,且大多数不溶于水,故它是一 种沉淀剂。H2S可以使Pb(Ac)2试纸变黑 ,因而可用此反应检验H2S的存在,反 应式为: H2S+Pb(Ac)2=PbS+2HAc
三. 臭氧的结构和性质 1. 价键结构
O O
2.比较氧族元素和卤素的氢化物在 2.比较氧族元素和卤素的氢化物在 酸性,还原性,热稳定性方面的递 变规律 3.叙述SO 3.叙述SO3. H2SO4和发烟硫酸的相 互关系,写出固态,气态SO 互关系,写出固态,气态SO3的结构 式
4.有四种试剂:Na 4.有四种试剂:Na2SO4、Na2SO3
12.填空题: 12.填空题:
1)从空气中分离稀有气体时,将液态空 气分馏出氧,氮之后,为了纯化稀有气体, 可使气体通过 除去CO2,
通过 除去微量氧,再通过 除 为主的稀有气 去N2,剩下气体便是以 体了。
(2)将Cl2通入热的NaOH溶液中,反应的产物 是 ;将 Br2加入低温下的NaCO3溶液, 反应的是 ;常温下I2与NaCO3溶液反应 的产物是 。 (3)液态BrF3有较高的导电性,其原因 是 。
6.一种钠盐A溶于水后,加入稀盐 酸,有刺激性气体B产生,同时有 黄色沉淀C生成。气体B能是高锰酸 钾溶液褪色,若通Cl2气于A溶液中, Cl2消失并得到溶液D。D与钡盐作用, 产生不溶于稀硝酸的白色沉淀E, 试确定A、B、C、D、E各为何种物 质?写出各步反应方程式。
7.完成下列反应的化学方程式 7.完成下列反应的化学方程式
五、硫的含氧酸及其盐 1、硫酸 、 浓硫酸与稀硫酸氧化性不同,在稀H2SO4 中,显氧化性的主要为H+,如: H2SO4(稀)+Zn=ZnSO4+H2↑ 浓硫酸是脱水剂和强氧化剂,其显氧化作 用的为S(Ⅵ),它可以被还原成低氧化数的 SO2、S、H2S等,如: 2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O 5H2SO4(浓)+4Zn=4ZnSO4+H2S↑+4H2O
