资料3(立题目的与依据)
医疗机构应用传统工艺配制中药制剂备案资料项目及说明

医疗机构应用传统工艺配制中药制剂备案资料项目及说明一、备案资料项目(一)《医疗机构应用传统工艺配制中药制剂备案表》原件。
(二)制剂名称及命名依据。
(三)立题目的和依据;同品种及该品种其他剂型的市场供应情况。
(四)证明性文件,包括:1.《医疗机构执业许可证》复印件、《医疗机构制剂许可证》复印件。
2.医疗机构制剂或者使用的处方、工艺等的专利情况及其权属状态说明,以及对他人的专利不构成侵权的保证书。
3.直接接触制剂的包装材料和容器的注册证书复印件或核准编号。
4.未取得《医疗机构制剂许可证》或《医疗机构制剂许可证》无相应制剂剂型的医疗机构还应当提供以下资料:(1)委托配制中药制剂双方签订的委托配制合同复印件;(2)制剂受托配制单位的《医疗机构制剂许可证》或《药品生产许可证》复印件。
5.已取得批准文号的传统中药制剂,在该批准文号有效期届满后,不予再注册,符合备案要求的,可提交原批准证明文件及其附件的复印件,以及资料(一)、(四)、(七)、(九),按规定进行备案;对此前已受理的此类制剂注册申请,申请人可选择申请撤回,向湖北省药品监督管理局备案。
6.备案材料真实性承诺书(五)说明书及标签设计样稿。
(六)处方组成、来源、理论依据及使用背景情况。
(七)详细的配制工艺及工艺研究资料。
包括工艺路线、所有工艺参数、设备、工艺研究资料及文献资料。
(八)质量研究的试验资料及文献资料。
(九)制剂质量标准及起草说明。
(十)制剂的稳定性试验资料。
(十一)连续3批样品的自检报告书。
(十二)原、辅料的来源及质量标准,包括药材的基原及鉴定依据、前处理、炮制工艺、有无毒性等。
(十三)直接接触制剂的包装材料和容器的选择依据及质量标准。
(十四)主要药效学试验资料及文献资料。
(十五)单次给药毒性试验资料及文献资料。
(十六)重复给药毒性试验资料及文献资料。
(十七)其他。
处方在本医疗机构具有5年以上(含5年)使用历史的,其制剂可免报资料项目(十四)至(十六)。
(整理)药品注册分类及申报资料要求

附件2:化学药品注册分类及申报资料要求一、注册分类1.未在国内外上市销售的药品:(1)通过合成或者半合成的方法制得的原料药及其制剂;(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂;(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品:(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;(3)改变给药途径并已在国外上市销售的制剂;(4)国内上市销售的制剂增加已在国外批准的新适应症。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6.已有国家药品标准的原料药或者制剂。
二、申报资料项目(一)综述资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
(二)药学研究资料7.药学研究资料综述。
8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9.确证化学结构或者组份的试验资料及文献资料。
10.质量研究工作的试验资料及文献资料。
11.药品标准及起草说明,并提供标准品或者对照品。
12.样品的检验报告书。
13.原料药、辅料的来源及质量标准、检验报告书。
14.药物稳定性研究的试验资料及文献资料。
15.直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
化药4类申报资料清单
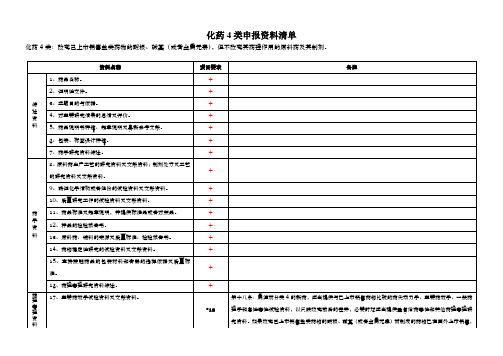
化药4类:改变己上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
资料名称
项目要求
备注
综述资料
1、药品名称。
+
2、证明性文件。
+
3、立题目的与依据。
+
4、对主要研究结果的总结及评价。
+
5、药品说明书样稿、起草说明及最新参考文献。
+
6、包装、标签设计样稿。
+
14、药物稳定性研究的试验资料及文献资料。
+
15、直接接触药品的包装材料和容器的选择依据及质量标准。
+
16、药理毒理研究资料综述。
+
药理毒理资料注册分类4的新药,应当提供与已上市销售药物比较的药代动力学、主要药效学、一般药理学和急性毒性试验资料,以反映改变前后的差异,必要时还应当提供重复给药毒性和其他药理毒理研究资料。如果改变己上市销售盐类药物的酸根、碱基(或者金属元素)而制成的药物已在国外上市销售,则按注册分类3的申报资料要求办理。
18、一般药理学研究的试验资料及文献资料。
*18
19、急性毒性试验资料及文献资料。
*18
20、长期毒性试验资料及文献资料。
*18
21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激牲、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
*19
第十九条:局部用药除按所属注册分类及项目报送相应资料外,应当报送资料项目21,必要时应当进行局部吸收试验。
23、致突变试验资料及文献资料。
±
可以用文献资料代替试验资料
24、生殖毒性试验资料及文献资料。
±
可以用文献资料代替试验资料
药品注册申报资料模版

申报资料目录(一)综述资料1、药品名称2、证明性文件3、立题目的与依据4、对主要研究成果的总结与评价5、药品说明书样稿、起草说明及最新参考文献6、包装、标签设计样稿(二)药学研究资料7、药学研究资料综述8、药材来源及鉴定依据12、生产工艺的研究资料及文献资料,辅料来源及质量标准15、药品标准草案及起草说明,并提供药品标准物质的有关资料16、样品及检验报告书17、药物稳定性研究的试验资料及文献资料18、直接接触药品的包装材料和容器的选择依据及质量标准(一)综述资料1、药品名称:汉语拼音:命名依据:根据《中华人民共和国卫生部药品标准中药成方制剂第十册》页2、证明性文件:附件1《药品生产企业许可证》复印件。
附件2《营业执照》复印件。
附件3《GMP认证证书》复印件。
附件4《不侵权行为保证书》。
附件5《药品包装材料和容器注册证》复印件。
3、立题目的与依据I- I -,中药“”处方来自《中华人民共和国卫生部药品标准中药成方制剂第十册》页。
处方由........ 等十七味中药构成,其中的作用为清热解毒、消肿散结,利尿通淋;的作用为泻热通肠、凉血解毒,逐淤通经;的作用为清热燥湿,泻火除蒸,解毒疗疮。
因此,具有,消肿止痛的功效。
对于脏腑毒热,血液不清引起的,血淋,白浊,尿道刺痛,大便秘结,疥疮,,红肿疼痛均有很好的疗效,受到广大医药工作者和患者的欢迎,市场前景广阔。
所以,我们选择了这个品种,通过试验对其生产工艺及质量标准进行了研究,进一步加强了生产过程中的中间体及产品的质量控制,提高了产品的质量。
尹 AL°、II II f/ f I /4、对主要研究成果的总结及评价:“”收载于《中华人民共和国卫生部药品标准中药成方制剂第十册》,根据国家有关药品管理的政策要求,现按中药注册分类第11类要求开展有关的研究工作,现将各项研究工作总结如下:4.1工艺研究我们对的提取工艺进行了研究。
其君药大黄的主要有效成分是蒽醌甙类物质,我们以大黄酚作为对照品,用HPLC法测定大黄酚的含量,计算提取过程中大黄酚的转移率,以确定最佳的提取条件。
2017年第80号_化学药品新注册分类申报资料要求(试行)

附件化学药品新注册分类申报资料要求(试行)第一部分注册分类1、2、3、5.1类申报资料要求(试行)一、申报资料项目(一)概要1.药品名称。
2.证明性文件。
2.1注册分类1、2、3类证明性文件2.2注册分类5.1类证明性文件3.立题目的与依据。
4.自评估报告。
5.上市许可人信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考文献。
8. 包装、标签设计样稿。
(二)主要研究信息汇总表9. 药学研究信息汇总表。
10. 非临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )生产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)生产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)非临床研究资料14.非临床研究资料综述。
15.主要药效学试验资料及文献资料。
16.安全药理学的试验资料及文献资料。
17.单次给药毒性试验资料及文献资料。
18.重复给药毒性试验资料及文献资料。
19.遗传毒性试验资料及文献资料。
20.生殖毒性试验资料及文献资料。
21.致癌试验资料及文献资料。
22.依赖性试验资料及文献资料。
23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。
24.其他安全性试验资料及文献资料。
25.非临床药代动力学试验资料及文献资料。
26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。
3 立题目的与依据

3 立题目的与依据化学药品6类己酮可可碱缓释片No.33、立题目的与依据一、品种简述 1、基本情况通用名称:己酮可可碱缓释片英文名称:Pentoxifylline Sustaind-release Tablets 汉语拼音:Jitongkekejian huanshipian化学名称:3,7-二氢-3,7-二甲基-1-(5-氧代己基)-1H-嘌呤-2,6-二酮结构式:分子式:C13H18N4O3 分子量:278.31理化性质:己酮可可碱为白色粉末或颗粒;有微臭,味苦。
在三氯甲烷中易溶,在水或乙醇中溶解,在乙醚中微溶。
2、药理作用及作用机制[1]己酮可可碱可以改善红细胞的变形能力,降低纤维蛋白的浓度,抑制血小板聚集,从而改善缺血组织的微循环,但对中枢神经系统无刺激作用。
3、剂型、规格本公司申报的己酮可可碱缓释片规格为0.4g,为市场已有规格。
4、适应症及用法用量[1]本品用于脑部血循环障碍如暂时性脑缺血发作,中风后遗症。
外周血循环障碍性疾病如血栓栓塞性脉管炎,间歇性跛行或静息痛。
内耳循环障碍如突发性耳聋,老年性耳鸣及耳聋。
眼部循环障碍,如糖尿病性视网膜动脉栓塞。
以下用药剂量指导适于成年人或体重超过50公斤的青少年:每次1片(相当于己酮可可碱400毫克),每日3次。
每日最大给药剂量为3片(相当于己酮可可碱1200毫克)。
对严重肾功能不全患者(肌酐清除率<10ml/min),需降低本品剂量至1化学药品6类己酮可可碱缓释片No.3正常用量的50-70%。
己酮可可碱缓释片应在餐后,用适量水,完整送服,不可嚼碎。
5、国内外上市情况己酮可可碱缓释片由赛诺菲制药1984年8月在美国上市,商品名“TRENTAL”,规格为400mg,目前有多家公司生产的产品在世界多个国家上市,国内由德国Merckle GmbH进口,商品名“瑞潘通”,但德国Merckle GmbH公司生产批件于2021年12月到期后就不再重新申请注册,因此国内无法购买到“瑞潘通”。
酮亮氨酸钙

化学药品注册分类6 第一部分综述资料Ⅰ―3酮亮氨酸钙α-Ketoleucine Calcium立题目的与依据研究机构:地址:邮政编码:资料编写人:资料完成日期:原始资料保存处:联系人:联系电话:药品注册申请人:资料3:立题目的与依据一、品种的一般情况[通用名] 酮亮氨酸钙[英文名] α-Ketoleucine Calcium[化学名] 4-甲基-2-氧代戊酸钙[汉语拼音] Tongliang’ansuangai[结构式][分子式] C12H18CaO6[注册分类] 本品已在中国上市销售,根据《药品注册管理办法》的规定,本品属化学药品第6类,即已有国家药品标准的原料药。
[作用特点] 酮亮氨酸钙在体内利用非必需氨基酸的氮转化为亮氨酸而发挥作用。
亮氨酸为人体8种必需氨基酸之一,属支链氨基酸。
L-亮氨酸是复合氨基酸静脉注射液不可缺少的原料,对于维持危重病人的营养需要,抢救患者的生命起着积极的作用。
同时作为支链氨基酸,因其氧化速率较快,在体内分解产生ATP的效率高于其它氨基酸,从而用来补充大运动量引起的能量消耗,减轻由此引起的中枢神经系统的疲劳反应,减少高强度运动造成的蛋白质分解。
二、立题背景营养治疗一直是延缓慢性肾病(CKD)进展、缓解尿毒症症状的一种有效措施。
而根据Brenner的“超滤学说”理论,残余肾单位的过度滤过,引起球内压力增高,同时增加肾小球滤过率,使残余肾单位劳损,造成慢性肾脏病的不断进展与恶化。
其中,饮食蛋白的含量是调节肾小球滤过的最主要因素。
因此,饮食疗法的目的不仅仅在于减少尿毒症的症状,还在于保护残余肾功能。
由德国Fresenius公司开发并于1990年进口中国的肾灵片(Ketosteril Tablets),目前的通用名为:复方α-酮酸片(商品名:开同®),为解决上述问题提供了可行性依据,它是含4种α-酮基酸(酮酸)、1种α-羟基酸和5种必需氨基酸的复合制剂,其特殊的药理作用弥补了氨基酸在体内会增高肾小球滤过率和尿白蛋白排泄的不足。
新药申报资料目录

附件 2:药品补充申请注册事项及申报资料要求(一)综述资料:1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书样稿、起草说明及最新参考文献。
6.包装、标签设计样稿。
(二)药学研究资料:7.药学研究资料综述。
8.药材来源及鉴定依据。
9.药材生态环境、生长特征、形态描述、栽培或培植(培育)技术、产地加工和炮制方法等。
10.药材标准草案及起草说明,并提供药品标准物质及有关资料。
11.提供植物、矿物标本,植物标本应当包括花、果实、种子等。
12.生产工艺的研究资料、工艺验证资料及文献资料,辅料来源及质量标准。
13.化学成份研究的试验资料及文献资料。
14.质量研究工作的试验资料及文献资料。
15.药品标准草案及起草说明,并提供药品标准物质及有关资料。
16.样品检验报告书。
17.药物稳定性研究的试验资料及文献资料。
18.直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料:19.药理毒理研究资料综述。
20.主要药效学试验资料及文献资料。
21.一般药理研究的试验资料及文献资料。
22.急性毒性试验资料及文献资料。
23.长期毒性试验资料及文献资料。
24.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等) 刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
25.遗传毒性试验资料及文献资料。
26.生殖毒性试验资料及文献资料。
27.致癌试验资料及文献资料。
28.动物药代动力学试验资料及文献资料。
(四)临床试验资料:29.临床试验资料综述。
30.临床试验计划与方案。
31.临床研究者手册。
32. 知情同意书样稿、伦理委员会批准件。
33.临床试验报告。
(一)综述资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
(二)药学研究资料7.药学研究资料综述。
银丹心脑通片立题目的与选题依据

中药注册分类8 申报资料3 立题目的与依据(银丹心脑通片)课题名称银丹心脑通片研究单位 xxxx制药有限公司申报单位 xxxx制药有限公司联系人 xxx联系方式 Tel:Fax:立题目的与选题依据1、处方来源银丹心脑通软胶囊收载于国家药品监督管理局《国家中成药标准汇编》(中成药地方标准上升国家标准部分内科心系分册),银丹心脑通片是根据银丹心脑通软胶囊改变剂型的中药8类新药。
其【处方】为:银杏叶 500g 丹参 500g 灯盏细辛 300g 绞股蓝 300g 山楂 400g 大蒜 400g三七 200g 天然冰片 10gβ环糊精 15g 辅料适量制成 1000片2、选题目的与选题依据银丹心脑通片汇集了治疗心脑血管病最权威的八种药:银杏叶、丹参、绞股蓝、灯盏细辛、大蒜、三七、山楂、天然冰片。
其中,银杏叶、丹参、大蒜的有效成分结合,能扩张血管,促进血液循环,预防和消除动脉硬化,对防治冠心病、心肌梗塞疗效显著;绞股蓝、灯盏细辛、三七、天然冰片有效成分联合,能改善血液循环,修复受损脑组织,促进脑神经细胞的生长,防治中风及后遗症疗效肯定;银杏叶、大蒜、山楂、三七有效成分联合,能快速缓解头晕眼花、烦躁失眠、手脚麻木等心脑血管病初期症状。
银丹心脑通片具有活血化瘀、行气止痛,消食化滞等功效,临床上用于气滞血瘀引起的胸痹,症见胸痛,胸闷,气短,心悸等;冠心病心绞痛,高脂血症、脑动脉硬化,中风、中风后遗症见上述症状者。
据报道银丹心脑通具有以下特点:1、增强冠状动脉血流量,改善心肌缺血缺氧状态,降低心肌耗氧量;2、改善冠心病患者胸痛、胸闷、疲乏、气短、心悸等症状;3、改善脑血流量,增强脑供氧,改善缺血性中风患者上下肢肌力,语言表达等神经功能缺损综合功能;4、显著改善头晕目眩、头痛、心烦易怒、气短乏力、便干便秘等临床症状;5、对高血压冠心病患者及高血压缺血性中风患者有辅助降压作用。
6、具有明显的降血脂作用和防止动脉脂质增加,对冠心病患者、高脂血症缺血性中风患者的血脂代谢,对高甘油三脂血症的疗效尤为显著。
03立题目的与依据

立题目的与依据一、处方来源《中华人民共和国卫生部药品标准》二、选题依据本品原方以片剂应用,具有较好的抗菌消炎作用,临床反应效果较好。
但是为了为临床医师提供更多的剂型选择,且胶囊剂能掩盖方中药物的苦味和不良气味,便于服用,且较片剂和丸剂崩解快,释药迅速,所含药物不受黏合剂和压力的影响,能很快扩散到胃液中去,特研制复方苦木消炎胶囊。
三、有关传统的中医理论、古籍文献资料穿心莲Andrographis paniculata (Burm. f.) Nees又名一见喜,苦草,四方草,印度草等。
为爵床科穿心莲属植物。
主要成分有内酯,甾醇,多种黄酮类化合物,生物碱等。
味苦,性寒,归心,肺,大肠,膀胱经。
具有清热解毒,凉血消肿之效。
是一种来源广毒副作用少的常用中草药。
临床上常用于治疗感冒,扁桃体炎,支气管炎,急性菌痢,胃肠炎等多种感染性疾病,此外还用于治疗恶性葡萄胎及绒毛膜上皮癌等。
苦木Picrasma quassioides (D. Don) Benn。
系苦木科植物,自古供药用,其根及茎有清热燥湿、解毒、杀虫的功能;用于菌痢、胃肠炎、胆道感染、;蛔虫病、急性化脓性感染、疥癣、湿疹、烧伤等症。
痢疾、肠炎等感染性疾患是因外感时邪疫毒所致的邪蕴肠腑、气血壅滞,传导失司。
所谓“时邪引起”,是指痢疾多发于夏秋之交,此时正值热郁湿蒸之际,湿热之邪侵入人体,蕴于脏腑导致发病。
所谓疫毒引起,是指具有传染性的致病邪气流行,相互传染导致痢疾流行。
方中穿心莲、苦木清热燥湿,解毒,适用于湿热型痢疾、泄泻等疾病。
四、国内外研究现状或生产使用情况综述复方苦木消炎片主要有广谱的抗菌作用、广谱的抗病毒作用和解热、镇痛、抗炎作用,临床上用于各种急性传染性疾患:呼吸道感染、耳鼻喉科感染、胃肠道感染、泌尿生殖系统感染、妇科感染、骨伤科感染、皮肤软组织感染及各种病毒性感染疾病。
目前国内只有复方苦木消炎片上市,根据《药品注册管理办法》附件一分类要求,本品为中药9类新药。
化药注册分类

附件二:化学药品注册分类及申报资料要求一、注册分类1、未在国内外上市销售的药品:(1)通过合成或者半合成的方法制得的原料药及其制剂;(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂;(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品:(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;(3)改变给药途径并已在国外上市销售的制剂;(4)国内上市销售的制剂增加已在国外批准的新适应症。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
二、申报资料项目(一)综述资料1、药品名称。
2、证明性文件。
3、立题目的与依据。
4、对主要研究结果的总结及评价。
5、药品说明书、起草说明及相关参考文献。
6、包装、标签设计样稿。
(二)药学研究资料7、药学研究资料综述。
8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9、确证化学结构或者组份的试验资料及文献资料。
10、质量研究工作的试验资料及文献资料。
11、药品标准及起草说明,并提供标准品或者对照品。
12、样品的检验报告书。
13、原料药、辅料的来源及质量标准、检验报告书。
14、药物稳定性研究的试验资料及文献资料。
15、直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料16、药理毒理研究资料综述。
17、主要药效学试验资料及文献资料。
18、一般药理学的试验资料及文献资料。
化药指导原则-立题目的与依据-刘瑞锦

复方制剂的组成 拟用于临床的适应症及用法用量 申报药品的注册分类及依据
申报生产时,注明临床试验的批件号及批准时间
1、品种基本情况
申报原料药时,应说明不原料药同时申报的制剂的基本情况。对
于目前在研并拟随后申报的制剂品种的情况亦可简要介绍。
申报制剂时,应说明原料药的来源及执行的质量标准,以及本申 报单位有无同一原料药的其他制剂品种的申报。
立题目的与依据是非常重要的部分,也是审评 老师首先审评的部分。很多品种如果该项资料写 的不到位可能马上面临被退审。
二、具体内容与要求
参考文献
品种基本情况
综合分析
具体内容
立题背景
国内外有关该品种 的知识产权等情况
品种的特点
1、品种基本情况
品种基本情况 简要概括品种各方面情况
药品名称 化学结构式、分子式、分子量、基本理化性质 药物的药理作用及作用机制 制剂的剂型、规格
3、2012年CDE电子刊物
未能对剂型改变的合理性进行全面的 分析阐述 近年来改剂型品种 申报多,但出现大 多立题依据丌符合 要计合理可行的临床试验方案
完成的临床试验丌能支持剂型选择和 立题依据的合理性
三、政策动态
基本要求
对现有产品的全面分析 提出产品的设计目标 围绕设计目标开展研究工作 对研究工作结果的解析
6、参考文献
所引文献按照期刊中参考文献的格式依次罗列在【参考文 献】项下,资料原文复印件附在该项资料之后
参考文献格式大致如下:
[1] 国家食品药品监督管理局. XXXXX注射液 国家药品标准. WS1-(X-XX)-2005Z [2] 沈永年. 磷缺乏综合征(综述). 临床儿科杂志. 1991,9( 5):333-335
化学药品注册分类及申报资料要求

附件2:化学药品注册分类及申报资料要求一、注册分类1.未在国内外上市销售的药品:(1)通过合成或者半合成的方法制得的原料药及其制剂;(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂;(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品:(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;(3)改变给药途径并已在国外上市销售的制剂;(4)国内上市销售的制剂增加已在国外批准的新适应症。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6.已有国家药品标准的原料药或者制剂。
二、申报资料项目(一)综述资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
(二)药学研究资料7.药学研究资料综述。
8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9.确证化学结构或者组份的试验资料及文献资料。
10.质量研究工作的试验资料及文献资料。
11.药品标准及起草说明,并提供标准品或者对照品。
12.样品的检验报告书。
13.原料药、辅料的来源及质量标准、检验报告书。
14.药物稳定性研究的试验资料及文献资料。
15.直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用炎琥宁立题目的与依据
一.研制目的和注册分类
穿心莲内酯(Andrographolide)系自爵床科植物穿心莲Andrographis paniculata Nees中提取到的二萜内酯类化合物,是中药穿心莲的主要有效成份之一,具有清热解毒、凉血消肿等功能。
现代药理学研究表明,穿心莲内酯及其衍生物(如脱水穿心莲内酯琥珀酸半酯、穿琥宁注射液等)具有消炎抗菌、抗病毒感染、抗肿瘤、抗心血管疾病、免疫刺激、保肝利胆及抗生育等功能。
(1)
我公司所研制的注射用炎琥宁(脱水穿心莲内酯琥珀酸半酯钾钠盐),已有同类产品上市。
按照《药品注册管理办法》的规定,该药属化药6类。
二.炎琥宁的临床应用情况
1.穿心莲抗癌的体外实验(2)
实验证明穿心莲提取物在低浓度下(5ug/ml)只对SW620表现出一些增殖抑制作用(约28%),而在高浓度下(500ug/ml)对HepG2(人体肝癌细胞株)的增殖抑制作用特别强烈,高于90%。
对人体肠腺细胞株SW620、LS180、和HT129的增殖抑制率分别为40%、34%和48%。
2. 对机体免疫功能的影响(3):穿心莲水煎剂在体外能提高人体白细胞吞噬金黄色葡萄球菌的能力。
口服穿心莲能使肿瘤病人及其它病人或健康人对旧结核菌素所致的皮肤延缓型超敏反应增强。
3.穿心莲提取物对心血管系统作用的临床实验(4)
临床实验中研究了穿心莲提取物对63例心脑血管疾病患者服药后3小时或一周的临床观察,发现穿心莲对1及5分钟血小板聚集率均有明显抑制作用,且随用药时间延长(1周后)疗效更显著。
通过20名志愿者服药前后血浆及血小板5-羟色胺测定,证明穿心莲能显著抑制血小板释放5-羟色胺.透射电镜观察到无论体外用药还是服药,穿心莲均能明显抑制ADP诱导的血小板管导系统扩张及颗粒释放。
4.炎琥宁治疗小儿急性上呼吸道感染154例(5)
本次实验共选急性上呼吸道感染病例300例,其中治疗组(炎琥宁粉针剂)154例,对照组(病毒唑注射液)146例。
治疗3天后的结果如下:治疗组痊愈70例(45.5%),显效45例(29.2%),有效34例(22.1%),无效5例(3.3%),总有效率78.8%;对照组痊愈率38例(26.0%),显效32例(21.9%),有效45例(30.8%),无效31例(21.1%),总有效率78.8%。
治疗组疗效明显优于对照组。
5.炎琥宁注射液治疗小儿肺炎56例疗效观察(6)
将106例住院病人随机分为治疗组56例,对照组50例(青霉素和氧哌嗪青霉素)。
治疗组中治愈45例(80.4%);好转11例(19.6%);总有效率100%。
对照组中治愈39例(78%);好转11例(22%);总有效率100%。
观察4项指标两组有显著差异,结果如表1所示.表明炎琥宁治疗小儿肺炎在退热、止咳、肺部罗音消失、X线片炎症吸收方面优于对照组。
表1主要观察指标比较
6.炎琥宁冻干粉佐治婴幼儿轮状病毒性腹泻疗效观察(7)
将患儿随机分为观察组120例(炎琥宁冻干粉),对照组100例(葡萄糖注射液或葡萄糖氯化钠注射液)。
结果发现观察组用药后平均退烧时间(1.50±0.11)天;平均腹泻停止时间(2.15 ±0.11)天。
对照组平均退烧时间(2.20±0.31)天;平均腹泻停止时间(3.50±0.18)天。
两组比较有明显的差异。
三.炎琥宁的市场分析
炎琥宁为中药穿心莲的提取物,其主要成分是穿心莲内酯琥珀酸半酯钾钠盐,成盐完全,保证了产品的纯度和溶解度。
具有抗病毒、抗菌双重功效,并且临床应用未发现明显毒副作用。
其适应症广泛,发病人群广,市场容量大。
目前国内仅有重庆药友制药有限公司独家生产,其零售价格为0.2g*1支/ 38.67元。
我公司研制的该品主要为炎琥宁原料和炎琥宁冻干粉针剂,在一定程度上引进了市场竞争机制,满足了市场的进一步需求,降低了人民的用药负担。
参考文献:
1.刘新建,等.穿心莲内酯及其衍生物的药理研究进展.中药材.2003,26(2):135-138.
1.李玉祥,等.中草药抗癌的体外试验.中国医科大学学
报.1999,30(1):37-42.
2.彭光勇,等.莲必治注射液(穿心莲内酯)对免疫功能的调节作用.
中国中药杂志.27.2.2002年2月.
3.王建升,等.穿心莲药理研究最新进展.国外医学中医中药分
册.1998.20.6.
4.庞金敏.炎琥宁治疗小儿急性上呼吸道感染154例.中原医
刊.30.6.2003年3月.
5.李家才,等.炎琥宁注射液治疗小儿肺炎56例疗效观察.中国厂矿
医学.2003,16(1):66-67
6.孙彦启,等.炎琥宁冻干粉佐治婴幼儿轮状病毒性腹泻疗效观察.
山东医药.2003,43(9):45-46。
