硫酸亚铁铵制备的优化研究_刘艳菊(1)
硫酸亚铁铵制备实验的改进

少 ,可 省 略掉 铁 屑净 化 这一 步 ,无 污染 气 体产 生 , 而且 接触 反应 的 面积增 大 ,反应 速率 加快 :
()在 铁 粉与 稀 硫 酸反 应 中加 入碳 粉 ,形成 原 3
反应 较慢 ,操作 步骤繁 琐 。
()亚 铁离 子 的被 氧化 问题 。铁 粉 与 稀硫 酸 随 2 着反 应进行 ,常会 出现 黄色溶 液 或黑 色块状 物 .硫 酸 亚铁 溶 液 与饱 和硫 酸 铵 混 合 时 也 会 出 现 黄 色现 象 ,混 合液进行 蒸发 浓缩 时又 易 出现 黄色溶 液或 黄 色晶体 。其主要 原 因是 ,随着 反应 的进行 ,反应放
试 剂用量 过多 ,因此反 应 时间 长 ,本 次实验 将用量 缩 小约 1 倍 .铁粉 用 量04g 0 . 。若 3m lL 硫 酸用量 o・ 约 为25m . L,锥形 瓶 底 部 面积大 ,硫酸很 快被 蒸发
.
倾 析 ,洗涤 ,晾干 。再 取42g 净 的铁 屑 与2 L . 洗 5m
三相 体系 的相 图 ,通 过 改变水 和 乙醇 的 比例得 到硫
酸亚 铁铵 晶体 ,有利 于 防止 亚铁 离子 的氧化 以及硫 酸亚 铁铵产 率 的提高 ,还可 以通 过引 导学生 比较新
的过滤 结晶方 法 与传统 蒸发 结 晶方法 ,来 提高大 家 的学 习兴 趣 。
鼻 、呛人 的气体 。这是 由于铁屑 不纯 ,与稀硫 酸反
氏漏斗 ,具支试 管代替抽 滤泵 。用锥形瓶固定
管 ,医院外科 手术用 于 腹腔 积液 、腹 腔积血 病人 的
21 0 0年 . 7期 第
1 4
化学 教 学
21 0 0年 , 7期 第
硫 酸 亚 铁铵 制 备 实验 的 改进
实验2-4硫酸亚铁铵的制备

二、倾析法——物质分离的一种物理方法 1.实质:固液分离的一种方法。 2.适用范围:沉淀的结晶颗粒较大,静置后容易沉降 至容器的底部。
3.具体操作:静置后,将烧杯中的上层清液沿玻璃棒 倒入另一容器内,即可使沉淀与清液分离。具体操作 如图。
4.沉淀物的洗涤:向盛有沉淀物的烧杯中注入水(或其 他洗涤液),充分搅拌后使沉淀沉降,再用3中的方法 将清液倒出,重复几次即可。
2.制备硫酸亚铁溶液: 【操作】(1)称量:用托盘天平称取4.2 g洗净的铁屑, 放入洁净的锥形瓶中。 (2)加酸、过滤:向其中加入25 mL 3 mol·L-1H2SO4溶 液,加热并不断振荡锥形瓶。反应过程中应适当补充 水,使溶液体积基本保持不变,待反应基本完全后, 再加入1 mL 3 mol·L-1H2SO4溶液,趁热过滤。 (3)转移:将滤液转移至蒸发皿中。
1液柱高度保持不变防止倒吸naoh合理即可控制滴加硫酸的速度合理即可溶液变澄清或浑浊消失4取少量产品溶于足量稀盐酸静置取上层清液或过滤取滤液滴加bacl溶液若出现沉淀则说明含有na合理即可方法技巧程序法解物质制备实验题的三个步骤程序法解物质制备实验题一般分为三个步骤
课题1 硫酸亚铁铵的制备
1.了解复盐硫酸亚铁铵的制备原理和方法。 2.训练物质的称量、溶解、加热、结晶、抽滤、水浴 加热、倾析法分离或洗涤等操作技能。 3.通过制备实验,进一步了解分离与提纯化合物最常 用和最简单的一些方法。 4.了解、学习并尝试有关制备实验方案的设计。
3.制备硫酸亚铁铵晶体: 【操作】(1)加硫酸铵饱和溶液:称取9.5 g(NH4)2SO4 晶体,配成饱和溶液,倒入制得的硫酸亚铁溶液中。 (2)蒸发浓缩:搅拌溶液,小火加热,在蒸发皿中蒸发 浓缩至溶液表面出现_晶__膜__为止。
用绿色化学理念改进硫酸亚铁铵制备实验

用绿色化学理念改进硫酸亚铁铵制备实验:针对无机化学实验硫酸亚铁铵制备中存在着废气污染及产物一级品率低的问题,提出相应的解决方法,改进后的制备实验切实可行,更符合绿色化学的要求:硫酸亚铁铵;绿色化学;无机实验:1005-6629(2021)05-0008-02:G633.8文献标识码:C1硫酸亚铁铵制备实验的优点与不足之处“硫酸亚铁铵的制备”是常选化学选修实验之一。
其制备实验步骤为:第一步先制备中间产物硫酸亚铁,第二步将硫酸亚铁与等摩尔的硫酸铵混合蒸发浓缩,利用在0-40℃时复盐的溶解度比构成复盐的任一组分硫酸亚铁和硫酸铵小的特性,冷却至室温析出硫酸亚铁铵结晶,工艺流程如图1所示。
该实验通常选用机械加工及制造行业产生的废弃物——铁屑为原料。
从环境爱护的角度来说,属于变废为宝、再生利用钢铁资源的环保型实验。
通过本实验学生一方面可学到一系列化学合成的差不多操作如:称量、除杂、加热、倾析、抽滤、溶解、蒸发、结晶,了解利用杂质含量给产品定级的鉴定方法;另一方面,让学生初步认识关于既白费资源又污染环境的废弃物如何通过化学方法转变为有用物质这一绿色化学工艺。
然而,由于原实验装置为放开式,废铁屑含有的碳、硫、磷、硅等杂质和硫酸反应时生成H2S、H3 P等有毒气体,导致实验室充满着强烈的刺激性气体,直截了当危害师生的躯体健康。
另外,实验的结果也不能令人中意,产物能达到级品的学生不多,级品的占了专门大的比例,这要紧是因为合成硫酸亚铁中间产物时,原实验采纳的工艺流程及操作极易导致Fe2+被氧化成Fe3+,增加产物中杂质Fe3+含量。
2改进实验的依据实现人类的可连续进展,大力进展绿色化学,是时代给予化学工作者的一项重要战略任务。
高校化学实验的绿色化工作也在不断地探究和全面推进。
绿色化学使用化学药品的差不多原则为:不用危害品,循环使用,回收利用资源,零排放。
与绿色化学要求相比,硫酸亚铁铵制备实验存在着以下两个缺点:废气有待治理和未达到原料的最大限度的合理利用。
硫酸亚铁铵制备实验教学方法的改进

硫酸亚铁铵制备实验教学方法的改进段辉;庄璐;陈云;王晓岗【摘要】针对\"硫酸亚铁铵的制备\"实验在教学中存在的不足进行改进,利用还原铁粉代替铁屑,提高反应速率并简化了后处理,采用数显程控恒温水槽来控制产品的合成与蒸发结晶,使反应能平稳快速的进行,避免了\"爆沸\"现象的发生,并使得产品形貌得到较大改善,同时,通过回收实验产物减少实验过程中产生的三废.改进后的实验在提高实验安全、改善产品性质、提高产率、普及绿色化学理念等多方面取得了较好的成效,用于本科实验教学取得良好的教学效果.【期刊名称】《实验室科学》【年(卷),期】2019(022)001【总页数】4页(P60-62,65)【关键词】硫酸亚铁铵;数显程控恒温水槽;实验效果【作者】段辉;庄璐;陈云;王晓岗【作者单位】同济大学化学化工实验教学示范中心, 上海 200092;同济大学化学化工实验教学示范中心, 上海 200092;同济大学化学科学与工程学院, 上海200092;同济大学化学化工实验教学示范中心, 上海 200092【正文语种】中文【中图分类】O614.81“硫酸亚铁铵的制备”是普通化学实验[1-3]课程里的一个经典实验,其基本原理是先用铁和硫酸反应,制得硫酸亚铁,然后再将硫酸亚铁和硫酸铵反应得到硫酸亚铁铵复盐,最后通过浓缩获得复盐产物的晶体[4-5]。
实验教学的目的主要是加深学生对溶解度概念的理解,训练学生称量、溶解、加热、蒸发、减压抽滤等基本实验操作技能[6]。
1 原实验教学中存在的问题“硫酸亚铁铵的制备”实验主要针对非化学类专业的学生开设,实际教学时数为2节课(2课时)。
实验过程可分为三大步骤:第一步是制备FeSO4。
在水浴加热的条件下,以碎铁屑为原材料和硫酸进行反应,实验中控制反应不要过于激烈,同时注意补充蒸发掉的少量的水,以防止FeSO4结晶,待反应速度明显减慢,用漏斗趁热过滤。
如果滤纸上有FeSO4·7H2O晶体析出,用热的去离子水将晶体溶解洗涤,洗涤液合并至反应液中。
硫酸亚铁铵制备实验的改进

硫酸亚铁铵制备实验的改进摘要对硫酸亚铁铵的制备实验进行了改进。
减少空气含氧量、加酸抑制Fe2+氧化,改进减压过滤装置进行趁热过滤,并以硫酸量计算反应的铁量,硫酸亚铁铵产率可达76.82%,产率较高。
关键词:硫酸亚铁铵的制备引言为了更好的了解复盐的特性和产率的计算,在无机化学实验中设置了硫酸亚铁铵的制备实验。
通常,有Fe2+参与的反应要考虑防止Fe2+的氧化,一般加过量铁粉起还原作用,但此实验有滤掉铁粉、加热的过程,导致Fe2+易被氧化,使产品纯度偏低。
实验室实验装置不能满足趁热过滤,使产品产量偏低。
由于空气的快速氧化,利用铁粉剩余质量计算反应质量造成数据误差。
通过对制备实验的分析,我们对制备硫酸亚铁铵的步骤进行了改进,从防氧化、防结晶、更准确处理数据的方面进行条件优化,较高产率的制备出硫酸亚铁铵。
1实验部分1.1实验试剂铁屑,碳酸钠溶液,硫酸,硫酸铵,乙醇,硫氰酸钾。
1.2实验仪器电子天平,烧杯,玻璃棒,电磁炉,布氏漏斗,抽滤瓶,量筒,滴管,蒸发皿,玻璃皿。
1.3实验方法称取5.6g铁屑,加40mlNa2CO3洗涤。
通风处内向净化后的铁屑加10mL 3mol/L的H2SO4,水浴加热,添蒸馏水保持体积,加1mLH2SO4,反应结束后趁热过滤,滤液转移至蒸发皿。
称取4.6g(NH4)2SO4加入滤液溶解完全,水浴加热至有结晶膜,冷却,减压过滤,用乙醇洗涤,晾干,称重,计算产率。
反应原理如下:0到60o C,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分的溶解度都小。
FeSO4+(NH4)2SO4+6H2O═(NH4)2SO4·FeSO4·6H2O2讨论2.1提高亚铁盐纯度未经改进的实验,对亚铁盐进行直接加热,防止Fe2+被氧化的措施是加入过量的铁粉。
但直接加热温度过高,高温下Fe2容易迅速被氧化,因此将原实验中直接加热改为水域加热,保持温度在60o C-70o C。
硫酸亚铁铵制备方法微型化的研究

硫酸亚铁铵制备方法微型化的研究近年来,全球气候变暖和能源危机的严重性导致了环境污染的普遍化,有经济可行性的绿色化学技术制备方法显得尤为重要。
硫酸亚铁铵(ammonium ferrous sulfate,简称AFS)作为一种重要的多功能元素,在植物根系中不仅有重要的营养作用,还能参与氧化还原反应和电子传输,从而改善植物的生长和发育过程,为农业带来巨大的经济收益。
硫酸亚铁铵的制备是当前研究的热点。
近年来,已有许多研究报道过硫酸亚铁铵的制备方法,如碱式法、碳酸钙法、溶剂层析法等,但这些方法均存在成本高?#22270;?#21152;程繁琐、操作危险等弊端,这需要加以改进。
因此,本文设计了一种简单、实用、高效且低成本的硫酸亚铁铵制备方法微型制备法。
该法是在滴定碱式制备法的基础上,采用新型的微反应釜,把小规模的反应过程分解为多个微型实验单元,从而实现对硫酸亚铁铵的微型化制备。
实验结果表明,在微反应釜中进行微型制备法,不仅能显著降低反应时间,减少甲醛排放,还能降低制备过程中产生的废水,减少制备成本,确保制备的硫酸亚铁铵量和质量。
为了更好地评价硫酸亚铁铵的性能,本实验中还采用了元素分析、电导率测定、折光率测定和扫描电子显微镜等方法去研究硫酸亚铁铵的结构特征、形貌特征、组成分布以及尺寸分布等特性。
实验结果表明,利用微反应釜进行制备的硫酸亚铁铵具有较高的折光率,电导率和粒径等性能,具有良好的溶解性和氧化还原性,且其结构保持较好。
实验研究表明,微型化制备硫酸亚铁铵?#19994;?#26159;有效的可行性。
它不仅大大降低了碱式制备法中成本高、操作繁琐、污染严重等缺陷,还为硫酸亚铁铵的更广泛应用提供了理论依据。
总之,经过本文的系统研究,以微反应釜为工具的微型制备法,不仅对硫酸亚铁铵的制备效果显著提高,而且具有成本低、处理过程安全、操作简便等优点,可在农业生产、绿色化学等领域有广泛的应用。
此外,本文还提出,在进行硫酸亚铁铵制备的微型化研究时,还可考虑其他因素,如改变反应温度、增加旋?#22270;?#30340;研究。
《硫酸亚铁铵的制备》学案用

课题实验7-1 硫酸亚铁铵的制备实验原理:铁屑易溶于稀硫酸,生成硫酸亚铁:Fe+H 2SO 4=FeSO 4+H 2↑硫酸亚铁与等物质量的硫酸铵在水溶液中相互作用,即生成溶解度较小的浅绿色硫酸亚铁铵复盐晶体:FeSO 4+(NH 4)2SO 4+6H 2O=FeSO 4·(NH 4)2SO 4·6H 2O ↓。
一般亚铁盐在空气中都易被氧化,但形成复盐后却比较稳定,不易氧化。
实验试剂:3mol/L 硫酸溶液,0.1mol/L 碳酸钠溶液,铁屑,硫酸铵。
实验仪器:电子天平,量筒(10mL,50mL ),烧杯(50mL ),锥形瓶(250mL ),蒸发皿(60mL ),玻璃棒,铁架台,酒精灯,三脚架,石棉网,胶头滴管,药匙,吸滤瓶,布氏漏斗。
具体实验步骤如下:1.Fe 屑的处理和称量【操作】称取约5g 铁屑,放入锥形瓶,加入15 mL1mol/LNa 2CO 3溶液,小火加热10 min以除去Fe 屑表面的油污,将剩余的碱液倒出,置于回收瓶中,用蒸馏水把Fe 冲洗干净,干燥后称其质量,记为m 1(Fe),备用。
【问题】1.铁屑颗粒能否太小?2.Na 2CO 3溶液用以除油污的原因是 ,加热更有利于提高去污能力的原因是 ,将剩余的碱液倒掉的方法是 。
2.FeSO 4的制备【操作】将称量好的Fe 屑放入锥形瓶中,加入25 mL 3mol /L H 2SO 4 ,放在水浴中加热并不断震荡。
反应中应适当补充水,待反应基本完全后,再加入1 mL 3mol /L H 2SO 4,趁热过滤,将滤液转移至蒸发皿中。
【问题】①反应的化学方程式为 ,②水浴加热过程中要注意往锥形瓶中补充适量水分,理由是。
③制备FeSO 4溶液时,用右图装置趁热过滤是 。
④趁热过滤的目的是 。
⑤反应结束时再加入1 mL 3mol /L H 2SO 4的作用是 ;⑥在制备FeSO 4过程中常会出现黄色现象,避免这种现象的有效方是 。
同铁不同性_FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O——硫酸亚铁铵制备的改进实验

同铁不同性_FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O——硫酸亚铁铵制备的改进实验同铁不同性:FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O——硫酸亚铁铵制备的改进实验引言:在化学实验中,我们常常需要使用金属离子盐来进行反应。
硫酸亚铁铵作为一种常见的金属离子盐,在实验中也被广泛应用。
然而,由于硫酸亚铁铵在空气中易潮解,容易失去结晶水,导致其贮存不稳定,给实验带来了一定的不便。
为了解决这个问题,在本次实验中,我们对硫酸亚铁铵的制备方法进行了改进,使其稳定性得到提高,具体实验方法及结果如下。
实验方法:1. 实验材料:硫酸亚铁(FeSO4·7H2O)和硫酸铵((NH4)2SO4)2. 实验步骤:(1)称取适量的硫酸亚铁晶体,加入一定量的蒸馏水中,搅拌溶解;(2)称取适量的硫酸铵晶体,加入另一个容器中,搅拌溶解;(3)将两种溶液分别过滤,并在溶液中加入少量的酒石酸溶液调节pH值;(4)将两个溶液慢慢倒入一起,同时搅拌;(5)过滤得到沉淀,用蒸馏水洗涤沉淀,使其纯净。
实验结果:在上述实验方法下,我们成功得到了硫酸亚铁铵沉淀。
该沉淀为浅绿色结晶,具有良好的结晶性能和稳定性。
相比之下,传统的硫酸亚铁铵制备方法所得到的物质易于潮解,结晶性较差。
讨论:本次实验中,我们对硫酸亚铁铵的制备方法进行了改进,使其结晶性得到了明显的改善。
与传统方法相比,我们使用了硫酸铵作为反应物,通过两种溶液缓慢混合的方式得到硫酸亚铁铵沉淀。
这种方法的优势在于,硫酸铵具有较好的溶解性,易溶解于水中,而硫酸亚铁在水中的溶解度较小,因此可以通过溶液混合的方式使得沉淀逐渐形成,进而得到纯度较高的硫酸亚铁铵。
另外,添加酒石酸溶液调节pH值的操作也是为了提高沉淀的结晶性能。
总结:通过本次实验,我们成功改进了硫酸亚铁铵的制备方法,得到了稳定性更好、结晶性更好的硫酸亚铁铵盐。
北大普化实验实验九第二题讨论报告

关于硫酸亚铁铵制备过程中亚铁离子被氧化问题的讨论完成日期:2015/11/29一、摘要本文从加料、控制反应时间两大角度总结了制备硫酸亚铁铵实验中防止亚铁离子被氧化的措施,并就哪一环节亚铁离子最容易被氧化进行了讨论。
加料包括通过使酸过量调节体系pH、使用去离子水减少溶解氧两方面;控制反应时间包括制备硫酸亚铁时加热至无大量气泡产生即进行减压过滤、配制近饱和硫酸铵溶液缩短蒸发时间两方面。
关于Fe2+最容易被氧化的环节,本文将从是否有氧气或铁粉、反应温度和时间等角度进行探讨。
二、前言Fe(II)即使处于固态也容易被空气氧化,在配制硫酸亚铁铵的水溶液时,必须通过除氧加酸等措施降低其被氧化程度。
防止Fe2+被氧化的措施都有哪些?这些措施有什么意义?哪一环节Fe2+最容易被氧化?本文对此进行了讨论。
三、内容1.对防止Fe2+被氧化措施的总结(1)加料A.使酸过量调节体系pH制备硫酸亚铁时,加入4g铁粉、15mL去离子水和15mL6mol·L-1硫酸,初始c(H+)=15×6×2/(15+15)=6 mol·L-1;加热至无大量气泡产生时(停止加热进行减压过滤),剩余铁粉约为0.1g,参与反应的硫酸量=反应的铁量=(4-0.1)/56=0.070mol若忽略溶液中水的蒸发和酸气(SO2和SO3)的产生,此时c(H+)=(15×10-3×6-0.070) ×2/(30×10-3)=1.3mol·L-1;加入近饱和硫酸铵溶液时,设室温为20℃,硫酸铵的溶解度为75.4g/100g水,按n(FeSO4):n((NH4)2SO4)=1:1的比例,应加入的硫酸铵质量为:(4-0.1)×132/56=9.2g;加入的近饱和溶液体积为9.2×100/75.4=12.2mL;加入后溶液的c(H+)=1.3×30/(30+12.2)=0.92mol·L-1;Fe-H2O体系的E-pH图蒸发浓缩至溶液表面出现少量晶体时,目测溶液量约为30mL,加入约10mL 去离子水后,溶液中的c(H+)约为1.0mol·L-1 ;由以上计算可知,在整个制备硫酸亚铁铵的过程中,溶液的酸性始终较强,由上图可知,酸性条件下Fe(II)与氧气反应的E较小,故使酸过量可有效防止Fe(II)被氧化。
实验七硫酸亚铁铵的制备及产品质量分析

去离子 水洗至
15~20mlH2SO4 水浴 加热
气泡很少时 减压 过滤
中性
称量残渣
转移滤 液至蒸
调pH=1~2
以1 : 0.8的 质量比加入
发皿中
(NH4)2SO4
冷却并减 压过滤
晶可体编辑称ppt重
水浴加热 至表面出 现晶膜
5
操作要点
2. 目视比色Fe3+含量分析
1.00g产品 置于25ml 比色管中
其与KMnO4法的异同?
可编辑ppt
19
实验七 硫酸亚铁铵的制备 及产品质量分析
可编辑ppt
1
实验目的
1. 了解制备复盐的一种方法。 2. 掌握无机制备的基本操作技术:
水浴加热、减压过滤、蒸发结晶。 3. 练习目视比色半定量分析方法。
可编辑ppt
2
实验原理
1. 硫酸亚铁铵的制备
硫酸亚铁铵俗称摩尔盐,为浅绿色单斜晶体,其溶 解较小,易从浓的FeSO4和(NH4)2SO4混合液中结 晶析出。本实验的制备原理如下:
可编辑ppt
18
思考题
1. 以Na2C2O4为基准物标定KMnO4溶液的浓度时应注意哪 些反应条件?
2. 用KMnO4溶液滴定Na2C2O4 时,为什么开始滴定褪色很 慢,随着滴定的进行而褪色愈来愈快?如果在开始滴定前 加入1~2滴MnSO4溶液,会发生什么现象?为什么?
3. KMnO4法测定亚铁的方法、原理是什么? 4. 请举出类似的用氧化还原滴定法测定亚铁的实例,并说明
Fe + H2SO4 = FeSO4 + H2 FeSO4 + (NH4)2SO4 + 6H2O = FeSO4 (NH4)2SO4 6H2O
实验十三硫酸亚铁铵的制备与限量分析

实验内容
4.硫酸亚铁铵制备 硫酸亚铁铵制备 重量比1 0.75加入 按FeSO4与(NH4)2SO4重量比1:0.75加入 溶解并加热蒸发。 (NH4)2SO4 ,溶解并加热蒸发。 沸腾后小火加热并搅拌, 沸腾后小火加热并搅拌,溶液变粘后停 止加热。充分冷却,减压过滤, 止加热。充分冷却,减压过滤,吸干水份 称重,计算产率。 称重,计算产率。
实验原理
复盐的概念 常见的复盐有明矾(硫酸铝钾) 常见的复盐有明矾(硫酸铝钾) 、莫尔 硫酸亚铁铵) 铁钾矾(硫酸铁钾) 盐(硫酸亚铁铵) 、铁钾矾(硫酸铁钾) 、 铝铵矾(硫酸铝铵) 铝铵矾(硫酸铝铵)等 。 本实验用硫酸亚铁与硫酸铵混合溶液蒸 发浓缩制备复盐硫酸亚铁铵。 发浓缩制备复盐硫酸亚铁铵。
下次实验:
实验十五: 实验十五:
三草酸合铁( 三草酸合铁(Ⅲ)酸钾的制备与性质
(一) 氧化 铁屑用10 10% 铁屑用10%Na2CO3加热去污并用蒸馏水 洗至中性。 洗至中性。 2.铁屑用3mol·dm 的硫酸溶解,水浴加热, 铁屑用3mol 2.铁屑用3mol dm-3的硫酸溶解,水浴加热, 注意补充水份并维持pH<2 pH<2。 注意补充水份并维持pH<2。 3.铁屑不再冒泡时趁热过滤 铁屑不再冒泡时趁热过滤, 3.铁屑不再冒泡时趁热过滤,少量热水冲洗 滤纸。 滤纸。
实验十三 硫酸亚铁铵的制备与限量分析
实验目的
了解复盐的制备方法; 了解复盐的制备方法; 练习加热、过滤、蒸发、 练习加热、过滤、蒸发、结晶等基本操 作; 了解目视比色法检验产品中微量杂质的 方法。 方法。
实验原理
复盐的概念 又称分子间化合物, 又称分子间化合物,由简单的化合物按 一定化学计量比结合而成的化合物,其中含 一定化学计量比结合而成的化合物,其中含 有大小相近、适合相同晶格的一些离子。 有大小相近、适合相同晶格的一些离子。 通常其溶解度小于组成它的简单化合物 其溶解度小于组成它的简单化合物, 通常其溶解度小于组成它的简单化合物, 可以通过蒸发、浓缩的方式得到复盐。 可以通过蒸发、浓缩的方式得到复盐。
硫酸亚铁铵制备的最佳工艺研究
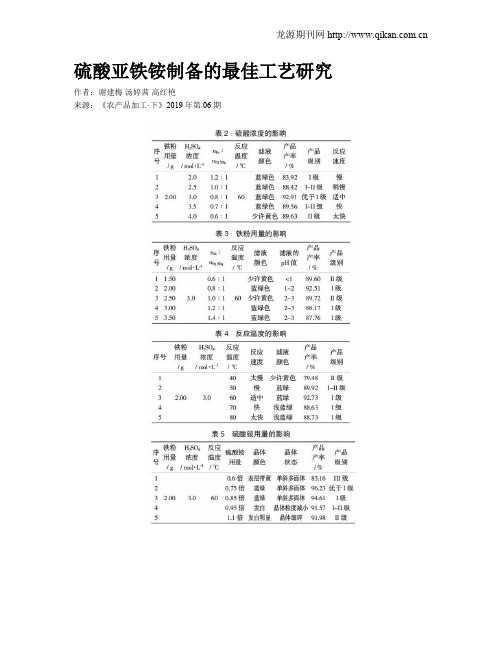
硫酸亚铁铵制备的最佳工艺研究作者:谢建梅汤婷茜高红艳来源:《农产品加工·下》2019年第06期摘要:通过对硫酸亚铁铵制备工艺优化的研究,确定在采用开放式装置立即水浴加热的条件下,浓度4 mol/L的硫酸、铁粉用量3 g、60 ℃水浴中加热制备硫酸亚铁、硫酸铵的用量为理论值的0.75倍的工艺条件下制备硫酸亚铁铵,其产率为96.45%,产品级别为优于I级。
关键词:硫酸亚铁铵;制备;工艺;优化中图分类号:TQ138.11 ; ; 文献标志码:A ; ; doi:10.16693/ki.1671-9646(X).2019.06.050Abstract:In this paper,the optimum condition in the synthesis of ferrous ammonium was studied here. The optimum condition was as follows:the mass of iron 3.0 g,the concentration ofH2SO4 4 mol/L,the temperature of water bath 60 ℃ in the open air,the mass of ammonia sulfate 0.75 times as that of theoretical requirement,with the productivity of 96.45%,and the grade of the product was better than grade I.Key words:ferrous ammonium sulfate;synthesis;technique;optimum硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]是一种复盐,常称为莫尔盐,或摩尔盐,外观为淡蓝绿色单斜晶体,密度1.864 g·cm-3,易溶于水,不易溶于乙醇,亚铁盐在空气中极易被氧化,但形成复盐后在空气中不易被氧化,因此在定量分析中常用来配制亚铁离子标准溶液。
实验十二、十三硫酸亚铁铵的制备和纯度的检验

温度/℃ 10 20 30 40 50 70
硫酸亚铁铵(商品名:摩尔盐): (1)在水中的溶解度比FeSO4或(NH4)2SO4都小。(2)将含 有FeSO4和(NH4)2SO4的混合溶液蒸发浓缩,冷却后可得硫酸 亚铁铵晶体。
二、实验原理
1.铁屑与稀硫酸作用,制得硫酸亚铁溶液: Fe + H2SO4 = FeSO4 + H2↑ 2. 硫酸亚铁溶液与硫酸铵溶液作用,生成溶解度 较小的硫酸亚铁铵复盐晶体: FeSO4 + (NH4)2SO4 + 6H2O = FeSO4•(NH4)2SO4• 6H2O
6.注意分次补充少量水,可防止FeSO4析出,也可控制 硫酸浓度不过大。
7.实验耗时太长,而且后阶段反应越来越慢,实验时可 稍多加铁屑,溶解大部分铁屑即可,不必将所有铁屑 溶解完。
8.计算(NH4)2SO4的用量,略小于铁屑的物质的量,基本保持 (NH4)2SO4和FeSO4的物质的量1︰1,溶解前按溶解度计算蒸 馏水的用量并煮沸。
(5)硫酸亚铁铵的制备和产品检验:
产品检验方法(组分分析;限量分析)
限量分析: 即按照不同等级化学试剂所允许杂质 的最高含量配成一系列标准溶液,然后将它们与 待测溶液在相同条件下进行试验。分为:比色法 和比浊法。
硫酸亚铁铵的制备实验报告

硫酸亚铁铵的制备实验报告[实验目的]1 .了解复盐的一般特征和制备方法;2 .练习水浴加热、常压过滤与减压过滤、蒸发与结晶等基本操作;3 .学习用目测比色法检验产品质量。
[实验原理]Fe屑溶于稀H2SO4生成FeSO4:Fe + H2SO4 = FeSO4+ H2等物质的量的FeSO4与(NH4)2SO4作用,能生成溶解度较小的硫酸亚铁铵(NH4)2SO4〃FeSO4〃6H2O,商品名称为莫尔盐。
FeSO4+ (NH4)2SO4+6H2O = (NH4)2SO4〃FeSO4〃6H2O一般亚铁盐在空气中易被氧化,但形成复盐后就比较稳定,因此在定量分析中常用来配制亚铁离子的标准溶液。
和其它复盐一样,(NH4)2SO4〃 FeSO4〃6H2O在水中的溶解度比组成的每一种组分[FeSO4或(NH4)2SO4]的溶解度都要小。
[仪器与试剂]仪器:台秤,锥形瓶 (150mL) ,250mL烧杯,量筒 (10 、 50mL) ,磨口抽滤漏斗及配套锥瓶,漏斗架,蒸发皿,吸滤瓶,水浴锅( 可用大烧杯代替 ) ,比色管 (25mL),石棉网,比色架,电炉,调压器,玻璃杯,抽滤机。
试剂:纯铁粉,HCl(2mol〃L -1) , H 2SO 4(3mol〃L -1) , 0.0100mg〃mL-1 标准 Fe 3+溶液,KSCN(1mol〃L -1 ) , (NH 4 ) 2SO 4 (s) , Na,无水乙醇,pH 试纸,蒸馏水。
2 CO 3[实验步骤]1.硫酸亚铁的制备:往盛有 2.0g 洁净铁屑的小烧杯中加入 15mL 3mol〃L -1H 2 SO 4溶液,盖上表面皿,放在低温电炉加热 ( 在通风橱中进行 ) 。
在加热过程中应不时加入少量去离子水,以补充被蒸发的水分,保持原有体积,防止 FeSO 4结晶出来;使铁屑与稀硫酸反应至不再冒出气泡为止。
趁热用普通漏斗过滤,滤液承接于洁净的蒸发皿中。
将留在小烧杯中及滤纸上的残渣取出,用滤纸片吸干后称量。
硫酸亚铁铵制备实验的改进

硫酸亚铁铵制备实验的改进
夏光强;龚培云
【期刊名称】《广州化工》
【年(卷),期】2018(46)22
【摘要】使用废铁屑为原料来制备硫酸亚铁铵,改进尾气处理装置,减少了环境污染,体现了绿色化学的概念.在兼顾产率和产品纯度的基础上,通过反应后残渣的称量,可以估算反应的铁的量,得到最佳配比为n(Fe):n((NH4)2SO4=1.0:1.1.对最后产品的结晶过程进行了改进,采用了反溶剂结晶法,以乙醇为反溶剂,将其加入反应完的溶液中,减少乙醇溶液的使用量,极大程度上避免了Fe2+的氧化,减少了产品的损耗,同时提升产品纯度.
【总页数】3页(P111-112,142)
【作者】夏光强;龚培云
【作者单位】西华师范大学化学化工学院, 四川南充 637002;西华师范大学化学化工学院, 四川南充 637002
【正文语种】中文
【中图分类】O6-3
【相关文献】
1.硫酸亚铁铵制备实验的改进 [J], 韦正友;石婷婷;司友琳;孙远东
2.硫酸亚铁铵制备实验的改进 [J], 徐敏
3.硫酸亚铁铵制备实验的绿色化改进 [J], 刘少华;田博士
4.有关硫酸亚铁铵制备实验的几点改进 [J], 李晓春
5.硫酸亚铁铵制备实验教学方法的改进 [J], 段辉;庄璐;陈云;王晓岗
因版权原因,仅展示原文概要,查看原文内容请购买。
硫酸亚铁铵制备实验的改进

硫酸亚铁铵制备实验的改进摘要对硫酸亚铁铵的制备实验进行了改进。
减少空气含氧量、加酸抑制Fe2+氧化,改进减压过滤装置进行趁热过滤,并以硫酸量计算反应的铁量,硫酸亚铁铵产率可达76.82%,产率较高。
关键词:硫酸亚铁铵的制备引言为了更好的了解复盐的特性和产率的计算,在无机化学实验中设置了硫酸亚铁铵的制备实验。
通常,有Fe2+参与的反应要考虑防止Fe2+的氧化,一般加过量铁粉起还原作用,但此实验有滤掉铁粉、加热的过程,导致Fe2+易被氧化,使产品纯度偏低。
实验室实验装置不能满足趁热过滤,使产品产量偏低。
由于空气的快速氧化,利用铁粉剩余质量计算反应质量造成数据误差。
通过对制备实验的分析,我们对制备硫酸亚铁铵的步骤进行了改进,从防氧化、防结晶、更准确处理数据的方面进行条件优化,较高产率的制备出硫酸亚铁铵。
1实验部分1.1实验试剂铁屑,碳酸钠溶液,硫酸,硫酸铵,乙醇,硫氰酸钾。
1.2实验仪器电子天平,烧杯,玻璃棒,电磁炉,布氏漏斗,抽滤瓶,量筒,滴管,蒸发皿,玻璃皿。
1.3实验方法称取5.6g铁屑,加40mlNa2CO3洗涤。
通风处内向净化后的铁屑加10mL 3mol/L的H2SO4,水浴加热,添蒸馏水保持体积,加1mLH2SO4,反应结束后趁热过滤,滤液转移至蒸发皿。
称取4.6g(NH4)2SO4加入滤液溶解完全,水浴加热至有结晶膜,冷却,减压过滤,用乙醇洗涤,晾干,称重,计算产率。
反应原理如下:溶解度g/100g水10 20 30 50 60FeSO4·7H2O 20.5 26.6 33.2 48.6 56.0(NH4)2SO473.0 75.4 78.0 84.5 91.9(NH4)2SO4·FeSO4·6H2O 18.1 21.2 24.5 31.3 38.50到60o C,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分的溶解度都小。
试验硫酸亚铁铵的制备

实验2-4 硫酸亚铁铵的制备1.实验目标(1)以用废铁屑制备硫酸亚铁铵为例,初步体验无机物质制备的过程(2)掌握水浴加热、过滤、蒸发、洗涤等基本操作(3)体验利用溶解度的差异制备物质的过程2.预习指导(1)实验原理硫酸亚铁铵俗称莫尔盐,浅绿色透明晶体,易溶于水,在空气中比一般的亚铁铵盐稳定,不易被氧化。
FeSO4在空气中容易被氧化,可以用SCN-来检验FeSO4溶液是否变质。
由于硫酸亚铁铵在水中的溶解度在0~60 ℃内比组成它的简单盐硫酸铵和硫酸亚铁要小,只要将它们按一定的比例在水中溶解、混合,即可制得硫酸亚铁铵的晶体。
其方法为:将金属铁溶于稀硫酸,制备硫酸亚铁。
Fe+H2SO4=FeSO4+H2↑将制得的硫酸亚铁溶液与等物质的量的(NH4)2SO4在溶液中混合,经加热浓缩、冷却后得到溶解度较小的硫酸亚铁铵晶体。
确定(NH4)2SO4质量的方法:Fe~FeSO4~(NH4)2SO4(2)实验技能①复习倾析法分离固体与液体以及固体的洗涤。
铁屑与碳酸钠溶液加热除油后用倾析法倒掉溶液,先用自来水再用蒸馏水将铁屑洗涤干净,可以用pH试纸检验洗涤液的pH来确定铁屑是否洗净,然后干燥称量m2(Fe)。
②水浴加热的操作。
本实验在铁与硫酸反应时需要对反应物进行较长时间的加热,因为安全原因需要用水浴加热。
可将锥形瓶放入盛有热水的水浴锅中加热,实验中可以用大烧杯代替水浴锅。
③复习过滤操作。
注意提醒学生过滤时操作应注意的几点。
④沉淀洗涤的方法。
过滤结束后,向固体中加入无水乙醇洗涤。
(3)实验操作要点①铁屑要首先除油污,因为废铁屑表面有油污,如果不除去不利于铁屑与硫酸的反应。
根据盐类水解知识可知,升高温度,促进Na2CO3的水解,溶液碱性增强,去油污能力增强,所以除污用热碳酸钠溶液。
②铁与稀硫酸反应时为加快反应速度需加热,但最好控温在60 ℃以下。
若温度超过60 ℃易生成FeSO4·H2O白色晶体,过滤时会残留在滤纸上而降低产量,对(NH4)2SO4的物质的量的确定也有影响,会使(NH4)2SO4的物质的量偏高。
09年高考化学质的制备和合成问题设计
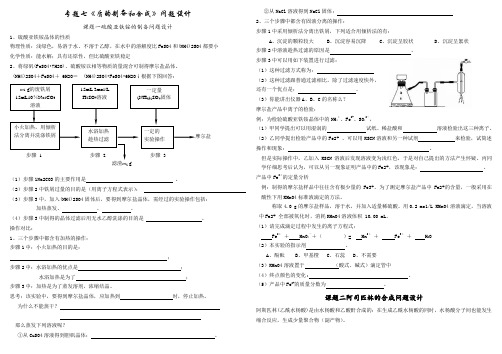
专题七《质的制备和合成》问题设计课题一硫酸亚铁铵的制备问题设计1、硫酸亚铁铵晶体的性质物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小 化学性质:能水解;具有还原性,但比硫酸亚铁稳定2、将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。
(NH4)2SO4+FeSO4+ 6H2O = (NH4)2SO4•FeSO4•6H2O ↓根据下图回答:(1)步骤1Na2CO3的主要作用是 。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括: 加热蒸发、 、 。
(4)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是 。
操作对比:1、三个步骤中都含有加热的操作: 步骤1中:小火加热的目的是:; 步骤2中:水浴加热的优点是 ; 水浴加热是为了 ; 步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到 时,停止加热。
为什么不能蒸干? 那么蒸发下列溶液呢?①从CuSO4溶液得到胆矾晶体: 。
②从NaCl 溶液得到NaCl 固体: 2、三个步骤中都含有固液分离的操作:步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:A 、沉淀的颗粒较大B 、沉淀容易沉降C 、沉淀呈胶状D 、沉淀呈絮状 步骤2中溶液趁热过滤的原因是 。
步骤3中可以用如下装置进行过滤:(1)这种过滤方式称为: (2)这种过滤跟普通过滤相比,除了过滤速度快外, 还有一个优点是: 。
(3)你能讲出仪器A 、B 、C 的名称么? 摩尔盐产品中离子的检验:例:为检验硫酸亚铁铵晶体中的NH 4+、Fe 2+、SO 42-,(1)甲同学提出可以用湿润的 试纸、稀盐酸和 溶液检验出这三种离子。
(2)乙同学提出检验产品中的Fe2+ 、可以用KSCN 溶液和另一种试剂 来检验,试简述操作和现象: 。
硫酸亚铁铵制备实验条件的优化研究

l 3 实验 步 骤 1 . 3 . 1 铁 屑 除 油
1 实 验 部 分
1 . 1实验 | 式剂与 仪器 试 剂: 3 o t o l ・ L 。 。 H : S O 4 溶液 , ( N H 4 ) : S O 4 ( 分析纯 ) , 2 m o l ・ L 。 H C I 溶液 ,1 oo t l ・ L KS C N溶液 ,( NH 4 ) F e ( S O4 ) ! - l 2 H1 0( 分析纯 ) ,无水 乙醇 铁 屑 为机床 加 工』 一 废弃物 。 仪 器 :电热恒 温干燥 箱( 精 宏) 、恒温 水浴 锅( 郑 州长 城) 、电子 分 析天 r ( 梅特 勒AL 2 0 4 ) 、电子 台秤 ( 上 海精 仪YP 5 0 2 N ) 、循环 水 真 空泵( 河 南长 城 ) 、 m氏漏 斗、蒸 发皿 、三 角烧 瓶 ,酒精灯 等 。 1 . ! 实验 原理 铁 屑 稀硫 酸 往加热 条 件下 反应 牛成 硫酸亚 铁 , 反应过 程 中 收{ i 5 氢 气{ 公代 I 1
广
7 8
东
化
工
2 0 1 7 年 第 6期
} 1 - gd c he m. C O I n
第4 4 卷总第 3 4 4期
硫 酸亚铁 铵制备实验条件 Fra bibliotek优化研 究 季 然 , 胡勇
( 兴第 中学 ,浙江 绍 兴 3 1 2 0 0 0 1
[ 摘 要】 本文 对高 中和 大学 化学 实验 课程 中硫 酸亚铁 铵 制备方 法 的反应 物 、温度 、蒸发 等条件 对 产物 的影 响进 行 了探 究 ,通过 对 实验 条件 的 优 化和 改进 ,解 决 了实验 过程 中常 见的 一些 问题 ,提 高 了 , 产物 的级 别和产 率 。 【 关键 词] 硫酸 亚铁 铵 ;铁屑 ;硫 酸亚 铁 ;产率 【 中 图分类 号】 06 3 [ 文 献标 识码] A [ 文章 编 号] 1 0 0 7 — 1 8 6 5 ( 2 0 1 7 ) 0 6 — 0 0 7 8 . 0 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
251
BIOTECHWORLD 生物技术世界硫酸亚铁铵的制备涉及氧化还原反应、复盐制备、杂质去除等过程,通过本实验可以使学生熟悉无机化学制备实验的基本原理;同时,实验过程中涉及称量、水浴加热、结晶、干燥、减压过滤、滴定等基本操作,完成本实验还可以全面锻炼和提高学生的动手能力。
再者,本实验产物常作为制备三草酸合铁酸钾的原料,培养学生绿色化学的理念。
但是实验室常用的制备方法存在不足,我们通过探究硫酸铵的状态(固体、过饱和溶液、饱和溶液)和浓度(不同浓度梯度的溶液)对实验的影响,获得了产率和纯度更高的实验方案。
1.实验
1.1 实验原理
在硫酸亚铁溶液中加入与FeSO 4相等物质的量的(NH 4)2SO 4,生成复盐硫酸亚铁铵。
它比较稳定,其六水合物不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。
因为硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO 4和(NH 4)2SO 4的溶解度都要小,可通过蒸发浓缩制得。
1.2 制备
(1)硫酸亚铁的制备。
往盛有4.0g铁屑的洁净三口烧瓶中分批加入15mL 3 mol/L H2SO 4溶液,放在水浴锅上加热(由于反应过程中可能产生H 2S、PH 3等有毒气体,可用NaOH溶液吸收),铁屑与稀硫酸反应至基本不再冒出气泡为止(约需30min)。
控制反应温度64~65℃,以防止FeSO 4结晶出来。
反应结束后趁热抽滤,收集剩余的铁屑,用滤纸吸干后称量,计算FeSO 4的理论产量。
(2)硫酸亚铁铵的制备。
根据 FeSO 4的理论产量,以(NH 4)2SO 4:FeSO 4(n:n=1:1),计算并称取固体(NH 4)2SO 4。
将(NH4)2SO 4配制成不同浓度的溶液,然后与FeSO 4溶液混合均匀并调节pH值为1,在水浴锅上蒸发浓缩至溶液表面刚出现结晶膜时为止。
自然冷却至硫酸
亚铁铵晶体完全析出。
减压抽滤并用少量的乙醇淋洗。
取出晶体置于两张洁净的滤纸之间,轻压以吸干母液,称重。
1.3 硫酸亚铁铵纯度的测定方法
称取制得的硫酸亚铁铵晶体,溶于硫酸溶液中,加沸水,摇匀。
用高锰酸钾标准溶液(C=0.1000mol/L)标定至溶液呈粉红色,并保持半分钟不褪色。
2 实验优化
(1)硫酸铵的状态、浓度对实验结果的影响表1所示:
表1中数据表明以硫酸铵溶液加入时能大大提高产品的产率和纯度,故选择加入硫酸铵溶液更为合适。
比较过饱和溶液与饱和溶液的数据可知,饱和溶液对应的产率和纯度都比过饱和溶液的高,可见,溶液中水的含量直接影响实验结果。
(2)不同浓度硫酸铵溶液对实验结果的影响图1所示:通过研究(NH 4)2SO 4溶液的浓度对产率和纯度的影响可知,在3.79~5.49×10-3mol/L范围内产物的纯度均在93%以上,且纯度随浓度的变化较小,故溶液中水的多少对产物纯度的影响较小。
由产率对浓度的曲线可知,当浓度在饱和浓度左右变动时,产率随溶液浓度的升高,先升高后下降。
在3.79~4.38×10-3mol/L范围内,产率随着浓度的升高逐渐变大,在4.38~5.34×10-3mol/L范围内产率处于最大范围83%~87%,在5.34~5.49×10-3mol/L范围内产率随浓度的升高而降低。
故,当浓度在4.38~5.34×10-3mol/L范围时,溶液中水分含量较为适宜、产率较高。
3 结语
以废铁屑为原料制备硫酸亚铁铵,控制铁屑过量,反应温度64~65℃,当硫酸铵溶液浓度为4.38~5.34×10-3mol/L,产率可达85%,产品纯度可达到93%以上。
通过对该实验过程的优化,提高了产品的产率和纯度。
参考文献
[1]曾琦斐.硫酸亚铁铵的制备方法研究[J].化学工程与装备,2011(4):23-25.
[2]韦正友,石婷婷,司友琳,孙远东.硫酸亚铁铵制备实验的改进[J].大学化学,2014(1):60-62+68.
[3]徐敏.硫酸亚铁铵制备实验的改进[J].当代化工,2015(1):37-38.
硫酸亚铁铵制备的优化研究
刘艳菊 黄甜甜 郝露露 杨怀霞
(河南中医学院药学院 河南郑州 450046)
摘要:本文对硫酸亚铁铵的制备进行了优化探索,针对传统实验中存在产率低的问题,探索了最佳实验条件,提高了产率和纯度。
关键词:硫酸亚铁铵 实验优化 产率 纯度中图分类号:O614.81文献标识码:A 文章编号:1674-2060(2016)01-0251-01
图1 硫酸铵浓度与硫酸亚铁铵收率与纯度的关系
硫酸铵的加入状态
称取铁屑的
量(g) 剩余铁屑的
量(g)
所需硫酸铵固
体(g) 加入蒸馏水的量
(ml) 所得硫酸亚铁铵的
量(g)
硫酸亚铁铵的收率(%) 硫酸亚铁铵的纯度(%) 固体+水 4.00 0.98 7.11 9.74 15.82 74.90 92.18 过饱和溶液 4.00 0.41 8.47 4.67 20.08 81.58 94.60 饱和溶液
4.00
0.41
8.47
11.60
20.26
85.01
96.30
表1 硫酸铵的加入状态对实验结果的影响。
