运行确认OQ方案
压缩空气系统运行确认(OQ)方案

运行确认方案(OQ)压缩空气储存及分配系统方案审核和批准供应商:客户:版本历史目录1.目的42.验证范围43.职责43.1. 供应商的职责43.2. 客户的职责44.参考文件清单45.系统描述55.1.描述56. 0Q实施76.1.先决条件76.2. 人员确认96.3.验证仪器校准确认116.4.运行功能确认137. 偏差报告168. 附件清单169.执行的审核和批准161.目的本运行确认是为了确认XXX制药有限公司新建项目的压缩空气及分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2.验证范围本运行确认的范围包括了……3.职责3.1. 供应商的职责A0Q方案编写>OQ实施和数据的收集A准备偏差报告和解决偏差的建议A如果出现偏差,与客户某个授权的人员进行协调A最终报告的编写3.2. 客户的职责A执行前审核和批准本方案A针对不符合项界定解决方法A审核和批准最终报告4.参考文件清单以下是方案编写所依据的参考文件:(SFDA)中国GMP2010年修订版欧盟GMP的附录1-无菌药品的生产,2008版欧盟GMP的附录15-验证和确认中国药典2010年版药品生产验证指南(2003年版)压力容器安装规范要求及洁净压缩空气质量标准。
四级过滤器使用说明书压缩空气系统URS《压缩空气系统标准操作规程》5.系统描述5.1.描述主要设备GA55型螺杆式压缩机。
辅助设备有YC-75AH/冷冻式干燥机、C-8/1.0储气罐、QE-150吸附式干燥机及C、T、A、H四级过滤器组成。
GA55型蜗杆式空气压缩机系统流程:将空气经过空气滤清器滤去尘埃、杂质,由减荷阀控制进入压缩机工作腔,随着蜗杆与两侧星轮片的合运动,空气被压缩,并在压缩过程开始时与喷入的润滑油混合,经压缩后的混合气体进入油气分离器,利用旋风分离法和上返分离法粗分离油气后,经精分离器滤芯进行精分离、通过最小压力阀排出的气体是比较纯净压缩空气;然后经过板翘式冷却器,将压缩空气冷却,空气中水蒸汽饱和析出,与压缩空气一起排出。
隧道烘箱运行确认 隧道烘箱OQ GMP文件

Declaration声明本方案是XXXXXX 有限公司(中国)的知识产权,供-D600 隧道烘箱的用户用于商业运作及接受管理当局的审核。
未经书面允许,禁止向第三方传播本方案。
APPROVALS批准原作者:XXXXXX 有限公司日期:20xx 年xx 月日Approval 1 (Engineering): Date:批准1(工程部门)日期Approval 2 (Production): Date:批准2(生产部门)日期Approval 3 (Quality Assurance): Date:批准3(质量保证)日期Approval 4 (Validation): Date:批准4(验证人员)日期REVISION HISTORY修订历史Table of Contents 1.0 Purpose目的2.0 Responsibilities责任3.0 System Description系统概述4.0 Procedure程序5.0 Reference参考6.0 Signature Identification签名7.0 Operational Verifications运行确认7.1 IQ VerificationIQ 确认7.2 Critical Instrument Calibration Verification关键仪表校准确认7.3 Test Instruments Calibration Verification测试仪表校准确认7.4 SOPs Referenced and Training Verification相关SOP 和培训确认7.5 Installation and Mechanical Verification更换规格件的安装和机械操作确认7.6 Safety Equipment / Alarm / Interlocks Verification安全设备/报警装置/联锁装置确认7.7 Loss of Utilities and Restart Verification断电后重启确认7.8 触摸屏及PLC Operational Verification触摸屏及PLC 操作确认7.9 Software Version Verification软件版本确认7.10 7.10隧道烘箱运行速度和产量确认7.11 Compliance Verification电气控制系统及PLC 符合性确认7.12 Empty Run Verification空运转操作确认8.0 Deviations偏差9.0 Attachments附件1.0Purpose 目的本运行确认方案(OQ)由 XXXXXX 有限公司(中国)起草,协助-D600 隧道烘箱的用户进行书面记录,确认机器已经按照设计要求安装,并且安装的机器运行性能符合设计要求和客户要求。
压缩空气系统运行确认(OQ)方案

运行确认方案(OQ)压缩空气储存及分配系统方案审核和批准供应商:客户:版本历史目录1.目的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.参考文件清单 (4)5.系统描述 (5)5.1.描述 (5)6.OQ实施 (7)6.1.先决条件 (7)6.2.人员确认 (9)6.3.验证仪器校准确认 (11)6.4.运行功能确认 (13)7.偏差报告 (16)8.附件清单 (16)9.执行的审核和批准 (16)1. 目的本运行确认是为了确认XXX制药有限公司新建项目的压缩空气及分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2. 验证范围本运行确认的范围包括了……3. 职责3.1. 供应商的职责➢OQ方案编写➢OQ实施和数据的收集➢准备偏差报告和解决偏差的建议➢如果出现偏差,与客户某个授权的人员进行协调➢最终报告的编写3.2. 客户的职责➢执行前审核和批准本方案➢针对不符合项界定解决方法➢审核和批准最终报告4. 参考文件清单以下是方案编写所依据的参考文件:(SFDA) 中国GMP2010年修订版欧盟GMP的附录1-无菌药品的生产,2008版欧盟GMP的附录15-验证和确认中国药典2010年版药品生产验证指南(2003年版)压力容器安装规范要求及洁净压缩空气质量标准。
四级过滤器使用说明书压缩空气系统URS《压缩空气系统标准操作规程》5. 系统描述5.1. 描述主要设备GA55型螺杆式压缩机。
辅助设备有YC-75AH/冷冻式干燥机、C-8/1.0储气罐、QE-150吸附式干燥机及C、T、A、H四级过滤器组成。
GA55型蜗杆式空气压缩机系统流程:将空气经过空气滤清器滤去尘埃、杂质,由减荷阀控制进入压缩机工作腔,随着蜗杆与两侧星轮片的合运动,空气被压缩,并在压缩过程开始时与喷入的润滑油混合,经压缩后的混合气体进入油气分离器,利用旋风分离法和上返分离法粗分离油气后,经精分离器滤芯进行精分离、通过最小压力阀排出的气体是比较纯净压缩空气;然后经过板翘式冷却器,将压缩空气冷却,空气中水蒸汽饱和析出,与压缩空气一起排出。
设备运行(OQ)

运行确认(OQ)
运行确认应在安装确认完成后进行。
其中的测试项目应根据对于工艺、系统和设备的相关知识而制定;测试应包括所谓的“最差条件”即操作参数的上下限度(例如最高和最低温度)而且测试应重复足够的次数以确保结果可靠并且有意义。
运行确认应包括但不局限于以下内容:
1. 功能测试:
设备的基本功能
系统控制方面的功能(如报警、自动控制等)
安全方面的功能(如设备的急停开关功能,安全联锁功能等)
2. 培训:在运行确认结束之前,应确认相关人员的培训已经完成,其中应至少包括设备操作、维护、以及安全指导方面的内容。
3. 检查OQ中所用到的测量用仪器:必须确保运行确认中所使用的测量用仪器仪表等都经过校准。
4. 检查相关文件的准备情况(以下文件都应在运行确认结束前完成)
操作规程:与设备设施操作、清洁相关的操作应在运行确认过程中进行完善和修改并在运行确认结束之前完成。
预防性维护计划:新设备已加入企业防护性维护计划中
校准计划
监测计划
表3-26 为建议运行确认检查清单模板,具体内容可根据实际需要进行增减。
说明:
测试方法和接受标准项中的内容需根据实际需要在起草方案时确定;
记录项中的内容应根据实际情况在确认测试时填写;
“()”中为建议的内容
“检查清单”可以放在方案的附件中,在确认执行过程中进行填写,作为原始记录
表3-26 建议的运行确认检查清单模板。
设计确认、安装确认、运行确认、性能确认

设计确认(DQ)、安装确认(IQ)、运行确认(OQ)、性能确认(PQ)设备/仪器的选型(DQ):设计确认应当证明厂房、设施、设备的设计符合预定用途和要求;记录设施、设备系统按照GMP要求进行设计的书面证据,这些书面证据说明所设计的设施、设备系统适合于目的用途,并且所设计的设施、设备系统组元和单元依据现行的工程理论与实践原则与考量和用户要求。
1设计确认主要是对设备选型和订购设备的技术规格、技术参数和指标适用性的审查,由需求使用部门实施。
2确认主要的工艺参数,物料衡算数据选取所需设备,检验仪器要根据检验精密度要求选取所需仪器。
3 查找设备的说明书或参数介绍,考察设备是否适合生产工艺、检验精度、校准、维修保养、清洗方面的要求,是否符合GMP要求。
4 从技术和经济两项指标选择合适的供应商。
5 根据设备参数和工艺要求设计安装图纸,根据工艺检验精度要求确定检验仪器的精度要求。
6设计确认由设备需要部门直接的技术人员和工程人员合作完成。
7 确认设备的变更而导致的其它相关的变更,包括其它设备、厂房设施等的需要。
安装确认(IQ):安装确认应当证明厂房、设施、设备的建造和安装符合设计标准;安装确认应列出所有需要书面记录的可识别信息,包括:设备的名称、系统的描述、设备识别编号(硬件和软件)、地点、辅助设施的要求、连接和安装特点。
IQ应该核实设备与采购清单是否吻合,所有图纸、手册、备件、供货商信息和其它相关文件都要齐全。
1核对到厂生产设备或仪器、配件、配套设施、文件等是否符合选型要求,是否齐全。
2参照设备说明书和其他技术文件,核对该生产设备或仪器的各项参数是否符合设计要求、是否符合工艺流程和质量控制、检验精度要求。
检查设备是否符合GMP的要求。
3安装阶段,设备、管道、辅助设施和仪器均应按照设计图纸或厂家安装要求来进行安装和检查。
同时,安装确认应包括该设备或系统的组成部分,辅助管道和量器的检定。
4将供货单位的技术资料归档,收集制定有关操作文件、记录。
运行确认(OQ)方案模板

运⾏确认(OQ)⽅案模板ZPY129 旋转式压⽚机运⾏确认(OQ)⽅案MCS-STP-VPP-×××-01xxx公司⽅案编写⼈员⽅案审核⼈员⽅案批准⼈员【⽬的】确认该系统或设备按照其规格运⾏,并记录相关信息和数据,证明设备或系统能达到所预期的各项功能。
【范围】当安装、⼤修或转移位置安装并完成安全确认之后。
【责任】ⅰ操作本系统或设备的⼈员执⾏运⾏确认并作相关记录;ⅱ设备主管负责监督确认⽅案的实施和各相关记录填写完整,负责报告确认过程的偏差和拟定设备运⾏确认报告;ⅲQA负责审核批准设备确认⽅案和报告。
1 运⾏确认所需的前提:1.1所需物资和其他配备确认:(格⼦不够⾃⾏增加)实施者:⽇期:偏差报告:复核者:⽇期:1.2需要校验的仪器仪表清单确认:(格⼦不够⾃⾏增加)实施者:⽇期:偏差报告:复核者:⽇期:1.3 运⾏确认所需SOPs和记录确认:(格⼦不够⾃⾏增加)1.4 运⾏确认培训记录确认:(格⼦不够⾃⾏增加)1.5 设备操作⼿册确认:(格⼦不够⾃⾏增加)实施者:⽇期:偏差报告:复核者:⽇期:2 运⾏确认程序2.1 校验需要校验的设备仪器并记录(如表1)2.2 确认关键控制点和警戒的操作条件并记录(如表3);关键控制点和警戒:(格⼦不够⾃⾏增加)实施者:⽇期:偏差报告:复核者:⽇期:2.3 确认设备运⾏后的各项输出参数实施者:⽇期:偏差报告:复核者:⽇期:2.4 列出校验设备仪器的校验要求(合格标准)(表5)2.5 需要的话,在正常条件或极端条件下,作挑战性试验,测量并记录2.5.1 正常条件下的测试:结果:实施者:⽇期:复核者:⽇期:2.5.2 极端条件下的测试(例如:突然断电、温度恢复时间、离⼼不平衡等情况):结果:实施者:⽇期:偏差报告:复核者:⽇期:2.6 记录实施过程的任何偏差,准备偏差报告,内容包括可接受标准的正当性和对操作的影响。
偏差描述:偏差处理并证明其可接受:对操作的影响:偏差报告者:⽇期:复核者:⽇期:2.7 准备设备确认报告,提交QA批准。
纯蒸汽储存和分配系统运行确认(OQ)方案

运行确认方案(OQ)纯蒸汽分配系统方案审核和批准供应商:客户:版本历史目录1.目的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.参考文件清单 (4)5.系统描述 (5)5.1.描述 (5)6.OQ实施 (7)6.1.先决条件 (7)6.2.人员确认 (8)6.3.验证仪器校准确认 (10)6.4.运行功能确认 (12)6.5.报警和联锁确认 (16)6.6.生产参数确认 (17)6.7.峰流量确认 (20)7.偏差报告 (22)8.附件清单 (23)9.执行的审核和批准 (23)1. 目的本运行确认是为了确认XXX制药有限公司新建项目纯蒸汽分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2. 验证范围本运行确认的范围包括了纯蒸汽分配系统,而不包括纯蒸汽制备系统。
本方案中的纯蒸汽系统(PS) 仅指纯蒸汽分配系统。
3. 职责3.1. 供应商的职责➢OQ方案编写➢OQ实施和数据的收集➢准备偏差报告和解决偏差的建议➢如果出现偏差,与客户某个授权的人员进行协调➢最终报告的编写3.2. 客户的职责➢执行前审核和批准本方案➢针对不符合项界定解决方法➢审核和批准最终报告4. 参考文件清单以下是方案编写所依据的参考文件:●(SFDA) 中国GMP2010年修订版●欧盟GMP的附录1-无菌药品的生产,2008版●欧盟GMP的附录15-验证和确认●中国药典2010年版●药品生产验证指南(2003年版)●(ISPE) 新建和改造的工厂制药工程指南,第3卷-无菌生产设施,第1版,1999年1月●(ISPE)新建和改造的工厂医药工程指南,第4卷-水和蒸汽系统,第1版2001年1月5. 系统描述5.1. 描述纯蒸汽由纯蒸汽制备系统供应到分配系统。
从制备系统出来的纯蒸汽进入分配系统,分配系统将纯蒸汽分配到各使用点;以下为分配系统的具体描述:⏹纯蒸汽通过分配系统输送至每个使用点。
电子天平运行确认方案

BT25S电子天平安运行确认(OQ)案1引言1.1验证目的2设备描述3验证案3.1运行确认(OQ)3.1.1运行确认1:仪器的各开关按钮的确认3.1.2运行确认2: 电子天平的校验确认3.1.3运行确认3: 电子天平的准确性(线性)确认3.1.4运行确认4: 电子天平的重复性测试3.1.5运行确认5: 电子天平的最小称量重量的测试3.1.6运行确认6: 电子天平的偏载测试3.1.7运行确认7: 电子天平的迟滞测试1 引言1.1 验证目的本运行确认(OQ)的目的,通过实验提供足够依据,证明BT25S电子天平达到了预定的要求,确认仪器的性能及技术指标能够满足化验室对仪器的要求。
1.2 验证围本验证案为BT25S电子天平运行确认(OQ)案。
1.3 验证期一年2 设备描述BT25S电子天平(出厂公司:赛多利斯科学仪器有限公司)可测量围为0.00001~21.00000克,适合工作在条件一般的实验室和其它工作间里,并获得可靠的称量结果,来保证分析数据的准确性。
3验证案3.1运行确认(OQ)3.1.1运行确认1:仪器的各开关按钮的确认3.1.1.1目的保证可以正常使用仪器检验样品重量。
3.1.1.2操作3.1.1.2.1调整水平脚,检查水平泡中的气泡是否可以处于圆环的中央。
3.1.1.2.2接通电源,检查显示器是否显示“OFF”,按ON/OFF键,天平进入自检,通过后检查显示器是否显示“0.00000 g ”,如显示,即自检通过,进入称量工作状态。
3.1.1.2.3在天平托盘上放置一称量瓶,按TARE键,检查显示器是否可以回到显示“0.00000 g”。
3.1.1.2.4移去称量瓶,再按TARE键,按CAL键,检查显示器是否显示”CAL”,几分钟后显示器上是否可以出现标示质量“0.00000 g”,校正结束。
3.1.1.3可接受标准仪器各开关及按钮功能均完好。
3.1.2运行确认2: 电子天平的校验确认3.1.2.1目的通过对电子天平的校验来确认电子天平测量能符合要求。
洁净单向流罩运行确认(OQ)

使用单位:********************公司文件名称:运行确认(OQ)设备名称:洁净单向流罩设备型号:***********文件编号:生产单位:*********公司OQ (运行确认)方案Prepared by 起草职责:编写设备安装确认方案,执行经批准的确认方案,做好确认过程的相关记录。
Reviewed by 审核职责:审核设备安装确认方案,监督确认方案的实施和各相关记录填写完整,负责报告确认过程的偏差和拟定确认报告Approved by 批准职责:批准设备安装确认方案和报告修订历史纪录Revision History目录1. 目的OBJECTIVE (5)2. 范围SCOPE (5)3. 设备描述EQUIPMENT DESCRIPTION (5)4. 职责RESPONSIBILITY (5)4.1设备供应商职责Vendor’s Responsibility (5)4.2厂家职责Manufacturer Responsibility (5)5. 确认前培训确认/签到表PRE-QUALIFICATION TRAINNING VERIFICATION/SIGNATURE LOG (7)6.校正情况确认TEST INSTRUMENT CALIBRATION VERIFICATION (8)7.OQ许可审批APPROVAL TO PROCEED WITH OQ (9)8.运行确认OPERATION QUALIFICATION (10)OQ1.标准操作程序确认Standard Operating Procedure Verification (10)OQ2.培训确认Training Verification (11)OQ3.关键仪器校准确认Critical Instrumentation Calibration Verification .. 12 OQ4.开机运行前确认Pre Operation Confirmation (13)OQ5.层流流速和均匀性确认Laminar Air Flow And Uniformity Verification14 OQ6.高效过滤器完整性测试Heap Filter Integrity Testing (16)OQ7.静态尘埃粒子测试Static State Particulate Testing (18)OQ8.静态层流流型Static State Laminar Flow Pattern (21)OQ9.照度和噪音测试Degree Of Illumination And Noise Test (22)9.OQ总结报告SUMMARY REPORT (24)10.偏差报告DEVIATION REPORT (25)11.偏差清单列表LIST OF DEVIATION (27)12.附件清单ANNEX LIST (28)1. 目的OBJECTIVE本方案用于洁净单向流罩的运行确认,确认其设计符合中国、欧盟和FDA的GMP要求,符合用户需求。
数显电热鼓风干燥箱OQ方案

数显电热鼓风干燥箱运行确认(OQ)方案目录1、目的 (1)2、范围 (1)3、职责 (1)4、法规和指南 (1)5、缩写与定义 (1)6、系统/设备描述 (1)7、确认前条件 (2)8、风险分析 (2)9、确认清单 (3)10、确认实施 (3)11、偏差处理 (3)12、变更控制 (3)13、附录 (3)1、目的:提供书面文件证明101AS-1数显电热鼓风干燥箱的运行能够满足实验要求。
2、范围:本确认方案适用于公司实验室101AS-1数显电热鼓风干燥箱的运行确认。
3、职责3.1.公司验证小组:负责起草、审核确认方案,并执行确认方案,起草确认报告;确保能及时发现各项工作的偏差及变更,按照《偏差管理SOP》及《变更管理SOP》执行,并对其进行的相关记录、调查情况、CAPA和最终结果进行确认。
3.2.QA:执行前完成对方案及记录的审核;负责确认过程的监控和检查,保证确认方案的实施,审核确认过程的相关记录及结果评价;审核偏差及变更的记录、调查、处理和评估。
3.3.公司验证领导小组:审核确认方案、报告;对确认过程中出现的偏差、变更进行审核。
3.4.公司验证领导小组负责人:批准确认方案、报告及确认过程中出现的偏差、变更的处理。
4、法规与指南4.1.中国GMP2010 版4.2.药品生产验证指南4.3.JJF 1101-2003环境试验设备温湿度校准规范4.4.JB/T 5520-91干燥箱技术条件5、缩写与定义无6、系统/设备描述6.1.基本信息型号:101AS-1仪器名称:数显电热鼓风干燥箱设备编号:XX生产商:上海圣欣科学仪器有限公司6.2.用途:101AS-1数显电热鼓风干燥箱用于QC实验室物品的干燥,常用温度150℃、180℃和250℃。
6.3.安装位置:本设备安装于QC消化干燥室,房间编号:(XX)。
6.4.结构与组件:本设备由箱体、电加热器、温控仪、风机、风对流循环风道、进风风道、出风风道和出风口大小调节装置等组成。
运行确认OQ

2.结论
报告记录人:
审核人:
第 10 页,共 10 页
【范围】 ______________________________工程所有系统及其设备的运行(只有在顺利地执行安 装确认并获得通过后,才能开始进行运行确认) 【验证小组的职责和验证计划】 1.验证小组的职责 1.1验证小组组长的职责 ● 保证OQ方案及OQ检查表的起草; ● 保证在执行前完成对OQ方案及OQ检查表的审核和批准; ● 确保能及时发现偏差,并按照已经达成一致偏差处理方法对其进行记录、纠正、调查 和最终确认。 ● 验证过程中,如有变更,保证按《变更控制》执行 ● 确保OQ报告的生成、审核和批准,以便对该OQ方案进行最终批准。 1.2 验证小组成员职责 ● 执行前完成对OQ方案及OQ检查表的审核。 ● 负责验证过程的监控和检查,保证验证方案的实施,参与验证结果评价。 ● 参与验证偏差的调查、处理、和评估。 ● 验证过程中,如有变更,保证按《变更控制》执行。 2. 验证计划 第 4 页,共 10 页
_______________________工程 验证方案
运行确认(OQ) 方案批准: 方案审核/批准签字 起草人 日期 文件编号: 602-OQ-001 执行日期: 年 月 日
审核人
批准人
变更记载 版本号 执行日期 变更原因、依据及详细变更内容
第 1 页,共 10 页
_______________________工程 验证方案
3.运行环境确认(对系统/设备运行要求的环境,如温湿度、压差、空间要求进行确认) 确认内容 温度 湿度 压差 耐腐 空间 确认人: 要求 0~150℃ 避免设备长时间在湿度特别大 的环境内 设备量程内 一般耐腐 设备在该空间内能正常工作 审核人: 实际情况 备注
GMP验证运行确认性能确认OQPQ模板
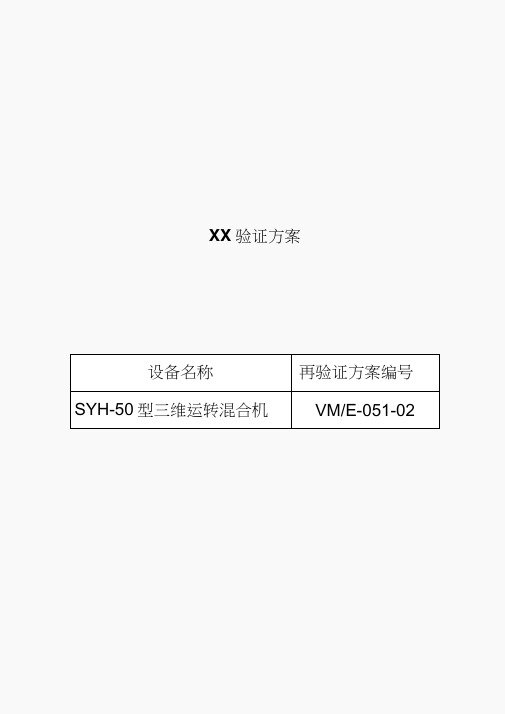
XX验证方案设备名称再验证方案编号SYH-50型三维运转混合机VM/E-051-02验证方案审查与批准您下面的签字表明您已审阅此份验证方案并同意实施。
姓名部门签名日期起草人姓名部门签名日期审核人审核人设备部审核人质量部姓名部门签名日期批准人质量受权人验证小组成员序号部门成员成员(签名/日期)1XX车间23设备部456质量部7验证小组组长:(签名/日期)1目的 (5)2验证范围 (5)3验证人员职责 (5)4系统概述 (5)4.1铭牌 (5)4.2主要功能和工艺用途 (5)4.3结构特征 (6)4.4主要技术参数见下表 (6)4.5 希9造商 (6)5参考文献 (6)6验证程序 (6)6.1文件确认 (7)6.2人员培训确认 (7)6.3仪器仪表的校准确认 (7)6.4运行确认 (8)6.4.1 设备操作测试 (8)6.5性能确认 (8)6.5.1 成粒控制确认 (8)7偏差 (9)7.1偏差清单 (9)7.2偏差处理单 (9)8拟订日常监测项目及验证周期 (9)9验证评定与结论,证书审核与批准 (9)10附件 (9)1目的公司XX车间新增XX设备,该设备投入使用以前应进行设备验证。
为证明该设备运行情况符合现行GMP规范和公司生产工艺标准,特制定本验证方案。
验证过程应严格按照本方案制定的内容进行,如因特殊原因确需变更时,应填写验证方案变更申请及批准书,并报质量部批准。
本方案是XX设备验证文件的第三部分:运行确认(0Q、性能确认(PQ)。
2验证范围本验证方案适用于XX车间XX设备运行确认、性能确认,该设备安装于 ________________________ ,设备编号为_________ 。
验证时间:年月日一一年月日3验证人员职责所在部门人员职责XX车间起草验证方案,负责具体实施,收集数据与材料,出具验证报告设备部审核验证方案与验证报告、验证组织与协调仪器仪表的校准质量部审核验证方案与验证报告、验证协调负责相关检测工作,出具检测报告4系统概述4.1铭牌--- 设备名称:――型号规格:――出厂日期:――出厂编号:――适用电源:制造单位: 4.2主要功能和工艺用途包括以下几个部份:设备与物料接触零部件材料采用了优质低碳奥氏体不锈钢316L,耐腐蚀,不与药品发生化学变化。
注塑产品(OQ)方案

*** (模具编号:271#)运行确认(OQ)方案*** (mould no.#271)Operation Qualification program文件编号/File no.:Q**-TM-Vf-271-2020001修订号/版本Revision no/version:0/1确认方式Verification nature:首次First,同步验证Concurrent verification产品/组件名称Product/Part name:*** ***注塑机编号/Injection Molding Machines no.:02-26__________________________________________________ _________工程部工程师Engineer 日期Date____________________________________ _______ __________质检部主管QA Manager 日期Date*****有限公司***Co. LTD2020年7月/july,2020目录/Catalog1.0目的/Purpose (3)2.0 范围/Scope (3)3.0 定义Definition (3)4.0 要求与责任Responsibility and authority.................... . (3)5.0背景/过程描述Background/process description (4)6.0测试设备Test equipment................................................... .. (4)7.0程序Procedure.............................................................. . (5)8.0报告和结论Report and conclusion (6)9.0再验证周期RE-verification cycle (7)附件1: OQ 参数范围Attached #1:OQ Parmeter Scope附件2: 外观检验表Attached #2 Visual Inspection Check List附件3: 尺寸/重量检验表Attached #3:Size/Weight Inspection Check List附件4: 功能检验表Attached #4:Function test Check List附件5: 机器参数实际显示值Attached #5:Actual parameter1.0 目的/Purpose:编写此方案的目的是指导我公司生产车间完成****生产操作工艺流程的确认。
注射用水储存和分配系统运行确认(OQ)方案

运行确认方案(OQ)注射用水储存和分配系统方案审核和批准供应商:客户:版本历史目录1.目的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.参考文件清单 (4)5.系统描述 (5)5.1.描述 (5)6.OQ实施 (8)6.1.先决条件 (8)6.2.人员确认 (9)6.3.验证仪器校准确认 (11)6.4.人机界面确认 (13)6.5.运行功能确认 (15)6.6.报警和联锁确认 (19)6.7.生产参数确认 (20)6.8.峰流量确认 (24)6.9.消毒过程确认 (26)7.偏差报告 (30)8.附件清单 (30)9.执行的审核和批准 (30)1. 目的本运行确认是为了确认XXX制药有限公司新建项目注射用水储存和分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2. 验证范围本运行确认的范围包括了注射用水储存和分配系统,而不包括注射用水制备系统。
本方案中的注射用水系统(WFI) 仅指注射用水的储存和分配系统。
3. 职责3.1. 供应商的职责➢OQ方案编写➢OQ实施和数据的收集➢准备偏差报告和解决偏差的建议➢如果出现偏差,与客户某个授权的人员进行协调➢最终报告的编写3.2. 客户的职责➢执行前审核和批准本方案➢针对不符合项界定解决方法➢审核和批准最终报告4. 参考文件清单以下是方案编写所依据的参考文件:●(SFDA) 中国GMP2010年修订版●欧盟GMP的附录1-无菌药品的生产,2008版●欧盟GMP的附录15-验证和确认●中国药典2010年版●药品生产验证指南(2003年版)●(ISPE) 新建和改造的工厂制药工程指南,第3卷-无菌生产设施,第1版,1999年1月●(ISPE)新建和改造的工厂医药工程指南,第4卷-水和蒸汽系统,第1版2001年1月5. 系统描述5.1. 描述注射用水储罐容量分别为:注射用水由注射用水制备系统供应到各个储罐。
设备运行确认(OQ)范本

设备运行确认(OQ)验证文件目录1目的 (1)2 适用范围 (1)3 责任者 (1)4 职责 (1)4.1工程设备部职责 (1)4.2 质量管理部职责 (1)4.3生产技术部职责 (1)4.4设备总监 (1)4.5质量授权人 (1)5 缩略语 (2)6 文件管理规范 (2)7 设备描述 (3)8 方案起草 (3)9 方案审核 (4)10 培训记录确认 (4)11 运行条件确认 (4)12仪器仪表确认 (5)13 运行确认流程 (5)14 运行功能确认 (5)15 运行状态确认 (6)16 运行确认报告 (7)17 运行确认结论 (7)1目的为了建立书面上的依据,确认固体制剂瓶装包装联动生产线按照其规格运行,并记录相关信息和数据,证明各台设备能达到所预期的各项功能。
通过验证,保证设备运行性能符合生产工艺和生产规模的要求,标准操作程序符合生产操作要求。
2 适用范围本程序适于非标和专用设备、设施完工后使用前的安装确认、验收。
其它设备可参照实行。
3 责任者工程设备部、质量管理部、生产技术部、设备总监、质量授权人4 职责4.1工程设备部职责负责组织设备运行确认(OQ)方案的起草和实施工作。
跟踪安装过程中所有偏差缺陷均已整改。
4.2 质量管理部职责参与设备安装过程中的质量审核工作,负责在运行过程中对偏差作出处理意见,确保设备零部件齐全,配置正确。
4.3生产技术部职责参与设备安装过程中设备生产性能的审核工作,确保设备运行稳定可靠,生产参数满足参数要求。
4.4设备总监审核验证方案的验证报告。
4.5质量授权人质量授权人负责方案、偏差的报告和最后批准。
5 缩略语在下面的表格中规定了本方案中使用的缩略语。
6 文件管理规范●填写栏目内容,应按照实际测试情况,对测试结果使用对勾“√”填写,只能选择一种测试结果填写。
示例如下:●在错误处划线,填入正确的内容,签名并注明更改日期,确保原先信息仍清晰可识别。
示例如下:2011年01月02日修改签名和修改日期2011年01月01日记录日期:年用4位数表示,日和月用2位数表示。
OQ 厂房设施运行确认方案
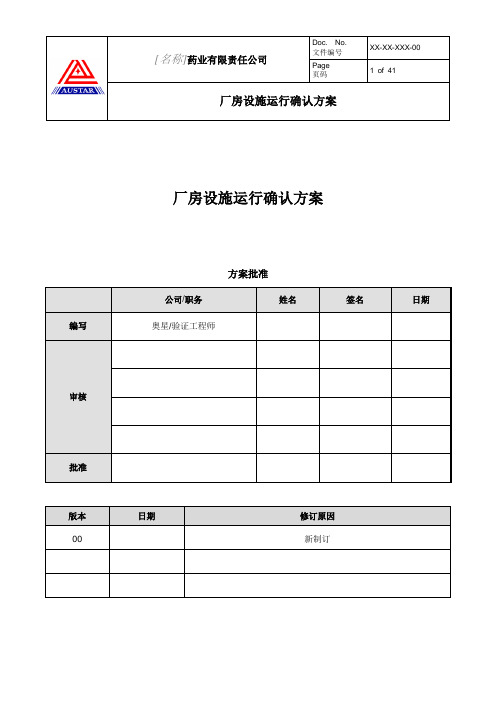
页码厂房设施运行确认方案厂房设施运行确认方案方案批准公司/职务姓名签名日期编写奥星/验证工程师审核批准版本日期修订原因00 新制订页码厂房设施运行确认方案目录1.介绍 (4)2.目的 (4)3.范围 (4)3.1范围内 (4)3.2范围外 (4)4.职责 (4)4.1奥星职责 (4)4.2[名称] 职责 (4)5.缩略语 (6)6.法规和指南 (7)6.1法规 (7)6.2指南 (7)7.参考文件 (8)8.系统/设备描述 (9)8.1系统设备用途 (9)8.2能力 (9)8.3设计和运行特点 (10)9.文件管理规范 (11)10.测试项目列表 (13)11.运行确认测试 (14)11.1先决条件确认 (14)11.2人员确认 (15)11.3SOP确认 (15)11.4培训确认 (15)11.5测试仪器仪表校准确认 (16)11.6互锁门确认 (16)11.7照度确认 (17)11.8噪声确认 (18)12.偏差处理 (18)13.变更控制 (18)页码厂房设施运行确认方案14.运行确认总结 (18)15.附件清单 (19)16.支持性附录清单 (19)17.测试报告 (19)页码厂房设施运行确认方案1. 介绍xxx有限公司位于xxx,现在xxx新建一个注射剂车间,用于生产xxx。
该厂房名称为xxx,共有xx层,建筑面积xxx。
该项目要通过中国GMP 2010版。
该厂房设施(×××)根据系统影响性评估的方法确定为直接影响系统,系统编号xxx。
通过风险评估的方法评估了部件的关键性,识别出潜在危险及其对产品的影响。
详细信息参见部件关键性评估报告(报告名称:[名称],编号:[编号])。
所有直接影响系统将按照VMP(文件编号:XXX)所附的验证矩阵进行确认,本方案为厂房设施的运行确认,因此所有的运行确认活动将按照本方案执行并记录。
2. 目的运行确认为[名称](公司名称)注射剂车间前验证的一部分。
设备运行确认OQ范本

设备运行确认(OQ)验证文件目录1目的 (1)2适用范围 (1)3责任者 (1)4职责 (1)4.1工程设备部职责 (1)4.2质量管理部职责 (1)4.3生产技术部职责 (1)4.4设备总监 (1)4.5质量授权人 (1)5缩略语 (2)6文件管理规范 (2)7设备描述 (3)8方案起草 (3)9方案审核 (4)10培训记录确认 (4)11运行条件确认 (4)12仪器仪表确认 (5)13运行确认流程 (5)14运行功能确认 (5)15运行状态确认 (6)16运行确认报告 (7)17运行确认结论 (7)1目的为了建立书面上的依据,确认固体制剂瓶装包装联动生产线按照其规格运行,并记录相关信息和数据,证明各台设备能达到所预期的各项功能。
通过验证,保证设备运行性能符合生产工艺和生产规模的要求,标准操作程序符合生产操作要求。
本程序适于非标和专用设备、设施完工后使用前的安装确认、验收。
其它设备可参照实行。
3责任者工程设备部、质量管理部、生产技术部、设备总监、质量授权人4职责4.1工程设备部职责负责组织设备运行确认(OQ)方案的起草和实施工作。
跟踪安装过程中所有偏差缺陷均已整改。
4.2质量管理部职责参与设备安装过程中的质量审核工作,负责在运行过程中对偏差作出处理意见,确保设备零部件齐全,配置正确。
4.3生产技术部职责参与设备安装过程中设备生产性能的审核工作,确保设备运行稳定可靠,生产参数满足参数要求。
4.4设备总监审核验证方案的验证报告。
4.5质量授权人质量授权人负责方案、偏差的报告和最后批准。
5缩略语在下面的表格中规定了本方案中使用的缩略语。
6文件管理规范•填写栏目内容,应按照实际测试情况,对测试结果使用对勾“J”填写,只能选择一种测试结果填写。
示例如下:•在错误处划线,填入正确的内容,签名并注明更改日期,确保原先信息仍清晰可识别。
示例如下:2011年01月02日修改签名和修改日期2011年01月01日记录日期:年用4位数表示,日和月用2位数表示。
OQ灭菌线运行确认方案

OQ PROTOCOL运行确认方案1#STERILION LINE OQ灭菌线运行确认File Number文件编号Version版本号Description描述011st VersionValidation Team 验证团队Name/Position姓名/职位Signature签名Date日期Written By 起草者Reviewer 审核者Reviewer 审核者Approver 批准者目录1.验证目标Validation Objective (3)2.范围Scope (3)3.职责Responsibilities (5)4.灭菌柜OQ确认策略Sterilizer OQ Qualification Strategy (5)5.接受标准Acceptance Criteria (7)6.偏差处理Deviations Handling (8)7.参考References (8)8.程序Procedure (9)9.附录Appendix (13)1.验证目标Validation Objective1.1.此次OQ确认的目的是证实及用文件记录现有预热间,灭菌柜,解析间,在安装确认完成后,通过对预热间,灭菌柜和解析间的OQ确认,能够在指定的公差范围内重复地准确地交付指定的灭菌过程。
The purpose of this OQ qualification is to demonstrate and document that the current preconditioning room,EO sterilization chamber and heated aeration room,as completion of IQ,through OQ,is capable of delivering the defined sterilization process reproducibly and accurately within defined tolerances.1.2.此次预热间,灭菌柜,解析间的OQ确认方案符合ISO11135:2014-医疗产品灭菌-环氧乙烷-医疗器械灭菌过程的发展,验证及常规控制的要求,EN1422-2014(YY0503-2016)的相关条款。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ZPY129 旋转式压片机
运行确认(OQ)方案
MCS-STP-VPP-×××-01
xxx公司
方案编写人员
方案审核人员
方案批准人员
【目的】
确认该系统或设备按照其规格运行,并记录相关信息和数据,证明设备或系统能达到所预期的各项功能。
【范围】
当安装、大修或转移位置安装并完成安全确认之后。
【责任】
ⅰ操作本系统或设备的人员执行运行确认并作相关记录;
ⅱ设备主管负责监督确认方案的实施和各相关记录填写完整,负责报告确认过程的偏差和拟定设备运行确认报告;
ⅲQA负责审核批准设备确认方案和报告。
1 运行确认所需的前提:
1.1所需物资和其他配备确认:
(格子不够自行增加)
实施者:日期:偏差报告:
复核者:日期:1.2需要校验的仪器仪表清单确认:
(格子不够自行增加)
实施者:日期:偏差报告:
复核者:日期:1.3 运行确认所需SOPs和记录确认:
(格子不够自行增加)
1.4 运行确认培训记录确认:
(格子不够自行增加)
1.5 设备操作手册确认:
(格子不够自行增加)
实施者: 日期:
偏差报告: 复核者:
日期: 2 运行确认程序
2.1 校验需要校验的设备仪器并记录(如表1)
2.2 确认关键控制点和警戒的操作条件并记录(如表3); 关键控制点和警戒: (格子不够自行增加)
实施者: 日期:
偏差报告: 复核者:
日期: 2.3 确认设备运行后的各项输出参数
实施者:日期:
偏差报告:
复核者:日期:
2.4 列出校验设备仪器的校验要求(合格标准)(表5)
2.5 需要的话,在正常条件或极端条件下,作挑战性试验,测量并记录
2.5.1 正常条件下的测试:
结果:
实施者:日期:
偏差报告:
复核者:日期:
2.5.2 极端条件下的测试(例如:突然断电、温度恢复时间、离心不平衡等情况):
结果:
实施者:日期:
偏差报告:
复核者:日期:
2.6 记录实施过程的任何偏差,准备偏差报告,内容包括可接受标准的正当性和对操作的影响。
偏差描述:
偏差处理并证明其可接受:
对操作的影响:
偏差报告者:日期:
复核者:日期:
2.7 准备设备确认报告,提交QA批准。
结果(初始研究数据,确认记录、所作的观察、遇到的问题、收集到信息的完整性;偏差报告总结;关键控制和警戒的结果;样本数据(若有);初始数据的保存位置;有关本研究的其他相关信息):
结论:
报告起草者:日期:
QA批准:日期:。
