外来文件清单2019
质量外来文件清单
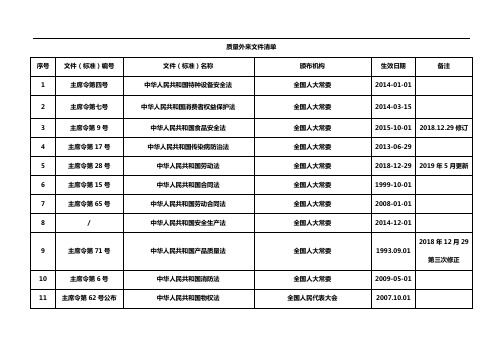
质量外来文件清单序号文件(标准)编号文件(标准)名称颁布机构生效日期备注1 主席令第四号中华人民共和国特种设备安全法全国人大常委2014-01-012 主席令第七号中华人民共和国消费者权益保护法全国人大常委2014-03-153 主席令第9号中华人民共和国食品安全法全国人大常委2015-10-01 2018.12.29修订4 主席令第17号中华人民共和国传染病防治法全国人大常委2013-06-295 主席令第28号中华人民共和国劳动法全国人大常委2018-12-29 2019年5月更新6 主席令第15号中华人民共和国合同法全国人大常委1999-10-017 主席令第65号中华人民共和国劳动合同法全国人大常委2008-01-018 / 中华人民共和国安全生产法全国人大常委2014-12-012018年12月29 9 主席令第71号中华人民共和国产品质量法全国人大常委1993.09.01第三次修正10 主席令第6号中华人民共和国消防法全国人大常委2009-05-0111 主席令第62号公布中华人民共和国物权法全国人民代表大会2007.10.0112 主席令第37号公布中华人民共和国民法通则全国人民代表大会2009.08.2713 2018年3月11日第十三届全国人民代表大会第一次会议通过中华人民共和国宪法修正案(附2018年修正本)全国人民代表大会2018.03.1114 2013年12月28日第十二届全国人民代表大会常务委员会第六次会议中华人民共和国公司法全国人民代表大会常务委员会2018.10.26 2019年5月新增15 GB 14934—1994 食(饮)具消毒卫生标准中华人民共和国卫生部2017-04-19 2019年5月更新16 GB 5749-2006 国家生活饮用水卫生标准卫生部/国家标准化管理委员会2007-07-0117 GB 9663-1996 旅店业卫生标准中华人民共和国卫生部1996-09-0118 GB 9664-1996 文化娱乐场所卫生标准中华人民共和国卫生部1996-09-0119 GB 9665-1996 公共浴室卫生标准中华人民共和国卫生部1996-07-0120 GB 9666-1996 理发店、美容店卫生标准国家技术监督局1996-09-0121 GB 9667-1996 游泳场所卫生标准中华人民共和国卫生部1996-09-0122 GB 9668-1996 体育馆卫生标准国家技术监督局1996-09-0123 GB 16153-1996 饭馆(餐厅)卫生标准中华人民共和国卫生部1996-09-0124 GB 2760-2011 食品添加剂使用标准中华人民共和国卫生部2015-05-24 2019年5月更新中华人民共和国国家质量监督检验检疫25 GB/T19001-2016 质量管理体系基础和术语2017-07-01总局/中国国家标准化管理委员会中华人民共和国国家质量监督检验检疫26 GB/T19004-2008 追求组织的持续成功质量管理方法2012-02-01 2019年5月更新总局/中国国家标准化管理委员会27 GB 3096-2008 声环境质量标准国家质量监督检验检疫总局2008-10-01中华人民共和国国家质量监督检验检疫28 GB/T19001-2016 质量管理体系要求2017-07-01总局/中国国家标准化管理委员会29 ISO 19011:2013 质量和(或)环境管理体系审核指南国际标准化组织2014-04-01 2019年5月新增30 GB 26687-2011 食品安全国家标准复配食品添加剂通则卫生部2011-09-05 2019年5月更新31 国务院令第302号关于特大安全事故行政责任追究的规定国务院2001-04-2132 国务院令第493号《生产安全事故报告和调查处理条例》国务院2007-06-01 2019年5月新增33 国务院令第376号突发公共卫生事件应急条例国务院2003-05-0934中华人民共和国国务院令第549号公布特种设备安全监察条例中华人民共和国国务院2009-05-0135劳务部发[1994]498号未成年工特殊保护规定中华人民共和国劳动部1995-01-0136 卫生部令第80号公共场所卫生管理条例实施细则中华人民共和国卫生部2011-05-0137 市人民政府第163次常务会议通过西安市电梯安全管理办法西安市人民政府2017-03-0438 国家质量监督检验检疫总局令第140号特种设备作业人员监督管理办法国家质量监督检验检疫总局局务会议审议通过2011-07-0139 根据2015年5月29日国家安全生产监督管理总局令第80号特种作业人员安全技术培训考核管理规定国家安全监管总局关于废止和修改劳动防护用品和安全培训等领域十部规章的决定2010-07-0140 SB/T 11143-2015 餐饮分餐服务操作规范商务部2015年第58号公告2016-09-01 2019年5月新增41 SB/T 11168-2016 餐饮烹炸操作规范商务部2017-05-01 2019年5月新增西安市人民政府第60次常务会议审议通42 西安市西安市控制吸烟管理办法2018-11-01 2019年5月新增过43 / 食品安全操作规范商务部2016.8.18编制:*** 日期:****-**-** 批准:*** 日期:****-**-**。
什么样的文件属外来文件

什么样的文件属外来文件
不是体系要求的文件,需要在组织内传达执行的文件,都属于外来文件。
外来文件的识别需根据相关方(见 4.2)和策划(6.1)的识别和管理的结果,对外来文件进行分类搜集控制。
根据4.2所识别的相关方,收集他们所提出和发布的有关质量管理的要求的文件并识别出其必要性后,他们所发布的文件即为外来文件。
主要有:
1.政府、上级发布的红头文件、相关部门发布的法律法规、规章制度;
2.与产品和服务有关的国家标准、行业标准、技术标准、产品标准、
检验检测标准;
3.
4.客户提供的设计图样、工艺文件、技术资料;
5.合作伙伴、供应商提供的技术资料、报告等;
6.大学、技术学校、研究机构、技能鉴定等提供的有关培训和能力培养方面的资料和要求;
7.
8.外部的满意度调查报告;
9.收集的与产品和服务有关的地区、民俗、地质、气候、经济、人文方面的正式报告;
10.来自竞争对手的重要报告、报道、通讯、文献、技术资料等;
11.与组织质量管理有关的新闻报道。
外来文件清单
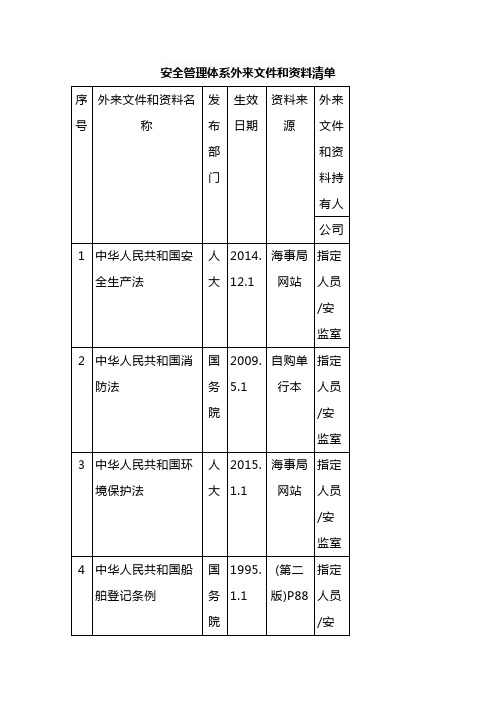
2016.1.1
海事局网站
指定人员/安监室
77
关于印发《海船船员健康检查要求》 海船员2012 (678)号
中国海事局
2012.10.1
海事局网站
指定人员/安监室
78
《国内水路运输管理条例》 国务院令 第625号
国务院
2013.1.1
海事局网站
指定人员/安监室
79
中华人民共和国海事局关于实施《73/78防污公约》附则V2011年修正案的通知 海船舶(2012)798号
68
国内航行船舶船载电子海图系统和自动识别系统设备管理规定
中国海事局
2010.4.12
海事局
指定人员/安监室
69
国内航行海船法定检验技术规则(2012年修改通报)
海事局
2012
海事局网站
指定人员/安监室
70
中华人民共和国海船船员健康证书管理办法 海船员(2016)521号
中国海事局
2016.9.21
海事局网站
指定人员/安监室
71
长江上海段船舶定线制航路调整方案,长江口深水航道(12.5米)延伸段试通航暂行规定
上海海事局
2011.1.8
海事局网站
指定人员/安监室
72
老铁山水道船舶安全航行特别管理规定(试行)
辽宁海事局
2010.7.2
海事局网站
指定人员/安监室
73
关于实施长山水道船舶定线制和长山水道船舶报告制的公告
中国海事局
2013.1.1
海事局网站
指定人员/安监室
80
《关于修改《中华人民共和国海上船舶污染事故调查处理规定》的决定(交通部2013年第16号令)
9001质量管理体系外来文件清单

——
外来文件
19
起重设备安装工程施工及验收规范规
GB 50278-2010
——
外来文件
20
机械设备安装工程施工及验收通用规范
GB 50231-2009
——
外来文件
21
起重机车轮及打车和小车轨道公差第一部分总则
GB/T101831-2010
——
外来文件
22
起重机试验规范和程序
GB 5905-1986
——
外来文件
41
起重机维护手册
GB/T18453-2001
——
外来文件
42
起重机备件手册
GB/T18875-2001
——
外来文件
43
港口门座起重机技术条件
GB/T17495-1998
——
外来文件
44
港口起重机稳定性基本要求
GB/T 17496-1998
——
外来文件
45
起重机用钢丝绳检验和报废应用规范
jl423外来文件清单共2页第1页序修改号文件名称文件编号备注记录gbt19001201质量管理体系要求外来文件08gbt19000202质量管理体系基础与术语外来文件08gbt50430203工程建设施工企业质量管理规范外来文件074中华人民共和国产品质量法外来文件5中华人民共和国合同法外来文件6中华人民共和国劳动法外来文件7中华人民共和国计量法外来文件8中华人民共和国标准化法外来文件9中华人民共和国消防法外来文件10中华人民共和国劳动合同法外来文件11中华人民共和国档案法外来文件12中华人民共和国环境保护法外来文件13中华人民共和国不正当竞争法外来文件14中华人民共和国公司法外来文件15中华人民共和国消费者权益保护法外来文件起重机械安装改造重大维修监督检验tsg16外来文件规则q70162008机电类特种设备安装改造维修许可规172003版外来文件则18电梯监督检验规程2002版外来文件起重设备安装工程施工及验收规范规gb19外来文件502782010机械设备安装工程施工及验收通用规gb20外来文件范50231200921起重机车轮及打车和小车轨道公差第gbt外来文件一部分总则22起重机试验规范和程序gb59051986外来文件23电梯制造与安装安全规范gb75882003外来文件gb24电梯安装验收规范外来文件100601993gb25电梯工程施工质量验收外来文件503102002gbt26电梯技术条件外来文件100582009gbt27电梯自动扶梯和自动人行道维修规范外来文件187752009jl423外来文件清单共2页第2页序修改文件名称文件编号备注号记录gbt5032820028建筑工程文件归档整理规范外来文件1db13j29建筑工程技术资料管理规程外来文件35200230电梯试验方法gbt100592009外来文件31起重机设计规范gbt38112008外来文件32起重机械安全规程gbt60671985外来文件gbt1440519933通用桥式起重机外来文件3gbt14406134通用门式起重机外来文件993gbt1749619935港口门座起重机修理技术规范外来文件8gbt1790819936起重机和起重机械技术性能和验收文外来文件9件gbt1843820037港口起重机验收试验规则外来文件1gbt1843920038港口起重机稳定性基本要求外来文件1gbt1844020039港口起重机技术性能和
外来文件清单(ISO9001四级文件表格)

外来文件名称
文件类型
状态
备注
1
中华人民共和国宪法
国家法律
有效
电子化
2
中华人民共和国劳动法
国家法律
有效
电子化
3
中华人民共和国产品质量法
国家法律
有效ቤተ መጻሕፍቲ ባይዱ
电子化
4
中华人民共和国消防法
国家法律
有效
电子化
5
中华人民共和国道路交通安全法
国家法律
有效
电子化
6
中华人民共和国环境保护法
国家法律
有效
电子化
7
中华人民共和国消费者权益保护法
国家法律
有效
电子化
8
中华人民共和国安全生产法
国家法律
有效
电子化
9
中华人民共和国清洁生产促进法
国家法律
有效
电子化
10
GB/T19001-2016/ISO9001:2015
国家标准
有效
书面
11
GB/T19000-2016/ISO9000:2015术语
国家标准
有效
书面
12
GB/T24001-2016/ISO14001:2015
国家标准
有效
电子化
18
绿色产品评价陶瓷砖(板)GB/T 35610-2017
国家标准
有效
电子化
19
陶瓷砖防滑性等级评价GB/T 37798-2019
国家标准
有效
电子化
20
陶瓷砖试验方法第2部分:尺寸和表面质量的检验GB/T 3810.2-2016
国家标准
有效
电子化
外来文件对照清单、存档、管理规范[模板]
![外来文件对照清单、存档、管理规范[模板]](https://img.taocdn.com/s3/m/bceb6c8425c52cc58ad6be81.png)
外来文件对照清单、存档、管理规范1. 概述本文主要定义外来文件的分类以及外来文件的接收、存档方面的规定。
2. 目的确保质量体系有效运作,并规范外来文件的管理。
3. 术语4. 内容4.1. 外来文件的分类4.1.1.与QMS系统有关的当地政府机关行政管理文件,如:《东莞市有关电子产品质量检验检疫的通告》等;4.1.2.国家法律法规文件,如《中华人民共和国劳动法》、《中华人民共和国工伤保险条例》等;4.1.3.国际标准文件,如《ISO9001:2015质量管理体系要求》、《RoHS指令》&《WEEE指令》等;4.1.4.国家标准文件,如《GB/T 2828.1-2003计数抽样检验程序》、《SJ/T 11363-2006 电子信息产品中有毒有害物质的限量要求》等;4.1.5.客供规范、标准,如某客户提供的《XXX产品进料检验规范》、与客户签定的《供应商环保协议书》、《产品承认书》等;4.1.6.客供图档,如某客户提供的XXX产品2D或3D图档、模具3D图档等;4.1.7.其他与产品有关的重要外来文件,如客户的ECN通知单等正式行文的资料;4.1.8.供应商提供的物料规范,如物料图纸。
4.2.外来文件接收、存档4.2.1.相关部门收到外来文件后,经部门主管确认后,依【文件受控流程】申请文件受控、存档、分发。
相关部门如下表示:4.2.2.文控中心收到外来文件受控申请后,确定核对文件是否有重复申请情况,完成后登记入【外来文件一览表】,并按【产品数据类文件编码原则及版本控制规范】进行文件编码。
如文件需归档在PDMC系统,文件编号由系统分配。
外来文件归档在PDMC系统“15.9.4管理外来文件”目录下,根据文件来源归档在相应的子目录下:“15.9.4.1管理客户文件”、“15.9.4.2管理供方文件”及“15.9.4.3管理第3方文件”。
4.2.3.下发的纸版外来文件均需加盖“外来文件”章,保存期限:四年。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
hItStOp1s0:9/9/3w-w1w.iso.or
/
g/search.html?q=10 电子档 有效
993-4 https://www.iso.or
/
g/standard/36406.h 电子档 有效
tml https://www.iso.or
/
g/standard/40884.h 电子档 有效
u/growth/sectors/m 电子档 有效
edicalhttp://ec.europa.e
/
u/growth/sectors/m 电子档 有效
edicalhttp://ec.europa.e
/
u/growth/sectors/m 纸制
有效
edical-
/
http://ec.europa.e 纸制/电子 u/growth/sectors/m 档
17 人体医疗器械的临床调查-良好的临床实践
ISO 14155: 2011/AC:2011 2011年2月 2011年2月
18 医疗设备制造商提供的信息
BS EN 1041:2008+A1:2013 2009/2/19 2009/2/19
19
医疗器械。与医疗器械标签,标签和提供的信息一起使 用的符号。第1部分:一般要求
7 医疗设备软件-软件生命周期过程
IEC 62304:2006+AMD1:2015 CSV
2015/6/26
2015/6/26
8 医疗器械风险管理在医疗器械中的应用
ISO 14971:2007
2007年9月 2007年9月
9
医用电气设备。第1-9部分:基本安全和基本性能的一般 IEC 60601-1-9:2007 +
IEC 60601-18:2006+AMD1:2012
CSV
6
医用电气设备 - 第2-16部分:血液透析,血液透析滤过 和血液过滤设备的基本安全性和基本性能的特殊要求
IEC 60601-2-16:2018RLV
2013/10/29 2013/10/29 2012/11/28 2012/11/28 2018/4/20 2018/4/20
https://webstore.i
/
ec.ch/publication/ 电子档 有效
2596 https://webstore.i
/
ec.ch/publication/ 电子档 有效
2599
https://webstore.i
/
ec.ch/publication/ 电子档 有效
63018 https://webstore.i
IEC 60601-1-2:2014
2014/2/25 2014/2/25
4
医用电气设备 - 第1-6部分:基本安全和基本性能的一般 IEC 60601-1-
要求 - 并列标准:可用性
6:2010+AMD1:2013 CSV
5
医用电气设备 - 第1-8部分:基本安全和基本性能的一般 要求-附属标准:医疗电气设备和报警系统的一般要求, 试验和指南医疗电气系统
重庆山外山血液净化技术股份有限公司 外来文件清单
记录格式编号:G02-11 版本号:V1.02 页次:第1页,共1页
外来文件清单
生效日期:2018-08-02
序号
文件名称
文件编号
发布日期
实施日期 发布单位
获取渠道
文件载体 有效性
备注
1
医用电气设备 - 第2-30部分:自动无创血压计基本安全 性和基本性能的特殊要求
要求。并列标准:环保设计要求
AMD1:2013 CSV
10
医疗器械生物学评价 第1部分:风险管理过程中的评价 与试验
ISO
10993-1:
2018
11
医疗器械的生物学评价-第4部分:血液相互作用试验的 选择
ISO 10993-4: 2017
2013/6/18 2013/6/18 2018/8/1 2018/8/1 2017年4月 2017年4月
2013/1/1 2013/1/1
2010年9月 2010年9月
/
/
26 上市后监管Post-Marketing_Surveillance_(PMS)
NB-MED-2_12-1_rev.11
/
/
https://www.iso.or
/
g/search.html?q=13 电子档 有效
485 https://webstore.i
tml https://www.iso.or
/
g/standard/68426.h 电子档 有效
tml
15 医疗器械-质量管理体系-监管要求
ISO 13485: 2016
2016年3月 2016年3月
16 医疗设备-第1部分:可用性工程在医疗设备中的应用 IEC 62366-1: 2015
2015/2/24 2015/2/24
12 医疗器械的生物学评价-第5部分:体外细胞毒性试验 ISO 10993-5: 2009
2009年6月 2009年6月
13 医疗器械的生物学评价-第10部分:刺激和皮肤过敏试验 EN ISO 10993-10: 2010
2010年8月 2010年8月
14 医疗器械的生物学评价-第11部分:全身毒性试验
IEC
80601-2-30:2018
2018/3/20 2018/3பைடு நூலகம்20
2
医用电气设备 - 第1部分:基本安全和基本性能的一般要 IEC 60601-
求
1:2005+AMD1:2012 CSV
2012/8/20 2012/8/20
3
医用电气设备 - 第1-2部分:基本安全和基本性能的一 般要求 - 并列标准:电磁干扰 - 要求和试验
/
ec.ch/publication/ 电子档 有效
21863 https://www.iso.or
/
g/standard/45557.h 纸制
有效
tml
/
/
纸制
有效
https://www.iso.or
/
g/standard/69081.h 电子档 有效
tml http://ec.europa.e
/
EN ISO 15223-1:2016
20 上市后临床跟踪指南
MEDDEV 2.12-2 rev.2 (2012)PMCF
21
MEDDEV 2.7.1 第4版-临床评估:根据指令9342和90385 制造商和指定机构的指南
MEDDEV.2.7.1版本.4
2017年3月 2017年3月 2012年1月 2012年1月 2016年6月 2016年6月
有效
edical-
/
/
电子档 有效
/
/
电子档 有效
/
/
电子档 有效
22 临床调查指南
MEDDEV2.7/4
2010年12月 2010年12月
23 医疗器械安全警戒系统指南
24
与申请有关的准则 理事会关于医疗设备的指令93/42 / EEC
25 欧盟指令
MEDDEV 2.12-1 rev.8
MEDDEV 2. 4/1 Rev. 9 June 2010
MDD_93+42+EEC_2007
ISO 10993-11: 2017
2017年9月 2017年9月
https://webstore.i
/
ec.ch/publication/ 电子档 有效
62878 https://webstore.i
/
ec.ch/publication/ 电子档 有效
2612
/
https://webstore.iec.c电h/子pu档blicat有io效n/2590
/
ec.ch/publication/ 电子档 有效
22794
https://www.iso.o
/
rg/standard/38193 电子档 有效
h.thttpmsl://webstore.i
/
ec.ch/publication/ 电子档 有效
2602
https://www.iso.o
/
rg/search.html?q= 电子档 有效
