华南师范大学实验报告封面
实验3,华南师范大学实验报告

华南师范大学实验报告姓名:课件密码:27137组别: 学号:实验题目:二茂铁及衍生物对柴油的助燃和消烟作用【前言】1、实验目的①本实验选择不同的燃油添加剂;利用氧弹量热计测定燃油在不同添加剂存在下的燃烧热,了解和比较不同汽油添加剂对柴油燃烧效率与速率的影响以及添加剂的节能助燃效应。
②学习和掌握甲醛缓冲溶液吸收-盐酸副玫瑰苯胺分光光度法测定SO2气体的浓度以及盐酸萘乙二胺分光光度法测定NO2气体浓度的分析方法以及气相色谱测定方法,并应用于汽油燃烧后尾气成份的测定。
③通过物理化学实验基本技术---量热技术的使用与气体无机污染物的多种分析方法(包括分光光度法和气相色谱法)的学习与应用使学生综合了解汽油添加剂在燃油助燃、消烟节能以及减少汽油尾气排放减少大气污染中所起的作用。
关注社会、关注环境。
2、实验意义本实验用自制的二茂铁作为添加剂,利用氧弹量热计测定燃油在是否有添加剂存在下的燃烧热,了解和比较添加二茂铁对柴油燃烧效率和速率的影响以及二茂铁的节能助燃效应。
同时,学习和掌握甲醛法和盐酸萘乙二胺分光光度法分别测定SO2和NO2气体的浓度,并应用于柴油燃烧后尾气成分的测定。
3、文献综述与总结3.1 1951 年末,Kealy 和Pauson 利用环戊二烯成功地制备出C10H10Fe。
次年,德国的Ficsher 利用X 光衍射技术发现二茂铁化合物具有异常高的化学稳定性。
1956 年Wilkinson 和Woodward 等通过红外光谱、磁化率以及偶极矩等技术手段确定二茂铁具有夹心结构的金属π配位化合物,证实其具有可靠的金属性能。
这些研究成果是20 世纪金属有机化学的重大发现,Ficsher 和Wilkinson 也因此获得1973 年度的诺贝尔化学奖。
是由于其特殊的结构和特别高的稳定性,二茂铁很快就引起了人们的研究兴趣,其合成方法也层出不穷。
20 世纪70年代,德国研发出了电解合成方法,随后又对该方法进行了改进,从而开辟了合成二茂铁的新天地。
黏度法测定水溶性高聚物分子量实验报告(华南师范大学)

实验报告学生姓名学号专业化学(师范)年级班级课程名称物理化学实验实验项目黏度法测定水溶性高聚物分子量实验类型□验证□设计□综合实验时间2020 年11 月21 日指导老师蔡跃鹏实验评分一、实验目的1.测定多糖聚合物-右旋糖苷的平均分子量。
2.掌握用乌式黏度计测定黏度的原理和方法。
二、实验原理高聚物的分子量是表征高聚物特征的基本参数之一,分子量不同,高聚物的性能差异很大。
例如,在临床医学中常用的一种优良的血浆代用品——右旋糖苷,它是一种水溶性的多糖类聚合物,在中等分子量的时候,它能提高血浆渗透压,扩充血容量;在低分子量的时候,它能降低血液黏稠度,改善微循环以及有抗血栓形成的作用;但是,高分子量(一般指相对分子质量大于40万)的右旋糖苷,则会引起红细胞聚集,导致微循环障碍。
可见,测定高聚物的分子量对生产和使用高分子材料具有十分重要的意义。
高聚物分子量大小不一,参差不齐,一般在103~107之间,所以通常所测高聚物的分子量是一种统计的平均分子量。
用于测定高聚物分子量的方法有很多,诸如有黏度法、端基分析、沸点升高、冰点降低、等温蒸馏、超离心沉降及扩散法等,其中,用黏度法测定的分子量称“黏均分子量”记作M̅η。
线型高分子可被溶剂分子分散,在具有足够的动能下相互移动,成为黏度态,η是可溶性的高聚物在稀溶液中的黏度,是它在流动过程中所存在内摩擦的反映,这种摩擦主要有:溶剂分子与溶剂分子之间的内摩擦,也就是纯溶剂的黏度,记作η0;还有高分子与高分子之间的内摩擦以及高分子与溶剂分子之间的内摩擦。
三者总和表现为高聚物溶液的黏度,记作η。
在同一温度下,高聚物的黏度一般都比纯溶剂的黏度大,即η>η0,这些黏度增加的分数叫做增比黏度,记作ηsp,即ηsp=η−η0η0=ηη0−1=ηr−1式中,ηr称为相对黏度,这指明溶液黏度对溶剂黏度的相对值,仍是整个溶液的黏度行为; ηsp则意味着已经扣除了溶剂分子之间的内摩擦效应。
华南师范大学实验报告

华南师范大学实验报告学生姓名林鸿锦学号专业综合理科二班年级、班级07级课程名称生物化学实验实验项目蛋白质等电点测定和沉淀反应实验类型□验证□设计□综合试验时间2008 年 9 月22 日实验指导老师陈文利实验评分一、目的1、了解蛋白质的两性解离性质2、学习测定蛋白质等电点的一种方法3、加深对蛋白质溶液稳定因素的认识4、了解沉淀蛋白质的几种方法及其实用意义二、原理蛋白质是两性电解质。
在蛋白质溶液中存在下列平衡:蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。
当溶液的PH达到一定数值时,蛋白质颗粒上正负电荷的数目相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液的pH值称为此种蛋白质的等电点。
不同蛋白质各有特异的等电点。
在等电点时,蛋白质的理化性质都有变化,可利用此种性质的变化测定各种蛋白质的等电点。
最常用的方法是测其溶解度最低时的溶液pH值。
本实验通过观察不同pH溶液中的溶解度以测定酪蛋白的等电点。
用醋酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制各种不同pH值的缓冲液。
向诸缓冲溶液中加入酪蛋白后,沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点.在水溶液中的蛋白质分子由于表面生成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。
蛋白质的沉淀反应可分为两类。
(1)可逆的沉淀反应:此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,蛋白质的沉淀仍能溶解于原来溶剂中,并保持其天然性质而不变性。
如大多数蛋白质的盐析作用或在低温下用乙醇(或丙酮)短时间作用于蛋白质。
提纯蛋白质时,常利用此类反应。
(2)不可逆沉淀反应:此时蛋白质分子内部结构发生重大改变,蛋白质常变性而沉淀,不再溶于原来溶剂中。
加热引起的蛋白质沉淀与凝固。
蛋白质与重金属离子或某些有机酸的反应都属于此类。
蛋白质变性后,有时由于维持溶液稳定的条件仍然存在(如电荷),并不析出。
因此变性蛋白质并不一定都表现为沉淀,而沉淀的蛋白质也未必都已变性.三、材料、试剂与器具(一)材料新鲜鸡蛋(二)试剂(1)0.4%酪蛋白醋酸钠溶液(2)醋酸溶液(0.01 mol/L、0.10 mol/L、1.00 mol/L)(3)蛋白质溶液——5%卵清蛋白溶液或鸡蛋清的水溶液(新鲜鸡蛋清:水=1:9)(4)pH4.7醋酸—醋酸钠的缓冲溶液(5)3%硝酸银溶液(6)5%三氯乙酸溶液(7)95%乙醇(8)饱和硫酸铵溶液(9)硫酸铵结晶粉末(10) 0.1mol/L盐酸溶液(11) 0.1mol/L氢氧化钠溶液(12) 0.05mol/L碳酸钠溶液(13)甲基红溶液(14)氯化钠固体(三)器具(1)移液管(1mL、2mL、10mL)及洗耳球(2)试管及试管架四、步骤与结果(一)酪蛋白等电点的测定取同样规格的试管4支,编号,按下表顺序分别精确地加入各试剂,混匀。
玻璃制备实验报告

华南师范大学实验报告学生姓名何嘉棋梁涌滨学号20122400078 20122400015专业材料化学年级、班级2012级课程名称无机非金属材料实验实验项目玻璃的制备实验类型验证设计综合实验时间2013 年12 月13日实验指导老师罗穗莲实验评分一.【实验目的】学习实验室条件下制备玻璃材料的基本训练学习玻璃的基本组成和配制二.【实验原理】绿色钠钙硅玻璃配方查资料得,钠钙硅玻璃化学组成范围如下表所示,由书上的钠钙硅玻璃的三元相图,SiO2 Na2O CaO65.8% 14.7% 8.5%,来提高玻璃的化学稳定性、热稳定性、机械强度、硬度和折射率。
加入MgO,范围为3.5%以下,是网络外体氧化物,可以使玻璃的硬化上单变慢,改善玻璃成形性能。
加入BaO,范围为0.5~1.0%,增加玻璃的折射率、密度、光泽和化学稳定性。
加入少量的Fe2O3作为脱色剂,加入少量的Cr2O3作为着色剂。
加完以下的原料之后为: Z=4R=(65.9*2+7.7*3+14.8+8.5+1.8+0.5+0.6*3+0.1*)/65.9=2.64X+Y=Z,X+Y/2=R,算去X 为1.28,Y 为2.72≈3,四面体三个是桥氧。
玻璃应该能连接成三维网络,应该保持较高的强度。
三.【实验药品与仪器】药品:二氧化硅 碳酸钙 碳酸钠 碱式碳酸镁 氧化铝 碳酸钡 氧化铁 碎玻璃仪器:坩埚四.【实验步骤】1、计算个组分原料使用配比。
2、将二氧化硅,碳酸钙,碳酸钠,碱式碳酸镁,氧化铝,碳酸钡,氧化铁,碎玻璃按照配比混合,研磨均匀。
五.【实验现象与分析】实验现象:玻璃内部产生较多裂纹,玻璃颜色为绿色,制备玻璃易碎。
结果分析: 名称SiO2 Al2O3 Na2O CaO MgO BaO Fe2O3 Cr2O3 比例(%)65.9 7.7 14.8 8.5 1.8 0.5 0.6 0.11、玻璃内部裂纹较多,证明在烧制过程中出现了较多的玻璃缺陷部分。
2燃烧热实验报告

华南师范大学实验报告学生姓名学号专业化学(师范) 年级、班级课程名称物理化学实验实验项目燃烧热的测定实验类型:□验证□设计□综合实验时间年月日实验指导老师蔡跃鹏实验评分【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别与联系。
②掌握量热技术的基本原理;学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹卡计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】物质的标准摩尔燃烧热(焓)△cH mθ是指1mol物质在标准压力下完全燃烧所放出的热量。
在恒容条件下测得的1mol物质的燃烧热称为恒容摩尔燃烧热Q V,m,数值上等于这个燃烧反应过程的热力学能的变化△rU m;恒压条件下测得的1mol物质的燃烧热称为恒压摩尔燃烧热Q p,m,数值上等于这个燃烧反应过程的摩尔焓变△rH m,化学反应热效应通常是用恒压热效应△rH m来表示。
若参加燃烧反应的是标准压力下的1mol物质,则恒压热效应△rH mθ即为该有机物的标准摩尔燃烧热△cH mθ。
若把参加反应的气体与生成的气体作为理想气体处理,则存在下列关系式。
Q p,m=Q V,m+(∑V B)RT (3-4) 式中,∑V B为生成物中气体物质的计量系数减去反应物中气体物质的计量系数;R为气体常数;T为反应的绝对温度;Q p,m与Q V,m的量纲为J/mol。
本实验所用测量仪器为氧弹量热计(也称氧弹卡计),按照结构及其与环境之间的关系,氧弹量热计通常分为绝热式和外槽恒温式,本实验所用为外槽恒温式量热计。
氧弹为高度抛光的刚性容器,耐高压、耐高温、耐腐蚀,密封性好,是典型的恒容容器。
测定粉末样品时需压成片状,一面充氧时冲散样品或燃烧时飞散开来。
量热反应测量的基本原理是能量守恒定律。
在盛有定量水的容器中,样品的物质的量为n mol,放入密闭氧弹,充氧,然后使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶、氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,及量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为Q V,m= -C(T2-T1)(3-5) n式中,Q V,m为样品的恒容摩尔燃烧热,J/mol;n为样品的物质的量,mol;C为仪器的总热容,J/K或J/℃。
物化实验报告燃烧热的测定

华南师范大学实验报告一、实验目的1、明确燃烧热的定义,了解定压燃烧热与定容燃烧热的差别。
2、掌握量热技术的基本原理;学会测定萘的燃烧热3、了解氧弹量热计的主要组成及作用,掌握氧弹量热计的操作技术。
4、学会雷诺图解法校正温度改变值。
二、 实验原理通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。
一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值T ∆,就能计算出该样品的燃烧热。
()p V Q Q RT n g =+∆ (1)()V W W Q Q C W C M+=+样品21总铁丝铁丝水水(T -T ) (2)用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T ∆。
便可据上式求出K ,再用求得的K 值作为已知数求出待测物(萘)的燃烧热。
三、仪器和试剂 1.仪器SHR-15氧弹量热计1台;贝克曼温度计;压片机 2台;充氧器1台;氧气钢瓶1个;1/10℃温度计;万能电表一个;天平 2.试剂铁丝;苯甲酸(AR);萘(AR );氧气四、实验步骤1、测定氧氮卡计和水的总热容量(1)样品压片:压片前先检查压片用钢模,若发现钢模有铁锈油污或尘土等,必须擦净后,才能进行压片,用天平称取约0.8g 苯甲酸,再用分析天平准确称取一根铁丝质量,从模具的上面倒入己称好的苯甲酸样品,徐徐旋紧压片机的螺杆,直到将样品压成片状为止。
抽出模底的托板,再继续向下压,使模底和样品一起脱落,然后在分析天平上准确称重。
分别准确称量记录好数据,即可供燃烧热测定用。
(2)装置氧弹、充氧气:拧开氧弹盖,将氧弹内壁擦净,特别是电极下端的不锈钢接线柱更应擦十净,将点火丝的两端分别绑紧在氧弹中的两根电极上,选紧氧弹盖,用万用表欧姆档检查两电极是否通路,使用高压钢瓶时必须严格遵守操作规则。
将氧弹放在充氧仪台架上,拉动板乎充入氧气。
1凝固点降低实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B = ×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3)若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
霍尔效应测量螺线管磁场实验报告

华南师范大学实验报告学生姓名学号专业化学年级、班级课程名称物理实验实验项目用霍尔效应测量螺线管磁场实验类型□佥证□殳计□综合实验时间2012年3月07实验指导老师实验评分一、实验目的1 了解霍尔效应现象掌握其测量磁场的原理。
2学会用霍尔效应测量长直通电螺线管轴向磁场分布的方法。
二、实验原理根据电磁学毕奥萨伐尔定律通电长直螺线管线上中心点的磁感应强度为:22MDLINB中心1理论计算可得长直螺线管轴线上两个端面上的磁感应强度为内腔中部磁感应强度的1/2 22MDLIN21B21B 中心端面2式中为磁介质的磁导率真空中的磁导率卩04nX-7T m/AN为螺线管的总匝数IM为螺线管的励磁电流L为螺线管的长度D为螺线管的平均直径。
三、实验仪器1FB510型霍尔效应实验仪2FB510型霍尔效应组合实验仪螺线管四、实验内容和步骤1.把FB510型霍尔效应实验仪与FB510型霍尔效应组合实验仪螺线管正确连接。
把励磁电流接到螺线管IM输入端。
把测量探头调节到螺线管轴线中心即刻度尺读数为13.0cm处调节恒流源2使ls4.00mA按下VH/Vs即测VH依次调节励磁电流为IM0±500mA每次改变±50mA依此测量相应的霍尔电压并通过作图证明霍尔电势差与螺线管内磁感应强度成正比。
2.放置测量探头于螺线管轴线中心即13.0cm刻度处固定励磁电流±500mA调节霍尔工作电流为Is0 ±.00mA每次改变±0.50mA 测量对应的霍尔电压VH 通过作图证明霍尔电势差与霍尔电流成正比。
3. 调节励磁电流为500mA 调节霍尔电流为4.00mA 测量螺线管轴线上刻度为X0.0cm13.0cm 每次移动1cm 测各位置对应的霍尔电势差。
注意根据仪器设计这时候对应的二维尺水平移动刻度读数为13.0cm 处为螺线管轴线中心0.0cm 处为螺线管轴线的端面找出霍尔电势差为螺线管中央一半的数值的刻度位置。
燃烧热的测定(华南师范大学物化实验)

华南师范大学实验报告燃烧热的测定一、实验目的(1)明确燃烧热的定义,了解恒压燃烧热与恒容燃烧烧热的差别与联系。
(2)测定萘的燃烧热,掌握量热技术基本原理。
(3)了解氧弹卡计的基本原理,掌握氧弹卡计的基本实验技术。
(4)使用雷诺校正法对温度进行校正。
二、实验原理2.1基本概念1mol物质在标准压力下完全燃烧所放出的热量,即为物质的标准摩尔燃烧焓,用表示。
若在恒容条件下,所测得的1mol物质的燃烧热则称为恒容摩表示,此时该数值亦等于这个燃烧反应过程的热力学能变尔燃烧热,用Q V,mΔr U m。
同理,在恒压条件下可得到恒压燃烧热,用Q p,m表示,此时该数值亦等于这个燃烧反应过程的摩尔焓变Δr H m。
化学反应的热效应通常用恒压热效应Δr H m来表示。
假若1mol物质在标准压力下参加燃烧反应,恒压热效应即为该有机物的标准摩尔燃烧热。
把燃烧反应中涉及的气体看做是理想气体,遵循以下关系式:Q p,m=Q V,m+(ΣV B)RT ①2.2氧弹量热计本实验采用外槽恒温式量热计,为高度抛光刚性容器,耐高压,密封性好。
量热计的内筒,包括其内部的水、氧弹及其搅拌棒等近似构成一个绝热体系。
为了尽可能将热量全部传递给体系,而不与内筒以外的部分发生热交换,量热计在设计上采取了一系列措施。
为了减少热传导,在量热计外面设置一个套壳。
内筒与外筒空气层绝热,并且设置了挡板以减少空气对流。
量热计壁高度抛光,以减少热辐射。
为了保证样品在氧弹内燃烧完全,必须往氧弹中充入高压氧气,这就要求要把粉末状样品压成片状,以免充气时或燃烧时冲散样品。
2.3量热反应测量的基本原理量热反应测量的基本原理是能量守恒定律。
通过数字式贝克曼温度计测量出燃烧反应前后的温度该表ΔT,若已知量热计的热容C,则总共产生的热量即为Q V=CΔT。
那么,此样品的摩尔恒容燃烧热为②式是最理想的情况。
但由能量守恒原理可知,此热量Q V的来源包括样品燃烧放热和点火丝放热两部分。
华师物化实验-溶胶的制备、纯化

华南师范大学实验报告姓名:dxh 学号:专业:化学师范班级:11化教6班课程名称:物理化学实验实验项目:溶胶的制备及纯化合作者:实验日期:2014年4月9日指导教师:孙艳辉实验分数:一、前言1、实验背景胶体溶液是一个多相体系,分散在介质中的微粒由于自身的电离或表面吸附其他粒子而形成带一定电荷的胶粒,分散相胶粒和分散相介质带有数量相等而符号相反的电荷,因此在相截面上建立了双电层结构。
当胶体相对静止时,整个溶液呈电中性。
但在外电场的作用下,胶体中的胶粒和分散介质反向相对移动时,就会产生电位差,此电位差称为ζ电势。
ζ电势是表征胶粒特性的重要物理量之一,在研究胶体性质及实际应用中有着重要的作用。
它随吸附层内离子浓度,电荷性质的变化而变化.它与胶体的稳定性有关, ζ绝对值越大,表明胶粒电荷越多, 胶粒间斥力越大,胶体越稳定。
2、实验要求(1)了解制备胶体的不同方法,学会制备Fe(OH)3溶胶。
(2)实验观察胶体的电泳现象,掌握电泳法测定胶体电动电势的技术。
二、实验部分1、基本原理胶体现象无论在工农业生产中还是在日常生活中,都是常见的问题。
为了了解胶体现象,进而掌握其变化规律,进行胶体的制备及性质研究实验很有必要。
⑴溶胶的制备溶胶的制备方法可分为分散法和凝聚法。
分散法是用适当方法把较大的物质颗粒变为胶体大小的质点,如机械法,电弧法,超声波法,胶溶法等;凝聚法是先制成难溶物的分子(或离子)的过饱和溶液,再使之相互结合成胶体粒子而得到溶胶,如物质蒸汽凝结法、变换分散介质法、化学反应法等。
Fe(OH)3溶胶的制备就是采用化学反应法使生成物呈过饱和状态,然后粒子再结合成溶胶。
⑵溶胶的纯化制成的Fe(OH)3溶胶溶液中常有其它杂质存在,而影响其稳定性,而且制得的Fe(OH)3水溶胶冷却时,反应要逆向进行,因此必须纯化。
常用的纯化方法是半透膜渗析法。
渗析时以半透膜隔开胶体溶液和纯溶剂,胶体溶液中的杂质,如电解质及小分子能透过半透膜,进入溶剂中,而大部分胶粒却不透过. 如果不断换溶剂,则可把胶体中的杂质除去. 要提高渗析速度,可用热渗析或电渗析的方法。
华师物化实验报告 凝固点的测定测定

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 年级、班级课程名称 实验项目 凝固点降低法测定物质的相对分子质量 实验类型 □验证 □设计 ■综合 实验时间 年 月 日 实验指导老师 实验评分一、实验目的:1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、测定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用。
二、实验原理:物质的相对分子质量是了解物质的一个最基本而且重要的物理化学数据,其测定方法有多种。
凝固点降低法成的物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要的意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度f T 比纯溶剂的凝固点*f T 下降,其降低值f f T T T -=∆*f 与溶液的质量摩尔浓度成正比,即f T ∆=m K f式中,f T ∆为凝固点降低值;m 为溶质质量摩尔浓度;f K 为凝固点降低常数,它与溶剂的特性有关。
表1 几种溶剂的凝固点降低常数值若称取一定量的溶质B W (g)和溶剂A W (g ),配成稀溶液,则此溶液的质量摩尔浓度B m 为3AB BB 10W M W m ⨯=mol/kg式中,B M 为溶质的相对分子质量。
则3Af Bf B 10W T W K M ⨯∆=g/mol若已知某溶剂的凝固点降低常数f K 值,通过实验测定此溶液的凝固点降低值f T ∆,即可计M。
算溶质的相对分子量B通常测凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
纯溶剂步冷曲线:纯溶剂逐步冷却时,体系温度随时间均匀下降,到某一温度时有固体析出,由于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平衡,当放热与散热达到平衡时,温度不再改变。
细胞质流动及其影响因素液泡系的活体染色

华南师范大学实验报告学生姓名何茂辉学号20062501302专业生物科学年级、班级06科三课程名称细胞生物学实验实验项目实验类型□验证□设计□综合实验时间09 年 6 月 2 日实验指导老师尤蓉、周仁超实验评分细胞质流动及其影响因素液泡系的活体染色实验目的:1.观察植物细胞质流动现象,了解影响细胞质流动的因素。
2.掌握细胞活体染色的原理和技术。
实验原理:1.细胞质流动现象的产生,是细胞骨架中微丝肌动蛋白与肌球蛋白相互滑动的结果。
2.细胞质流动要消耗能量,受各种因素诸如温度、渗透压及各种离子的影响。
3.液泡是细胞内浓缩产物的主要场所,具有重要的功能。
中性红是液泡的特殊染色剂,只将液泡染成红色。
对于活细胞,细胞质和细胞核不会被染色。
实验步骤:细胞质流动及其影响因素1.载玻片,滴1~2滴蒸馏水2.紫鸭趾草雄蕊花丝(黑藻嫩叶)装片3.观察细胞质流动4.吸水纸吸干水,加试剂,记录细胞质停止流动的时间5.吸水纸吸干,加清水,观察流动是否能恢复植物液泡系的活体染色1.取一干净载玻片,滴一滴1/3000中性红染液2.用刀片将初生的黄豆根尖切一纵薄片,置染液中,染8min3.用吸管吸Ringer液或蒸馏水滴在染液周围,使染液冲淡,吸去再换水使染液近无色4.用盖玻片盖在样品上,吸去多余水份,观察结果与分析:细胞质流动及其影响因素结果思考题:1. 如何理解细胞质流动原理?细胞质流动原理是细胞骨架中微丝肌动蛋白与肌球蛋白相互滑动的结果。
2. 胞质环流有何特点? 为什么?特点:细胞质成薄层沿着细胞膜以一定的速度和方向循环流动原因:大液泡在细胞的中央,而细胞质只是贴壁的一层,因此细胞质只能沿着细胞膜循环流动3.黄豆根尖经中性红超活染色,为什么看到生长点的细胞中液泡多,而且染色深,延长区细胞中液泡数量变少,染色浅因为生长点的细胞分裂旺盛,没有分化,含有较多且少的液泡。
而延长区得细胞已经分化,细胞内一般只含有一个大液泡。
华南师范大学实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 林 鸿 锦 学 号 专 业 综合理科二班 年级、班级 07级 课程名称 生物化学实验 实验项目 脂肪酸的β—氧化 实验类型 □验证 □设计 □综合 试验时间 2008 年 11 月 17 日 实验指导老师 陈 文 利 实验评分一、目的通过测定和计算反应液内丁酸氧化生成丙酮的量,掌握测定β-氧化作用的方法及其原理。
二、原理在肝脏内脂肪酸经β-氧化生成乙酰辅酶A ,两分子乙酰辅酶A 缩合成乙酰乙酸。
乙酰乙酸可脱羧生成丙酮,也可还原生成β-羟丁酸。
乙酰乙酸、β-羟丁酸和丙酮总称为酮体。
本实验用新鲜肝糜与丁酸保温,生成的丙酮可用碘仿反应测定。
在碱性条件下,丙酮与碘生成碘仿。
反应式如下:COCH CH O H CO COOH COCH CH H 2COOH CHOHCH CH HOH CHCOOH CH CH 2H -COOH CH CH CH 332223233223丙酮脱羧丁酸↓+→−−→−-−−−→−=−−→−剩余的碘可用标准Na 2S 2O 3滴定:根据滴定样品与滴定对照所消耗的硫代硫酸钠溶液体积之差,可以计算由丁酸氧化生成丙酮的量。
三、材料、试剂和仪器(一)材料新鲜兔肝(二)试剂1、0.1%淀粉溶液(溶于饱和NaCl)2、0.5mol/L丁酸溶液3、20%三氯乙酸溶液4、10%氢氧化钠溶液5、10%盐酸6、0.1mol/L碘溶液7、标准0.02mol/L硫代硫酸钠溶液8、1/15mol/L,pH7.6磷酸盐缓冲液(三)器具1、漏斗2、碘量瓶3、试管及试管架4、移液管(5mL,10mL)5、碱性滴定管6、恒温水浴锅四、实验过程(一)肝匀浆的制备实验室已准备好新鲜的兔肝匀浆以及煮沸过的兔肝匀浆。
(二)酮体的生成取大试管两支,分别编号,按下表操作。
(单位:mL)现象及分析溶液呈乳白色,沉淀不明显(煮沸的时候蛋白质已变性)有大量暗褐色沉淀(与三氯乙酸反应,蛋白质变性)分别过滤,收集滤液,得无蛋白溶液。
综合化学实验实验一_华南师范大学实验报告

华南师范大学实验报告姓名:组员:课件密码:30620学号:实验题目:二茂铁的绿色合成组别: 第四组实验时间:2014.03.20 【前言】1、实验目的①了解一些易对环境造成污染的化合物的绿色合成方法,力求把对环境的影响降到最低限度,培养学生在从事科研与生产活动中绿色、环保理念。
②掌握用微型合成装置合成、提纯二茂铁的操作技术。
③学会通过熔点的测定、红外光谱等手段来分析鉴定二茂铁。
2、文献综述与总结二茂铁(FcH)又名双环戊二烯基铁,学名二环戊二烯基铁,属于金属有机化合物,它是由两个环戊二烯基阴离子和一个二价铁阳离子组成的具有夹心形状的化合物(见图),其分子式为(C5H5)2Fe。
二茂铁易溶于甲醇、乙醇、乙醚、石油醚、汽油、二氯甲烷、苯等常用有机溶剂,溶于浓硫酸,在沸腾的烧碱和盐酸溶液中不溶解、不分解;二茂铁具有高度热稳定性、化学稳定性和耐辐射性;二茂铁具有芳香性,100℃以上能升华,不容易发生加成反应,易发生取代反应;此外二茂铁还有低毒性,在溶液中两个环可以自由旋转等特点。
正是基于二茂铁的这种稳定性、芳香性、低毒、亲油性、富电性、氧化还原性和易取代等特点,使得自二茂铁出现以来就引起了广大科研工作者极大的兴趣,对于二茂铁及其衍生物的合成、结构及性质和应用的研究一直以来都是大家所关注的热点。
二茂铁的出现极大的推动了金属有机化学的发展,被认为是近代化学发展的里程碑。
2.1二茂铁的发现1951 年Kealy 及Pauson 利用格氏试剂C5H5MgBr和催化剂FeCl3合成富瓦烯没有成功,但是却意外地得到了一种黄色的晶体,经过一些简单的研究他们得出该物质的分子式为C10H10Fe,并且初步得出该物质的一些物性,如他们测出该物质的熔点172.5~173℃,沸点249℃,不溶于水、10%NaOH 和热的浓盐酸,但易溶于稀硝酸,浓硫酸及二氯甲烷、苯、乙醚、石油谜、甲醇和乙醇等一些常用有机溶剂,比较稳定。
几乎同时Miller 等人用环戊二烯和铁在300℃及常压下也制得了该物质。
华师物化实验报告原电池电动势的测定及热力学函数的测定

华师物化实验报告原电池电动势的测定及热力学函数的测定华南师范大学实验报告学生姓名学号专业年级、班级课程名称物理化学实验实验项目原电池电动势的测定与应用实验类型□验证□设计■综合实验时间年月日实验指导老师实验评分[实验目的]1、掌握电位差计的测定原理和原电池电动势的测定方法。
2、加深对可逆电极、可逆电池、盐桥等概念的理解。
3、测定电池在不同的温度下的电动势,计算电池反应的热力学函数△G、△H和△S。
[实验原理]1、对消法测定原电池电动势(1)电池的电动势不能直接用伏特计来测量,因为电池与伏特计相接后,便成了通路,有电流通过,发生化学变化、电极被极化、溶液浓度改变、电池电势不能保持稳定。
且电池本身有内阻,伏特计所量得的电位降不等于电池的电动势。
利用对消法(又叫补偿法)可是我们在电池无电流(或极小电流)通过时,测得其二级的静态电势,这时的电位降即为该电池的平衡电势,此时电池反应是在接近可逆条件下进行的。
因此,对消法测电池电势的过程是一个趋近可逆过程的例子。
(2)电池电动势测定原理:Hg | Hg2Cl2(s) | KCl(饱和) | | AgNO3 (0.02 mol/L) | Ag根据电极电位的能斯特公式,正极银电极的电极电位:其中=0.799-0.00097(t-25)负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式:φ饱和甘汞= 0.2415 - 0.00065(t–25)而电池电动势E=φ+-φ-;可以算出该电池电动势的理论值。
与测定值比较即可。
2、电动势法测定化学反应的△G、△H和△S如果原电池内进行的化学反应是可逆的,且电池在可逆条件下工作,则此电池反应在定温定压下的吉布斯函数变化△G和电池的电动势E有以下关系式:△G=-nFE从热力学可知:△S=-nF(E1-E2)/(T1-T2)△H=-nFE+△S[仪器与试剂](1)实验仪器SDC数字电位差计 1台饱和甘汞电极 1支银电极 1支 20mL小烧杯 2个超级恒温槽 1台 250mL 烧杯 1个U 形管 1个(2)实验试剂0.1mol/L AgNO3溶液饱和氯化钾溶液硝酸钾琼脂去离子水[实验步骤]1、制备盐桥3%琼脂-饱和硝酸钾盐桥的制备方法:在 250mL 烧杯中,加入 100mL 蒸馏水和3g琼脂,盖上表面皿,放在石棉网上用小火加热至近沸,继续加热至琼脂完全溶解。
分析实验报告 高效液相色谱

华南师范大学实验报告学生姓名:杨秀琼学号:20082401129专业:化学年级班级:08化二课程名称:仪器分析实验实验项目:液相色谱分析混合样品中的苯和甲苯实验类型:综合实验时间:2010/416一、[实验目的:]1、掌握高效液相色谱定性和定量分析的原理及方法2、了解高效液相色谱的构造、原理及操作技术二、[实验原理:]高效液相色谱法:以液体作为流动相的色谱法。
它是在经典液相色谱实验基础上,引入气相色谱的理论,在技术上采用高压输液泵,高效固定相和高灵敏的检测器,而发展起来的快速分离分析技术。
具有分离效能高,检出限低,操作自动化和应用范围广的特点。
其基本原理:利用欲分配的诸组分在固定相和流动相间的分配有差异(即由不同的分配系数),当两相做相对运动时,这些组分在此两相中分配反复进行,从几千次到百万次,即使组分的分配系数只有微小差异,随着液体流动相却可以有明显的差异,最后使这些组分都得到分离,通过检测器时,样品浓度被转换成电信号传送到记录仪。
三、[仪器和试剂:]1.主要仪器:岛津液相色谱仪(LC-10AT)[配有紫外检测PhenomenexO柱];10μL微量注射器2、试剂:甲醇、水苯和甲苯混合待测溶液苯标准溶液:2.0μL/mL甲苯标准溶液:2.0μL/mL苯、甲苯混合标准溶液:1.0μL/mL、2.0μL/mL、5.0μL/mL、10.0μL/mL 四、[实验步骤]1、按操作规程开机。
2、.选择合适的流动相配比,优化色谱条件通过调节溶剂甲醇和水的混合比例,从而来优化色谱调剂。
调好最佳色谱条件,控制流速为1ml/min 。
柱温30℃,检测波长354nm 3、苯、甲苯定性分析在最佳条件下,待基线走稳后,用10μL 微量注射器分别进样10μL 苯和 甲 苯混合待测溶液,10μL 苯标准溶液(2.0μL/mL)和10μL 甲苯标准溶液(2.0μL/mL)(微量注射器用甲醇润洗3~5遍),观察并记录色谱图上显示的保留时间,确定苯和甲苯的峰。
液相反应平衡常数的测定(华南师范大学物化实验)
七、实验评注与拓展
由于 Fe3++SCN-在水溶液中存在水解平衡,所以 Fe3+与 SCN-的实际反应很复 杂,其机理为
k1
Fe3 SCN FeSCN 2 k1 K2
Fe3 H 2O FeOH 2 H (快)
k3
FeOH 2 SCN FeOHSCN k3 K4
FeOHSCN H FeSCN 2 H 2O(快)
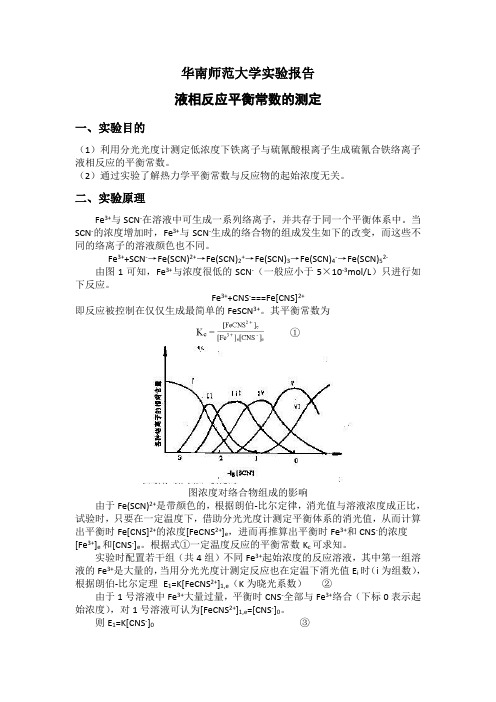
的 SCN-(一般应小于 5×10-3mol/L)只进行 Fe3++CNS-===Fe[CNS]2+的反应,但当
Fe3+、SCN-浓度较大时,就不只是生成一配位的络离子,[FeCNS2+]1,e≠[CNS-],则 E1≠K[CNS-]0 故不能用式④计算。 (2)平衡常数与反应物起始浓度有无关系
平衡常数是与温度有关的常数,与反应物起始浓度并无关系。 (3)测定 Kc 时,为什么要控制酸度和离子强度
1 2×10-3 1×10-4
4
×10-5 mol/L ×10-3 mol/L ×10-4 mol/L
Kc
六、实验结果分析
本次实验测得三个样品溶液的平衡常数分别为、、,可见编号为 3、4 的样品 液所得的数据较为接近,而编号 2 的样品相差较大。在条件许可的情况下,应进 行二次实验以获取较为准确的数据。根据化学数据手册,在 298K 温度下,Fe3+ 与 SCN-反应的平衡常数为 140。本次实验值与其相比较,相对误差高达%。
当达到平衡时,整理得到 [FeSCN 2 ]平 [Fe3 ]平[SCN ]平
=
k1
K2k3 [H ]平
k 1
k 3 K 4[H ]平
= K平
由上式可见,平衡常数受氢离子的影响。因此,实验只能在同一 pH 值下进 行。本实验为离子平衡反应,离子强度必然对平衡常数有很大影响。所以,在各
稀溶液法测定偶极矩实验报告(华南师范大学)

实验报告学生姓名学号专业化学(师范)年级班级课程名称结构化学实验实验项目稀溶液法测定偶极矩实验类型 验证 设计 综合实验时间2020 年10 月19 日指导老师彭彬实验评分【实验目的】1. 掌握溶液法测定偶极矩的主要实验技术2. 了解偶极矩与分子电性质的关系3. 测定乙酸乙酯的偶极矩【实验原理】1.偶极矩与极化度分子结构可以近似地看成是由电子云和分子骨架(原子核及内层电子)所构成。
由于空间构型的不同,其正负电荷中心可能重合,也可能不重合。
前者称为非极性分子,后者称为极性分子。
1912年德拜提出“偶极矩”的概念来度量分子极性的大小,其定义式是μ⃑=qd式中,q是正负电荷中心所带的电量;d为正负电荷中心之间的距离;μ⃑是一个矢量,其方向规定为从正到负。
因分子中原子间的距离的数量级10−10m,电荷的数量级为10−20C,所以偶极矩的数量级是10−20C∙m。
通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来鉴别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩指向某个方向的机会均等。
所以偶极矩的统计值等于零。
若将极性分子置于均匀的电场E中,则偶极矩在电场的作用下,趋向电场方向排列。
这时称这些分子被极化了。
极化的程度可以用摩尔转向极化度Pμ来衡量。
Pμ与永久偶极矩μ的平方成正比,与绝对温度T成反比。
Pμ=4πN Aμ2 9kT式中,k为玻兹曼常数;N A为阿伏加德罗常数;T为热力学温度;μ为分子的永久偶极矩。
在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架的相对移动,分子骨架也会发生形变。
这称为诱导极化或变形极化。
用摩尔诱导极化度P诱导来衡量。
显然,P诱导可分为两项,即电子极化度P e和原子极化度P a,因此P诱导=P e+P a如果外电场是交变场,极性分子的极化情况则与交变场的频率有关。
当处于频率小于1010Hz的低频电场或静电场中,极性分子所产生的摩尔极化度P是转向极化、电子极化和原子极化的总和。
