抗癌新药最新大全
新型抗癌药能治25种癌症!

国内有望上市⼀半患者肿瘤缩⼩!国内有望上市新型抗癌药能治25种癌症!⼀半患者肿瘤缩⼩!去年,全球第三款不限癌种的抗癌药恩曲替尼重磅上市,再次引起了巨⼤的轰动!与⾸款上市的NTRK抑制剂拉罗替尼不同,恩曲替尼针对的靶点和癌症更多,不仅对NTRK1 / 2/3融合的患者有“特效”,同时对ROS1和ALK基因的融合和改变的癌症也能发挥巨⼤的抗癌功效,并且还有超强的⼊脑效果,这意味着,对⼤部分药物都束⼿⽆策的脑转移,这款药物也能完美应对。
此外,这款药物之前公布的数据显⽰,对于存在NTRK融合的⼉童患者,有效率能够⾼达100%,这是史⽆前例的。
可以说,这是⼀款药物是不分年龄,不分癌种,有效率超⾼的抗癌“神药”。
官⽅数据:有效率57%!长效缓解在官⽹公布的TRK融合癌患者的三项⼤型临床试验汇总数据显⽰,恩曲替尼的总缓解率ORR为57%,其中7.4%的患者完全缓解(肿瘤全部消退)。
并且对于特定的⼈群,恩曲替尼的有效率能达到100%,⽐如在研究中4例TPR-NTRK1融合的患者,肿瘤全部缩⼩。
续缓解时间从2.8个⽉~26个⽉不等。
研究证实:对多种癌症有效⽬前已发现NTRK融合存在于超过25类癌症中,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,成⼈和⼉童患者都可以使⽤。
◀肺癌▶关于ROS1阳性⾮⼩细胞肺癌的汇总分析包括来⾃Ⅱ期STARTRK-2,Ⅰ期STARTRK-1和Ⅰ期ALKA-372-001的数据,招募了15个国家/地区和150个临床试验地点的患者,这些患者都是局部晚期或转移性ROS1融合的⾮⼩细胞肺癌患者,在可评估的53名患者中,结果显⽰:有77%(41例)的患者在数据截⽌时达到了缓解(ORR),其中包括3名(6%)完全缓解(CR),38名(72%)部分缓解( PRs),以及1名(2%)病情稳定的患者。
中位⽆进展⽣存时间(PFS)为19.0个⽉。
%!其中20%的患者完全缓解!值得⼀提的是,这些患者包括23名未治疗和治疗的伴有脑转移患者,反应率为55%!治疗前治疗两个周期后◀消化道肿瘤▶在2020年最新举⾏的额ESMO⼤会上,专门采集了entrectinib 在ALKA-372-001和STARTRK-1,STARTRK-2研究中NTRK融合阳性的胃肠道恶性肿瘤患者数据。
阿扎胞苷等17种抗癌药名单
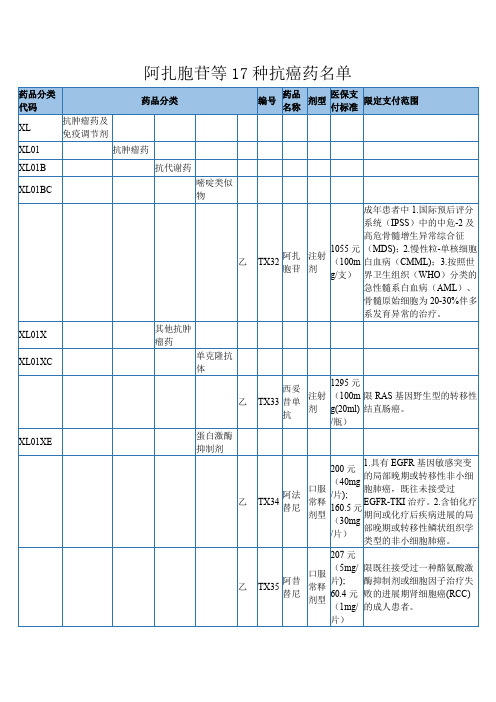
药品分类 代码
抗肿瘤药及 XL
免疫调节剂
药品分类
药品
医保支
编号
剂型
限定支付范围
名称
付标准
XL01
抗肿瘤药
XL01B
抗代谢药
XL01BC
XL01X XL01XC XL01XE
嘧啶类似 物
乙
其他抗肿 瘤药
单克隆抗 体
乙 蛋白激酶 抑制剂
乙
乙
成年患者中 1.国际预后评分
系统(IPSS)中的中危-2 及
色素瘤。
1.既往至少接受过一种治疗 伊布 口服 189 元 的套细胞淋巴瘤(MCL)患 TX45 替尼 常释 (140m 者的治疗;2.慢性淋巴细胞白
剂型 g/粒) 血病/小淋巴细胞淋巴瘤 (CLL/SLL)患者的治疗。
4933 元
(4mg/
粒); 1.每 2 个疗程需提供治疗有
3957.9 效的证据后方可继续支付;2.
/瓶)
200 元 1.具有 EGFR 基因敏感突变
的局部晚期或转移性非小细
口服 (40mg 胞肺癌,既往未接受过
阿法 TX34 替尼
常释 剂型
/片); 160.5
元 EGFR-TKI 治疗。2.含铂化疗 期间或化疗后疾病进展的局
(30mg 部晚期或转移性鳞状组织学
/片) 类型的非小细胞肺癌。
207 元
/片)
细胞肺癌成人患者。
口服
260 元 (250m
限间变性淋巴瘤激酶(ALK) 阳性的局部晚期或转移性非
乙
克唑 TX38 替尼
常释 剂型
g/粒); 219.2
元
小细胞肺癌患者或 ROS1 性的晚期非小细胞肺癌患
近年上市的部分靶向抗癌新药及其作用机制概况

近年上市的部分靶向抗癌新药及其作用机制概况随着生物学、基因组学等领域的逐步发展,靶向抗癌新药的研究和开发取得了重大突破。
这些新药针对癌细胞的特定分子靶点,具有更加精准、有效、可靠的治疗效果。
本文将从临床应用方面,为大家介绍近年上市的部分靶向抗癌新药及其作用机制。
1. PD-1/PD-L1抑制剂PD-1(程序性死亡受体1)和PD-L1(程序性死亡配体1)是肿瘤细胞表面的抑制性蛋白,可以阻止免疫细胞攻击肿瘤细胞。
PD-1/PD-L1抑制剂可以抑制PD-1或PD-L1的作用,释放出免疫系统对癌细胞的攻击力。
目前上市的PD-1/PD-L1抑制剂包括Keytruda(佩德格里治)和Opdivo(奥赛替尼)等。
2. EGFR抑制剂EGFR(表皮生长因子受体)是一种受体酪氨酸激酶,广泛存在于各种癌细胞中。
EGFR 抑制剂可以抑制EGFR的活性,阻止癌细胞生长和分裂。
目前上市的EGFR抑制剂包括Tarceva(他曾达)和Iressa(依达拉奉)等。
3. BCR-ABL抑制剂BCR-ABL是一种融合蛋白,广泛存在于慢性髓系白血病(CML)中。
BCR-ABL抑制剂可以抑制BCR-ABL的活性,阻止癌细胞生长和分裂。
目前上市的BCR-ABL抑制剂包括Gleevec (格列卫)和Sprycel(寰极)等。
PARP(聚合酶1)是一种参与DNA修复的酶,广泛存在于各种癌细胞中。
PARP抑制剂可以抑制PARP的活性,通过干扰DNA修复途径,诱导肿瘤细胞自我灭亡。
目前上市的PARP 抑制剂包括Lynparza(乐博维)和Zejula(泽菊立)等。
总之,靶向抗癌新药的研究和开发对于提高肿瘤治疗效果、降低不良反应、改善患者生存质量具有重要意义。
随着技术的进步,相信将会有越来越多的新药问世,为治愈癌症贡献力量。
最新抗癌药替拉扎明详细介绍

一类新药—替拉扎明项目简介一、概况据世界卫生组织(WHO)统计,全球平均每年死于恶性肿瘤者达690万人,新发病为870万例,且这一数字还在逐年增加。
全世界每年新确诊肿瘤疾病患者达到1000万人,预计到2020年,全世界每年将新发生2000万例肿瘤,其中1400万例在亚洲、非洲和拉丁美洲的发展中国家。
据我国卫生部统计,目前我国每年有106万左右的恶性肿瘤新生患者,同时有106.7万左右的良性肿瘤患者,两者合计约有212.7万,即肿瘤的全国发病率约在1.65‰左右。
每年,我国因肿瘤死亡人数约有154万人左右,癌症(肿瘤)成为继心脑血管疾病后的我国第二大疾病。
缺氧是诱导肿瘤血管生成的一个非常重要的因素,在目前国内外均有大量的实验和临床研究证实了这一点。
缺氧对促进肿瘤血管生成的调节主要是通过在分子水平上,缺氧对促进肿瘤血管生成的细胞因子转导的调节而实现的。
与缺氧有关的促进肿瘤血管生成的细胞因子有如下几种。
1、HIF-1(缺氧诱导因子-1),2、VEGF(血管内皮生长因子)以及血管内皮生长因子的两个受体(flt-1,KDR/flk-1),3、bFGF(碱性成纤维细胞生长因子),4、IGF(胰岛素样生长因子)及其主要受体IGF-IR,5、MMP(基质金属蛋白酶)。
目前,临床上对肿瘤的治疗仍以手术和放、化疗为主,但由于在实体瘤中存在着10%~50%的乏氧细胞,这些乏氧细胞对射线及化疗药物的耐受性比有氧细胞强2.5~3倍。
因而,在常规放(化)疗剂量治疗时,乏氧细胞不能被有效杀死,于是埋下了癌症复发祸根。
要想杀灭肿瘤乏氧细胞,只有加大放(化)疗剂量,然而,这又给患者带来难以承受的毒副反应和痛苦。
总之,乏氧细胞是肿瘤难治愈、易复发和转移的重要因素之一。
二、项目优势替拉扎明(tirapazamine,TPZ)化学名称:3-氨基-1,2,4苯并三唑-1,4-二氮-氧化物(3-Amino-1,2,4-benzotuiazine-1,4-dioxide)又名Win59075或SR4233,是一种新型的生物还原活性物。
中国十大癌症特效药

中国十大癌症特效药癌症,作为目前威胁人类生命和健康的头号杀手,正愈来愈收到社会各界的关注,人们对于癌症的检测和抗癌的进程也不断取得各种突破。
抗癌是一个漫长而艰辛的过程,而治疗癌症更需要根据体检的病理类型和分区来决定相应的治疗方法。
针对药物治疗,目前中国主要的十大抗癌特效药分别有以下几种:1、奥沙利铂(Oxaliplatin)由瑞士Debiopharm公司研究开发,法国Sanofi公司生产销售,1999年10月在法国率先上市,随后在欧洲、南美等地上市。
我国于1999年批准进口奥沙利铂注射剂。
此品对大肠癌、非小细胞肺癌、卵巢癌等多种动物和人类肿瘤细胞株均有显着的抑制作用。
2、紫杉醇(Paclitaxel)美国百时美-施贵宝公司开发的一个全新植物抗癌药,1993年10月首次在美国上市,国内首次上市的时间为1995年。
该产品主要以抑制肿瘤细胞重要的分裂方式(微管蛋白合成)使肿瘤体积逐渐缩小,而非直接杀死白细胞。
3、异长春花碱(Vinorebine)又名长春瑞滨、去甲长春碱,由法国PierreFabre公司开发,1989年法国上市,1992年在国内上市。
此品是一种半合成的第四代长春花属生物碱,上市剂型为静脉注射剂,规格为10毫克誜10毫升,是广谱抗肿瘤药。
4、多西他赛(Docetaxel)法国赛诺菲-安万特公司研制开发并生产的一种新型抗肿瘤药物,用于治疗晚期乳腺癌和非小细胞瘤。
1995年4月首次在墨西哥上市,随后在英、美、法、意、德、日等地上市,1996年进入我国,自2002年起先后有多家国内企业开始生产仿制品。
5、吉西他滨(Gemcitabine)由礼莱公司开发,1995年在瑞典、荷兰、芬兰和南非等地首次上市,1999年12月批准在国内应用。
此药是二氟核苷类抗代谢抗癌新药,为去氧胞苷的水溶性类似物,最初开发时用于抗病毒。
目前,该药已批准用于治疗胰腺癌和非小细胞肺癌,用于治疗乳腺癌、卵巢癌、膀胱癌、前列腺癌以及白血病和淋巴瘤的研究正在进行。
近年上市的部分靶向抗癌新药及其作用机制概况

近年上市的部分靶向抗癌新药及其作用机制概况近年来,随着医学科技的不断进步,靶向抗癌新药的研发取得了重大突破,为癌症患者带来了新的治疗选择。
靶向药物通过干扰癌细胞的特定生物学通路,实现对癌细胞的精准打击,减少对正常细胞的损害,从而显著提高治疗效果并降低毒副作用。
下面我们将对近年上市的部分靶向抗癌新药及其作用机制进行概况介绍。
1. 卡格雷索(Caprelsa)卡格雷索是一种针对甲状腺癌的靶向药物,其作用机制是通过抑制基因突变所导致的血管内皮生长因子受体(VEGFR)的激活,阻断肿瘤血管的形成和生长,从而抑制癌细胞的生长和扩散。
近年来,卡格雷索已经在临床中获得了广泛应用,成为治疗甲状腺癌的重要选择之一。
2. 奥拉帕尼(Lynparza)奥拉帕尼是一种PARP(聚合酶)抑制剂,主要用于治疗BRCA1/2基因突变相关的卵巢癌和乳腺癌。
PARP酶在细胞DNA修复过程中发挥着重要作用,而奥拉帕尼的抑制作用可以使癌细胞失去DNA修复的能力,最终导致癌细胞死亡。
奥拉帕尼的上市为BRCA基因突变患者提供了新的治疗选择,并在临床上展现出良好的疗效。
3. 依唑替尼(Ibrance)依唑替尼是一种CDK4/6抑制剂,用于治疗激素受体阳性乳腺癌。
激素受体阳性乳腺癌的生长往往依赖于细胞周期蛋白依赖性激酶4/6(CDK4/6)的活化,而依唑替尼可以阻断CDK4/6的激活,抑制癌细胞的增殖。
依唑替尼的上市为激素受体阳性乳腺癌患者提供了新的治疗选择,显著改善了患者的生存期和生活质量。
阿帕替尼是一种针对EGFR基因突变相关的非小细胞肺癌的靶向药物。
EGFR基因突变是非小细胞肺癌中常见的分子标志物,阿帕替尼通过特异性地抑制基因突变导致的EGFR激活,阻断癌细胞的信号传导通路,从而抑制癌细胞的生长和转移。
临床试验证实,阿帕替尼在治疗非小细胞肺癌患者中表现出非常明确的疗效,为这一类型癌症的治疗带来了重大进展。
以上仅是近年上市的部分靶向抗癌新药及其作用机制的概况,随着科学技术的不断发展,相信未来会有更多更有效的靶向药物问世,为癌症患者带来更多的治疗选择和希望。
抗癌新药

龙源期刊网 抗癌新药作者:范存义来源:《祝您健康》1996年第03期新近问世的安络宁注射液。
经大量临床验证,对治疗各种中晚期肿瘤有较好疗效。
尤其对消化系统的食道癌、胃癌、肝癌、胆囊癌、胰腺癌、肠癌等疗效显著;对肺癌、鼻咽癌、乳腺癌、骨癌,以及泌尿生殖系统的肿瘤亦有较好疗效,深受广大肿瘤病人的信赖。
本品的主要特点:①该药选用有较高抗癌作用的名贵中药材,经合理配方、科学加工,精制成纯中药针剂。
无任何毒副作用及不良反应。
②对大多数肿瘤有较好的控制作用。
部分癌块能显著缩小甚至消退。
③对中晚期病人的发热、疼痛、食欲减退、胸腹水及各种炎性反应等症状,均有较好的控制和缓解效果。
④由于本品通过静脉注射直接进入血液循环,迅速吸收生效。
充分解决了中晚期病人病情重、口服药物困难、胃肠功能差、药效难以吸收的矛盾。
⑤在使用表品的同时不但可以进行其他各种中西医治疗,包括放、化疗等,而且可以减轻放、化疗的毒副作用,提高疗效。
⑥本品使用安全方便,医院、家庭均可使用,费用也较低。
典型病例:成都病人袁×,患晚期食道癌,滴水不下,经安络宁治疗,病情明显好转。
江苏金坛责门癌患者虞××,67岁,吞咽困难,体质虚弱,曾昏倒两次,病情严重。
在走投无路的情况下使用安络宁近两个月,病情逐渐好转,开始可进流汁和半流汁,目前饮食已跟正常人完全一样。
医生去看他时,真不敢相信他曾是一位晚期责门癌的病人。
晚期肝癌患者彭××,外院早已拒绝收治。
当时主诉疼痛难忍,已用多种镇痛剂,全身情况极差,上腹巨大肿块。
经安络宁连续治疗两个多月,疼痛消失,精神好转,饮食增加,肿块略有缩小,每天谈笑风生,并下床活动。
近年上市的部分靶向抗癌新药及其作用机制概况

近年上市的部分靶向抗癌新药及其作用机制概况近年来,随着人们对肿瘤治疗的需求不断增长,许多新的靶向抗癌药物相继上市。
这些靶向药物通过特异性地抑制癌细胞内部的特定信号通路或分子靶点,以阻止肿瘤生长和扩散,具有较低的副作用和较高的疗效。
接下来,我们将介绍近年来上市的一些常见的靶向抗癌新药及其作用机制。
1. 克唑替尼(Gefitinib):克唑替尼是一种靶向表皮生长因子受体(EGFR)的酪氨酸激酶抑制剂。
它能够选择性地结合和抑制EGFR,从而阻断EGFR激活的信号通路,抑制肿瘤细胞的生长和增殖。
它主要用于治疗非小细胞肺癌(NSCLC)患者中的EGFR突变型。
2. 阿帕替尼布(Olaparib):阿帕替尼布是一种抑制聚合多腺苷酸核苷酸链酶(PARP)的药物。
PARP是维持DNA完整性和修复损伤的关键酶,而阿帕替尼布能够抑制PARP的活性,使癌细胞无法正确修复DNA损伤,最终导致癌细胞死亡。
它主要用于治疗BRCA突变相关的卵巢癌和乳腺癌。
3. 尼拉帕尼布(Niraparib):尼拉帕尼布也是一种PARP抑制剂,与阿帕替尼布类似。
它被广泛用于治疗卵巢癌和乳腺癌等BRCA突变相关的肿瘤。
4. 马法替尼(Imatinib):马法替尼是一种酪氨酸激酶抑制剂,主要用于治疗慢性髓细胞白血病(CML)和一些鱼皮瘤,如胃肠道肿瘤。
它通过抑制BCR-ABL 融合蛋白的激酶活性,从而阻断BCR-ABL信号通路,抑制癌细胞的增殖。
5. 曲妥珠单抗(Rituximab):曲妥珠单抗是一种CD20阳性B细胞特异性抗体,用于治疗非霍奇金淋巴瘤(NHL)和部分B细胞恶性肿瘤。
它能够通过结合CD20阳性B细胞表面的抗原,介导抗体依赖性细胞毒性和细胞相关的细胞毒性,从而诱导癌细胞凋亡。
近年上市的部分靶向抗癌新药具有独特的作用机制,能够更精准地干预癌细胞的生长和扩散,在临床治疗中带来更好的疗效。
由于每个药物的靶向和机制不同,患者在使用之前应向医生咨询,并遵循医生的建议进行治疗。
癌症靶向药年终大盘点

随着医学科技的飞速发展,癌症治疗领域取得了举世瞩目的成就。
靶向药物作为一种新型的抗癌治疗手段,以其精准、高效、低毒等特点,受到了全球医学界的广泛关注。
2021年,我国癌症靶向药物研发取得了丰硕的成果,本文将对2021年癌症靶向药进行年终大盘点。
一、肺癌靶向药物1. EGFR抑制剂针对EGFR基因突变的非小细胞肺癌(NSCLC)患者,我国已有多个靶向药物获批上市,如吉非替尼、厄洛替尼、奥希替尼等。
2021年,我国新增一款EGFR抑制剂——奥赛替尼,其在EGFR T790M突变阳性患者中显示出优异的疗效。
2. ALK抑制剂针对ALK基因融合的NSCLC患者,我国已有克唑替尼、阿来替尼、塞瑞替尼等靶向药物。
2021年,我国新增一款ALK抑制剂——恩沙替尼,其在ALK阳性患者中表现出良好的疗效。
3. PD-1抑制剂PD-1抑制剂在肺癌治疗中取得了显著成果,如纳武单抗、帕博利珠单抗等。
2021年,我国新增一款PD-1抑制剂——替雷利珠单抗,其在晚期肺癌患者中显示出良好的疗效。
二、乳腺癌靶向药物1. HER2抑制剂针对HER2阳性的乳腺癌患者,我国已有曲妥珠单抗、帕妥珠单抗、拉帕替尼等靶向药物。
2021年,我国新增一款HER2抑制剂——阿贝替尼,其在HER2阳性乳腺癌患者中显示出良好的疗效。
2. CDK4/6抑制剂CDK4/6抑制剂在乳腺癌治疗中发挥着重要作用,如帕博西尼、瑞博西尼等。
2021年,我国新增一款CDK4/6抑制剂——阿比特西尼,其在乳腺癌患者中表现出良好的疗效。
3. PI3K抑制剂PI3K抑制剂在乳腺癌治疗中发挥着重要作用,如阿帕替尼、依维莫司等。
2021年,我国新增一款PI3K抑制剂——艾地替尼,其在乳腺癌患者中显示出良好的疗效。
三、结直肠癌靶向药物1. EGFR抑制剂针对RAS野生型结直肠癌患者,我国已有西妥昔单抗、帕尼单抗等靶向药物。
2021年,我国新增一款EGFR抑制剂——尼妥珠单抗,其在结直肠癌患者中显示出良好的疗效。
抗癌药品和罕见病药品清单(第三批)

已获准上市的剂型 片剂 片剂 片剂 片剂 片剂 片剂 胶囊剂 胶囊剂 片剂 片剂 注射剂 胶囊剂 胶囊剂 注射剂 注射剂 片剂 注射剂 胶囊剂 片剂 片剂 片剂 胶囊剂 片剂 胶囊剂 胶囊剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂
税号 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049090 28444210 28444390 30049090 30049090 30049090 30049090 30049090 30049090 30049090 30049010 30049090 30049090 30049090 30042090 30049090 30049090 30049090 30025100 30021500 30021500 30021500 30021500 30021500 30021500 30021500
税号 30049090 30049090 30049090 30049090 30049090 30049090 30021500 30049090 30049090 30021500 30021200 30021500 30049090 30021500 30021500 30021500 30049090 30049090 30049090
富马酸二甲酯 氨吡啶 一氧化氮 丁苯那嗪 利司扑兰
维拉苷酶α 奥法妥木单抗
阿加糖酶 α 艾度硫酸酯酶β 伊奈利珠单抗 艾诺凝血素α
司妥昔单抗 醋酸艾替班特 拉那利尤单抗 布罗索尤单抗 萨特利珠单抗 氯苯唑酸葡胺
2023年医保新药目录

2023年医保新药目录
2023年医保新药目录包括以下药品:
1、抗癌药物:恩替卡韦片、替比夫定片、奥沙利铂片、阿霉
素片、阿尔茨海默氏症药物、洛匹那韦片、阿司匹林片、替米沙坦片、多西他赛片、依托泊苷片等。
2、抗感染药物:阿奇霉素片、头孢克肟片、氟哌酸片、氯霉
素片、头孢曲松片、阿莫西林片、利奈唑胺片、阿米卡星片等。
3、抗心血管病药物:氯吡格雷片、维拉帕米片、阿卡波糖片、贝特米特片、氢氯噻嗪片、美托洛尔片、西地那非片、坎地沙坦片等。
4、抗精神病药物:氟哌利多片、奥氮平片、氟罗沙星片、氟
比米片、氟哌利多滴眼液、复方氟哌利多片、氟哌酸片、复方奥氮平片等。
5、抗痛风药物:氨氯地平片、贝特米特片、苯妥英钠片、苯
扎那芬片、苯巴比妥片、西替利嗪片等。
6、其他药物:布洛芬片、美洛昔康片、美法令片、美罗培南片、维生素K1片、硫酸镁片、硫酸钙片、硫酸钠片等。
今年17款抗癌新药已获批!来自罗氏、百济神州、诺华、恒瑞医药

今年17款抗癌新药已获批!来自罗氏、百济神州、诺华、恒瑞医药值得一提的是,这些获批的创新药意义非凡。
其中,至少五款创新药为所获批适应症领域的首个,例如,中国广泛期小细胞肺癌患者迎来了首款免疫疗法,中国头颈部鳞癌患者迎来了首款获批的靶向药物等等。
此外,在过去的九个月多月里,中国还迎来了两款ADC药物、首个中国国产第三代EGFR-TKI、以及首个中国国产BTK抑制剂等。
本文中,我们将带大家走进这些创新抗癌药物,看看它们都给癌症患者带来了哪些获益。
2020年在中国获批上市的抗癌创新药(截止9月10日)注:每个癌种获批的新药数量根据CDE相关负责人在2020年CSCO上的公开PPT资料整理。
如有遗漏,欢迎在后台留言指出。
肺癌无论是在全球范围,还是在中国,肺癌的发病率和死亡率都高居“众癌之首”。
肺癌分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC占了80%-85%。
在获批的抗癌新药中,有四款针对的是肺癌,涵盖的适应症包括广泛期小细胞肺癌、T790M突变阳性的NSCLC、ALK阳性NSCLC、非鳞NSCLC。
今年2月,中国广泛期小细胞肺癌患者迎来了首款免疫疗法。
罗氏(Roche)旗下的PD-L1单抗阿替利珠单抗获批联合化疗用于一线治疗广泛期的小细胞肺癌,成为中国首个获批该适应症的肿瘤免疫疗法。
3期临床试验IMpower133研究数据显示,对比化疗手段,阿替利珠单抗联合化疗可以显著延长小细胞肺癌患者的总生存,降低该研究受试患者死亡风险30%。
根据罗氏早前发布的新闻稿,IMpower133研究是30年来广泛期小细胞肺癌一线治疗的首次重大突破。
同时,经EGFR-TKI治疗进展且T790M突变的NSCLC患者也迎来了新的选择。
今年3月,豪森药业的第三代EGFR-TKI阿美替尼获NMPA批准上市,治疗既往经EGFR-TKI治疗进展且T790M突变阳性的局部晚期或转移性NSCLC成人患者。
值得一提的是,这不仅是首个获批的中国国产第三代EGFR- TKI,也是全球范围第二个获批上市的第三代EGFR- TKI。
抗癌新药原理

抗癌新药原理
抗癌新药主要是通过改变癌细胞的生长和分裂来达到治疗的目的,其药理机制主要分为以下几类:
1. 细胞周期调节药物
细胞周期调节药物主要通过影响癌细胞的生长和分裂过程,从而
达到抑制癌细胞生长的目的。
这类药物主要包括细胞周期特异性药物
和非特异性药物,例如,细胞周期特异性药物如氟尿嘧啶、环磷酰胺、依托泊唑等;非细胞周期特异性药物包括顺铂、多西他赛等,其作用
机制主要是干扰细胞的DNA合成和微管组装。
2. 靶向治疗药物
靶向治疗药物主要是针对特定的癌细胞分子靶点进行设计和研究的,其基本原理是通过特异性作用于癌细胞靶点上,从而对癌细胞生
长和增殖进行干扰和抑制。
这类药物主要包括酪氨酸激酶抑制剂、EGFR抑制剂、VEGF抑制剂等,例如,伊马替尼是一种靶向治疗药物,
主要用于治疗慢性髓性白血病。
3. 免疫治疗药物
免疫治疗药物主要是通过激活或增强机体自身免疫系统的功能,
从而增加机体自身对癌细胞的杀伤能力。
这类药物主要包括免疫检查
点抑制剂、肿瘤疫苗、CAR-T细胞治疗等,例如,PD-1抑制剂可以通
过抑制免疫检查点的作用,增加机体对癌细胞的攻击能力,从而达到
治疗肺癌、黑色素瘤等恶性肿瘤的目的。
总之,抗癌新药的原理主要是通过对癌细胞的生长和分裂进行干
扰和抑制,从而达到治疗的目的。
不同的抗癌药物有不同的作用机制,需要根据不同患者的病情和症状来选择合适的药物进行治疗。
未来,
随着科技和医学的不断发展,抗癌新药将会创新和升级,给癌症患者
带来更为有效的治疗手段和更好的生存机会。
最新医保目录中抗肿瘤药物及适应症总结2024

最新医保目录中抗肿瘤药物及适应症总结20242023年12月13日,2023版国家医保目录调整结果公布,新增126种药品!新版医保目录将于2024年1月1日正式实施。
在谈判/竞价环节,143个目录外药品参加,其中121个谈判/竞价成功,成功率为84.6%,平均降价61.7%,成功率和价格降幅均与2023年基本相当。
其中,新增抗肿瘤药物21种,涉及多个癌种。
以下是2023年国家医保药品目录提到的抗肿瘤药物,已按不同癌症类型分类整理,可按需查询。
非小细胞肺癌1甲磺酸奥希替尼片限:1IB-HIA期存在表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的非小细胞肺癌(NSe1C)患者的治疗,患者须既往接受过手术切除治疗,并由医生决定接受或不接受辅助化疗;2.具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的局部晚期或转移性非小细胞肺癌(NSC1e)成人患者的一线治疗;3.既往经EGFR酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性NSC1C成人患者的治疗。
有效期:2024年1月1日至2024年12月31日2甲磺酸阿美替尼片限:1.表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的局部晚期或转移性非小细胞肺癌(NSC1C)成人患者的一线治疗;2.既往经EGFR酪氨酸激酶抑制剂(TK1)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者的治疗。
有效期:2023年3月1日至2024年12月31日3克理替尼胶囊限间变性淋巴瘤激酶(A1K)阳性的局部晚期或转移性非小细胞肺癌患者或ROS1阳性的晚期非小细胞肺癌患者。
有效期:2023年3月1日至2024年12月31日4塞瑞替尼胶囊限间变性淋巴瘤激酶(A1K)阳性的局部晚期或转移性非小细胞肺癌(NSC1C)患者的治疗。
这些癌症、肝炎等大病有新药了,转发出去能救太多人!新上市的25种药全列出来了!

这些癌症、肝炎等大病有新药了,转发出去能救太多人!新上市的25种药全列出来了!如今,药物审批、新药研发的速度越来越快,以前治不了的病、治不好的病,现在都有越来越多的药可以用了!健康时报微信就为大家梳理一下,近一年多来,都有哪些“重磅新药”上市!1. 肺癌:欧狄沃“O药”,全球首个PD-1中国获批治疗:晚期非小细胞肺癌公司:百时美施贵宝时间:2018年6月获批上市欧狄沃(O药)是目前国内首个获批上市的PD-1抑制剂,用于非小细胞肺癌的二线治疗,它开启免疫肿瘤治疗新时代。
一项中国患者为主的(90%为中国患者)III期临床试验CheckMate-078结果显示,相比于标准化疗,“O药”可降低死亡风险32%,能够明显延长患者的总生存期。
2. 肝癌:乐卫玛肝癌靶向一线治疗10年新突破治疗:肝癌公司:卫材时间:2018年9月获批上市该药一线治疗晚期肝癌安全有效,特别是针对中国的肝癌患者和乙肝病毒相关肝癌患者疗效显著,中位总生存期较索拉非尼对照组提高了整整5个月。
3. 乳腺癌:爱博新全球首个乳腺癌CDK4/6抑制剂治疗:晚期乳腺癌公司:辉瑞时间:2018年7月获批上市爱博新是全球首个细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,适用于治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌。
相比来曲唑单药,爱博新联合来曲唑治疗显著延长了晚期乳腺癌患者10个月的中位无进展生存期。
4. 卵巢癌:利普卓卵巢癌30年来第一个靶向药治疗:卵巢癌公司:阿斯利康时间:2018年8月获批上市利普卓是首个PARP抑制剂,用于铂敏感复发性卵巢癌的维持治疗。
卵巢癌治疗将进入靶向时代。
多项临床试验显示,利普卓具有优异的临床疗效,显著延长了铂敏感复发型卵巢癌患者的无进展生存期,降低了患者的疾病进展和死亡风险,改善了患者的生存质量。
5. 直肠癌:爱优特抗击晚期结直肠癌的中国“芯”治疗:晚期结直肠癌公司:和记黄埔医药时间:2018年9月获批上市这是中国首个自主研发抗癌新药,用于治疗晚期肠癌。
最新抗癌药替拉扎明详细介绍

一类新药—替拉扎明项目简介一、概况据世界卫生组织(WHO)统计,全球平均每年死于恶性肿瘤者达690万人,新发病为870万例,且这一数字还在逐年增加。
全世界每年新确诊肿瘤疾病患者达到1000万人,预计到2020年,全世界每年将新发生2000万例肿瘤,其中1400万例在亚洲、非洲和拉丁美洲的发展中国家。
据我国卫生部统计,目前我国每年有106万左右的恶性肿瘤新生患者,同时有106.7万左右的良性肿瘤患者,两者合计约有212.7万,即肿瘤的全国发病率约在1.65‰左右。
每年,我国因肿瘤死亡人数约有154万人左右,癌症(肿瘤)成为继心脑血管疾病后的我国第二大疾病。
缺氧是诱导肿瘤血管生成的一个非常重要的因素,在目前国内外均有大量的实验和临床研究证实了这一点。
缺氧对促进肿瘤血管生成的调节主要是通过在分子水平上,缺氧对促进肿瘤血管生成的细胞因子转导的调节而实现的。
与缺氧有关的促进肿瘤血管生成的细胞因子有如下几种。
1、HIF-1(缺氧诱导因子-1),2、VEGF(血管内皮生长因子)以及血管内皮生长因子的两个受体(flt-1,KDR/flk-1),3、bFGF(碱性成纤维细胞生长因子),4、IGF(胰岛素样生长因子)及其主要受体IGF-IR,5、MMP(基质金属蛋白酶)。
目前,临床上对肿瘤的治疗仍以手术和放、化疗为主,但由于在实体瘤中存在着10%~50%的乏氧细胞,这些乏氧细胞对射线及化疗药物的耐受性比有氧细胞强2.5~3倍。
因而,在常规放(化)疗剂量治疗时,乏氧细胞不能被有效杀死,于是埋下了癌症复发祸根。
要想杀灭肿瘤乏氧细胞,只有加大放(化)疗剂量,然而,这又给患者带来难以承受的毒副反应和痛苦。
总之,乏氧细胞是肿瘤难治愈、易复发和转移的重要因素之一。
二、项目优势替拉扎明(tirapazamine,TPZ)化学名称:3-氨基-1,2,4苯并三唑-1,4-二氮-氧化物(3-Amino-1,2,4-benzotuiazine-1,4-dioxide)又名Win59075或SR4233,是一种新型的生物还原活性物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
括卵巢癌、多发性骨髓瘤、急性淋巴细胞白血病。
安卓健(Antroquinonol)
安卓健是由台湾国鼎生技研发的KRAS抑制剂,针对非小细胞肺 癌KRAS突变。安卓健于2010年5月14日获得美国FDA(国际医疗审 核最具权威的机构)以及台湾行政院卫生署食品药物管理局核准, 在台北荣民总医院与三军总医院执行非小细胞肺癌(NSCLC)Ⅰ期 临床试验。2013年3月,2013年3月,Ⅰ期临床成功结束。Ⅱ期临 床预计将于2013年11月正式启动。 来自多个国家的研究人员在台 湾、美国及东南亚等地区,针对共计198名患者,观察研究这些患 者服用安卓健后的治疗效果。如下表,临床使用中,肺癌、肝癌、 前列腺癌、胆囊癌、多发性骨髓癌均有痊愈案例。在这198个临床 案例中??人,部分显效119人,完全显效12人,总改善率70%。 这个数据远远超出同类抗癌药物。更多的消息可以去安卓健官网 了解更多。
症,年销售额峰值预计为50亿美元。
Obinutuzumab (GA101)
Obinutuzumab是Genentech研发的新一代anti-CD20单抗,用于 治疗慢性淋巴细胞白血病,目前处于III期临床。356例患者分成 chlorambucil组、GA101+ chlorambucil组,总应答率分别为 30.2%、75.5%,完全应答率为0、22.2%,中位无进展生存期为 10.9个月、23.0个月,rituximab+chlorambucil的三项指标分别 为65.9%、8.3%、15.7个月。2012年rituximab的销售额为71.43亿 美元,obinutuzumab优于rituximab,钱景可观。
Idelalisib (GS-1101)
Idelalisib是Gilead Sciences研发的PI3Kδ 抑制剂,用于治 疗慢性淋巴细胞白血病、非霍奇金淋巴瘤,目前处于III期临床。 54例CLL患者经50-350mg QD or BID治疗后,客观应答率为56%, 完全应答率为4%,81%的患者实现淋巴结应答。中位首次应答时间 为1.9个月,中位无进展生存期为17个月,中位持续应答时间为18 个月。Infinity Pharma的PI3Kδ /γ 抑制剂IPI-145表现出了更好 的活性、更低的肝毒性,但比Gilead晚一步。
Lambrolizumab (MK-3475)
Lambrolizumab是Merck研发的全人源anti-PD1单抗,用于治疗 晚期恶性黑色素瘤,2013年4月获得FDA的“Breakthrough Therapy”资格,目前处于II期临床。作用机理与Nivolumab类似, 但比Nivolumab晚一步。135例患者经10mg/kg Q2W、10mg/kg Q3W、 2mg/kg Q3W治疗后,平均客观应答率为38%。其中57例患者经 10mg/kg Q2W治疗后,客观应答率为52%,完全应答率为10%。
LDK378
LDK378是Novartis研发的选择性ALK抑制剂,用于治疗ALK阳 性非小细胞肺癌,2013年3月获得FDA的“Breakthrough Therapy” 资格,目前处于III期临床。88例患者经400-750mg LDK378 QD治 疗后,总应答率为70%,对于64例crizotinib耐药型患者,总应答 率为73%。对于已经确证有应答的患者,持续应答时间为7.4个月, 78%的患者持续应答时间在6个月以上。对于所有123例非小细胞肺 癌患者,中位无进展生存期为8.6个月。
Daratumumab
Daratumumab是Johnson & Johnson开发的全人源anti-CD38单 抗,用于治疗复发型、难治型多发性骨髓瘤,2012年8月J&J以11 亿美元从Genmab买入,目前处于II期临床,以进入FDA快速通道, 2013年5月获得“Breakthrough Therapy”资格。Daratumumab对 于其他类型的血癌,如弥漫大B细胞性淋巴瘤、慢性淋巴细胞白血 病、急性淋巴细胞白血病、急性髓细胞白血病、滤泡性淋巴瘤、 套细胞淋巴瘤等,也有治疗潜力。
Palbociclib (PD-0332991)
Palbociclib是Pfizer研发的CDK4/6抑制剂,用于在治疗晚期 乳腺癌,2013年4月获得FDA的“Breakthrough Therapy”资格, 目前处于III期临床,Eli Lilly的同类药物LY2835219处于II期临 床。36例患者(18例HR+/Her2-、2例HR+/Her2+、8例HR-/Her2-)经 125mg PD-0332991 QD治疗后,部分应答率为7%,14%患者病情稳 定6个月以上。PD-0332991治疗ER+/Her2-、ER+/Her+、ER-/Her2三类晚期乳腺癌的无进展生存期分别为4.1个月、18.8个月、1.8 个月。Palbociclib目前还在进行针对其他适应症的临床试验,包
Talimogene laherparepvec (T-VEC)
Talimogene laherparepvec是Amgen研发的溶瘤病毒(2011年 收购BioVax而来),用于治疗无法切除的恶性黑色素瘤。436例患 者分成T-VEC治疗组和GM-CSF治疗组,结果显示T-VEC组客观应答 率为26%,完全应答率为11%,持续应答率为16%,GM-CSF组客观应 答率为6%,完全应答率为1%,持续应答率为2%。
来自互联网总结
Nivolumab (BMS-936558/ONO-4538/MDX1106)
Nivolumab是Bristol-Myers Squibb/Ono Pharma共同研发的 全人源anti-PD1单抗,用于治疗恶性黑色素瘤、肺癌、肾癌,已 进入FDA快速通道,目前处于III期临床。106例恶性黑色素瘤患者 (107例?)经1-10mg/kg Q2W治疗后,客观应答率为31%。 Nivolumab联合anti-CTLA4单抗效果更好,37例恶性黑色素瘤患者 经0.3-3mg/kg nivolumab+3mg/kg ipilimumab Q3W治疗后,客观 应答率为38%,其中17例患者经1mg/kg nivolumab+3mg/kg ipilimumab Q3W治疗后,客观应答率为47%(53%?),完全应答
MPDL320A (RG7446)
Hale Waihona Puke MPDL320A是Genentech研发anti-PDL1单抗,治疗转移性恶性 黑素瘤,目前处于I期临床。anti-PDL1单抗与anti-PD1单抗不同, 它不干扰PDL2与PD1的结合,因此可能没有肺炎等严重副反应。已 公布的I期临床数据显示,0.01mg/kg至20mg/kg剂量下耐受性良好, 无剂量限制性毒性。35例患?呔?-20mg/kg Q3W治疗后,客观应答 率为26%。
率为18%,41%的患者治疗12周后肿瘤缩小80%以上。
Ibrutinib (PCI-32765)
Ibrutinib是Johnson & Johnson与Pharmacyclics Inc.共同 研发的BTK抑制剂,用于治疗复发型、难治型慢性淋巴细胞白血病 (CLL)和套细胞淋巴瘤(MCL)。2011年12月,Johnson & Johnson以9.75亿美元买下该药,目前处于III期临床,2013年2月 获得FDA的“Breakthrough Therapy”资格。115例MCL患者经 ibrutinib治疗后,总应答率为68%,22%的患者实现完全应答。在 CLL的II期临床试验中,75%的患者无进展生存期超过26个月,83% 的患者总生存期超过26个月。如果该药被批准用于CLL及其他适应
