食品毒理学课件第三章 毒性作用及其评价
合集下载
食品毒理学课件第三章 毒性作用及其评价

3.4 致突变、致癌、致畸
P145细菌回复突变试验(Ames试验)
Ames实验法是利用组氨酸缺陷的鼠伤寒沙门氏菌的 突变株(His-)为测试指示菌,观察其在受试物 作用下回复突变为野生型的一种测试方法。
组氨酸缺陷型的鼠伤寒沙门氏菌在缺乏组氨酸的培 养基上不能生长。但在加有致突变原的培养基上 培养,则可使突变型产生回复突变成为野生型, 即恢复合成组氨酸的能力,于是就能在缺乏组氨 酸的培养基上生长为菌落,通过计数菌落出现的 数目就可以估算受试物诱变性的强弱。
P141:以DNA为靶的损伤机理 P142:DNA-蛋白质交联物形成
3.4 致突变、致癌、致畸
P144:突变的后果
作用于体细胞:
体细胞突变的后果:肿瘤、畸形、动脉粥样硬化、糖尿 病、衰老等,但最受重视的是肿瘤。
作用于生殖细胞:
①对机体没有影响,②导致对健康无影响的正常人体生 化组成的遗传变异;③导致遗传易感性的改变;④导 致遗传性疾病;⑤致死性突变,造成配子死亡、死胎 及自发流产等。
4.食品安全性毒理学评价试验的四个阶段和内容
• 第三阶段:亚慢性毒性实验: 实验期在3个月左右,检验该品的毒性对机体
的重要器官或生理功能的影响包括繁殖和致畸实 验
4.食品安全性毒理学评价试验的四个阶段和内容
• 第四阶段:慢性毒性实验: 考查少量该品长期对机体的影响,确定最大无作
用量,一般以寿命较短敏感的动物的一生为一个 试验阶段,如用大白鼠试验2年小白鼠试验1.5年。
3.4 致突变、致癌、致畸
细菌回复突变试验(Ames试验)
鼠伤寒沙门氏菌(His+)
正向突变 回复突变
鼠伤寒沙门氏菌(His-)
代谢活化系统 受试物
3.4 致突变、致癌、致畸
食品毒理学章课件(共46张PPT)

物所产生的毒性效应。 慢性毒性试验的染毒周期一般为6个月至2年,甚至终生染毒。 3 亚慢性和慢性毒性试验的目的 观察长期接触受试物的毒效应谱和靶器官
确定长期接触受试物的剂量-反应关系,为制定人类接触的安全限值提供依 据。
4 亚慢性和慢性毒性试验设计
4.1 实验动物 首选实验动物是大鼠 断乳不久的实验动物,5-6周龄
蓄积作用。
2 蓄积毒性的表现在两个方面: 物质蓄积:若能用化学方法测得体内存在该化合物的母体或其代谢产物
,即为物质蓄积; 功能蓄积:经长期接触后在机体内测不出该化学物质的原形或其代谢产物
,却出现慢性毒性作用时,称为功能蓄积。
3 蓄积毒性试验方法 3.1 蓄积系数法 蓄积系数是多次染毒使半数动物出现中毒效应(或死亡)的累积剂量 [ED50(n)]与一次染毒使半数动物出现相同效应(或死亡)的剂量 [ED 50(1)]的比值,即: K=ED50(n)/ED50(1) 蓄积系数的分级标准 K<1 高度蓄积 1≤K<3 明显蓄积 3≤K<5 中等蓄积 5≤K 轻度蓄积
第三节 亚慢性和慢性毒性作用 亚慢性毒性是指人或实验动物连续接触较长时间、较大剂量的外源化合物所引起
的毒性效应。
亚慢性毒性试验的设计原则 剂量上限应小于急性毒性LD50的剂量
每次接触的剂量相等 “连续多日”约相当于实验动物寿命的1/30-1/10
2 慢性毒性作用 慢性毒性是指人或实验动物长期(甚至终生)反复接触低剂量的化学毒
食品毒理学章课件
第一节 毒物因素
一、外源化学物的结构
1 取代基对毒性的影响 烷烃类物质中的氢原子被卤素取代,毒性增强。取代基越多,毒性越
大。如CCl4>CCl3>CCl2>CCl。
化学物中引入羧基或磺酸基后,脂溶性降低,水溶性升高,易排泄,毒 性降低。如苯甲酸的毒性低于苯。
确定长期接触受试物的剂量-反应关系,为制定人类接触的安全限值提供依 据。
4 亚慢性和慢性毒性试验设计
4.1 实验动物 首选实验动物是大鼠 断乳不久的实验动物,5-6周龄
蓄积作用。
2 蓄积毒性的表现在两个方面: 物质蓄积:若能用化学方法测得体内存在该化合物的母体或其代谢产物
,即为物质蓄积; 功能蓄积:经长期接触后在机体内测不出该化学物质的原形或其代谢产物
,却出现慢性毒性作用时,称为功能蓄积。
3 蓄积毒性试验方法 3.1 蓄积系数法 蓄积系数是多次染毒使半数动物出现中毒效应(或死亡)的累积剂量 [ED50(n)]与一次染毒使半数动物出现相同效应(或死亡)的剂量 [ED 50(1)]的比值,即: K=ED50(n)/ED50(1) 蓄积系数的分级标准 K<1 高度蓄积 1≤K<3 明显蓄积 3≤K<5 中等蓄积 5≤K 轻度蓄积
第三节 亚慢性和慢性毒性作用 亚慢性毒性是指人或实验动物连续接触较长时间、较大剂量的外源化合物所引起
的毒性效应。
亚慢性毒性试验的设计原则 剂量上限应小于急性毒性LD50的剂量
每次接触的剂量相等 “连续多日”约相当于实验动物寿命的1/30-1/10
2 慢性毒性作用 慢性毒性是指人或实验动物长期(甚至终生)反复接触低剂量的化学毒
食品毒理学章课件
第一节 毒物因素
一、外源化学物的结构
1 取代基对毒性的影响 烷烃类物质中的氢原子被卤素取代,毒性增强。取代基越多,毒性越
大。如CCl4>CCl3>CCl2>CCl。
化学物中引入羧基或磺酸基后,脂溶性降低,水溶性升高,易排泄,毒 性降低。如苯甲酸的毒性低于苯。
《食品毒理学评价》课件

实验动物管理
应提供适宜的饲养环境,包括温度、 湿度、光照、饲料和水等,以确保实 验动物的健康和实验结果的准确性。
实验设计的方法和原则
实验设计方法
可以采用随机化、盲法、对照等实验设 计方法,以提高实验的可靠性和科学性 。
VS
实验设计原则
应遵循科学、合理、可行的原则,确保实 验结果具有可重复性和可推广性。
黄曲霉素的危害
黄曲霉素是一种强致癌物质,长期摄入可能增加患肝癌等恶性肿瘤 的风险。
毒理学评价内容
通过动物实验等方法,评估黄曲霉素的毒性作用、致癌性等,并研 究其作用机制。
安全控制措施
制定相应的安全控制措施,如加强食品生产过程中的卫生管理、提高 食品加工工艺等,降低食品中黄曲霉素的含量。
谢谢观看
目的
评估食品中有害物质在短时间内 大量摄入后对机体的毒性作用。
方法
通过实验动物进行急性毒性试验 ,观察动物的中毒症状、死亡率
和病理变化等指标。
结果评价
根据试验结果,对食品中有害物 质的急性毒性进行分级和评估。
亚慢性毒性评价
目的
结果评价
评估食品中有害物质在较长时间内低 剂量摄入对机体的毒性作用。
根据试验结果,对食品中有害物质的 亚慢性毒性进行分级和评估。
01
02
03
04
危害识别
识别食品中可能存在的有害物 质,评估其对健康的影响。
暴露评估
评估消费者通过食品摄入有害 物质的量,以及摄入频率和持
续时间。
危害特征描述
描述有害物质对健康的影响性 质、程度和作用机制。
风险特征描述
综合危害识别、暴露评估和危 害特征描述的结果,评估有害
物质对人群健康的风险。
应提供适宜的饲养环境,包括温度、 湿度、光照、饲料和水等,以确保实 验动物的健康和实验结果的准确性。
实验设计的方法和原则
实验设计方法
可以采用随机化、盲法、对照等实验设 计方法,以提高实验的可靠性和科学性 。
VS
实验设计原则
应遵循科学、合理、可行的原则,确保实 验结果具有可重复性和可推广性。
黄曲霉素的危害
黄曲霉素是一种强致癌物质,长期摄入可能增加患肝癌等恶性肿瘤 的风险。
毒理学评价内容
通过动物实验等方法,评估黄曲霉素的毒性作用、致癌性等,并研 究其作用机制。
安全控制措施
制定相应的安全控制措施,如加强食品生产过程中的卫生管理、提高 食品加工工艺等,降低食品中黄曲霉素的含量。
谢谢观看
目的
评估食品中有害物质在短时间内 大量摄入后对机体的毒性作用。
方法
通过实验动物进行急性毒性试验 ,观察动物的中毒症状、死亡率
和病理变化等指标。
结果评价
根据试验结果,对食品中有害物 质的急性毒性进行分级和评估。
亚慢性毒性评价
目的
结果评价
评估食品中有害物质在较长时间内低 剂量摄入对机体的毒性作用。
根据试验结果,对食品中有害物质的 亚慢性毒性进行分级和评估。
01
02
03
04
危害识别
识别食品中可能存在的有害物 质,评估其对健康的影响。
暴露评估
评估消费者通过食品摄入有害 物质的量,以及摄入频率和持
续时间。
危害特征描述
描述有害物质对健康的影响性 质、程度和作用机制。
风险特征描述
综合危害识别、暴露评估和危 害特征描述的结果,评估有害
物质对人群健康的风险。
《食品毒理学基础》课件

比较化学毒性和生物毒 性的异同。
毒性的评价方法
介绍毒性评价的方法和 标准。
第四章:毒素在食品中的含量
毒素在食品中的来源
讨论毒素进入食品的途径和来源。
章:毒素对人体健康的影响
毒素的毒理学效应
阐述毒素对人体健康的不良影响和毒理学 特征。
毒素的卫生标准和限值
《食品毒理学基础》PPT 课件
食品毒理学基础PPT课件将介绍食品毒理学的基本概念、毒素的分类、毒素在 食品中的含量、毒素对人体健康的影响以及控制食品中毒素的方法等内容。
第一章:引言
食品毒理学的概述
介绍食品毒理学的起源、 发展和研究范围。
食品毒理学的研究 对象和研究内容
探讨食品毒理学研究的 重点和内容。
介绍毒素的卫生标准和限值,以保障公众 健康。
第六章:控制食品中毒素的方法
食品毒素的防治措施
探讨预防和控制食品中毒素的方法和策略。
食品毒素的监测和检测方法
介绍食品毒素的监测和检测技术。
第七章:未来发展趋势
食品毒理学的应用前景
展望食品毒理学在未来的应用前景和发展方向。
食品安全问题的思考
引发对食品安全问题的思考和讨论。
食品安全意义
讲述食品毒理学对保障 食品安全的重要性。
第二章:毒素的分类
毒素的定义
明确毒素的概念和定义。
毒素的种类
介绍不同类型的毒素, 如化学毒素、生物毒素 等。
功能毒素和结构毒 素的区分
解释功能毒素和结构毒 素之间的区别。
第三章:毒理学的基本概念
毒性的定义
阐述毒性的概念和定义。
化学毒性和生物毒 性的区别
大学课件-食品毒理学化学毒物的一般毒性作用-亚慢性慢性毒性

K=ED50(n)/ED50(1) K=LD50(n)/LD50(1)
1.固定剂量法
• 先求出LD50(常选用大/小鼠灌胃或腹腔注射方法进行染毒) • 然后选取相同条件的40只(或更多)实验动物,分为两组
(染毒组,对照组),每组至少20只,雌雄各半。 • 试验组在1/20~l/50LD50的范围内选定一个剂量 • 每日以固定剂量、定时和相同途径进行染毒,试验期间观
2、实验动物染毒期限: 亚慢性毒性试验
–工业毒理学——1-3个月 –食品毒理学——3-6个月 –环境毒理学—— 3-6个月 慢性毒性试验 –工业毒理学——6个月或更长 –食品毒理学——1年以上或2年 –环境毒理学—— 1年以上或2年 –致癌试验—— 接近或等于动癌瘤
性肝坏死、亚急性肝坏死
肾
汞、铅
变性、坏死、炎症、萎缩、 中毒性肾病、急性肾小管坏死、肾
纤维化
固缩
脑
CO、铅
变性、坏死、出血、水肿、 中毒性脑水肿、中毒性脑病
脱髓鞘、神经胶质增生
肺 氯气、纯氧、铍、 水肿、出血,肺泡炎、 中毒性肺水肿,化学牲肺炎、弥漫
白草枯
纤维化
性肺泡损伤、肺透明膜病
心血管 钡、CS2 血液及造血 铅、苯
亚慢性试验评判:
NOAEL < 100Intakehuman —— 放弃 100Intakehuman < NOAEL < 300Intakehuman —— 继续慢性试验 NOAEL > 人的可能摄入量的300倍 —— 不必慢性试验,直接进行毒性评价
4
慢性试验评判:
• NOAEL < 50Intakehuman —— 放弃
系,则为强蓄积性。
20 d蓄积实验法结果评价表
1.固定剂量法
• 先求出LD50(常选用大/小鼠灌胃或腹腔注射方法进行染毒) • 然后选取相同条件的40只(或更多)实验动物,分为两组
(染毒组,对照组),每组至少20只,雌雄各半。 • 试验组在1/20~l/50LD50的范围内选定一个剂量 • 每日以固定剂量、定时和相同途径进行染毒,试验期间观
2、实验动物染毒期限: 亚慢性毒性试验
–工业毒理学——1-3个月 –食品毒理学——3-6个月 –环境毒理学—— 3-6个月 慢性毒性试验 –工业毒理学——6个月或更长 –食品毒理学——1年以上或2年 –环境毒理学—— 1年以上或2年 –致癌试验—— 接近或等于动癌瘤
性肝坏死、亚急性肝坏死
肾
汞、铅
变性、坏死、炎症、萎缩、 中毒性肾病、急性肾小管坏死、肾
纤维化
固缩
脑
CO、铅
变性、坏死、出血、水肿、 中毒性脑水肿、中毒性脑病
脱髓鞘、神经胶质增生
肺 氯气、纯氧、铍、 水肿、出血,肺泡炎、 中毒性肺水肿,化学牲肺炎、弥漫
白草枯
纤维化
性肺泡损伤、肺透明膜病
心血管 钡、CS2 血液及造血 铅、苯
亚慢性试验评判:
NOAEL < 100Intakehuman —— 放弃 100Intakehuman < NOAEL < 300Intakehuman —— 继续慢性试验 NOAEL > 人的可能摄入量的300倍 —— 不必慢性试验,直接进行毒性评价
4
慢性试验评判:
• NOAEL < 50Intakehuman —— 放弃
系,则为强蓄积性。
20 d蓄积实验法结果评价表
食品毒物的一般毒性作用课件

素的毒性和危险性 • 体内试验(in vivo test)--在实验动物模型
(model)上进行 • 体外试验(in vitro test)--在微生物、人工
培养的细胞或组织或器官上进行 • 人体试验和流行病学调查
食品毒物的一般毒性作用
§1概述
• 发展趋势: • 动物用量少、动物痛苦小、开发体外替代
食品毒物的一般毒性作用
二、急性毒性试验
(二)试验动物的饲养环境
• 恒定的温度:22±3℃ • 湿度:30~70% • 照度:昼夜各半 • 饲料合格、饮水合格、垫料合格
食品毒物的一般毒性作用
二、急性毒性试验
(三)染毒途径的选择:
模拟人在生活和生产环境中实际接触受 试物的途径和方式;有利于不同化学物之 间急性毒性大小的比较;受试物的性质和 用途;各种受试物毒性评价程序的要求等。
食品毒物的一般毒性作用
二、急性毒性试验
• ⒉试验动物的年龄和体重:
• 通常要求选择刚成年动物进行试验,而且须是未曾交 配和受孕的动物。例如:大鼠180~240g、小鼠18~ 25g、家兔2~2.5kg、豚鼠200~250g、狗10~15kg。 同一批试验动物体重变异范围不应超过该批动物平均 体重的20%。
• 5.禁食:
• 经消化道染毒时,要求试验前对动物禁食 • 大鼠、大型动物——隔夜禁食; • 小鼠--禁食4h
食品毒物的一般毒性作用
二、急性毒性试验
• 染毒后继续禁食2~4h,但在禁食时要保障饮水。
• 6.实验动物的预检:
• 选择健康动物 • 1~2周的检疫期 • 动物购来后适应饲料和环境3 d~5 d
食品毒物的一般毒性作用
二、急性毒性试验
• 3.试验动物的性别:
(model)上进行 • 体外试验(in vitro test)--在微生物、人工
培养的细胞或组织或器官上进行 • 人体试验和流行病学调查
食品毒物的一般毒性作用
§1概述
• 发展趋势: • 动物用量少、动物痛苦小、开发体外替代
食品毒物的一般毒性作用
二、急性毒性试验
(二)试验动物的饲养环境
• 恒定的温度:22±3℃ • 湿度:30~70% • 照度:昼夜各半 • 饲料合格、饮水合格、垫料合格
食品毒物的一般毒性作用
二、急性毒性试验
(三)染毒途径的选择:
模拟人在生活和生产环境中实际接触受 试物的途径和方式;有利于不同化学物之 间急性毒性大小的比较;受试物的性质和 用途;各种受试物毒性评价程序的要求等。
食品毒物的一般毒性作用
二、急性毒性试验
• ⒉试验动物的年龄和体重:
• 通常要求选择刚成年动物进行试验,而且须是未曾交 配和受孕的动物。例如:大鼠180~240g、小鼠18~ 25g、家兔2~2.5kg、豚鼠200~250g、狗10~15kg。 同一批试验动物体重变异范围不应超过该批动物平均 体重的20%。
• 5.禁食:
• 经消化道染毒时,要求试验前对动物禁食 • 大鼠、大型动物——隔夜禁食; • 小鼠--禁食4h
食品毒物的一般毒性作用
二、急性毒性试验
• 染毒后继续禁食2~4h,但在禁食时要保障饮水。
• 6.实验动物的预检:
• 选择健康动物 • 1~2周的检疫期 • 动物购来后适应饲料和环境3 d~5 d
食品毒物的一般毒性作用
二、急性毒性试验
• 3.试验动物的性别:
食品毒理学·表示毒性的常用指标 ppt课件

2020/11/13
12
一、致死剂量:半数致死量测定方法
在曲线中段,即50%死亡率附近,斜率最大, 对应的剂量即为LD50。
同时计算95%的可信限(即5%的误差)。
2020/11/13
13
LD50测定
2020/11/13
14
一、致死剂量
(三) 最小致死剂量 minimal lethal dose,MLD或LD01 ,指化 学物质引起受试对象中的个别成员出现死亡的 剂量。 从理论上讲,低于此剂量即不能引起死亡。
19
二、阈剂量
▪ 慢性毒作用的敏感阈剂量最低; ▪ 因人与动物的敏感性差异,在剂量外推到人时设
置“安全系数”。 ✓ 车间内接触的化学品:<10,如敌敌畏; ✓ 毒作用带窄:>10,如异氰酸甲酯为100; ✓ 食品:从无作用剂量外推到ADI为100。
2020/11/13
20
三、最大无作用剂量
maximal no-effect dose,MNEL:
又称“中毒阈剂量”,指略高于最大无作用剂量 或浓度。
➢ 指在一定时间内,化学物质按一定方式或途径与 机体接触,使某项观察指标开始出现异常变化或 使机体开始出现损害作用所需的最低剂量。
2020/11/13
22
三、最大无作用剂量
➢毒理学试验能够确定的是未观察到损 害作用的剂量(NOEL)。 ➢NOEL是毒理学的一个重要参数,在 制订化学物质的安全限值时起着重要作 用。
高耐受性或高敏感性的个体,故LD100常有很大 的波动性。实际意义不大。
2020/11/13
8
一、致死剂量
(二) 半数致死剂量
median lethal dose,LD50 ,指受试动物经一
食品毒理学与食品安全评价3

①灭活、毒性降低 ②极性增加 物
③产生毒性代谢
25
(3)排泄 excretion
化学物和毒物以原形或代谢产物形式通过 排泄或分泌器官排出体外的过程
排泄途径
尿液
粪便
肺脏
汗腺
乳汁
含废物 多血液
尿的形成
肾小球 肾小球的滤过作用
毛 细 血 管
肾小囊 (形成原尿) 肾小管的重吸收作用 肾小管 (形成尿液)
指多种化学物同时存在时的毒效应为各化学物分 别作用时毒效应的总和。
例:甲拌磷与乙酰甲胺磷 谷硫磷与苯硫磷 谷硫磷与敌百虫 作用特点:毒物结构上为同系物,毒作用靶器官相同
分子的结构相像、且组成上彼此相差一个或几个原子团,同系物 必须符合同一通式。
33
相加作用
化学物A
化 学 物
靶 器 官
效 应
效应B
10
①
毒
(6)膳食因素
膳食中的长链脂肪酸与有毒金属形成金属皂从
而降低其吸收程度。 抗坏血酸可防止胃肠中的亚硝化反应。 膳食中脂肪促进或延缓脂溶性化合物的吸收。 脂肪使胃排空减慢,因而使摄入的毒物的吸收 也慢。 与营养素或其他化学物共用主动运输系统的毒 物可能被取代,如钙取代铅。
11
(6)膳食因素
含废物 少血液
尿液
27
(3)排除过程
被吸收的有毒化合物主要排出途径是经尿和胆汁。 ① 经尿排除:已吸收化合物的排出机制是被动肾小球滤过、 小管滤过以及主动小管运输。大部分有毒物和其他化合物 由肾小球过滤和主动小管运输来排除。根据尿pH的不同肾 小管内的化合物可能通过被动扩散而被再吸收,因此要看 毒物是酸性或碱性,尿pH可以加速或延缓它经尿排除。所 以,碱性尿有利酸性化合物排除,反之亦然。 ② 经胆汁排除 血中许多有毒化合物是由肝经胆汁排除。 显然,肝胆功能不良的人很可能对某些化合物毒性反应较 严重。患病毒性肝炎的人是否比健康人对某些有毒化合物 更敏感有待研究。慢性酒精中毒的人可能也有同样问题。 最后,肝胆系统发育未成熟的新生儿需要特别保护,使他 (她)们避免摄入某些主要经胆汁排泄的外源化学物。 ③ 其他排泄途径:经呼出气、汗液、唾液以及乳汁参与排 泄有害化学物质,但比起上述经尿和经胆汁排泄来说重要 性相对小些。但对饮奶的婴幼儿来说,乳汁还是重要的, 牛奶甚至人奶可能含有药物、农药以及环境污染物,曾经 在美国引起集体性(非细菌性)食物中毒。目前我国还少 有对乳类的这方面的系统检测与研究。
食品安全性独理学评价和危险度评价课件

亚慢性毒性评价
评估物质长时间低剂量暴露的 毒性,包括90天喂养实验等
。
慢性毒性评价
评估物质长期低剂量暴露对人 体的潜在危害,通常需要更长 时间和更大范围的动物实验。
致癌性评价
评估物质是否具有致癌性,通 常采用动物实验和流行病学调
查等方法。
毒理学评价的限制和挑战
限制
动物实验不能完全预测人体反应,不同物种间存在差异;实验条件与实际生活 条件存在差异;实验结果受多种因素影响,如剂量、暴露时间等。
食品接触材料安全性评价
要点一
食品接触材料安全标准
制定和实施食品接触材料安全标准,规范食品接触材料的 使用。
要点二
食品接触材料安全性评估
对食品接触材料进行毒理学评价和危险度评价,确保其安 全性。
01
食品安全性毒理学 评价和危险度评价
的未来发展
新技术与方法的应用
人工智能与大数据分析
代谢组学
利用人工智能和大数据技术对大量毒 理学数据进行处理和分析,提高评价 的准确性和效率。
通过观察实验动物在短时间内摄入高剂量化学物质后的反应,评估该物质的急性 毒性。实验通常采用单次或短期多次给药,观察动物在24小时内或一周内的反应 。
亚慢性毒性评价
亚慢性毒性评价旨在评估食品中化学物质在较长时间内的毒 性影响,通常为3个月或更长时间。
亚慢性毒性评价是在较长时间内观察实验动物摄入较低剂量 化学物质后的反应。实验期间,动物会持续接触化学物质, 并观察其生理、生化、代谢等方面的变化。
01
食品安全性毒理学 评价概述
定义与目的
定义
食品安全性毒理学评价是对食品 中潜在有害物质进行科学评估的 过程,旨在评估这些物质对人体 健康的潜在危害。
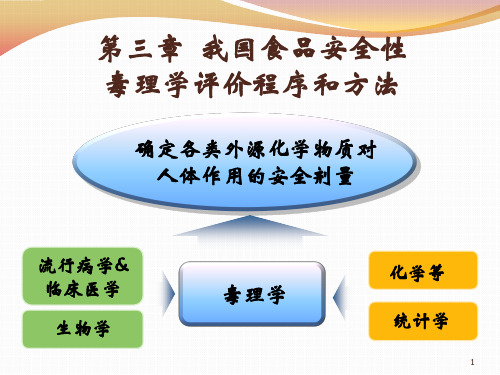
食品毒理学_我国食品安全性评价程序和方法PPT参考课件
结
定
果
判
进行食品安全性评价 时需要考虑的因素
7
一.食品安全性毒理学评价 试验的方法与目的
准备工作
收集其基本材料 了解其使用情况 选用合适的形式 收集相关资料
第一阶段
试验的目的 试验的设计 LD50的计算方法 试验的局限性
第二阶段
遗传毒性试验 传统致畸试验 30天喂养试验
确定各类外源 化学物质对人 体作用的安全 剂量
(+)排除
(-)接受
食品安全性评估的决定树分析 2
食品安全性评估的决定树分析
+:毒性不可接受 -:不表示毒性不可接受 ?:证据不足 S:已知代谢途径并且安全 U:代谢途径未知
3
一. 食品安全性毒理学评价试验四 个阶段的内容
1.第一阶段:急性毒性试验 2.第二阶段:遗传毒性试验、传统致畸试
14
③
②
①
细菌回复 突变试验
哺乳动 物细胞 基因突 变试验
微核 试验
④
⑤
精子畸 形分析 显性致
死试验
15
(3)试验结果判定:
从以下a、b、c三个选项中各选择一项进行试验:
选项 编号
a
备选试验名称
①
鼠
伤
寒
沙门
氏
菌
/
体内 哺试乳验动
物
微
体外 粒试体验酶
试
验
(Ames试验);②V79/HGPRT基因突变试验。
若试验中发现明显的毒性作用,尤其是有 明显的剂量-反应关系(具有蓄积效应)时, 则考虑进一步的毒性试验。
21
被检物质(定性) 暴露分析(定量)
急性毒性
(+)排除
食品毒物的一般毒性作用课件完整版

功能蓄积(functional accumulation) 多次染毒使半数动物出现效应(或死亡)的累
量组动物的死亡数。 亚慢性毒性试验的设计
② 根据确定的剂量组进行染毒。 大鼠、大型动物——隔夜禁食;
分析中毒死亡时间的规律具有一定意 大鼠、大型动物——隔夜禁食;
外观体征、行为活动、体重、食物利用率、中毒症状
优先考虑白色家兔。而急性吸入毒性试验和经口急性 数剂量,依此类推直至最高剂量组,查各自的反对数即得
受试物在贮存期内稳定性和在饲料中的稳定性必须进行研究并
观察记录每组动物死亡数。
毒性试验则优先考虑大鼠。 大鼠1~4ml/200g,不超过5ml/只
亚慢性毒性(subchronic toxicity)是指人或实验动物连续多日(通常1~3个月)重复接触外源化学物所引起的毒性效应。 研究受试物亚慢性和慢性毒性损害的可逆性;
第一节 概述
一、一般毒性研究的特点和发展趋势
1.最终目标:证明食品中某种化学、生物或物理因素的毒性 和危险性。
2.主要手段: 体内试验(in vivo test)--在实验动物模型上进行 体外试验(in vitro test)--在微生物、人工培养的 细胞或组织或器官上进行。
3.发展趋势: 动物用量少、动物痛苦小、开发体外替代试验; 在传统长期毒性试验中附加额外或特殊毒性观测内容 。
6.实验动物的预检: 第一阶段:急性毒性试验(致死和非致死)
测得的LD50仅仅是一个近似值 急性毒性参数
– 选择健康动物 多次染毒使半数动物出现效应(或死亡)的累
③ 根据预试验的死亡资料确定组距。
–1~2周的检疫期 积剂量[ED50(n)]与一次染毒使半数动物出现相
计量资料:一般用t检验 大鼠1~4ml/200g,不超过5ml/只
量组动物的死亡数。 亚慢性毒性试验的设计
② 根据确定的剂量组进行染毒。 大鼠、大型动物——隔夜禁食;
分析中毒死亡时间的规律具有一定意 大鼠、大型动物——隔夜禁食;
外观体征、行为活动、体重、食物利用率、中毒症状
优先考虑白色家兔。而急性吸入毒性试验和经口急性 数剂量,依此类推直至最高剂量组,查各自的反对数即得
受试物在贮存期内稳定性和在饲料中的稳定性必须进行研究并
观察记录每组动物死亡数。
毒性试验则优先考虑大鼠。 大鼠1~4ml/200g,不超过5ml/只
亚慢性毒性(subchronic toxicity)是指人或实验动物连续多日(通常1~3个月)重复接触外源化学物所引起的毒性效应。 研究受试物亚慢性和慢性毒性损害的可逆性;
第一节 概述
一、一般毒性研究的特点和发展趋势
1.最终目标:证明食品中某种化学、生物或物理因素的毒性 和危险性。
2.主要手段: 体内试验(in vivo test)--在实验动物模型上进行 体外试验(in vitro test)--在微生物、人工培养的 细胞或组织或器官上进行。
3.发展趋势: 动物用量少、动物痛苦小、开发体外替代试验; 在传统长期毒性试验中附加额外或特殊毒性观测内容 。
6.实验动物的预检: 第一阶段:急性毒性试验(致死和非致死)
测得的LD50仅仅是一个近似值 急性毒性参数
– 选择健康动物 多次染毒使半数动物出现效应(或死亡)的累
③ 根据预试验的死亡资料确定组距。
–1~2周的检疫期 积剂量[ED50(n)]与一次染毒使半数动物出现相
计量资料:一般用t检验 大鼠1~4ml/200g,不超过5ml/只
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.4 致突变、致癌、致畸
DNA加合物的形成:如黄曲霉毒素B1
3.4 致突变、致癌、致畸
DNA加合物的形成:黄曲霉毒素B1
3.4 致突变、致癌、致畸
DNA加合物的形成:如苯并芘
3.4 致突变、致癌、致畸
DNA加合物的形成:如苯并芘
3.4 致突变、致癌、致畸
DNA加合物的形成
共同点: 形成氧化物再攻击DNA。
3.4 致突变、致癌、致畸
P145细菌回复突变试验(Ames试验)
Ames实验法是利用组氨酸缺陷的鼠伤寒沙门氏菌的 突变株(His-)为测试指示菌,观察其在受试物 作用下回复突变为野生型的一种测试方法。
组氨酸缺陷型的鼠伤寒沙门氏菌在缺乏组氨酸的培 养基上不能生长。但在加有致突变原的培养基上 培养,则可使突变型产生回复突变成为野生型, 即恢复合成组氨酸的能力,于是就能在缺乏组氨 酸的培养基上生长为菌落,通过计数菌落出现的 数目就可以估算受试物诱变性的强弱。
3.2 蓄积毒性作用
有的化学物质进入机体后虽然贮存在体内的数量极 微,甚至不能检出,但会引起机体的功能或形态 结构发生一定程度的改变,如果是一种不可逆的 变化,或在机体修复过程完成前该化学物又第二 次进入机体并再次造成损害,则这种功能或形态 变化也可逐渐积累,即功能蓄积,是一种慢性中 毒现象。
3.3 亚慢性、慢性毒性作用
第三章 毒性作用及其评价
3.1 急性毒性试验(acute toxicity test)
• 剂量-反应关系
• (Dose-response
relationship)
• 剂量: 剂量是指化学毒物的摄 入量(mg)。
• 反应: 动物的死亡数或者炎症 等外观形态改变(靶器官、靶 组织等)
3.1 急性毒性试验(acute toxicity test)
剂量-反应关系(Doseresponse relationship)
在一定的剂量范围内,同一 种物质的毒效应随着剂量 的增加,显示出相应的规 律性变化,称为毒性物质 的剂量–—效应关系。
3.1 急性毒性试验(acute toxicity test)
• 剂量-反应关系
• (Dose-response
3.2 蓄积毒性作用 大多数外来化学物质进入机体后,经过复杂的生物
转化和生物转运过程,最后将从体内消除。
如果一种外来化学物质反复多次进入机体而且其前 次进入剂量尚未完全消除,则这一化学物在体内 的总量将不断增加并贮留,这种现象称为化学物 的蓄积作用(生物半减期:体内消除一半所需时 间)。
贮存库:骨骼组织、脂肪组织等。
3.4 致突变、致癌、致畸
细菌回复突变试验(Ames试验)
鼠伤寒沙门氏菌(Hiቤተ መጻሕፍቲ ባይዱ+)
正向突变 回复突变
鼠伤寒沙门氏菌(His-)
代谢活化系统 受试物
3.4 致突变、致癌、致畸
细菌回复突变试验(Ames试验)
3.4 致突变、致癌、致畸
细菌回复突变试验(Ames试验)
检测系统中还包括大鼠的肝微粒体酶(S9)体外代 谢活化系统(产生细胞色素P450),使受试物在 体外受到与活体内似的氧化活化作用,故可测出 间接诱变原。
(2)短期癌症生物分析
上述慢性动物致癌实验人力物力与时间都耗费较大,因此短 期癌症生物分析试验就有独到之处。美国等国家已将两种 转基因模型Tg.AC小鼠模型和P53小鼠模型用作该类实验。
• 多阶段:
3.4 致突变、致癌、致畸
• P156-158 外源化学物的致癌作用
3.4 致突变、致癌、致畸
P159 化学致癌活性实验
(1)慢性动物试验
通常以饲养实验动物来完成,需要每个性别的动物50-100个, 培养时间通常大鼠为2年,小鼠为1.5年,实验结束后要对 所有的组织器官进行病理学检查。
• 菌株: 我国新药审批办法规定使用TA97、TA98、 TA100、TA102四种菌株,经检定符合要求,-80度 或液氮冻存备用。
3.4 致突变、致癌、致畸
• P156-158 外源化学物的致癌作用
• 多个基因:前癌基因、肿瘤抑制基因、程序性死 亡有关的基因、肿瘤易感基因等。
• 多因素:基因、器官来源、组织类型、多种环境 致癌物、致癌因子或条件可协同作用、个体的不 同遗传背景
relationship)
• LD50:指供试动物经 口一次或在24h内多 次染毒,能引起半 数试验动物死亡的 剂量,单位为mg/kg 体重。
3.1 急性毒性试验(acute toxicity test)
剂量-反应关系(Dose-response relationship)
半致死剂量(LD50)与毒性分级
3.4 “三致”作用:致突变、致癌、致畸
生物分子
DNA的自我复制:保持遗传信息; RNA的转录与翻译:遗传信息的表达。
毒物可以与DNA、RNA反应或者修饰DNA、RNA 后果是:
后代遗传信息改变或者细胞生长和分化改变
3.4 致突变、致癌、致畸
P139
基因突变:碱基置换、移码、大段损伤 染色体畸变: 染色体数目异常
亚慢性毒性作用是指试验动物连续多日接触较大剂 量的外来化学物所出现的中毒效应。
上限小于急性毒性LD50 30天-90天实验 通常连续接触外来化学物3个月,其毒性效应往往与
再延长接触时间所表现的毒性效应基本相同,而 不必再延长期限。
• 慢性毒性作用是指以低剂量外来化学物长期给予 试验动物接触,其对试验动物产生的慢性毒性。
• 生命大部分时间或终身接触
3.3 亚慢性、慢性毒性作用
毒效应:免疫抑制、酶 活抑制、脂质过氧化、 生物大分子的结合反 应(靶分子、生物学 标志)、肿瘤(靶组 织、靶器官)的形成 等。
毒效应-剂量关系:
最低有害作用水(LOAEL)
• 名词解释: 剂量-反应关系 急性毒性作用 慢性毒性作用 毒效
应 靶器官 生物学标志 LD50 NOAEL LOAEL
P141:以DNA为靶的损伤机理 P142:DNA-蛋白质交联物形成
3.4 致突变、致癌、致畸
P144:突变的后果
作用于体细胞:
体细胞突变的后果:肿瘤、畸形、动脉粥样硬化、糖尿 病、衰老等,但最受重视的是肿瘤。
作用于生殖细胞:
①对机体没有影响,②导致对健康无影响的正常人体生 化组成的遗传变异;③导致遗传易感性的改变;④导 致遗传性疾病;⑤致死性突变,造成配子死亡、死胎 及自发流产等。
