国家药品监督管理局公告2019年第71号——国家药监局关于修订丹参川芎嗪注射液说明书的公告
丹参川芎嗪注射液与丹红注射液治疗脑梗死的疗效对比研究

2013:680. [2] 孙海波,张英泽.PFNA 治疗老 年 股 骨 转 子 间 骨 折 围 手 术 期 隐
性 失 血 量 分 析 [J].中 国 骨 与 关 节 外 科 ,2014,7(6):494497. [3]SehatKR,EvansR,NewmanJH.How muchbloodisreally
(收 稿 日 期 :20180813)
丹参川芎嗪注射液与丹红注射液治疗脑梗死的疗效对比研究
张静瑶
脑梗死患者生存时间和预后与患者脑组织微 血管密度具有明显正相关,脑组织 缺血 区 周边微 血 管密 度 大 小 直 接 影 响 患 者 生 存 期 及 预 后 。 [1,2] 因 此,增强缺血病变区血管再 生能力 可作 为 治疗脑 梗 死、改善患者脑组织血液 供 应 的 良 好 途 径 。 [3] 而 注 射类中药制剂因其高效的生物利用度及吸收迅速 等优点而得到广泛应用。为 更好的治 疗疾 病、改 善 患者预后,笔者对丹参川芎嗪注射液 与丹 红注射 液 治疗脑梗死的临床效果进 行 了对比 研 究,现 将结 果 分析如下。 1 资 料 与 方 法 1.1 临 床 资 料:选 择 2015 年 6 月 至 2017 年 6 月 在中国飞机强度研究所职工医院内科接受治疗的 240例脑梗死患者作为研 究对象,患者 均 符 合 1995 年第四届脑血管病学术会议中制定有关脑梗死的 诊断 标 准[4],且 经 脑 部 CT 或 (和 )磁 共 振 成 像
山 西 医 药 杂 志 2018 年 11 月 第 47 卷 第 21 期 ShanxiMedJ,November2018,Vol.47,No.21
DOI:10.3969/j.issn.02539926.2018.21.033 作者单位:710065 西 安,中 国 飞 机 强 度 研 究 所 职 工 医 院
丹参川芎嗪注射液的临床应用

丹参川芎嗪注射液的临床应用发表时间:2012-10-17T15:57:04.983Z 来源:《医药前沿》2012年第16期供稿作者:汪燕邵建兵[导读] 丹参川芎嗪注射液作为以活血化瘀为主要功效的单体中成药,应用范围广泛,可探讨开发在其他科的应用。
汪燕邵建兵(江苏省如皋市人民医院药剂科江苏如皋 226500)【摘要】目的探讨丹参川芎嗪注射液在临床各科应用后的疗效以及病理药理依据。
方法收集丹参川芎嗪注射液在本院心血管内科、神经内科、内分泌科、呼吸科、骨科的临床资料,结合药理病理学,总结出丹参川芎嗪在临床各科应用的具体疗效和理论根据。
结论丹参川芎嗪注射液作为以活血化瘀为主要功效的单体中成药,应用范围广泛,可探讨开发在其他科的应用。
【关键词】丹参川芎嗪活血化瘀微循环【中图分类号】R969 【文献标识码】A 【文章编号】2095-1752(2012)16-0022-02丹参川芎嗪注射液为中药复方制剂,其组分为盐酸川芎嗪(化学名称为:2, 3,5, 6-四甲基吡嗪盐酸盐)、丹参素(化学名称为:β-(3,4-二羟基苯基乳酸)。
二者联合有抗血小板聚集, 扩张冠状动脉,降低血液粘度,加速红细胞的流速,改善微循环,并具有抗心肌缺血和心肌梗死的作用;降血脂,抗凝及调整血管舒缩功能等。
适用于闭塞性脑血管疾病,如脑供血不全; 脑血栓形成;脑栓塞及其他缺血性心血管疾病,如冠心病的胸闷、心绞痛、心肌梗塞、缺血性中风、血栓闭塞性脉管炎等症。
具体应用如下:1、脑血管疾病1.1 急性脑梗死中医称脑梗死为缺血性中风,气滞血瘀是本病的主要病理机制之一。
现代研究根据本病血液流变学异常,以稠黏为特征,血小板活性亢进、聚集、黏附功能异常,结合CT病灶部位,大小等情况,形成了本病病因病机的瘀血论,为活血化瘀法在本病治疗过程中的广泛应用提供了理论依据。
丹参川芎嗪是目前临床上应用较多的活血化瘀药之一,具有改善微循环,促进纤维蛋的溶解,降低全血粘滞度,改善血液流变学及微循环障碍,降血脂,抗动脉粥样硬化[1],抗血小板凝集和解聚,扩张小动脉,抗缺血后再灌注和炎性损伤和活血化瘀作用。
国家药品监督管理局关于修订柴胡注射液说明书的公告

国家药品监督管理局关于修订柴胡注射液说明书的公告
【法规类别】药品管理
【发文字号】国家药品监督管理局公告2018年第26号
【发布部门】国家药品监督管理局(已变更)
【发布日期】2018.05.23
【实施日期】2018.05.23
【时效性】现行有效
【效力级别】XE0303
国家药品监督管理局关于修订柴胡注射液说明书的公告
(国家药品监督管理局公告2018年第26号)
根据药品不良反应监测和安全性评价结果,为进一步保障公众用药安全,国家药品监督管理局决定对柴胡注射液说明书增加警示语,并对【不良反应】【禁忌】【注意事项】等项进行修订。
现将有关事项公告如下:
一、柴胡注射液生产企业应依据《药品注册管理办法》等有关规定,按照柴胡注射液说明书修订要求(见附件),提出修订说明书的补充申请,于2018年7月31日前报省级食品药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。
在补充申请备案后6个月内对已出厂的药品说明书及标签予以更换。
柴胡注射液生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好柴胡注射液临床使用和安全性问题的宣传培训,指导医师合理用药。
二、临床医师应当仔细阅读柴胡注射液说明书的修订内容,在选。
国家食品药品监督管理局关于修订丹香冠心注射液说明书的通知

国家食品药品监督管理局关于修订丹香冠心注射液说明书的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2009.01.04•【文号】国食药监注[2009]2号•【施行日期】2009.01.04•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于修订丹香冠心注射液说明书的通知(国食药监注[2009]2号)各省、自治区、直辖市(药品监督管理局):根据丹香冠心注射液不良反应监测情况,国家局组织对丹香冠心注射液说明书进行了修订,并征求有关方面的意见。
现将丹香冠心注射液说明书样稿予以公布(见附件)。
请通知辖区内有关药品生产企业,按照要求尽快修订说明书和标签,并将修订的内容及时通知相关医疗机构、药品经营企业等单位。
附件:丹香冠心注射液说明书样稿国家食品药品监督管理局二○○九年一月四日附件:丹香冠心注射液说明书样稿核准日期:修改日期:丹香冠心注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:丹香冠心注射液汉语拼音:Danxiang Guanxin Zhusheye【成份】丹参、降香。
【性状】本品为棕色的澄明液体。
【功能主治】活血化瘀,理气止痛。
用于冠心病心绞痛、心肌梗死属瘀血闭阻证。
【规格】每支装(1)2ml (2) 10ml【用法用量】1.肌内注射,一次2~4ml,一日1~2次;2.静脉注射,一次4ml,用50%葡萄糖注射液20ml稀释后应用,一日1次。
3.静脉滴注,一次10~16ml,用5%葡萄糖注射液100~500ml稀释后应用,一日1次。
【不良反应】1. 偶见皮疹、皮肤红肿、瘙痒、恶心、呕吐、寒战、发热、头晕、头痛、腹痛、腹泻、心悸等,可引起严重过敏反应,表现为过敏性休克、呼吸困难、喉水肿等。
2.偶见局部静脉炎。
【禁忌】1.孕妇及哺乳期妇女禁用。
2.对本品过敏者禁用。
【注意事项】1.本品不得与其他药物混合注射使用。
国家药监局关于修订风寒感冒颗粒、穿心莲注射液药品说明书的公告节选[发布时间:2023-11-22]
![国家药监局关于修订风寒感冒颗粒、穿心莲注射液药品说明书的公告节选[发布时间:2023-11-22]](https://img.taocdn.com/s3/m/ca0aef847e192279168884868762caaedd33ba3e.png)
国家药监局关于修订风寒感冒颗粒、穿心莲注射液药品说明书
的公告节选[发布时间:2023-11-22]
佚名
【期刊名称】《中老年保健》
【年(卷),期】2024()3
【摘要】风寒感冒颗粒说明书修订要求【警示语】项应当增加:本品含麻黄,运动员慎用。
【禁忌】项应当增加:对本品及所含成分过敏者禁用。
三、【不良反应】项应当增加:监测显示,风寒感冒颗粒可见以下不良反应报告。
【总页数】1页(P6-6)
【正文语种】中文
【中图分类】R28
【相关文献】
1.国家药监局关于修订抗病毒糖浆、胶囊、软胶囊、丸(浓缩丸)、滴丸、片、泡腾片、阻嚼片、口服液、颗粒药品说明书的公告[2021年第117号,发布时间:2021-10-12]
2.国家药监局关于修订肺力咳合剂(胶囊)药品说明书的公告
3.国家药监局关于修订小儿化痰止咳制剂药品说明书的公告(2022年第24号)
4.国家药监局关于修订质子泵抑制剂类药品说明书的公告
5.国家药监局关于修订康妇消炎栓、蛇胆川贝制剂药品说明书的公告
因版权原因,仅展示原文概要,查看原文内容请购买。
修订两种中药注射剂说明书,限制使用机构

标准化建设的村卫生站宽敞明亮、配备齐全,村民每次拿药看病只要1元钱;乡村医生都是有编制的大学毕业生,技术水平高,年均收入达23.5万元;区、镇、村三级人才可双向流动,区医镇用、镇医村用……广东6月7日,广东省卫计委和人社厅等部门联合在花都市召开全省基层卫生综合改革推进现场会。
从会上获悉,广东将在全省推广基层医改的“花都模式”。
广东省卫计委主任段宇飞表示,诞生于广东深圳的“罗湖模式”是城市医改的主要方向,而“花都模式”则是基层据花都区卫计局局长曹扬介绍,2018年,花都将乡山东:放开30项医疗服务价格,医疗机构可自主定价为充分发挥市场在资源配置中的决定性作用,满足人民群众多层次多样化的医疗服务需求,山东省物价局、卫计委、人力资源社会保障厅联合发文,自6月15日起放开公立医疗机构30项医疗服务项目价格,由医疗机构自主制定价格。
此次放开的项目主要为市场竞争充分和个性化需求较强的特需医疗服务项目价格,共涉及13个大类(详细项目名单请扫码阅读)。
但“放开”不等于“放任”,文件特别强调,医疗机构要建立健全医码上看扫一扫,看全文扫一扫,看全文修订两种中药注射剂说明书,继5月29日发布《关于修订柴胡注射液说明书的公告》后,6月11日和12日,国家药品监督管理局接连发布公告,对双黄连注射剂和丹参注射剂也作出修订说明书的要求。
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对双黄连注射剂〔双黄连注射液、注射用双黄连(冻干)、双黄连粉针剂〕和丹参注射剂〔丹参注射液、注射用丹参(冻干)、丹参滴注液〕说明书增加警示语,并对“不良反应”“禁忌”和“注意事项”项进行修订。
警示语内容应包括:本品不良反应包括过敏性休克,应在有抢救条件的医疗机构使用,使用者应接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治。
双黄连注射剂山西太原:十方面发力,推进医养结合据山西省太原市卫计委6月4日消息,太原市卫计委、太原市民政局联合出台2018年医养结合工作行动方案,确定今年医养结合工作将从10个方面加大力度,以实际行动发挥好全国第一批医养结合试点市的带头引领作用。
卫生部、国家食品药品监督管理局、国家中医药管理局关于进一步加

卫生部、国家食品药品监督管理局、国家中医药管理局关于进一步加强中药注射剂生产和临床使用管理的通知
【法规类别】卫生综合规定
【发文字号】卫医政发[2008]71号
【发布部门】卫生部(已撤销)国家食品药品监督管理局(原国家药品监督管理局)(已撤销)国家中医药管理局
【发布日期】2008.12.24
【实施日期】2008.12.24
【时效性】现行有效
【效力级别】部门规范性文件
卫生部、国家食品药品监督管理局、国家中医药管理局
关于进一步加强中药注射剂生产和临床使用管理的通知
(卫医政发〔2008〕71号)
各省、自治区、直辖市卫生厅局、食品药品监督管理局(药品监督管理局)、中医药管理局,新疆生产建设兵团卫生局、食品药品监督管理分局:
近年来,“鱼腥草注射液”、“刺五加注射液”、“炎毒清注射液”、“复方蒲公英注射液”、“鱼金注射液”等多个品种的中药注射剂因发生严重不良事件或存在严重不良反应被暂停销售使用。
为保障医疗安全和患者用药安全,现就进一步加强中药注射剂生产和临床使用管理有关问题通知如下:
一、加强中药注射剂生产管理、不良反应监测和召回工作
(一)药品生产企业应严格按照《药品生产质量管理规范》组织生产,加强中药注射剂生产全过程的质量管理和检验,确保中药注射剂生产质量;应加强中药注射剂销售管理,必要时应能及时全部召回售出药品。
(二)药品生产企业要建立健全药品不良反应报告、调查、分析、评价和处理的规章制度。
指定专门机构或人员负责中药注射剂不良反应报告和监测工作;对药品质量投诉和药品不良反应应详细记录,并按照有关规定及时向当地药品监督管理部门报告;对收集的信息及时进行分析、组织调查,发现存在安全隐患的,主动召回。
(三)药品生产企业应制。
多种中药注射剂被限制使用

多种中药注射剂被限制使用作者:杨丽萍来源:《百姓生活》2019年第04期近年来,中药注射剂的安全问題引起了国家层面的注意。
根据国家药品监督管理局发布的《国家药品不良反应监测年度报告(2017年)》,中药注射剂是引起不良反应的重灾区,这为中药注射剂的安全性敲响警钟。
2018年,已有多款中药注射剂,被国家药监局要求修改说明书,禁用于新生儿、儿童或孕妇。
说明书修改:【禁忌】项目中需注明“儿童禁用”。
缘起于20世纪40年代的柴胡注射液,是我国第一个中药注射剂。
当时正值抗战时期,药品匮乏,柴胡熬成汤剂,被进一步以煎煮蒸馏方式制成针剂,用于治疗感冒、疟疾等引起的发热。
在那个特殊时期,它起到了一定作用。
在将近80年的使用过程中,它一直被当作感冒退烧的特效药。
同时,关于其不良反应的研究报道也陆续出现。
此次,国家药监局修改柴胡注射液说明书,明确提出儿童禁用,并增加了过敏、休克等不良反应。
根据我国药品监督管理局数据统计,目前我国柴胡注射剂的批准文号共计77个,涉及数十家企业。
说明书修改:【禁忌】项中须列出“4周岁及以下儿童、孕妇禁用”,并增加警示语“本品不良反应包括过敏性休克”。
双黄连注射剂是我国最早批准的中药注射液品种之一,其主要成分为金银花、黄芩、连翘提取物,用于治疗发热、咳嗽、咽痛等。
在不少基层医疗机构里,双黄连注射剂一度成为治疗儿童感冒发热初期的首选药物。
然而,双黄连注射剂的不良反应似乎从未停止。
在中国知网(CNKI)文献数据库在线检索篇名中含“双黄连注射剂”关键字后发现,搜索出88条结果都是关于其不良反应的报道和研究。
其中有一篇发表在《中国药房》上的文章对双黄连注射剂致27例患者死亡文献进行了分析,其中,22例患者死于过敏性休克。
可是在双黄连注射剂之前的药品说明中,“用药禁忌”一栏只有四个字:“尚不明确”。
其实,这款曾经在基层受欢迎的中药注射剂,在2017年人社部网站公布的新版医保药品目录中,被限制为二级以上医院才有资格用。
丹参川芎嗪注射液

• 配伍用药:单独使用,避免配伍;
丹参川芎嗪注射液
❖ 丹参川芎嗪注射液的有效成分具备全面而广泛的基础药理学研究,是当前中药植物药研究中作用机理最明确的药
物,最具化学药物的药理特征,也是中药现代化的最大亮点之一;
丹参川芎嗪注射液
丹参川芎嗪注射液
❖ 丹参川芎嗪注射液是采用当前祖国医学中基础药理作用研究最全面、有效成分药理机制研究最透彻、临床疗效公认最确切的植物化学单 体药丹参素和盐酸川芎秦经过科学配伍研制成的新一代植物化学单体药物;
❖ 丹参川芎嗪注射液也是我国植物药中对心脑血管疾病多层次、多靶点、全方位药理作用、药代指征动力学 研究比较清晰的植物药注射制剂。
6、膜再生性能和使用寿命 陶瓷膜系统通过简便的清洗,即可在短时间内完全恢 复膜性能,膜再生性能极强,且清洗成本低。陶瓷膜 使用寿命长,
7、制作材质及规范要求 膜及辅助材质均为无污染材料,现场清洁卫 生,可有效降低工人劳动强度,符合FDA(
或GMP)规范要求。
8、工艺设计及控制 工艺由资深的工艺设计师设计,系统规范合 理,可实现自动控制,更可根据用户具体要 求,实现手动控制和自动控制的简便转换
复方药 成分复杂 原料药达标即可 不确切 混合物 不可控制 不稳定
丹参川芎嗪注射液
❖ 药物有效成分的生物学活性更能充分发挥,尤其是在慢性疾病的治疗中;
❖ 成分的多元化以及药理作用的多样性避免病变治疗带来的局限;
❖ 用现代医药学理论方法和质控标准验证了传统医学的综合施治精髓;
❖ 有效避免了药物ADR的发生;
❖ 高血压病(约占非栓塞性脑血管病的55~75%
国家药品监督管理局关于修订丹参注射剂说明书的公告

Rituxan获美国FDA批准,
成为寻常型天疱疮(PV)首个生物疗法
近期,美国食品药品管理局(FDA)已批准美罗华(Rituxan,通用名:利妥昔单抗)用于中度至重度寻常型天疱疮(PV)成人患者的治疗。
此次批准,使Rituxan成为FDA批准治疗PV 的首个生物疗法,标志着PV临床治疗方面60多年来首个重大进展。
Rituxan是一种治疗性单克隆抗体,靶向结合正常和恶性B细胞表面的CD20抗原,随后调动人体天然防御,攻击和杀死被标记的B细胞。
此次批准,是基于临床研究Ritux 3的数据。
该研究是一项前瞻性、多中心、随机、平行组、开放标签研究,在90例新诊断的中度至重度PV患者中开展。
研究中,患者随机分成两个方案组:①CS标准剂量方案组;②Rituxan联合剂量逐渐降低的短期低剂量口服CS方案组。
研究的主要终点是在不使用类固醇2个月或更长时间的情况下在治疗第24个月实现完全缓解(定义为完全上皮化且没有新的和/或已形成的病灶)。
研究结果显示,Rituxan大幅提高了PV缓解率,同时成功减少和/或停止了。
国家食品药品监督管理局关于开展中药注射剂安全性再评价工作的通知

国家食品药品监督管理局关于开展中药注射剂安全性再评价工作的通知【法规类别】中药管理【发文字号】国食药监办[2009]28号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2009.01.13【实施日期】2009.01.13【时效性】现行有效【效力级别】XE0303国家食品药品监督管理局关于开展中药注射剂安全性再评价工作的通知(国食药监办〔2009〕28号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):中药注射剂是我国中医药文化的组成部分,是现代中医药创新取得的成果,已经成为临床疾病治疗的独特手段,正在发挥不可替代的作用。
近年来,随着我国药品研制和生产技术水平的提高,已上市中药注射剂存在的一些问题日益受到重视,相应技术要求有了较大提高。
为进一步提高中药注射剂安全性和质量可控性,国家局决定在全国范围内开展中药注射剂安全性再评价工作。
现将《中药注射剂安全性再评价工作方案》印发给你们,请遵照执行。
工作中如有问题,请及时向国家局反馈。
附件:中药注射剂安全性再评价工作方案国家食品药品监督管理局二○○九年一月十三日附件:中药注射剂安全性再评价工作方案根据《药品管理法》第三十三条和《药品管理法实施条例》第四十一条规定,国家局制定中药注射剂安全性再评价工作方案。
一、工作原则和目标按照“全面评价、分步实施、客观公正、确保安全”的原则,全面开展中药注射剂安全性再评价工作,通过开展中药注射剂生产工艺和处方核查、全面排查分析评价、有关评价性抽验、不良反应监测、药品再评价和再注册等工作,进一步规范中药注射剂的研制、生产、经营、使用秩序,消除中药注射剂安全隐患,确保公众用药安全。
二、工作任务目前,中药注射剂存在着安全风险,主要体现在基础研究不充分、药用物质基础不明确、生产工艺比较简单、质量标准可控性较差,以及药品说明书对合理用药指导不足、使用环节存在不合理用药等。
应结合辖区内中药注射剂药品生产的实际情况,深入具体地对每个品种、每个企业进行风险排查,找出存在的安全隐患;对中药注射剂的生产工艺和处方核查工作中发现的有关处方、生产工艺、药品标准、药品说明书等问题认真研究解决。
丹参川芎嗪注射液说明书请仔细阅读说明书并在医师指导下使
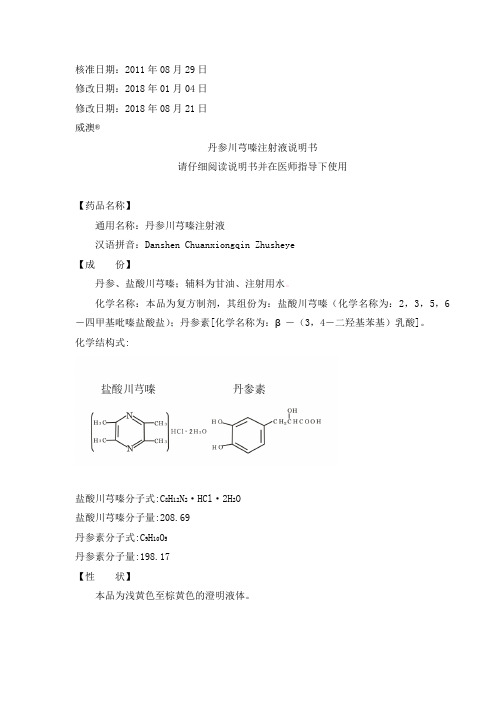
-四甲基吡嗪盐酸盐);丹参素[化学名称为:β -(3,4-二羟基苯基)乳酸]。 化学结构式:
盐酸川芎嗪分子式:C8H12N2·HCl·2H2O 盐酸川芎嗪分子量:208.69 丹参素分子式:C9H10O5 丹参素分子量:198.17 【性 状】
本品为浅黄色至棕黄色的澄明液体。
【适 应 症】 用于闭塞性脑血管疾病,如脑供血不全,脑血栓形成,脑栓塞及其他缺血性心血管
疾病,如冠心病的胸闷、心绞痛、心肌梗塞、缺血性中风、血栓闭塞性脉管炎等症。 【规 格】
5ml 【用法用量】
静脉滴注,用 5%~10%葡萄糖注射液或生理盐水 250ml~500ml 稀释,每次 5~10ml【药物相互作用】 不宜与碱性注射剂一起配伍。
【药物过量】 尚不明确。
【药理毒理】 有抗血小板聚集,扩张冠状动脉,降低血液粘度,加速红细胞的流速,改善微循环,
并具有抗心肌缺血和心肌梗死的作用。 【药代动力学】
尚不明确。 【贮 藏】
遮光,密闭,在阴凉处(不超过 20℃)保存。 【包 装】
玻璃安瓿装,5ml×5 支/盒。 【有 效 期】
暂定 24 个月 【执行标准】
WS-10001-(HD-1138)-2002-2017 【批准文号】
国药准字 H22026448 【生产企业】
企业名称:吉林四长制药有限公司 生产地址:吉林省梅河口市珠江路北段 邮政编码:135000 电话号码:0435-6918345 传真号码:0435-6918417
以下不良反应主要来自于丹参川芎嗪注射液上市应用后的国家药品不良反应监测 系统反馈数据。其它同类产品,说明书中亦有下列大多数的不良反应。包括:
磷酸盐酸川芎嗪注射制剂说明书修订要求-V1

磷酸盐酸川芎嗪注射制剂说明书修订要求-V1随着医学技术的发展与进步,药品更新日新月异,不断有新的药品和新的制剂问世,为了确保药品的使用安全和有效性,药品说明书是必不可少的。
而磷酸盐酸川芎嗪注射制剂说明书作为一种重要的药品说明书,也应该不断地更新与修订。
本文将从以下几点进行分析:1.法律法规的要求药品说明书的修订,首先要遵守国家的法律法规,如《药品管理法》、《药品注册管理办法》、《药品管理法实施条例》等相关法规。
这些法规明确规定了制剂的质量、安全性等要求,同时也规定了药品说明书的编写要求及其修订规范,因此制剂的说明书修订必须遵守这些法规。
2.药品的实际应用情况药品的使用情况是制剂说明书修订的重要依据。
必须根据药品的使用情况不断地调整、完善制剂说明书,使其更贴近实际应用场景,符合临床用药实践。
例如,针对药品在疾病治疗方面的新进展或新应用场景,需要更新药品的适应症、用法用量、注意事项等方面的内容。
3.药品研究实验的进展药品研究实验是药品修订的重要依据之一。
如研制、上市的新药品也要不断的进行药理学、安全性、效果等方面的研究,及时更新新的实验数据,完善药品说明书内容。
4.临床反馈及生产实践的总结制剂说明书的修订也要充分考虑临床实践和生产实践的反馈。
通过药品安全性监测、临床用药评价系统和药物不良反应监测体系等多种渠道获取临床反馈和意见,及时发现和处理意外反应和不良反应,提高药品的治疗效果,降低不必要的安全风险。
同时,还需结合实际生产生产实践,特别是批次不同的药品,根据不同的质量特征、相应的生产工艺路线,以不断提高药品的生产工艺及产品质量,优化药品说明书更新维护。
5.市场监管部门的监督要求制剂说明书的修订也要考虑市场监管部门的监督。
如要遵守《药品说明书标准》、《药品说明书编写指南》等规定基础上进行修订,确保说明书的质量、准确性和规范性符合相关的要求,满足市场监管部门的审核和审批要求,以保障市场公平竞争和消费者的权益。
国家药品监督管理局关于川参通注射液进行Ⅲ期临床试验的批复-药管注[1999]116号
![国家药品监督管理局关于川参通注射液进行Ⅲ期临床试验的批复-药管注[1999]116号](https://img.taocdn.com/s3/m/31ec9b2d66ec102de2bd960590c69ec3d5bbdb98.png)
国家药品监督管理局关于川参通注射液进行Ⅲ期临床试验的批复
正文:
---------------------------------------------------------------------------------------------------------------------------------------------------- 国家药品监督管理局关于川参通注射液进行Ⅲ期临床试验的批复
(药管注[1999]116号)
贵州省卫生厅:
你厅“关于申请中药二类新药川参通注射液进入Ⅲ期临床的报告”[黔卫药发(1998)第586号]收悉。
经研究,同意你厅意见,由中国中医药研究所西苑医院总牵头组织有关医院(见附件1、附件2)对该品种进行Ⅲ期临床试验。
请有关参与临床研究单位所在省药品监督管理局或卫生厅认真做好组织协调工作,以便顺利完成Ⅲ期临床试验研究。
临床研究方案由牵头医院组织修订后实施。
各有关医院在临床研究方案修订和临床试验时要关注安全性指标的考察。
认真按照《新药审批办法》及有关规定要求,做出科学评价。
附件1、Ⅲ期临床研究方案(略)
2、参与临床研究的有关单位(略)
国家药品监督管理局药品注册司
一九九九年三月十九日
——结束——。
四川升和药业丹参注射液存安全隐患

四川升和药业丹参注射液存安全隐患
佚名
【期刊名称】《绿色中国》
【年(卷),期】2013()24
【摘要】国家药监局表示:8月以来,四川升和药业生产的部分批次丹参注射液在多个省份,致多名患者用药后出现寒战、发热等不良事件。
目前,企业已全面停产并深入查找原因。
请使用该厂生产丹参注射液的患者务必注意!
【总页数】1页(P7-7)
【关键词】丹参注射液;安全隐患;药业;四川;国家药监局;生产;患者
【正文语种】中文
【中图分类】TQ461
【相关文献】
1.重庆正通药业有限公司、国家工商行政管理总局商标评审委员会与四川华蜀动物药业有限公司商标行政纠纷案 [J],
2.对四川升和药业男子乒乓球俱乐部推广与宣传对策的研究 [J], 金慧惠;谭东辉;
3.山东信得药业有限公司收购四川华西动物药业有限公司 [J], 无
4.山东信得药业有限公司并购四川华西动物药业有限公司 [J], 无
5.加强环境保护打造可持续发展的现代药业集团——记四川科伦药业股份有限公司 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家药品监督管理局公告2019年第71号——国家药监局关于修订丹参川芎嗪注射液说明书的公告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2019.08.29
•【文号】国家药品监督管理局公告2019年第71号
•【施行日期】2019.08.29
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局公告
2019年第71号
国家药监局关于修订丹参川芎嗪注射液说明书的公告
为进一步保障公众用药安全,国家药品监督管理局决定对丹参川芎嗪注射液说明书【不良反应】、【注意事项】等项进行修订。
现将有关事项公告如下:
一、所有丹参川芎嗪注射液生产企业均应依据《药品注册管理办法》等有关规定,按照丹参川芎嗪注射液说明书修订要求(见附件),提出修订说明书的补充申请,于2019年10月29日前报省级药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。
在补充申请备案后6个月内对所有已出厂的药品说明书及标签予以更换。
上述丹参川芎嗪注射液生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好使用和安全性问题的宣传培训,涉及用药安全的内容变更要立即以适当方式通知药品经营和使用单位,指导医师、药师合理用药。
二、临床医师、药师应当仔细阅读丹参川芎嗪注射液说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
三、患者应严格遵医嘱用药,用药前应当仔细阅读说明书。
特此公告。
附件:丹参川芎嗪注射液说明书修订要求
国家药监局
2019年8月29日。
