生化名词解释(生物化学)
生化名词解释

生物化学名词解释生物化学:生物化学是用化学的原理和方法,从分子水平来研究生物体的化学组成,及其在体内的代谢转变规律从而阐明生命现象本质的一门科学。
糖类化合物:多羟基醛或多羟基酮或其衍生物。
差向异构体:仅一个手性碳原子构型不同的非对映异构体。
旋光异构体:由于不对称分子中原子或原子团在空间的不同排布对平面偏振光的偏振面发生不同影响所产生的异构体。
αβ异头物:异头碳的羟基与最末的羟甲基是反式的异构体称α-异头物,具有相同取向的称β-异头物。
单糖:简单的多羟基醛或酮的化合物。
成脎反应:单糖的醛基或酮基与苯肼作用生成糖脎。
寡糖:由少数几个单糖通过糖苷键连接起来的缩醛衍生物。
多糖:由10个以上单糖单位构成的糖类物质。
血糖:是血液中的糖份,绝大多数为葡萄糖。
糖原:动物体内的储存多糖,相当于植物体内的淀粉。
脂质:脂肪酸与醇脱水反应形成的酯及其衍生物。
反式脂肪酸:不饱和的有机羧酸存在顺式和反式。
皂化值:完全皂化1g油脂所需KOH的毫克数。
碘值:100g油脂卤化时所能吸收的碘的克数,表示油脂的不饱和程度。
抗氧化剂:具有还原性、能抑制靶分子自动氧化的物质。
兼性离子:同时带有正电荷和负电荷的离子。
等电点:蛋白质或两性电解质(如氨基酸)所带净电荷为零时溶液的pH。
层析:基于不同物质在流动相和固定相之间的分配系数不同而将混合组分分离的技术。
蒽酮反应:蒽酮可以与游离的已糖或多糖中的已糖基、戊糖基及已糖醛酸起反应,反应后溶液呈蓝绿色,在620nm处有最大吸收。
谷胱甘肽:由L-谷氨酸、L-半胱氨酸和甘氨酸组成的三肽。
简单蛋白:仅由氨基酸组成。
结(缀)合蛋白:由简单蛋白与其它非蛋白成分结合而成。
蛋白质一级结构:以肽键连接而成的肽链中氨基酸的排列顺序。
蛋白质二级结构:肽链主链骨架原子的相对空间位置。
蛋白质超二级结构:若干相邻的二级结构单元按照一定规律有规则地组合在一起,彼此相互作用,形成在空间构象上可彼此区别的二级结构组合单位。
结构域:二级、超二级结构基础上形成的介于超二级结构和三级结构之间的局部折叠区,是一个特定区域。
生化名词解释

《生物化学》名词解释总结生物化学biochemistry生物化学即生命的化学,是一门研究生物体的化学组成、体内发生的反应和过程的学科。
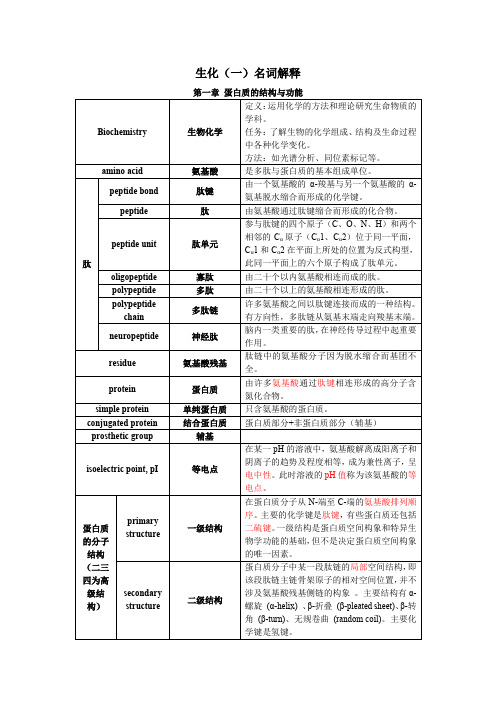
肽键peptide bond蛋白质分子中的主要共价键,是连接两个氨基酸的酰胺键,由一个羧基和一个氨基脱水缩合而成肽peptide氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。
一般含有几个到十几个以下的氨基酸组成的肽称为寡肽oligopeptide,由十几个以上的氨基酸组成的称为多肽poly peptide蛋白质的一级结构primary structure蛋白质的一级结构是指多肽链中氨基酸残基的排列顺序,包括形成二硫键的半胱氨酸残基的位置。
一级结构是蛋白质空间构象和生物学功能的基础,但不是决定其空间构象的唯一因素。
蛋白质的二级结构secondary structure蛋白质的二级结构是指多肽链中相邻的氨基酸残基形成的局部肽链空间结构,是主链原子的局部空间排列。
二级结构的形式包括α螺旋、β片层、β转角、π螺旋、随意卷曲等。
蛋白质的三级结构tertiary structure蛋白质的三级结构是指整条多肽链中所有氨基酸残基,包括相距甚远的氨基酸残基主链和侧链所形成的全部分子结构。
蛋白质的四级结构quaternary structure蛋白质的四级结构是指各具独立三级结构的多肽链再以各自特定的形式接触排布后,结集所形成的蛋白质最高层次空间结构。
超二级结构super secondary structure蛋白质分子中的一些二级结构单元,往往有规律地聚集在一起,形成相对稳定的超二级结构的基本形式(如αα、βββ、βαβ等),又称模体motif结构域structural domain单个或多个超二级结构进一步集结起来,形成的在蛋白质分子空间结构中明显可区分的区域,称为结构域,结构域同时又是蛋白质分子中分工的功能单位。
亚基subunit部分蛋白质分子由几条多肽链组成,每条多肽链都是其独立的三级结构,这些肽链再以各自特定形式接触排布后,形成蛋白质的四级结构,而这些具有独立三级结构的肽链称为亚基,亚基单独存在时不具有生物活性。
生化名词解释

Phototroph:光能自养生物:这是植物和一些带有色素的自养细菌如绿S细菌的类型,它们以无机的CO2为C源,以光能为能量来源,从而合成自身的有机物。
Chemotroph:化能自养生物:能氧化某种无机物并利用所产生的化学能还原二氧化碳和生成有机碳化物的一类微生物。
Metabolism:新陈代谢:生物体与外界环境之间的物质和能量交换以及生物体内物质和能量的转变过程叫做新陈代谢。
新陈代谢是生物体内全部有序化学变化的总称。
它包括物质代谢和能量代谢两个方面。
Catabolism:分解代谢:指机体将来自环境或细胞自己储存的有机营养物质分子(如糖类、脂类、蛋白质等),通过一步步反应降解成较小的、简单的终产物(如二氧化碳、乳酸、氨等)的过程,又称异化作用。
Anabolism: 合成代谢:又称同化作用或生物合成,是从小的前体或构件分子(如氨基酸和核苷酸)合成较大的分子(如蛋白质和核酸)的过程Coupled reaction: 耦合反应:体系若存在两个或两个以上反应,(a)、(b)、…,其中反应(a)单独存在时不能自动进行;若反应(a)至少有一个产物是反应(b)的反应物,并且(b)的存在使得反应(a)可以进行,这种现象叫做反应的耦合,所发生的反应即所谓的耦合反应。
Phosphoryl transfer potential: 磷酰转移势:Activated carrier:活化载体:Oxidation phosphorylation: 氧化磷酸化:是指在生物氧化中伴随着ATP生成的作用。
有代谢物连接的磷酸化和呼吸链连接的磷酸化两种类型。
Ligation reaction: 连接反应Ligation : 在双螺旋DNA单链上,连接缺口处两个相邻碱基形成磷酸二脂键(也可用于连接RNA 平末端连接)。
Oxidation-reduction reaction: 氧化还原反应(oxidation-reduction reaction, 也作redox reaction)是在反应前后元素的化合价具有相应的升降变化的化学反应。
生物化学名词解释

绪论1.生物化学(biochemistry):从分子水平来研究生物体(包括人类、动物、植物和微生物内基本物质的化学组成、结构,以及在生命活动中这些物质所进行的化学变化(即代谢反应)的规律及其与生理功能关系的一门科学,是一门生物学与化学相结合的基础学科。
2.新陈代谢(metabolism):生物体与外界环境进行有规律的物质交换,称为新陈代谢。
通过新陈代谢为生命活动提供所需的能量,更新体内基本物质的化学组成,这是生命现象的基本特征,是揭示生命现象本质的重要环节。
3.分子生物学(molecular biology):分子生物学是现代生物学的带头学科,它主要研究遗传的分子基础(分子遗传学),生物大分子的结构与功能和生物大分子的人工设计与合成,以及生物膜的结构与功能等。
4.药学生物化学:是研究与药学科学相关的生物化学理论、原理与技术,及其在药物研究、药品生产、药物质量控制与药品临床中应用的基础学科。
第一章糖的化学1.糖基化工程:通过人为的操作(包括增加、删除或调整)蛋白质上的寡糖链,使之产生合适的糖型,从而达到有目的地改变糖蛋白的生物学功能。
2.单糖(monosaccharide):凡不能被水解成更小分子的糖称为单糖。
单糖是糖类中最简单的一种,是组成糖类物质的基本结构单位。
3.多糖(polysaccharide):由许多单糖分子缩合而成的长链结构,分子量都很大,在水中不能成真溶液,有的成胶体溶液,有的不溶于水,均无甜味,也无还原性。
4.寡糖(oligosaccharide):是由单糖缩合而成的短链结构(一般含2~6个单糖分子)。
5.结合糖(glycoconjugate):也称糖复合物或复合糖,是指糖和蛋白质、脂质等非糖物质结合的复合分子。
6.同聚多糖(homopolysaccharide):也称为均一多糖,由一种单糖缩合而成,如淀粉、糖原、纤维素、戊糖胶、木糖胶、阿拉伯糖胶、几丁质等。
7.杂多糖(heteropolysaccharide):也称为不均一多糖,由不同类型的单糖缩合而成,如肝素、透明质酸和许多来源于植物中的多糖如波叶大黄多糖、当归多糖、茶叶多糖等。
生化名词解释

生物化学:主要是从分子水平研究生物体的化学组合及其在生命活动过程中化学变化的一门学科,又称生命的化学。
基因组:一个生物体的全部遗传信息,也就是DNA的总和。
基因组学:研究基因组的结构、功能及其相互关系的科学。
糖:是一类多羟基醛或多羟基酮及其锁缩聚物或衍生物的统称。
同多糖:是由同一种单糖缩合而成的,包括淀粉、糖原、纤维素等直链淀粉:是由D—葡萄糖通过a—1,4—糖苷键相连而成的线性分子支链淀粉:是由D—葡萄糖通过a—1,4—糖苷键连接成短链,并通过a—1,6—糖苷键相连形成分支。
糖原:是葡萄糖在动物体内的储存形式,只要存在于肝脏和肌肉中,分别称为肝糖原和肌糖原。
与碘作用呈紫红色或红褐色脂类:是脂肪和类脂的总称,难溶于水易溶于有机溶剂。
脂肪是甘油和3个脂肪酸生成的甘油酯。
类脂是结构或理化性质类似于脂肪的物质,包括磷脂、糖脂和类固醇等必需脂肪酸:亚油酸、亚麻酸是机体需要,但是在体内不能合成,必须由食物提供氨基酸的等电点:通过向溶液里加酸或加碱,使得氨基酸的羧基和氨基的电离倾向相等,即氨基酸呈电中性,此时溶液的PH值。
两性电离:氨基酸含有呈酸式电离的羧基和呈碱性电离的氨基,因此氨基酸是两性电解质,在一定PH溶液中都可电离成带正电荷或负电荷的基团。
肽:多个氨基酸通过肽键连接起来的分子肽键:是由一个氨基酸的a—羧基和另一个氨基酸的a—氨基缩合失去一分子水而形成蛋白质的一级结构:多肽链中氨基酸组成和排列顺序二级结构:蛋白质分子中由肽键平面的相对旋转构成的局部空间构象。
三级结构:指在二级结构的基础上,多肽链中相距较远的侧链通过相互作用进一步盘绕成特定的空间结构,其包括了主链和侧链所有原子的空间排布。
四级结构:多个亚基通过非共价键聚合在一起,形成特定空间构象的、具有生物学功能的蛋白质亚基:在四级结构中每一条具有三级结构的多肽链镰刀状细胞贫血:β链的N端第六个氨基酸残基由亲水的谷氨酸变异成疏水的缬氨酸蛋白质的变形:天然蛋白质在某些理化因素作用下,其特定的空间结构被破坏,进而导致理化性质改变和生物学活性的丧失蛋白质的复性:有些蛋白质在变形后,去除使其变形的因素,能恢复或部分恢复其原来的空间构象,并恢复生物活性。
生化名词解释

1、生物化学P1也称生命的化学,是研究生物机(微生物、植物、动物)的化学组成和生命现象中化学变化规律的一门学科。
2、碱基堆积力(碱基平面堆积力)P18是由芳香族碱基π电子之间相互作用而引起的。
3、 DNA三级结构P20指DNA双螺旋进一步折叠卷曲而成的构象。
4、结构域P50对于较大的球状蛋白分子,它的一条长的多肽链在超二级结构的基础上进一步卷曲折叠,形成若干个空间上相对独立、且具有一定功能的近似球状的紧密实体,这种紧密球状结构被称为结构域。
5、核酸变性P30是指核酸在高温、酸、碱或一些变性剂(如尿素等)的作用下,其氢键被破坏,导致有规律的双螺旋结构变成单链的、无规律“线团”的过程。
6、分子杂交P31把不同来源的DNA链放在同一溶液中作变性处理,或把变性的DNA与RNA放在一起,只要它们之间的某些区域有碱基配对的可能,一旦进行退火处理,它们之间就可形成局部的DNA-DNA或DNA-RNA杂合体双链,这一过程称为分子杂交。
7、等电点P40在某一PH值的溶液中,若氨基酸解离成阳离子和阴离子的趋势及程度相等,氨基酸带有数量相等的正负两种电荷,即静电荷等于零,此时溶液的PH值就称为该氨基酸的等电点。
8、超二级结构P49在蛋白质中,某些相邻的二级结构单元(α-螺旋、β-折叠、β-转角、无规卷曲)常常相互靠近、彼此作用,在局部区域形成有规则的二级结构聚合体,充当更高层次结构的构件,该二级结构的聚合体就称为蛋白质的超二级结构。
9、变构效应(变构作用)P59是指寡聚蛋白质分子中,一个亚基由于与其他分子结合而发生构象变化,引起分子构象和功能的改变,并引起相邻亚基的分子构象和功能也发生改变。
10、全酶(结合酶)P70酶分子中除蛋白质部分外,还含有对热稳定的非蛋白质的有机小分子或金属离子,这类酶统称为结合酶或全酶.11、辅酶、辅基P71辅酶是指以非共价键与酶蛋白结合的小分子有机物质,通过透析或超滤等物理方法可以除去。
辅基是指以共价键与酶蛋白结合的小分子有机物质,不能通过透析或超滤的方法除去。
生化名词解释

生物化学名词解释1.同功酶:是指有机体内能够催化同一种化学反应,但其酶蛋白本身的分子结构组成却有所不同的一组酶。
2.翻译:是在以rRNA和蛋白质组成的核糖核蛋白体上,以mRNA为模板,根据每三个相邻核苷酸决定一种氨基酸的三联体密码规则,由tRNA运送氨基酸,合成出具有特定氨基酸顺序的蛋白质肽链的过程。
3.DNA变性:指DNA双螺旋区的氢键断裂,变成单链并不涉及共价键的断裂。
4.半保留复制:双链DNA的复制方式,其中亲代链分离,每一子代DNA分子由一条亲代链和一条新合成的链组成。
5.β氧化:脂肪酸的β氧化作用是脂肪酸在一系列酶的作用下,在a-碳原子和β碳原子之间断裂,β碳原子氧化成羟基,生成含2个碳原子的乙酰CoA和比原来少2个的碳原子脂肪酸。
6.氧化磷酸化:电子沿呼吸链传递时,将释放出的自由能转移并使ADP磷酸化形成ATP,此过程称氧化磷酸化。
7.必需脂肪酸:为人体生长所必需的但又不能自身合成,必须从食物中摄取的脂肪酸。
Eg亚油酸、亚麻酸、花p生四烯酸。
8.密码子:存在于信使RNA中的三个相邻的核苷酸顺序,是蛋白质合成中某一特定氨基酸的密码单位。
密码子确定哪一种氨基酸参入蛋白质多肽链的特定位置上,共有64个密码子,其中61个是氨基酸密码子,3个终止密码子。
9.蛋白质一级结构:指蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。
10.戊糖磷酸途径:磷酸戊糖途径指机体某些组织(如肝、脂肪组织等)以6-磷酸葡萄糖为起始物在6-磷酸葡萄糖脱氢酶催化下形成6-磷酸葡萄糖酸进而代谢生成磷酸戊糖为中间代谢物的过程,又称为磷酸已糖旁路。
11.蛋白质二级结构:指在蛋白质分子中的局部区域内,多肽链沿一定方向盘绕和折叠的方式。
12.米氏常数:用Km值表示,是酶的一个重要参数。
Km值是酶反应速度(V)达到最大反应速度(Vmax)一半时底物的浓度(单位M或mM)。
米氏常数是酶的特征常数,只与酶的性质有关,不受底物浓度和酶浓度的影响。
生化考试考研必备(含分子生物学)-名词解释特全(共259个)

生化考试考研必备(含分子生物学)-名词解释特全(共259个)生物化学名词解释蛋白质的结构与功能1.氨基酸(amino acid):是一类分子中即含有羧基又含有氨基的化合物。
2.肽(peptide):是氨基酸之间脱水,靠肽键连接而成的化合物。
3.肽键:是一个氨基酸α-羧基与另一个氨基酸α-氨基脱水形成的键,也称为酰胺键。
4.肽键平面(肽单元):因肽键具有半双键性质,只有α-碳相连的两个单键可以自由旋转,在多肽链折叠盘绕时,Cα1、C、O、N、H、Cα2六个原子固定在同一平面上,故称为肽键平面。
5.蛋白质一级结构:是指多肽链中氨基酸残基的排列顺序。
6.α-螺旋:多肽链的主链围绕中心轴有规律的螺旋式上升,每3.6个氨基酸残基盘绕一周,形成的右手螺旋,称为α-螺旋。
7.模序(motif):在蛋白质分子中,两个或三个具有二级结构的片段,在空间上相互接近,形成一个具有特殊功能的空间结构,称为模序。
8.次级键:蛋白质分子侧链之间形成的氢键、盐键、疏水键三者统称为次级键。
9.结构域(domain):蛋白质三级结构被分割成一个或数个球状或纤维状折叠较为紧密的区域,各行其功能,该区域称为结构域。
10.亚基:有些蛋白质分子中含有两条或两条以上具有三级结构的多肽链组成蛋白质的四级结构,才能完整的表现出生物活性,其中每个具有三级结构的多肽链单位称为蛋白质的亚基。
11.协同效应:是指一个亚基与其配体结合后能影响此寡聚体中另一亚基与配体的结合能力。
如果是促进作用称为正协同效应,反之称为负协同效应。
12.蛋白质等电点(pI):当蛋白质溶液处于某一pH值时,其分子解离成正负离子的趋势相等成为兼性离子,此时该溶液的pH值称为该蛋白质的等电点。
13.蛋白质的变性:在某些理化因素的作用下,使蛋白质严格的空间结构受到破坏,导致理化性质改变和生物学活性丧失称为蛋白质的变性。
14.蛋白质的沉淀:分散在溶液中的蛋白质分子发生凝聚,并从溶液中析出的现象称为蛋白质的沉淀。
FreeKaoYan生化名词解释

名词解释生物化学生物化学,是生命的化学,是研究生物体的化学组成和生命过程中的化学变化规律的一门科学。
它是从分子水平来研究生物体(包括人类、动物、植物和微生物)内基本物质的化学组成、结构,及在生命活动中这些物质所进行的化学变化(即代谢反应)的规律及其与生理功能的关系的一门科学,是一门生物学与化学相结合的基础学科。
▲分子生物学分子生物学是以生物大分子为研究目标,通过对蛋白质、酶和核酸等大分子的结构、功能及其相互作用等运动规律的研究来阐明生命分子基础,从而探索生命奥秘的一门科学。
它是由生物化学、遗传学、微生物学、病毒学、结构分析及高分子化学等不同研究领域结合而形成的一门交叉科学,目前已发展成生命科学中的带头学科。
第一章糖的化学单糖凡不能被水解成更小分子的糖称为单糖。
单糖是糖类中最简单的一种,是组成糖类物质的基本结构单位。
单糖可根据其分子中含碳原子多少分类,最简单的单糖是三碳糖,在自然界分布广、意义大的五碳糖和六碳糖,也分别称为戊糖和己糖。
▲寡糖寡糖是由单糖缩合而成的短链结构(一般含2~6个单糖分子)。
其中二糖是寡糖中存在最为广泛的一类。
▲多糖多糖是由许多单糖分子缩合而成的长链结构,分子量都很大,在水中不能成真溶液,有的成胶体溶液,有的根本不溶于水,均无甜味,也无还原性。
多糖有旋光性,但无变旋现象。
最重要的多糖有淀粉、糖原和纤维素等。
多糖中有一些是与非糖物质结合的糖称为复合糖,如糖蛋白和糖脂。
▲同聚多糖同聚多糖也称为均一多糖,是由一种单糖缩合而成,如淀粉、糖原、纤维素、戊糖胶、木糖胶、阿拉伯糖胶、几丁质等。
▲杂聚多糖杂聚多糖也称为不均一多糖,是由不同类型的单糖缩合而成,如肝素、透明质酸和许多来源于植物中的多糖如波叶大黄多糖、当归多糖、茶叶多糖等。
▲粘多糖粘多糖也称为糖胺聚糖,是一类含氮的不均一多糖,其化学组成通常为糖醛酸及氨基己糖或其衍生物,有的还含有硫酸。
如透明质酸、肝素、硫酸软骨素等。
▲结合糖结合糖也称糖复合物或复合糖,是指糖和蛋白质、脂质等非糖物质结合的复合分子。
期末生化名词解释

生物化学期末考试名词解释1、限制性内切酶:原核生物中存在着一类能识别外源DNA双螺旋中 4-8 个碱基对所组成的特异的具有二重旋转对称性的回文序列,并在此序列的某位点水解DNA双螺旋链,产生粘性末端或平末端,这类酶称为限制性内切酶。
2、从头合成:利用磷酸核糖、氨基酸、CO2和NH3等简单物质为原料,经过一系列酶促反应合成核苷酸,此途径不经过碱基、核苷的中间阶段,是从无到有的途径。
3、补救合成:利用体内核酸的降解产生的游离碱基或核苷,经过比较简单的反应过程,合成核苷酸。
4、生糖氨基酸:凡能形成丙酮酸、α-酮戊二酸、琥珀酸和草酰乙酸的氨基酸都称为生糖氨基酸。
5、生酮氨基酸:在分解过程中能转变为乙酰乙酰-CoA的氨基酸称为生酮氨基酸。
(亮、赖)6、生糖兼生酮氨基酸:代谢产生的中间产物既可转变成酮体又可转变成糖的氨基酸称为生糖兼生酮氨基酸。
(异亮、苯丙、酪、色)7、一碳基团:某些氨基酸代谢过程中产生的只含有一个碳原子的基团,称为一碳基团。
8、转氨基作用:在转氨酶的催化下,α-氨基酸的氨基转移到α-酮酸的酮基碳原子上,使原来的α-氨基酸生成相应的α-酮酸,而原来的α-酮酸则形成了相应的α-氨基酸,这种作用称为转氨基作用或氨基移换作用。
9、糖酵解:是在无氧条件下,将葡萄糖降解为乳酸并伴随着ATP生成的一系列反应,是生物体内普遍存在的葡萄糖分解的途径。
该途径简称EMP途径。
10、柠檬酸循环:在有氧条件下,糖分解产生的丙酮酸先转变为乙酰辅酶A,再通过一个循环彻底分解成CO2和H20。
这个循环中关键的物质是柠檬酸,因此称为柠檬酸循环11、葡萄糖的异生作用:以一些非糖物质(包括乳酸、甘油、氨基酸、丙酮酸及丙酸等)为前体合成葡萄糖的过程,称为葡萄糖的异生作用。
12、β-氧化:脂肪酸的分解是从羧基端的β-碳原子(从酰基 CoA 开始)开始的,每次切掉两个碳原子单元,这种降解方式就称为脂肪酸的β-氧化。
13、α-氧化:脂肪酸氧化作用发生在α-碳原子上,分解出CO2,生成比原来少一个碳原子的脂肪酸,这种氧化作用称为α-氧化作用。
生物化学名词解释
生化(一)名词解释
第二章酶
第三章糖代谢
第四章脂质代谢成混合微团
CM 乳糜微粒由
合成的
醇共同组装成三酯和胆固醇。
Essentialfattyacid 必需脂肪酸机体自身不能合成,必须从食物中获得的多价不饱和脂肪酸,主要包括亚油酸,亚麻酸,花生四烯酸。
胆固醇胆固醇的得名源于它最先是从动物胆石中分离出的、
胆固醇及其酯以及游离脂肪酸。
apo 载脂蛋白载脂蛋白指血浆脂蛋白中的蛋白质部分。
HDL
础,发病机理十分复杂。
高脂血症血脂高于正常人上限,即为高脂血症。
第五章生物氧化
第六章氨基酸代谢
第十五章肝的生物化学。
生化名词解释

A ATP synthaseing(ATP合酶):又称复合体V,由F0和F1的部分组成,F0是镶嵌在线粒体内膜中的质子通道,F1可催化ADP磷酸化为ATP氨基酸代谢库(AA metabolic pool):食物蛋白质经消化而被吸收的氨基酸与体内组织蛋白质降解产生的氨基酸混在一起,分布于体内各处,参与代谢氮平衡试验 (nitrogen balance):测定摄入食物中的含氮量和粪尿含氮量来研究体内蛋白质代谢的一种实验B变构效应allosteric effect:酶聚蛋白与配基结合后改变蛋白质的构象,导致蛋白质生物学特性改变的现象PKU(苯丙酮酸尿症):尿中出现大量苯丙酮酸等代谢产物的疾病必需氨基酸(EAA):人体内有八种氨基酸不能合成,这种氨基酸体内需要而又不能自身合成,必须通过食物提供alanine-glucose cycle(丙氨酸-葡萄糖循环):丙酮酸和葡萄糖反复在肌和肝之间进行氨的转运的途径(不)可逆抑制作用 (ir-)reversible inhibition:抑制剂通过非共价键与酶和酶-底物复合物可逆性结合;不可逆抑制作用的抑制剂通过和酶活性中心上的必须基团以共价键结合,使酶失活。
变构调节 allosteric effect:体内的代谢物与关键酶分子活性中心外的某个部位可逆的结合,使酶发生变构,而改变其催化活性,对酶催化活性的调节方式称为变构调节。
pasteur effect巴斯德效应:有氧氧化抑制生醇发酵(糖酵解)的现象。
必需脂肪酸:机体不能合成,必须由食物提供,是动物不可缺少的营养素。
半保留复制(semi conservation replication):在DNA生物合成时,母链DNA分解成两股链,分别作为模板,按碱基配对原则合成与母链互补的子链。
子细胞中的DNA。
一股链从亲代完整获得,另一股链则完全重新合成。
两个子细胞DNA的碱基序列与亲代一致1不对称转录:(asymmetric transcription)在DNA分子双链上,一股链作为模板指引转录,另一股链不转录;但模板链并非总在同一单链上。
生化复习资料

生化复习资料1.一.名词解释生物化学:又称生命的化学,是研究生命机体(微生物,植物,动物)的化学组成和生命现象中的化学变化规律的一门科学。
生物大分子:是分子量比较大的有机物,主要包括蛋白质、核酸、多糖和脂肪。
DNA的二级结构:构成DNA的多糖脱氧核苷酸链之间通过链间氢键卷曲而成的构象,其结构形式是右手双螺旋结构。
核酸的变性:在某些理化因素的作用下,DNA分子中的碱基堆积力和氢键被破坏,空间结构受到影响并引起DNA分子理化性质和生物学功能的改变,这种现象称为核酸的变性。
增色效应:DNA变性时,双链发生解离,共轭双键更充分暴露,在260nm处对紫外光的吸收增加,这种现象称为增色效应,可用于判断天然DNA是否发生变性。
6Tm:通常把核酸加热变性过程中紫外光吸收值达到最大值的50%时的温度称为核酸的解链温度,又称熔点,融点或熔融温度。
7核酸探针:用放射性同位素或其他标记物标记的核酸片段,该片段具有特异序列,能与互补连结合,它可以是寡核苷酸片段,全基因或其一部分,也可以是RNA,可用于特定基因的鉴定,疾病诊断,进化分析等方面。
稀有蛋白质氨基酸:在某些蛋白质中还存在一些不常见的氨基酸,他们没有遗传密码,都是常见蛋白质氨基酸参与多肽链后经酶促修饰而形成的,称为稀有氨基酸,也称修饰氨基酸。
蛋白质一级结构:是指蛋白质多肽链中氨基酸残基从N末端到C末端的排列顺序,即氨基酸序列。
维持蛋白质一级结构的化学键主要是肽键,有些蛋白质还包含二硫键。
蛋白质三级结构:是指单条肽链蛋白质的所有原子在三维空间的排布情况,既包括主链原子,也包含侧链原子三级结构是蛋白质发挥功能所必需的蛋白质四级结构:是指含两条或多条肽链的蛋白质分子中,各亚基间通过非共价键彼此缔合在一起而形成的特定的三维结构。
分子病:由于基因突变导致蛋白质一级结构的变异,进而导致蛋白质生物动能的下降或丧失,并引起疾病,这类疾病统称为分子病,例如镰刀行红细胞贫血病就是由于血红蛋白一级结构变异而导致的一种分子病。
生化名词解释

氨基酸的等电点:对某一种氨基酸而言,当溶液在某一个特定的pH,氨基酸以两性离子的形式存在,并且其所带的正电荷数与负电荷数相等,即净电荷为零。
在直流电场中,它既不向正极,也不向负极移动。
此时溶液的pH 称为这种氨基酸的等电点(pI)肽键:指蛋白质分子中,由一个氨基酸的α-COOH和另一个氨基酸的α-NH2之间脱水缩合而成的酰胺键.它是蛋白质结构中的主要共价键.肽:由氨基酸通过肽键形成的聚合物(二肽、三肽、寡肽、…多肽)肽平面:肽链主链的肽键C-N具有双键的性质,因而不能自由的旋转,使连接在肽键上的六个原子共处于一个平面上,此平面称为肽单位平面,又称酰胺平面。
通常是反式的.二面角:C-C的旋转角为ψ,C-N的旋转角为φ,这两个旋转角决定两个肽平面在空间上的相对位置。
一级结构:指多肽链上各种氨基酸残基的种类和排列顺序,也包括二硫键的数目。
二级结构:指多肽链主链在一级结构的基础上进一步的盘旋或折叠,形成的周期性构象,维系二级结构的力是氢键超二级结构:在蛋白质中经常存在由若干相邻的二级结构单元按一定规律组合在一起,形成有规则的二级结构集合体,超二级结构又称或模体.结构域:在较大的蛋白质分子里,多肽链的空间折叠常常形成两个或多个近似球状的三维实体,它们之间由舒展的肽链连接。
是在超二级结构的基础上形成的具有一定功能的结构单位四级结构:多个具有三级结构的多肽链(称亚基)的聚合。
或者说,四级结构指亚基的种类、数目及各个亚基在寡聚蛋白中的空间排布和亚基之间的相互作用分子病:基因突变导致蛋白质一级结构的突变,导致蛋白质生物功能的下降或丧失,就会产生疾病,变性:是指一些理化因素,如热、光、机械力、酸碱、有机溶剂、重金属离子、变性剂(如尿素等),破坏了维持蛋白质空间构象的非共价作用力,使其空间结构发生改变,结果导致其生物活性的丧失。
变性一般并不引起肽键的断裂。
复性:消除变性的因素,有些蛋白质的生物活性可能得以恢复.变构效应:在寡聚蛋白分子中,一个亚基由于与其它分子结合而发生构想变化,并引起相邻其它亚基的构想和功能的改变。
生化名词解释

2.蛋白质的一级结构:是指多肽链中氨基酸(残基)的排列的序列,若蛋白质分子中含有二硫键,一级结构也包括生成二硫键的半胱氨酸残基位置。
维持其稳定的化学键是:肽键。
蛋白质二级结构:是指多肽链中相邻氨基酸残基形成的局部肽链空间结构,是其主链原子的局部空间排布。
蛋白质二级结构形式:主要是周期性出现的有规则的α-螺旋、β-片层、β-转角和无规则卷曲等。
蛋白质的三级结构是指整条多肽链中所有氨基酸残基,包括相距甚远的氨基酸残基主链和侧链所形成的全部分子结构。
因此有些在一级结构上相距甚远的氨基酸残基,经肽链折叠在空间结构上可以非常接近。
蛋白质的四级结构是指各具独立三级结构多肽链再以各自特定形式接触排布后,结集所形成的蛋白质最高层次空间结构。
3..蛋白质的变性:在某些理化因素的作用下,蛋白质的空间结构受到破坏,从而导致其理化性质的改变和生物学活性的丧失,这种现象称为蛋白质的变性作用。
蛋白质变性的实质是空间结构的破坏。
4.蛋白质沉淀:蛋白质从溶液中聚集而析出的现象。
1.生物化学:在有机化学和生理学基础上发展起来,运用化学的理论和方法,研究生物体的化学组成、化学变化 (即物质代谢),以及其与生理功能之间的联系的一门学科。
2.电泳:带电粒子在电场中向所带电荷相反的电极移动的现象。
4.蛋白质的等电点:使蛋白质分子所带正、负电荷相等,即净电荷为零时的溶液pH值。
5.变构效应:蛋白质分子因与某种小分子物质(变构调节剂)相互作用,使构象发生轻度改变,生物学活性发生显著改变的现象。
7.肽键:是一分子氨基酸的α-羧基与另一分子氨基酸的α-氨基脱水缩合形成的化学键。
11.亚基:蛋白质分子四级结构中每条具有独立三级结构的多肽链。
又称亚单位或单体。
12.蛋白质复性:变性蛋白在除去变性因素后,能恢复天然结构和功能的现象。
13.蛋白质沉淀:蛋白质分子聚集从溶液中析出的现象。
14.盐析:当盐浓度较高时,蛋白质的溶解度降低,从溶液中沉淀析出的现象。
生化(1)

生物化学一、名词解释:1.生物分子:生物体和生命现象的结构基础和功能基础,是生物化学研究的基本对象。
2.运动生物化学:从分子水平上研究运动对机体化学组成的影响和物质代谢特点以及变化规律与身体健康运动机能和运动能力相互关系的一门新学科。
3.必需氨基酸:人体不能自行合成,必需从外界摄取以完成营养需要的氨基酸。
(包括:赖氨酸,蛋氨酸(甲硫氨酸),苏氨酸,亮氨酸,异亮氨酸,色氨酸,缬氨酸,苯丙氨酸。
)4.蛋白质的一级结构:蛋白质分子内氨基酸以肽键连接的排列顺序。
5.必需脂肪酸:通常把维持人体生长所需而体内不能合成的脂肪酸。
包括:亚油酸、亚麻酸、花生四稀酸。
6.酶:是生物细胞(或称活性细胞)产生的具有催化功能的物质。
7.同工酶:指催化同一种化学反应,而酶蛋白的分子结构、理化性质及生物学性质不同的一类酶。
8.乳酸脱氢酶(LDH):是催化糖代谢中丙酮酸和乳酸之间的相互转变的酶。
9.生物氧化(细胞呼吸or组织呼吸):有机物质在生物体细胞内氧化分解产生二氧化碳和水,并释放出大量能量的过程。
10.呼吸链:指在线粒体内膜上一系列递氢、递电子体按一定顺序排列,构成的一条连锁反应体系。
11.底物水平磷酸化:指在物质分解代谢过程中,代谢物脱氢后,能量在分子内部重新分布,形成高能磷酸化合物,然后将高能磷酸基团转移到ADP形成ATP的过程。
12.氧化磷酸化:在生物氧化过程中,代谢物脱下的氢经呼吸链氧化生成水时,所释放出的能量用于ADP磷酸化生成ATP。
13.高能化合物:一般将水解时释放自由能在20.9KJ(5.0Kcal)以上。
14.磷酸原供能系统:由ATP和磷酸肌酸分解反应组成的供能系统。
15.糖酵解(糖的无氧代谢):糖原和葡萄糖在无氧条件下分解生成乳酸,并合成ATP的过程。
(糖酵解的反应在细胞质内进行)16有氧代谢:糖、脂肪和蛋白质三大细胞燃料在氧充足的条件下,彻底氧化分解,生成CO2和H2O,并释放能量的过程。
17.三羧酸循环(柠檬酸循环):由于这么循环反应开始于乙酰CoA与草酰乙酸缩合生成的含有三个羧基的柠檬酸。
生化名词解释

58.一碳单位:指具有一个碳原子的基团
59.从头合成:生物体内用简单的前体物质合成生物分子的途径
60.补救合成:将已分解的生物体的一部分物质加以利用,再次进行该物质的生物合成的一个途径
61.复制:以亲代DNA分子为模板合成一个新的子代DNA分子的过程
62.转录:遗传信息由DNA转换到RNA的过程
31.糖原的合成与分解:合成:指葡萄糖合成糖原的过程.分解:肝糖原分解成为 葡萄糖,是一个非耗能过程.
32.三羧酸循环:是需氧生物体内普遍存在的代谢途径,因为在这个循环中几个主要的中间代谢物是含有三个羧基的柠檬酸
33.乳酸循环:肌肉收缩通过糖酵解生成乳酸。肌肉内糖异生活性低,所以乳酸通过细胞膜弥散进入血液后,再入肝,在肝脏内异生为葡萄糖。葡萄糖释入血液后又被肌肉摄取,这就构成了一个循环(肌肉-肝脏-肌肉),此循环称为乳酸循环。
15.DNA的变性:DNA变性指理化因素下,DNA分子中氢键断裂,双螺旋结构松开,形成无规则的单键线状结构.
16.退火:变性DNA有适应条件下,两条彼此分开后的单链从新缔合成双螺旋结构。称为DNA的复性退火
17.酶:由活细胞产生的具有催化功能的生物催化剂.
18.结合酶:由蛋白质和非蛋白质成分组成,其中蛋白质部分称酶蛋白,非蛋白质部分称辅酶因子.
63.翻译:转录合成mRNA可以作为模版合成蛋白质.
64.逆转录:也称反转录以RNA为模板合成DNA的过程,是RNA病毒的复制形式,需逆转录酶的催化种
65.半保留复制:一种双链脱氧核糖核酸(DNA)的复制模型,其中亲代双链分离后,每条单链均作为新链合成的模板
66.前导链和后随链:
9.蛋白质的电泳:在同一PH环境下,由于各种蛋白质所带电荷的性质和数量不同分子量大小不一,因此它们在同一电场中移动速率不同.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生化名词解释第一章1.一级结构:在蛋白质分子中,从N-端至C-端的氨基酸排列顺序称为蛋白质的一级结构。
是蛋白质空间构象和特异生物学功能的基础。
2.二级结构:是指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
3.三级结构:指整条肽链中全部氨基酸残基的相对空间位置,也就是整条肽链所有原子在三维空间的排布位置。
4.四级结构:蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
5.超二级结构:在许多蛋白质分子中,可由2个或2个以上具有二级结构的肽段在空间上相互接近,形成一个有规则的二级结构组合称为超二级结构。
6.模体:蛋白质中具有特定功能的或作为一个独立结构一部分的相邻的二级结构的聚合体。
7.分子伴侣(molecular chaperon):通过提供一个保护环境从而加速蛋白质折叠成天然构象或形成四级结构的蛋白质。
8.肽单元(peptide unit):参与肽键的6个原子(Cα1、C、O、N、H、Cα2)位于同一平面构成。
9.结构域(domain)指的是分子量大的蛋白质折叠成的结构紧密、稳定的区域,可以各行其功能。
10.蛋白质变性(protein denaturation):在物理和化学因素作用下,其特定的空间构象被破坏,从而导致理化性质的改变和生物学活性的丧失,称为蛋白质变性。
第二章11.核酸:是以核苷酸为基本组成单位的生物信息大分子,具有复杂的结构和重要的生物学功能。
可分为脱氧核糖核酸和核糖核酸。
12.核酸杂交(nucleic acid hybridization):具有互补碱基序列的DNA或RNA分子,通过碱基对之间氢键形成稳定的双链结构,包括DNA和DNA的双链,RNA和RNA的双链,DNA和RNA 的双链。
13.核小体(nucleosome):是染色质的基本组成单位,由DNA和H1、H2A,H2B,H3和H4等5种组蛋白共同构成。
14.D NA变性:在某些理化因素(温度、pH、离子强度等)作用下,DNA双链的互补碱基对之间的氢键断裂,使双螺旋结构松散,形成单链的构象,不涉及一级结构的改变。
15.D NA的增色效应(DNA hyperchromic effect):在DNA解链中,更多的共轭双键暴露,含有DNA的溶液在260nm处的吸光度增加,这种现象称为DNA的增色效16.D NA的解链温度(DNA melting temperature):解链过程中,紫外吸光度的变化达到最大值的一半时所对应的温度。
17.D NA复性:当变性条件缓慢地除去后,两条解离的互补链可重新互补配对,恢复原来的双螺旋结构。
18.退火(anneal):变形的双链DNA经缓慢冷却后,两条互补链可以重新恢复天然的双螺旋构象的过程。
第三章19.酶:酶是由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质。
20.酶的活性中心:或称酶的活性部位,是酶分子中能与底物特异地结合并催化底物转变为产物的具有特定三维结构的区域。
21.同工酶(isoenzyme):指催化相同的化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
22.别构调节(allosteric regulation):体内某些代谢物与酶的活性中心非共价可逆结合,引起酶的构象改变,从而改变酶的活性,酶的这种调节方式称为别构调节。
23.酶的共价修饰(covalent modification):酶蛋白肽链上的一些基团可在其它酶的催化下,与某些化学基团共价结合,同时又可在另一种酶的作用下去掉已结合的化学基团,从而影响酶的活性,又称为酶的化学修饰。
24.酶原(zymogen,proenzyme):有些酶在细胞内合成或初分泌时,或在其发挥催化功能前,只是酶的无活性前体,称为酶原。
第四章25.维生素(vitamin):是一类人体不能合成或合成很少,必须由食物供应的小分子有机化合物。
按其溶解性可分为脂溶性维生素和水溶性维生素。
主要功能是调节人体物质代谢和维持正常生理功能。
第六章26.糖酵解(glycolysis):指的是葡萄糖在胞质内生成丙酮酸的过程,净生成2A TP和2NADH,是糖有氧氧化和无氧氧化的共同起始阶段。
27.三羧酸循环(citric acid cycle):在线粒体内乙酰CoA进行八步酶促反应并构成循环反应系统。
共经历4次脱氢、2次脱羧,生成4分子还原当量和2分子CO2,循环的各中间产物没有量的变化。
它是糖、脂肪、氨基酸的共同供能途径和物质转变枢纽。
28.底物水平磷酸化(substrate-level phosphosphorylation):指ADP或其他核苷二磷酸的磷酸化作用与底物的脱氢作用直接相偶联的反应过程。
是生物体内产能的方式之一。
29.糖的有氧氧化(aerobic oxidation):有氧时葡萄糖依次经糖酵解生成丙酮酸,丙酮酸入线粒体氧化脱羧生成乙和CO2,同时偶联电子传递并释放能量,此过程净生成30或32A TP,是糖的主要产能途径。
30.磷酸戊糖途径:指从糖酵解的中间产物葡糖-6-磷酸开始形成旁路,通过氧化、基团转移两个阶段生成果糖-6-磷酸和3-磷酸甘油醛,从而返回糖酵解的代谢途径。
主要生理意义是提供NADPH和磷酸核糖。
31.巴斯德效应:指糖有氧氧化抑制糖无氧氧化的现象。
第七章32.脂肪动员(fat mobilization):指储存在脂肪细胞内的脂肪在脂肪酶作用下,逐步水解,释放游离脂肪酸和甘油供其他组织细胞氧化利用的过程。
33.酮体(ketonr bodies):脂肪酸在肝内β-氧化产生的大量乙酰CoA,部分转变为酮体,包括乙酰乙酸、β-羟丁酸和丙酮。
酮体经血液运输至肝外组织氧化利用,是肝向肝外输出能量的一种方式。
34.载脂蛋白(apolipoprotein):血浆脂蛋白中的蛋白质部分,分为ABCDE等几大类,在血浆中起运载脂质的作用,还能识别脂蛋白受体、调节血浆脂蛋白代谢酶的活性。
35.脂蛋白(lipoprotein):脂—蛋白质的非共价聚合物,为血浆中不溶性脂类的脂蛋白中甘油三酯的酶,是血脂在血液中存在、转运及代谢的形式。
36.生物氧化(biological oxidation):物质在生物体内进行氧化称生物氧化,主要有糖、脂肪、蛋白质等,在体内分解时逐步释放能量,最终生成CO2和H2O的过程。
37.氧化呼吸链(oxidative respiratory chain):又称电子传递链,指线粒体内膜中按一定顺序排列的一系列具有电子传递功能的酶复合体,可通过连续的氧化还原反应将电子最终传递给氧生成水。
第九章38.氮平衡(nitrogen balance):机体吸收氮与排泄氮之间的关系。
39.活性甲硫氨酸(SAM):是体内甲基最重要的直接供体。
40.营养必需氨基酸(nutritionally essential amino acid):体内不能自身合成必须由食物提供的氨基酸,包括:亮氨酸、异亮氨酸、甲硫氨酸、缬氨酸、苏氨酸、色氨酸、苯丙氨酸和赖氨酸。
41.一碳单位(one carbon unit):是指某些氨基酸在分解代谢过程中产生的含有一个碳原子的基团。
42.氨基酸代谢库:食物蛋白质经消化而被吸收的氨基酸与体内组织蛋白质降解产生的氨基酸及体内合成的非必需氨基酸共同分布于体内参与代谢。
43.腐败作用(putrefaction):指肠道细菌对未被消化的蛋白质及消化产物的分解作用。
第十章44.核苷酸补救合成(salvage pathway):利用体内游离的嘌合成嘌呤或嘧啶核苷酸。
该途径主要存在于脑或骨髓组织。
45.核苷酸从头合成(de novo synthesis):利用磷酸核糖、氨基酸、一碳单位、CO2等简单物质为原料,经过一系列酶促反应合成嘌呤或嘧啶核苷酸称之为从头合成。
第十一章46.生物转化(biotransformation):机体对内、外源性的非营养物质进行代谢转变,增加其水溶性和极性,利于从尿或胆汁排出体外。
第十三章47.基因(gene):能够编码蛋白质或RNA的核酸序列,包括基因的编码序列(外显子)和编码区前后具有基因表达调控作用的序列和单个编码序列间的间隔序列(内含子)。
48.基因组(genome):是指一个生物体内所有遗传信息的总和。
49.基因组构:单个基因的组成结构及一个完整的生物体内基因的组织排列方式统称为基因组构。
50.断裂基因(split gene):真核基因结构不连续,称为断裂基因。
51.外显子(exon):基因组DNA中,出现在成熟mRNA分子的核苷酸序列称为外显子。
其最终被翻译成蛋白质。
52.内含子(intron):位于外显子之间、可以被转录在前体RNA中,但经过剪接被去除,最终不存在于成熟mRNA分子中的核苷酸序列。
又被称为间插序列。
53.旁侧序列(flanking sequence):位于基因转录区前后并与其紧邻的DNA序列。
54.启动子(promoter):是DNA分子上能够与RNA聚合酶结合并形成转录起始复合体的区域。
55.增强子(enhance):是可以增强真核基因启动子工作效率的顺式作用元件,是真核基因中最重要的调控序列,决定着每一个基因在细胞内的表达水平。
56.沉默子:(silencer)是可抑制基因转录的特定核苷酸序列,当其结合一些反式作用因子时对基因的转录起阻遏作用,使基因沉默。
第十四章57.半保留复制(semi-conservative replication):DNA复制时,亲代DNA双螺旋解开成为两条单链各自作为模板,按照碱基配对规律合成一条与模板相互补的新链,形成两个子代DNA分子。
每一个子代DNA分子中都保留有一条来自亲代的链。
这种复制方式称为半保留复制。
58.冈崎片段(Okazaki fragment):指的是DNA复制时,随从链复制中的不连续片段。
59.引发体(primosome):是复制起始时形成的,原核生物DnaB、DnaC、DnaG等蛋白质结合到DNA起始复制60.逆转录(recerse transcription):指以RNA为模板,按照碱基配对原则,在逆转录酶的作用下,催化合成DNA 的过程。
61.逆转录酶:能催化RNA为模板合成双链DNA的酶,成为逆转录酶,全称是依赖RNA的DNA聚合酶。
62.端粒(telomere):是真核生物染色体线性DNA分子末端的结构。
第十五章63.D NA损伤:各种体内外因素所导致的DNA组成与结构的变化称为DNA损伤,可产生两种后果:一是DNA 结构发生永久性改变即突变,二是导致DNA失去作为复制和(或)转录模板的功能。
64.D NA损伤修复:指纠正DNA两条单链间错配的碱基、清除DNA链上受损的碱基或糖基、恢复DNA的正常结构的过程。
