实验四二次生长曲线
生长曲线实验报告

生长曲线实验报告生长曲线实验报告引言:生长曲线实验是生物学中常见的实验之一,通过观察和记录生物体在不同时间点的生长情况,可以得出生物体的生长曲线。
本实验旨在通过观察小麦种子在一段时间内的生长情况,探讨生物体的生长规律。
实验材料和方法:实验所用材料包括小麦种子、培养皿、水、土壤和测量工具。
首先,将小麦种子均匀地撒在培养皿中,然后加入适量的水和土壤。
接下来,将培养皿放置在适宜的环境条件下,如温度适宜、光照充足的室内。
在实验过程中,每隔一段时间,使用测量工具对小麦的生长情况进行测量和记录。
实验结果和分析:在实验过程中,我们观察到小麦种子开始发芽,并逐渐生长成苗。
通过对不同时间点的测量数据进行整理和分析,我们得到了小麦的生长曲线。
初始阶段,小麦种子刚开始发芽,幼苗生长速度较慢。
此时,小麦的生长曲线呈现出一个平缓的上升趋势。
随着时间的推移,小麦的生长速度逐渐加快,生长曲线开始呈现出一个急剧上升的趋势。
这是因为小麦苗的根系逐渐扩展,吸收到更多的水分和养分,从而促进了植物体的生长。
然而,随着时间的继续推移,小麦的生长速度逐渐减缓,生长曲线开始趋于平缓。
这是因为小麦的生长到达了一个饱和状态,养分和水分的吸收速度与消耗速度达到了平衡。
此时,小麦的生长曲线呈现出一个平稳的水平趋势。
结论:通过本实验,我们得出了小麦的生长曲线,从而揭示了小麦在不同时间点的生长规律。
小麦的生长曲线呈现出一个平缓上升、急剧上升和平稳水平的趋势。
这说明小麦的生长速度在不同阶段有所差异,最终趋于稳定。
生长曲线实验不仅可以用于研究植物的生长规律,还可以应用于其他生物体的生长研究。
通过观察和记录生物体的生长情况,我们可以更好地了解生物体的生长过程,为农业生产和生物科学研究提供有益的参考。
总结:生长曲线实验是一种常见的生物学实验方法,通过观察和记录生物体的生长情况,可以得出生物体的生长曲线。
本实验以小麦种子为例,通过测量和记录小麦的生长情况,得出了小麦的生长曲线。
微生物实验报告:测定细菌生长曲线

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。
二次生长曲线

二次生长曲线概述二次生长曲线是描述生物体生长变化的数学模型。
它可以用于解释许多生物体的生长过程,包括植物、动物以及人类等。
二次生长曲线常用于分析生物体的生长速率、生长期间的变化以及预测未来的生长趋势。
二次生长曲线的数学表达式为:其中,y代表生物体的生长量(例如体重、身高等),x表示生长的时间,k1、k2和k3是二次生长曲线的参数。
二次生长曲线在植物生长中的应用1. 早期生长期植物的生长过程可以分为不同的阶段,其中早期生长期是植物生长最快的阶段。
在早期生长期,植物的二次生长曲线呈现出快速上升的趋势。
这是因为植物在这个阶段需要大量的营养物质来支持生长,包括水分、光照以及二氧化碳。
2. 生长速率的变化随着植物的生长进程,二次生长曲线的斜率会逐渐减小。
这意味着植物的生长速率逐渐变慢。
这是由于植物在发育过程中需要消耗更多的能量来支持细胞分裂和细胞扩张。
当生长速率达到最大值后,植物的生长将进入成熟期。
3. 预测未来的生长趋势通过对植物生长数据的观察和分析,可以利用二次生长曲线来预测未来的生长趋势。
根据已有的生长数据,可以确定二次生长曲线的参数,从而预测植物在未来一段时间内的生长情况。
这对农业生产和园艺种植具有重要的指导意义。
二次生长曲线在动物生长中的应用1. 幼年生长期动物的生长也可以使用二次生长曲线来描述。
在幼年生长期,动物的二次生长曲线呈现出急速上升的趋势。
这是因为幼年动物需要大量的能量来支持骨骼和肌肉的发育,以及各个器官的成熟。
2. 性别差异对于某些动物,二次生长曲线的斜率可能在雄性和雌性之间存在差异。
例如,雄性动物可能在某一阶段生长速率更快,以便在繁殖的竞争中占据优势。
二次生长曲线的分析可以帮助研究者探究这种性别差异的原因。
3. 成熟期和老化随着动物的生长,二次生长曲线的斜率会逐渐减小,并最终趋于平缓。
这代表着动物的生理发育逐渐趋于稳定,进入成熟期。
在成熟期之后,动物的生长将逐渐减缓,甚至停止,并展现出老化的特征。
细菌生长曲线的测定的实验步骤

细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t 2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000u l吸头80个;无菌5000u l吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始p H,所有瓶子测量发酵9h结束测p H.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
实验七 细菌生长曲线

细菌生长曲线测定生05 边晔 2010030026周四班同组成员:徐竞吴国梁夏川两位学弟实验时间 2012年11月29日一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时2.学习液体培养基的配制以及接种方法3.反复练习无菌操作技术4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同5.掌握利用细菌悬液混浊度间接测定细菌生长的方法二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
三、实验仪器、材料和用具大肠杆菌,枯草杆菌,金黄色葡萄球菌菌液及平板;培养基(100mL/250mL三角瓶X10瓶/大组),牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支);培养箱,摇床,722s分光光度计;比色皿3个+共用参比杯一个。
四、实验步骤1.准备菌种(已做):将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种,分成3小组做,实验结果共享:第(1)小组1)取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm2)取2.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm3)取4.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组4)取1.0ml金黄色葡萄球菌接种到100ml培养基,37 ℃ 200rpm5)取1.0ml金黄色葡萄球菌接种到100ml培养基,37 ℃ 110rpm6)取1.0ml金黄色葡萄球菌接种到100ml培养基,30 ℃ 200rpm第(3)小组7)取一个大肠杆菌菌落接种到100ml培养基,37 ℃ 200rpm8)取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm9)取1.0ml大肠杆菌菌液接种到100ml培养基,30 ℃ 200rpm每培养一小时取样一次(2.5h,3.5h加测1次)。
实验报告微生物的生长曲线实验

实验报告微生物的生长曲线实验实验报告
实验目的:
本实验旨在通过监测微生物的生长曲线,研究微生物的生长规律,并探讨其对环境因素的响应。
实验材料及方法:
1. 材料:
- 微生物培养基
- 无菌培养瓶或试管
- 微量移液器或移液管
- 无菌平板
- 培养箱或恒温摇床
- 显微镜
2. 方法:
(这里使用编号列表来列出具体的实验步骤)
实验步骤:
1. 实验前准备:
(这里写明实验前的准备工作,如准备培养基、灭菌操作等)
2. 微生物获取:
(这里描述如何获取微生物样品,如从环境中采样、有选择地分离微生物菌落等)
3. 微生物培养:
(这里阐述微生物的培养过程,包括制备培养基、接种微生物样品等步骤)
4. 生长曲线检测:
(这一部分是实验的重点,需要详细记录实验过程和结果。
可以使用表格、图表等方式展示数据)
5. 结果分析:
(根据实验结果,对微生物生长曲线进行分析和解读,可结合图表进行说明)
6. 讨论与结论:
(根据实验结果的分析,进行讨论并得出结论,可以对实验中可能存在的问题进行分析,提出进一步改进的建议)
实验结论:
通过本实验对微生物的生长曲线进行监测,我们得出了如下结论:
(这里简洁地总结实验结果得出的结论,为了增加字数可以进一步展开阐述,如讨论生长曲线的不同阶段、影响微生物生长的环境因素等等)
实验报告结束。
注意:本实验报告以“实验报告”的格式为基础,根据实验内容进行适当的调整。
其中,具体的实验步骤和结果可以根据实际情况进行修改和补充,以确保文章的准确性和完整性。
细菌生长曲线的测定实验报告

竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml 玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
微生物生长曲线

大家好
13
大家好
14
结束
大家好
15
大家好
9
从生长曲线我们可以算出细胞每分裂一次所需要的 时间,即代时,以G表示。其计算公式为:
G t2t1 (lgW2lgW1)/lg2
式中t1和t2为所取对数期两点的时间; W1和W2分别为相应时间测得的细胞含量(g/L)或 OD。
大家好
10
实验仪器、材料和用具
实验材料:大肠杆菌,枯草杆菌菌液及平 板;
成因 微生物刚刚接种到培养基之上,其代谢系 统需要适应新的环境,同时要合成酶、辅酶、其他 代谢中间代谢产物等,所以此时期的细胞数目没有 增加。
对数期:
(1)菌体以几何数增加,增长速度快;
(2)细胞代谢能力最强;
(3)细菌很少死亡或不死亡。
成因 经过调整期的准备,为此时期的微生物生
长提供了足够的物质基础,同时外界环境也是最佳
成因 主要是外界环境对继续生长越来越不利、 细胞的分解代谢大于合成代谢、继而导致大量细菌 死亡。
大家好
6
测定细菌生长曲线
实验目的
了解细菌生长曲线特征,测定细菌繁殖 的代时;
学习液体培养基的配制以及接种方法;
反复练习无菌操作技术;
了解不同细菌,不同接种方法在同一培 养基上生长速度的不同;
掌握利用细菌悬液混浊度间接测定细菌 生长的方法
状态。大Βιβλιοθήκη 好5稳定期:(1)生长速率下降,死亡率上升; (2)细胞数达到最大值,新生的细菌数和死亡 的细菌数相当。
成因 营养的消耗使营养物比例失调、有害代谢 产物积累、PH值EH值等理化条件不适宜 衰亡期:
(1)死亡率增加,细菌少繁殖或不繁殖; (2)细菌常出现多形态、畸形或衰退型,有的 会产生芽孢
细菌两次生长曲线不一致的原因

细菌两次生长曲线不一致的原
因
温馨提示:文档内容仅供参考
细菌的生长曲线通常由四个主要阶段组成:潜伏期、指数增长期、稳定期和衰退期。
如果细菌在两次生长过程中表现出不一致的生长曲线,可能有以下原因:
环境条件不同:细菌对环境条件非常敏感,包括温度、pH值、营养物质和氧气水平等。
如果两次实验中的环境条件不同,例如温度或培养基成分不同,细菌的生长曲线可能会受到影响。
初始细菌数量不同:即使环境条件相同,如果两次实验中的初始细菌数量不同,也会导致生长曲线的不一致。
较多的初始细菌数量可能导致更快的指数增长期和更早的稳定期。
细菌菌株变异:细菌菌株之间可能存在遗传变异。
如果两次实验使用的是不同的细菌菌株,它们的生长特性可能会有所不同,导致生长曲线不一致。
技术操作差异:实验操作的技术差异也可能导致生长曲线的不一致。
例如,在培养细菌的过程中,培养基的制备、接种的方法、培养条件的控制等因素都可能对细菌的生长产生影响。
随机性:细菌的生长是一个随机过程,在相同条件下,两次实验的生长曲线可能会有一定的差异。
这是由于微小的随机事件和细菌个体之间的差异所致。
综上所述,细菌两次生长曲线不一致的原因可能是由于环境条件、初始细菌数量、细菌菌株的变异、技术操作差异和生长过程的随机性等多种因素的综合影响。
细菌生长特点及生长曲线的测定
实验原理(分光光度计与比浊法)
朗伯-比尔定律 A=-lg(I/I。)=-lgT=kLc
比浊法虽只能测相对数量,但便捷。某些情况 下,我们重在数量的变化而不在数量本身
三、实验内容
1、分光光度计的使用
2、大肠杆菌生长曲线的测定与绘制
四、实验材料
1. 试剂
蛋白胨、氯化钠、酵母浸粉等。 2. 仪器 托盘天平、高压蒸汽灭菌锅、分光光度计、恒温箱、恒温振荡 器。 3. 玻璃器皿 试管、烧杯、量筒、锥形瓶、培养皿、移液管等。 4. 其它物品
药匙、称量纸、pH试纸、记号笔、棉花、纱布、耐高温皮筋、 报纸等。
恒温振荡器(摇床)
五、实验流程
接种→培养→取样→比浊
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:50
第三组: LB 培养基,1:20 第四组: LB 培养基,1:100 第五组: LB 培养基,1:10 第六组: LB 培养基,1:5
二、实验原理
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4
数 量
n y=2
0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4 0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
八、讨论
1.接种龄如何影响大肠杆菌生长?
2.培养基营养成分/浓度如何影响大肠杆菌生长? 3.实验为何观察不到稳定期和衰退期? (请3选1,作答在实验报告上)
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:20
微生物生长曲线知识讲解

——汤俊华
一 微生物生长曲线 二 生长曲线的四个时期 三 生长曲线各个时期的特点 四 测定细菌生长曲线 四 生产应用
微生物生长曲线是以微生物数量(活 细菌个数或细菌重量)为纵坐标,培 养时间为横坐标画得的曲线。一般说, 微生物(细菌)重量的变化比个数的 变化更能在本质上反应出生长的过程。 曲线可分为三个阶段即生长率上升阶 段(对数生长阶段)、生长率下降阶 段及内源呼吸阶段。
培养基:牛肉膏蛋白胨葡萄糖培养基
实验仪器:取液器(5000ul, 1000ul 各一支); 培养箱, 摇床,722s分光光度计;
实验用具:无菌1000ul吸头80个;无菌 5000ul吸头2个;比色皿9个+共用参比杯 一个.
实验步骤
准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中, 37℃振荡培养18h,另外准备单菌落平板各1块 分为三个小组:
微生物生长曲线在生产实践中的应用
根据微生物的生长曲线可以明确微生物的 生长规律,对生产实践具有重大的指导意义。 故根据对数期的生长规律可以得到培养菌种 时缩短工期的方法:接种对数期的菌种,采用 最适菌龄,加大接种量,用与培养菌种相同 组成的培养基。有如,根据稳定期的生长规 律,可知稳定期是产物的最佳收获期,也是 最佳测定期,通过对稳定期到来原因的研究 还促进了连续培养原理的提出和工艺技术的 创建。
成因 微生物刚刚接种到培养基之上,其代谢系 统需要适应新的环境,同时要合成酶、辅酶、其他 代谢中间代谢产物等,所以此时期的细胞数目没有 增加。
对数期:
(1)菌体以几何数增加,增长速度快; (2)细胞代谢能力最强; (3)细菌很少死亡或不死亡。 成因 经过调整期的准备,为此时期的微生物生 长提供了足够的物质基础,同时外界环境也是最佳 状态。
实验二 生长发育的计算与生长曲线的绘制
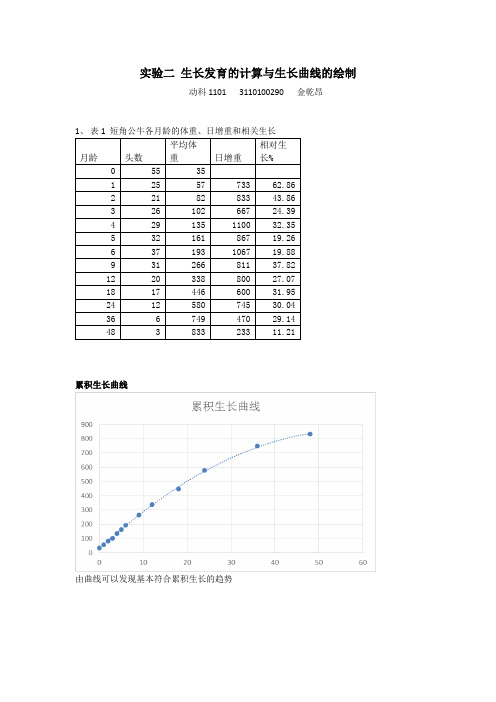
实验二生长发育的计算与生长曲线的绘制
动科1101 3110100290 金乾昂
累积生长曲线
由曲线可以发现基本符合累积生长的趋势
绝对生长曲线
由于取点不均匀时间间隔不一致所以无法表现出类似于正态对称的结构,而且由于生长过程中会有波动,受环境的影响所以曲线的结果是很不理想的。
但从图中可以发现大致的常态曲线趋势。
相对生长曲线
由于月龄间隔不一致所以也无法表现出抛物线的趋势但是如果单单取前6个点还是符合抛物线的初始阶段的形态的。
图整体看上去也大致呈现反抛物线趋势。
2、
由数据可以看出在生长时期,肝脏的生长强度最大,超出整体水平,小肠与总体水平基本相似,卵巢生长最为缓慢,心脏以及肺脏稍缓。
3、
说明肩胛骨和指骨的成熟都比较迟缓,生长强度较弱,次序依次是
指骨>肩胛骨>上膊骨>前脖骨>管骨。
微生物的生长曲线

过高或过低的pH值都会抑制微生物的生长,甚至 03 导致微生物死亡。
溶解氧
溶解氧是影响好氧微生物 生长的重要因素之一。
溶解氧浓度过低或过高都 会抑制好氧微生物的生长 。
在适宜的溶解氧浓度下, 好氧微生物的生长速率会 加快。
微生物生长曲线的未来研究
微生物的生长曲线
汇报人:
202X-01-03
目录
• 微生物生长曲线的概念 • 微生物生长曲线的实验方法 • 微生物生长曲线的应用 • 微生物生长曲线的影响因素 • 微生物生长曲线的未来研究展望
01
微生物生长曲线的概念
定义
微生物生长曲线是描述微生物在特定环境条件下,随时 间变化生长繁殖情况的一种曲线图。
3
生态恢复
通过研究微生物生长曲线,可以了解微生物在生 态系统中的作用和贡献,为生态恢复提供科学依 据。
在生物医学研究中的应用
药物筛选
利用微生物生长曲线,可以筛选 具有抗癌、抗菌等活性的药物候 选物,为新药研发提供支持。
疾病诊断
通过观察特定病原微生物的生长 曲线,可以辅助诊断和监测疾病 的发展和治疗效果。
解释与结论
根据分析结果解释微 生物生长的规律和影 响因素,得出结论。
03
微生物生长曲线的应用
在工业生产中的应用
发酵过程控制
01
微生物生长曲线可用于指导发酵过程的控制,通过调整培养条
件,提高发酵产物的产量和纯度。
生物催化剂制备
02
利用微生物生长曲线,可以优化生物催化剂的制备过程,提高
其活性和稳定性。
02 在营养物质浓度适宜的条件下,微生物的生长速 率会加快,细胞数量会增多。
实验七细菌生长曲线

细菌生长曲线测定生05 边晔2010030026四班同组成员:竞国梁夏川两位学弟实验时间2012年11月29日一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时2.学习液体培养基的配制以及接种法3.反复练习无菌操作技术4.了解不同细菌,不同接种法在同一培养基上生长速度的不同5.掌握利用细菌悬液混浊度间接测定细菌生长的法二、实验原理将一定量的菌种接种在液体培养基,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
三、实验仪器、材料和用具大肠杆菌,枯草杆菌,金黄色葡萄球菌菌液及平板;培养基(100mL/250mL三角瓶X10瓶/大组),牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支);培养箱,摇床,722s分光光度计;比色皿3个+共用参比杯一个。
四、实验步骤1.准备菌种(已做):将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种,分成3小组做,实验结果共享:第(1)小组1)取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm2)取2.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm3)取4.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm第(2)小组4)取1.0ml金黄色葡萄球菌接种到100ml培养基,37 ℃200rpm5)取1.0ml金黄色葡萄球菌接种到100ml培养基,37 ℃110rpm6)取1.0ml金黄色葡萄球菌接种到100ml培养基,30 ℃200rpm第(3)小组7)取一个大肠杆菌菌落接种到100ml培养基,37 ℃200rpm8)取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃110rpm9)取1.0ml大肠杆菌菌液接种到100ml培养基,30 ℃200rpm每培养一小时取样一次(2.5h,3.5h加测1次)。
细菌生长曲线的测定的实验步骤
细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线的测定

细菌生长曲线的测定细菌生长曲线的测定是研究细菌生长过程中数量的变化规律的重要实验方法。
通过测定不同时间点上细菌的数量,我们可以了解细菌的繁殖速度、生命周期以及适宜生长环境等信息。
本文将介绍细菌生长曲线的测定步骤,并探讨其在科学研究和实际应用中的指导意义。
首先,测定细菌生长曲线的实验需要准备培养基、平板、试管等实验器材,以及待测的细菌样品。
将培养基倒入平板中,使其均匀地附着在平板表面上。
取一定量的细菌样品,接种在试管中的培养基中,然后将试管放入恒温培养箱中。
在不同时间点上,分别取出试管,通过将样品进行稀释后在平板上接种细菌来测定其数量。
通过计数细菌在平板上形成的菌落数,我们可以得到细菌数量随时间的变化规律。
细菌生长曲线通常可以分为四个阶段:潜伏期、指数期、平稳期和衰亡期。
在潜伏期,细菌数量较低,适生环境适宜时,细菌开始繁殖。
进入指数期后,细菌数量呈指数增长,繁殖速度较快。
在平稳期,细菌数量达到平衡,新生细菌数量与死亡细菌数量相等。
最后,在衰亡期中,细菌数量逐渐减少。
细菌生长曲线的测定对于科学研究和实际应用中有着重要意义。
在科学研究中,通过测定细菌生长曲线可以获得细菌的生命周期信息,了解其生长特性和繁殖机制。
这对于研究细菌的生物学特性、药物敏感性以及探索新的治疗方法具有指导意义。
此外,测定细菌生长曲线还可用于评估食品、水源等环境中的细菌污染情况,为公共卫生和食品安全提供重要依据。
在实际应用中,细菌生长曲线的测定可用于制定细菌培养条件和控制措施。
通过了解细菌的繁殖速度和繁殖条件,我们可以优化培养条件以提高细菌产量,或者通过调节环境因素来控制细菌的滋生。
此外,在药物研发和微生物工程中,测定细菌生长曲线可以评估抗生素对细菌的杀菌效果、药物毒性及其机制,为药物设计和微生物工程提供重要参考。
综上所述,细菌生长曲线的测定是一项生动、全面且具有指导意义的实验方法。
通过测定细菌数量随时间的变化规律,我们可以了解细菌的生长特性、繁殖机制和生命周期等信息。
实验报告细胞生长曲线的绘制实验报告范文_0298

2020实验报告细胞生长曲线的绘制实验报告范文_0298EDUCATION WORD实验报告细胞生长曲线的绘制实验报告范文_0298前言语料:温馨提醒,教育,就是实现上述社会功能的最重要的一个独立出来的过程。
其目的,就是把之前无数个人有价值的观察、体验、思考中的精华,以浓缩、系统化、易于理解记忆掌握的方式,传递给当下的无数个人,让个人从中获益,丰富自己的人生体验,也支撑整个社会的运作和发展。
本文内容如下:【下载该文档后使用Word打开】1,分别选取生长良好的P1、P3、P5代BMSCs消化后制备成细胞悬液,调整细胞密度为5x104/ml。
接种到96孔板,每孔接种200μl细胞悬液进行培养(每孔1x104细胞)。
2,培养16-48后,每天选择6个培养孔各自加入MTT溶液(5mg/ml)20μl,37℃继续孵育。
3,孵育4h后终止培养,吸出孔内上清,此时应该倾斜96孔板,用枪头小心的将上清液吸去,不可吸去下面的结晶颗粒,慢慢吸去。
每孔加入150μlDMSO,室温振荡10min,使结晶充分溶解,于试验孔平行设不加细胞只加培养液的空白对照1孔。
【1】1,两种方法分离小型猪骨髓间充质干细胞的比较分别取两组0,1,3代细胞,制成1x103的细胞悬液,接种到96孔板,每孔细胞悬液200微升,置37℃、5%CO2饱和湿度孵箱内孵育,各组每24小时分别取出4孔,每孔加入MTT(2mg/ml)20微升37℃孵育,4h后吸弃孔内培养液,每孔加入150微升分析纯的二甲基亚砜,移至酶联免疫检测仪上振荡10min,用分光光度计在492nm波长处测定每孔的吸光度值(OD492),以OD(492)值为纵坐标,时间为横坐标绘制生长曲线【2】来自:SD大鼠骨髓间充质干细胞体外分离培养的实验研究大鼠MSCs生长曲线测定:为了定量测定大鼠BMSCs的生长状况,对来源于同一动物的原代细胞进行连续培养。
分别选取生长良好的P1、P3、P5代BMSCs消化后制备成细胞悬液,调整细胞密度为5x104/ml。
实验三 二次生长曲线

二展曲线(二次生长曲线) 二展曲线(二次生长曲线)
培养基中同时存在两类糖时细菌生长表现出一 条双峰的生长曲线。 条双峰的生长曲线。
第一类:如葡萄糖、甘露糖、果糖、 第一类:如葡萄糖、甘露糖、果糖、蔗糖或甘露醇等 第二类:如麦芽糖、阿拉伯糖、 第二类:如麦芽糖、阿拉伯糖、山梨醇或环己六醇等
二次生长现象的机理
2:45 2:50 3:00 3:30 4:00 4:30 5:00
2组 10,11,12 2组 13,14,15 3组 16,17,18 3组 19,20,21
分别测定OD值,计算平均值。 值 计算平均值。 分别测定
四、结果与讨论
以生长时间为横坐标, 以生长时间为横坐标,A600为纵坐标绘 制生长曲线。 制生长曲线。 结合诱导酶形成过程解释 E.coli 二展生 长曲线。 长曲线。 实验操作中如何保证菌体快速增长? 实验操作中如何保证菌体快速增长?
微生物利用葡萄糖的酶系是固有的, 微生物利用葡萄糖的酶系是固有的,而利用乳糖 或阿拉伯糖、半乳糖等)的酶系是诱导形成的。 (或阿拉伯糖、半乳糖等)的酶系是诱导形成的。由 于合成新的酶系需要一定的时间, 于合成新的酶系需要一定的时间,所以在二次生长之 间出现了一段停滞期。 间出现了一段停滞期。 研究表明不是葡萄糖本身阻遏了乳糖分解的酶系的 合成,而是细胞内cAMP的浓度在起作用。当有葡萄糖 的浓度在起作用。 合成,而是细胞内 的浓度在起作用 细胞内cAMP水平低;当葡萄糖被利用后,cAMP 水平低; 时,细胞内 水平低 当葡萄糖被利用后, 的浓度上升。 的浓度上升。
CAP activator LacI repressor (constitutive) cAMP Allolactose CAP = catabolite activator protein
生长曲线名词解释微生物学

生长曲线名词解释微生物学
生长曲线是表示微生物生长过程中细胞数量或生物量随时间变化趋势的曲线。
通过生长曲线,可以了解微生物的生长规律和特点,包括生长速率、生长周期、生长峰期等。
在微生物学实验中,通常将一定量的微生物接种到适宜的培养基中,在不同的温度、pH值、氧气等条件下培养,定期测定细胞数量
或生物量,以时间为横坐标,以细胞数量或生物量为纵坐标绘制生长曲线。
生长曲线可以分为以下几个阶段:
1. 延迟期:在这一阶段,微生物逐渐适应环境,开始准备生长,但细胞数量没有明显增加。
2. 对数生长期:在这一阶段,微生物以最大的生长速率进行生长,细胞数量呈指数增长。
3. 稳定期:在对数生长期结束后,细胞生长速率逐渐降低,细胞数量维持稳定,这一阶段也称为平台期。
4. 衰亡期:在这一阶段,细胞开始死亡,细胞数量逐渐减少。
通过生长曲线的研究,可以了解不同微生物的生长特点,从而为工业发酵、生物工程等领域提供重要的基础数据和指导。
同时,也可以利用生长曲线对微生物进行控制和优化,以提高生产效率和产品质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4:30
5:00
2-4组每隔5分钟取样,每次3瓶,分别测定OD值,计算平均值。
四、结果与讨论
以生长时间为横坐标,光密度(OD值) 为纵坐标绘制生长曲线。
结合诱导酶形成过程解释E.coli二展生 长曲线。 实验操作中如何保证菌体快速增长?
附录:牛肉膏蛋白胨液体培养 基
牛肉膏 3g 蛋白胨 10g NaCl 5g 水 1000ml pH 7.0-7.2
实验四 微生物二展生长曲线
一、基本原理
典型生长曲线
延滞期、对数
微生物生长测定方法
•干重法 •比浊法 •生理指标法 •稀释平板计数法 •血球计数法
生长期、稳定 期、衰亡期 二展曲线(二次生长 曲线) 一条双峰的生长曲线。
培养基中同时存在两类糖时细菌生长表现出
第一类:如葡萄糖、甘露糖、果糖、蔗糖或甘露醇 第二类:如麦芽糖、阿拉伯糖、山梨醇或环己六醇
4. 摇床振荡培养 将发酵瓶置37℃恒温室摇床振荡培养3小 时,按编号顺序分别按下面时间取出,每次取3瓶(即3个 重复),用721型分光光度计测OD450nm ,计算其平均值, 填下表。
负责 人
瓶号
再培养时间
OD值
负责人
瓶号
再培养时间 OD值
1组 1组 1组
1,2,3 4,5,6 7,8,9
0 2 2:20
14周(5月20日)实验操作考试
考核内容:微生物生理学基本实验 操作、原理及注意事项
二、实验器材
菌种:液体培养基
生长培养基:K2HPO4 0.7g,KH2PO4 0.3g, MgSO4.7H2O 0.1g,(NH4)2SO4 1g,NaCl 0.5g,葡 萄糖 0.5g,乳糖 1g,蒸馏水 1000ml
仪器或其他用具:比色杯,分光光度计
四、操作步骤
1. 取培养24h的E.coli斜面加5ml无菌水洗下,接种于肉膏蛋 白胨培养基中,摇床活化3h,供实验接种用。 2. 配制生长培养基 ,用250ml三角瓶装置50ml,共装42瓶。 加好纱布塞,115OC灭菌25分钟。 3. 接种 将上述准备好的处于对数生长期的大肠杆菌悬液 每瓶接1ml。
4组 4组 5组
22,23,24 25,26,27 28,29,30
2:45 2:50 3:00
2组 10,11,12
2组 13,14,15
2:25
2:30
5组
5组
31,32,33
34,35,36
3:30
4:00
3组 16,17,18
3组 19,20,21
2:35
2:40
6组
6组
37,38,39
40,41,42
