浸润性乳腺癌风险分级
乳腺癌分期标准最新版

乳腺癌的分期标准本分期标准内容出自于《乳腺癌诊疗指南》(2022年版),为最新版本。
乳腺癌的分期方案:肿瘤分期包括了肿瘤的大小、累及范围(皮肤和胸壁受累情况)、淋巴结转移和远处转移情况。
正确的肿瘤分期是指导患者个体化治疗决策的基础。
乳腺癌患者要进行临床分期和病理分期。
第8版AJCC乳腺癌分期对肿瘤大小的测量做出了详尽的规定。
肿瘤大小的测量有多种方法,包括临床触诊、影像学评估、病理大体测量和显微镜下测量。
乳腺癌分期中涉及到的肿瘤大小是指浸润性癌的大小。
由于体检、影像学及大体检查均无法区分浸润性癌和导管内癌,因此显微镜下测量应该是最准确的测量方式。
如果浸润性癌范围较大,无法用1个蜡块全部包埋,则以巨检时的肿瘤大小为准。
若浸润性癌病灶局限,可以用1个蜡块全部包埋,则肿瘤大小以显微镜下测量的大小为准。
(1)如果肿瘤组织中有浸润性癌和原位癌2种成分,肿瘤的大小应该以浸润性成分的测量值为准,可注明原位癌的范围和比例等。
(2)原位癌伴微浸润:出现微浸润时,应在报告中注明,并测量微浸润灶最大径;如为多灶微浸润,浸润灶大小不能累加,需在报告中注明多灶微浸润,并测量最大浸润灶的大小。
(3)对于肉眼能确定的发生于同一象限的2个以上多个肿瘤病灶,应在病理报告中注明为多灶性肿瘤,并分别测量大小。
(4)对于肉眼能确定的发生于不同象限的2个以上多个肿瘤病灶,应在病理报告中注明为多中心性肿瘤,并分别测量大小。
(5)如果肿瘤组织完全由DCIS组成,应尽量测量其范围。
淋巴结状态是决定乳腺癌患者治疗和预后的重要因素,对于淋巴结转移数位于分期临界值(如1、3和10个转移)附近时,要特别仔细观察淋巴结的转移数目,从而做出准确的pN分期。
新辅助治疗后标本的分期需结合临床检查、影像学检查和病理检查信息,根据手术切除标本的情况对治疗后的yT和yN进行判定。
1。
mr乳腺癌birads分级标准

mr乳腺癌birads分级标准全文共四篇示例,供读者参考第一篇示例:MR乳腺癌BIRADS分级标准是一种用于评估乳腺癌风险的系统性评估方法。
BIRADS分级标准是美国放射学会(ACR)制定的乳腺癌筛查评估工具,主要用于评估乳腺X线、超声和磁共振成像结果。
通过这种标准,医生可以更准确地评估乳腺肿瘤的性质,从而更好地指导治疗和预后。
MR乳腺癌BIRADS分级标准将乳腺成像结果分为七个不同的级别,分别为0级、1级、2级、3级、4级a级、4级b级、4级c级和5级。
每个级别对应着不同的临床意义和后续处理方案。
0级表示需要进一步的检查,通常是由于图像质量不佳或结果存在争议。
1级表示乳腺成像结果正常,没有发现明显异常。
2级表示存在良性结节或囊肿,通常是一种正常的生理变化,无需进一步处理。
3级表示存在可疑病变,需要进一步的观察和评估。
4级a级表示存在中度可疑病变,需要进行活检以明确诊断。
4级b级表示存在高度可疑病变,需要更多的临床检查和评估。
4级c级表示非常高度可疑,可能是乳腺癌,需要进行活检以明确诊断。
5级表示乳腺成像结果高度可疑为恶性病变,几乎可以确诊为乳腺癌,需要尽快进行治疗。
根据BIRADS分级标准,医生可以更好地指导患者进行进一步的检查和治疗,提高乳腺癌的早期诊断率和治疗效果。
MR乳腺癌BIRADS分级标准还包括了对乳腺癌风险因素的评估,例如年龄、家族史、激素替代治疗的使用等。
这些风险因素可以帮助医生更准确地评估患者的乳腺癌风险,及时进行干预和治疗。
MR乳腺癌BIRADS分级标准是一种重要的乳腺癌筛查评估工具,可以帮助医生更准确地评估患者的乳腺癌风险,及时进行干预和治疗,提高乳腺癌的早期诊断率和治疗效果。
希望通过这种标准,能够减少乳腺癌的死亡率,提高患者的生存率。
第二篇示例:MR乳腺癌BIRADS分级标准(Breast Imaging Reporting and Data System)是一种独立于其他乳腺癌诊断工具的评估方法,通过评估磁共振成像(MRI)结果,为医生提供对患者乳腺异常情况的准确评估和分类。
乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用

·专家讲座·乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用殷凯 汪洁(上海交通大学医学院附属同仁医院乳腺外科,上海 200336)摘 要 乳腺癌临床分期、病理分类分级和分子分型,一直以来都是乳腺癌诊疗中明确诊断、制订治疗计划,选择治疗方案的依据。
临床实践中的新发现也促使各种分类不断得到完善、更新和改进,使每一种分类方法与其他分类依据和方法相结合,发展出更精准的新分类和新亚型,并进一步发现新的治疗方式和治疗靶点。
本文综述临床上通用的乳腺癌分类方法及应用,以及在此基础上发展的新分类、分型及临床试验在治疗中的应用,并对最新的基因工具的应用进行系统性介绍,力图理清现今乳腺癌标准化、个体化治疗的决策依据,并展望未来更为精准化的发展趋势和方向。
关键词乳腺癌;临床分期;分子分型;个体化治疗;精准医学中图分类号:R737.9 文献标志码:A 文章编号:1006-1533(2023)14-0003-06引用本文殷凯,汪洁. 乳腺癌临床分期、病理分类分级和分子分型在精准诊治中的应用[J].上海医药, 2023, 44(14): 3-8; 16.Application of clinical staging, pathological classification and molecular subtyping in precise diagnosis and treatment of breast cancerYIN Kai, WANG Jie(Department of Breast Surgery of Tongren Hospital Affiliated to School of Medicine of Shanghai Jiao Tong University, Shanghai 200336,China)ABSTRACT The diagnosis, treatment planning and regimen decision of breast cancer are routinely made according to its clinical stage, pathological classification and molecular subtype. On the other hand, novel findings and issues raised from clinical practice also facilitated the innovation and development of staging and subtyping, hence promoted novel therapies and therapeutic targets. This systematic review will focus on the fundamental clinical staging, classification and subtypes of breast cancer, as well as the up-to-dated gene assays developed recently as prognostic and decision-making tools, to elucidate the decision basis for current precision treatments of breast cancer, and to look forward the prospect of precision medicine tendency in the near future.KEY WORDS breast cancer; clinical staging; molecular subtype; individualized treatment; precision medicine癌症分期是研究者根据癌症对身体的影响程度提出的评估系统,通常可以帮助医生制订针对癌症的治疗方案,也可以预测癌症对治疗的反应以及癌症患者的生存期。
nnis分级标准

nnis分级标准NNIS分级标准将患者分为以下4个级别:1. I级(clean)I级患者是指无感染风险或仅有最小感染风险的患者。
这些患者通常不需要特殊的感染控制措施。
无论在医院内还是在社区里,I级患者的感染风险都非常低。
2. II级(clean-contaminated)II级患者是指存在一定感染风险的患者,但手术切口或感染切口仅受有限污染的患者。
这些患者一般需要预防性抗生素和其他预防感染措施的帮助。
包括接受胆道、中空器官、胃肠道等手术的患者。
3. III级(contaminated)III级患者是指存在较高感染风险的患者,其手术切口或感染切口有明显污染的患者。
这些患者需要更严格的感染控制措施,包括更长时间的预防性抗生素和更频繁的伤口清洁处理。
包括发生器官破裂、严重创伤、感染等情况的患者。
4. IV级(dirty)IV级患者是指存在最高感染风险的患者,其手术切口或感染切口有严重污染的患者。
这些患者需要最严格的感染控制措施,包括最长时间的预防性抗生素、更频繁的伤口处理和更庞大的感染控制团队的支持。
包括多处受伤、肺部感染或腹腔感染等情况的患者。
NNIS分级标准的目的是将感染风险相似的患者分为同一级别,并根据患者的级别来确定预防感染的策略,以降低医院内感染的发生率和传播。
这种分类有助于医院准确评估患者的感染风险,并根据风险程度采取相应的预防措施,从而提高医疗质量和安全性。
需要注意的是,NNIS标准并不仅限于感染风险的分类,还包括其他评估指标,如感染发生率、感染部位、感染病原体等。
因此,医疗机构在实施感染控制方案时需要综合考虑多个因素,以制定最合适的措施。
同时,NNIS分级标准也需要与其他评估工具和指南结合使用,以便更全面地评估和控制感染风险。
总结来说,NNIS分级标准是一种将患者根据感染风险进行分类的标准,旨在帮助医疗机构制定相应的感染控制措施。
通过准确评估患者的感染风险,并采取相应的预防措施,可以有效降低医院内感染的发生率和传播风险。
2018版卫建委乳腺癌诊疗规范

通常情况下,腋窝淋巴结清扫范围应包括背
阔肌前缘至胸小肌外侧缘(Level Ⅰ)、胸小 肌外侧缘至胸小肌内侧缘(Level Ⅱ)的所有 淋巴结。清扫腋窝淋巴结要求在10个以上, 以保证能真实地反映腋窝淋巴结的状况。只 有当Level Ⅰ~Ⅱ明显转移或者Level Ⅲ(胸 小肌内侧缘至腋静脉入口处)探及增大转移 的淋巴结时才需进行Ⅰ~Ⅲ水平的全腋窝淋 巴结清扫。
乳腺癌切除乳房再造的基本原则如下
必须将肿瘤治疗放在首位。乳房再造的任何整形外科治疗都 不应推迟乳腺癌辅助治疗的时间,不应影响乳腺癌辅助治疗 的进行。 必须将乳房再造纳入乳腺癌的整个治疗方案,医师有义务告 知患者有选择进行乳房再造的权利。 在乳腺切除过程中,应在不违反肿瘤学原则的前提下,尽可 能保留乳房的皮肤、皮下组织以及重要的美学结构(如乳房 下皱襞等),最大限度地为乳房再造保留条件,提高再造乳 房美学效果和患者满意度。 乳腺癌的治疗应当在多学科团队合作框架下进行,包括放射 科、乳腺外科、整形外科、影像科、病理科、心理科、核医 学科、免疫科等。
高危人群乳腺癌筛查
建议对乳腺癌高危人群提前进行筛查(小于 40 岁),筛查间期推荐每年 1 次,筛查手段除了应用一 般人群乳腺 X 线检查之外,还可以应用 MRI 等影像 学手段。 乳腺癌高危人群符合以下3个条件,即①有明显的 乳腺癌遗传倾向者②既往有乳腺导管或小叶不典型增 生或小叶原位癌的患者③既往行胸部放疗。
一般风险人群妇女乳腺癌筛查
1. 20~39 岁 (1)每月 1 次乳腺自我检查。 (2)每 1-3 年 1 次临床检查。 2. 40~69 岁 (1)适合机会性筛查和群体性筛查。 (2)每 1~2 年 1 次乳腺 X 线检查(条件不具备时,可选择乳腺 超声检查)。 (3)对致密型乳腺(腺体为 c 型或 d 型)推荐与超声检查联合。 (4)每月 1 次乳腺自我检查。 (5)每年 1 次临床检查。 3. 70 岁以上 (1)机会性筛查(有症状或可疑体征时进行影像学检查)。 (2)每月 1 次乳腺自我检查。 (3)每年 1 次临床检查。
(整理)WHO乳腺肿瘤组织学分类-9月1日
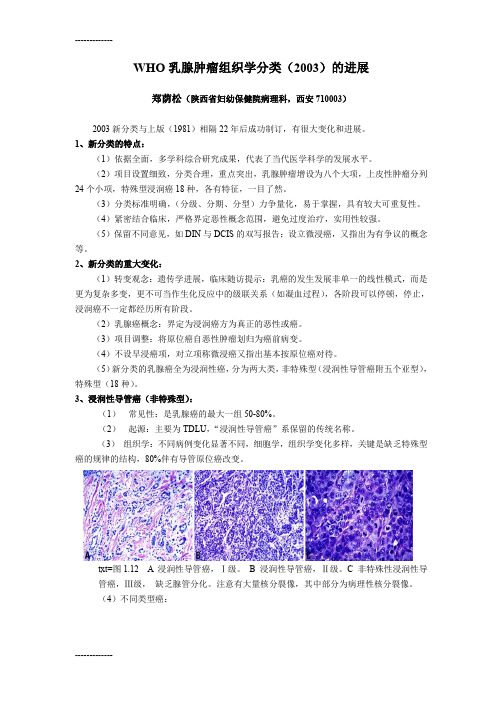
WHO乳腺肿瘤组织学分类(2003)的进展郑荫松(陕西省妇幼保健院病理科,西安710003)2003新分类与上版(1981)相隔22年后成功制订,有很大变化和进展。
1、新分类的特点:(1)依据全面,多学科综合研究成果,代表了当代医学科学的发展水平。
(2)项目设置细致,分类合理,重点突出,乳腺肿瘤增设为八个大项,上皮性肿瘤分列24个小项,特殊型浸润癌18种,各有特征,一目了然。
(3)分类标准明确,(分级、分期、分型)力争量化,易于掌握,具有较大可重复性。
(4)紧密结合临床,严格界定恶性概念范围,避免过度治疗,实用性较强。
(5)保留不同意见,如DIN与DCIS的双写报告;设立微浸癌,又指出为有争议的概念等。
2、新分类的重大变化:(1)转变观念:遗传学进展,临床随访提示:乳癌的发生发展非单一的线性模式,而是更为复杂多变,更不可当作生化反应中的级联关系(如凝血过程),各阶段可以停顿,停止,浸润癌不一定都经历所有阶段。
(2)乳腺癌概念:界定为浸润癌方为真正的恶性或癌。
(3)项目调整:将原位癌自恶性肿瘤划归为癌前病变。
(4)不设早浸癌项,对立项称微浸癌又指出基本按原位癌对待。
(5)新分类的乳腺癌全为浸润性癌,分为两大类,非特殊型(浸润性导管癌附五个亚型),特殊型(18种)。
3、浸润性导管癌(非特殊型):(1)常见性:是乳腺癌的最大一组50-80%。
(2)起源:主要为TDLU,“浸润性导管癌”系保留的传统名称。
(3)组织学:不同病例变化显著不同,细胞学,组织学变化多样,关键是缺乏特殊型癌的规律的结构,80%伴有导管原位癌改变。
txt=图1.12 A 浸润性导管癌,Ⅰ级。
B 浸润性导管癌,Ⅱ级。
C 非特殊性浸润性导管癌,Ⅲ级,缺乏腺管分化。
注意有大量核分裂像,其中部分为病理性核分裂像。
(4)不同类型癌:①混合型癌:非特殊型构象<50%,余为特殊型。
图1.13 混合型浸润性导管和小叶癌。
可见肿瘤中两种明显不同的组织生长方式,左为导管癌,右为小叶癌。
nottingham标准

乳腺癌Nottingham分级属于浸润性乳腺癌的组织学分级系统,又被称为诺丁汉分级系统。
分级系统根据对腺管形成比例、细胞核多形性、核分裂象计数等评分,三项分值相加后将浸润性乳腺癌分为三级。
1、腺管形成比例评分:大于75%为1分,10%-75%为2分,不足10%为3分;
2、细胞核多形性评分:细胞核小并且规则一致为1分,细胞核中等大小、略多形性为2分,细胞核大且多形性为3分;
3、核分裂象计数评分:根据高倍镜下视野直径内核分裂相评分,核分裂象计数区域必须根据显微镜高倍视野的直径进行校正,有对应的表格查询积分,以1-3分的标准打分。
上述每项指标均需分别独立评估,再将三项指标所得积分相加,就可以对浸润性乳腺癌进行诺丁汉分级。
三项指标总得分在3-5分为1级,属于高分化、低级别的浸润性乳腺癌。
三项总分在6-7分为2级,属于中分化、中级别浸润性乳腺癌。
三项总分在8-9分为3级,属于低分化、高级别浸润性乳腺癌。
由此可见,乳腺癌诺丁汉分级时得分越高级别越高,恶性程度越高,预后越差。
乳腺癌组织学分级和病理分期

乳腺癌组织学分级和病理分期乳腺癌是一种常见的恶性肿瘤,根据乳腺癌的组织学分级和病理分期,可以更好地评估患者的病情和预后。
本文将详细介绍乳腺癌组织学分级和病理分期的相关内容,帮助读者更好地了解和应对乳腺癌。
一、乳腺癌组织学分级乳腺癌组织学分级是根据肿瘤细胞在镜下的形态特征进行评估的一种系统方法。
常用的乳腺癌组织学分级系统有Elston-Ellis分级法和Nottingham组织学分级法。
Elston-Ellis分级法主要根据乳腺癌细胞核大小和异型性(细胞核在形状和大小上与正常细胞相比的异常程度)来划分乳腺癌为三个等级:Ⅰ级(低分级)、Ⅱ级(中分级)和Ⅲ级(高分级)。
其中,Ⅰ级乳腺癌细胞核大小相对较小、异型性较低,预后相对较好;Ⅲ级乳腺癌细胞核大小较大、异型性明显,预后较差。
Nottingham组织学分级法综合考虑了乳腺癌的核分裂数目、核异型性和管状结构形成情况。
根据得分来进行分级,总分越高,分级越高,预后越差。
乳腺癌组织学分级的目的是通过评估肿瘤的组织学特征,初步了解肿瘤的恶性程度和患者的预后状况,从而有针对性地制定治疗方案和预测患者的生存期。
二、乳腺癌病理分期乳腺癌病理分期是根据乳腺癌的扩散程度和转移情况进行分期的。
目前最常用的乳腺癌病理分期系统是TNM分期系统。
TNM分期系统将乳腺癌的病理分期分为以下几个阶段:1. T期(原发肿瘤):根据原发肿瘤的大小和侵袭情况进行分期。
T0代表没有原发肿瘤,T1代表肿瘤直径小于2厘米,T2代表肿瘤直径大于2厘米但小于5厘米,T3代表肿瘤直径大于5厘米,T4代表肿瘤侵犯胸壁或侵犯皮肤。
2. N期(淋巴结转移):根据淋巴结的受累情况进行分期。
N0代表没有淋巴结转移,N1代表腋窝淋巴结转移,N2代表腋窝淋巴结转移和锁骨上淋巴结转移,N3代表腋窝淋巴结转移、锁骨上淋巴结转移和锁骨下淋巴结转移。
3. M期(远处转移):根据是否存在远处器官的转移情况进行分期。
M0代表没有远处转移,M1代表有远处转移。
浸润性乳腺癌

浸润性乳腺癌浸润性乳腺癌(invasive breast cancer)是一种女性常见的恶性肿瘤,患者的预后与癌症的早期诊断和治疗密切相关。
在这篇文章中,我们将探讨浸润性乳腺癌的病因、症状、诊断和治疗等方面,并提出预防与早期筛查的重要性。
浸润性乳腺癌是由乳腺内细胞异常增殖引起的肿瘤,它们可以通过乳管和腋窝淋巴结扩散到身体的其他部位。
目前,科学家尚未完全确定乳腺癌的确切病因,但一些风险因素已经被识别出来。
这些风险因素包括女性激素水平异常,家族史,年龄,个人生活方式等。
然而,我们应该意识到,即使没有这些风险因素,任何女性都有可能患上乳腺癌,因此对于每个女性来说,都应该重视预防和早期筛查。
浸润性乳腺癌的症状通常是不明显的,特别是在早期。
最常见的症状是肿块或肿块的存在。
这些肿块可以是无痛的,呈圆形或不规则形状,并且可以在触摸时有明显的运动。
乳腺癌的其他症状包括乳房皮肤颜色和形状的改变,乳头溢液,乳房或乳腺淋巴结肿大,以及乳房区域的疼痛或刺痛感。
如果有这些症状,应尽快就医,以确立诊断并进行早期治疗。
乳腺癌的诊断通常包括乳腺检查、乳房X线、乳房超声和乳腺穿刺活检等。
这些诊断方法可以帮助医生了解肿瘤的大小、位置和恶性程度,从而确定合适的治疗方案。
对于乳腺癌的早期诊断,乳房X线,即乳房X线摄影术(mammography)是一种常用的筛查方法。
根据年龄和个人风险,医生可能会建议每年或每两年进行乳房X线检查。
对于高风险人群,如有家族史或BRCA1和BRCA2突变的人,医生可能会建议更频繁的乳房X线检查。
一旦确诊浸润性乳腺癌,患者应该尽早开始治疗。
治疗乳腺癌的方法通常包括手术切除肿瘤、放疗和化疗。
手术切除通常是一个重要的治疗步骤,可以通过局部切除肿瘤或全乳切除来实现。
辅助放疗和化疗可以帮助杀死隐藏在乳腺内或身体其他部位的癌细胞,以减少复发率。
对于某些患者,激素治疗也可能是必要的。
除了治疗外,预防和早期筛查在乳腺癌的管理中起着至关重要的作用。
乳腺超声分级标准

乳腺超声分级标准
乳腺超声分级一般指的是BI-RADS分级,为乳腺超声诊断应用的分级标准,用来评价乳腺病变良性、恶性的程度。
BI-RADS分级一共分为7个等级,包括0-6级,分别代表着不同的含义:
1、0级:较为特殊,临床上认为本次检查结果无意义,需再次进行检查;
2、1级:指的是超声检查没有看到乳腺病变,检查结果为阴性;
3、2级:指的是虽然看到了乳腺有病灶,但是可以确定为良性病变;
4、3级:指良性病变可能性比较大,恶性风险较小(小于2%);
5、4级:4级又分为4a、4b和4c三个级别,指的是怀疑这个结节可能恶变,4a的恶性几率大概在10%,4b的恶性几率大概在30%,4c的恶性几率大概在50%;
6、5级:指的是高度怀疑乳腺结节为恶性,也就是恶性的可能性可以达到90%,基本上可以确诊为乳腺癌,需要尽早进行治疗;
7、6级:如果超声检查结果提示乳腺病灶的等级为6级,基本可以确定是乳腺癌,而且应该不属于早期的乳腺癌,因为在超声下表现得比较典型,说明乳腺癌处于进展期,需配合医生及早治疗。
建议定期复查乳腺超声检查,如果有变化,应该积极地进行治疗。
平时需要注意适当运动,避免熬夜、劳累,以及心情烦躁等,应保持良好心态和愉快心情,对身体健康有利。
【衡道丨干货】乳腺特殊类型浸润性癌小结(上)

【衡道丨干货】乳腺特殊类型浸润性癌小结(上)在日常工作中,乳腺浸润性癌非常常见,根据它们的临床和病理特征,大致可分为两大类:特殊类型(如小叶癌、小管癌、黏液癌等)和非特殊类型,后者占大多数。
随着第5版《乳腺肿瘤WHO分类》出版,乳腺浸润性癌的特殊类型和非特殊类型的概念发生了一些调整。
接下来我们结合新、旧两版WHO内容,回顾一下乳腺特殊类型浸润性癌基本病理特征。
由于文章篇幅较长,将分成上下两篇,今天先带来上半部分的内容,之后小衡再来分享下半部分,敬请锁定「衡道病理」公众号。
基本概念浸润性乳腺癌(IBC)是乳腺腺体发生的一大类异质性、恶性上皮肿瘤,具有较广泛的形态谱系。
浸润性乳腺癌,特殊类型最新版乳腺WHO要求≧90%的肿瘤成分表现出特殊的组织学类型,例如小叶癌、小管癌和黏液癌等。
浸润性乳腺癌,非特殊类型(IBC-NST)是一大类异质性的浸润性乳腺癌,占乳腺浸润性癌的多数,形态学上不能归类为任何特殊的组织学类型,同义词包括浸润性导管癌、浸润性乳腺癌,NOS等。
疾病列表表格说明:根据2019版乳腺WHO肿瘤分类,乳腺浸润性癌中的特殊类型包含8种,分别是小叶癌、小管癌、筛状癌、黏液腺癌、黏液性囊腺癌、乳腺浸润性微乳头状癌、大汗腺癌和化生性癌。
病理特征1、乳腺浸润性小叶癌(ILC)(1)临床特征:•约占乳腺浸润性癌5%-15%;•好发于57-65岁,稍大于IBC-NST患者;•部分病例为多灶发生;•10%-20%累及双侧乳腺;•钼靶上最常表现为毛刺状包块,钙化少见;•与钙黏着蛋白基因(CDH1)种系突变有关;•相比IBC-NST:小叶癌患者年龄稍大、腋窝淋巴转移少见、长期预后相似;(2)病理形态:结构•肿块大体常界限不清;•肿瘤细胞在纤维基质内单个散在分布;•部分肿瘤细胞排列呈单行线状;•部分肿瘤细胞围绕正常导管呈靶环状排列;•通常缺乏腺管形成(腺管形成3分);•肿瘤缺乏宿主反应,背景结构保存;•大多伴有小叶原位癌成分;细胞•肿瘤细胞体积较小;•肿瘤细胞彼此之间缺乏粘附性;•肿瘤细胞核呈卵圆形,胞浆稀薄;•细胞核染色质均匀细腻,核仁不明显;•肿瘤细胞核异型性小(核级1-2级);•核分裂象罕见(多形性亚型除外);(3)少见特征:•有时细胞胞浆可见黏液空泡;•有时细胞内黏液增多呈印戒样;•有时细胞浆含泡沫状颗粒,呈组织细胞样;•间质可能出现丰富的细胞外黏液;•有时合并存在IBC-NST;(4)免疫组化:•ER:经典型ILC几乎总是阳性;•PR:阳性率60-70%(腺泡型最高,多形性最低);•ERBB2(HER2)扩增和过表达:ILC很少见;•E-cadherin:ILC细胞膜阴性(约15%例外);•P120:ILC细胞膜阴性;•P53、CK14、CK5/6、SMA和P63:很少表达;图1:乳腺浸润性小叶癌;乳腺组织内,肿瘤细胞散在分布,部分呈单行线性排列。
乳腺超声钙化分级标准birads

乳腺超声钙化分级标准birads乳腺超声检查是评估乳腺疾病的一种重要影像学检查方法,而钙化是乳腺疾病的常见表现之一。
为了规范乳腺超声检查中钙化灶的评估和分级,美国影像医学会(ACR)制定了乳腺影像报告和数据系统(BI-RADS)。
该系统根据钙化灶的形态、分布等特征,将其分为0-6级,以指导临床诊疗决策。
BI-RADS 0级表示评估不完整,需要进一步检查或对比以往影像资料。
这一级别常见于初筛时发现的一些非特异性钙化,或者技术因素导致的图像质量欠佳,无法做出明确判断的情况。
BI-RADS 1级为阴性,即未发现任何异常钙化。
这种情况下,可以建议患者遵循常规的筛查间隔,一般为1-2年。
但对于高危人群,如乳腺癌家族史、既往乳腺活检提示良性病变等,可能需要更频繁的随访。
BI-RADS 2级为良性发现,主要包括典型的皮肤钙化、血管钙化、粗大的杆状钙化、圆形钙化伴音晕等。
这些钙化灶通常与年龄相关,或者由良性病变如脂肪坏死、乳腺囊肿等引起。
对于BI-RADS 2级钙化,临床医生一般建议患者遵循常规筛查。
BI-RADS 3级为可能良性,通常表现为数量较少、分布局限的细小钙化灶。
这类钙化虽然可疑度较低,但仍需要进一步随访以明确其性质。
一般建议6个月后复查乳腺超声,如果钙化灶无明显变化,可以延长随访间隔至1-2年;如果钙化灶增多、分布范围扩大或形态趋于多形性,则需要考虑活检等进一步检查。
BI-RADS 4级为可疑恶性,细分为4A、4B、4C三个亚级。
其中,4A级表示恶性可能性低,通常表现为形态和分布欠规则的细小钙化灶,建议行乳腺穿刺活检明确诊断;4B级表示恶性可能性中等,常见于数量较多、分布欠均匀、部分呈线状或分支状的多形性钙化,需要行乳腺穿刺或空芯针活检;4C级提示恶性可能性高,主要为细小多形性钙化伴分布密集或线样排列,高度提示导管内病变,应尽快行组织学检查明确诊断。
对于BI-RADS 5级钙化,恶性可能性极高,超声表现为不规则形态、成簇或线样分布的多形性细小钙化,部分可伴有恶性肿块。
乳腺癌rs评分标准

乳腺癌rs评分标准
乳腺癌的RS评分标准是指根据乳腺癌组织的组织学类型、肿瘤大小、淋巴结转移情况和雌激素受体(ER)、孕激素受体(PR)以及人类表皮生长因子受体2(HER2)状态来确定患者的预后和治疗方案的一种评分系统。
具体而言,乳腺癌RS评分标准主要有以下几个方面:
1. 组织学类型:乳腺癌可分为浸润性导管癌、浸润性小叶癌和其他类型。
不同组织学类型的乳腺癌预后和治疗策略有所不同。
2. 肿瘤大小:乳腺癌的大小可以通过肿瘤的直径来衡量。
一般来说,肿瘤越大,生长越快,预后越差。
3. 淋巴结转移:乳腺癌的转移往往首先发生在淋巴结中。
根据淋巴结的受累情况,乳腺癌可分为无淋巴结转移、腋窝淋巴结转移和远处淋巴结转移。
4. ER和PR状态:ER和PR是乳腺癌细胞中的激素受体,它们的存在与否影响着乳腺癌的预后和治疗效果。
阳性表示患者对内分泌治疗敏感,预后较好。
5. HER2状态:HER2是一种参与细胞增殖的蛋白质,高表达HER2的乳腺癌患者预后较差,但使用靶向药物可以改善预后。
根据以上因素,乳腺癌的RS评分可分为低风险组、中等风险组和高风险组,不同风险组的患者可以根据评分结果来制定相应的治疗方案,包括手术切除、放疗、化疗、内分泌治疗或靶向治疗。
乳腺BI-RADS分级

•
• ① ②
③ ④ ⑤
良性征象:圆形或椭圆形、长轴和胸壁平行,低 回声薄壁。 恶性征象:符合其中一条应该考虑恶性 形状不规则,纵横比大于1 边界不清晰,有成角、毛刺、结节样突出(小分 叶) 明显低回声,后方回声增强,周边强回声晕 内部微小钙化 血流穿入,血管粗大紊乱
纵横比>1。病理证实 为IDC。
指阴性或正常,超声检查未见异常改变。 有把握判断为正常。建议随诊(一年) 患癌风险<2%。
良性征象。基本上可以排除恶性。建议根据年龄及临床
表现随诊(半年至一年) 1.单纯性囊肿 2.乳腺内淋巴结(也可能属于1级) 3.乳腺假体植入
4.多次复查超声检查图像变化不大,年龄<40岁的纤维腺
复合扫查式
-----放射状扫查与纵横 扫查相结合的方式
可疑病灶 二个垂直的切面或 更多的切面予以显示 使其具有可重复性
检查快要结束时
进行一系列放射状、横断面或矢状位的扫查 尤其要仔细观察cooper韧带的走行 可通过韧带走行的中断来识别微小肿瘤
mass
正常cooper’s韧带
中断的cooper’s韧带
瘤或首次超声检查年龄<25岁的纤维腺瘤、手术后结构
欠规则但多次复查图像无变化。
5.脂肪小叶。
指可能良性征象,恶性的危险性<2%。建议短期随访(3-6个
月)及其他检查。 1.年龄<40岁的实性椭圆形、边界清、纵横比<1的肿块,良 性可能 2.考虑纤维瘤可能性大:实性肿块呈椭圆形、边界清、纵横
复合性囊肿
34岁女性,复合性囊肿,显示为边界清晰的 卵圆形肿块,内部均匀的低回声(箭头示)。抽 吸术抽出2ml乳性液体,切除活组织检查检查为急 慢性非特异性炎症
乳腺超声诊断分级标准规范

乳腺超声诊断分级标准规范在阅读乳腺超声报告时,我们常会见到这样一组英文字母,许多朋友在咨询中也常提到,即:BI-RADS。
这组字母是 Breast Imaging Reporting andData System(乳腺影像报告和数据系统)的英文缩写,是目前乳腺超声诊断普遍应用的分级评价标准。
现在我们一起来了解一下BI-RADS分级标准的具体含意:0级(category 0):指采用超声检查不能全面评价病变,需要进一步的其它影像学检查诊断。
例如:1、有乳头溢液、不对称增厚、皮肤及乳头改变等临床表现,而超声无征象;2、临床触及肿块,年龄大于20岁,超声检查有可疑征象或无特征,需乳腺钼靶检查;3、超声检查及钼靶检查均无特征,需鉴别乳腺癌保乳术后形成的疤痕与复发病灶时,推荐磁共振检查;4、确定治疗前,需最后评估者确定治疗前需最后评估者:1级(category 1):阴性(negative)指超声检查未见异常改变,有把握判断为正常。
建议随诊(一年)。
例如:无肿块、无结构紊乱、无皮肤增厚、无微钙化;2级(category 2):良性征象(benign finding/findings)基本可以排除恶性。
建议根据年龄及临床表现随诊(半年至一年)。
例如:单纯性囊肿乳腺内淋巴结(也可能属1级)乳腺假体植入多次复查超声,图像变化不大,年龄小于40岁的纤维腺瘤或首次超声检查年龄小于25岁的纤维腺瘤;手术后结构欠规则,但多次复查超声,图像无变化。
脂肪小叶3级(category 3):可能良性征象(probaly benign finding) 恶性危险小于2%。
建议短期随访(三至六个月)及其它检查。
例如:年龄小于40岁的实性椭圆形、边界清、纵横比小于1的肿块,良性可能,恶性的危险性小于2%;考虑纤维腺瘤可能性大:实性肿块呈椭圆形、边界清、纵横比小于1。
经过连续二至三年的复查,可将原先的3级(可能良性)改为2级(良性);多发性复杂囊肿或簇状小囊肿瘤样增生结节(属不确定一类)4级(category 4):可疑恶性(suspicious abnormality)需病理学检查,恶性危险性 3%-94%。
乳腺癌的病理分级与预后评估

乳腺癌的病理分级与预后评估乳腺癌是在女性中最常见的恶性肿瘤之一,病理分级和预后评估是指根据病理学特征和其他相关因素来判断患者乳腺癌的恶性程度和预后情况。
准确的病理分级和预后评估对于乳腺癌的治疗方案选择和预后判断具有重要意义。
一、病理分级乳腺癌的病理分级是根据肿瘤组织在显微镜下的形态特征来进行判断的。
常用的病理分级体系是根据肿瘤细胞的分化程度、核分裂象的数量以及肿瘤的组织结构等进行评估。
1. 核分裂数量(Nuclear Grade):核分製数量是指肿瘤细胞核内的分裂像的数量。
分裂像的增多代表肿瘤细胞的活跃程度和增殖能力的加强,也意味着肿瘤的恶性程度较高。
通常将核分裂数量分为3级,分别为Ⅰ级(低分裂率)、Ⅱ级(中度分裂率)和Ⅲ级(高分裂率)。
2. 分化程度(Differentiation):分化程度是指肿瘤组织细胞与正常组织细胞的相似性程度,也常称为肿瘤细胞的“好坏程度”。
一般分为3级,分别为Ⅰ级(高分化)、Ⅱ级(中分化)和Ⅲ级(低分化)。
分化程度越高,肿瘤细胞的形态和功能与正常细胞越相似,预后越好。
3. 腺体形态(Tubule Formation):腺体形态是指肿瘤组织中腺体的形成程度。
腺体是乳腺组织中正常的组织结构,储存和排泄乳汁。
正常的腺体形态代表肿瘤较为亲近正常组织,表明预后较好。
以上三个特征被广泛应用于乳腺癌的病理分级中,常用的病理分级方法有Nottingham分级系统和Elston-Ellis分级方法。
通过对肿瘤标本中肿瘤细胞分化程度、核分裂数量和腺体形态等特征的分级,可以评估乳腺癌的病理学特征,从而判断乳腺癌的恶性程度和预后风险。
二、预后评估乳腺癌的预后评估是根据病理分级结果以及其他相关因素来判断患者的存活率和复发率。
常用的预后评估指标包括年龄、肿瘤大小、淋巴结转移情况、激素受体状态和HER2状态等。
1. 年龄:年龄是乳腺癌患者预后的重要因素之一。
年龄较小的患者通常有较好的预后,而年龄较大的患者预后相对较差。
浸润性乳腺癌风险分级

浸润性乳腺癌风险分级(St.Ga11en2007)
低风险:淋巴结阴性并符合下列全部条件:
肿瘤病理测量≤2cm,
组织学分级1级
没有广泛的瘤周脉管癌栓
雌激素和/或孕激素受体阳性
无HER2/neu基因扩增或HER2∕neιι蛋白过度表达
年龄235岁
中风险:淋巴结阴性并符合下列任一条件
肿瘤病理测量>2cm,
组织学分级2—3级
有广泛的瘤周脉管癌栓
雌激素和/或孕激素受体阴性
HER2∕neu基因扩增或HER2∕neu蛋白过度表达年龄V35岁
1一3个阳性淋巴结,且雌激素和/或孕激素受体阳性和HER2∕neu基因扩增或HER2∕neu蛋白过度表达
高风险:1一3个阳性淋巴结,且雌激素和/或孕激素受体阴性,或HER2∕neu基因扩增或HER2/neu蛋白过度表达
≥4个阳性淋巴结。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浸润性乳腺癌风险分级(St. Gallen 2007)
低风险:淋巴结阴性并符合下列全部条件:
肿瘤病理测量≤2 cm,
组织学分级1级
没有广泛的瘤周脉管癌栓
雌激素和/或孕激素受体阳性
无HER2/neu基因扩增或HER2/neu蛋白过度表达
年龄≥35岁
中风险:淋巴结阴性并符合下列任一条件
肿瘤病理测量>2 cm,
组织学分级2-3级
有广泛的瘤周脉管癌栓
雌激素和/或孕激素受体阴性
HER2/neu基因扩增或HER2/neu蛋白过度表达年龄<35岁
1-3个阳性淋巴结,且雌激素和/或孕激素受体阳性和HER2/neu基因扩增或HER2/neu蛋白过度表达
高风险:1-3个阳性淋巴结,且雌激素和/或孕激素受体阴性,或HER2/neu基因扩增或HER2/neu蛋白过度表达
≥4个阳性淋巴结。
