谷胱甘肽过氧化物酶(GPX)活性检测试剂盒说明书 微量法
碧云天谷胱甘肽过氧化物酶检测试剂盒说明书

碧云天生物技术/Beyotime Biotechnology 订货热线:400-1683301或800-8283301 订货e-mail :******************技术咨询:*****************网址:碧云天网站 微信公众号谷胱甘肽过氧化物酶检测试剂盒(NADPH 法)产品编号 产品名称包装 S0056谷胱甘肽过氧化物酶检测试剂盒(NADPH 法)100次产品简介:谷胱甘肽过氧化物酶检测试剂盒(NADPH 法)(Cellular Glutathione Peroxidase Assay Kit with NADPH)是一种简单易行的通过紫外比色来检测细胞、组织或其它样品中谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)活性的试剂盒。
绝大部分细胞内的谷胱甘肽过氧化物酶都是含硒的,且硒为该酶的活性中心组成部分。
细胞内也有很少量的不含硒的谷胱甘肽过氧化物酶存在。
本试剂盒检测的是最常见的含硒的谷胱甘肽过氧化物酶。
本试剂盒的使用灵活方便,样品用量和检测时间的范围宽,样品用量可以根据样品中GPx 的活力在0.1-50微升之间调整,检测时间可以根据样品中GPx 的活力在5-30分钟内进行调整。
本试剂盒和总谷胱甘肽过氧化物酶检测试剂盒(S0058)配合使用,可以定量检测出样品中不含硒的谷胱甘肽过氧化物酶。
谷胱甘肽过氧化物酶可以清除活细胞内的过氧化物,在保护细胞免受自由基损伤过程中起着关键作用。
细胞内的脂类容易和自由基发生反应,产生脂类过氧化物。
谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)还原脂类过氧化物,从而消除自由基的毒害作用。
谷胱甘肽过氧化物酶几乎在所有组织中都有分布。
在一些病理状况下谷胱甘肽过氧化物酶的活力会发生明显上调或下调。
谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)催化过氧化氢以及许多有机过氧化物,产生水或有机醇。
但以过氧化氢为底物进行检测会受同样可以分解过氧化氢的过氧化氢酶(Catalase)的影响,因为过氧化氢酶的酶活性会干扰谷胱甘肽过氧化物酶的测定。
谷胱甘肽还原酶检测试剂盒(DTNB法)说明书

谷胱甘肽还原酶检测试剂盒(DTNB 法)产品简介:谷胱甘肽还原酶检测试剂盒(DTNB 法) (Glutathione Reductase Assay Kit with DTNB)是一种简单易行的通过比色法来检测细胞、组织或其它样品中谷胱甘肽还原酶(Glutathione reductase, GR)活性的试剂盒。
谷胱甘肽还原酶在许多组织中都有分布,可以维持细胞内充足的还原型谷胱甘肽(GSH)水平。
GSH 可以清除自由基和一些有机过氧化物,或作为谷胱甘肽氧化酶(Glutathione peroxidase)的底物来清除一些过氧化物。
谷胱甘肽还原酶可以还原氧化型谷胱甘肽(GSSG)生成还原型谷胱甘肽(GSH),而GSH 可以和生色底物DTNB 反应产生黄色的TNB 和GSSG ,并可以通过测定A 412来检测TNB 的生成量。
适当设置应体系,前后两个反应合并起来后,GSSG/GSH 过量而GR 相对不足时,该反应体系中谷胱甘肽还原酶就成为整个反应体系的限速因素,此时黄色的TNB 生成量和谷胱甘肽还原酶的活性呈线性正相关。
从而通过测定A 412就可以计算出谷胱甘肽还原酶的活性水平。
本试剂盒的具体反应原理如下:两个反应相合并:本试剂盒检测肝脏样品的检测效果如图1所示。
图中可见,对于肝脏样品可以检测到比较强的谷胱甘肽还原酶的活性并且有很好的剂量效应。
图1. 谷胱甘肽还原酶检测试剂盒(DTNB 法)用于肝脏裂解样品的实测效果图。
本试剂盒可以检测组织匀浆液上清、细胞裂解液上清等生物样品中的谷胱甘肽还原酶的活性。
一个试剂盒共可以进行100次检测。
碧云天生物技术/Beyotime Biotechnology 订货热线: 400-1683301或800-8283301 订货e-mail :****************** 技术咨询: ***************** 网址: 碧云天网站 微信公众号保存条件:-20ºC保存,一年有效。
碧云天谷胱甘肽过氧化物酶检测试剂盒

¾ 谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)催化过氧化氢以及许多有机过氧化物,产生水或有机醇。如果以过氧 化氢为底物进行检测,则同样可以分解过氧化氢的过氧化氢酶(Catalase)的酶活性会干扰谷胱甘肽过氧化物酶的测定。本 试剂盒利用了一种间接测定的方法。谷胱甘肽过氧化物酶可以催化GSH产生GSSG,而谷胱甘肽还原酶可以利用NADPH 催化GSSG产生GSH,通过检测NADPH的减少量就可以计算出谷胱甘肽过氧化物酶的活力水平。在上述反应中,谷胱甘 肽过氧化物酶是整个反应体系的限速步骤,因此NADPH的减少量和谷胱甘肽过氧化物酶的活力线性相关。
e. 所有试剂使用前须在水浴中或PCR仪等设备上温育到25℃。
3. 样品测定:
表1
空白对照 (blank)
样品本底对照
样品 (sample)
谷胱甘肽过氧化物酶l
176-184 µl
待测样品
-
2-10 µl
2-10 µl
GPx检测工作液
10 µl
10 µl
10 µl
谷胱甘肽还原酶
0.4 µl
4 µl
8µl
GPx检测工作液体积
10.4 µl
104 µl
208µl
d. 15mM过氧化物试剂溶液的配制。取21.5微升过氧化物试剂(t-Bu-OOH)加入10毫升Milli-Q级纯水,混匀,即配制成
15mM过氧化物试剂溶液。配制好的15mM过氧化物试剂溶液仅限当日使用,且需尽量在冰浴上存放。
产品编号 S0056
谷胱甘肽过氧化物酶检测试剂盒
产品名称 谷胱甘肽过氧化物酶检测试剂盒
谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(比色法)
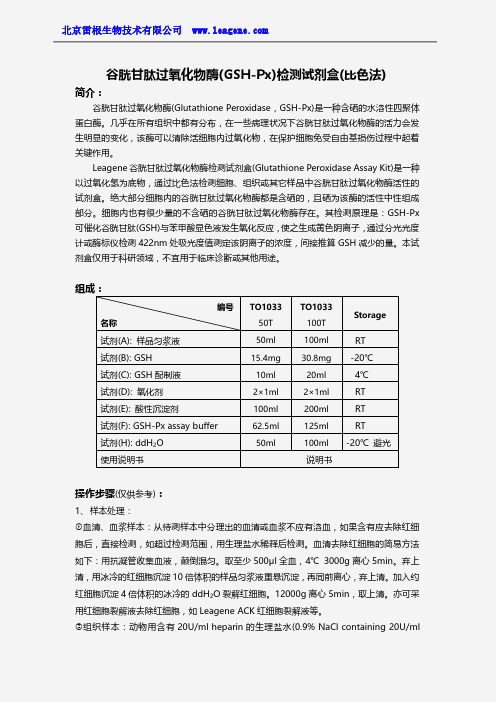
组成:
编号 名称 试剂(A): 样品匀浆液 试剂(B): GSH 试剂(C): GSH 配制液 试剂(D): 氧化剂 试剂(E): 酸性沉淀剂 试剂(F): GSH-Px assay buffer 试剂(H): ddH2O 使用说明书
TO1033 50T 50ml
15.4mg 10ml 2×1ml 100ml 62.5ml 50ml
北京雷根生物技术有限公司
谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(比色法)
简介:
谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)是一种含硒的水溶性四聚体 蛋白酶。几乎在所有组织中都有分布,在一些病理状况下谷胱甘肽过氧化物酶的活力会发 生明显的变化,该酶可以清除活细胞内过氧化物,在保护细胞免受自由基损伤过程中起着 关键作用。
Leagene 谷胱甘肽过氧化物酶检测试剂盒(Glutathione Peroxidase Assay Kit)是一种 以过氧化氢为底物,通过比色法检测细胞、组织或其它样品中谷胱甘肽过氧化物酶活性的 试剂盒。绝大部分细胞内的谷胱甘肽过氧化物酶都是含硒的,且硒为该酶的活性中性组成 部分。细胞内也有很少量的不含硒的谷胱甘肽过氧化物酶存在。其检测原理是:GSH-Px 可催化谷胱甘肽(GSH)与苯甲酸显色液发生氧化反应,使之生成黄色阴离子,通过分光光度 计或酶标仪检测 422nm 处吸光度值测定该阴离子的浓度,间接推算 GSH 减少的量。本试 剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
—
0.1ml
2ml
1ml
4、 GSH-Px 显色反应: 可参考下表设置检测反应体系,依次加入试剂:
Hale Waihona Puke 加入物质空白对照管 本底对照管 测定管
氧化型谷胱甘肽(GSSG)检测试剂盒(DTNB 比色法)说明书
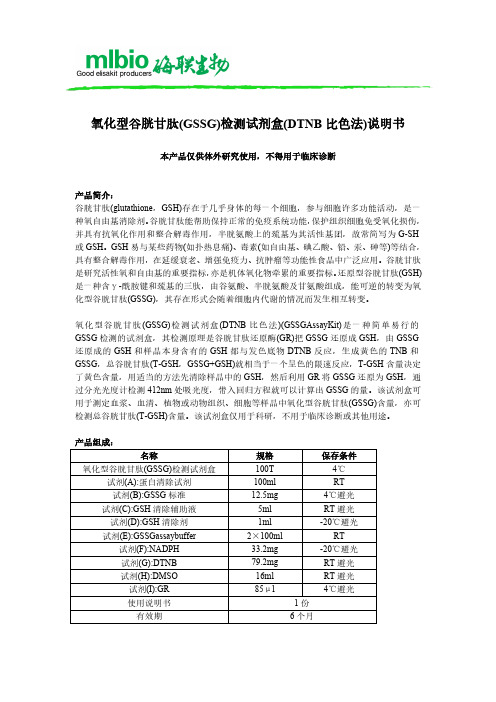
氧化型谷胱甘肽(GSSG)检测试剂盒自备材料:1、匀浆器或研钵、离心管或小试管、低温离心机、水浴锅2、蒸馏水、PBS或生理盐水、70%乙醇3、分光光度计、比色皿操作步骤(仅供参考):1、配制GSSG标准储存液:取12.5mgGSSG标准加入2mlddH2O,溶解并混匀,即为GSSG 标准储存液(10mM)。
一部分立即使用,其余适当分装后-20℃保存。
2、配制GSH清除剂工作液:在1mlGSH清除剂中加入9ml70%乙醇,溶解并混匀,即为GSH 清除剂工作液。
3、配制NADPH工作液:在33.2mgNADPH中加入4mlddH2O,即成NADPH工作液,一部分立即使用,其余适当分装后-20℃保存。
4、配制DTNB储存液:在79.2mgDTNB中加入16mlDMSO,溶解并混匀,即为DTNB储存液(12.5mM)。
一部分立即使用,其余适当分装后-20℃保存。
5、配制GR工作液:按GR:GSSGassaybuffer=1:49的比例混合,即为GR工作液。
-20℃保存,1个月有效。
注意:试剂(I)量较少,使用前应先4℃离心后再使用。
6、配制标准品:把GSSG标准储存液(10mM)用蛋白清除试剂稀释成50μM标准溶液,然后依次稀释成25、12.5、6.25、3.125μMGSSH标准溶液,取空白、3.125、6.25、12.5、25、50μMGSSG标准溶液6个点作标准曲线。
注意:由于GSSG标准在蛋白清除试剂中不太稳定,用蛋白清除试剂配制的GSSG溶液必须新鲜配制后使用,不可冻存后再使用。
7、准备样品:①红细胞或血浆样品:取新鲜血液,600r/min离心10min,沉淀为红细胞,上清为血浆。
对于红细胞,用PBS洗涤两次,取约50μl红细胞沉淀或血浆,加入50μl蛋白清除试剂,充分Vortex振匀。
4℃或冰浴放置10min,4℃10000r/min离心10min,取上清,用于GSSG测定,样品需暂时4℃保存备用,不立即测定的样品可以-70℃保存,但不宜超过10天。
谷胱甘肽过氧化物酶(GSH—Px)试剂盒说明书

谷胱甘肽过氧化物酶(GSH—Px)试剂盒说明书谷胱甘肽过氧化物酶(GSHPx)试剂盒说明书微量法100T/96S注意:正式测定之前选择23个预期差别大的样本做猜测定。
测定意义:GSHPx是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的重要酶之一、GSHPx不但能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的损害和加添机体抗辐射等本领。
测定原理:GSHPx催化有机过氧化物氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340nm有特征汲取峰,而NADP+没有;通过测定340nm光汲取减少速率来计算GSHPx活性。
自备仪器和用品:低温离心机、水浴锅、可调整移液器、酶标仪、96孔板和蒸馏水。
试剂构成和配置:试剂一:液体120mL×1瓶,室温保管。
试剂二:粉剂×1瓶,4℃保管。
试剂三:液体10μL×1支,20℃保管。
试剂四:液体200μL×1瓶,4℃保管。
粗酶液提取:1.组织:依照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:依照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波碎裂细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
3.血清等液体:直接测定。
GSHPx测定操作:1.酶标仪预热30min,调整波长到340nm。
2.混合试剂在25℃或者37℃(哺乳动物)水浴中预热30min。
大鼠谷胱甘肽过氧化物酶正常范围

大鼠谷胱甘肽过氧化物酶正常范围大鼠谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)是一种重要的抗氧化酶,具有保护细胞免受氧化应激损伤的重要功能。
它能够将有害的过氧化物质转化为无害的代谢产物,从而维护细胞内氧化还原平衡。
该酶的正常范围可作为综合评估大鼠健康状况的重要指标。
一般来说,正常大鼠的GPx活性应在一定的范围内。
实验研究表明,GPx活性与大鼠的年龄、性别、营养状况等因素相关。
首先,GPx活性随着大鼠的年龄增长而发生变化。
在幼年阶段,大鼠体内GPx活性较低。
随着成长,GPx活性逐渐增加,达到成年期的稳定水平。
然而,在老年阶段,GPx活性又会逐渐降低。
因此,根据大鼠的年龄,我们可以了解其GPx活性是否处于正常范围内。
其次,性别也会对大鼠GPx活性产生一定的影响。
一项研究发现,雄性大鼠的GPx活性明显高于雌性大鼠。
这可能与雄性大鼠对氧化应激的抵抗能力更强有关。
因此,在评估大鼠GPx活性时,应考虑到性别差异。
此外,营养状况也会对大鼠GPx活性产生影响。
一项研究发现,摄入富含谷胱甘肽的食物可以提高大鼠体内GPx活性。
这表明,适当的营养摄入对维持GPx活性的正常范围非常重要。
总结起来,大鼠GPx活性的正常范围受到多种因素的影响,包括年龄、性别以及营养状况等。
我们可以通过测量大鼠的GPx活性来评估其细胞内氧化还原平衡情况。
如果GPx活性超出正常范围,则可能存在氧化应激损伤等问题。
因此,掌握大鼠GPx活性的正常范围对于研究大鼠健康状况具有指导意义。
在实际应用中,我们可以通过特定的实验方法检测大鼠GPx活性,并结合其他指标综合评估大鼠的氧化应激状况。
这为大鼠健康管理和疾病研究提供了重要的参考依据。
过氧化物酶(Peroxidase,POD)试剂盒使用说明

3、细菌或细胞 POD 活性
(1)按样本蛋 反应体系中每分钟 A470 变化 0.01 定义为一个酶活 力单位。
POD(U/mg prot)=245μL(反应体系)÷1000μL×提取酶液总体积(1000μL)÷样 本体积(5μL)÷0.01×ΔA÷蛋白质浓度(mg/mL)=4900×ΔA÷蛋白质浓度(mg/mL)
2、组织 POD 活性
(1) 按样本蛋白浓度计算
单位的定义:每 mg 组织蛋白在每 ml 反应体系中每分钟 A470 变化 0.005 定义为一个酶 活力单位。
POD(U/mg prot)=245μL(反应体系)÷1000μL×提取酶液总体积(1000μL)÷样 本体积(5μL)÷0.005×ΔA 测定÷蛋白质浓度(mg/mL)=9800×ΔA÷蛋白质浓度(mg/mL)
用 96 孔板测定的计算公式如下
1、血清(浆)POD 活性
单位的定义:每 mL 血清(浆)在每 ml 反应体系中每分钟 A470 变化 0.005 定义为一个 酶活力单位。
POD(U/mL)=245μL(反应体系)÷1000μL×血清(浆)总体积(1000μL)÷样本 体积(5μL)÷0.005×ΔA =9800×ΔA
(2)按细菌或细胞密度计算
单位的定义:每 1 万个细菌或细胞在每 ml 反应体系中每分钟 A470 变化 0.01 定义为一 个酶活力单位。
POD(U/104 cell)=245μL(反应体系)÷1000μL×提取酶液总体积(1000μL)÷样 本体积(5μL)÷0.01×ΔA÷细菌或细胞密度(104 cell /mL)=4900×ΔA÷细菌或细胞密 度(104 cell /mL)
(2)按样本鲜重计算
单位的定义:每 g 组织在每 ml 反应体系中每分钟 A470 变化 0.01 定义为一个酶活力单 位。
南京建成GPX试剂盒说明书

南京建成GPX试剂盒说明书一、产品简介南京建成GPX试剂盒是一种用于测定谷胱甘肽过氧化物酶(GPX)活性的试剂盒。
谷胱甘肽过氧化物酶是一种重要的抗氧化酶,在生物体内起到清除自由基的作用。
该试剂盒采用酶促反应原理,通过检测GPX酶催化反应的速率,反映样品中GPX活性的强弱。
二、试剂盒组成1.GPX试剂盒2.GPX标准品3.过氧化氢(H2O2)稀释液4.反应底物液5.转化液6.二恶吖啶试剂7.芳醛显色剂液8.脱氧胆酸液三、操作步骤步骤一:样品处理1.将待测样品离心收集沉淀,去除杂质;2.取适量样品,加入过氧化氢(H2O2)稀释液,混匀;3.将处理后的样品转移至离心管,进行离心提取。
步骤二:制备标准曲线1.取GPX标准品不同浓度的工作液,依次加入反应孔;2.使用空白对照孔作为空白对照;3.分别加入转化液和反应底物液,混匀。
步骤三:反应过程1.加入样品提取液和转化液,混匀;2.加入反应底物液,混匀;3.加入二恶吖啶试剂,混匀;4.加入芳醛显色剂液,混匀;5.加入脱氧胆酸液,混匀。
步骤四:测定吸光度使用酶标仪在450nm波长下测定样品、标准品和空白对照的吸光度值。
四、结果判读根据标准曲线,计算出样品中GPX活性的浓度,进行数据分析。
根据浓度值的高低,可以判断出样品中GPX活性的强弱。
五、注意事项1.试剂盒的各组分应在4℃保存,开封后应尽快使用;2.不同批次的试剂盒不能混合使用;3.操作前,必须严格按照说明书操作,确保实验的准确性;4.不同样品的处理方式可能不同,请参照具体样品类型的处理方法;5.操作过程中应佩戴实验手套,避免接触试剂;6.尽量避免阳光直射,保持试剂的保存质量。
六、故障排除1.若标准曲线呈线性上升趋势,则说明实验条件符合要求,结果可信;2.若标准曲线呈非线性趋势,则可能是试剂盒保存不当或过期,需更换新的试剂,重新进行实验;3.若实验结果不符合预期,可能是样品处理不当或操作过程中出错,请检查并重新进行实验。
人谷胱甘肽过氧化酶3 (GPX3)ELISA Kit中文实验说明书

溶液后每隔一段时间观察一下显色情况以控制反应时间(比如每隔 10 分钟)。当肉眼可
见标准品前 3-4 孔有明显梯度蓝色,后 3-4 孔显色不明显时,即可加入终止液终止反应,
此时蓝色立刻变为黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。
7、 底物溶液应为浅蓝色或无色,如果颜色严重变深则必须弃用。底物溶液易受污染,请避
光妥善保存。
【数据处理】
可将标准品及样本值减去 S0 孔数值后绘制曲线,如果设置复孔,则应取其平均值计算。以标
准品的浓度为纵坐标(对数坐标),OD 值为横坐标(对数坐标),在对数坐标纸上绘出标准
曲线。推荐使用专业制作曲线软件进行分析,可从我们的网站下载专业软件 "Curve Expert",
并根据提示制作标准曲线。根据样本 OD 值,由标准曲线查出相应的浓度;或用标准品的浓度
3、 生物素标记抗体工作液 生物素标记抗体液按 1:100倍用生物素标记抗体稀释液进行稀释。如 10μl生物素标记抗体加
990μl生物素标记抗体稀释液,轻轻混匀,在临用前10分钟内配妥。
4、 辣根过氧化物酶标记亲和素工作液 辣根过氧化物酶标记亲和素 按 1:100 倍用辣根过氧化物酶标记亲和素稀释液进行稀释。 如
1、 血清:全血标本请于室温放置 2 小时或 4°C 过夜后于 2 - 8°C 1000 x g 离心 15 分钟,取
上清即可立即检测;或进行分装,并将标本放于-20°C 或-80°C 保存,但应避免反复冻融。 解冻后的样品应再次离心,然后检测。 2、 血浆:可用 EDTA 或肝素作为抗凝剂,标本采集后 30 分钟内于 2 - 8°C 1000 g 离心 15 分钟,取上清即可立即检测;或进行分装, 并将标本放于-20℃或-80℃保存,但应避免 反复冻融。解冻后的样本应再次离心,然后检测。 3、 组织裂解液:取 100mg 组织,用 1X PBS 洗去血污。剪成小块放入组织研磨器(匀浆 管)中,加入 1 ml 1X PBS,制成匀浆,然后置于-20°C 过夜。经过反复冻融 2 次处理破 坏细胞膜后,将组织匀浆于 2 - 8°C 5000 g 离心 5 分钟取上清。取适量上清液立即进行实 验,或将上清分装保存于-20°C 或-80°C。解冻后的样品应再次离心,然后检测。避免反 复冻融。 注:标本溶血会影响最后检测结果,因此溶血标本不宜进行此项检测。 【样本稀释】 血清,血浆样本用样本稀释液进行1:2000倍稀释后进行检测,具体操作如下:取2μl 样本 加入到98μl 的样本稀释液(1:50稀释)中混匀。再从上述稀释液中取6μl加入到234μl 样本稀 释液(1:40稀释)中混匀。二步完成后得到的即为 1:2000倍稀释后的样本。此推荐稀释倍数 仅供参考,用户应根据实验自行确定其最优稀释倍数。 【试剂配制】 1、 标准品 (1) 从试剂盒中取出一支标准品,于 6000-10000rpm 离心 30 秒。用 1ml 样本稀释液溶解, 并用枪头对准冻存管底部反复吸打 5 次以助溶解,充分混匀得到标准品 S7,放置备用。 (2) 取 7 个 1.5 ml 离心管(S0-S6)依次排列,各加入 250µl 样本稀释液。吸取 250µl 标准品 S7 到第一个离心管中(S6),轻轻吹打混匀。从 S6 中吸取 250µl 到第二个 EP 管中(S5),
氧化应激检测方法

氧化应激检测方法氧化应激是指机体内氧化与抗氧化失衡所引起的一系列有害反应。
氧化应激与多种疾病的发生和发展密切相关,如神经系统疾病、心血管疾病、肿瘤和炎症等。
因此,准确检测氧化应激的程度非常重要。
本文将介绍几种常用的氧化应激检测方法。
1.抗氧化酶活性测定:超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化物酶(CAT)是体内重要的抗氧化酶。
这些酶的活性可以反映氧化应激的强度。
例如,SOD活性指标可以通过测定其对还原试剂的抑制能力来进行监测。
GPx活性可以通过观察其对底物的降解情况来进行测定。
而CAT活性可以通过观察其催化底物降解速率来进行测定。
测定抗氧化酶活性可以提供一个直接的指标来评估氧化应激的程度。
2.抗氧化物质的测定:维生素C、维生素E和谷胱甘肽等是体内重要的抗氧化剂。
这些物质的浓度可以通过高效液相色谱法、电化学法等进行测定。
比如,维生素C可以通过高效液相色谱法进行测定。
维生素E可以通过吸收光度法进行测定。
谷胱甘肽可以通过还原试剂反应测定其浓度。
测定抗氧化物质的浓度可以反映体内抗氧化能力。
3.氧化损伤标志物的测定:氧化应激会导致DNA、脂质和蛋白质等生物分子的氧化损伤。
因此,测定氧化损伤标志物的浓度可以反映氧化应激的程度。
例如,通过测定尿液中8-羟基脱氧鸟苷(8-OHdG)的浓度来评估DNA氧化损伤。
通过测定血液中丙二醛(MDA)的浓度来评估脂质氧化损伤。
通过测定血液中氧化蛋白(carbonylated protein)的浓度来评估蛋白质氧化损伤。
这些标志物的浓度可以通过各种分析技术进行测定,如高效液相色谱法、气相色谱法等。
4.氧自由基测定:总之,氧化应激的检测方法可以从抗氧化酶活性、抗氧化物质浓度、氧化损伤标志物浓度和氧自由基浓度等方面进行评估。
这些方法可以为研究氧化应激的机制、评估氧化应激的程度以及指导临床治疗提供重要的参考。
凯基谷胱甘肽过氧化物酶(GSH-PX)测试盒

注意
注 1:空白管、标准管一般只需做 1-2 只。
注 2:最佳取样量及最佳取样浓度因样品种类不同,其 GSH-PX 活力不一。根据酶的百分抑制率与酶的活 力呈抛物线关系,各种测定样品取样量及取样浓度不一样,在每测定一种新的样品前最好选择一个最佳取
样量及最佳取样浓度。
最佳取样浓度的摸索
测试前先预试以确定最佳取样浓度:当您第一次使用本试剂盒测试某一种新的样品时最好先做三只不同浓
4℃或室温保存 6 个月
4℃保存 6 个月 4℃避光保存五天
4℃保存
GSH 的分子量为 307,每次测定前将 1 支 3.07mg 的 GSH 标准品粉剂加到 GSH 标准品的溶剂应用液 中,定容至 10ml 即为 1mmol/L 的 GSH 溶液,现用 现配。
取 1mmol/L GSH 溶液 2ml 加 GSH 标准品溶剂应用 液 18ml 定容至 20ml,作标准曲线用,若不做标准 曲线可以不配。
保存条件 4℃
3 5 7
GSH 应用液的配制: 1mmol/L GSH 溶液
100u mol/L GSH 溶液 20umol/L 的 GSH 标准溶液
试剂二应用液的配制:将已配好的 甲乙两种混合。此为过饱和溶液, 室温静置冷却后,如有结晶,则取 上清进行实验。 加蒸馏水 100ml 溶解 每支加蒸馏水 10ml 溶解 标准品溶剂应用液:GSH 标准品 溶剂贮备液:双蒸水=1:9 即 10 倍稀释配成应用液;按所需量现用 现配。
二.试剂盒的组成和配制
25 Tests (50 Tubes)试剂盒的组成和保存: 试剂编号 1
2
3 4 5
名称 贮备液
甲粉 乙液 粉剂 液体 粉剂
6
GSH 标准品粉剂
谷胱甘肽还原酶(GR)活性检测试剂盒说明书 紫外分光光度法

北京索莱宝科技有限公司谷胱甘肽还原酶(GR)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1160规格:50T/48S产品内容:试剂一:液体100mL×1瓶,4℃保存。
试剂二:液体3mL×1瓶,4℃保存。
试剂三:粉剂×1瓶,4℃保存。
临用前加入5.0mL蒸馏水,混匀。
产品说明:GR是广泛存在于真核和原核生物中的一种黄素蛋白氧化还原酶,GR催化GSSG还原生成GSH,是谷胱甘肽氧化还原循环的关键酶之一(通常昆虫中GR被TrxR取代)。
GR催化NADPH还原GSSG生成GSH,有助于维持体内GSH/GSSG比值。
GR在氧化胁迫反应中对活性氧清除起关键作用,此外GR还参与抗坏血酸-谷胱甘肽循环途径。
GR能催化NADPH还原GSSG再生GSH,同时NADPH脱氢生成NADP+;NADPH在340nm有特征吸收峰,相反NADP+在该波长无吸收峰;通过测定340nm吸光度下降速率来测定NADPH脱氢速率,从而计算GR活性。
自备仪器和用品:紫外-可见分光光度计、低温离心机、水浴锅、移液器、1mL石英比色皿和蒸馏水操作步骤:一、粗酶液提取:称约0.1g组织,加入1.0mL试剂一,冰上充分研磨,10000rpm4℃离心10min,取上清液,待测。
二、GR测定操作:1.紫外-可见分光光度计预热30min以上,调节波长到340nm,蒸馏水调零。
2.试剂一置于25℃(普通物质)或者37℃(哺乳动物)中预热30min以上。
3.空白管:取1mL石英比色皿,加入50μL试剂二,100μL试剂三,850μL试剂一,于340nm测定10s和190s吸光度,记为A空1和A空2。
第1页,共2页4.测定管:取1mL石英比色皿,加入50μL试剂二,100μL试剂三,100μL上清液,750μL试剂一,于340nm测定10s和190s吸光度,记为A测1和A测2。
索莱宝氧化型谷胱甘肽(GSSG)含量检测试剂盒说明书
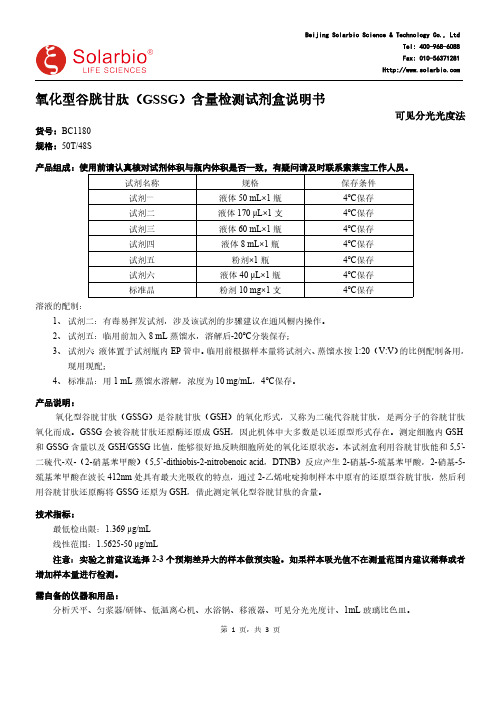
第 1 页,共 3 页氧化型谷胱甘肽(GSSG )含量检测试剂盒说明书可见分光光度法货号:BC1180规格:50T/48S 产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件试剂一液体50 mL×1瓶4℃保存试剂二液体170 μL×1支4℃保存试剂三液体60 mL×1瓶4℃保存试剂四液体8 mL×1瓶4℃保存试剂五粉剂×1瓶4℃保存试剂六液体40 μL×1瓶4℃保存标准品粉剂10 mg×1支4℃保存溶液的配制:1、试剂二:有毒易挥发试剂,涉及该试剂的步骤建议在通风橱内操作。
2、试剂五:临用前加入8 mL 蒸馏水,溶解后-20℃分装保存;3、试剂六:液体置于试剂瓶内EP 管中。
临用前根据样本量将试剂六、蒸馏水按1:20(V:V )的比例配制备用,现用现配;4、标准品:用1 mL 蒸馏水溶解,浓度为10 mg/mL ,4℃保存。
产品说明:氧化型谷胱甘肽(GSSG )是谷胱甘肽(GSH )的氧化形式,又称为二硫代谷胱甘肽,是两分子的谷胱甘肽氧化而成。
GSSG 会被谷胱甘肽还原酶还原成GSH ,因此机体中大多数是以还原型形式存在。
测定细胞内GSH 和GSSG 含量以及GSH/GSSG 比值,能够很好地反映细胞所处的氧化还原状态。
本试剂盒利用谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid ,DTNB )反应产生2-硝基-5-巯基苯甲酸,2-硝基-5-巯基苯甲酸在波长412nm 处具有最大光吸收的特点,通过2-乙烯吡啶抑制样本中原有的还原型谷胱甘肽,然后利用谷胱甘肽还原酶将GSSG 还原为GSH ,借此测定氧化型谷胱甘肽的含量。
技术指标:最低检出限:1.369 μg/mL线性范围:1.5625-50 μg/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
谷胱甘肽 S-转移酶(GST)活性检测试剂盒说明书__ 紫外分光光度法UPLC-MS-4496

谷胱甘肽S-转移酶(GST)活性检测试剂盒说明书紫外分光光度法货号:UPLC-MS-4496规格:50T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一液体50mL×1瓶4℃保存试剂二液体45mL×1瓶4℃保存试剂三粉剂×1瓶4℃保存溶液配制:试剂三:临用前加5mL蒸馏水溶解。
产品说明:谷胱甘肽S-转移酶(glutathione S-transferase,GST)是一种具有多种生理功能的蛋白质家族,主要存在于细胞质内。
GST是体内解毒酶系统的重要组成部分,主要催化各种化学物质及其代谢产物与GSH的巯基共价结合,使亲电化合物变为亲水物质,易于从胆汁或尿液中排泄,达到将体内各种潜在或具备毒性的物质降解并排出体外的目的。
因此,GST在保护细胞免受亲电子化合物的损伤中发挥着重要的生物学功能。
此外,因为GST具有GSH-Px活性,亦称为non-Se GSH-Px,具有修复氧化破坏的大分子如DNA、蛋白质等的功能。
注意,GST催化的反应减少GSH含量,但是不增加GSSG含量。
GST催化GSH与CDNB结合,其结合产物的光吸收峰波长为340nm;通过测定340nm波长处吸光度上升速率,即可计算出GST活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:紫外-可见分光光度计、低温离心机、水浴锅、可调节移液器、研钵/匀浆器、1mL石英比色皿和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
gpx4试剂盒检测原理

gpx4试剂盒检测原理
1.检测原理概述
GPX4试剂盒采用化学法检测GPX4的活性。
其原理基于GPX4对还原型谷胱甘肽(GSH)的依赖性。
在GPX4的作用下,底物过氧化物化合物会被还原为相应的醇,这一过程消耗还原型谷胱甘肽(GSH)。
通过检测GSH的消耗量,可以推算出GPX4的活性。
2.GPX4活性检测
试剂盒中的底物是一种特定的过氧化物化合物,它在GPX4的作用下会被还原为相应的醇。
在这一过程中,GPX4消耗了还原型谷胱甘肽(GSH)。
通过检测GSH的消耗量,可以推算出GPX4的活性。
3.底物与指示剂反应
试剂盒中的底物是一种过氧化物化合物,它可以在GPX4的作用下被还原为醇。
这个反应过程中会伴随着颜色的变化,可以根据颜色的变化来测定GPX4的活性。
4.检测结果分析
根据试剂盒中底物的颜色变化和GSH的消耗量,可以推算出GPX4的活性。
一般来说,颜色变化越明显,GSH消耗量越大,说明GPX4的活性越高。
通过对GPX4活性的测定,可以了解生物样品中GPX4的活性水平。
5.注意事项
在使用试剂盒时,需要注意以下几点:首先,试剂盒中的底物和指示剂都应该按照说明书进行储存和使用;其次,在进行实验前,应该对样品进行充分的处理和清洗;最后,在实验过程中,应该保证实验环境的清洁和无菌。
总之,GPX4试剂盒是一种方便快捷的检测GPX4活性的工具,其原理基于化学法检测GPX4对还原型谷胱甘肽(GSH)的依赖性。
通过测定GSH的消耗量来推算出GPX4的活性,从而帮助研究者了解生物样品中GPX4的活性水平。
第十节 谷胱甘肽过氧化物酶(GSH-Px)活力测定

1.3.6.2 血或组织中谷胱甘肽过氧化物酶(GSH-Px)活力测定1.3.6.2.1 原理谷胱甘肽过氧化物酶(GSH-Px)是体内存在的一种含硒清除自由基和抑制自由基反应的系统。
对防止体内自由基引起膜脂质过氧化特别重要,其活力以催化GSH氧化的反应速度,及单位时间内GSH减少的量来表示,GSH和5,5’-二硫对硝基苯甲酸(DTNB)反应在GSH-Px催化下可生成黄色的5-硫代2-硝基苯甲酸阴离子,于423nm波长有最大吸收峰,测定该离子浓度,即可计算出GSH减少的量,由于GSH能进行非酶反应氧化,所以最后计算酶活力时,必须扣除非酶反应所引起的GSH减少。
1.3.6.2.2 试剂和仪器仪器:可见光分光光度计、酶标仪、低温高速离心机、匀浆器、恒温水浴锅、微量加样器试剂:叠氮钠磷酸缓冲液pH7.0N a N316.25mg 终浓度2.5mmol/LEDTA-N a27.44mg 终浓度0.2mmol/LN a2HPO4 1.732g 终浓度0.2mol/LN a H2PO4 1.076g 终浓度0.2mol/L加蒸馏水至100mL,用少量HCL、N a OH调pH7.0,4℃保存。
1mmol/L谷胱甘肽(还原型GSH)溶液GSH 30.7mg加叠氮钠磷酸缓冲液至100mL,临用前配制,冰冻保存1-2日。
1.25-1.5mmol/LH2O2溶液取30%H2O20.15-0.17mL,用双蒸水稀释至100mL,作为贮备液,4℃避光保存,临用前将贮备液用双蒸水稀释10倍即可。
偏磷酸沉淀液HPO316.7g(先用蒸馏水溶解)EDTA 0.5gN a Cl 280g加蒸馏水至1000mL,用普通滤纸过滤,室温保存。
0.32mol/LN a2HPO4溶液:N a2HPO422.7g加蒸馏水至500mL,室温保存。
DTNB显色液DTNB 40mg柠檬酸三钠 1.0g加蒸馏水至100mL,4℃避光保存1个月。
0.2M磷酸缓冲液pH7.40.9%生理盐水1.3.6.2.3 实验步骤1.3.6.2.3.1 样品制备溶血液:取鼠血10μl加入到1mL双蒸水中,充分振摇,使之全部溶血1:100待测,4h内测定酶活力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谷胱甘肽过氧化物酶(GSH-Px/GPX)活性检测试剂盒说明书微量法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1195规格:100T/48S 产品简介:
谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px 或GPX)是机体内广泛存在的一种重要的过氧化物分解酶。
GPX 能够催化还原型谷胱甘肽(GSH)生成氧化型谷胱甘肽(GSSG),使有毒的过氧化氢还原成无毒的羟基化合物。
GPX 催化H 2O 2氧化GSH,产生GSSG,GSH 能与DTNB 生成在412nm 处有特征吸收峰的化合物,412nm 下吸光度的下降即可反应GPX 的活性。
试验中所需的仪器和试剂:
可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、EP 管。
产品内容:
提取液:液体80mL×1瓶,4℃保存;
试剂一:粉剂×1瓶,4℃保存;临用前加入5.5mL 蒸馏水溶解;试剂二:粉剂×1瓶,4℃保存;临用前加入3.3mL 蒸馏水溶解备用;
试剂三:液体10μL×1支,临用前按1μL 试剂三:499μL 蒸馏水的比例稀释试剂三,4℃保存。
现用现配;
试剂四:液体30mL×1瓶,4℃保存;瓶底若有结晶可50℃水浴溶解,此溶液为饱和溶液,若底部最终还有结晶,吸取上清使用即可;
试剂五:液体5mL×1瓶,4℃保存;
试剂六:粉剂×1瓶,4℃保存;临用前加入5mL 蒸馏水溶解备用;
标准品:粉剂×1支,10mg 还原型谷胱甘肽,4℃保存。
临用前加入1.62mL 蒸馏水溶解为20μmol/mL 的标准溶液备用。
操作步骤:
一、粗酶液的提取:
1、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取0.05g组织,加入1mL提取液)进行冰浴匀浆。
10000rpm,4℃离心10min,取上清置冰上待测(如上清不清澈,再离心3min)。
2、细菌、真菌:按照细胞数量104个:提取液体积(mL)500~1000:1的比例,建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(率300w,超声3s,间隔7s,总时间3min)然后10000rpm,4℃,离心10min,取上清置冰上待测(如上清不清澈,再离心3min)。
3、血清(浆)等液体:直接测定。
二、测定步骤:
1、分光光度计/酶标仪预热30min以上,调节波长至412nm,蒸馏水调零。
2、将20μmol/mL标准液用提取液稀释为0.3125μmol/mL的标准溶液。
再吸取20μL各标准溶液与80μL
试剂四混匀待用,此标准液混合物的浓度为0.0625μmol/mL。
标准液混合物现用现配。
3、将30μL样本与30μL试剂一混合后室温放置5min。
4、操作表:(在1.5mL离心管中依次加入下列试剂)
测定管对照管样品混合物(µL)20-
试剂二(μL)2020
37℃下预热5min
试剂三(µL)2020
37℃下反应5min
试剂四(μL)200200
样品混合物(µL)-20
4000rpm常温离心5min,取上清于EP管或者96孔板中。
试剂名称(μL)测定管对照管标准管空白管上清液100100--标准液混合物--100-试剂四---100
试剂五40404040
试剂六40404040
蒸馏水20202020
混匀后室温放置2min,测定412nm下的吸光度,分别记为A测定管、A对照管、A标准管、A空白管。
计算△A测定=A对照管-A测定管,△A标准=A标准管-A空白管。
GPX活性计算:
1、抑制百分率的计算
抑制百分率=(A对照管-A测定管)÷(A对照管-A空白管)×100%
尽量使样品的抑制百分率在30-70%范围内,越靠近50%越准确。
如果计算出来的抑制百分率小于30%或大于70%,则通常需要调整加样量后重新测定。
如果测定出来的抑制百分率偏高,则需适当稀释样品;如果测定出来的抑制百分率偏低,则需重新准备浓度比较高的待测样品。
2、GPX活性计算
(1)按蛋白浓度计算
活力单位定义:每mg蛋白在反应体系中每分钟催化1nmol GSH氧化定义为一个酶活力单位。
GPX(U/mg prot)=ΔA测定÷(△A标准÷C标)×1000×V酶促÷(Cpr×V样)÷T
=325×ΔA测定÷△A标准÷Cpr。
(2)按样本鲜重计算
活力单位定义:每g样品在反应体系中每分钟催化1nmol GSH氧化定义为一个酶活力单位。
GPX(U/g鲜重)=ΔA测定÷(△A标准÷C标)×1000×V酶促÷(V样÷V样总×W)÷T
=325×ΔA测定÷△A标准÷W。
(3).按细胞数量计算
活力单位定义:每104个细胞在反应体系中每分钟催化1nmol GSH氧化定义为一个酶活力单位。
GPX(U/104cell)=ΔA测定÷(△A标准÷C标)×1000×V酶促÷(细胞数量×V样÷V样总)÷T =325×ΔA测定÷△A标准÷细胞数量。
(4).按液体体积计算
活力单位定义:每毫升液体在反应体系中每分钟催化1nmol GSH氧化定义为一个酶活力单位。
GPX(U/mL)=ΔA测定÷(△A标准÷C标)×1000×V酶促÷V样÷T=325×ΔA测定÷△A标准。
C标:标准液混合物的浓度:0.05μmol/mL;V酶促:酶促反应体系体积,0.26mL;
V样:样本混合物中含有的样本体积,0.01mL;V样总:提取液体积,1mL;
Cpr:上清液蛋白浓度(mg/mL);T:反应时间,5min;
细胞数量:以万计;W:样品质量,g;
1000:换算系数,1μmol=1000nmol。
注意事项
1、反应完成后建议在10min内检测完成。
2、吸光度若大于1.5时,建议将样本用提取液稀释后进行测定。
