c3 (环烷烃)解析
环烷烃的概念

环烷烃的概念环烷烃是一类有机化合物,也被称为脂环烷烃或脂肪环烷烃。
它的分子结构由碳(C)和氢(H)原子组成,其中碳原子形成一个或多个环状结构,每个碳原子上连接着两个氢原子。
环烷烃的普遍化学式为CnH2n,其中n代表碳原子的数量。
环烷烃根据碳原子的环状结构可以分为多个类别,最简单的是环己烷(C6H12),它由六个碳原子组成一个环。
其他常见的环烷烃有环戊烷、环丙烷等。
环烷烃的特点是分子结构中含有一个或多个环状结构,这种环状结构使得环烷烃相对于直链烷烃具有一些特殊的性质。
首先,由于环烷烃分子内部有较大的空间限制,环烷烃的分子难以与其他分子进行反应,使得环烷烃的化学稳定性较高。
此外,环烷烃还具有较高的沸点和熔点,比直链烷烃的物理性质要高。
环烷烃可以通过多种方法合成,最常见的方法是通过烷烃的脱氢反应得到。
例如,环己烷可以由己烷经过加热脱氢反应制得。
此外,环烷烃还可以通过环状化合物之间的反应合成,如环戊烷可以由乙烯和乙烯二聚反应得到。
环烷烃在生活中有广泛的应用。
最典型的例子是石油和天然气中的环烷烃,它们是石油和天然气中最常见的组分之一。
石油和天然气中的环烷烃可以用于生产燃料、润滑剂和化工原料。
此外,环烷烃还可用作溶剂、塑料、橡胶等领域的原料。
但是,环烷烃也存在一些环境和健康方面的问题。
环烷烃是一类挥发性有机物,它们在大气中的存在会对空气质量产生负面影响,形成臭氧、光化学烟雾等污染物。
此外,环烷烃还可能引发健康问题,如呼吸道疾病和神经系统损伤。
总之,环烷烃是一类有机化合物,具有稳定性高、物理性质特殊的特点。
它们在能源、化工和其他领域有着广泛的应用,但也带来环境和健康方面的问题。
对环烷烃的深入研究和合理利用,有助于提高环境质量,推动可持续发展。
有机化学第三章环烷烃
2、加成反应 、
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 加氢(随碳原子数增加,环的稳定性增加; 件也愈苛刻) 件也愈苛刻)
Ni + H2 40 C Ni 110 C Pt 330 C以 上 以
互为构象异构体。 互为构象异构体。
重叠式构象
交叉式构象
一、环己烷的构象
1918年 Mohr提出非平面无张力环学说,提出环已烷 年 提出非平面无张力环学说, 提出非平面无张力环学说 的六个碳原子都保持正常键角109o28’的椅式和船式构象。 构象。 的六个碳原子都保持正常键角 的椅式和船式构象
1、椅式构象(稳定的极限构象) 椅式构象(稳定的极限构象)
环 丁烷 环 丙烷 cyclopropane cyclobutane
环戊烷 cyclopentane
CH3 CH3 A: Isopropylcyclopentane
CH2CH2CH2CH2CH3 B: 1-Cyclobutylpentane
C3
2
4
D
1
5 4 3 2
E
CH3 CH3 CH CH3
F
CH3 CH3 CH3CCH CH3 Br
+ HBr
3、氧化反应 、
a)小环不被高锰酸钾,臭氧所氧化 )小环不被高锰酸钾,
+ KMnO4 + O3 H+ × H+ ×
应用:鉴别小环与不饱和烃类化合物 应用:
CH3 CH=C H 3C H3C CH3 KMnO4 H3C H
+
COOH +
有机化学 第四章 环烷烃讲解

2, Bridged-ring alkane and fused-ring alkane 桥环烃和稠环烃
1)选母体:根据成环的总碳原子数及环数,称为“n环某烷”。
2)编号:从桥头碳开始;从最长桥开始。
3)书写:先写环数
方括号内沿着编号方向写出每个环中除桥头碳原子
H
4
H
H
H3 2H
H
1H
H
H H
H H
H
H H
H
蝴蝶状
蝴蝶式
部分交叉式 扭转张力较小
4
H2C
H2C 3
H H
1
2H H
6.3kJ/mol higher
全重叠式
2.5kJ/mol
envelop structure
信封式
half-chair structure
半椅式
如果:
具有多组全重叠式
Large ring 多于13个碳原子的环体系中,分子链一般呈皱折形
Cycloalkanes 第四章 环烷烃
Organic Chemistry A (1) By Prof. Li Yan-Mei Tsinghua University
Content
4.1 Classification, Isomerization and nomenclature 4.2 Structure of cycloalkanes 4.3 Physical properties & spectrum data 4.4 Chemical properties 4.5 Preparation (learn on your own)
环烷烃

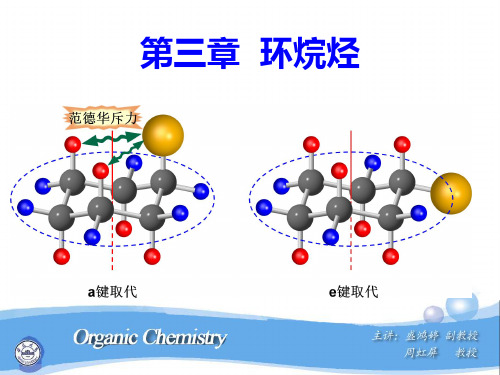
a键
e键
(3) 相邻两组a键伸展方向相反,一个向上,一个向下,e 键也如此。
a a
e e
e a
a e
e e a a
1
2
3
4
a
e
a 和e键的关系不清晰
5 a 和e 键的关系清晰
3.构象翻转:
Year 1883
Name of scientist Baeyer
1890 H.Sachse 1915-1918 W.M.Mohr
1920
1943 O.Hassel
1950 D.Barton
Point of view
Assumes that six carbon atoms are on the same plane
当环己烷由一种椅式构象翻转为另一种椅式构象时,原
来的a键变成e键,原来的e键变成a键。由于六个碳上连接的 都是氢原子,所以两种椅式构象完全等同。
5
61
43
2
456 3 21
O
O
O
O O O
4O
O1 O
O O
4O O
O O
O
O
O
环上原子或基团的空间关系保持。
O
O O O
O1 O
二. 取代环己烷的构象
3.3 环的张力
一、Bayer’s张力学说
Assumption: 1 成环的碳原子均在同一同面上,且呈正多边形 2 碳原子采取sp3杂化形式,正常键角应为约109.5度 3 为了满足平面正多边形的内角要求,成环的键必须向内或向
有机3-环烷烃(2)-(1)_图文

cis-1, 4-二叔丁基环己烷的构象
有较大的1, 3-竖键作用
扭船型构象
多取代环己烷: (1)环己烷多元取代物的最稳定的构象是e-取代最
多的构象; (2)环上有不同取代基是,大的取代基在e-键的构
象最稳定。
课堂练习:
1、画出1,1-二甲基环己烷的椅式构象,指出直立位甲基和平 伏位甲基。
1. 【解析】
椅式构像:① 所有两个相邻的碳原子的碳氢键都处于 交叉式位置;
② 所有环上氢原子间距离都相距较远,无 非键张力。
船式构像:① C2-C3及C5-C6间的碳氢键处于重叠式位 置;
② 船头和船尾上的两个碳氢键向内伸展,相 距较近,比较拥挤,存在非键张力。
环己烷碳架是折叠的
椅式构象
C2, C3, C5, C6 共平面
a, e-
能量相等
e, a-
cis-1, 4-二甲基环己烷
1, 4-cis
a, e-
e, a-
能量相等
trans-1, 4-二甲基环己烷
1, 4-trans
a, a有1. 3-竖键作用
e, e优势构象
不同基团二取代环己烷
1, 2-cis
大基团总是 占据 e键
1, 3-竖键作用较大
优势构象
扭曲式构象
各种环己烷构象的势能图
2. 单取代环己烷的构象分析
甲基环己烷的构象
1,3-竖键作用
CH3与C3为对位交叉 优势构象,室温时占95%
CH3与C3为邻位交叉
取代环己烷的构象1
叔丁基环己烷的构象
优势构象 室温:100%
1. 3-竖键作用非常大
3. 二取代环己烷的构象分析
cis-1, 2-二甲基环己烷
c3-环烷烃

(2) 不同取代基
例:写出顺-1-甲基-2-叔丁基环己烷的稳定构象。
CH3 (H3C)3C e H H a C(CH3)3 a H H3 C e H
不稳定,因 叔丁基在a键 受到环同边 a-H的排斥力 远大于甲基
e-叔丁基
a-叔丁基
结论:不同取代基时体积大的取代基在e位的构象较稳定,当然也是 ee >ae >aa,若只能为ae式时,则体积大者在e键时比较稳定,即 e(大)a(小)>e(小)a(大)
10
例: 环丙烷分子中环内C-C键之间的夹角为60° (为几何角),要使键角由正常的109°28′→ 60°,必须使两个价键各向内偏转 24°44′= (109°28′- 60°)/2
60°
环烷烃: 分子中价键的 偏转程度:
109°28′ 60° 24°44′
120°
90°
108°
+24°44′ +9°44′
(Cycloalkane )
第三章 环烷烃
1
◇环烷烃 — 分子中C原子以单键互相连接成闭合环 ◇通 式 — CnH2n,链成环需增加一个C-C单键,同时减少两个H,与烯 烃为同分异构体
一、环烷烃的异构和命名
1.环烷烃的异构
◇环烷烃构造异构产生的原因: ◎环的大小
◎侧链的长短和位置
◎顺反异构(cis-trans-isomerism)
30
作业
一、第三版P41问题3.1 (1)(3)(4) (第二版P45) 二、第三版P54问题3.5 (1)(2)(3)(4) (第二版P59) 三、补充题:有一饱和烃,其分子式位C7H14,并只含有一个一级碳原 子,写出该化合物可能的结构式并命名之。
31
补充:十氢化萘的构象
环烷烃知识讲解
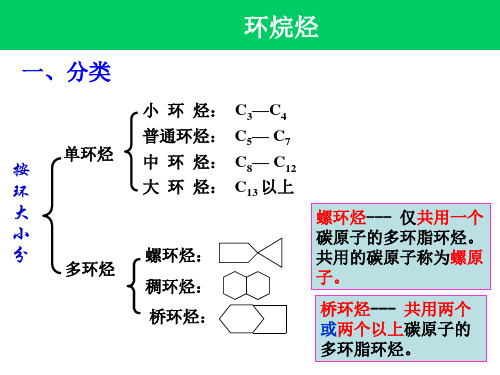
一、分类
小 环 烃: C3—C4
按
单环烃
普通环烃: C5— C7 中 环 烃: C8— C12
环
大 环 烃: C13 以上
大
螺环烃--- 仅共用一个
小
碳原子的多环脂环烃。
分
螺环烃:
多环烃
稠环烃:
共用的碳原子称为螺原 子。
桥环烃:
桥环烃--- 共用两个 或两个以上碳原子的
多环脂环烃。
1
二、 命 名
19
2. 加HX 、X2
CH2 CH2 + Br2
常温
CH2
CH2-CH2-CH2
Br
Br
CH2 CH2 + HBr CH2
CH2-CH2-CH2
H
Br
H3C— CH CH2 + HBr CH2
CH2 CH2
加热
CH2
+ CH2
Br2
CH3-CH-CH2-CH2
Br
H
CH2-CH2-CH2-CH2
3、桥环烃命名
具有两个或两个以上的碳环公用两个或两个 以上的碳原子的化合物
桥头碳原子:两环共用的碳原子。 桥路:两个桥头碳原子之间的碳链或一个键。
(1) 桥 (2) 桥 桥头碳
Байду номын сангаас
桥头碳 (3) 桥
7
1. 首先确定环数。 二环 , 三环
•环的数目的确定:将环上的键切断,每次切断一根键,使其 变成链状化合物,根据所需切断键的最小次数即为该桥环 化合物所含的环数。
a键 e键
同类型键: 邻位指向相反, 间位指向相同。
15
2)船式构象
H 183pm H
立体化学 第5章 环烷烃
1,2,4-三甲基环己烷
C. 必要时须注明立体构型;
D. 复杂化合物也可将环的部分当作取代基。
顺-1,2-二甲基环丙烷 反-1,3-二甲基环丁烷
4-环戊基庚烷
(2) 多环化合物的命名:
(命名较为复杂, 以二环化合物为例). A. 参加成环的总碳原子数作为母体烃; 如有8个碳原子,则称为辛烷 B. 简单桥环可用“二环”、“三环”等作词头; C. 二环“连接”处的碳原子为桥头碳原子; D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的碳原子 数写入方括号中(注意:桥头C原子都不可计入)。
2) 环戊烷的构象
环戊烷的结构是以拆叠的形式存在,四个C原子基本在一 平面上,另一个C则在平面之外,这种构象称为信封式构象。 环戊烷由于以“信封式”构象存在,使分子张力较小,化学性 质较稳定。
3) 环己烷的构象及构象分析
i) 椅式和船式构象
椅式
船式
船式构象相对能量较高, 不稳定,通过C-C键扭曲, 使其成为扭曲式(或称为扭 船型)。这种构象相对于船 式能量低。
角张力---由于键角偏离正常键角 而产生的张力。
环丙烷的三个C在同一平而上,相邻两个C上的C-H键都是重叠式构象, 相互拥挤,产生排斥,也具有较高的能量。
扭转张力---由于重叠式构象而产生的张力。
4. 环烷烃的构象和构象分析
1) 环丁烷的构象
环丁烷的四个C不在同一平面上,形如蝴蝶。即通过C-C键的扭转而以 一个拆叠的碳环存在。 环丁烷的三个C原子分布在同一平面,另一个C取于平面之外。 环丁烷的这种存在形式可使环的张力降低,但仍然是一个不稳定分子。
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类与分子对称轴平行,即垂直于环平面,称为
有机化学03环烷烃

CH3
有不同取代基时,大基团 处于e键的构象为优势构象。
H 3C H 3C H 3C C H H CH3
H3C H
CH3 C
CH3 H CH3
(t-Bu,e; Me,a)优势构象
(t-Bu,a; Me,e)
trans-1-甲基-3-叔丁基环己烷 trans-1-tert-Butyl-3-methylcyclohexane
环戊烷的构象:
C:sp3杂化, 轨道夹角109.5° 正五边形内角为108° 角张力:109.5-108=1.5° 可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五个碳 原子亦不共平面,而是以“信封 式”构象存在,使五元环的环张 力可进一步得到缓解。
反-1, 3-二乙基环戊烷
环烷烃的结构与稳定性
(一)环烷烃的稳定性与环大小的关系
1、稳定性:
<
<
,
…...
2、环烷烃稳定性大小的解释:
(1)Baeyer 张力学说 (2)“弯曲键”理论。 “弯曲键”理论是Baeyer 张力学说现代解释。
拜尔张力学说(A.von Baeyer 1885年)
① ② 假设成环所有的碳原子都在同一平面上,构成正多边形。 。 假设所有键角为109 28′(即四面体结构)。
CH3 H3C H CH3 H H3C H H CH3 CH3 H CH3
H3C
H
顺(cis): 两个取代基在环同侧;
反(trans):两个取代基在环异侧。
顺-1, 4-二甲基环己烷
反-1, 4-二甲基环己烷
思考题
C2H5
H
H
环烷烃(环丙烷、环丁烷、环戊烷、环己烷)的构象

环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。
3环烷烃

△ H[(CH2)n]
3
4
5
6
7
8
n (kJ/mol)
-697.1 -686.2 -664 -658.6 -662.4 -663.6
从环烷烃的开环反应条件(见本章§ )及燃烧热数据可以看出: 从环烷烃的开环反应条件(见本章§2)及燃烧热数据可以看出 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定, 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
中是环烷烃的同分异构体有: 如: C5H10 中是环烷烃的同分异构体有: 共4种构造异构体) 种构造异构体) ( 种构造异构体
CH2CH3 H3C
其中
H3C CH3
CH3
还存在顺反异构体: 还存在顺反异构体:
H3 C H
CH3 H
H3C H
H CH3
立体异构:构造式相同,而原子(或基团)在空间的位置不同; 立体异构:构造式相同,而原子(或基团)在空间的位置不同; 顺反异构:立体异构中的一种类型, 顺反异构:立体异构中的一种类型,指的是由于环或双键的存在 而产生的立体异构;常见于环烷烃和烯烃; 而产生的立体异构;常见于环烷烃和烯烃;
产生偏差的原因是因为Baeyer张力学说中的假设成环原子处于 张力学说中的假设成环原子处于 产生偏差的原因是因为 张力学说中的假设 共平面是错误的。 共平面是错误的。 事实上,除环丙烷外,其它环烷烃的成环原子都不是在共平面上; 事实上,除环丙烷外,其它环烷烃的成环原子都不是在共平面上;
三、环烷烃的真实结构: 环烷烃的真实结构:
HH H H
纽曼投影式
化妆品化学:环烷烃的性质

Br
➢ 1,3-二溴丙烷和1,4-二溴丁烷都是微黄色液体,是重要的有机合成原料。
➢ 小环烷烃与溴发生加成反应,溴的棕红色消失,用于鉴别三、四元环烷烃。
02 环烷烃的化学性质
一、环烷烃的化学性质
(3)加卤化氢:环丙烷和环丁烷都能与卤化氢发生加成反应,生成开链一 卤代烷烃。
+ H Br
CH3CH2CH2Br (1-溴丙 烷)
与卤素的加成在常温下就可进行,环丁烷则需要加热才能进行。如环丙烷与溴在
室温下发生加成反应生成1,3-二溴丙烷;环丁烷与溴在加热条件下发生加成反
应生成1,4-二溴丁烷。
+ Br
Br 室温 CH2CH2CH2 Br Br
(1,3-二溴丙烷)
+ Br
加热
Br
CH2CH2CH2CH2 (1,4-二溴丁烷)
Br
环烷烃的性质
1
目
2
录
01 环烷烃的物理性质
一、环烷烃的物理性质
1、物态
常温下,C3~C4环烷烃是气体; C5~C11环烷烃是液体;高级环烷烃是固体。
2、熔点和沸点
环烷烃的熔点和沸点变化规律是随分子中碳原子数目的增加而升高。同碳数目的 环烷烃的熔点和沸点高于开链烷烃。
3、相对密度
环烷烃的相对密度都小于1,比水轻,但比相应的开链烷烃的相对密度大。
(4)
(5) CH3 CH3
光照
CH3 + HCl
光照
+ Br2 + Cl2
02 环烷烃的化学性质
一、环烷烃的化学性质
3、氧化反应
➢ 与开链烷烃相似,环烷烃包括环丙烷和环丁烷这样的小环烷烃,在常温下都不 能与一般的氧化剂(如高锰酸钾的水溶液)发生氧化反应。如果环上的支链含有 不饱和键时,则不饱和键被氧化断裂,而环不发生破裂。
有机化学 第3环烷烃

环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
桥环化合物编号时,从一个桥头开始,循最长的桥编到另一个桥头, 然后再循次长桥编回起始桥头,最后从紧挨着起始桥头的碳原子循最 短桥完成全部编号(桥头原子不重复编号)。 两个桥头原子中的任意一个都可以作为编号起点。如果一个桥头有 取代基时,有取代基的编“1”号。两个桥头都有取代基时,取代基小 的编“1”号。 桥链上同时有不饱和键和取代基时,先按最长、次长、最短桥顺序 考虑,再考虑使不饱和键给予最小编号,最后考虑将取代基尽可能给 予最小编号。 4 CH CH
五、环烷烃的结构与稳定性
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
CH3
2 3 4 1 5 6
7
CH3
6 4 8 1 5 3 2
CH3
Br
5-甲基-1-溴螺[3, 4]辛烷2,6-二甲基螺[4.5]癸烷
我们将桥环和螺环双环烷烃的名称写成公式:
l
m
C3-烷烃

烷烃【打火机的由来:】1823年,德国化学家德贝莱发明了世界上第一台打火机。
他是利用锌和硫酸发生化学反应生成氢气,氢气喷到铂棉上自动起火。
由于这种打火机缺点很多,未能得到推广使用。
现代的电子打火机,主要用丁烷作为燃料,用电子陶瓷取代火石作为引燃物,用起来方便快捷。
丁烷属于烷烃,它的性质与甲烷相似,还有哪些物质与丁烷的性质也相似呢?一、烷烃的结构和性质(1)烷烃的概念烃分子里,碳原子之间都以碳碳单键结合成链状,碳原子的其余价键全部跟氢原子结合,这样的结合使得每个碳原子的化合价都已充分利用,都达到“饱和”,凡是具有这些共同特征的烃都属于烷烃,又叫做叫做饱和链烃。
烷烃概念的内涵有如下几点:①烷烃首先是烃,分子里只含C、H两种原子;②分子里仅含C—C键和C—H键;③烷烃分子结合成链状,可以是所谓的“直链”,如:CH3―CH2―CH2―CH3。
也可以含有支链,如:。
但结合为环状的不是烷烃,如:它们属于环烷烃,通式为C n H2n,化学性质与烷烃相似。
(2)烷烃的物理性质烷烃都是由分子组成的物质,分子之间的相互作用是分子间作用力,分子间作用力要比化学键弱得多。
因此,烷烃的熔点、沸点都较低,密度较小。
但是,不同的烷烃其物理性质也不同。
对于烷烃而言,相对分子质量大的,分子间作用力大,熔、沸点较高;对于相对分子质量相同的烷烃,支链越多,沸点越低。
烷烃的物理性质归纳如下:【溶解性:】烷烃不溶于水,但易溶于有机溶剂。
液态烷烃本身就是有机溶剂。
(相似相溶:结构相似者可能互溶)【状态:】分子里碳原子数等于或小于4的烷烃,在常温、常压下都是气体。
另外,(新戊烷)在常温、常压下也是气体。
其他烷烃,在常温、常压下都是液体或固体。
【密度:】烷烃的相对密度小于水的密度。
以下是部分烷烃的沸点和相对密度:例:将下列物质的沸点按由高到低的顺序排列(填序号)_____。
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH ④(CH3)4C⑤(CH3)2CHCH2CH3解析:本题是填空题,考查同系物的沸点与其相对分子质量及结构的关系等方面的知识。
环烷烃知识讲解

12
四. 环己烷及其衍生物的构象
1. 环己烷的构象 极端构象:
1)椅式构象
椅式
船式
H 2 H
250pm H3H
H 4 H
HH H
H
6
2
H
H 1 H
H6
H
H
5
H
1 H5 4
H
H
H
3H
H
H
扭船式
• 不存在: 空间张力; 扭转张力; 角张力。
13
1. 单环烃的命名
①按成环碳原子数目称为环某烷。
CH2 CH2 CH2 环丙烷
CH2 CH2
CH2 CH2 环丁烷
CH2 CH2 CH2
CH2 CH2
环戊烷
② 若环上有多个取代基时,编号从较小的取代基开始, 且使取代基的位次最小。(最低系列、次序原则)
1-甲基-4-丙基环己烷
4
3
或
5
2 1
1-甲基-3-乙基环戊烷 2
与正常键角偏差角度
49.5o
19.5o
1.5o
环烷烃
三元环
四元环
五元环
但是五元以上的环会不会因环数增大而不稳定?
四元环
五元环
六元环
10
近代共价键理论解释环的稳定性
电子云 偏向环平面 外侧,容易 受等亲电试 剂进攻,故 似烯烃进行 加成反应。
弯曲键(香蕉键)
共价键的形成是由于原 子轨道相互交盖的结果,交 盖程度越大,键越稳定。
Br
Br
20
3.环丙烷对氧化剂稳定
KMnO4 / H+
COOH
3_环烷烃(2)

两种类型C 两种类型C−H键
a键 : 键 竖键, 直键, 竖键 直键 直立键
H H H H H H H
H
H H H
H H H H
H H H H
H
e键 : 键 横键, 平键, 横键 平键 平伏键
a键和 键的相互转换 键和e键的相互转换 键和
H
3
翻转后,原来的 键转变 翻转后 原来的a键转变 原来的 键转变为a键 为e键,而e键转变为 键 键 而 键转变为
4、画出反-1,2-二氯环己烷的椅式构象,解释为什么两个氯必须都在 画出反-1,2-二氯环己烷的椅式构象,
直立位或都在平伏位。 直立位或都在平伏位。
【解答】 解答】
H H H H H H H H H Cle Cle H 环翻转 H H H H H H Cla H Cla H H
课堂练习: 课堂练习:
H
交叉式
C6-C1
2.50Å 2.50Å
H H H H H H H H H
H H
2.49Å 2.49Å
H
H~H之间距离均大 之间距离均大 之间距离均 于H的Van der 的 Waal’s半径之和 半径之和 (2.40Å )
2.49Å 2.49Å
环己烷的椅式构象
环己烷椅式构象的书法分3 环己烷椅式构象的书法分3步:
3 1
CH3
3
CH3 CH3 H
1
H3C
1
3
a, ee-
能量相等
e, aa-
CH3
1, 3-trans 3-
cis-1, 4-二甲基环己烷 CH3 H3C H3C H
4 1
CH3 H H3C
4
1
4
CH3
【知识解析】环烷烃

环烷烃1 环烷烃的结构环烷烃属于饱和烃,它的分子结构中存在碳环;与链状烷烃相似,所有碳原子都采取sp3杂化,每个碳原子与其连接的4个原子构成四面体空间结构,分子中仅有C—C σ键和C—H σ键。
最小的环烷烃是由3个碳原子构成的环丙烷(△)。
名师提醒(1)相同碳原子数的链状烷烃和环烷烃相比较,链状烷烃分子中的C—C键数比环烷烃分子中的少1,如丙烷分子中只有2个C—C σ键,而环丙烷分子中有3个C—C σ键;链状烷烃分子中的C—H键数比环烷烃分子中的多2。
(2)虽然环烷烃和链状烷烃的碳骨架不同,但由于二者的共价键类型相同,故化学性质相似。
2 环烷烃同系物的通式环丙烷()的分子式是C3H6,环丁烷()的分子式是C4H8,环戊烷()的分子式是C5H10……,由此可推断出环烷烃的分子通式是C n H2n(n≥3,n 为正整数)。
3 环烷烃同系物的物理性质随碳原子数的递增,环烷烃同系物的熔点、沸点逐渐升高,密度逐渐增大,但都小于水的密度,都难溶于水。
4 环烷烃同系物的化学性质与链状烷烃相似,环烷烃的化学性质比较稳定,不与强酸、强碱、强氧化剂反应;能在光照下发生取代反应、能在空气或O2中燃烧等。
典型例题例3-9(2020福建厦门期末)甲基环戊烷()常用作溶剂及色谱分析标准物质,也可用于有机合成。
下列有关该有机物的说法错误的是()A.分子式为C6H12B.与环己烷互为同分异构体C.易溶于水及苯D.不能使酸性高锰酸钾溶液褪色解析◆由甲基环戊烷的结构简式可推知其分子式为C6H12,A项正确;环己烷的分子式为C6H12,故环己烷与甲基环戊烷的分子式相同,而结构不同,二者互为同分异构体,B项正确;由环烷烃的物理性质可知,该有机物难溶于水,C项错误;由环烷烃的化学性质可知,该有机物不能使酸性高锰酸钾溶液褪色,D项正确。
答案◆C。
03-第三章-环烷烃

1. 化学反应 1). 取代反应
+ Br2 hν
Br + HBr
机理:自由基机理 取代反应一般在五、六元环上易发生。 2). 加成反应 小环易发生加成反应。
12
①. 加 H2
+ H2
Ni 40℃ C3 H C2 H CH3
+ H2
Ni 100℃
C3 H C2 H CH2C3 H
+ H2
Pt 300℃
角张力能Eθ 分偏 子离 中平 由衡 于位 几置 何时 原, 因所 要引 使起 键的 角张 的力 大。 小
扭转角变化
扭转角张力能Eφ
分
子
中
由
于
扭
转
角
变
化
所
引
起
的
张
力
。
22
例:顺交叉式丁烷构象,由于两个甲基的非键作用,相互排 斥,不稳定。
例:三元环、四元环由于键角变为60°、 90°,所以有一种 角张力,不稳定,易发生加成反应。
6 5
1
27
1). 椅式
4
6
5
3
2
1
C3
碳1、2、4、5是椅座。 碳1、5、6 是椅背。 碳2、3、4 是椅腿。
28
椅式C-H键的分类:
6个直立键:3个朝上,3个朝下。 都叫a键。平行于C3轴。 C3
6个平伏键:3个朝上,3个朝下。 都叫e键,与直立键成109°28/。 C3
29
结论:
①. 椅式是环己烷的最稳定的构象,在各种构象的平衡混合 物中,椅式占99.9%。 因为在椅式构象中,相邻两个碳原子上C-H键都处于交 叉式。四种张力能为零。
CH 3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2323
2424
2.4 取代环己烷构象
0.25nm
1、一取代:
CH3 CH3
椅式构象中,C1、C3和C5 (或C2、C 4和C 6)的三个a键所连的 氢原子之间的距离与两个氢原子半径大致相等,故无排斥力,
若氢原子被大基团取代则会拥挤而产生排斥力。若大基团连在
e键上,由于大基团伸向环外,距离较远,无排斥力,故大基 团连在e键的构象是更稳定的构象。
1.选主链:一般以环作为主体; 2.编号:取代基位置尽可能小,由连小基团的碳原子开始编号。
CH3
1 6 5 4 2 4 3 5 6
CH3
3
CH3
2
1
6 5 4
2 3
CH3
1
CH3
CH CH3 CH3
1,4-二甲基环己烷
1,3-二甲基环己烷 1-甲基-4-异丙基环己烷
6 6
3. 某些情况下,如当简单的环上连有较长的碳链时,也 可将环当作取代基,如:
1717
而在椅式构象中,不存在这种排斥力,C2—C3 、C5—C6上连 接的基团为邻位交叉式,因而能量较低,故椅式构象是更稳定 的构象,环己烷构象中通常椅式构象占优势。
1818
1919
2 3 1 6 5
4
从环己烷分子的椅式构象模型中可以看出:C1、C3和C5处 在同一个平面内,C2、C 4和C 6处在另外一个平面。
5 4 6 7
CH3 CH3
H 3C
CH 3
H3C 3
2
1
3,7,7-三甲基二环[4.1.0]庚烷 课堂练习:
7,7-二甲基二环[2.2.1]庚烷
1010
2.3 环烷的结构
H2 C H2 C CH2 环丙 烷
(
)
1111
环丙烷中,C-C键未达到最大重叠,键角105 0,偏离正常
键角,没有正常σ键稳定,故分子内存在一种使电子云达
CH2CH2CH2CH2CH3
环丁基戊烷
4. 取代的不饱和烃,要从不饱和键开始编号
7 7
二、多环脂环烃 (联环、螺环、稠环、桥环) 螺环: 两个碳环共有1个碳原子 稠环:两个碳环共有2个碳原子 桥环:两个或两个以上碳环共有2个以上碳原子
H 3C CH 3
桥环 环个数:一个环状化合物转变成开链化合物时需要 断开的碳碳键数来确定
8 8
1、二环螺环化合物命名: 以“螺”为词头编号由较小环中与螺原子相邻的碳原子开始,沿 小环经螺原子到大环。螺[m.n]某烷
6 5 7 3 4 7 8 1 1 2 6
5
CH3
4
3 2
螺[2.4]庚烷
螺[5.5]十一烷
5-甲基螺[3.4]辛烷
课堂练习:
9 9
2.二环桥环化合物的命名:双环[m.n.o]某烷 从桥头碳原子开始,各桥碳原子数由大到小放在方括号内,括号 放在“二环”与“某烷”之间
2525
1.下面构象最稳定的是
2626
2。画出甲基环己环最稳定都构象
3 。画出顺式1-甲基-3-异丙基环己环最稳定构象
2727
2.5 十氢化萘的构象
顺十氢化萘
反十氢化萘
2828Biblioteka 2.6 环烷烃的性质 P58 一.物理性质:不溶于水,沸熔点和相对密度比相应的烷烃高。 二.化学性质“大环似烷,小环似烯”, 1、催化氢化:Pt、Pd或Ni的催化下,环丙烷和环丁烷开环加成
Ni 800C Ni 2000C
+ +
H2
CH3CH2CH3
H2
CH3CH2CH2CH3
在上述条件下,环戊烷、环己烷以及更大环的环烷烃就不发生反应
2、顺反异构:由于成环原子之间的单键不能自由旋转而
引起。两个取代基在环平面同侧为顺式,不同侧为反式
H3C
H
H3 C
CH3 H
H
H CH3 CH3 H
H3 C
H
顺-1,4-二甲基环己烷
H3 C H
反-1,4-二甲基环己烷
H CH3
5 5
2.2 环烷烃的命名 一、单环脂环烃 与烷烃命名相似,在相应烷烃名称前加一“环”字。
3、按环中键的类型分:环烷烃、环烯烃、环炔烃等
2.1.1 通式:环烷烃CnH2n ;环烯烃CnH2n-2 ;环炔烃CnH2n-4;五、 六元环最为常见。
4 4
2.1.2 环烷烃异构:碳骨架异构和立体顺反异构: 1、碳骨架异构 如:C8H16
CH2 CH3 CH3 CH2 CH3 H3 C CH3 H3 C CH2 CH3 H3 C CH3 CH2 CH3
第二章 环烷烃
Cycloalkanes
2 2
2.1环烷烃的通式和构造异构
环烷烃(由碳和氢两种元素组成的环状化合物) 脂环烃的分类 1、按碳环数分:单环脂环烃;二环脂环烃和多环脂环烃等
CH3
立方烷
棱烷
蓝烷
金刚烷
3 3
2、按成环碳原子数分:三元环、四元环、五元环脂环烃等, 其中五,六元环最稳定
小环化合物 C3~C4 普通环化合物 C5~C7 中环化合物 C8~C11 大环化合物 ≥C12
到最大重叠的倾向的力,叫张力。
1212
环丁烷分子中也存在张力,但比环丙烷要小,随着碳原 子数增加,成环碳原子可以不在一个平面内,碳碳键逐 渐趋于最大重叠 普通环化合物 C5~C7
1313
2.4 环己烷及其衍生物的结构 P61 1 环己烷构象
1
3 2 5 4 6
1
(a)
(b)
6
2
3 5
4
环己烷 的两种极限构象
e键
特点:
1. 在环已烷的椅式构象中,每一个碳原子上各 有一个a键及一个e 键; 2. 相邻两个碳原子上的a键(或e键)都是一个 向上,另一个向下(反式); 3. 而相隔一个碳原子的两个a键(或e键)的方 向是一致的(顺式);
4. 处于对位(1,4)的两个碳原子上的a键(或 e键)的方向又是相反的(反式)。
1414
3
4 5
2 6
1
4 5
3
2 6
1
在(a)和(b)中,C2、C3 、C5 、C6都在一个平面内,但在(b) 中,C1和C4在平面的同一侧,这种构象叫船式构象;而在(a)
中,C1和C4在平面的上下两侧,这种构象叫椅式构象。
1515
环己烷 椅式构象 船式构象的凯库勒模型
1616
在船式构象中, C1和C4上的两个氢原子相距极近,相互 之间排斥力比较大;而且C2—C3 、C5—C6上连接的基 团为全重叠式,这种构象能量较高。
2020
a键 e键
每个碳上与氢原子相连的两个键都是一个垂直于平面,这个键
叫直立键,以a[axial( 轴向的)]表示;另一个键则大致与平面
平行,叫做平伏键,以e[equatorial(赤道的)]表示。
六个a键六个e键;画法:3左3右,3上3下。
2121
a键 e键
环已烷的椅式构象的画法
a键
2222
