第9章 蛋白质和氨基酸的测定
第九章氨基酸代谢

5.96
CH3-CH-CH2 CHCOOH
Leu L
CH3
NH2
5.98
二、氨基酸的脱氨基作用
? 脱氨基作用 是指氨基酸脱去氨基生成相 应α-酮酸的过程。
氧化脱氨基
转氨基作用 ?方式
联合脱氨基
*嘌呤核苷酸循环
(一) 氧化脱氨基作用
1. L-谷氨酸脱氢酶广泛 存在于肝、脑、肾等组织中。 2. 其辅酶为 NAD+ 或NADP+。 3. GTP、ATP为其抑制剂; GDP、ADP为其激活剂。
尿素
鸟氨酸
氨基甲酰磷酸
精氨酸
延胡索酸
O2
NO
一氧化氮合酶 (NOS)
精氨酸代 琥珀酸
瓜氨酸
天冬氨酸
对心脑血管方面
NO在感觉传入以及学习记忆等有很重要的作用。先
天性精氨酸代琥珀酸合成酶(裂解酶)缺乏可出现严重
的精神障碍症状。还有研究发现 NO可抑制肿瘤的生长。
(三)高氨血症和氨中毒
1.血氨浓度升高称 高氨血症,此时可引起脑 功能障碍,称 氨中毒。常见于肝功能严重损伤、 尿素合成酶系的遗传缺陷。
1.总氮平衡 摄入氮 = 排出氮(正常成人)。 2.正氮平衡 摄入氮 > 排出氮(儿童、孕妇等 )。 3.负氮平衡 摄入氮 < 排出氮(饥饿、消耗性
疾病患者 )。 4.氮平衡意义 可反映体内蛋白质代谢的慨况。
(二) 需要量
成人每日最低蛋白质需要量为 30~50g,我 国营养学会推荐成人每日蛋白质需要量为 80g。
食物蛋白质
组织 分解 蛋白质
合成
氨基酸 代谢库
尿素 氨
α-酮酸
酮体 氧化供能
糖
Hale Waihona Puke 体内合成氨基酸 (非必需氨基酸)
197-习题作业-食品中蛋白质和氨基酸的测定 习题作业答案

习题九、食品中蛋白质的测定 答案一、填空题1.新鲜食品中的含氮化合物大都以蛋白质为主体。
2.脱水和氧化;催化剂、指示消化反应的完成、蒸馏时碱性反应的指示剂。
3.防止消化时产生的泡沫溢出瓶外;冷凝管尖端插入液面之下,样品消化液,将冷凝管尖端提离液面。
4.游离氨基酸。
5.使消化液呈碱性,便于氨游离出来,深蓝色或产生黑色沉淀,反应生成氢氧化铜,增加氢氧化钠的用量。
6.与氨基结合使氨基酸的碱性消失。
7.消化、蒸馏、吸收、滴定。
8.少量辛醇或液体石蜡或硅油。
9.澄清透明的蓝绿色。
10.蓝绿色、暗红色。
11.提高溶液沸点。
12.氨基酸,含氮。
13.硼酸。
二、判断题1.× 2.√ 3.√ 4.×三、名词解释1.粗蛋白含量:新鲜食品中含氮化合物大都以蛋白质为主体,凯氏定氮法是通过测出样品中的总含氮量再乘以相应的蛋白质系数而求出蛋白质的含量的方法。
由于样品中含有少量非蛋白质含氮化合物,如核酸、生物碱、含氮类脂、卟啉以及含氮色素等非蛋白质的含氮化合物,所以结果为粗蛋白含量。
2.蛋白质系数:每份氮素相当于的蛋白质的份数。
一般蛋白质含氮为16%,所以1份氮素相当于6.25份蛋白质,此数值(6.25)称为蛋白质系数。
不同种类食品的蛋白质系数不同。
四、问答题1.凯氏定氮法测定蛋白质的原理及操作步骤如何?加入的各种试剂起什么作用?操作过程中有哪些注意事项?原理:样品、浓硫酸和催化剂一同加热消化,使蛋白质分解,其中碳和氢被氧化为二氧化碳和水逸出,而样品中的有机氮转化为氨,并与硫酸结合成硫酸铵。
然后加碱蒸馏,使氨逸出,用硼酸溶液吸收后,再以标准盐酸溶液滴定。
根据消耗的标准盐酸液的体积可计算蛋白质的含量。
测定步骤:样品的消化、蒸留、吸收和滴定。
试剂及作用:硫酸铜催化剂和指示剂;硫酸钾提高沸点(4000C);浓硫酸消化;氢氧化钠溶液蒸留出氨气;硼酸溶液吸收氨气;盐酸标准溶液标定硼酸氨;溴甲酚绿-甲基红指示剂。
注意事项:所用试剂需用无氨蒸馏水配;消化初期先小火防泡沫溢出;蒸馏装置要密封,冷凝管要插入吸收瓶液液面之下;蒸馏结束一定要先撤吸收瓶再关电炉。
检测蛋白质中氨基酸的含量的各种方法及优劣讨论

蛋白质中氨基酸的含量测定组成蛋白质的基本单位是氨基酸,氨基酸通过脱水缩合形成肽链。
蛋白质是由一条或多条多肽链组成的生物大分子,其含量测定是生化药品研究中最常用、最基本的分析方法之一。
目前其常用的测定方法有凯氏定氮法、福林酚法、双缩脲法、BcA法、考马斯亮蓝法、紫外分光光度法及荧光法。
1凯氏定氮法1.1方法本法系依据蛋白质为含氮的有机化合物,当与硫酸和硫酸铜、硫酸钾一同加热消化时使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。
然后碱化蒸馏使氨游离,用硼酸液吸收后以硫酸滴定液滴定,根据酸的消耗量乘以氮转化为蛋白质的换算系数,即为蛋白质的含量。
本法各国药典收载的方法一致。
故参照《中国药典》2005年版三部[41附录方法,按纯蛋白类供试品及添加无机含氮物质及有机非蛋白质含氮物质的供试品分别拟定各测定方法。
1.2讨论1.2.1凯氏定氮法虽耗时较长,但它是蛋白质测定方法中最经典的测定方法,本法所测的结果为蛋白质绝对浓度而非相对浓度,可用于标准蛋白质含量的准确测定。
1.2.2本法灵敏度较低,适用于O.2~2.o mg氮的测定,干扰少。
1.2.3蛋白质是复杂的含氮有机化合物,一般蛋白质的含氮量为16%,故含氮量转化为蛋白质的系数为6.25。
但由于不同蛋白质的结构差异,其换算系数会稍有区别,如乳制品为6.38,动物胶为5。
65等,因此一些特殊蛋白质应在各论中相应说吩其转化系数。
1.2.4在本法附注中起草了非蛋白氮供试品溶液制备的两种常用方法用于非氮的测定,一般采用钨酸沉淀法,但当供试品中含有氨基酸(精氨酸)时,由于其会影响蛋白质的沉淀,故建议采用三氯醋酸沉淀法方法(1)与方法(3)的线性相关系数均能达到0.999以上,较理想;方法(1)试剂配制繁琐且整个实验费时长,而方法(3)操作更简便快速。
第九章 蛋白质和氨基酸的测定

4.结果计算
式中
w——氨基酸态氮的质量分数;
C——氢氧化钠标准溶液的浓度,mol/L;
V1——用中性红作指示剂滴定消耗氢氧化钠标 准溶液的体积,ml;
V2——用百里酚酞作指示剂滴定消耗氢氧化钠 标准溶液的体积,ml; 0.014——氮的毫摩尔质量,g/mmol
m—— 测定用样品溶液相当于样品的质量,g。
思考题:
1.为什么说用凯氏定氮法测定出食品中的蛋白质含量 为粗蛋白含量?
2.在消化过程中加入的硫酸铜试剂有哪些作用?
3.样品消化过程中内容物的颜色发生什么变化?为什 么?
4.样品经消化进行蒸馏之前为什么要加入氢氧化钠? 这时溶液的颜色会发生什么变化?为什么?如果没有变 化,说明了什么问题?须采取什么措施? 5.蛋白质蒸馏装置的水蒸气发生器中的水为何要用硫 酸调成酸性? 6.蛋白质测定的结果计算为什么要乘上蛋白质系数?
(5) 混合指示剂
甲基红—溴甲酚绿混合指示剂: 5份2g/L溴甲酚绿95%乙醇溶液与1份2g/L甲基红乙 醇溶液混合均匀。终点为灰红色。 或甲基红—亚甲蓝混合指示剂:
一体积的亚甲蓝(0.05%酒精溶液)和二体积的甲 基红指示剂(0.05%酒精溶液)的混合物。终点为紫色。
(6) 饱和硼酸溶液(40g/L): 称取20g硼酸溶解于500mL热水中,摇匀备用。 (7) 0.1N盐酸标准溶液
第九章 蛋白质和氨基酸的测定
第一节 概述 第二节 蛋白质的测定方法 第三节 氨基酸态氮的测定
第一节 概述
一、pro组成与蛋白质系数 1.组成 pro是由两性氨基酸通过肽键结合在一起的大 分子化合物。
元素组成百分比:
元素 C H O N S P
百分比 50 7 23
16
9 蛋白质及氨基酸的测定

5.操作方法:采用凯氏法测出的蛋白质样品为
标准样绘标准曲线。
三.紫外吸收法
1.原理:利用蛋白质的特有基团,
R │ (— NH—CH—CO) 对紫外光有吸收作用在280 nm下,吸光度与蛋白 质浓度成直线关系,求含量。
2.适用范围:常用于生物化学工作,因为 干扰因素多,故在食品分析领域应用不广 泛。
硫酸铜的作用
① 催化剂 2CuSO4=Cu2SO4+SO2↑+O2 ↑ C+2CuSO4=Cu2SO4+SO2↑+CO2↑
Cu2SO4+2H2SO4=2CuSO4+2H2O+SO2↑ 此反应不断进行,待有机物被消化完后, 不再有硫酸亚铜(褐色)生成,溶液呈现清 澈的蓝绿色。
② 可以指示消化终点的到达
⑦蒸馏过程应注意接头处无松漏现象,蒸馏完毕,
先将蒸馏出口离开液面,继续蒸馏1min,将附 着在尖端的吸收液完全洗入吸收瓶内,再将吸 收瓶移开,最后关闭电源,绝不能先关闭电源, 否则吸收液将发生倒吸。
⑧硼酸吸收液的温度不应超过40°C,否则氨吸
收减弱,造成损失,可置于冷水浴中。
⑨混合指示剂在碱性溶液中呈绿色,在中性溶液
9 蛋白质及氨基酸的测定
概述
蛋白质概况 蛋白质是含氮的有机化合物,分子量很大。主
要由C、H、O、N、S五种元素组成。某些蛋白质 中还含有微量的 P、Cu、Fe、I 等。
在食品和生物材料中常包括蛋白质,可能还包 括有非蛋白质含氮的化合物,(如核酸、含氮碳水 化合物、生物碱等;含氮类脂、卟啉和含氮的色 素)。
0.014—氮的毫摩尔质量,g/mmol;
F—蛋白质系数;
m—样品质量,g。
改 进 后 的 水 化 装 置
食品理化检验分析 第九章 蛋白质和氨基酸的测定

二、 自动凯氏定氮法 1、原理及适用范围同前 2、特点:
(1)消化装置用优质玻璃制成的凯氏消化瓶,红 外线加热的消化炉。 (2)快速:一次可同时消化8个样品,30分钟可消 化完毕。 (3)自动:自动加碱蒸馏,自动吸收和滴定,自 动数字显示装置。可计算总氮百分含量并记录,12 分钟完成1个样。
5.计算: 氨基酸态氮=〔 c×(V2-V1)×0.014×100 ) 〕/W×100 V1——用中性红为指示剂时,碱液所消耗 的体积 V2——用百里酚酞乙醇液为指示剂时标液 消耗量
0.014——氮的毫摩尔质量,g/mmol。
(二)茚三酮的比色法
原理:氨基酸在一定条件下与茚三酮起反应,生 成蓝紫色化合物,可比色定量。(570nm)
一.双缩脲法 1.原理 脲(尿素)NH2—CO—NH2 加热至150~160℃时 ,两分子缩和成双缩脲。 NH2—CO—NH2 + NH2—CO—NH2 NH2—CO—NH—CO—NH2 + NH3 双缩脲能和硫酸铜的碱性溶液生成紫红色络和 物,此反应叫双缩脲反应。(缩二脲反应) 蛋白质分子中含有肽键( —CO—NH—),与双缩 脲结构相似。在同样条件下也有呈色反应,在一定 条件下,其颜色深浅与蛋白质含量成正比,可用分 光光度计来测其吸光度,确定含量。(560nm)
3.双指示剂:
① 40%中性甲醛溶液:以百里酚酞作指示剂,用 氢氧化钠将40%甲醛中和至淡蓝色。
② 0.1%百里酚酞乙醇溶液,(9.4~10.6)
③ 0.1%中性红 50%乙醇溶液,(6.8~8.0) ④ 0.1 mol/L 氢氧化钠标准溶液。
4.操作:
取相同两份样品20~30mg→分别于250ml三角瓶→各 加50ml蒸馏水 一份加中性红3滴→用0.1mol/L NaOH 滴定终点(由红变琥珀色),记录用量,另一份加百里酚 酞乙醇液3滴加中性甲醛20ml→摇匀→用0.1mol/L NaOH 滴至淡兰色。分别记录两次所消耗的碱液ml数。
蛋白质和氨基酸的测定复习题

蛋白质和氨基酸的测定复习题一、填空1.构成蛋白质的基本物质是氨基酸;所有的蛋白质都含氮素;测定蛋白质的含量主要是测定其中的含氮量。
2.凯氏定氮法测定N元素含量时,样品与浓硫酸,催化剂一同加热消化,其中碳和氢氧化成二氧化碳和水,N最终转化为硫酸铵。
3.测定蛋白质的主要消化剂是硫酸;消化时,凯氏烧瓶应倾斜45度角;温度控制时应先低温消化,待泡末停止产生后再加高温消化;消化结束时,凯氏烧瓶内的液体应呈透明蓝绿色;蒸馏过程中,接收瓶内的液体是硼酸;蛋白质测定所用的氢氧化钠的浓度是45%左右;所用的指示剂是甲基红—溴甲酚绿混合指示剂。
将甲基红—溴甲酚绿混合指示剂加入硼酸溶液中,溶液应显暗红色。
4.测氨基酸态氮时,加入甲醛的目的是使氨基的碱性消失;氨基酸态氮含量测定的公式是X=c V×0.014×100/m 。
二、判断:1.(√)凯氏定蛋法测蛋白质含量时,酸吸收液的温度不应超过40°C2.(×)凯氏定氮法测氮含量时,消化中采用K2SO4作为催化剂。
3.(√)牛磺酸是一种氨基酸。
4.(√)氨基酸分析仪检测牛磺酸时,因为牛磺酸与强酸性树脂结合力不强,首先被洗脱下来。
三、单项选择题1、凯氏定氮法只能测粗蛋白的含量是因为样品中常含有 A 、 D 、 E 、以及 F 等非蛋白质的含氮物质,故结果为粗蛋白质含量。
A 核酸、B无机氮、C 尿素、D生物碱、E含氮类脂、F含氮色素2. (D )凯氏定氮法测定蛋白质,蒸馏前,若加碱后消化液呈蓝色,此时应。
A. 不必在意,马上进行蒸馏B. 增加消化液用量C. 加入适量的水D. 增加氢氧化钠的用量四、简答题1.粗蛋白答:粗蛋白是食品中含氮化合物的总称,既包括真蛋白又包括非蛋白含氮化合物,后者又可能包括游离氨基酸、嘌呤、吡啶、尿素、硝酸盐和氨等。
2.凯氏定氮法测定蛋白质,结果计算为什么要乘以蛋白质的折算数?消化中K2SO4和CuSO4分别起什么作用?答:凯氏定氮法测得的是样品中N元素的含量,而样品中蛋白质的含量一般为15~17%,只要乘以相应的折算系数就可以计算粗蛋白的含量,样品不同,折算系数有所差异,要视具体原料不同,选用不同的折算系数。
食品分析与检验蛋白质与氨基酸的测定

食品分析与检验蛋白质与氨基酸的测定蛋白质与氨基酸的测定在食品分析与检验领域中具有重要意义。
蛋白质是食品中重要的营养组分,而氨基酸是构成蛋白质的基本单元,对于评价食品的品质和安全性具有重要意义。
本文将介绍蛋白质与氨基酸的测定方法及其在食品分析与检验中的应用。
蛋白质的测定方法主要有几种:生物测定法、光谱法和色谱法。
其中,生物测定法主要是通过测定食品中的氮元素含量来间接测定蛋白质含量。
常用的方法有凯氏氮法、造浆法和改良Kjeldahl法等。
光谱法主要是通过根据蛋白质的特征光吸收谱测定其含量。
常用的方法有紫外-可见光谱法、荧光光谱法和红外光谱法等。
色谱法是通过分离和检测蛋白质的各种成分来测定其含量。
常用的方法有凝胶过滤层析法、液相色谱法和气相色谱法等。
氨基酸是构成蛋白质的基本单元,对于评价蛋白质的营养价值和品质具有重要作用。
氨基酸的测定方法主要有色谱法和生物传感器方法。
其中,色谱法是目前最主要的氨基酸定量方法,其主要包括高效液相色谱法和气相色谱法。
高效液相色谱法常用于氨基酸的定性和定量分析,具有灵敏度高、选择性好和分析速度快的特点;气相色谱法通常用于氨基酸的定性分析,具有高分离能力和分析速度快的优势。
生物传感器方法是一种新兴的氨基酸测定方法,通过利用生物传感器对氨基酸的选择性响应来测定其含量。
生物传感器方法具有灵敏度高、反应快和操作简便等特点。
在食品分析与检验中,蛋白质与氨基酸的测定具有广泛的应用。
首先,蛋白质含量是评价食品营养价值的重要指标之一、通过测定食品中蛋白质的含量,可以评估其蛋白质营养价值和食品质量。
其次,氨基酸是判定食品蛋白质种类和品质的重要指标。
通过测定食品中各种氨基酸的含量,可以评价蛋白质的品质和营养价值。
此外,蛋白质与氨基酸的测定还可以用于食品的伪标问题的检验,如检验食品中是否含有非法添加的蛋白质或氨基酸衍生物。
综上所述,蛋白质与氨基酸的测定在食品分析与检验中具有重要意义。
通过选择合适的测定方法,可以准确、快速地测定食品中的蛋白质含量和氨基酸组成,从而评价食品的品质、安全性和营养价值。
蛋白质氨基酸测定

三聚氰胺(melamine)
是一种有机含氮杂环化合物,学名1,3,5-三嗪-2,4,6-三胺, 或称为2,4,6-三氨基-1,3,5-三嗪,简称三胺、蜜胺、氰尿 酰胺,是一种重要的化工原料,主要用途是与醛缩合,生 成三聚氰胺-甲醛树脂,生产塑料,这种塑料不易着火,耐 水、耐热、耐老化、耐电弧、耐化学腐蚀,有良好的绝缘 性能和机械强度,是木材、涂料、造纸、纺织、皮革、电 器等不可缺少的原料。它还可以用来做胶水和阻燃剂,部 分亚洲国家,也被用来制造化肥。
①样品消化 : 准确称取一定量的样品至干燥洁净的 500mL凯氏烧瓶中,加入硫酸铜0.5g(1g)、硫酸钾10g (3g)和浓硫酸20mL、玻璃珠数粒→轻轻摇匀,以45º斜 支于石棉网上→用电炉以小火加热(或先烧瓶放在距电 炉较远处),待内容物全部炭化、泡沫停止产生后→加 大火力(或将烧瓶放在电炉上),保持瓶内液体微沸→至 液体变蓝绿色透明后→继续加热微沸30min→关闭电炉, 取下烧瓶、冷却→转移至100mL容量瓶中,加水定容。
❖ 加入硫酸铜的作用 催化作用:加速有机物的氧化分解 C+ 2CuSO4 → Cu2SO4 + SO2↑+ CO2↑ Cu2SO4 + 2H2SO4 → 2CuSO4 + 2H2O + SO2↑ 此反应不断进行,待有机物被消化完后,不再有硫 酸亚铜(褐色)生成,溶液呈现清澈的蓝绿色。
消化完全指示:蓝绿色;
三聚氰胺的最大的特点是含氮量很高(66 %),加之其生产工艺简单、成本很低, 给了掺假、造假者极大地利益驱动,有人 估算在植物蛋白粉和饲料中使蛋白质增加 一个百分点,用三聚氰胺的花费只有真实 蛋白原料的1/5。所以“增加”产品的表观 蛋白质含量是添加三聚氰胺的主要原因, 三聚氰胺作为一种白色结晶粉末,没有什 么气味和味道,掺杂后不易被发现等也成 了掺假、造假者心存侥幸的辅助原因。
生物化学第九章蛋白质的酶促降解和氨基酸的代谢

1 H N-C- P 2
氨甲酰磷酸
2ADP+Pi
谷氨酸
-酮戊 二酸
谷氨酸
鸟氨酸
2
瓜氨酸 氨基酸
-酮戊 二酸
氨基酸 鸟氨酸 O NH2-C-NH2 尿素
瓜氨酸
谷氨酸 天冬氨酸
5
精氨酸
尿素循环
精氨琥珀酸
3
4
草酰乙酸
延胡索酸
细胞溶液
植物体含有脲酶,尤其是在豆科植物种子中 脲酶活性较大,能专一地催化尿素水解并放出氨, 反应式如下:
2、转氨基作用
R1-CH-COO|
NH+3
α -氨基酸1
R2-C-COO|| O
α-酮酸2
R1-C-COO|| O
α-酮酸1
R2-CH-COO| NH+3
转氨酶
(辅酶:磷酸吡哆醛)
α-氨基酸2
要点:
①反应可逆。
②体内除Lys、Gly、Thr、Pro和羟脯氨 酸外,大多数氨基酸都可进行转氨基作 用。 ③转氨酶均以磷酸吡哆醛为辅酶。磷酸吡 哆醛是VB6的衍生物。反应中起传递氨 基的作用。
活性中心含有 Zn2+ 、 Mg2+等 金属
3、4、2、4
金属蛋白酶类 (metallopritelnase)
枯草杆菌蛋白酶 嗜热菌蛋白酶
3.消化道内几种蛋白酶的专一性
氨肽酶
(Phe.Tyr.Trp) (Arg.Lys)
羧肽酶 羧肽酶
(Phe. Trp)
(脂肪族)
胃蛋白酶
胰凝乳 蛋白酶
弹性蛋白酶
胰蛋白酶
异亮氨酸 甲硫氨酸 缬氨酸
琥珀酰CoA
-酮戊二酸
氨基酸碳骨架进入三羧酸循环的途径
食品中氨基酸及蛋白质的测定(实验报告)
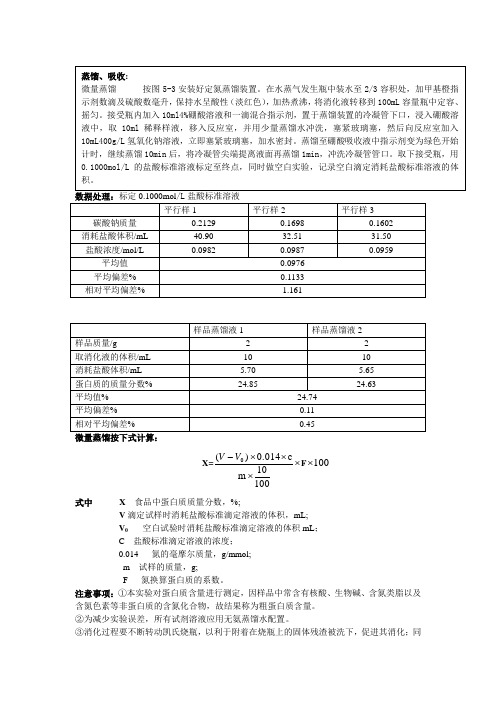
测定食品中的蛋白质---2013.3.25组员:***实验目的:(1)会测定食品中粗蛋白的含量。
(2)明确常见的食品蛋白质含量,以及测定原理。
实验原理:将被检样品加入浓硫酸,以硫酸铜,硫酸钾为催化剂共同加热消化食品中蛋白质分解为氨,并与硫酸结合成硫酸铵,通过碱化蒸馏,使氨分离出来,用硼酸吸收形成硼酸按后,再用盐酸标准溶液滴定,根据消耗的标准盐酸的体积,通过换算系数,可测定食品中蛋白质的含量。
实验仪器:凯氏烧瓶、可调式电炉、定氮蒸馏装置试剂:①硫酸铜CuSO4.5H2O ②硫酸钾③硫酸(密度为1.8149g/L)④40g/L 硼酸溶液⑤混合试剂;1g/L甲基红乙醇溶液与1g/L亚甲基蓝乙醇溶液,用时按2:1的比例混合。
实验步骤:数据处理:标定0.1000mol /L 盐酸标准溶液微量蒸馏按下式计算:X=⨯⨯⨯⨯-10010m c0.014)(0V V F 100⨯式中 X 食品中蛋白质质量分数,%;V 滴定试样时消耗盐酸标准滴定溶液的体积,mL;V 0 空白试验时消耗盐酸标准滴定溶液的体积mL ;C 盐酸标准滴定溶液的浓度; 0.014 氮的毫摩尔质量,g/mmol; m 试样的质量,g;F 氮换算蛋白质的系数。
注意事项:①本实验对蛋白质含量进行测定,因样品中常含有核酸、生物碱、含氮类脂以及含氮色素等非蛋白质的含氮化合物,故结果称为粗蛋白质含量。
②为减少实验误差,所有试剂溶液应用无氨蒸馏水配置。
③消化过程要不断转动凯氏烧瓶,以利于附着在烧瓶上的固体残渣被洗下,促进其消化;同时为防止造成氮损失,不要用强火,应保持缓和沸腾。
④样品中含脂肪或糖较多,消化过程中易产生大量泡沫,为防止泡沫外溢,在消化开始时用小火加热,并时时摇动,并可以加入少量辛醇、液体石蜡或硅油消泡剂,并控制热源强度。
⑤一般消化至呈透明后,继续消化30min即可,但对于含有特别难以氨化的氮化合物的样品,如含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸等时,呈较深绿色。
第九章 蛋白质的测定

但硫酸钾加入量不能太大,否则消化体系温度过高, 又会引起已生成的铵盐发生热分解而造成损失:
(NH4)2SO4=NH3↑+(NH4)HSO4 2(NH4)HSO4=2NH3↑+2SO3↑+2H2O
硫酸铜的作用
2CuSO4=CuSO4+SO2↑+O2 CO2+2CuSO4=Cu2SO4+SO2↑+O2↑ Cu2SO4+2H2SO4=2CuSO4+2H2O+SO2↑ 此反应不断进行,待有机物被消化完后,不再有硫酸 亚铜(褐色)生成,溶液呈现清澈的蓝绿色。 ② 可以指示消化终点的到达 ③ 下一步蒸馏时作为碱性反应的指示剂。 ① 催化剂
KjeltecTM 8200 凯氏定氮仪
包含KjeltecTM 8100 所有的特征, 另加:
自动添加接收液
自动安全门
可增加模块升级到全自动凯氏定 氮仪
KjeltecTM 8400 全自动凯氏定氮仪
包括 KjeltecTM 8200的所有特征, 外加:
滴定、计算和报告。 可升级和20或60位自动进样器连 用,进行无人值守的全自动化操 作。 局域网连接方式能够和打印机及 天平进行无障碍连接。 彩色触摸屏。 通过可选计算机数据管理软件 Compass实现完全由计算机控制 样品注册和报告。
The Kjeldahl Procedure 凯氏法的程序
1. Digestion step 消化 2. Distillation step 蒸馏 3. Titration step 滴定
1、原理
2NH2(CH2)2COOH+13H2SO4→(NH4)2SO4+6CO2+12SO
2+16H2O
蛋白质和氨基酸的测定

缬氨酸
丝氨酸
Pro的基本组成单位是氨基酸 几种常见的氨基酸
那什么是 氨基酸呢?
几种常见的氨基酸
这些氨基酸 结构上有什 么共同点?
羧基和氨基 连接在同一 个碳原子上
蛋白质的基石物质:α-氨基酸
氨基酸的缩合
二肽、多肽等
肽键
三、什蛋问么:白样蛋质的白性质的质具性呢有?质
1. 盐析 2. 变性
1. 误食重金属盐,可 以喝大量牛奶进 行紧急处理 ,WHY?
a) 凯氏烧瓶500 mL或250 mL b) 龙科A—凯氏定氮仪 c) 扭力天平 d) 分析天平 e) 5mL移液管 f) 温度可以控制的电炉 g) 小漏斗 h) 滴定管 i) 250 mL锥形瓶 j) 玻璃珠
②仪器
③ 试剂
〔GB/T 5009.5-2003《食品中蛋白质的测定》第一法〕
a) 硫酸铜 <CuSO4·5H2O> b) 硫酸钾 c) 硫酸 <密度为1.8419g/L> d) 硼酸溶液 <20g/L> e) 氢氧化钠溶液 <400g/L> f) 盐酸标准滴定溶液[c<HCl>=0.0500 mol/L] 或硫酸标准滴定溶 液[c<1/2H2SO4>=0.0500 mol/L] g) 混合指示液:1份甲基红乙醇溶液 <1g/L> 与5份溴甲酚绿乙醇 溶液<1g/L> ,临用时混合.<也可用2份甲基红乙醇溶液<1g/L>与1 份次甲基蓝乙醇溶液<1g/L>临用时混合>.
36.2
切达干酪
24.9
酸奶(普通的、低脂) 5.3
水果和蔬菜
苹果(生、带皮)
0.2
食品检验与分析第十章蛋白质和氨基酸的测定

食品检验与分析第十章蛋白质和氨基酸的测定蛋白质是生命体内非常重要的一类生物大分子,它在细胞结构和机能维持、代谢调控以及免疫防御等方面起着重要作用。
因此,对蛋白质的准确测定和定量分析具有极其重要的意义。
本章主要介绍蛋白质和氨基酸的测定方法。
蛋白质的测定方法主要分为定性测定和定量测定两大类。
定性测定方法包括生物试验法、电泳法、免疫学方法和核磁共振法等。
定量测定方法包括比色法、碱液法、生物试验法、紫外分光光度法和蛋白质序列测定法等。
比色法是常用的蛋白质定量方法之一,它利用蛋白质与试剂形成复合物,复合物在特定波长下具有特异性吸光度。
根据吸光度与蛋白质浓度的线性关系,就可以测定蛋白质的含量。
常用的比色法有布拉德福法、Lowry法和BCA法等。
布拉德福法是最常用的蛋白质定量方法之一、该法利用菜酶素染色反应,使蛋白质呈现紫色,然后通过比色法测定溶液的吸光度,从而测定蛋白质的含量。
布拉德福法的优点是灵敏度高,适用于各种类型的蛋白质测定。
Lowry法是另一种常用的蛋白质定量方法,该法利用碱液将蛋白质氢氧化,生成肽链片段,然后与Folin-Phenol试剂发生酸碱反应,生成蓝色产物,通过比色法测定吸光度,从而得到蛋白质的含量。
BCA法是一种基于比色法的蛋白质定量方法,该法利用铜离子和双酚试剂反应生成复合物,复合物在特定波长下具有最大吸光度,通过测定吸光度可以得到蛋白质的含量。
BCA法的优点是灵敏度高,适用于各种类型的蛋白质测定。
氨基酸是构成蛋白质的基本单位,对氨基酸的快速准确测定具有重要意义。
氨基酸的测定方法主要分为色谱法和比色法两大类。
色谱法是氨基酸测定的常用方法之一,主要包括气相色谱法和高效液相色谱法。
气相色谱法将氨基酸转化为甲醯基衍生物,然后通过气相色谱进行分离和定量。
高效液相色谱法使用分离柱进行分离,可以达到更高的分离效率和灵敏度。
比色法是氨基酸测定的另一种常用方法,主要有二色法和氨基酸定量方法。
二色法利用氨基酸与染料之间的化学反应产生色素,通过比色法测定吸光度,从而确定氨基酸的含量。
第09章 蛋白质的降解与氨基酸代谢

5. 脱酰氨作用
二、脱羧基作用
体内部分L-AA可在脱羧酶作用下,脱羧生成相应的 一级胺。生物体内广泛存在脱羧酶,其辅酶为磷酸吡 哆醛,但是His脱羧酶无需要辅基(生成组胺)。脱 羧酶的专一性很高,一般一种AA对应一种脱羧酶。
直接脱羧基作用:
氧化脱羧基作用:
*多巴进一步氧化可生成聚合物黑素。人体皮肤的表皮基 底层及毛囊中存在黑素细胞,能将酪氨酸转变为黑素 ,使皮肤和毛发呈现黑色。 *帕金森病人因中枢神经递质多巴胺的减少表现出颤抖等 症状。
Choline
第九章 蛋白质的降解与 氨基酸代谢
第三节 氨和氨基酸的生物合成
ቤተ መጻሕፍቲ ባይዱ
一、氮素循环
二、生物固氮
指大气中的分子氮 分子氮在某些微生物体内固氮酶的作用下 分子氮 还原为NH3,然后再被植物吸收,用于合成氨基酸及 其它含氮化合物的过程。 生物固氮反应在常温常压下进行,是氮素循环的重要 环节,为氨的主要来源,每年自然界生物固氮总量达 到2亿吨,远远超过工业固氮(Fe作催化剂,450℃, 20~30MPa)。
谷氨酸脱氢酶(GDH):普遍存在于动植物和微生物 谷氨酸脱氢酶 体内,无需氧气,活性和专一性都很强,且只对L-谷氨 酸起催化作用。
* 此酶是一个结构很复杂的别构酶。ATP、GTP、NADH 可抑制其活性;ADP、GDP及某些AA可激活其活性。 因此当ATP、GTP不足时,Glu的氧化脱氨会加速进行 ,有利于AA分解供能。
固氮反应
①固氮:N2 + 6H+ + 6e- → 2NH3 ②放氢:2H3O+ + 2e - → H2 + 2H2O
固氮条件 充足的ATP;②强还原剂(还原态铁氧蛋白);③厌 );③ ①充足的 ; 强还原剂(还原态铁氧蛋白); 氧环境。 氧环境。
蛋白质和氨基酸测定方法

第十章 蛋白质和氨基酸的测定第一节 概述蛋白质是生命的物质基础,是构成生物体细胞组织的重要成分,是生物体发育及修补组织的原料。
一切有生命的活体都含有不同类型的蛋白质。
人体内的酸、碱及水分平衡,遗传信息的传递,物质代谢及转运都与蛋白质有关。
人及动物只能从食物中得到蛋白质及其分解产物,来构成自身的蛋白质,故蛋白质是人体重要的营养物质,也是食品中重要的营养成分。
蛋白质在食品中含量的变化范围很宽。
动物来源和豆类食品是优良的蛋白质资源。
部分种类食品的蛋白质含量见表10-1表10-1 部分食品的蛋白质含量蛋白质是复杂的含氮有机化合物,摩尔质量大,大部分高达数万~数百万,分子的长轴则长达1nm ~100nm ,它们由20种氨基酸通过酰胺键以一定的方式结合起来,并具有一定的空间结构,所含的主要化学元素为C 、H 、O 、N ,在某些蛋白质中还含有微量的P 、Cu 、Fe 、I 等元素,但含氮则是蛋白质区别于其它有机化合物的主要标志。
不同的蛋白质其氨基酸构成比例及方式不同,故各种不同的蛋白质其含氮量也不同。
一般蛋白质含氮量为16%,即1份氮相当于6.25份蛋白质,此数值(6.25)称为蛋白质系食 品 种 类 蛋白质的质量分数(以湿基计)/% 食 品 种 类 蛋白质的质量分数(以湿基计)/%谷类和面食大米(糙米、长粒、生) 7.9大米(白米、长粒、生、强化) 7.1小麦粉(整粒) 13.7玉米粉(整粒、黄色) 6.9意大利面条(干、强化) 12.8玉米淀粉 0.3乳制品牛乳(全脂、液体) 3.3牛乳(脱脂、干) 36.2切达干酪 24.9酸奶(普通的、低脂) 5.3水果和蔬菜苹果(生、带皮) 0.2芦笋(生) 2.3草莓(生) 0.6莴苣(冰、生) 1.0土豆(整粒、肉和皮) 2.1 豆类 大豆(成熟的种子、生) 36.5 豆(腰子状、所有品种、 23.6 成熟的种子、生) 豆腐(生、坚硬) 15.6 豆腐(生、普通) 8.1 肉、家禽、鱼 牛肉(颈肉、烤前腿) 18.5 牛肉(腌制、干牛肉) 29.1 鸡(可供煎炸的鸡胸肉、 23.1 生) 火腿(切片、普通的) 17.6 鸡蛋(生、全蛋) 12.5 鱼(太平洋鳕鱼、生) 17.9 鱼(金枪鱼、白色、罐 26.5 装、油浸、滴干的固体)数。
蛋白质与氨基酸的测定

蛋白质与氨基酸的测定
蛋白质测定可以采用以下方法:
1. 比色法:常用的比色剂有布鲁姆甘蓝G、伯胺蓝、硫酸铜-法明斯试剂等。
比色法的原理是蛋白质与比色剂形成复合物,复合物的颜色与蛋白质的含量成正比。
2. 生物学方法:通过测定蛋白质在生物体中所起的生物学作用,如酶活性、免疫反应等来定量测定蛋白质的含量。
3. 尿素-二元酸法:通过加入细胞膜清洗液中的尿素和二元酸,并利用这两种化合物对蛋白质的溶解性,然后根据其溶解度定量测定蛋白质的含量。
氨基酸的测定可以采用以下方法:
1. 比色法:在酸性条件下,氨基酸与2,4-二硝基苯肼、2,4-二硝基苯胺等发生磺酰化反应,形成淡棕色的产物,比色法根据产物的吸光度来定量测定氨基酸的含量。
2. 二级结构破坏法:通过加热和高浓度酸的处理,使蛋白质的二级结构破坏,进而测定其中的氨基酸含量。
3. 比重法:在油水分离流程中,用比重法分离出有机相,然后加入酸性溶液,
氨基酸与酸反应,形成有颜色的产物,根据产物的吸光度来定量测定氨基酸的含量。
食品分析《蛋白质及氨基酸含量的测定》(第9章)

同样条件下也有呈色反应,在一定条件下,其颜色深浅与蛋
白质含量成正比,可用分光光度计来测其吸光度,确定含量。 (560nm)
方法特点及应用范围 本法灵敏度较低,但操作简单快速,故在生物化学领域中测 定蛋白质含量时常用此法。本法亦适用于豆类、油料、米谷 等作物种子及肉类等样品测定。
紫外吸收法测定蛋白质含量
双指示剂: ① 40%中性甲醛溶液:以百里酚酞作指示剂,用氢氧化钠将40% 甲醛中和至蓝色。
② 0.1%百里酚酞乙醇溶液,
③ 0.1%中性红50%乙醇溶液, ④ 0.1 mol/L 氢氧化钠标准溶液。 操作:同时取两份样, ① + 中性红指示剂,用氢氧化钠直接滴,中和样液中其它酸性
物质。
② + 百里酚酞+ 中性甲醛+ NaOH滴,中和了样液中氨基酸的羧 基与其它酸性物质的总和。二者之差可计算氨基酸含量。
Rf = a / b
溶剂前沿 b 样点 a
点样原点
优点:
① 展开时间短,一般在20—30分钟,展开距离通常只需10 cm,且分离效果好。 ② 层析后得到的斑点小而清晰。 ③ 能够使用多种显色剂。 ④ 点样量少,灵敏度高。(比纸层析高10—100倍) 精确 到0.01ug。 ⑤ 也可用于大量分离>500 mg,作为样品制备层析。
存于溶液中,过滤后,用凯氏定氮法分别测定沉淀和滤液中 的氮含量。
蛋白质氮和非蛋白质氮的测定
(2)用Cu(OH)2作沉淀剂: 原理:样品经粉碎后加水磨至均匀后,转入离心管中,以 Cu(OH)2沉淀蛋白质,离心分离,并用蒸馏水洗涤。用凯氏 定氮法分别测定溶液中的非蛋白氮和沉淀中的蛋白质氮。
氨基酸的一般定量测定 1、甲醛滴定法 原理:氨基酸本身有碱性 —NH2— 基,又有 酸性 —COOH 基,成中性内盐,加入甲醛 溶 液后,与 —NH2— 结合,碱性消失,再用强碱来滴定 — COOH 基。 特点:适用于发酵工业,如发酵液中含氮量,其发酵过程中 氮量减少情况等。(适于食品中游离氨基酸的测定)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二)微量凯氏定氮法
1、原理及适用范围同前 2、与常量法不同点: 加入硼酸量有50 ml → 10 ml 滴定用盐酸浓度由0.1 mol/L → 0.01mol/L 可用微量滴定管。 3、蒸馏装置
微量凯氏定氮法装置 (三)自动凯氏定氮法
1、原理及适用范围同前 2、特点
(1)消化装置用优质玻璃制成的凯氏消化瓶,红外 线加热的消化炉。 (2)快速:一次可同时消化8个样品,30分钟可消 化完毕。 (3)自动:自动加碱蒸馏,自动吸收和滴定,自动 数字显示装置。可计算总氮百分含量并记录,12 分钟完成1个样。
苏氨酸* 半胱氨酸
HO
NH2 CH2 CHCOOH
酪氨酸 天门冬酰胺
色氨酸* 丝氨酸
tryptophan
NH2 NH2 COCH 2 CHCOOH
NH2 H2NCOCH 2CH2 CHCOOH
H
NH2 HO CH2 CHCOOH
serine
谷酰胺
glutamine
1
2016-12-13
-aa structure
<5> 用过量的 H2SO4 或 HCl 标准溶液吸收, 再用 NaOH 标准溶液滴定过剩的酸液,用 甲基红指示剂。
结果计算
蛋白质含量= C×(V1-V2)×M m×1000
注意: F——氮换算为蛋白质的系数,一般食物为 6.25 ;纯乳 与纯乳制品为6.38;面粉为5.70;玉米、高粱为6.24;花生 为5.46;大米为5.95;大豆及其粗加工制品为5.71;大豆蛋 白制品为6.25;肉与肉制品为6.25;大麦、小米、燕麦、裸 麦为5.83;芝麻、向日葵为5.30;复合配方食品为6.25。
全自动凯氏定氮仪(吸收、蒸馏、滴定)
6
2016-12-13
二、分光光度法
原理:食品中的蛋白质在催化加热条件下被分解, 分解产生的氨与硫酸结合生成硫酸铵,在pH 4.8 的乙酸钠-乙酸缓冲溶液中与乙酰丙酮和甲醛反应 生成黄色的3,5-二乙酰-2,6-二甲基-1,4-二氢化吡 啶化合物。在波长400 nm 下测定吸光度值,与 标准系列比较定量,结果乘以换算系数,即为蛋 白质含量。
9.2
蛋白质的测定
显色反应
定性分析
氨基黑法 溴酚蓝法 考马斯亮蓝法 酸性品红法 氨基萘酚磺酸法 过碘酸-Schiff 氏试剂显色法 甲苯胺蓝法 阿尔新蓝法 适用脂蛋白 苏丹黑法 油红-O法
适用糖蛋白
3
2016-12-13
蛋白质的定量测定
一些蛋白质的含氮量一般为 15%~ 17.6%
NH2 HOOC CH2 CHCOOH
Cn name 天门冬氨酸
acidic
En name Aspartic acid Glutamic acid lysine arginine histidine
物理特性
NH2 HOOC CH2CH2 CHCOOH
谷氨酸
所有纯净的 -AA 是无色晶体 , 有很高的熔点 (200~300 ℃) 有旋光度,除了甘氨酸 不溶于石油和苯等,但溶于水
④ 样品中若含脂肪或糖较多时,消化过程中易产生 大量泡沫,为防止泡沫溢出瓶外,在开始消化时 应用小火加热,并不停地摇动;或者加入少量辛 醇或液体石蜡或硅油消泡剂,并同时注意控制热 源强度。 ⑤ 当样品消化液不易澄清透明时,可将凯氏烧瓶冷 却,加入30%过氧化氢 2~3 m1 后再继续加热消 化。
⑥ 若取样量较大,如干试样超过5 g, 可按每克 试样5 m1的比例增加硫酸用量。 ⑦ —般消化至呈透明后,继续消化30分钟即可, 但对于含有特别难以氨化的氮化合物的品。如 含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸 等时,需适当延长消化时间。有机物如分解完 全,消化液呈蓝色或浅绿色,但含铁量多时, 呈较深绿色。 ⑧ 蒸馏装置不能漏气。
说明及注意事项
①所用试剂溶液应用无氨蒸馏水配制。 ×F×100(g/100g) ②消化时不要用强火,应保持和缓沸腾,以免粘附 在凯氏瓶内壁上的含氮化合物在无硫酸存在的情 况下消化不完全而造成氮损失。 ③消化过程中应注意不时转动凯氏烧瓶,以便利用 冷凝酸液将附在瓶壁上的固体残渣洗下,并促进 其消化完全。
H OH
RCHC O2N+H3
H OH
+
R + NH3 CH COOH
阴离子,在高 pH时
在等电点时是偶极离子
阳离子,在低 pH时
注意: 氨基酸和蛋白质都有酸性和碱性特性,它们都是在低pH 值时带正电荷,在高pH值时带负电荷
氨基酸的等电点(pI)
阳极 + + + + + + + + + 阴极
2. 蛋白质概况
5
2016-12-13
⑨ 蒸馏前若加碱量不足,消化液呈蓝色不生成氢 氧化铜沉淀,此时需再增加氢氧化钠用量。 氢氧化铜在70~90℃时发黑。 ⑩硼酸吸收液的温度不应超过40℃,否则对氨的 吸收作用减弱而造成损失,此时可置于冷水浴中 使用。 ⑾蒸馏完毕后,应先将冷凝管下端提离液面清洗 管口,再蒸1分钟后关掉热源,否则可能造成吸 收液倒吸。
-aa structure
Cn name
En name threonine cystine tyrosine asparagine
NH2 CH3SCH2CH2 CHCOOH CH2 NH CH2 CH2 CHCOOH NH2 CH2 CHCOOH
NH2 CH2 CHCOOH
N
HO NH2 CH3CH CHCOOH NH2 HS CH2 CHCOOH
NH2 CH2COOH NH2 CH3 CHCOOH
CH3 NH2 CH3 CH CHCOOH
CH3 NH2 CH3 CH CH2 CHCOOH
CH3 NH2 CH3 CH2 CH CHCOOH
-aa structure
Cn name 蛋氨酸* 脯氨酸 苯丙氨酸*
En name methionine proline phenylalanine
2
2016-12-13
蛋白质中N的转换因子
食品 蛋或肉 乳制品 小麦 其他谷物及油料种子 杏仁 坚果 其他种子和椰子 转换因子 6.25 6.38 5.70 6.25 5.18 5.46 5.30
蛋白质的主要特性
1. 作为氨基酸的聚合物,蛋白质有酸性和碱性两种性 质, 两性离子 & 等电点& 电泳 2. 大多数蛋白质是水溶性的,不能透过透析膜 3. 变性:加热,酸,碱,盐和洗涤剂都会使蛋白质的 溶解性和功能特性改变 可逆的/ 不可逆的变性 4.在280nm的紫外吸收,因存在三种带有芳香基团的氨 基酸残基:酪氨酸,色氨酸,苯丙氨酸
NH2 H2NCH2CH2CH2CH2 CHCOOH
NH2 NH H2N C NH CH2CH2CH2 CHCOOH
赖氨酸* 精氨酸 组氨酸
=
N N H
NH2 CH2 CHCOOH
basic
8
化学特性
氨基酸是两性电解质
RCHC O2H
NaOH
有两性 -COOH, -NH2
NH2
+
HCL
R NH2 CH COO
2. 中和&蒸馏:加碱蒸馏,使氨蒸出
2NaOH +(NH4)2SO4
→ 2NH3↑+Na2SO4 + 2H2O
2016-12-13 22
凯氏定氮法的装置
<1>加硫酸钾 作为增温剂,提高溶液沸点,纯 硫酸沸点 340℃,加入硫酸钾之后可以提高至 400℃以上。也可加入硫酸钠,氯化钾等提高 沸点,但效果不如硫酸钾。 <2> 加硫酸铜 作为催化剂。还可以作消化终 点指示剂,以及蒸馏时碱性指示剂。还可以加 氧化汞、汞(均有毒,价格贵)、硒粉、二氧 化钛。 <3> 加氧化剂 物氧化速度。 如双氧水、次氯酸钾等加速有机
→ (NH4)2B4O7 + 5H2O
4.用强酸滴定 : 盐酸溶液 (NH4)2B4O7 + 5H2O + 2HCl → 2NH4Cl + 4H3BO3 5. 计算 :(N: HCl = 1:1)
2NH2(CH2)2COOH + 13H2SO4
加热
(NH4)2SO4 + 6CO2 +
12SO2 + 16H2O一定要用浓硫酸(98%)
2016-12-13
主要内容 第9章 蛋白质和氨基酸的测定
1. 概述
蛋白质和氨基酸概况 定性测定 定量测定 定性测定 定量测定
2. 蛋白质的测定
3. 氨基酸的测定
9.1 概述
1.氨基酸概况
氨基酸(AA) : 氨化了的羧酸(R-COOH)
蛋白质中常见的20种 -AA
-aa structu亮氨酸* En name glycine alanine valine leucine isoleucine
3.方法的优势与劣势
四、双缩脲法
1.原理:脲(尿素)NH2—CO—NH2 加热至
150~160℃时,两分子缩和成双缩脲。 NH2—CO—NH2 + NH2—CO—NH2 NH2—CO—NH—CO—NH2 + NH3
双缩脲能和硫酸铜的碱性溶液生成紫色络和物,这种反应叫双 缩脲反应。(缩二脲反应) 蛋白质分子中含有肽键 —CO—NH— 与双缩脲结构相似。在 同样条件下也有呈色反应,在一定条件下,其颜色深浅与蛋白 质含量成正比,可用分光光度计来测其吸光度,确定含量。 (540nm) 注:测蛋白质时叫双缩脲法,并不另加双缩脲。样品不用消化。
测定食品中的蛋白质的含量,对于评价食品的营养价 值,合理开发利用食品资源、提高产品质量、优化食品配 方、指导经济核算及生产过程控制均具有极其重要的意义。
