工程热力学基本概念
工程热力学知识点总结

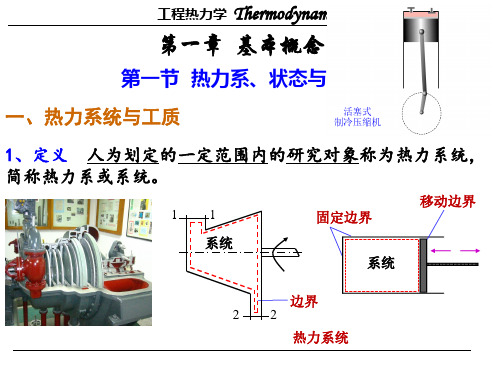
工程热力学大总结'…第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
)开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
}均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
:热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
工程热力学基本概念及重要公式

工程热力学基本概念及重要公式1.热力学系统和热力学过程:热力学系统是指一定空间区域内被观察的物质或物体,它可以是一个封闭系统、开放系统或隔离系统。
热力学过程是指系统经历的状态变化过程,可以分为等温过程、绝热过程、等容过程和等焓过程等。
2.热力学第一定律:热力学第一定律是能量守恒定律在热力学中的表述,即能量守恒原则。
它可以表示为:ΔU=Q-W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外做功。
该定律说明了系统内能的变化等于系统吸收的热量减去系统对外做的功。
3.热力学第二定律:热力学第二定律是热力学中的基本定律之一,也被称为熵增定律。
它可以表述为系统总熵永不减小,即所有自然界的过程和现象都遵循熵增的趋势。
根据熵的定义,dS≥Q/T,其中dS表示系统熵的增量,Q表示吸收的热量,T表示温度。
这个公式说明了系统的熵增量等于吸收的热量除以温度。
4.等温过程和绝热过程:在等温过程中,系统与外界保持温度不变,即温度恒定。
根据理想气体状态方程,PV=常数,即在等温过程中,气体的压强与体积呈反比关系。
在绝热过程中,系统与外界在热量交换上完全隔绝,即吸收或放出的热量为零。
根据理想气体状态方程,PV^γ=常数,其中γ为绝热指数,指的是在绝热过程中,气体压强与体积的幂指数之积的常数。
5.卡诺循环:卡诺循环是热力学中一种完美的热机循环,它由两个等温过程和两个绝热过程组成。
卡诺循环是理想的热机循环,它在可逆过程中实现了最大的功效率。
卡诺循环的功效率可表示为η=(T1-T2)/T1,其中T1表示高温热源的温度,T2表示低温热源的温度。
6.热力学第三定律:热力学第三定律是热力学中的基本定律之一,它表明在温度等于绝对零度时,所有系统的熵都将趋于零。
这个定律的提出为研究低温物理学和凝聚态物理学提供了重要的基础。
这些是工程热力学中的一些基本概念和重要公式。
工程热力学作为能源工程和热力工程等领域的基础学科,对于能量转换和热力设备的设计与运行具有重要作用。
工程热力学基本概念

工质:实现热能和机械能之间转换的媒介物质。
系统:热设备中分离出来作为热力学研究对象的物体。
状态参数:描述系统宏观特性的物理量。
热力学平衡态:在无外界影响的条件下,如果系统的状态不随时间发生变化,则系统所处的状态称为热力学平衡态。
压力:系统表面单位面积上的垂直作用力.温度:反映物体冷热程度的物理量。
温标:温度的数值表示法。
状态公理:对于一定组元的闭口系统,当其处于平衡状态时,可以用与该系统有关的准静态功形式的数量n加上一个象征传热方式的独立状态参数,即(n+1)个独立状态参数来确定.热力过程:系统从初始平衡态到终了平衡态所经历的全部状态。
准静态过程:如过程进行的足够缓慢,则封闭系统经历的每一中间状态足够接近平衡态,这样的过程称为准静态过程。
可逆过程:系统经历一个过程后如果系统和外界都能恢复到各自的初态,这样的过程称为可逆过程。
无任何不可逆因素的准静态过程是可逆过程.循环:工质从初态出发,经过一系列过程有回到初态,这种闭合的过程称为循环.可逆循环:全由可逆过程粘组成的循环。
不可逆循环:含有不可逆过程的循环.第二章热力学能:物质分子运动具有的平均动能和分子间相互作用而具有的分子势能称为物质的热力学能.体积功:工质体积改变所做的功。
热量:除功以外,通过系统边界和外界之间传递的能量。
焓:引进或排出工质输入或输出系统的总能量。
技术功:工程技术上将可以直接利用的动能差、位能差和轴功三项之和称为技术功。
功:物质间通过宏观运动发生相互作用传递的能量。
轴功:外界通过旋转轴对流动工质所做的功。
流动功:外界对流入系统工质所做的功。
热力学第二定律:克劳修斯说法:不可能使热量从低温物体传到高温物体而不引起其他变化.开尔文说法:不可能从单一热源吸热使之完全转化为有用功而不引起其他变化.卡诺循环:两热源间的可逆循环,由定温吸热、绝热膨胀、定温放热、绝热压缩四个可逆过程组成。
卡诺定理:在温度为T1的高温热源和温度为T2的低温热源之间工作的一切可逆热机,其热效率相等,与工质的性质无关;在温度为T1的高温热源和温度为T2的低温热源之间工作的热机循环,以卡诺循环的热效率为最高.熵:沿可逆过程的克劳修斯积分,与路径无关,由初、终状态决定。
工程热力学知识点总结

工程热力学知识点总结工程热力学知识点总结1. 热力学基本概念热力学是研究能量转化和能量传递规律的学科,它关注系统的宏观性质和变化。
热力学的基本概念包括系统、界面、过程、平衡状态、状态方程等。
2. 热力学第一定律热力学第一定律是能量守恒的表述,它表示能量的增量等于传热和做功的总和。
数学表达式为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示热的传递,W表示外界对系统做功。
3. 热力学第二定律热力学第二定律描述了自然界中存在的一种过程的不可逆性,即熵增原理。
它指出孤立系统的熵总是增加或保持不变,不会减少。
熵增原理对热能转化和能量传递的方向提供了限制。
4. 热力学循环热力学循环是一系列热力学过程组成的闭合路径,通过这个路径,系统经历一系列状态变化,最终回到初始状态。
常见的热力学循环有卡诺循环、斯特林循环等。
5. 热力学性质热力学性质是用来描述物质宏观状态的物理量,常用的热力学性质包括温度、压力、内能、焓、熵等。
它们与热力学过程和相变有着密切的关系。
6. 热力学方程热力学方程是用来描述物质宏观状态的数学关系。
常见的热力学方程有状态方程(如理想气体状态方程)、焓的变化方程、熵的变化方程等。
这些方程对于分析和计算热力学过程非常重要。
7. 理想气体理想气体是热力学中一种理想的气体模型。
在理想气体状态方程中,气体的压力、体积和温度之间满足理想气体方程。
理想气体模型对于理解和研究气体性质和行为非常有用。
8. 发动机热力学循环发动机热力学循环是指内燃机和外燃机中进行热能转换的一系列过程。
常见的发动机热力学循环有奥托循环、迪塞尔循环等。
通过研究发动机热力学循环,可以优化发动机的效率和性能。
9. 相变热力学相变热力学研究物质由一种相态转变为另一种相态的过程。
相变热力学包括液体-气体相变、固体-液体相变、固体-气体相变等。
了解相变热力学对于理解物质的性质和行为具有重要意义。
总结:工程热力学是研究能量转化和能量传递规律的学科,它关注系统的宏观性质和变化。
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
工程热力学基本概念

= 收获/代价
炉
热效率: t
w net q1
顺 时 针
汽轮机
发电机 凝 汽 器
逆向循环 又称制冷循环或热泵循环
高温热源
或 制 Q1
逆 时
热冷 泵机
W
针
Q2
低温热源
制冷循环的经济性用制冷系数衡量:
2
1
1,a,2
1,b,2
b
2
状态参数的变化只与初终态相关,
1 dxx2 x1 与路径无关。
状态参数都有以上特性。
状态参数的循环 dx 0 积分等于零。
反之,有以上特性之一, 即为状态参数。
1-3 平衡状态、状态方程式、坐标图
一、平衡状态
热力系在没有外界作用的情况下〔重力场除 外〕,宏观性质不随时间变化的状态。
热力过程:工质由一个状态变化到另一状态所经历 的全部状态的总和。
实际过程由一系列非 平衡状态组成
例:
非平衡状态
无法简单描述
平衡状态
宏观静止
能量不能转换
“平衡〞意味着宏观静止, 引入 理想模型:
“过程〞意味着变化,意味着
准平衡过程
平衡被破坏。二者如何统一?
一、准平衡过程 热力系从一个平衡态连续经历一系列
系统与外界 通过边界进 展相互作用
热力系的选取主要决定于研究任务 。
选取热力系时注意:
❖热力系可以很大,但不能大到无限。
❖热力系可以很小,但不能小到只包含少量分子, 以致不能遵守统计平均规律。
❖ 边界可以是实际存在的, 也可以是假想的。
❖ 边界可以是固定的, 也可以是变动的。
系统与外界通过边界进展相互作用。
平衡的中间态过渡到另一个平衡态
工程热力学基本概念及重要公式

工程热力学基本概念及重要公式1.系统与环境在工程热力学中,系统是指研究的对象或我们感兴趣的部分。
环境则是系统以外的其他部分。
系统和环境之间可以通过物质和能量的交换进行相互作用。
2.状态与平衡系统的状态由一组可测量的性质(如温度、压强、体积等)确定。
当系统中各种性质不发生任何变化时,系统处于平衡状态。
在平衡状态下,系统的能量转化不会引起热量或功的流动。
3.热力学函数热力学函数是描述热力学性质的函数,包括熵、焓和自由能等。
它们与系统的状态相对应,可以通过测量一些物理量来计算。
4.热力学第一定律热力学第一定律是能量守恒定律在系统中的应用。
根据这一定律,系统的内能增加等于系统吸收的热量加上对外做的功。
ΔU=Q-W其中,ΔU表示系统内能的变化,Q表示系统从环境吸收的热量,W 表示系统对外做的功。
5.热力学第二定律热力学第二定律主要研究热量的传递和能量转化中的不可逆性。
根据热力学第二定律,热量只能从高温区传递到低温区,不会自发地从低温区传递到高温区。
6.热力学第二定律的两种表述热力学第二定律有两种表述方式:卡诺定理和熵增定理。
卡诺定理:任何工作在热源和冷源之间的热机,其效率都不会超过卡诺效率,即:η=1-Tc/Th其中,η表示热机的效率,Tc表示冷源的温度,Th表示热源的温度。
熵增定理:封闭系统的熵不会减少,只能增加或保持不变。
在一个孤立系统中,熵增是不可逆过程的一个特征。
7.热力学循环热力学循环是指一系列热力学过程的组合,最终系统回到起始状态。
常见的热力学循环包括卡诺循环、斯特林循环和布雷顿循环等。
8.其他重要公式除了上述公式外,工程热力学还有一些重要的公式,如:热量传递公式:Q=m*c*ΔT其中,Q表示热量,m表示物体的质量,c表示物体的比热容,ΔT表示温度的变化。
功的公式:W = F * d * cosθ其中,W表示功,F表示力,d表示位移,θ表示力的方向与位移方向的夹角。
气体状态方程:PV=nRT其中,P表示压强,V表示体积,n表示物质的摩尔数,R为气体常数,T表示温度。
工程热力学知识点总结

工程热力学知识点总结一、基本概念1. 热力学系统热力学系统是指研究对象的范围,可以是一个物体、一个系统或者多个系统的组合。
根据系统与外界的物质交换和能量交换情况,将系统分为封闭系统、开放系统和孤立系统。
2. 热力学状态热力学状态是指系统的一种特定状态,由系统的几个宏观性质确定。
常用的状态参数有温度、压力、体积和能量等。
3. 热力学过程热力学过程是系统在一定条件下的状态变化。
常见的热力学过程有等温过程、绝热过程、等压过程和等容过程等。
4. 热力学平衡系统的平衡是指系统内各部分之间不存在宏观的能量或物质的不均匀性。
在平衡状态下,系统内各部分之间的宏观性质是不发生变化的。
5. 热力学势函数热力学势函数是描述系统平衡状态的函数,常见的有内能、焓、自由能和吉布斯自由能等。
二、热力学定律1. 热力学第一定律热力学第一定律是能量守恒定律的热力学表述。
它可以表述为:系统的内能变化等于系统对外界所做的功与系统吸收的热的代数之和。
2. 热力学第二定律热力学第二定律是热力学中一个非常重要的定律,它对能量转化的方向和效率进行了限制。
根据热力学第二定律,系统内部永远不会自发地将热量从低温物体传递到高温物体,这就是热机不能做功的原因。
3. 卡诺定理卡诺定理是热力学第二定律的一种推论,它指出在两个恒温热源之间进行热机循环时,效率最高的情况是卡诺循环。
4. 热力学第三定律热力学第三定律规定了在温度接近绝对零度时热容为零,即系统的熵在绝对零度时为常数。
三、热力学循环1. 卡诺循环卡诺循环是一种理想的热机循环,它采用绝热和等温两个可逆过程。
卡诺循环的效率是所有热机循环中最高的。
2. 斯特林循环斯特林循环是一种理想的外燃循环,它采用绝热和等温两个可逆过程。
斯特林循环比卡诺循环的效率低一些,但是实际上,在制冷机中应用得比较广泛。
3. 布雷顿循环布雷顿循环是一种理想的内燃循环,它采用等容和等压两个可逆过程。
布雷顿循环是内燃机的工作循环,应用比较广泛。
工程热力学第一章基本概念

受重力影响,大部分热力系统内部存在压力变化,但该变化相对很小,通常忽略不计。 The variation of pressure as a result of gravity in most thermodynamic system is relatively small and usually disregarded
热力学温标(Kelvin scale):纯水三相点温度为273.16K,每1K为水三相点温度的1/273.16。
朗肯温标(Rankine scale):以绝对零度为起点的华氏温标
温标之间的换算
基本状态参数——压力(Pressure)
微观概念:大量分子碰撞器壁的结果。
单位面积上的压力
分子浓度
平均平动动能
在没有外来影响的情况下,两物体相互作用最终达到相同的冷热状况。
热力学第零定律 1931年 T
热力学第一定律 18401850年 E
热力学第二定律 18541855年 S
热力学第三定律 1906年 S基准
闭口系统的质量保持恒定
开口系统(Open system):有物质流穿过边界的系统,又称为控制体积或控制体(Control volume)。
开口系统的界面称为控制界面。
开口系统和闭口系统都可能与外界发生能量(功和热)传递。
闭口系统与开口系统
绝热系统(Adiabatic system):系统与外界之间没有热量传递的系统。
化学平衡( Chemical equilibrium ) 系统中化学成分不随时间变化 if its chemical position does not change with time. That is, no chemical reactions occur. 化学反应——化学不平衡势
工程热力学 基本知识点

第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
(完整版)工程热力学知识总结

第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
工程热力学知识点总结

工程热力学知识点总结工程热力学是一门研究能量转换规律以及热能有效利用的学科,它在能源、动力、化工等领域有着广泛的应用。
以下是对工程热力学一些重要知识点的总结。
一、基本概念1、热力系统热力系统是指人为选取的一定范围内的物质作为研究对象。
根据系统与外界的物质和能量交换情况,可分为闭口系统(与外界无物质交换)、开口系统(与外界有物质交换)和绝热系统(与外界无热量交换)等。
2、状态参数描述热力系统状态的物理量称为状态参数,如压力、温度、比体积等。
状态参数的特点是只取决于系统的状态,而与达到该状态的路径无关。
3、热力过程热力系统从一个状态变化到另一个状态所经历的途径称为热力过程。
常见的热力过程有定容过程、定压过程、定温过程和绝热过程等。
4、热力循环系统经历一系列热力过程后又回到初始状态,所形成的封闭过程称为热力循环。
二、热力学第一定律热力学第一定律是能量守恒与转换定律在热力学中的应用,其表达式为:输入系统的能量输出系统的能量=系统储存能量的变化。
对于闭口系统,热力学第一定律可表示为:$Q =\Delta U + W$,其中$Q$ 为系统吸收的热量,$\Delta U$ 为系统内能的变化,$W$ 为系统对外所做的功。
对于开口系统,热力学第一定律的表达式较为复杂,需要考虑进、出口的能量流动。
三、热力学第二定律热力学第二定律指出了热过程的方向性和不可逆性。
常见的表述有克劳修斯表述和开尔文表述。
克劳修斯表述:热量不可能自发地从低温物体传向高温物体。
开尔文表述:不可能从单一热源取热使之完全变为有用功而不产生其他影响。
热力学第二定律的实质是揭示了自然界中一切自发过程都是不可逆的。
四、理想气体的性质理想气体是一种假设的气体模型,其分子之间没有相互作用力,分子本身不占有体积。
理想气体的状态方程为$pV = nRT$,其中$p$ 为压力,$V$ 为体积,$n$ 为物质的量,$R$ 为气体常数,$T$ 为温度。
理想气体的内能和焓仅与温度有关,与压力和体积无关。
工程热力学-1-基本概念

p f (T , v ) T f ( p , v ) v f ( p , T )
pv R g T
30
状态参数坐标图
简单可压缩系N=2,是平面坐标图。
p
1
1)系统任何平衡态可表 示在坐标图上。 2)过程线中任意一点为 平衡态。
2
v
3)非平衡态无法在图上 用实线表示。
31
第1章 基本概念
33
一般过程
p1 = p0 T1 = T0
突然加上重物 p2 = p0+重物 最终 T2 = T0
p0,T0
p
2.
p1,T1 p2,T2
.
1
v
34
准平衡过程
p1 = p0 T1 = T0
假如重物有无限多层 每次只加上无限薄一层 系统随时接近于平衡态
p0,T0
p
2.
p1,T1
.
1
v
35
准平衡过程有实际意义吗?
0
5 t[ C ] (t[ F ] 32) 9
0
18
基本状态参数:压力
单位面积上承受的垂直作用力 物理中压强,单位Pa,N/m2 常用单位:
1 1 1 1 1 1 1 kPa = 103 Pa(千帕) MPa = 106 Pa (兆帕) bar = 105 Pa (巴) atm = 760 mmHg = 1.01325×105 Pa (标准大气压) mmHg = 133.3 Pa (毫米汞柱) mmH2O = 9.81Pa (毫米水柱) at = 1 kgf/cm2 = 9.81 × 104 Pa (工程大气压)
4
系统、外界和边界
5
划分热力系举例
工程热力学基本概念及定义

物质三态中 气态最适宜。
2
三、热源(heat source; heat reservoir)
定义:工质从中吸取或向之排出热能的物质系统。 • 高温热源—热源 ( heat source ) 低温热源—冷源(heat sink) • 恒温热源(constant heat reservoir) 变温热源
1-1 热能和机械能相互转换的过程
一、热能动力装置(Thermal power plant)
定义:从燃料燃烧中获得热能并利用热能得到动 力的整套设备。
气体动力装置(combustion gas power plant)
内燃机(internal combustion gas engine)
分
燃气轮机装置(gas turbine power plant)
1
m
WQ
4
1 开口系
2
1+2 闭口系
1+2+3 绝热闭口系
1+2+3+4 孤立系
3
非孤立系+相关外界
=孤立系
12
3. 简单可压缩系统(simple compressible system)
—最重要的系统
只交换热量和一种体积变化功的系统
体积变化功
压缩功 膨胀功
注意: 1)闭口系与系统内质量不变的区别; 2)开口系与绝热系的关系; 3)孤立系与绝热系的关系。
3
蒸汽动力装置中热能转变为机械能的过程
1
过热器 6
锅炉
汽轮机
冷
给水泵
凝 器
4
3
发 电 机 2
冷却水
热能动力装置的工作过程:
工质自 高温热源
工程热力学-第一章—基本概念

● 为什么叫做热力学第零定律
热力学第零定律 热力学第一定律 热力学第二定律 热力学第三定律
1931年
T
18401850年 E
18541855年 S
1906年
S基准
● 温度的热力学定义
★由热力学第零定律可以推断:处于同一热平衡 状态的各个热力系,必定有某一宏观特征彼此 相同,用于描述此宏观特征的物理量——温度。
T 0.5 m c2 T=0 0.5 m c2=0 分子一切运动停止,零动能。
● 热力学第零定律
◆ 热平衡:不同物体的冷热程度相同,则它们处于热平衡。 ◆ 热力学第零定律(热力学中的一个基本实验结果):
若两个热力系分别与第三个热力系处于热平衡,那么这 两个热力系也处于热平衡。
温度测量的理论基础 B 相当于温度计
压力的表示方法
◆ 绝对压力(p)、表压力(pg)、 真空度(pv)
◆ 绝对压力p、表压力pg、真空度pv、 大气压力pb的关系 pg =p- pb pv= pb-p
只有绝对压力p才是系统的状态参数。
例1:已知甲醇合成塔上压力表的读数为 150kgf/cm2,这时车间内气压计上的 读数为780mmHg。试求合成塔内绝 对压力等于多少kPa?
●状态参数的微分特性:全微分
状态参数的微分特性
设 z =z (x , y) , dz是全微分 则: dzxzy dxyzxdy
充要条件是: 2 z 2 z xy yx
可判断是否是状态参数。
2.强度参数和广度参数
● 强度参数:与物质的量无关的参数。
如 p、T、v 等
0 冰熔点
32
-17.8 盐水熔点 0
559.67 491.67 459.67
工程热力学知识点总结

工程热力学知识点总结1. 热力学基本概念1.1 热力学系统:研究对象,与周围环境有能量和物质交换。
1.2 环境:系统之外的一切,与系统形成对比。
1.3 边界:系统与环境之间的分界线。
1.4 状态:系统在某一时刻宏观性质的集合。
1.5 平衡态:系统状态不随时间变化的状态。
1.6 过程:系统从一个平衡态到另一个平衡态的演变。
2. 热力学第一定律2.1 能量守恒:系统内能量的变化等于热量与功的和。
2.2 内能:系统内部微观粒子动能和势能的总和。
2.3 热量:系统与环境之间由于温度差而交换的能量。
2.4 功:系统对环境或其他系统施加的力与其位移的乘积。
2.5 热力学第一定律公式:ΔU = Q - W。
3. 热力学第二定律3.1 熵:系统无序度的量度,是不可逆过程的度量。
3.2 孤立系统:不与外界交换能量或物质的系统。
3.3 熵增原理:孤立系统熵永不减少。
3.4 卡诺定理:所有热机的最大效率由卡诺循环确定。
4. 热力学性质4.1 温度:系统热动能的度量,是热力学过程的驱动力。
4.2 压力:分子对容器壁单位面积的平均作用力。
4.3 体积:系统占据的空间大小。
4.4 比热容:单位质量的物质温度升高1K所需吸收的热量。
4.5 热容:系统温度升高1K所需吸收的热量。
5. 理想气体行为5.1 理想气体状态方程:PV = nRT。
5.2 摩尔体积:1摩尔理想气体在标准状态下的体积。
5.3 气体常数:理想气体状态方程中的常数R。
5.4 马略特定律:理想气体在恒定温度下,体积与压力成正比。
5.5 波义耳定律:在恒温条件下,理想气体的压强与其体积成反比。
6. 热力学循环6.1 卡诺循环:理想化的热机循环,由四个可逆过程组成。
6.2 奥托循环:内燃机的理想循环,包括等容加热、绝热膨胀、等容放热和绝热压缩。
6.3 朗肯循环:蒸汽动力循环,包括泵吸、锅炉加热、涡轮膨胀和冷凝器排热。
7. 相变与潜热7.1 相变:物质从一种相态转变为另一种相态的过程。
工程热力学基本概念

工程热力学基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称之热力系统,简称系统。
边界:分隔系统与外界的分界面,称之边界。
外界:边界以外与系统相互作用的物体,称之外界或者环境。
闭口系统:没有物质穿过边界的系统称之闭口系统,也称操纵质量。
开口系统:有物质流穿过边界的系统称之开口系统,又称操纵体积,简称操纵体,其界面称之操纵界面。
绝热系统:系统与外界之间没有热量传递,称之绝热系统。
孤立系统:系统与外界之间不发生任何能量传递与物质交换,称之孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称之单相系。
复相系:由两个相以上构成的系统称之复相系,如固、液、气构成的三相系统。
单元系:由一种化学成分构成的系统称之单元系。
多元系:由两种以上不一致化学成分构成的系统称之多元系。
均匀系:成分与相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分与相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称之工质的热力状态,简称之状态。
平衡状态:系统在不受外界影响的条件下,假如宏观热力性质不随时间而变化,系统内外同时建立了热的与力的平衡,这时系统的状态称之热力平衡状态,简称之平衡状态。
状态参数:描述工质状态特性的各类物理量称之工质的状态参数。
如温度(T)、压力(P)、比容(υ)或者密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或者密度能够直接或者间接地用仪表测量出来,称之基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别与第三个物体处于热平衡,则它们彼此之间也必定处于热平衡。
压力:垂直作用于器壁单位面积上的力,称之压力,也称压强。
相对压力:相关于大气环境所测得的压力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工程热力学基本概念及基本公式1.准静态过程(Quasi-static Process )过程中热力学系统经历的是一系列平衡状态并在每次状态变化时仅无限小地偏离平衡状态。
A quasi-static process is one in which the departure from thermodynamic equilibrium is at most infinitesimal.2.外界(Surroundings ):系统之外的一切其它物质。
边界(Boundary ):系统与外界之间的分界面。
闭口系统(Closed System ) ←→控制质量(Control Mass ):系统与外界之间没有物质交换,但有能量交换。
0;0≠=E m δδ开口系统(Open System )←→控制体积(Control Volume ):系统与外界之间不仅有物质交换,还有能量交换。
0;0≠≠E m δδ 孤立系统(Isolated System ):系统与外界之间既无质量交换又无能量交换。
0;0==E m δδ 3.热力学第一定律(First Law of Thermodynamics ):在系统两个状态之间的所有绝热过程的净功是一样的,也就是说,闭口系统在经历给定两点的绝热过程对环境所作的净功仅与系统初态和终态有关,而与绝热过程的具体路径无关。
It is found by experiment that for all adiabatic processes between two states the value of the net work done by or on the system is the same. That is, the value of the net work done by or on a closed system undergoing an adiabatic process between two given states depends solely on the end states and not on the details of the adiabatic process.dE Q W δδ=-→dE QW dt=- 4.第二定律的陈述(Statements of the Second Law )克劳修斯陈述: ① 热能不可能单独地从低温物体传向高温物体。
(It is impossible for any system to operate in such away that the sole result would be an energy transfer by heat from a cooler to a hotter body.) ② 热能可以单独地从高温物体传向低温物体。
③ 在外界作用下,热能可以从低温物体传向高温物体。
开尔文-普朗克陈述: ① 任何系统不可能从单一热库吸收热能在经历一个热循环之后使之完全转变为功。
(It is impossiblefor any system to operate in a thermodynamic cycle and deliver a net amount of work to its surroundings while receiving energy by heat transfer from a single thermal reservoir.) ② 热力系统可以从一个热库吸热同时向另一个热库放热并在经历一个热循环之后使剩余热能完全转变为功。
③ 外界对热力系统作功并在其经历一个热循环之后使之完全转变为热能。
5.不可逆和可逆过程(Irreversible and Reversible Processes ) 不可逆过程:系统在经历了一个热力过程之后,如果系统及其环境不能精确地回复到各自的初始状态。
A process is called irreversible if the system and all parts of its surroundings cannot be exactly restored to their respective initial states after the process has occurred.不可逆过程主要有:热交换过程;自由膨胀过程;燃烧过程;混合过程;粘性流动过程;非弹性变形过程; 可逆过程:系统在经历了一个热力过程之后,如果系统及其环境能回复到各自的初始状态。
A process is called reversible if the system and all parts of its surroundings can be exactly restored to their respective initial states after the process has occurred.①可逆过程必须是准静态过程,即必须在势差足够小、变化足够慢的条件下进行。
②可逆过程中不存在任何耗散效应,如摩擦、扰动、电阻、永久变形等,这些效应必定导致无法消除的影响。
6.相 (phase ):化学成分和物理结构在空间分布均匀的物质。
The term phase refers to a quantity of matter that is homo- geneous throughout in both chemical composition and physical structure. 7.相变(Phase Change ):干度(Quality ): vapour liquid vapourm x m m =+8.纯物质 (pure substance ):化学成分在空间分布均匀不变的物质化学。
A pure substance is one that is uniform and invariable in chemical composition. 9.状态公理(State Principle ):对于系统能量独立改变的每一种方式,将有一个独立的特性参数与之对应。
There is one independent property for each way a system’s energy can be varied independently. 10.简单系统(Simple System ) :如果一个系统在经历准平衡过程时除热交换形式之外只有一种功形式能改变系统的能量。
简单系统独立的状态参数:1+1=2 11.功、热量:相同点:都是过程量,非状态参数。
⎰⎰==.;q q w w δδ不同点:①功是热力学系统和环境之间通过边界而转移的能量,且其全部效果可表现为举起重物。
(Work is done by a system on its surroundings if the sole effect on everything external to the system could have been the raising of a weight.)热量是由于热交换而通过边界传递的能量,且部分效果可表现为举起重物。
功的能量品质高于热量。
②W > 0 : work done by the systemW < 0 : work done on the system 而Q > 0 : heat transfer to the systemQ < 0 : heat transfer from the system 。
12.P-V 图和T-V 图、饱和蒸汽线、饱和液体线、过热蒸汽、过冷液体、临界点 13.理想气体模型(Ideal Gas Model ):RT T u T h h T u u RT pv +====)()();(;;dTdhT c dT du T c p v ==)(;)( 14. 控制体积:质量守恒(Conservation of Mass ): CVd d ie i em mm t =-∑∑能量守恒(Conservation of Energy ):22CV CV CV d d 22 i e i i i e e e i e E V V Q W m h gz m h gz t ⎛⎫⎛⎫=-+++-++ ⎪ ⎪⎝⎭⎝↓↓↓⎭↓↓∑∑ 热伴随质量输入的能量功量量能量积累 伴随质量输出的能量注意:对于稳定状态(Steady State ):0;0==cv cv dE dm 15.温标:如果一个可逆循环系统从温度为H T 的高温热库吸收的热量为H Q ,向温度为C T 的低温热库放出的热量为C Q ,则有:HC cycle rev H C T TQ Q =)(一个系统工作于两个热库之间,对外输出净功cycle W ,循环热效率 Hc H c y c l e Q QQ W -==1η即cycle W =H Q -C Q 16.熵方程①闭口系统(Closed Systems ):σδ+=-⎰2112T QS S ,当内部可逆时,熵产σ=0,即 微分形式为: 又由: ; ;从而引出TdS 方程(TdS Equation ): 和 单位质量形式:单位摩尔形式: 注意:TdS 方程适合于可逆或不可逆过程的闭口系统,以及开口系统稳态流入流出的流体。
②开口系统(控制体积)(Control Volumes ):在闭口系统的基础上再引入质量的流进流出引起的熵变。
两边除以△t 并取极限可得: 对于多个入口和出口情况 :CV ji i e e j i e j rat rate of entr rates of entropy e ofentropy Q dS opy changeproductio ms m tr s dt T an e nsf rσ=+-+∑∑∑ ④ 理想气体的熵变(Entropy Change of an Ideal Gas ):由intre 21v21Q S S T δ⎛⎫-= ⎪⎝⎭⎰int revQ dS T δ⎛⎫= ⎪⎝⎭()()int intrev rev Q dU W δδ=+()int rev W pdV δ=()dU dH d U pV Vdp pdV=+=++TdS dU pdV =+TdS dH Vdp=-Tds du pdv =+Tds dh vdp =-Tds du pdv =+Tds dh vdp=-()()CVCV j i i e e j jQ S t t S t m s m s T σ+∆-=+-+∑CV ji i e e j jQ dS m s m s dt T σ=+-+∑du p ds dv T T =+dh v ds dp T T=-()v du c T dT =()p dh c T dT =pv RT =()v dT dvds c T R T v⇒=+()p dT dpds c T R T p=-17.状态方程★T R n PV RT Pv mRT PV_=⇔=⇔= MRR _=R 为气体常数,_R 摩尔气体常数,_R =8.314J/mol.K M 为气体摩尔质量。
