第五章 析氢腐蚀和吸氧腐蚀
析氢腐蚀和吸氧腐蚀的电极反应式

析氢腐蚀和吸氧腐蚀的电极反应式
负极都是Fe-2e-=Fe2+
正极:
吸氧腐蚀:2H2O+O2+4e-=4OH-
析氢腐蚀:2H++2e-=H2↑
铁(iron)是一种金属元素,原子序数为26,铁单质化学式:Fe,平均相对原子质量为55.845。
纯铁是白色或者银白色的,有金属光泽。
熔点1538℃、沸点2750℃,能溶于强酸和中强酸,不溶于水。
铁有0价、+2价、+3价、+4价、+5价和+6价,其中+2价和+3价较常见,+4价、+5价和+6价少见。
铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四。
纯铁是柔韧而延展性较好的银白色金属,用于制发电机和电动机的铁芯,铁及其化合物还用于制磁铁、药物、墨水、颜料、磨料等,是工业上所说的“黑色金属”之一。
扩展资料:
铁的物理性质:
外观与形状:纯铁是带有银白色金属光泽的金属晶体,通常情况下呈灰色到灰黑高纯铁丝色无定形细粒或粉末。
有良好的延展性、导电、导热性能。
有很强的铁磁性,属于磁性材料。
密度 : 7.874 g/cm3
比热容:460J/(kg·℃)。
声音在铁中的传播速率:5120m/s。
纯铁质地软,不过如果是铁与其他金属的合金或者是掺有杂质的铁,通常情况下熔点降低,硬度增大。
晶体结构:面心立方和体心立方。
析氢腐蚀和吸氧腐蚀

由于缓慢步骤形成 的阻力,在氢的平 衡电位下将不能发 生析氢腐蚀。因此 氢的析出电位要比 氢电极的平衡电位 更负一些,两者间 差值的绝对值称为 氢过电位。
在一定电流密度下,氢的平 衡电位与析氢电位之差,就 是该电流密度下氢的过电位。
过电位是电流密度的函数。
析氢过程的阴极极化曲线
(氢离子作为唯一的去极 化剂情况下)
a值与材料有关。
根据缓慢放电理论求得的b H值为0.118V(25℃), 这与大多数金属电极上实测的b H值大致相同, 见表5-l。
在酸性溶液中,25℃时,氢在铂、钯电极上析 出的实测数据 b H为0.03V,说明氢析出的控制 步骤不是式(5-6)所示。目前可以认为,极化不 大时,在光滑的铂、钯金属上,氢析出的控制 步骤如式(5-7)所示;极化较大或电极表面被极 化时,控制步骤可能如式(5-8)所示。
第一节 电化学腐蚀中的阴极过程
金属在电解质溶液中发生电化学腐蚀的根本 原因是:
电解质溶液中含有能使该种金属氧化的物质, 即腐蚀过程的去极化剂。
去极化剂的阴极过程与金属氧化的阳极过程 共轭组成腐蚀过程。显然,没有阴极过程,阳 极过程就不会发生,金属也就不会发生电化学 腐蚀。
由阴极极化的本质可知,凡能在阴极上吸收电子的 过程(即阴极还原反应)都可以构成金属电化学腐蚀的 阴极过程。
( 4 )氢分子聚集成氢气泡析出。
在这些步骤中,如果某一步骤进行得缓慢,就会控 制影响着其他步骤的顺利进行,由阳极流过来的电子就 会在阴极上积累,导致阴极电位向负向移动,从而产生 一定的阴极过电位。
在碱性介质中,如果发生析氢反应,电极上还原的 不是氢离子,而是水分子,是电子直接加在水分子上, 然后分解产生氢气和OH-
当前的电化学工业主要是水溶液的电化学,水的电 解过程可能叠加到任何阴极或阳极反应上,所以析氢过 电位的研究也有很大的实用价值。
析氢腐蚀和吸氧腐蚀

(3) 腐蚀电位位于阴极极化曲线的析氢反应 平衡电位以下,在自然腐蚀状态,阴极反 应包括O2还原反应和H+还原反应。如Mg在 中性溶液中的腐蚀。
• 氧扩散控制吸氧腐蚀的特征
在自然腐蚀状态,阴极反应速度,因而 金属腐蚀电流密度等于O2的极限扩散电 流密度id
icor ic Ecor id
特征:
(2) 阳极极化控制
当ia0 << ic0,才会出现阳极极化控制。因为除Pt、 Pd等低氢过电位金属外,在常见的工程金属材料 表面上析氢反应的交换电流密度都不很大,故这 种类型的析氢腐蚀不可能发生在活化极化控制的 腐蚀体系,只有当金属在酸溶液中能部分钝化, 造成阳极反应阻力大大增加,才能形成这种控制 类型。比如铝和不锈钢在稀硫酸中发生析氢腐蚀 就是这种情况。显然,这种类型的析氢腐蚀的阳 极反应不再受活化极化控制。
• 析氢腐蚀的典型例子—Fe在酸中的腐蚀
(1)在pH < 3的酸溶液中,阴极反应受活化极化 控制。
(2)在弱氧化性和非氧化性酸溶液中,在反应速 度不是很大时,阳极反应亦受活化极化控制。
(3)在大多数情况下,Fe在酸溶液中的腐蚀形态 是均匀腐蚀。
所以,Fe在酸溶液中的腐蚀可以当作均相腐蚀电 极处理,作为活化极化控制腐蚀体系的典型例子。
温度:摄氏度 铁在盐酸巾的腐蚀速度与温度的关系
腐蚀影响因素
(2)溶液中的其他组分
(3)温度 温度升高,腐蚀速度迅速增大,因为温度升高时 阳极反应和阴极反应速度都加快了。 金属 方面 (1)金属材料种类和杂质 金属材料种类和所含杂质的影响既涉及阴极反应 又涉及阳极反应这一影响,混合控制腐蚀体系比 阴极极化控制腐蚀体系明显。 (2) 阴极区面积 (3) 金属表面的状态
原电池吸氧腐蚀和析氢腐蚀

原电池吸氧腐蚀和析氢腐蚀
原电池是一种将化学能转化为电能的装置,它由两个不同金属和一个电解质组成。
在使用过程中,原电池可能发生吸氧腐蚀和析氢腐蚀,这会影响其性能和寿命。
吸氧腐蚀是指当原电池处于开路状态时,电解质中的氧气会与金属发生反应,导致金属表面产生氧化物。
这种腐蚀会降低原电池的电势差和电流输出,甚至导致电池失效。
为了避免吸氧腐蚀,可以在电池使用后及时加盐水或其他还原剂。
析氢腐蚀是指当原电池处于闭路状态时,电解质中的水分解产生氢气,并在金属表面析出。
这种腐蚀会导致金属表面出现气孔、气泡和裂纹,甚至引起电池爆炸。
为了避免析氢腐蚀,可以选择合适的金属材料和电解质,以及控制电流密度和电池温度。
总之,吸氧腐蚀和析氢腐蚀是原电池使用过程中需要注意的问题,正确的使用和维护可以延长电池寿命并保证其正常工作。
- 1 -。
原电池吸氧腐蚀和析氢腐蚀

原电池吸氧腐蚀和析氢腐蚀
原电池是一种由两种不同金属通过电解液相联系形成的电化学
系统。
在这种系统中,其中一种金属被氧化,另一种金属被还原,从而产生电能。
然而,当原电池处于开路状态时,金属表面会与电解液中的氧气和水分子发生反应,导致腐蚀现象的发生。
在原电池中,金属表面与氧气反应形成的氧化物称为吸氧腐蚀。
在这种腐蚀中,金属表面会被氧化,并且会形成一层氧化物覆盖在金属表面上。
吸氧腐蚀的程度取决于金属的活性和氧气的浓度。
例如,铁、镁和锌在氧气中容易吸氧腐蚀,而铜和铝则比较耐腐蚀。
与吸氧腐蚀不同的是,原电池中金属表面与水分子反应形成氢气的腐蚀称为析氢腐蚀。
在这种腐蚀中,金属表面与水分子反应形成氢气,并且在金属表面上形成小气泡。
析氢腐蚀的程度取决于金属的活性和水的浓度。
例如,锌和铝在酸性水中容易析氢腐蚀,而铜则比较耐腐蚀。
原电池吸氧腐蚀和析氢腐蚀都会导致金属表面的损失和腐蚀产
物的形成,从而影响到原电池的性能和寿命。
为了减少这种腐蚀,可以采取一些措施。
例如,可以在金属表面涂上一层保护膜,以防止金属表面与电解液发生反应。
此外,可以选择更耐腐蚀的金属材料,以延长原电池的使用寿命。
总之,原电池吸氧腐蚀和析氢腐蚀是原电池中常见的腐蚀现象。
了解这些腐蚀现象的原因和措施,对于保护原电池的性能和延长寿命非常重要。
材料腐蚀与防护-第五章-析氢腐蚀和吸氧腐蚀.

氧去极化的阴极极化曲线: 由于氧去极化的阴极过程与氧向金属表面输送过程及 氧的离子化反应有关.所以氧去极化的阴极极化曲线比较 复杂。 分为四个部分: (1)阴极过程由氧离子化反应控制,即反应速度< <传输速度。 (2) 阴极过程由氧的扩散过程控制,即传输速度< <反应速度。 随着电流密度的不断增大,氧扩散过程缓慢引起浓差 极化。 (3)阴极过程由氧的离子化反应与氧的扩散过程混 合控制,即传输速度=反应速度。 (4)阴极过程由氧去极化及氢去极化共同控制。
析氢腐蚀的特征: 1.阴极反应浓度极化较小,一般可以忽略,原因: • (1)去极化剂是带电的半径很小的氢离子,在 溶液中有较大的迁移和扩散能力; • (2)去极化浓度较大,在酸性溶液中是氢离子, 在中性和碱性溶液中是水分子;H2O+e—H+OH• (3)氢气泡的搅拌作用; 2.与PH值关系较大。 3.与金属材料的本质和表面状态有关。 4.与阴极面积有关。 5.与温度有关。
影响氧去极化腐蚀的因素: (1)氧的浓度: 极限扩散电流密度随溶解氧的浓度增加 而增加,氧去极化腐蚀速度随着氧的浓度增加而增加。 (2)流动速度: 在氧浓度一定的情况下,极限扩散电流 密度与扩散层厚度呈成反比。溶液流速增加使扩散层 厚度减小,腐蚀速度增加。腐蚀速度随溶液流速的增 加而增加。 (3)温度:通常溶液温度升高有利于提高界面反应速度。 因此,在一定的温度范围内腐蚀速度将随温度升高而 加速。 (4)盐浓度:随着盐浓度增加,溶液的电导率增大,腐 蚀速度明显加快。
5.2 吸氧腐蚀 当电解质溶液中有氧存在时,在阴极上发生氧去极化反应, 在中பைடு நூலகம்或碱性溶液中: 在酸性溶液中:
由此引起阳极金属不断溶解的现象称作氧去极化腐蚀。
许多金属及其合金在中性或碱性溶液中,在潮湿大气、 海水、土壤中都可能发生氧去极化腐蚀,甚至在流动的弱 酸性溶液中也会发生氧去极化反应。因此,与析氢腐蚀比 较,氧去极化腐蚀更为普遍和重要。
36 析氢腐蚀和吸氧腐蚀

16
3.6.2 氧去极化腐蚀(吸氧腐蚀)
必要条件: 金属的氧化电位比氧还原反应的电位负。 EM<EO2 中、碱性溶液中氧还原反应 O2+2H2O+4e 4OH酸性溶液中反应 O2+4H++4e 2H2O
相较于氢去极化腐蚀,氧还原反应可以在正 得多的电位下进行,因此氧去极化腐蚀要更为 普遍。
9
杂质对Zn在0.25M的H2SO4溶
液中腐蚀速度的影响
吸氧图
1 2
( ) 铝
速(
率 ;
) 铜
不 同 的
、 、杂
铅 铁质
、 、对
汞 锑锌
降 、腐
低 砷蚀
了 、速
锌 锡度
的 、的
腐 镉影
蚀 加响
速 速是
率 了不
。 锌同
的的
动力学数据
腐。 蚀 10
的 腐 蚀 过 程 。
是 高 氢 过 电 位 金 属 , 属 于 阴 极 控 制
17
氧向金属(电极)表面的输送过程-消耗型
18
吸氧腐蚀中氧气传输的特点
• 对于氧去极化的阴极过程,浓度极化很突出,常 常占有主要地位。这是因为作为阴极去极化剂的 氧分子与氢离子的本质不同所决定的。
• (1)氧分子向电极表面的输送只能依靠对流和扩 散;
• (2)由于氧的溶解度不大,所以氧在溶液中的浓 度很小,一般为10-4mol/L;
8
四、氢去极化腐蚀概况
• 一般来说,电势较负金属在氧化性较弱的 酸和非氧化性酸中以及电极电位很负的金 属(如Mg)在中性或碱性溶液中的腐蚀都 属于氢去极化的腐蚀。
• 当金属中含有电位比金属电位更正的杂质 时,如果杂质上的氢过电位低,则阴极反 应过程将主要发生在杂质表面上进行,杂 质就成为阴极区。此时,杂质的氢过电位 的高低对基体金属的腐蚀有很大影响。
【知识解析】析氢腐蚀和吸氧腐蚀的比较-完整版课件
典例详析
例3-10(2020浙江浙东北联盟期中) 利用如图所示装置进行实验,开始时,a、b管中液面相平,密封好,放置一段时间 。下列说法不正确的是(C ) A.a管内发生吸氧腐蚀,b管内发生析氢腐蚀 B.一段时间后,a管内液面高于b管内液面 C.a管内溶液的pH增大,b管内溶液的pH减小 D.a、b管内具有的相同的电极反应式为Fe-2e- === Fe2+
Fe失去电子成为Fe2+进入溶
Fe失去电子成为Fe2+进入溶液,Fe失
液,Fe失去的电子流入C极,
去的电子流入C极,H+移向C极,与C
极上的电子结合成H2从溶液中析出
O2在C极上获得电子成为OH -进入溶液
其他反应及产物 普遍性
Fe2++2OH===Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
再见
典例详析
解析:U形管左侧是中性溶液,生铁丝发生吸氧腐蚀,右侧是酸性溶液,生铁丝发 生析氢腐蚀,故A正确。U形管左侧发生吸氧腐蚀,导致a管内气体压强减小,U形管 右侧发生析氢腐蚀,生成氢气,导致b管内气体压强增大,一段时间后,a管内液面 高于b管内液面,故B正确。a管内铁失电子生成亚铁离子,氧气得电子和水反应生成 氢氧根离子,a管内总反应为2Fe+O2+2H2O === 2Fe(OH)2,反应过程中消耗水 ,但因电解质溶液呈中性,所以a管内溶液的pH不变;b管内发生析氢腐蚀,消耗H+ ,溶液的pH增大,故C错误。a、b管内构成的原电池中,铁都作负极,具有相同的 电极反应式:Fe-2e- === Fe2+,故D正确。
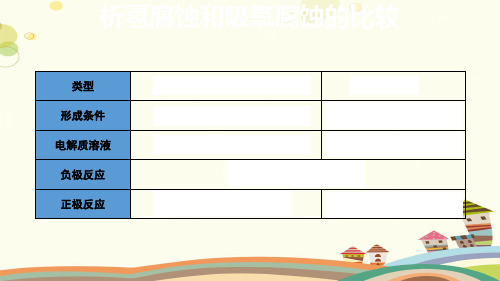
析氢腐蚀和吸氧腐蚀的比较
类型 形成条件 电解质溶液 负极反应 正极反应
析氢腐蚀与吸氧腐蚀

3.溶液中中性分子的还原反应 如:
吸氧反应
O2 +H2O+4e 4OH
氯的还原反应
Cl2 2e 2Cl
2
4.不溶性化合物的还原反应 如:
Fe(OH)3 +e Fe(OH)2 OH
或
Fe3O4 H2O 2e FeO 2OH
5.有机化合物的还原反应 如:
RO 4e 4H RH2 H2O
密度 iH0 不同;有的则是因析
氢反应机理不同引起的。而bH 的值则大致相同。
7
不同金属上析氢反应的交换电流密度
根据aH值的大小可将常用电极材料大致分为三类: 1)氢在其上析出具有高过电位的金属(aH≈1.0~1.6V),如Pb,Hg,Cd,Zn,Sn等。 2)氢在其上析出具有中过电位的金属(aH≈0.5~1.0V),如Fe,Co,Ni,Cu等。 3)氢在其上析出具有低过电位的金属(aH≈0.1~0.5V),如Pt,Pd,W等。
,当溶液PH=7,25℃时
pO2 p
0.21
在酸性溶液中,如果发生氧的还原,其反应为
16
其平衡电位为:
若pH=6,则 EO2,H /H2O 0.865V 。不难看出,由于溶氧的中,碱性及酸性 环境中的氧电位比氢电位还高,又由于中,碱性环境占据了腐蚀环境的绝 大部分,所以以析氢腐蚀相比,溶氧腐蚀具更重要的意义。
铁和碳钢的析氢腐蚀(混合控制)
13
五、减小析氢腐蚀的途径 金属的析氢腐蚀通常为阴极控制或阴、阳极混合控制,腐蚀速度主要取决 于析氢过电位的大小。析氢过电位大则析氢腐蚀速度就小。因此,为了减 小或防止析氢腐蚀,通常可采用如下的方法:
(1)改变金属材料的成分,加人析氢过电位高的成分,如在钢中加锌等。 (2)减小或清除金属中的有害杂质,特别是析氢过电位小的杂质。 (3)对金属所处的环境添加缓蚀剂。 (4)降低活性阳离子成分如 Cl 、S2 等。 (5)设法减小阴极面积。
析氢腐蚀和吸氧腐蚀

析氢腐蚀和吸氧腐蚀
从动力学角度而言,析氢腐蚀比吸氧腐蚀进行得更快,一旦发生了析氢腐蚀,往往会造成很大的损失。
但是,在溶液中不论是碱性及酸性环境,氧电位都比氢电位高,而且中性、碱性环境占据了腐蚀环境的绝大部分(这种情况下析氢腐蚀不发生),所以以析氢腐蚀相比,吸氧腐蚀具更重要的意义。
析氢腐蚀,指的是钢铁制品在酸性较强的溶液中与质子反应发生时放出氢气的腐蚀。
如果钢铁制品使用不当或者保管不合理的话,它就会在潮湿空气中,吸附空气中的水蒸气而形成一层薄薄的水膜。
这层水膜中无疑可以吸收空气中的二氧化碳。
而二氧化碳与水反应生产的碳酸,又会使得使水里的氢离子增多。
这就构成无数个以铁为负极、碳为正极、酸性水膜为电解质溶液的微小原电池。
析氢腐蚀发生的速率很快。
(这个反应首先是个原电池反应,而且反应面积大,同时生成的氢气可以很快脱离体系,反应速率能不快么。
)吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀。
这个反应速率取决于
氧穿过空气/溶液界面进入溶液;
在溶液对流作用下,氧迁移到阴极表面附近;
在扩散层范围内,氧在浓度梯度作用下扩散到阴极表面;
在阴极表面氧分子发生还原反应,也叫氧的离子化反应。
这四个步骤显然比析氢腐蚀的步骤多且慢。
但在热力学的角度而言,它发生的趋势更大,而且应用的范围更广,所以就更有意义咯。
析氢腐蚀和吸氧腐蚀的区别

析氢腐蚀和吸氧腐蚀的区别二者的腐蚀环境不同,一般来讲,析氢腐蚀的腐蚀环境是由含水、湿度高的空气组成,而吸氧腐蚀则是在大气中进行的。
1、析氢腐蚀和吸氧腐蚀的区别如果说有哪些金属容易发生析氢腐蚀,那么这个说法是对的,不过有的时候这个判断并不正确,因为有些材料,其他的条件都满足了,但是还是会产生析氢腐蚀。
例如在海水中工作的船舶,它们就很容易发生析氢腐蚀。
而有些材料,即使是在空气中也能发生析氢腐蚀。
析氢腐蚀在日常生活中比较少见,所以人们往往认为它只发生在不纯的物质中,或是没有干燥处理好的设备里。
而吸氧腐蚀则更常见,尤其是石油开采的地方,到处都有。
我们常见的不锈钢制品,其实就是不锈钢,也会发生吸氧腐蚀。
2、氢在钢中存在形态不同。
在海水中,水是分子,水分子与氢离子结合,形成氢分子,而且极不稳定,水分子互相碰撞而消失;在大气中,空气是无数分子的集合体,而且非常不稳定,因此经常会看到大量的水分子不停地碰撞而消失的情况,甚至许多分子相互接触而形成微尘状态。
根据分析,从腐蚀电池原理上分析,钢铁在含酸性物质的水溶液中比在空气中更容易受到腐蚀,主要原因是:析氢腐蚀的发生取决于氢离子的浓度,而且最低氢离子浓度要求为5×10^-4~5×10^-5 mol/L。
若水中含有2 mol/L的氢离子时,钢铁表面就开始出现钝化膜,使腐蚀减速,故通常把水中氢离子浓度作为衡量腐蚀程度的指标。
空气中,通常要求的氢离子浓度较小,约为0.01~0.03mol/L。
3、吸氧腐蚀和析氢腐蚀的形成条件也不相同。
吸氧腐蚀,指金属表面溶解氧浓度低于其钝化膜允许的氧浓度的条件下发生的腐蚀。
例如,海水中的Fe- 2×10-3~Fe- 4×10-2。
若温度较低, Fe表面发生析氢腐蚀的结果是Fe- 4×10-2转变为Fe。
吸氧腐蚀有两种情况,一种是在低于其电极电位的低氧化状态下发生的,称为欠氧化吸氧腐蚀;另一种是在高于其电极电位的过氧化状态下发生的,称为过氧化吸氧腐蚀。
第五章 析氢腐蚀和吸氧腐蚀

由阴极极化的本质可知,凡能在阴极上吸收电子的 过程(即阴极还原反应)都可以构成金属电化学腐蚀的 阴极过程。
阴极上吸收电子的还原反应大致有以下几类:
1.溶液中阳离子的还原反应 如:
析氢反应:
2H 2e H 2
金属离子的沉积反应: Cu2 2e Cu
金属离子的变价反应: Fe3 e Fe2
表5-1 不同金属上析氢反应的Tafel常数aH和bH/值
金 属 酸性溶液
碱性溶液 金 属 酸性溶液
碱性溶液
aH/(V) bH/(V) aH/(V) bH/(V)
aH/(V) bH/(V) aH/(V) bH/(V)
Pt 0.10 0.03 0.31 0.10 Cu 0.87 0.12 0.96 0.12
Ti 0.82 0.14 0.83 0.14 Tl 1.55 0.14
Bi 0.84 0.12
Pb 1.56 0.11 1.36 0.25
由表5-1可以看到, a H的数值对不同金属来说变 化很大,由铂0.10V到铅1.56V,这主要是因为不同 金属上析氢反应的交换电流密度不同,见表5-2;有 的则是因析氢反应机理不同引起的。
Mo 0.66 0.08 0.67 0.14 Sn 1.20 0.13 1.28 0.23
Fe 0.70 0.12 0.76 0.11 Zn 1.24 0.12 1.20 0.12
Mn 0.80 0.10 0.90 0.12 Cd 1.40 0.12 1.05 0.16
Nb 0.80 0.10
Hg 1.41 0.114 1.54 0.11
H 与 lgic成线性关系
H aH bH lg iC
(5-11)
这一关系式是塔菲尔于1905年通过对析氢反应的大 量实验总结出来的。对析氢过电位的研究能够查明析氢 的机理,因此有很大的理论价值。对析氢过电位所确定 的一些规律能够部分地扩大应用于其他电化学反应的动 力学,这就大大地提高了研究析氢过电位的理论意义。
析氢腐蚀与吸氧腐蚀

2.4.2 析氢电位
析氢电位等于情的平衡电位与析氢过电位之差。
析氢过电位 ɧH与氢离子的阴极 去极化的过程,电极的材 料和溶液 组成等因素有关
2.4.3 析氢腐蚀的控制过程
1. ★阴极控制:腐蚀速度主要取决于析氢过电位的大小。 例如:锌在酸中的溶解就是阴极控制下的析氢腐蚀。 2. ★阳极控制:阳极控制的析氢腐蚀主要是铝、不锈钢等钝化金属在稀 酸中的腐蚀。 3. ★混合控制 :阴、阳极极化大致相同。 例如:铁和钢在酸性溶液中的 析氢腐蚀中为阴、阳极混合控 制。
2.4.2.1 吸氧腐蚀的必要条件
吸氧腐蚀:以氧还原反应为阴极过程的金属腐蚀。
必要条件:金属的电位金属的电位比氧还原反应的电位负
2.4.2.2 氧的阴极还原过程及其过电位
★在中性和碱性溶液中氧分子的还原反应为: O2+2H2O+4e 4OH- ★在酸性溶液中氧分子的还原反应为: O2+4H++4e 2H2O ★在温度25℃, 氧压强po2=1atm条件下,以上两反应 的平衡电位均为 EO2=1.229-0.059pH ★整个吸氧的阴极过程可分为以下几个分步骤: 1)氧向电极表面输送; 2)氧吸附在电极表面上; 3)氧离子化。
2.4.2.3 吸氧腐蚀的控制过程及特点
1)如果腐蚀金属在溶液中的电位较正,腐蚀过程 中氧的传递速度又很大,则金属腐蚀速 度主要由氧在电极上的放电速度(吸氧阴极反应速度)决定,属于活化极化控制。
2)如果腐蚀金属在溶液中的电位非常负,如Zn、 Mn等,阴极过程将由氧去极化(吸氧反 应)和 氢离子去极化(析氢反应)两个反应共同组成。 3)如果腐蚀金属在溶液中的电位较负,如碳钢,处于活性溶解状态而氧的传输速度又有限 ,则金 属腐蚀速度受浓度极化控制,由氧的极限扩散电流密度决定。腐蚀? 2、析氢腐蚀和吸氧腐蚀的必要条件分别是什么? 3、析氢腐蚀和吸氧腐蚀的影响因素有哪些? 4、析氢腐蚀和吸氧腐蚀的过程是否可控?控制方式有哪些?
析氢腐蚀与吸氧腐蚀

Cu+ +2e Cu
Fe3+ +e Fe2+
2.溶质中阴离子的还原反应 如:
氧化性酸根离子的还原反应 或
NO3
2H
2e
NO
2
H2O
S2O62 +2e 2SO42
3.溶液中中性分子的还原反应 如:
吸氧反应 氯的还原反应
O2 +H2O+4e 4OH Cl2 2e 2Cl
属来说变化很大,由铂0.10V 到铅1.56V,这主要是因为不 同金属上析氢反应的交换电流
密度 iH0 不同;有的则是因析
氢反应机理不同引起的。而bH 的值则大致相同。
不同金属上析氢反应的交换电流密度
根据aH值的大小可将常用电极材料大致分为三类: 1)氢在其上析出具有高过电位的金属(aH≈1.0~1.6V),如Pb,Hg,Cd,Zn,Sn等。 2)氢在其上析出具有中过电位的金属(aH≈0.5~1.0V),如Fe,Co,Ni,Cu等。 3)氢在其上析出具有低过电位的金属(aH≈0.1~0.5V),如Pt,Pd,W等。
(1)改变金属材料的成分,加人析氢过电位高的成分,如在钢中加锌等。 (2)减小或清除金属中的有害杂质,特别是析氢过电位小的杂质。 (3)对金属所处的环境添加缓蚀剂。 (4)降低活性阳离子成分如 Cl 、S2 等。 (5)设法减小阴极面积。
第三节 吸氧腐蚀 以氧分子的还原反应为阴极过程的腐蚀称 为 吸氧腐蚀。
一般来说,(3)、(4)两个步骤为阴极还原反应的控制步骤。下 面通过溶氧的阴极极化曲线来讨论吸氧的电极过程动力学。
由图可知,极化曲线可分为三个部分:
1.Ee-B区
过电位不大,电流密度不大时为电化学步骤控制。这时过电位与电 流密度的对数成直线关系,说明阴极极化过程的速度主要决定于氧 的离子化反应。
腐蚀与防护4

2.吸附的氢原子除了进入金属内部外,大部分 在电极表面扩散并复合形成氢分子。 (2a)两个吸附的氢原子进行化学反应而复 合成一个氢分子,发生化学脱附: 2Had →H2
化学脱附反应,电化学文献中也称之为塔菲尔(Tafel)反应
(2b)由一个H+离子与一个Had原子进行电化 学反应而形成一个氢分子,发生电化学 脱附: H++Had + e-→ H2
不同金属上析氢反应的Tafel常数a H和bH值(25℃)
根据过电位值的大小,可将金属大致分成 三类,可看出金属材料对析氢过电位的影响:
1.高氢过电位的金属,如Pb、Hg、Cd、Zn、Sn 等,在1.0 ~1.6V之间; 2.中氢过电位的金属,如:Fe、Co、Ni、Cu、Ag 等,在0.5 ~1.0V之间 3.低氢过电位的金属,如Pt、Pd、Au等,在0.5 ~0.1V之间。
氧或其它物质的单分 子或多分子层
钝化膜的五种类型
吸附膜:由氧或其它物质的单分子或多分子层组成。例如 Fe-Cr合金 在酸性溶液中形成氧或氢氧化物单分子吸附膜。 三维氧化物聚合物成相膜: 由氧的多分子吸附膜转变生长为氧化物膜。如Fe在酸性溶液中形成内 层为Fe3O4、外层为γ-Fe2O3的钝化膜。 在无保护性膜上形成的成相膜: 例如:钴上形成的钝化膜。在中性溶液中,首先形成无保护性的CoO 膜,然后才形成Co3O4膜。Cu在中性溶液中形成由Cu2O和CuO组成成 相膜。 氢氧化物沉积层覆盖的成相膜: 如Fe在中性溶液中形成的钝化膜,其氧化物成相膜的厚度与电位成线 性关系,而外层沉积层厚度与电位无关。Co在碱性溶液中、Ti在酸性 溶液中形成的钝化膜都属于这种类型。 同组成的多孔膜覆盖的成相膜: 如Al在阳极氧化后,在其表面形成多孔的氧化物膜。
理学析氢腐蚀和吸氧腐蚀PPT课件

9
第9页/共45页
氢去极化的阴极极化曲线与氢过电位
• 由于缓慢步骤形成的阻力,在氢电极的平衡电位下将不能发生 析氢过程,只有克服了这一阻力才能进行氢的析出。
3.形成二氧化一氢离子:HO2 e HO2
4.形成过氧化氢:HO2 H H2O2
5.形成水:H2O2 2H 2e 2H2O
或H 2O2
1 2
O2
H 2O
32
第32页/共45页
在碱性溶液中的基本步骤为:
1.形成半价氧离子:O2 e O2
2.形成二氧化一氢离子:O2 H2O e HO2 OH
一般的说,在不同条件下金属腐蚀的阴极过程可以 有以下几种类型:
1. 溶液中的阳离子的还原,例如
2H 2e H2
2. 溶液中的阴离子的还原,例如
S2O32 2e S2O34 2SO42
3. 溶液中的中性分子的还原,例如
O2 2H2O 4e 4OH
4. 不溶性产物的还原,例如
FeOH 3 e FeOH 2 OH
40
第40页/共45页
3、盐浓度的影响 随着盐浓度的增加,由于溶液电导率的增大,腐蚀速度会有 所上升。但随着盐浓度的增加,又使氧的溶解度降低。
氧化纳的浓度对铁腐蚀速度的影响
41
第41页/共45页
4、 温度的影响 温度升高使电极反应速度加快,扩散系数增大;温度升高又使 氧的溶解度下降。 对于敞开系统,温度升高会降低O2的溶解度,使icorr↓;对于密 闭系统,会加速氧腐蚀过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
返回
(1) a值
a是ic = 1单位时的过电位c值。文献 中常称为氢过电位。金属电极材料的种
类对析氢反应的a值有重大影响。
---因为a=blgi0
按|a|的大小可划分:
高氢过电位金属(如Hg,Pb,Zn,Cd) 中氢过电位金属(如Cu,Fe,Ni) 低氢过电位金属(如Pt,Pd)
a=blgi0可知,a值反映了交换电流密度i0大小。 (随着i0增大,|a|减小 )
0.110 0.113 0.12 0.118 0.115 0.116 0.125 0.110 0.130 0.13
6.6x10-15 3.0x10-13 2.2x10-12 3.1x10-11 1.1x10-7 6x10-9 2.5x10-6 1.5x10-6 8x10-5 0.17
腐 蚀 动力学
腐 蚀 动力 学
第五章 析氢腐蚀和吸氧腐蚀
析氢腐蚀
•发生析氢腐蚀的体系 •析氢腐蚀的阴极过程 •阳极过程 •析氢腐蚀的控制类型 •析氢腐蚀的影响因素 •讨论
析氢腐蚀
发生析氢腐蚀的体系
能量条件 :Eea(Me/Men+) < Eec(H2/H+) ; (1) 活泼金属----标准电位很负的活泼金属 (2) 中等活泼金属---多数工程上使用的金属,如Fe (3) 不活泼金属---正电性金属一般不会发生析氢腐蚀。但
返回
阳极过程
动力学特征 ----活化极化控制
历程(自学) ----也是一系列的复杂过程
返回
析氢腐蚀的控制类型
控制类型的判据---根据析氢腐蚀特点:
●可以按照均相腐蚀电极处理,欧姆电阻可以忽略, 只需要比较阴极反应和阳极反应的阻力
--- 比较Pa、Pc(极化率,Evans极化图) ●由于阴、阳极反应都受活化极化控 制。因此,
是当溶液中含有络合剂时,正电性金属(如Cu,Ag)也 可能发生析氢腐蚀。
由电位比较判断电化学腐蚀的可能性和倾向
金属离子活度按10-6计算,气体压力按latm计算
电位
E(V) 1.23
+1.0
Au=Au3++3e
H O=O +4H++4e 22
Cu=Cu2++2e
0
H2=2H++2e
Fe=Fe2++2e
2x10-5
氢离子还原反应的历程 (自学)
------- 一系列的复杂过程 氢损伤---氢原子在金属中的扩散
吸附在金属表面的氢原子能够渗入金属并在金 属内扩散,可能造成氢鼓泡,氢脆等损害,金属表 面吸附氢原子浓度愈大,则渗入金属的氢原子愈多, 氢损害的危害性愈大。因此,凡是在金属表面发生 析氢反应的场合,都应当注意是否会造成氢损伤问 题。
(2) b值
b称为Tafel斜率,与金属材料和溶液关系很小, 故各种金属表面上析氢反应的b值相差不大。
b=118mV ( = 51.24mV),这是一个典型的数值。 对单电子反应n = 1,取传递系数 = 0.5,在25C,可
以算出b=118mv。
各种金属上析氢单一电极反应的常数a(i=1安培/厘米2), b及交换电流密度io(金属仅仅是析氢单一电极反应的场所)
金属阳极的单一电极反应的交换电流密度(室温)
电极材料
电极反应
溶液
io(安培/厘米2)
Hg
H++e=1/2H2
1.0NH2SO4
5x10-13
Pt
H++e=1/2H2
0.2NH2SO4
10-3
Ag
Ag++e=Ag
100g/lAgNo3 1.1x10-2
Cd
1/2Cd2++e=1/2Cd 160g/lCdSO4 1.4x10-2
Ni
1/2Ni2++e=1/2Ni 2.0NNiSO4
2x10-9
Fe
1/2Fe2+e=1/2Fe 2.0NFeSO4
10-8
Co
Hale Waihona Puke 1/2Co2+e=1/2Co 2.0NCocl2
8x10-7
Cu
1/2Cu2++e=1/2Cu 2.0NCuSO4
2x10-5
Zn
1/2Zn2+e=1/2Zu 2.0NZuSO4
阴极极化控制的析氢腐蚀极化图
图5-2 Zn在0.5N硫酸中的腐蚀
(2) 阳极极化控制--- ia0<< ic0 (或Pa>> Pc)
当ia0 << ic0,才会出现阳极极化控制。
只有当金属在酸溶液中能部分钝化,造成 阳极反应阻力大大增加,才能形成这种控制类 型。
有利于阳极钝化的因素使腐蚀速度减小。
要比较电极反应的阻力,只需比较交换电流密度 --- 比较ia0、ic0 (交换电流密度,真实极化曲线)
析氢腐蚀的三种控制类型
(1)阴极极化控制
--- ia0>> ic0 (或Pa<< Pc)
如Zn在稀酸溶液中的腐蚀。因为Zn是高氢过电 位金属,ia0>>ic0,故为阴极极化控制。 其特点---腐蚀电位Ecor与阳极反应平衡电位Eea 靠近。对这种类型的腐蚀体系,在阴极区析氢反 应交换电流密度的大小将对腐蚀速度产生很大影 响。
所以,Fe在酸溶液中的腐蚀可以当作均相腐蚀电 极处理,作为活化极化控制腐蚀体系的典型例子。
• 析氢腐蚀的阴极过程
H+ 还原反应的动力学特征(特点) 微极化---c很小时(小于7.8mV) c = Rf ic (Rf=RT/i0nF) 强极化---c较大时(大于118mV) c = a – b lgic (a=blgi0 b=118mV
(3) 混合控制--- ia0≈ ic0 (或Pa≈ Pc)
阴阳极极化程度差不多,称为混合控制。 其特点是: 腐蚀电位离阳极反应和阴极反 应平衡电位都足够远,即
金属
Pb Hg Cd Zn Cu Ag Fe Ni Pd 光亮Pt
溶
液
a伏
b 伏 io(安培/厘米2)
1N H2SO4 1N H2SO4 1.3N H2SO4 1N H2SO4 2N H2SO4 1N Hcl
1N Hcl 0.11N NaoH 1.1N KoH
1N Hcl
-1.56 -1.415 -1.4 -1.24 -0.80 -0.95 -0.70 -0.64 -0.53 -0.10
Zn=Zn2++2e
-1.0
-2.54
Mg=Mg2++2e
0
2
4
6
8
10
12
14(PH)
返回
• 典型例子—Fe在酸中的腐蚀
(1)pH < 3时,阴极反应受活化极化控制。 (Q:它为什么不是浓度控制?---定性/定量判据) (2)在弱氧化性和非氧化性酸溶液中,在反应速
度不是很大时,阳极反应亦受活化极化控制。 (3)Fe在酸溶液中的腐蚀形态,一般是均匀腐蚀。
