肌酐-(肌氨酸氧化酶法)试剂盒-新word版本
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求baiding

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐的含量。
1.1 包装规格
产品组成:
2.1 外观
2.1.1 试剂1为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡粉色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体, 无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.080(光径1.0cm,548nm±20nm 波长)。
2.4 分析灵敏度
测定100μmol/L样本,吸光度变化在0.010~0.030范围内。
2.5 线性区间
2.5.1 [5.6,1500]μmol/L(37℃)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [5.6,50]μmol/L范围内,线性绝对偏差应不超过±5μmol/L;(50,1500]μmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5%。
2.6.2 批间差
批间相对极差≤8%。
2.7 准确度
相对偏差在±10%范围内(测试国际参考物质SRM 909c (NIST))。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
3 综述材料 肌酐检测试剂盒(肌氨酸氧化酶法)

℃肌酐测定试剂盒(肌氨酸氧化酶法)综述资料******生物医疗科技有限公司目录1 产品预期用途 (3)1.1预期用途 (3)1.2临床适应症背景情况 (3)1.2.1 相关的临床或实验室诊断方法及产品现状等 (3)1.2.2 国内外已批准上市的同品种试剂盒情况 (4)2 产品描述 (4)2.1试剂盒测定原理 (4)2.2试剂盒产品的组成 (5)2.3主要参数与试验方法 (6)2.3.1 主要参数 (6)2.3.2 测试过程 (6)2.4主要原材料的来源及制备方法 (6)2.4.1 主要成分 (6)2.4.2 主要原材料的来源 (7)2.5主要生产工艺过程 (7)3 有关生物安全性的说明: (7)4 产品主要研究结果的总结和评价 (7)4.1主要研究结果的总结 (7)4.2分析性能评价 (8)4.3稳定性评价 (9)4.3.1 稳定性验证分为实时稳定性(效期稳定性)、运输稳定性、机载稳定性。
(9)4.3.2 合格标准见下表 (9)4.4参考区间 (10)4.4.1 血清肌酐样本参考区间 (10)4.4.2 尿液肌酐样本参考区间 (10)4.5临床评价 (10)4.5.1 原理、组成对比结果见下表 (10)4.5.2 储存条件及有效期对比结果见下表 (11)4.5.3 预期用途、适用样本对比结果见下表 (11)4.5.4 性能指标对比见下表 (11)4.5.5 离群值的剔除 (11)4.5.6 线性回归分析与相关性 (11)4.5.7 Bland-Altman 图分析 (12)4.5.7.1 血清样本Bland-Altman分析结果 (12)4.5.7.2 尿液样本Bland-Altman分析结果 (12)4.5.8 检测结果一致性分析 (12)4.5.9 医学决定水平处偏倚 (12)4.6校准品的量值溯源与性能评价 (12)附录1 (14)肌酐测定试剂盒(肌氨酸氧化酶法)综述资料1 产品预期用途1.1 预期用途用于定量检测人血清或尿液中肌酐的浓度。
肌酐测定试剂盒(肌氨酸氧化酶法)标准化操作规程

肌酐测定试剂盒(肌氨酸氧化酶法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人 经培训且考核通过的临床检验人员。
3 适用范围 本试剂适用于体外定量检测人血清、血浆或尿液中肌酐的浓度。
4 检验方法本试剂采用酶法测定肌酐的浓度。
5 检验原理样本中的肌酐在试剂中肌酐酰胺水解酶的催化下水解成肌酸,肌酸在试剂中肌酸脒基水解酶的催化作用下,被水解成肌氨酸和尿素,肌氨酸在肌氨酸氧化酶的作用下,生成的肌氨酸与水和氧反应,产生甘氨酸、甲醛和过氧化氢,生成的过氧化氢在过氧化物酶的催化下与苯胺类色原物质和4-氨基安替比林作用产生水和醌亚胺色素,醌亚胺色素的生成量与样本中总肌酐的含量成正比,通过测定特定波长处反应最终生成的色素量,可以计算出样品中总肌酐的浓度。
6 检验标本要求6.1 样本为血清、血浆或尿液。
6.2 血浆样本采用EDTA 抗凝,应不溶血。
样本采集后应尽快分析。
6.3 肌酐样本在2℃~8℃可稳定7天。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司肌酐试剂盒(酶法) 7.22H O +肌酐肌酐酰胺水解酶肌酸2H O +肌酸肌酸脒基水解酶肌氨酸+尿素2222H O+O H O ++肌氨酸+肌氨酸氧化酶 甘氨酸甲醛222H O +4-+ +H O氨基安替比林苯胺类色原物质过氧化物酶醌亚胺色素7.3试剂的稳定性与贮存:7.3.1 试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2 试剂开封后在2℃~8℃条件下可稳定30天。
7.4试剂的变质指示:若试剂混浊,不能再使用。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1 空白吸光度:A≤0.100。
8.2.2分析灵敏度:测试100μmol/L被测物时,吸光度变化△A>0.01。
8.2.3 线性范围:30μmol/L~2500μmol/L区间内,线性相关系数| r ︱≥0.9900;[30,70] μmol/L区间内,线性偏差应不超过±7µmol/L;(70,2500] μmol/L 区间内,线性偏差不超过±10%。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求丹大

肌酐测定试剂盒(肌氨酸氧化酶法) 适用范围:本品用于体外定量测定人血清中肌酐的含量。
1.1规格规格1: (试剂1:15mL;试剂2: 5mL);规格2: (试剂1:30mL;试剂2:10mL); .规格3: (试剂1:60mL;试剂2:20mL);校准品:为选配规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品:为选配规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成试剂盒组成见表1表1 肌酐(CRE)测定试剂盒组成2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;各组分齐全,完整,液体无漏液;试剂1、试剂2均为淡黄色透明液体,不得有沉淀和絮状物。
2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),37℃条件下,光径1cm,在A546nm 处测定试剂空白吸光度A≤0.2。
2.1.4分析灵敏度测定100μmol/L的样品时,吸光度差值△A>0.004。
2.1.5线性范围2.1.5.1在[30,1500]μmol/L内,相关系数R≥0.990。
2.1.5.2在[30,70]μmol/L内,线性绝对偏差不超过±7μmol/L;(70,1500]μmol/L内,线性相对偏差不超过±10%。
2.1.6 重复性重复测试(100±10)μmol/L和(500±100)μmol/L样本,所得结果的变异系数(CV%)应不大于5%。
2.1.7批间差测定(100±10)μmol/L和(500±100)μmol/L样本,所得结果的批间相对极差(R)应不大于10%。
2.1.8准确度用国家校准品(GBW09174a)参考物质检测,实测值与标示值的相对偏差在±10%内。
2.2校准品2.2.1外观校准品为淡黄色液体。
肌酐(CRE)测定试剂盒(酶法)产品技术要求st

1.性能指标1.1外观外观应符合表2要求。
表1 试剂盒内各组成的外观性状1.2装量液体试剂装量要求不低于标示量。
1.3试剂空白吸光度试剂空白吸光度≤0.2。
1.4分析灵敏度测试100μmol/L肌酐时,吸光度变化≥0.01。
1.5线性范围测试血清样本,试剂线性在[30,2500] μmol/L(37℃)区间内:a)线性相关系数|r|应不小于0.990;b)在范围[30,70] μmol/L 区间内,线性绝对偏差应不超过±7μmol/L;(70,2500] μmol/L 区间内,线性相对偏差应不超过±10% 。
1.6精密度1.6.1重复性变异系数(CV)应≤5%。
1.6.2批间差批间相对极差R≤10%。
1.7准确度相对偏差应不超过±10% 。
1.8分析特异性当抗坏血酸≤100mg/dL、胆红素≤20mg/dL、血红蛋白≤350mg/dL、脂肪乳剂≤1%、类风湿因子≤100IU/mL 时,对试剂检测结果的偏差影响在±10% 以内。
1.9量值溯源应明确分析物的量值溯源。
1.10校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
1.11校准品正确度量值传递的正确度应符合|En|≤1。
1.12质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.13校准品均匀性1.13.1瓶内均匀性:CV 瓶内应不大于5%。
1.13.2瓶间均匀性:CV 瓶间应不大于5%。
1.14质控品均匀性1.14.1瓶内均匀性:CV 瓶内应不大于5%。
1.14.2瓶间均匀性:CV 瓶间应不大于5%。
肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)产品技术要求sainuopu
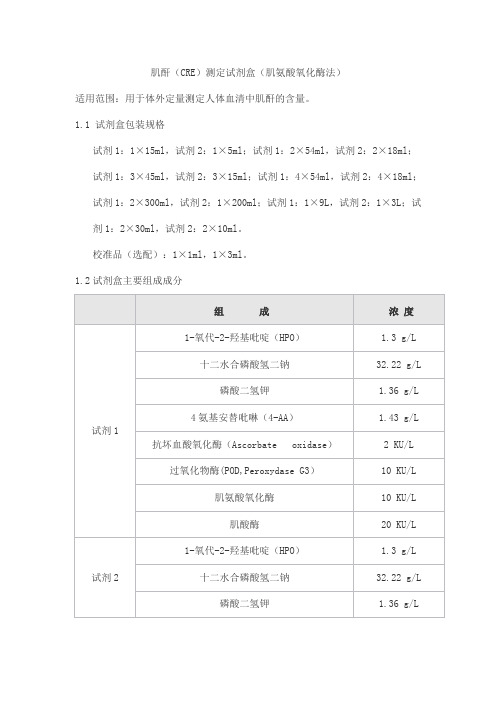
肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)适用范围:用于体外定量测定人体血清中肌酐的含量。
1.1 试剂盒包装规格试剂1:1×15ml,试剂2:1×5ml;试剂1:2×54ml,试剂2:2×18ml;试剂1:3×45ml,试剂2:3×15ml;试剂1:4×54ml,试剂2:4×18ml;试剂1:2×300ml,试剂2:1×200ml;试剂1:1×9L,试剂2:1×3L;试剂1:2×30ml,试剂2:2×10ml。
校准品(选配):1×1ml,1×3ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1 浅黄色至浅红色澄清液体;试剂2 无色至淡黄色澄清液体。
校准品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应不大于0.3。
2.4 分析灵敏度测定100μmol/L肌酐时,吸光度变化值(ΔA)应在(0.003,0.25)范围内。
2.5 线性范围测定血清样本,试剂线性在[30,1500]μmol/L(37°C)区间内:a)线性相关系数|r|不小于0.990;b)[30,70]μmol/L区间内,线性偏差应不超过于±7μmol/L;(70,1500]μmol/L 区间内,线性偏差应不超过±10%。
2.6 重复性重复测试两份高低浓度的质控样品,所得结果的变异系数(CV)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM914a)。
【word】酶法与Jaffe’s速率法测定血清肌酐的方法学评价

酶法与Jaffe’s速率法测定血清肌酐的方法学评价954?国际检验医学杂志2007年1O月第28卷第1O期lntJ1.abMed,Octo~r2007,V o1.28,No.10酶法与JaffeS速率法测定血清肌酐的方法学评价薛邦禄徐维家林韶华【摘要】目的通过对酶法和JaffeS速率法测定血清肌酐的结果进行方法学比较,寻找一种简便,特异,准确的检测肌酐的方法.方法使用酶法(肌氨酸氧化酶法)和JaffeS速率法(Fixed)在0一lympusAU2700全自动生化分析仪上测定血清肌酐,并对测定结果进行方法学评价,包括精密度实验,回收实验,干扰实验,对比实验.结果精密度实验显示,酶法和Jaffes 速率法批内变异系数分别为1.69和2.77,批间变异系数分别为2.37和3.14.对比实验结果显示,两种方法有良好的相关性,且无显着性差异(P)0.05),相关系数r=0.9873.回收试验显示,JaffeS速率法的回收率分别为95.7,102.1和106.8,平均回收率为i01.5;酶法的回收率分别为96.4,97.9和103.4,平均回收率为99.2.干扰试验结果显示,JaffeS速率法特异性不强,容易受到许多非特异性物质的干扰,尤其是临床黄疸患者的血清肌酐测得值偏差较大,而酶法从方法学上克服了肌酐测定中干扰物的影响.溶血及黄疸标本对酶法几乎无干扰,Jaffes速率法出现负干扰.结论酶法在重复性和抗干扰能力方面优于JaffeS速率法,酶法是目前测定血清肌酐的最好方法.【关键词】肌酐;酶法;JaffeS速率法中图分类号:R457.4文献标识码:B文章编号:1673-4130(2007)1O一954一O2肌酐(creatinine)是肌酸代谢的最终产物,血清中肌酐来源于肌肉中的肌酸和磷酸肌酸,由磷酸肌酸通过脱磷酸基并闭合成环而形成的内脱水物.肌酐是肌肉组织代谢产生的废物,通常情况下人体内形成的肌酐量是恒定的.游离肌酐在人体代谢中不能被重复利用,并主要通过肾小球滤过后随尿液排出.肌酐测定方法可分为化学法和酶法两大类.化学法有多种,但大都以Jaffe氏建立的碱性苦味酸法为基础.酶法测定肌酐有4种途径,其中3种为紫外线测定,1种为比色测定,相比之下,比色法具有灵敏度高,线性范围宽,试剂稳定性强等优越性.目前,我国l临床实验室测定血清肌酐主要采用JaffeS速率法和酶法.其中,JaffeS速率法测定血清肌酐易受内源性物质的影响,但由于试剂价格较低,国内仍在使用.酶法是近几年推出的一种新方法,本组对JaffeS速率法和酶法测定血清肌酐进行方法学比较,酶法相比JaffeS速率法具有线性范围宽, 抗干扰能力强,没有试剂毒性等优点,特别适合于自动分析. 资料与方法1.试剂:酶法试剂:肌氨酸氧化酶一PAP肌酐试剂盒,由上海科华东菱诊断用品有限公司提供.Jaffes速率法试剂:试剂盒由伊利康生物技术有限公司提供.2.标准液:上海科华一东菱诊断用品有限公司生产浓度为265mol/L肌酐标准液.伊利康生物技术有限公司生产浓度为442”mol/I肌酐标准液.3.标本:血清标本:来源于大连市中心医院临床患者.血红蛋白液:临床收集正常新鲜EDTA—Kz抗凝血,生理盐水洗涤红细胞,离心,弃上清,加蒸馏水溶血测定血红蛋白含量(配制成0.25,0.50,0.75,1.00g/L).质控血清:由日本Olympus公司提供.4.仪器:OlympusAU2700全自动生化分析仪.作者单位116033大连市中心医院检验科(薛邦禄,徐维家); 116013大连市中山区妇幼保健所(林韶华)经验交流?5.测定参数:(1)酶法:主波546nm,副波700nm,温度37C,双试剂,样本为试剂1:试剂2—4:120:40(td),测光点为9点和27点,终点法(End).(2)JaffeS速率法:主波520 nm,副波660nm,温度37.C,双试剂,样本为试剂1:试剂2—15:120:30(I),测光点为14点和21点,速率法(Fixed).结果1.精密度试验:用酶法和JaffeS速率法对质控血清分别进行批内和批间精密度试验.酶法:批内2O例,批间2O例,平均值分别为103.3~mol/I和105.5~mol/I,CV值分别为1.69%和2.37.JaffeS速率法:批内2O例,批间2O例,平均值分别为l14.7tLmol/L和111.8tLmol/L,CV值分别为2.77和3.14%.2.对比试验:随机收集4O例临床患者血清标本(包括溶血,黄疸,脂血等).在OlympusAU27OO全自动生化分析仪上用酶法和JaffeS速率法分别测定血清肌酐,并计算相关系数, 结果如下:相关系数r一0.9873,查Rs界值表P%0.05,说明此两种方法有相关性.查t值表P>O.05,说明此两种方法无显着差异.3.回收试验:取1m1混合血清(取自临床体检样本),加入一定浓度的肌酐标准液0.05ml(66,133,265tLmol/L),分别进行回收试验.其结果分别为:(1)酶法:96.4,97.9,103.4;(2)JaffeS速率法:95.7,102.1,106.8.平均回收率分别为99.2和101.5.4.干扰试验:等体积的混合血清加入等体积的蒸馏水和血红蛋白液(O.25,0.50,0.75,1.O0g/L).测定结果表明,酶法几乎无干扰;Jaffes速率法,血红蛋白在0.25g/L以上时有明显负干扰.随机选取1O份黄疸血清用两种方法分别测定肌酐,结果显示胆红素对JaffeS速率法有明显的负干扰.讨论肌酐别名肌乙酸内酰胺,是生物体肌肉组织中储能物质肌国际检验医学杂志2007年lO月第28卷第lO期IntJLabMed,October2007,V o1.28,No.10酸(creatine)的代谢终产物.一般来说,机体每20g肌肉,每日代谢产生1mg肌酐,肌酐主要通过尿液排出体外.当人体肾功能低下或衰竭时,血液中便积累了远高于正常浓度的肌酐(15mg/L),尿素(200mg/L)等代谢废物,在疾病终末期,就会产生尿毒症的一系列症状.目前血清肌酐临床检测方法主要有JaffeS速率法和酶法,而国内大多数实验室仍采用JaffeS速率法来测定血清肌酐.经典的Jaffe方法测定血清肌酐的主要缺点是特异性差,反应受许多非特异性”色源”物质(如丙酮酸钠等)的干扰,其误差可达到2O_2].Jocelyn根据Jaffe方法符合一级动力学机制建立的JaffeS速率法测定血清肌酐比经典的Jaffe方法是一大进步.JaffeS速率法在一定程度上改进了Jaffe方法的非特异性,减少了非肌酐色源干扰,并适用于自动生化分析仪. 但由于JaffeS速率法也是一种非特异性反应,易受假肌酐化合物干扰,尽管在测定中采用速率带标准的方法来测定,但测定结果与其他项目相比在准确性方面有一定的差异.同时,碱性苦味酸是一种强腐蚀剂,对全自动生化分析仪有很大的腐蚀性作用.另外,苦味酸色素对比色杯的污染是长期使用全自动生化分析仪的一个主要问题,清洗液效力低,温度不够就不能有效地去除肌酐与碱性苦味酸化合物污染,不仅对测定结果有影响,还大大地缩短了自动分析仪的使用寿命_3].近年来,多采用抗干扰能力较强的”两点法”来测定血清肌酐(亦属于JaffeS速率法),它巧妙地利用真假肌酐二者反应时间差来消除快,慢反应中假肌酐的干扰,使特异性提高,但仍然不能全面地消除非肌酐色素的干扰,尤其是胆红素对血清肌酐测定的负干扰].目前多数学者认为胆红素干扰肌酐测定机制可能为:在955?500~520nrn处胆红素有较强吸收,并且在NaOH的作用下,胆红素转变为620nlTl处有较强吸收的胆绿素而使原吸收减弱,这样就掩饰了肌酐与苦味酸的显色反应,使肌酐测定值偏低.本研究结果显示,JaffeS速率法与酶法相比,其明显劣势表现在抗干扰能力方面,Jaffes速率法血红蛋白在0.25g/L以上时即有明显的负干扰,胆红素也有不同程度的负干扰.酶法从方法学上克服了肌酐测定中干扰物的影响,准确度高,且精密度试验优于JaffeS速率法,对仪器及比色杯无腐蚀性和污染性,与Jaffes速率法相关性良好.两种方法回收试验均符合方法学评价要求,无差异.但酶法试剂价格昂贵,不利于中小型医院开展.总之,JaffeS速率法虽经不断改良,但其抗干扰能力无法与酶法相提并论.酶法测定血清肌酐是目前国内临床比较客观,准确的一种方法,特别适合自动化分析.参考文献[1]朱鸿,孙国华,孙树馨,等.利用酶法检测肌酐的方法学评价[J].大连医科大学,2002,24(1):5051.[2]居漪,曾芝如.酶法和Jaffe速率法测定血清肌酐方法学比较[J]. 上海医学检验杂志,2002,17(1):24—25.[3]金哗,苏建荣.酶法与Jaffe反应速率法测定肌酐的比较及干扰分析[J].首都医科大学,2002,23(4):344—345.[4]韩志钧,黄志锋,卢业成,等主编.临床化学常用项目自动分析法[M].第3版.沈阳:辽宁科技出版社,1995.[5]石凌波,林龙顺.常见肌酐测定方法中存在的干扰[J].中华检验医学杂志,2001,24(2):102104.(收稿日期:2006—1l一04)(上接第953页)下细胞释放的一氧化氮量是很少的,但是有免疫调节,神经传递,血压生理调控和血小板凝集的抑制等生理功能.在病理情况下巨噬细胞和多形核细胞能产生大量的诱导型一氧化氮合酶和超氧化物阴离子自由基,从而合成大量的NO和Hz0z.过量的NO和H0对心血管系统,免疫系统,呼吸系统,神经系统,消化系统等均有损伤作用,引起多器官组织损伤.结果表明,INF-a和IL一6两种促炎细胞因子明显升高,提示炎症反应参与了创伤性休克的发病过程.NO活性升高,提示NO作为活性很强的自由基的氧化还原反应参与了创伤性休克的发展过程,可能是引起大顽固性休克低血压的主要原因.内毒素,细胞因子,NO协同作用,使休克向不可逆转化.综上所述,NO,INF-a,I1一6参与了创伤性休克的发生,发展过程,动态检测外周血NO,TNF-a,IL-6含量对评价创伤性休克的病情,预后和治疗有指导意义.参考文献[1]GiannoudisPV,HildebrandF,PapeHC.Inflammatoryserum markersinpatientswithmultipletrauma.CantheypredictOut—come[J]?JBoneJointSurgBr,2004,86(3):313—323.r2]Schroder0,IaunRA,HeldB,eta1.Associationofinterleukin一10promoterpolymorphismwiththeincidenceofmultipleorgan dysfunctionfollowingmajortrauma:resultsofaprospectivepilot study[J].Shock,2004,21(4):306—310.[3]RussellDH,Barretojc,KlemmK,eta1.Hemorrhagicshockin—creasesgutmacromolecularpermeabilityintherat[J].Shock, 1995,4(1):5O一55.[4]BoneHO,FischerSR,SchenartsPJ,eta1.Continuousinfusion ofpyridoxalatedhemoglobinp0ly0xyethykneconjugateinhyper—dynamicsepticsheep[J].Shock,1998,10(1):69—76.(收稿日期:2007—03—04)。
肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)产品技术要求lideman

肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)适用范围:本产品用于体外定量测定人血清中肌酐的含量。
1.1规格试剂1(R1):2×60mL,试剂2(R2):2×20mL;试剂1(R1):4×60mL,试剂2(R2):2×40mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×300mL,试剂2(R2):1×200mL;试剂1(R1):2×80mL,试剂2(R2):2×16mL;试剂1(R1):2×60mL,试剂2(R2):2×12mL;试剂1(R1):5×60mL,试剂2(R2):5×12mL;试剂1(R1):5×60mL,试剂2(R2):5×20mL;试剂1(R1):2×40mL,试剂2(R2):1×16mL;试剂1(R1):3×60mL,试剂2(R2):3×60mL;试剂1(R1):2×80mL,试剂2(R2):2×80mL;试剂1(R1):2×40mL,试剂2(R2):2×40mL;试剂1(R1):1×18mL,试剂2(R2):1×6mL ;试剂1(R1):2×45mL,试剂2(R2):2×15mL。
512T:试剂1(R1):134.4mL,试剂2(R):44.8mL。
校准品(选配):1×3mL。
1.2 组成1.2.1试剂组成试剂1(R1)(以下简称R1)试剂2(R2)(以下简称R2)表1 试剂组成1.2.2校准品的组成:单水平的液体校准品,在水基质中添加肌酐(纯度:大于95)%;定值范围:(400-500)μmol/L。
2.1 外观液体双试剂:R1为浅黄色澄清液体,R2为浅黄色澄清液体。
肌酐测定实验报告

一、实验目的本次实验旨在通过肌酐测定,了解肌酐在人体内的代谢过程,评估肾功能状况,并探讨影响肌酐水平的相关因素。
二、实验原理肌酐是人体肌肉组织代谢过程中产生的一种非蛋白含氮物质,主要由外源性肌酸代谢而来。
正常情况下,肌酐在体内保持相对稳定水平,主要通过肾脏排泄。
因此,肌酐测定可以反映肾脏的滤过功能,是评估肾功能的重要指标。
三、实验材料1. 样本:新鲜尿液、血液2. 试剂:肌酐酶、肌酸酶、肌氨酸氧化酶、尿素、甘氨酸、甲醛等3. 仪器:肌酐测定仪、离心机、水浴箱等四、实验方法1. 血清肌酐测定(1)取血清样本,按照试剂盒说明书进行肌酐酶催化反应,生成肌酸。
(2)加入肌酸酶,将肌酸水解产生肌氨酸和尿素。
(3)肌氨酸在肌氨酸氧化酶作用下氧化生成甘氨酸、甲醛等产物。
(4)通过测定产物浓度,计算血清肌酐含量。
2. 尿肌酐测定(1)取尿液样本,按照试剂盒说明书进行尿肌酐测定。
(2)通过测定尿液中肌酐浓度,评估肾功能状况。
五、实验结果1. 血清肌酐测定结果本次实验血清肌酐浓度为XX μmol/L,与正常值范围XX-XX μmol/L相符。
2. 尿肌酐测定结果本次实验尿肌酐浓度为XX μmol/L,与正常值范围XX-XX μmol/L相符。
六、讨论与分析1. 肌酐测定结果分析本次实验血清肌酐和尿肌酐测定结果均在正常范围内,说明受试者肾功能正常。
2. 影响肌酐水平的相关因素(1)蛋白质摄入:蛋白质摄入过多或过少均可影响肌酐水平。
高蛋白饮食可导致血清肌酐升高,低蛋白饮食则可能导致血清肌酐降低。
(2)肌肉含量:肌肉含量与肌酐生成密切相关。
肌肉含量增加,肌酐生成量也随之增加。
(3)肾功能:肾功能受损会导致肌酐排泄受阻,引起血清肌酐升高。
3. 肌酐测定的临床意义肌酐测定是评估肾功能的重要指标。
通过肌酐测定,可以早期发现肾功能异常,为临床诊断和治疗提供依据。
七、结论本次实验通过肌酐测定,成功评估了受试者的肾功能状况。
实验结果表明,受试者肾功能正常。
肌酐-(肌氨酸氧化酶法)试剂盒-新

肌酐测定标准操作程序1. 摘要肌酐试剂盒适用于体外临床检验,用于测定人血清或尿液中肌酐的含量。
2. 适用范围程序适用于AU5811自动生化分析仪检测血清尿液中肌酐的浓度。
3. 职责使用AU5811自动生化分析仪进行测定CREA 浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法上海科华生物工程股份有限公司生产的肌酐(CREA )试剂盒采用的是肌氨酸氧化酶法。
5. 原理上海科华生物工程股份有限公司的肌酐 (肌氨酸氧化酶法)试剂盒的测定原理如下:O H N N O H O H HCHO O O H O H O H 2222222224---42+−−−→−-+-+++−−−−→−+++−−−−→−+−−−−→−+醌亚胺间甲苯胺磺丙基乙基氨基安替比林甘氨酸肌氨酸尿素肌氨酸肌酸肌酸肌酐过氧化物酶肌氨酸氧化酶肌酸脒基水解酶肌酐氨基水解酶 肌酐在肌酐氨基水解酶的作用下水解成肌酸,肌酸在肌酸脒基水解酶的作用下生成肌氨酸和尿素,其中产物肌氨酸在肌氨酸氧化酶的作用下生成甘氨酸、过氧化氢和甲醛。
最后过氧化氢在过氧化物酶的催化下与色原底物4-氨基安替比林和N-乙基-N-磺丙基-间甲苯胺反应生成红色化合物醌亚胺.由于醌亚胺在波长546nm 处有最大吸收峰,所以在一定底物浓度范围内, 546nm 处吸光度的变化值与样本中肌酐的含量成正比.6. 仪器AU5811自动生化分析仪7. 试剂7.1 试剂来源:上海科华生物工程股份有限公司提供7.2 试剂瓶内主要成分:肌酸脒基水解酶、肌氨酸氧化酶、抗坏血酸氧化酶、过氧化物酶、ESPMT 、肌酐胺基水解酶、4-氨基安替比林7.3 试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
7.4 试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用科华公司提供的标准品对自动分析仪进行校准。
肌酐(Cr)含量检测试剂盒说明书(肌氨酸氧化酶法)__ 微量法UPLC-MS-6020
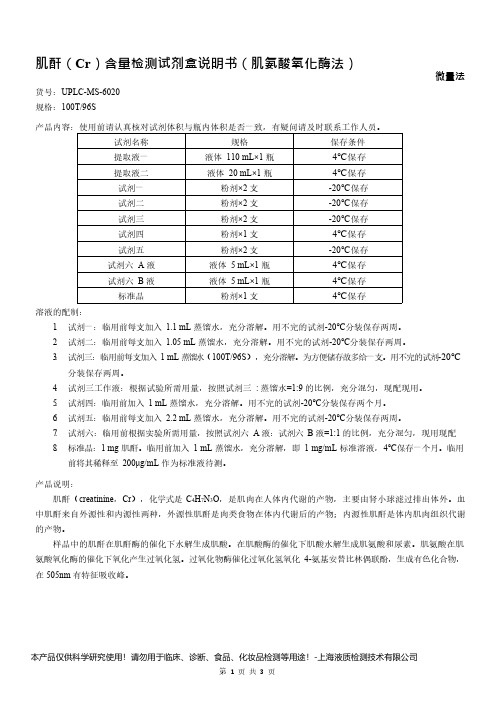
肌酐(Cr)含量检测试剂盒说明书(肌氨酸氧化酶法)微量法货号:UPLC-MS-6020规格:100T/96S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件提取液一液体110mL×1瓶4℃保存提取液二液体20mL×1瓶4℃保存试剂一粉剂×2支-20℃保存试剂二粉剂×2支-20℃保存试剂三粉剂×2支-20℃保存试剂四粉剂×1支4℃保存试剂五粉剂×2支-20℃保存试剂六A液液体5mL×1瓶4℃保存试剂六B液液体5mL×1瓶4℃保存标准品粉剂×1支4℃保存溶液的配制:1.试剂一:临用前每支加入1.1mL蒸馏水,充分溶解。
用不完的试剂-20℃分装保存两周。
2.试剂二:临用前每支加入1.05mL蒸馏水,充分溶解。
用不完的试剂-20℃分装保存两周。
3.试剂三:临用前每支加入1mL蒸馏水(100T/96S),充分溶解。
为方便储存故多给一支。
用不完的试剂-20℃分装保存两周。
4.试剂三工作液:根据试验所需用量,按照试剂三:蒸馏水=1:9的比例,充分混匀,现配现用。
5.试剂四:临用前加入1mL蒸馏水,充分溶解。
用不完的试剂-20℃分装保存两个月。
6.试剂五:临用前每支加入2.2mL蒸馏水,充分溶解。
用不完的试剂-20℃分装保存两周。
7.试剂六:临用前根据实验所需用量,按照试剂六A液:试剂六B液=1:1的比例,充分混匀,现用现配8.标准品:1mg肌酐。
临用前加入1mL蒸馏水,充分溶解,即1mg/mL标准溶液,4℃保存一个月。
临用前将其稀释至200μg/mL作为标准液待测。
产品说明:肌酐(creatinine,Cr),化学式是C4H7N3O,是肌肉在人体内代谢的产物,主要由肾小球滤过排出体外。
血中肌酐来自外源性和内源性两种,外源性肌酐是肉类食物在体内代谢后的产物;内源性肌酐是体内肌肉组织代谢的产物。
肌酐测定试剂盒(酶法)使用说明书

医疗器械生产企业许可证编号:沪药管械生产许20030955号医疗器械注册证注册号:沪食药监械(准)字2005第2400962号产品标准号:YZB/沪0761-40-2005肌酐测定试剂盒(酶法)使用说明书【用途】本试剂用于人血清、血浆或尿中肌酐含量的测定。
【原理】肌酐+H2O肌酐胺基水解酶肌酸;肌酸+H2O+O2肌酸脒基水解酶肌氨酸+尿素肌氨酸+ H2O+O2肌氨酸氧化酶甘氨酸+HCHO+H2O22H2O2+4-氨基安替比林+2.4-DCP过氧化物酶醌亚胺+4H2O【试剂规格】规格1 规格2R1 3×60ml 2×60mlR2 3×20ml 2×20ml【试剂成份】R1:肌酸脒基水解酶 80KU/L;肌氨酸氧化酶 25KU/L;抗坏血酸氧化酶10KU/L;过氧化氢酶10KU/L;2,4-DCP 2.2mmol/L。
R2:肌酐胺基水解酶280KU/L;4-AAP 5mmol/l;过氧化物酶40KU/L。
【样本】无溶血的血清,肝素抗凝的血浆。
样本于2-8℃保存可稳定7天。
试验前将新鲜尿液用蒸馏水作1/21稀释,测定结果乘以21。
【实验参数】反应温度 37℃比色杯光径1cm主波长546nm 副波长660nm测定方法两点法样本量6µlR1 180µl R2 60µl 延迟时间 300秒测定时间 300秒【测试程序】A1A2主波长546nm37℃样本6ul 5分钟10分钟R1:180µl R2:60µl【计算】测定吸光度(A2-A1)× 校准液浓度肌酐(µmol/L) =校准吸光度(A2-A1)【参考范围】男性:70-115µmol/L;女性:44-80μmol/L,上值仅供参考,各实验室须建立本室.的参考值。
【注意事项】1. 样品请使用血清、血浆或尿(尿液作21倍稀释,测定结果须乘以稀释倍数);2. 高球蛋白标本在加入第一试剂后,产生浑浊可影响测定结果;3. 试剂与样本量根据生化分析仪要求可以按比例改变。
生化实验室肌酐Cr肌氨酸氧化酶法作业指导书

生化实验室肌酐Cr肌氨酸氧化酶法作业指导书1、前言试验名称:肌酐测定,英文名称:Cr,方法:肌氨酸氧化酶法。
本文件适用于安阳鼎城糖尿病医院检验科生化实验室,目的是指导工作人员正确的在科华KHB450全自动生化分析仪上测定血清、血浆、尿样本中的肌酐浓度,以保证测定结果的准确可靠。
本试验用体外定量测定人血清、血浆或尿液样本中肌酐的浓度。
肌酐是肌酸代谢的最终产物,体内的肌酸大部分与磷酸结合成磷酸肌酸,血清中肌酐来源于肌肉中的肌酸和磷酸肌酸,而肌肉中肌酸量的多少是人体肌肉重量的反映,通常情况下人体内形成的肌酐量是恒定的,游离肌酐在体内代谢中不能被重复利用,并主要通过肾小球滤过后随尿液排出,因此血液循环系统中肌酐的含量完全依赖于它的排泄速度,测定血清中肌酐的含量主要用来评价肾功能状态。
2、测定原理血清中的肌酐在肌酐氨基水解酶、肌酸眯基水解酶、肌氨酸氧化酶和过氧化物酶的先后水解和氧化下,最终生成了醌亚胺。
由于醌亚胺在波长546nm处有吸收峰,所以在一定底物浓度范围内,546nm 处吸光度的变化值与样本中的肌酐的含量成正比。
3、试剂试剂生产商:长海科华公司。
剂型:液体双试剂。
包装量:R1:4*45ml R2:3*20ml注册号:沪食药监械(准)字2010第2400023号。
生产许可证号:沪药管械生产许20030916号。
基本成份:试剂1:肌酸眯基水解酶肌氨酸氧化酶抗坏血酸氧化酶过氧化氢酶ESPMT试剂2:肌酐胺水解酶过氧化物酶储存条件和有效期:试剂避光储存于2―8℃可至有效期。
4、标准品:使用试剂盒附带标准品5、质控品:生产商:英国Randox公司。
剂型:干粉试剂,用5ml去离子水复溶,完全溶解30分钟后使用。
保存条件:未溶解时2―8℃稳定至有效期,复溶后2―8℃稳定一周。
6、、样品要求:样品采集前病人准备无特殊要求,用肝素锂抗凝管或促凝管常规方法肘静脉采血,血标本4000转离心3分钟,分离血清或肝素抗凝血浆,样本应不溶血。
肌酐测定标准操作规程

肌酐测定标准操作规程1.检验原理:(肌氨酸氧化酶法)血样中原有肌酸通过试剂除去后,肌酐在肌酐酶的作用下生产肌酸,肌酸又在肌酸酶作用下转化为肌氨酸。
肌氨酸氧化酶将生成的肌氨酸氧化,生成甘氨酸、甲醛和过氧化氢。
过氧化氢与4-氨基安替比林(4-AA )、N-乙基-间甲基苯胺-2-羟丙基磺酸钠(TOOS )在过氧化物酶(POD )作用下反应下生成红色醌类物质。
在546nm 处,其显色程度与血液中的肌酐成正比。
肌酐+O H 2−−→−肌酐酶肌酸 肌酸+O H 2−−→−肌酐酶肌氨酸 肌氨酸+2O +O H 2−−→−SOD甘氨酸+甲醛+过氧化氢 过氧化氢+TOOS+4+AA −−→−POD红色醌类物质+O H 2 2.试剂主要组成成分3.样本要求:新鲜无溶血血清、肝素或EDTA 抗凝血浆。
在18~25℃保存6小时,2~8℃保24小时,-20℃保存7天,样本不可反复冻融!4.检验方法;仪器法(详见DF-603/DI-600标准操作规程)5.参考范围:6.检验结果的解释:6.1样本含量超出线性范围时,建议用0.9%(W/V )的氯化钠溶液稀释样本。
通常稀释2倍,当样本浓度较大时提高稀释倍数,建议最大稀释不超过10倍6.2.单位换算:mg/dL=umol/L ×0.01137.检验方法的局限性7.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊,或以水空白在546nm处吸光度大于0.300时不能使用。
7.3检验结果仅供参考,不作为临床诊断唯一依据。
8.产品性能指标8.1线性范围:在给定的样本/试剂比例和条件下测定时,本试剂线性范围可达0-5000umol/L。
线性相关系数r≥0.99008.2试剂空白吸光度:在546nm处,光径1cm时,空白吸光度A≤0.300。
8.3准确度:相对偏差≤10%。
8.4精密度8.4.1重复性CV≤3%8.4.2批间差:R≤10%8.5分析灵敏度:在给定的样本/试剂比例和条件下测定时,1umol/L的肌酐对应的△A不低于2×4108.6干扰试验无明显干扰:添加干扰物后的测定值与初始测定值的相对偏差处于±10%以内。
艾威德肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)说明书

肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)说明书【产品名称】肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)【包装规格】a)试剂1:2×45mL试剂2:2×15mLb)试剂1:4×60mL试剂2:4×20mLc)试剂1:2×60mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中肌酐的含量。
肌酐经肾小球过滤后不被肾小管重吸收,通过肾小管排泄。
在肾脏疾病初期,血清肌酐值通常不升高,直至肾脏实质性损害,血清肌酐值才升高。
在正常肾脏血流量的条件下,肌酐值如升高至176~353μmol/L,提示为中度至严重的肾损害。
测定肌酐常用于晚期肾脏病的辅助诊断[1]。
【检验原理】肌酐经肌酐酶水解成肌酸,肌酸经过肌酸酶水解成肌氨酸,肌氨酸被肌氨酸氧化酶氧化生成过氧化氢。
过氧化氢与过氧化物酶、4-氨基安替比林、N-乙基-N-(3-磺丙基)-3-甲氧基苯胺钠盐反应,生成有色染料。
该染料在546nm 波长下的吸光度增加量与血清中的肌酐的含量成正相关。
【主要组成成分】试剂1主要组分缓冲液100mmol/L ESPAS(N-乙基-N-(3-磺丙基)-3-甲氧基苯胺钠盐) 1.5mmol/L抗坏血酸氧化酶>2KU/L肌氨酸氧化酶>8KU/L肌酸脒基水解酶>40KU/L试剂2主要组分缓冲液100mmol/L肌酐胺基水解酶≥450KU/L POD(过氧化物酶)≥55KU/L4-AA(4-氨基安替比林) 2.5mmol/L 注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为18个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECTc8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/ CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/ BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
肌酐测定试剂盒说明书
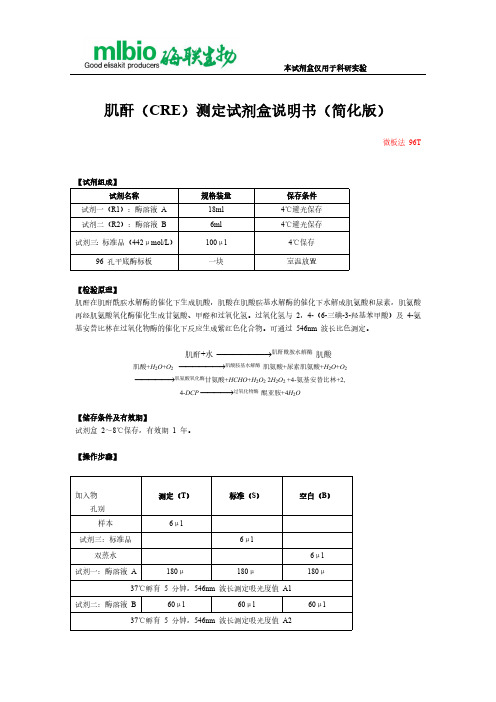
肌酸+H2O+O2 肌酸胺基水解酶 肌氨酸+尿素肌氨酸+H2O+O2 肌氨酸氧化酶甘氨酸+HCHO+H2O2 2H2O2 +4-氨基安替比林+2,
4-DCP 过氧化物酶 醌亚胺+4H2O
【储存条件及有效期】 试剂盒 2~8℃保存,有效期 1 年。
【操作步骤】
加பைடு நூலகம்物 孔别
积
246
本试剂盒仅用于科研实验
肌酐(CRE)测定试剂盒说明书(简化版)
微板法 96T
【试剂组成】 试剂名称
试剂一(R1):酶溶液 A 试剂二(R2):酶溶液 B 试剂三:标准品(442μmol/L)
96 孔平底酶标板
规格装量 18ml 6ml 100μl 一块
保存条件 4℃避光保存 4℃避光保存
4℃保存 室温放置
【检验原理】 肌酐在肌酐酰胺水解酶的催化下生成肌酸,肌酸在肌酸胺基水解酶的催化下水解成肌氨酸和尿素,肌氨酸 再经肌氨酸氧化酶催化生成甘氨酸、甲醛和过氧化氢。过氧化氢与 2,4-(6-三碘-3-羟基苯甲酸)及 4-氨 基安替比林在过氧化物酶的催化下反应生成紫红色化合物。可通过 546nm 波长比色测定。
肌酐含量 (测定 A -K *测定 A )-(空白 A -K *空白 A ) 标准品浓度
=
2
1
2
1
(μmol / L)(标准 A2 -K *标准 A1)-(空白 A2 -K *空白 A1)(442μmol/L)
注:稀释因子 K =
加样量+酶溶液 A 体积
= 186
加样量+酶溶液 A 体积+酶溶液 B 体
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求中生北控

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本产品用于体外定量测定人血清中肌酐的浓度。
1.1包装规格液体双剂型试剂1(R1):40mL×2,试剂2(R2):20mL×2,校准品:2mL×1;试剂1(R1):60mL×2,试剂2(R2):30mL×2,校准品:2mL×1;试剂1(R1):80mL×2,试剂2(R2):40mL×2,校准品:2mL×1;试剂1(R1):40mL×2,试剂2(R2):20mL×2,校准品:2mL×2(1个浓度)。
1.2主要组成成分1.2.1试剂 1(R1)(液体)肌酸脒基水解酶 60KU/L肌氨酸氧化酶 17KU/L1.2.2试剂 2(R2)(液体)肌酐氨基水解酶 390KU/L4-氨基安替吡啉 900mg/L过氧化物酶 20KU/L1.2.3校准品(液体)水基质、肌酐,目标浓度:442μmol/L:400~480μmol/L。
(每批定值,值有批特异性,详见值单)2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂1(R1)应为淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.2试剂2(R2)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.3 校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 试剂空白吸光度在波长546nm(540nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤0.200。
2.3.准确度测定GBW09174,相对偏差应不超过±10%。
2.4分析灵敏度浓度为100μmol/L的肌酐所引起的吸光度差值(△A)的绝对值应在0.016~0.029的范围内。
2.5重复性重复测试同一样本,变异系数(CV)应≤5%。
2.6批间差测定同一样本,批间差(R)应≤6%。
2.7线性范围在22,3000]μmol/L范围内,线性相关系数(r)应≥0.990;在(60,3000]μmol/L范围内,线性相对偏差应不超过±10%;在[22,60]μmol/L范围内,线性绝对偏差应不超过±6μmol/L。
肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)产品技术要求百奥泰康

肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)适用范围:该试剂盒用于体外定量测定人血清中肌酐的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1:肌酸脒基水解酶≥10.0KU/L肌氨酸氧化酶≥10.0KU/LTOPS ≥1.4mmol/L试剂2:过氧化物酶(POD)≥20.0KU/L肌酐酰胺基水解酶≥200.0KU/L4-氨基安替比林≥1.5mmol/L1.2.2校准品组成肌酐目标浓度:200μmol/L该校准品为水基质液体校准品2.1 外观a) R1应为无色至淡黄色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为无色溶液,无混浊,无未溶解物。
2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.300。
2.4 分析灵敏度CRE试剂盒测定浓度100μmol/L的被测物时,吸光度变化率(ΔA/min)应不小于0.008。
2.5 准确度测试参考物质,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.7 线性在[10,8000]μmol/L范围内,CRE试剂盒的线性相关系数r应不低于0.9900;在[10,70]范围内绝对偏差应不超过7μmol/L,在(70,8000]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供肌酐校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家标准物质GBW09175。
2.9稳定性原包装的CRE试剂盒在2℃~8℃避光保存,有效期为18个月。
试剂在规定的条件下保存到有效期末,产品的性能应符合2.3、2.4、2.5、2.6.1和2.7的要求。
尿中肌酐的肌氨酸氧化酶法

尿中肌酐的肌氨酸氧化酶法1 原理尿液中的肌酐在肌酐酶的催化作用下水解生成肌酸,随后肌酸在肌酸酶的催化下水解产生肌氨酸和尿素。
肌氨酸在肌氨酸氧化酶的催化下氧化成甘氨酸、甲醛和过氧化氢,最后偶联Trinder反应形成的醌亚胺色素与肌酐的浓度成正比,可用比色测定。
2 仪器2.1尿样收集瓶,50mL。
2.2精密分析天平,感量0.01mg。
2.3生化分析仪。
2.4移液管,1mL、5mL。
2.5容量瓶,100mL。
3 试剂3.1实验用水:去离子水。
3.2肌酐检测试剂盒(肌氨酸氧化酶法):一般含有肌酸酶和肌氨酸氧化酶等反应酶和4-氨基安替比林等显色剂。
在30µmol/L~1250µmol/L线性范围内,试剂的线性相关系数应满足r ≥0.990。
3.3盐酸溶液(0.1mol/L):取4.2mL盐酸,加水稀释至500mL。
3.4肌酐(C4H7N3O),优级纯。
3.5 肌酐标准贮备溶液[ρ(C4H7N3O)=10.00g/L]:准确称取1.00g肌酐(经110℃干燥2h),室温下盐酸溶液溶解,用移液管移入100mL容量瓶中,并用盐酸溶液定容至刻度。
该贮备液置于冰箱4℃冷藏可稳定保存3个月。
3.6肌酐标准应用溶液[ρ(C4H7N3O)=1.00g/L]:将肌酐标准贮备溶液用纯水稀释至1.00g/L。
该应用液置于冰箱4℃冷藏可稳定保存1个月。
4 样品的采集、运输和保存依据《职业卫生生物监测总则》进行样品采集。
将采集后的尿液在室温下运输。
4℃条件下保存样品有效期为14d。
5 分析步骤5.1参数设置启动生化分析仪,放置肌酐检测试剂盒,按照试剂盒说明书相关规定设定反应温度、反应时间和仪器测定参数。
5.2仪器校正将肌酐标准应用溶液[ρ(C4H7N3O)=1.00g/L]按照肌酐检测试剂盒要求,用水稀释至合适倍数后,放入生化分析仪进行分析,得到稀释后肌酐测定浓度(µmol/L)。
按式(1)计算校正系数。
酶法测定血清肌酐(Crea)-标准操作程序

三级文件酶法测定血清肌酐(Crea)标准操作程序文件编号:版本/状态:A/1第2页共3页生效日期:目的:规范酶法测定血清肌酐(Crea)标准操作规程。
范围:适用于酶法测定血清肌酐(Crea)的标准操作。
职责:生化部检验人员对本规程的实施负责。
规程:1 测定方法:采用酶比色法,定量测定血清中血清肌酐(Crea)的含量。
2 测定原理肌酐酶肌酐+ H2O 尿素 + 肌氨酸肌氨酸氧化酶肌氨酸 + H2O + O2甘氨酸 + HCHO + H2O2过氧化物酶H2O2 + 4-氨基氨替比林 + HTIB 色素原 + H2O + HI 反应形成的色素原的密度与肌酐的浓度呈正比。
3 标本血清,肝素或EDTA抗凝血浆(不要用肝素铵的抗凝剂),处理方法见标本准备。
稳定性: 2 - 8℃ 7天-20℃长期储存4 试剂4.1试剂来源:ROCHE配套试剂(详见试剂说明书)。
贮存条件及稳定性:未打开试剂盒:2-8℃储存至效期末R1:打开后机上稳定28天R2:打开后机上稳定28天准备:直接使用。
4.2 校准物来源:ROCHE配套校准物, 符合SRM916a标准,具体如下:S1:生理盐水S2:C.f.a.s贮存条件:校准物在2-8℃保存可保存至有效期。
准备:直接使用。
定标频率:A试剂盒在仪器上放置42天后B 试剂批号更换后C 由质控结果决定4.3 质控物来源:Precinorm (罗氏正常值质控)Precipath (罗氏病理值质控)其它适合的质控品贮存条件:置2-8℃冰箱至有效期。
准备:直接使用。
三级文件酶法测定血清肌酐(Crea)标准操作程序文件编号:版本/状态:A/1第3页共3页生效日期:质控间隔时间及限制:应视不同地区及各自实验室情况而定。
质控结果应在限定的范围之内,如果超出范围,实验室应根据情况采取措施。
5 上机操作见GS200全自动生化分析仪操作维护保养程序。
6 参考范围男性:0.67-1.17mg/dl(59-104umol/l)女性:0.51-0.95mg/dl(45-84umol/l)7 性能指标本法线性范围为血液:0.03-30mg/dl,不准确度允许范围X±15%,不精密度CV=2.3%,灵敏度为:0.03mg/dl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肌酐测定标准操作程序
1. 摘要
肌酐试剂盒适用于体外临床检验,用于测定人血清或尿液中肌酐的含量。
2. 适用范围
程序适用于AU5811自动生化分析仪检测血清尿液中肌酐的浓度。
3. 职责
使用AU5811自动生化分析仪进行测定CREA 浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法
上海科华生物工程股份有限公司生产的肌酐(CREA )试剂盒采用的是肌氨酸氧化酶法。
5. 原理
上海科华生物工程股份有限公司的肌酐 (肌氨酸氧化酶法)试剂盒的测定原理如下:
O H N N O H O H HCHO O O H O H O H 2222
222224---42+−−−→−-+-+++−−−−→−+++−−−−→−+−−−−→−+醌亚胺间甲苯胺磺丙基乙基氨基安替比林甘氨酸肌氨酸尿素
肌氨酸肌酸肌酸
肌酐过氧化物酶肌氨酸氧化酶肌酸脒基水解酶肌酐氨基水解酶 肌酐在肌酐氨基水解酶的作用下水解成肌酸,肌酸在肌酸脒基水解酶的作用下生成肌氨酸和尿素,其中产物肌氨酸在肌氨酸氧化酶的作用下生成甘氨酸、过氧化氢和甲醛。
最后过氧化氢在过氧化物酶的催化下与色原底物4-氨基安替比林和N-乙基-N-磺丙基-间甲苯胺反应生成红色化合物醌亚胺.
由于醌亚胺在波长546nm 处有最大吸收峰,所以在一定底物浓度范围内, 546nm 处吸光度的变化值与样本中肌酐的含量成正比.
6. 仪器
AU5811自动生化分析仪
7. 试剂
7.1 试剂来源:上海科华生物工程股份有限公司提供
7.2 试剂瓶内主要成分:肌酸脒基水解酶、肌氨酸氧化酶、抗坏血酸氧化酶、过氧化物酶、
ESPMT 、肌酐胺基水解酶、4-氨基安替比林
7.3 试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为
12个月。
试剂不可冰冻。
7.4 试剂准备:试剂为即用式。
8.标准品和质量控制
8.1校准程序:使用科华公司提供的标准品对自动分析仪进行校准。
按照公司标准品使
用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品响应量通过合适的数学模型绘制校准曲线。
8.2质控品:罗氏公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:按《Westgard多规则质控方法测定标准操作程序》
8.5室间质评:分别参加河北省室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。
9.标本
9.1 样本为新鲜无溶血现象的血清或24h尿液。
24h尿液样本应按1:20用生理盐水进行
机外稀释;也可在仪器参数中选择尿液样本参数,让仪器自动稀释。
样本于4℃保存,可稳定7天。
9.2标本拒收:由实验室人员核收送来标本,如有溶血、已被污染、标识不清或与申请
单不符状况,一律要求重新留取标本。
9.3标本处理:收集编号后离心获取血清/血浆以备检测使用。
10.测定程序
10.1分析参数:详见参数表。
10.2操作步骤:签收样本→离心→上机检测→审核报告→签发报告→标本保存。
10.3获取结果:在AU5811仪器上或AU5811传送的中文系统电脑上查找相应结果。
10.4结果报告:对检验后的结果进行审核,系统分析,判断结果的可报告性。
可报告的
结果直接发报告,对不可报告结果进行复检后发报告。
11.计算
标准品校准项目后,测定室内质控,质控结果符合质控要求后方可测定样本。
无需手工计算,每个标本的结果自动打印
12.废液处理
参阅检验科《安全手册》废液处理标准规程处理。
13.操作性能
13.1可报告范围:本法对CREA检测范围为0~8840μmol/L。
13.2特异性/干扰:当样品中VC≤1g /L,胆红素浓度≤684mg/L,血红蛋白浓度≤5.00g/L,
甘油三酯≤20mmol时对测定结果的影响可忽略。
13.3灵敏度:测定本试剂盒内所附标准液(265μmol/l), 其吸光度应在0.050~0.20A之间。
13.4精密度:批内:CV≤6%。
批间相对极差:≤6%。
14.注意事项
14.1试剂盒仅用于体外诊断。
测定结果仅作为相关疾病的临床诊断依据。
14.2 血清等标本有些可能含有感染性成份,因此应以具有感染危险性而充分注意操作。
14.3 试剂盒中含有防腐剂叠氮钠,切勿吞咽,避免与皮肤及粘膜接触。
如不慎接触,
应用大量清水冲洗。
如误服,应立即上医院诊治。
15.参考值
血清和血浆:男:70~115μmol/L (0.8~1.3mg/dl);
女:44~80μmol/L(0.5~0.9mg/dl);
24h尿液:男:7000~18000μmol/24h;
女:5300~16000μmol/24h;
各实验室应建立自己的参考值范围。
16.临床意义
本试剂盒适用于体外临床检验,用于测定人血清或尿液中肌酐的含量。
人体中的肌酐经肾小球滤过后不被肾小管重吸收,通过肾小管排泄,在肾脏疾病初期,血清肌酐值通常不升高,直至肾脏实质性损害,血清肌酐值才增高。
所以,血肌酐测定对诊断晚期肾脏病临床意义较大。
血清肌酐水平随人的年龄,体重和性别而变化。
有时它在肌肉块少,恶病质的病人,截肢者和老年人中的水平较低。
血清肌酐水平正常并不排除肾功能受损。
17.支持性文件
17.1AU5811自动生化分析仪使用说明书。
17.2 AU5811自动生化分析仪分析参数。
17.3上海科华生物工程股份有限公司提供的试剂说明书。
18.参考文献
18.1斋藤正行等,临床化学分析Ⅱ(东京化学同人)53(1968)18. 2 安原正善等,临床检验仪器试剂,8(5),1183(1985).
18. 3 小西八郎等,临床检验自动化学杂志.。
