2022年致畸试验标准
国家癌症中心发布:2022年全国癌症报告

国家癌症中心发布:2022年全国癌症报告来源:华基因2022年2月,国家癌症中心发布了最新一期的全国癌症统计数据。
全国肿瘤登记中心负责全国肿瘤登记数据收集、质量控制、汇总、分析及发布工作。
(由于全国肿瘤登记中心的数据一般滞后,本次报告发布数据为全国肿瘤登记中心收集汇总全国肿瘤登记处2016年登记资料。
)研究基于国家癌症中心最新数据,从全国682个癌症监测点中遴选487个高质量监测点,覆盖人口达3.8亿,详尽阐述了2016年中国癌症疾病负担情况。
与2015年相比,上报统计数据的监测点数量增加181个,高质量监测点增加119个,表明我国的肿瘤登记工作覆盖面逐步推进,数据质量和规范程度进一步提高,为国家卫生政策制定提供更有力的科学依据。
01.我国癌症发病情况基本情况新发病例:406.4万世标发病率:186.46/10万男性高于女性(207.03/10万 vs 168.14/10万)年龄差异男性高于女性:0~19岁、60岁以上女性高于男性:15~59岁峰值:男女癌症新发病例峰值均在60~79岁地域差异总体城市高于农村(189.7/10万 vs 176.2/10万)城市高于农村:肺癌、乳腺癌、结直肠癌、前列腺癌农村高于城市:胃癌、肝癌、宫颈癌、食管癌02.2016年我国癌症死亡情况基本情况总死亡人数:241.4万世标死亡率:105.19/10万男性高于女性(138.14/10万 vs 73.95/10万)性别差异所有年龄段:男性死亡人数均高于女性死亡率女性高于男性:胆囊癌、甲状腺癌死亡率男性高于女性:其他所有癌种年龄差异男性高于女性:0~14岁、60岁以上女性高于男性:15~59岁死亡率最高:60~79岁地域差异总体农村高于城市(106.1/10万 vs 102.8/10万)城市高于农村:肺癌、结直肠癌、乳腺癌、前列腺癌农村高于城市:肝癌、胃癌、食管癌、宫颈癌03.2000—2016年中国癌症发病率与死亡率趋势发病趋势上升:男性:前列腺癌、结直肠癌、白血病、脑瘤、胰腺癌和膀胱癌女性:甲状腺癌、宫颈癌、子宫癌、乳腺癌、脑瘤、肺癌、结直肠癌下降:男性和女性:食管癌、胃癌、肝癌死亡趋势上升:男性:前列腺癌、结直肠癌、胰腺癌、白血病女性:宫颈癌、甲状腺癌、乳腺癌下降:男性和女性:食管癌、胃癌、肝癌、肺癌男性和女性部分癌症2000—2016年间发病率和死亡率变化趋势。
湖北省禁止非医学需要鉴定胎儿性别和选择性终止妊娠的规定(2022年修正)

湖北省禁止非医学需要鉴定胎儿性别和选择性终止妊娠的规定(2022年修正)文章属性•【制定机关】湖北省人民政府•【公布日期】2022.03.23•【字号】湖北省人民政府令第423号•【施行日期】2022.03.23•【效力等级】地方政府规章•【时效性】现行有效•【主题分类】妇幼健康正文湖北省禁止非医学需要鉴定胎儿性别和选择性终止妊娠的规定(2001年12月10日湖北省人民政府令第218号公布根据2014年12月31日湖北省人民政府令第378号《湖北省人民政府关于规章清理结果的决定》第一次修正根据2022年3月23日《湖北省人民政府关于修改和废止涉及行政处罚内容的省政府规章的决定》第二次修正)第一条为了控制人口数量、提高人口素质,保持正常出生人口性别构成,促进人口与经济、社会的可持续发展,根据有关法律、法规,制定本规定。
第二条全社会应提高对保持正常出生人口性别比重要性的认识,破除旧的生育观念,自觉遵守禁止非医学需要鉴定胎儿性别和选择性终止妊娠的规定。
第三条各级人民政府应将保持正常出生人口性别比纳入人口与计划生育目标管理责任制,组织协调有关部门共同做好禁止非医学需要鉴定胎儿性别和选择性终止妊娠的工作。
县(含县级市、省辖市的区,下同)以上卫生健康行政部门和市场监督管理部门,按照各自职责,对本行政区域内的胎儿性别鉴定和终止妊娠工作实施监督管理。
人力资源和社会保障部门应当配合卫生健康行政部门和市场监督管理部门依法查处违法鉴定胎儿性别和选择性终止妊娠行为。
第四条省卫生健康行政部门应制定使用超声诊断仪和染色体检测专用设备的管理制度以及施行终止妊娠手术的管理制度;省市场监督管理部门应制定用于终止妊娠药物管理制度,并定期组织检查。
计划生育技术服务机构、医疗保健机构和药品经营者应当严格执行管理制度,并加强对有关人员的教育和管理。
第五条计划生育技术服务机构、医疗保健机构以及个体诊所,应将所购超声诊断仪的类型、数量报县卫生健康行政部门备案。
2022年版化妆品安全技术规范的主要修订内容
Lauroyl Arginate HCL) ,“化妆品中最大允许浓度 0.4%使用
范围和限制条件:禁用于唇部、喷雾和气雾产品;标签上必须标 印的使用条件和注意事项:避免接触眼睛,若发生需要采取相应
措施”。“三氯叔丁醇”、“脱氢乙酸及其盐类”、“戊二醛”
的使用范围和限制条件从“禁用于喷雾产品”修改为“禁用于喷
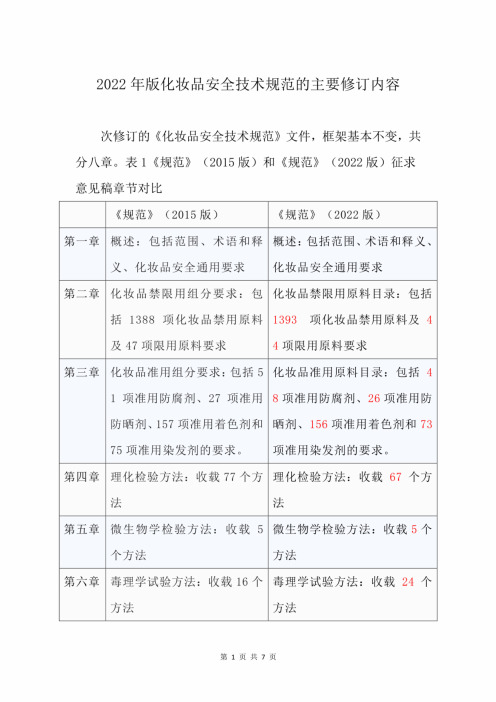
2022 年版化妆品安全技术规范的主要修订内容
次修订的《化妆品安全技术规范》文件,框架基本不变,共 分八章。表 1《规范》(2015 版)和《规范》(2022 版)征求
意见稿章节对比 《规范》 (2015 版)
《规范》(2022 版)
第一章 概述:包括范围 、 术语和释 概述:包括范围、术语和释义、
局部淋巴结试验:DA” 、“局部淋巴结试验:BrdU-ELISA” 、
直接多肽反应试验”、“体外 3T3 中性红摄取光毒性试验”、
皮肤光变态反应试验”、“体外哺乳类细胞微核试验”。修订
检验方法 2 项,即国家药监局 2019 年第 12 号公告中的“细
菌回复突变试验”和“致畸试验”。此外,结合注册备案检验工 作中发现的问题,对部分试验要求进行明确,如细化预试验要求、 明确剂量设计、数据处理和结果判断要求等。
第 6 页 共7页
( 七)人体安全性检验方法化妆品人体检验的基本原则,从“化 妆品人体检验之前应先完成必要的毒理学检验并出具书面证明, 毒理学试验不合格的样品不再进行人体检验毒理学试验不合格 的样品不再进行人体检验”修改为“化妆品人体检验之前应先完 成必要的产品安全性评价并出具书面证明,安全性评价不合格的 产品不再进行人体检验”。且根据《条例》、《化妆品功效宣称 评价规范》等要求,删除了方法中适用产品类别的描述。根据医 学研究进展及注册备案检验工作经验,调整完善了受试者的入选 排除要求、不同剂型产品的取样方式等内容。
天冬对大鼠的亚慢性和致畸毒性研究

Vol.36No.2Mar.2024天冬对大鼠的亚慢性和致畸毒性研究夏祺悦1,蒋勇1,王东霞2,李彬3,* (1.四川省疾病预防控制中心,四川成都610041;2.绵阳市疾病预防控制中心,四川绵阳621000;3.广西壮族自治区疾病预防控制中心,广西南宁530028)The subchronic toxicityand teratogenicity ofRadix Asparagi in rats XIA Qiyue1,JIANG Yong1,WANG Dongxia2,LI Bin3,* (1.Sichuan Center for Disease Prevention and Control,Chengdu610041, Sichuan;2.Mianyang Center for Disease Prevention and Control,Mianyang 621000,Sichuan;3.Guangxi Center for Disease Prevention and Control,Nanning530028,Guangxi,China)收稿日期:2023-09-28;修订日期:2024-02-28【摘要】目的:研究天冬对大鼠经口重复给药的亚慢性毒性和致畸毒性。
方法:90天经口毒性试验采用SD大鼠80只,雌雄各半,体质量65.4~94.0g,拌饲法设2000、4000、8000mg/kg共3个剂量组和1个阴性对照组,连续给予受试物90天,观察动物一般状况,记录动物体质量、摄食量,计算食物利用率,并进行血液学、血生化及病理学检测,从而评价其亚慢性毒性。
传统致畸试验采用雌性SD孕鼠,剂量为1000、2000、4000mg/kg共3个剂量组,另设阴性对照组(蒸馏水),每组22只,经口灌胃给药,于孕第20天处死母体,检查受孕情况和胎仔发育,观察胎仔外观,检查骨骼及内脏,以评估致畸毒性。
结果:90天经口毒性试验中大鼠未出现中毒症状及死亡,试验组大鼠组织病理学检查未见毒性损伤作用。
致畸试验

致畸试验1 范围GB/T 15670的本部分规定了致畸试验的基本原则、方法和要求。
本部分适用于为农药登记而进行的致畸试验。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 14925 实验动物环境及设施3 术语和定义下列术语和定义适用于本文件。
3.1致畸性teratogenicity在胚胎发育期引起子代永久性结构和功能异常的化学物质的特性。
3.2母体毒性maternal toxicity引起亲代雌性妊娠动物直接或间接的健康损害效应。
4 试验目的检测妊娠动物接触受试物后引起的子代致畸可能性。
5 试验概述将性成熟期的雌性动物与雄性动物进行交配,将确认怀孕的雌性动物随机分配到各个剂量组,在妊娠动物的胚胎发育器官形成期给予受试物染毒,并在子代预期出生前将母体处死,取出子宫,检查吸收胎、活胎、死胎及胎仔的外观、内脏和骨骼畸形情况。
6 仪器与试剂6.1 仪器实验室常用设备、生物显微镜及体视显微镜、游标卡尺(百分尺)等。
6.2 试剂6.2.1 茜素红贮备液:茜素红饱和液(溶剂为50%乙酸)5.0 mL、甘油10.0 mL、1%水合氯醛60.0 mL 混合,放入棕色瓶中(适用于不剥皮法骨骼染色)。
6.2.2 茜素红应用液:取贮备液3 mL~5 mL,用1 g/100 mL~2 g/100 mL氢氧化钾液稀释至1000 mL,存于棕色瓶中。
6.2.3 茜素红溶液:茜素红0.1 g、氢氧化钾10 g、与蒸馏水1000 mL混合,临用前配制(适用于剥皮法骨骼染色)。
6.2.4 透明液A:甘油200 mL、氢氧化钾10 g,与蒸馏水790 mL混合。
6.2.5 透明液B:甘油与蒸馏水等量混合。
6.2.6 固定液(Bouins液):2,4,6-三硝基酚(苦味酸)饱和液75份、甲醛20份、与冰乙酸5份混合。
我国食品安全性毒理学评价的试验方法

一、《食品安全性毒理学评价程序(试行)》(GB15193.1-2003)
该程序规定了我国食品安全性毒理学评价的总体原则、程序、方法和结果判定,适用于拟用于食品的化学和生物物质,如食品添加剂、食品加工用微生物等。
该程序规定的试验方法包括:
* 急性毒性试验
* 蓄积毒性试验
* 亚慢性毒性试验
* 慢性毒性试验
* 致癌试验
* 生殖毒性试验
* 致突变试验
* 免疫毒性试验
二、《食品安全性毒理学评价方法标准》
该标准系列包括《细菌回复突变试验》、《哺乳动物红细胞微核试验》、《哺乳动物骨髓细胞染色体畸变试验》、《小鼠精原细胞或精母细胞染色体畸变试验》、《啮齿类动物显性致死试验》、《28天经口喂养试验》、《6个月经口喂养试验》、《12个月经口喂养试验》、《致癌试验》、《生殖发育毒性试验》等。
这些标准规定了我国食品安全性毒理学评价中常用的试验方法的具体要求,包括试验目的、试验动物、试验剂量、试验方法、试验评价等。
此外,国家食品药品监督管理总局还发布了《食品安全风险评估技术指导原则》(2022版),其中第4章“毒理学评估”对食品安全性毒理学评价的一般原则、方法和结果判定进行了详细说明。
智慧树答案卫生毒理学知到课后答案章节测试2022年

第一章1.毒物是()答案:在一定条件下,较小剂量即能对机体发生损害作用的物质2.经典的毒理学研究对象是()。
答案:各种化学物质3.常用的毒理学研究方法不包括()。
答案:人体试验4.随着生物技术和生物信息学的快速发展,毒理学正在发展的领域()。
答案:计算毒理学;表观遗传毒理学;毒理学替代法;转化毒理学5.现代毒理学主要包括描述毒理学、机制毒理学和管理毒理学。
()答案:对第二章1.在毒性大小的常用描述参数中,LOAEL指的是:()。
答案:在规定的暴露条件下,化学物引起机体(人或实验动物)某种有害作用的、已被观测到的最低剂量或浓度。
2.有害作用的质反应剂量反应关系多呈S型曲线,原因在于不同个体对外源性化学物的( )。
答案:易感性差异3.以下对于毒作用带的正确描述是()答案:慢性毒作用带值大,发生慢性中毒的危险性大;半数致死剂量与急性阈值的比值为急性毒作用带 ;急性阈剂量与慢性阈剂量的比值为慢性毒作用带4.毒性是毒物的一种固有不变的内在属性。
()答案:对5.对某化学毒物进行毒性试验,测定结果为:LD50=896 mg/kg,LD0=152mg/kg,LD100=1664 mg/kg,Limac=64 mg/kg,Limch=8 mg/kg,其慢性毒作用带的数值为()。
答案:8第三章1.pKa为4.2的有机酸(苯甲酸)在消化道中吸收最好的部位是()。
答案:胃2.毒物代谢的两重性是指()。
答案:经过代谢,毒性可增加(代谢活化)或降低(代谢解毒)3.化学毒物生物转化的Ⅰ相反应,不包括下列哪一种反应?()答案:甲基化4.生物转化酶的非竞争性抑制包括以下哪些情况?()答案:破坏酶;减少酶的合成;与酶的活性中心发生可逆或不可逆的结合。
;变构作用5.细胞色素P450酶系主要存在于微粒体中。
()答案:对第四章1.PKa值对弱酸性或弱碱性有机化合物,只有在pH条件适宜,非离子型浓度达到最高才易吸收,发挥毒效应最大。
是由于哪种因素的影响()?答案:电离度与毒效应2.外源化学物联合作用的类型有()。
致畸试验-精品文档

数据整理和分析
对收集到的数据进行整理和分析, 比较不同剂量组之间的差异,并评 估受试物对胚胎或胎儿的影响程度 。
结果评估与报告
根据分析结果,撰写致畸试验报告 ,对受试物对胚胎或胎儿的影响进 行评估,并提出相应的建议和措施 。
安全防护与质量控制
实验室安全保障
确保实验室具备良好的通风、防 火、防爆等安全设施,并严格按 照实验室安全规范进行操作和管
评价标准
制定评价致畸物的标准,如剂量、暴露时间、效应等指标,为致畸物的风险评估提供依据。
05
致畸试验的应用与展望
医学研究领域的应用
致畸试验在医学研究领域的应用
致畸试验是一种用于评估药物、化学物质或生物因子对胚胎或胎儿发育潜在影响的试验方 法。在医学研究中,致畸试验为临床前研究的重要组成部分,为药物研发、毒理学评价以 及环境科学领域的研究提供了重要的数据支持。
提高试验质量和可靠性
致畸试验的可靠性和准确性对于风险评估和决策具有重要 意义。未来需要不断提高致畸试验的质量和可靠性,通过 改进试验方法、规范操作流程、加强数据监管等方式,提 高试验数据的准确性和可靠性。
06
参考文献
参考文献
要点一
总结词
该文献研究了致畸试验在评估药物安 全性中的重要性。
要点二
详细描述
02
致畸试验的目的是检测受试物对 胚胎或胎儿的损害作用,从而评 估其风险性和安全性。
试验设计原则
致畸试验应遵循随机、对照、重复和 量效的原则。
试验设计时需考虑受试物浓度、染毒 时间、动物种属和性别等因素。
染毒方法及实施步骤
染毒方法包括经口染毒、经皮染毒、经呼吸道染毒等,根据受试物性质和试验目 的选择合适的染毒途径。
益阳2022年卫生系统招聘考试真题及答案解析1

益阳2022年卫生系统招聘考试真题及答案解析【word版】1:孟鲁司特为单项选择题:A、M胆碱受体拮抗剂B、白三烯受体拮抗剂C、白三烯受体感动剂D、磷酸二酯酶抑制剂E、β2受体感动剂2:关于冠心病的预防和患者教育,下列说法不正确的是单项选择题:A、宜低盐、低脂饮食B、LDL-C是血脂特别患者降脂治疗的首要目标C、糖耐量特别患者,经生活干预6个月仍无效者,即口服二甲双胍D、冠心病患者需长期口服阿司匹林等抗血小板药物E、一旦怀疑急性冠心病发作,马上嚼服阿司匹林600mg3:雷公藤制剂的不良反应症状有多项选择题A、药物性肝炎B、肾功能不全C、粒细胞削减D、白细胞削减E、血小板削减4:对乙酰氨基酚用于退热的药物应用特点是多项选择题A、可作为退热药的首选B、成人一日用量不宜超过4gC、弊端是大剂量对肝脏有损害D、尤其相宜老年人和儿童服用E、每隔4~6小时重复用药1次5:下列哪项不是消渴常见的病因单项选择题:A、素体阴虚B、饮食不节C、情志失调D、感受热毒E、劳欲过度6:下列不属予青少年健康危害行为的是()。
单项选择题:A、尝试吸烟B、网络成瘾C、意外妊娠D、缺乏户外活动E、合理支配作息时间7:急性血源性骨髓炎晚期特点是单项选择题:A、骨质破坏B、死骨形成C、形成局限性脓肿D、新骨形成和骨性死腔E、骨坏死并化脓8:环境卫生学讨论的范畴不包括下列哪项()。
单项选择题:A、环境质量评价B、公共场所卫生C、城乡规划卫生D、环境污染治理E、化妆品卫生9:引起肝损伤的含铅类中药有多项选择题A、雄黄B、朱砂C、红粉D、密陀僧E、铅丹10:患者女性,48岁,咳逆阵作.面赤咽干,痰滞咽喉,咳之赡出,咳引胸胁痛,舌苔薄黄少津,脉象弦数。
治法宜采纳单项选择题:A、清肺平肝,顺气降火B、养阴清肝,化痰止咳C、清肺化痰,宜肃肺气D、疏风清热,润燥止咳E、疏风清热,肃肺化痰11:股肿多发生于单项选择题:A、上肢静脉B、下肢静脉C、胸壁静脉D、颈静脉E、面部静脉12:以下各穴除哪项外均为募穴单项选择题:A、京门B、大包C、章门D、期门E、石门13:会阴侧切缝合术的产妇。
生殖器官畸形及诊治共识_2022年学习资料

4ESHRE定义的双角子宫和纵隔子宫是,若宫底-浆膜层内陷<宫壁厚度的50%且宫腔内隔厚度>宫壁厚-度的5 %,定为纵隔子宫;若宫底内陷>宫壁厚度的-50%,则为双角子宫[1]-推荐使用ESHRE的定义鉴别纵隔子宫 双角子宫-<50%->50%
五、Robert子宫、斜隔子宫、盲角子宫-建议使用:Robert子宫Robert uterus-·子宫分隔 于宫腔一侧,将该侧宫腔完全封闭,使之-成为与阴道或对侧宫腔不相通的盲腔
3.子宫颈外口闭塞external cervical os-obstruction -建议“子宫颈外口”替 “子宫颈”,部位更清晰;-用“闭塞”与“闭锁”区分,以避免歧义-C
。4.条索状子宫颈cervical cord:-●-阴道检查不可见但可触及子宫颈阴道部结构-D1-D2-D
·子宫颈残迹fragment of cervix.-E1-E2
月形子8-狄隔子多-d<1 cm-d>1 cm-c>90-a<90
·3.双角子宫bicornuate uterus与纵隔子宫的鉴别:-目前文献报道的两者鉴别诊断的标准不统一 大致有-以下几种:-1宫底浆膜层凹陷不同:双角子宫凹陷>1Cm,而-纵隔子宫凹陷<1cm-2两者内膜均呈分 状,双角子宫分开距离>4Cm-纵隔子宫分开距离<4cm
3Troiano和McCarthy[2]提出,两侧宫角部内膜-顶点的连线若距宫底浆膜层的距离<5mm或穿过 底-图3A则认为是双角子宫;若这条线距宫底浆膜层-的距离>5mm认为是纵隔子宫,无论宫底是圆顶状、-平坦或 有切迹而成分离状-微信号-3B-图3 Troiano和McCarthy[2]建议的双角子宫与纵隔子宫的区别 示3A、3B:双角子宫3C:纵隔子宫
2022年粮农食品安全评价考试模拟试题18

2022年粮农食品安全评价考试模拟试题18姓名年级学号题型选择题填空题解答题判断题计算题附加题总分得分评卷人得分一、单选题1.()是化学物质毒性的决定因素。
A.剂量√B.接触时间C.浓度D.机体的状态2.()直接决定了化学物质所致机体损伤的性质与强度。
A.剂量B.阈剂量C.靶剂量√D.半数致死量3.比较下列遗传物质,()最小?A.染色体B.染色质C.基因√D.DNA4.毒效应的强度主要取决于()在其作用位点的浓度及持续时间。
A.毒物B.终毒物√C.靶毒物D.代谢物5.化学毒物贮存在下列哪个器官对机体的毒性最小?()A.肝脏B.肾脏C.骨骼D.脂肪√6.化学物质的结合产物主要排出机体的途径是()。
A.肾脏B.呼吸道C.胆汁√D.汗7.化学物质毒性的具体表现是()。
A.致癌性B.致畸性C.急性毒性D.损害作用√8.机体对化学毒物的处置可简单的分成相互有关的吸收、分布、代谢及排泄四个过程。
属于生物转化的是哪个过程?()A.吸收B.分布C.代谢√D.排泄9.机体解毒可以有几种不同的途径,主要取决于有毒物质的()。
A.化学性质√B.物理性质C.生物性质D.抵抗力10.急性毒作用带值与死亡危险性的关系是()。
A.急性毒作用带值越大,死亡危险性越大B.急性毒作用带值越大,死亡危险性越小√C.二者无关D.急性毒作用带值越小,死亡危险性越小11.食品安全性评价的研究范围包括()。
A.食物B.药物C.环境污染物D.机体成分√12.食品毒理是食品安全性评价的重要组成部分,食品毒理的主要研究领域不包括()。
A.描述毒理B.机制毒理C.预防毒理√D.管理毒理13.外源化学物在体内的生物转化过程中,Ⅱ相反应指的是()。
A.氧化B.还原C.分解D.结合√14.下列哪个气象条件可增加经皮肤接触毒物的毒性?()A.温度高√B.温度低C.湿度小D.压力小15.下列途径中,哪项毒物吸收的速度最快()?A.注射√B.经消化道C.经呼吸道D.经皮肤16.下列吸收方式中,吸收速度最快的是()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
致畸试验Teratogenicity Test1 范围本标准规定了动物致畸试验的根本原则,试验方法和技术要求。
本标准用于检测化装品原料的致畸作用。
2 术语和定义2.1 致畸性teratogenicity化学物质在器官发生期间引起子代X性结构异常的特性。
2.2 母体毒性maternal toxicity化学物质引起亲代雌性妊娠动物直接或间接的健康损害效应,表现为增重减少、功能异常、中毒体征,甚至死亡。
3 试验原理与目的母体在孕期受到可通过胎盘屏障的某种有害物质作用,影响胚胎的器官分化与发育,导致结构异常,出现胎仔畸形。
在胚胎发育的器官形成期给予妊娠动物化学物质,可检测该化学物质对胎仔的致畸作用。
检测妊娠动物接触化装品原料后引起胎仔畸形的可能性,预测其对人体可能的致畸性。
4 仪器和试剂4.1 仪器和器材实验室常用设备、生物显微镜、体视显微镜、游标卡尺、电子天平。
4.2 主要试剂4.2.1 甲醛、冰乙酸、2,4,6-三硝基酚、氢氧化钾、甘油、水合氯醛、茜素红。
4.2.2 茜素红储藏液:以50% 乙酸为溶剂的茜素红饱和液5.0mL,甘油10.0mL,1%水合氯醛60.0mL混合,存于棕色瓶中。
4.2.3 茜素红应用液:取储藏液3mL~5mL,用10g/L~20g/L氢氧化钾液稀释至1000mL,存于棕色瓶中。
4.2.4 茜素红溶液:茜素红0.1g,氢氧化钾10g,蒸馏水1000 mL,临用时配制〔剥皮法骨骼染色法〕。
4.2.5 透明液A:甘油200mL,氢氧化钾10g,蒸馏水790mL 混合。
4.2.6 透明液B:甘油与蒸馏水等体积混合。
4.2.7 固定液〔Bouins液〕:2,4,6-三硝基酚〔苦味酸饱和液〕75份、40 %甲醛20份、冰乙酸5份。
5 试验方法5.1 受试物受试物应使用原始样品,假设不能使用原始样品,应对受试物进行适当处理。
5.2 实验动物和喂养环境5.2.1 动物选择:啮齿动物首选大鼠,非啮齿类动物首选家兔。
假设选其他物种应给出理由。
选用健康、性成熟的雄性动物和未经交配的雌性动物,试验开始时动物体重的差异不应超过平均体重的±20%,所用动物应注明种类、品系、性别、体重和周龄。
5.2.2 动物数量:性成熟的雄鼠和雌鼠通常按1:1或1:2比例合笼交配,如果5d内未交配,应更换雄鼠。
为了获得足够的胎仔来评价其致畸作用,大鼠每个剂量水平的怀孕动物数不少于16只,家兔每个剂量水平的怀孕动物数不少于12只。
5.2.3 动物的打算和喂养:实验动物及实验动物房应符合国家相应标准和规定。
实验动物在试验前应至少进行3d~5d 的环境适应和检疫观察,试验期间动物自由饮水和摄食,妊娠动物应单笼喂养。
5.3 剂量和分组试验至少设3个剂量组,同时设溶剂对比组,溶剂对比组除不给受试物外,其余处理均同剂量组。
必要时设阳性对比组,常用经口给予的阳性对比物为敌枯双、五氯酚钠、阿司匹林及维生素A等,或者用环磷酰胺于孕第12d腹腔注射1次。
曾用阳性物开展过致畸试验、并在所用实验动物种系有阳性结果发觉,试验可略去设置阳性对比组。
高剂量组原则上应使局部动物出现某些发育毒性和〔或〕母体毒性,如体重轻度减轻等,但不至于引起死亡或严峻疾病,如果母体动物有死亡发生,应不超过母体动物数量的10%。
低剂量组不应出现任何观察到的母体毒性或发育毒性作用。
建议递减剂量系列的组间距2倍~4倍比拟适宜,当组间差距较大时〔如超过10倍〕加设一个试验组。
试验剂量的设计参考急性毒性试验剂量、28天经口毒性试验、90天经口毒性试验剂量和人体实际摄入量进行。
对于能求出LD50的受试物,依据LD50值和剂量-反响关系曲线斜率设计高剂量组的剂量。
对于求不出LD50的受试物,如果28天或90天经口毒性试验未观察到有害作用,以最大未观察到有害作用剂量作为高剂量;如果28天或90天经口毒性试验观察到有害作用,以最小观察到有害作用剂量为高剂量组,以下设2个剂量组。
设置剂量水平常还应参考受试物的其他毒理学资料。
5.4 试验步骤和观察指标5.4.1 “受孕动物〞的检出对于大鼠,雌、雄性动物同笼后,每日早晨对雌鼠检查阴栓〔或阴道涂片〕,查出阴栓〔或精zi〕,认为该动物已交配,当天作为“受孕〞零天。
对于家兔,雌兔和雄兔合笼后阴道涂片检查到精zi当日作为“受孕〞零天。
检出的“受孕动物〞按随机分组,并称重和编号。
受试物的给予途径受试物通常经口灌胃给予,假设选用其他途径应说明理由。
通常,在器官形成期给予受试物(大鼠孕期6d~15d,家兔孕期6d~18d)。
受试物灌胃给予时,要将受试物溶化或悬浮于适宜的溶剂中,首选溶剂为水,不溶于水的受试物可使用植物油〔如玉米油、橄榄油等〕,不溶于水或油的受试物亦可使用羧甲基纤维素、淀粉等配成混悬液或糊状物等。
受试物应新奇配制,有资料说明其溶液或混悬液储存稳定者除外。
应每日在同一时间灌胃一次,并依据母体体重调整灌胃体积。
灌胃体积一般为10mL/kg体重,如为水溶液时,最大灌胃体积可达20mL/kg体重,如为油性液体,灌胃体积应不超过4mL/kg 体重;各组灌胃体积应一致。
5.4.3 母体观察每日对动物进行临床观察,包含皮肤、被毛、眼睛、黏膜、呼吸、神经行为、四肢活动等情况,及时记录各种中毒体征,包含发生时间、表现程度和延续时间,发觉虚弱或频死的动物应进行隔离或处死,母体有流产或早产征兆应及时处死并解剖检查。
在受孕第0d、给予受试物第1d、给予受试物期间每3d及处死当日称母体体重。
假设通过饮水途径给予受试物,还应记录饮水量。
5.4.4 受孕母体处死和一般检查分娩前1d〔一般大鼠为孕第20d,家兔为孕第28d〕处死母体。
剖腹检查亲代受孕情况和胎体发育。
迅速取出子宫,称子宫连胎重,以得出妊娠动物的净增重。
记录黄体数、早死胎数、晚死胎数、活胎数及着床数。
处死时对全部妊娠动物进行尸体解剖和肉眼检查,保存肉眼发觉有改变的脏器,以便于进行组织学检查,同时保存足够对比组的相应脏器以供比拟。
5.4.5 活胎鼠检查逐一记录胎鼠性别、体重、体长、尾长、检查胎鼠外观有无异常。
致畸试验胎鼠外观常见检查工程见表1。
表1 致畸试验胎鼠外观检查工程5.4.6 胎鼠骨骼标本的制作与检查骨骼标本制作方法一:将每窝1/2的活胎鼠放入95%〔V/V〕乙醇中固定2周~3周,取出胎仔流水冲洗数分钟后放入10g/L~20g/L的氢氧化钾溶液内〔至少5倍于胎仔体积〕8h~72h,透明后放入茜素红应用液中染色6h~48h,并轻摇1次/d~2次/d,至头骨染红为宜。
再放入透明液A中1d~2d,放入透明液B中2d~3d,待骨骼染红而软组织根本褪色后,可将标本放在甘油中保存。
骨骼标本制作方法二〔剥皮法〕:也可将胎鼠剥皮、去内脏及脂肪后,放入茜素红溶液染色,当天摇动玻璃瓶2次~3次,待骨骼染成红色时为止。
将胎鼠放入透明液A中1d~2d,换到透明液B中2d~3d。
待胎鼠骨骼已染红,而软组织的紫红色根本褪色后,可将标本放在甘油中保存。
胎鼠骨骼检查:将标本放入小平皿中,用透射光源,在体视显微镜下作整体观察,然后逐渐检查骨骼。
测量头顶间骨及后头骨缺损情况,然后检查胸骨的数目、缺失或融合〔胸骨骨化中心为5个,剑突1块;骨化不全时首先缺第5胸骨、次为缺第2胸骨〕。
肋骨通常12对~13对,常见畸形有融合肋、分叉肋、波状肋、短肋、多肋〔常见14肋〕、缺肋、肋骨中断。
脊柱发育和椎体数目〔颈椎7个,胸椎12个~13个,腰椎5个~6个,底椎4个,尾椎3个~5个〕,有无融合、纵裂等。
最后检查四肢骨。
致畸试验胎鼠骨骼常见检查工程见表2。
表2 致畸试验胎鼠骨骼检查工程5.4.7 胎鼠内脏检查每窝的1/2活胎鼠放入Bouins液中,固定两周后作内脏检查。
先用自来水冲去固定液,将胎鼠仰放在石蜡板上,剪去四肢和尾,用刀片在头部横切或纵切5刀,再剖开胸腔和腹腔。
按不同部位的断面观察器官的大小、形状和相对位置。
正常切面见图。
图1 胎鼠头部示意图⑴经口从舌与两口角向枕部横切〔切面①〕,观察大脑、间脑、小脑、舌及颚裂。
⑵在眼前面作垂直纵切〔切面②〕,可观察鼻部。
⑶从头部垂直通过眼球中央作纵切〔切面③〕,可观察眼部。
⑷沿头部最大横位处穿过脑部作切面〔切面④〕,可观察脑室部。
以上切面的目的可分别观察舌裂、双叉舌、颚裂、眼球畸形、鼻畸形,脑和脑室异常。
⑸沿下颚水平通过颈部中部作横切(切面⑤),可观察气管、食管和延脑或脊髓。
以后自腹中线剪开胸、腹腔,依次检查心、肺、横膈膜、肝、胃、肠等脏器的大小、位置,查毕将其摘除,再检查肾脏、输尿管、膀胱、子宫或睾丸位置及发育情况。
然后将肾脏切开,观察有无肾盂积水与扩大。
必要时还需对心脏内部结构进行检查。
致畸试验胎鼠内脏常见检查工程见表3。
表3 致畸试验胎鼠内脏检查工程部位检查工程部位检查工程部位检查工程头部〔脊髓〕嗅球发育不全胸部主动脉弓腹部多囊肾侧脑室扩张食道闭锁马蹄肾第三脑室扩张气管狭窄肾积水无脑症无肺症肾缺失无眼球症多肺症膀胱缺失小眼球症肺叶融合睾丸缺失角膜缺损隔疝卵巢缺失单眼球气管食管瘘卵巢异位胸部右位心内脏异位子宫缺失房中隔缺损腹部肝分叶异常子宫发育不全室间隔缺损肾上腺缺失输卵管积水对非啮齿类动物,如家兔,应对全部的胎仔均进行骨骼和内脏的检查,其检查程序参照大鼠进行。
5.5 数据处理、统计方法及结果评定整理每只动物的资料并将试验结果列表,包含试验开始时体重、各试验组的动物数、子代动物数、试验过程中死亡或人为处死的动物数、受孕动物数、临床中毒表现和出现中毒体征的动物数。
胎鼠的观察结果,包含畸形类型及其他相关信息。
用合理的统计方法对下述指标进行统计分析:母体体重、体重增重〔处死时母体体重-孕6d体重〕、子宫连胎重、体重净增重〔处死时母体体重-子宫连胎重-孕6d体重〕、着床数、黄体数、汲取胎数、活胎数、死胎数及百分率、胎仔的体重及体长、有畸形的胎仔数〔包含外观、骨骼和内脏畸形〕,有畸形胎仔的窝数及百分率,计算动物总畸胎率和某单项畸胎率。
对胎仔的相关指标统计应以窝为单位。
受孕率〔%〕=受孕动物数/实验动物数×100%活胎率〔%〕=活胎数/胎鼠总数×100%死胎率〔%〕=死胎数/胎鼠总数×100%汲取胎率〔%〕=〔早期+中期+晚期〕汲取胎数/胎鼠总数×100%外观畸形率〔%〕=外观畸形胎鼠数/检查胎鼠数×100%骨骼畸形率〔%〕=骨骼畸形胎鼠数/检查胎鼠数×100%内脏畸形率〔%〕=内脏畸形胎鼠数/检查胎鼠数×100%畸胎率〔%〕=畸胎总胎鼠数/活胎仔总数×100%6 结果解释解释致畸试验结果时,应该结合亚慢性、繁殖毒性、毒物动力学及其他试验结果综合考虑,试验结果从动物外推到人时,必须注意种属差异。
