水溶液中离子平衡图像专题
高中化学第3章水溶液中的离子反应与平衡微专题7难溶电解质沉淀溶解平衡图像分析新人教版选择性必修1

3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解 平衡曲线,下列说法不正确的是( D )
A.加入Na2SO4固体可使溶液由a点变到b点 B . T1 温 度 下 , 在 T1 曲 线 上 方 区 域 ( 不 含 曲 线 ) 任 意 一 点 时 , 均 有 BaSO4沉淀生成 C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含 a、b) D.升温可使溶液由b点变为d点
A.L1线代表AgCl的沉淀溶解平衡曲线 B.a1、b两点所示溶液中c(Ag+):b>a1 C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到 c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2 和MnCl2溶液中滴加0.1 mol·L-1的K2S溶液,滴加过程中溶液-lg c(Fe2 +)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知: Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下 列说法错误的是( A )
2.c(Mn+)—pH图像 Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应 金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化 物的Ksp的大小以及离子分离方法的选择。
跟|踪|训|练 1.(2024·青岛高二检测)一定温度下,AgCl(s) Ag(aq)+Cl-(aq)体系 中,c(Ag+)和 c(Cl-)的关系如图所示。下列说法不正确的是( D )
(4)相同实验条件下,沉淀相同物质的量的Cl-和Br-消耗的AgNO3 的物质的量相同,由于Ksp(AgBr)<Ksp(AgCl),当滴加相同物质的量的 Ag+时,溶液中c(Br-)<c(Cl-),故反应终点c向b方向移动。
水溶液中离子平衡的两类特殊图像

[答案] C
[例 2] (2017·全国卷Ⅰ)常温下,将 NaOH 溶液滴加到已
二酸(H2X)混合溶液的 pH 与离子浓度变化的关系如图所示。下
列叙述错误的是
()
A.Ka2(H2X)的数量级为 10-6 B.曲线 N 表示 pH 与 lgccHHX2X-的变化关系 C.NaHX 溶液中 c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-) =c(H+)
答案:C
2.常温时,Ca(OH)2 和 CaWO4(钨酸钙)的沉 淀溶解平衡曲线如图所示。下列分析不正
确的是
()
A.常温时 Ksp[Ca(OH)2]>Ksp(CaWO4) B.a 点:无 Ca(OH)2 沉淀,有 CaWO4
沉淀
C.加热饱和 Ca(OH)2 溶液有白色沉淀生成 D.常温时这两种饱和溶液中 c(Ca2+)相等
cHX- lg cH2X
生成物与反应 物离子浓度比
lgccHHX2X-越大,反应 向正反应方向进行
的常用对数
的程度越大
对数图像
V lgV0
稀释后与稀释 前体积比的常
lgVV0越大,稀释程度
用对数
越大
AG= cH+ lgcOH-
氢离子与氢氧 AG 越大,酸性越强,
根离子浓度比 中性时,ccOHH+-=1,
Ca(OH)2 溶液有白色沉淀生成,C 项正确;设饱和氢氧化钙溶液中钙离子 浓度为 x,则氢氧根离子浓度为 2x,x·(2x)2=1.0×10-7,解得 x≈2.9×10 -3mol·L-1,设饱和钨酸钙溶液中钙离子浓度为 y,钨酸根离子浓度也为 y, 则 y2=1.0×10-10,y=1.0×10-5mol·L-1,x>y,D 项不正确。
2023年高考化学总复习第一部分考点梳理第八章水溶液中的离子平衡微专题22 电解质溶液图像分析

微专题○22电解质溶液图像分析【知识基础】1.与水电离平衡相关的图像不同温度下水溶液中c(H+)与c(OH-)的变化曲线A、C、B三点所示溶液[c(H+)=c(OH-)]均呈中性,升高温度,K w依次增大。
直线AB 的左上方区域所示的溶液[c(H+)<c(OH-)]均为碱性溶液,右下方区域所示的溶液[c(H +)>c(OH-)]均为酸性溶液。
注意:水的电离过程吸热,温度越高,K w越大。
K w只与温度有关,与溶液的酸碱性变化无关。
水电离出的c水(H+)与c水(OH-)始终相等。
2.中和滴定过程中pH-V图像25 ℃时,以向20 mL 0.1 mol·L-1一元弱酸HA溶液中加入0.1 mol·L-1NaOH溶液过程中的pH-V图像为例进行分析:0.05 mol·L-1,A-+H2O⇌HA+OH-,则c(HA)≈c(OH-)=10−4.5 mol·L−1,c(A−)=0.05 mol·L −1 −10−4.5mol ·L−1≈0.05 mol ·L −1,K h (A-)=c (HA )·c (OH −)c (A −)=10−4.5×10−4.50.05=2×10-8,则K a (HA)=K w K h (A −)=10−142×10−8=5×10−7。
3.分布分数图像分布分数图像一般是以pH 为横轴、分布分数(组分的平衡浓度占总浓度的分数)为纵轴的关系曲线,以草酸H 2C 2O 4为例,含碳元素的各组分分布分数(δ)与pH 的关系如图所示。
曲线含义分析:随着pH 的逐渐增大,溶质分子的浓度逐渐减小,酸式酸根离子浓度先逐渐增大后逐渐减小,酸根离子浓度逐渐增大,所以δ0表示H 2C 2O 4、δ1表示HC 2O 4−、δ2表示C 2O 42−。
特殊点的应用:对于物种分布分数图像,一般选择“交点”处不同微粒的等浓度关系,代入电离常数公式计算各级电离常数。
第一部分 题型20 水溶液中离子平衡图像的分析 -2024年高考化学课件
化 学N
— 5—
Ka1(H2A)·Ka2(H2A)=c2Hc+H·2cAA 2-=1.0×10-9×1.0×10-13=1.0×10-22,c(H2A)≈0.1 mol·L-1,c(H+)=0.1 mol·L-1,则 c(A2-)=1.0×10-21 mol·L-1,Ksp(MA)=c(M2+)·c(A2 -)=0.002×1.0×10-21=2.0×10-24,数量级为 10-24,D 正确。
A.a 点溶液中存在:2c(Sr2+)+c(H+)=c(F-)+c(OH-) B.c 点溶液中存在:c(H+)=c(Cl-)+c(OH-)-c(F-) C.常温下,Ksp(SrF2)=10-10.2 D.常温下,氢氟酸的 Ka 数量级为 10-2
化 学N
— 15 —
解析 由氢氟酸的电离常数公式可知,溶液中ccHHF+=cKFa-,电离常数为定值, 溶液中 lgccHHF+越大,则溶液中氟离子浓度越大,锶离子浓度越小,所以 L1 表示-lg
C
正确;
n(KHP)=n(HClO4),
c(HClO4)=
n V
≈1.4×0.01104-3Lmol=0.100 mol·L-1,选项 D 正确。
化 学N
— 11 —
4.二元有机酸(H2X)的电离常数 Ka1=1.67×10-8、Ka2=3.34×10-17。BaX 难溶 于水,常温下,将 BaX 溶解在一定浓度的 HY 溶液中,直至不再溶解,测得混合液 中 c2(H+)与 c2(Ba2+)的关系如图所示。下列说法错误的是( B )
c(F-)与 lgccHHF+的变化曲线,L2 表示-lg c(Sr2+)与 lgccHHF+的变化曲线。a 点溶液中 存在电荷守恒关系:2c(Sr2+)+c(H+)=c(F-)+c(OH-)+c(Cl-),故 A 错误;由题图 可知,c 点溶液中 c(Sr2+)=c(F-),溶液中存在电荷守恒关系:2c(Sr2+)+c(H+)=c(F-) +c(OH-)+ c(Cl-),则溶液中 c(H+)=c(Cl-)+c(OH-)-c(F-),故 B 正确;由题图
水溶液中的离子平衡图像分析题(学生版)

水溶液中的离子平衡图像分析题考试范围:xxx ;考试时间:100分钟;命题人:xxx注意事项:1 •答题前填写好自己的姓名、班级、考号等信息2 •请将答案正确填写在答题卡上第I 卷(选择题)请点击修改第I 卷的文字说明评卷人 得分.选择题(共40小题)molL 「1 CfCOONa 溶液中,所得溶液 pH 变化曲线如图所示(忽 略体积变化)。
下列说法不正确的是( )B .点②所示溶液中: c ( Na +)= c (CD +c (CH a COO 「)C .点③ 所示溶液中:c (Na +)> c (CD > c (CfcOO 「)= c (CfcOOH)D .点④ 所示溶液中:c ( Na +) +c (CfCOOH +c (H +)> molL ^11.常温下,将L 「1盐酸慢慢加入到浓度为A .点①所示溶液中由水电离产生的 c (OH ) = 10 molL 12 .常温下,100mL L的H2A溶液中滴加L NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示,F列说法正确的是( )I “A. H2A在水中的电离方程式是:H2A= H++HA「,HA「H+A2B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大C. Y点溶液中存在以下关系: c ( Na+)> c ( HA ) = c (A2)> c (OH )> c ( H+)D. X点溶液中含A元素相关离子:c (H2A) +c ( HA「)+c (A2「)= L3 •常温下将NaOH溶液添加到己二酸(H2X,为二元弱酸)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述正确的是( )A. 己二酸电离常数Ka i (H2X)约为10B. 曲线M表示pH与lg的变化关系C. 当溶液中c (X2「)= c ( HX)时,溶液为碱性D. 当混合溶液呈中性时, c (Na+)> c ( HX「)> c (X2「)> c(OH「)= c ( H+)4. 已知:pBa 2+ =- lgc ( Ba 2。
水溶液中的离子平衡 小专题-图表图形图像

2019备考-----图表图形图像小专题一.【2019 考试说明】对图形、图表、图像的考试要求:1.接受、吸收、整合化学信息的能力⑴对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
⑵ 通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。
⑶从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
2.分析和解决化学问题的能力⑴将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
⑵将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。
二.热点图像分类展示1.化学反应速率、化学平衡基本图像:m A(g) + n B(g) p C(g) + q D(g) ΔH>0,m+n>p+q ⑴速率曲线图⑵转化率曲线图:(p1<p2)⑶几种特殊图像:m A(g) + n B(g) p C(g) + q D(g)① 图甲、乙,M 点前未达平衡,v 正>v 逆;M 点后为平衡,即升温,A%增大或C%减小,平衡左移,故正反应的ΔH<0。
② 图丙,L 线上所有的点都是平衡点。
L 上方的点(E),v 正>v 逆;L 下方的点(F),v 正<v 逆2.酸溶液稀释图像:⑴同体积、同浓度的盐酸、醋酸加水稀释相同的倍数,醋酸的pH 大加水稀释到相同的pH,盐酸加入的水多加水稀释相同的倍数,盐酸的pH 大加水稀释到相同的pH,醋酸加入的水多⑶① HY 为强酸、HX 为弱酸① MOH 为强碱、ROH 为弱碱3.Kw 和Ksp 图像:⑴曲线型不同温度下水溶液中c(H+)与c(OH-)的变化曲线常温下,CaSO4 在水中的沉淀溶解平衡曲线[K sp=9×10-6]① A、C、B 三点均为中性,温度依次升高,① a、c 点在曲线上,a→c 的变化为增大K w 依次增大c(SO 2-),如加入Na SO 固体,但K 不4 2 4 sp② D 点为酸性溶液,E 点为碱性溶液,变K w=1×10-14② b 点在曲线的上方,Q c>K sp,将会有沉淀③ AB 直线的左上方均为碱性溶液,任意一生成点:③ d 点在曲线的下方,Q c<K sp,则为不饱和c(H+)<c(OH-)溶液,还能继续溶解CaSO4(pM 为阳离子浓度的负对数,pR 为阴离子浓度的负对数)① 直线AB 上的点:c(M2+)=c(R2-);②溶度积:CaSO4>CaCO3>MnCO3;③ X 点对CaCO3 要析出沉淀,对CaSO4 是不饱和溶液,能继续溶解CaSO4;2-2+ -5④ Y 点:c(SO4)>c(Ca),二者的浓度积等10 ;2-2+ -10.6Z 点:c(CO3)<c(Mn),二者的浓度积等10 。
2024高考试题评析及教学启示第9讲-水溶液中的离子反应平衡图像题 课件 (共65张PPT)

Ag+
CrO42-
恰好完全反应
试题情境:沉淀转化滴定+图表坐标系
思维方式转变:前期沉淀转化滴定,后期沉淀溶解平衡移动
创新点
2.(2024全国甲卷T13)将0.10mmol Ag2CrO4配制成1.0mL悬浊液,向其中滴加0.10mol·L-1的NaCl溶液。lg[cM/(mol·L-1)](M代表Ag+、Cl-或CrO42-)随加入NaCl溶液体积(V)的变化关系如图所示。下列叙述正确的是( )
错误原因:未考虑图像横轴pH逐渐增大,需要向溶液中加入强碱(如NaOH等)来调节,则电荷守恒要考虑其他外加的阳离子。
1.(2024湖北卷13)CO2气氛下,Pb(ClO4)2溶液中含铅物种的分布如图。纵坐标(δ)为组分中铅占总铅的质量分数。已知c0(Pb2+)=2.0×10-5mol·L-1,pKa1(H2CO3)=6.4、pKa2(H2CO3)=10.3,pKsp(PbCO3)=12.1。下列说法错误的是( )
类分布曲线
难
7
浙江6月
H2S水溶液的多重平衡
分布曲线
难
8
湖南卷
HCOOH与NaOH的滴定反应
滴定曲线
较难
新课标卷
曲线归属、常数计算、电离度计算、电荷守恒
黑、吉、辽卷
曲线归属、常数计算3
河北卷
离子浓度比较、常数计算
山东卷
曲线归属、常数计算、物料守恒、离子浓度计算
常数计算、水解率计算、指示剂的选择、沉淀的判断
试题
湖北卷
在CO2氛围中调pH的Pb2+配位转化
分布曲线
难
2
全国甲卷
Ag2CrO4与NaCl的沉淀转化滴定
水溶液中的离子平衡图像分析题学生版

水溶液中的离子平衡图像分析题考试范围:xxx;考试时间:100分钟;命题人:xxx注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第Ⅰ卷选择题请点击修改第I卷的文字说明评卷人得分一.选择题共40小题1.常温下;将0.10mol•L﹣1盐酸慢慢加入到20.00mL浓度为0.10 mol•L﹣1 CH3COONa溶液中;所得溶液pH变化曲线如图所示忽略体积变化..下列说法不正确的是A.点①所示溶液中由水电离产生的cOH﹣=10﹣5.5 mol•L﹣1B.点②所示溶液中:cNa+=cCl﹣+cCH3COO﹣C.点③所示溶液中:cNa+>cCl﹣>cCH3COO﹣=cCH3COOHD.点④所示溶液中:cNa++cCH3COOH+cH+>0.10 mol•L﹣1第1页(共37页)第2页(共37页)2.常温下;100mL 0.1mol/L的H2A溶液中滴加0.1mol/L NaOH溶液;含A元素相关微粒物质的量随pH的变化如图所示;下列说法正确的是A.H2A在水中的电离方程式是:H2A=H++HA﹣;HA﹣⇌H+A2﹣B.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大C.Y点溶液中存在以下关系:cNa+>cHA﹣=cA2﹣>cOH﹣>cH+D.X点溶液中含A元素相关离子:cH2A+cHA﹣+cA2﹣=0.1mol/L3.常温下将NaOH溶液添加到己二酸H2X;为二元弱酸溶液中;混合溶液的pH与离子浓度变化的关系如图所示..下列叙述正确的是A.己二酸电离常数Ka1H2X约为10﹣4.4B.曲线M表示pH与lg的变化关系C.当溶液中cX2﹣=cHX﹣时;溶液为碱性D.当混合溶液呈中性时;cNa+>cHX﹣>cX2﹣>cOH﹣=cH+第3页(共37页)第4页(共37页)4.已知:pBa2+=﹣lgcBa2+;pK a=﹣lgK a.向20mL0.1 mol/L BaCl2溶液中滴加0.2mol/LNa2CO3溶液的滴定曲线如图所示;下列描述错误的是常温下;H2CO3的电离常数pK a1=6.4;pk a2=10.3:K sp BaSO4=1.1×10﹣10A.在碳酸钠溶液中;K h1CO32﹣=10×10﹣3.7B.根据曲线数据计算可知K sp BaCO3的数量级为10﹣9C.相同条件下;若改为0.15 mol/L BaCl2溶液;反应终点F移到K点D.相同条件下;若改为0.2 mol/L Na2SO4溶液;反应终点F移向H方向移动5.在25℃时;甘氨酸在水溶液中解离方程式如下:当调节溶液的pH使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..其物质的量分数α随溶液pH变化的关系如图所示..下列说法中正确的是A.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+B.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣C.pH=7;cA±>cA+>cA﹣D.甘氨酸晶体熔点较高;主要是因为晶体中羧基与氨基之间形成内盐第5页(共37页)6.在25℃时;向20mL 0.2mol•L﹣1的氢氟酸中滴加0.2 mol•L﹣1的NaOH溶液时;溶液的pH变化如图所示..已知:H+aq+OH﹣aq=H2Ol△H=﹣a kJ•mol﹣1;HFaq=H+aq+F﹣ag△H=+b kJ•mol﹣1..下列说法不正确的是A.氢氟酸是一种弱酸B.在A处溶液中:cF﹣+cHF>0.1mol•L﹣1C.OH﹣aq+HFaq=H2Ol+F﹣aq△H=﹣a﹣bkJ•mol﹣1D.A点时水的电离程度大于B点时水的电离程度7.常温下;用0.01000 mol•L﹣1的盐酸滴定0.01000 mol•L﹣1 NaA溶液20.00mL.滴定曲线如图所示;下列说法正确的是A.a点到d点的过程中;等式cHA+cA﹣=0.01000 mol•L﹣1恒成立B.b点时;溶液中微粒浓度大小关系为:cA﹣>cCl﹣>cHA>cOH﹣>cH+第6页(共37页)C.c点时;溶液中微粒浓度存在关系:cNa++cH+=cHA+cOH﹣+2cA﹣D.d点时;溶液中微粒浓度存在关系:cOH﹣+cA﹣=cH+8.298K时;用0.1000mol•L﹣1盐酸滴定20.00mL0.1000mol•L﹣1ROH溶液;所得溶液的pH与lg的关系如图所示..下列说法正确的是A.298K时;ROH的电离常数K b=1.0×10﹣9.3B.本实验宜选用酚酞溶液作指示剂C.Z点为滴定终点D.Y点溶液中cCl﹣<cR+第7页(共37页)9.H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数平衡时某物种的浓度占各物种浓度之和的分数与pH 的关系分别如图1和图2所示:下列说法正确的是A.H3AsO3的pK a1=9.2pK a1=﹣lgK a1B.NaH2AsO3溶液中:cOH﹣=cH++cH3AsO3C.NaH2AsO4溶液中:cH+>cOH﹣D.H3AsO4溶液中滴入NaOH溶液至pH>11.5时;cAsO43﹣>H2AsO4﹣>c HAsO42﹣10.25℃时;向Na2CO3溶液中滴入盐酸;混合溶液的pH与离子浓度变化的关系如图所示..已知:lgX=lg或lg;下列叙述正确的是A.曲线m表示与pH与的变化关系B.NaHCO3溶液中cCO32﹣>cH2CO3C.当溶液呈中性时;cNa+=cHCO3﹣+2cCO32﹣D.25℃时;HCO3﹣+H2O⇌H2CO3+OH﹣的平衡常数为1.0×10﹣7.6第8页(共37页)第9页(共37页)11.常温下;向20mL0.2 mol•L﹣1H2A溶液中滴加0.2 mol•L﹣1 NaOH溶液;含A元素的有关微粒物质的量变化如图所示..根据图示判断;下列说法正确的是A.H2A在水中的电离方程式H2A=H++HA﹣;HA⇌H++A2﹣B.当VNaOH溶液=20mL时;溶液中各粒子浓度的大小顺序:cNa+>cHA﹣>cH+>cOH﹣C.当VNaOH溶液=30mL时;溶液中存在以下关系:2cH++cHA﹣+2cH2A=cA2﹣+2cOH﹣D.等体积等浓度的NaOH溶液与H2A溶液混合后;其溶液中水的电离程度比纯水大12.某温度下;HA和HB的电离常数分别为5.0×10﹣4和1.7×10﹣5.将pH和体积均相同的两种酸溶液分别稀释;其pH随加水体积的变化如图所示..下列叙述正确的是A.曲线Ⅰ对应的溶液中存在:HB═H++B﹣B.溶液中水的电离程度:b点>c点C.从c点到d点;溶液中保持不变第10页(共37页)D.相同体积a点的两溶液分别与NaOH恰好中和后;溶液中nNa+相同第11页(共37页)13.AlPO4的沉淀溶解平衡曲线如图所示..下列说法不正确的A.T1>T2B.AlPO4在b点对应的溶解度大于c点C.图中四个点的K sp:a=c=d<bD.T1温度下;在AlPO4的饱和溶液中加入ACl3可使溶液由c点变到a点14.室温下;向10mL0.1000mol•L﹣1NaOH溶液中逐滴加入0.1000mol•L﹣1的某一元酸HX;溶液pH变化曲线如图..下列说法不正确的是A.等浓度的HX、NaX混合溶液中;HX的电离程度大于X﹣的水解程度B.c点所示溶液中存在:2cH+﹣2cOH﹣=cX﹣﹣cHEC.a、b、c点所示溶液中;由水电离出的cH+•cOH﹣值不变第12页(共37页)D.a→c点所示溶液中;cX﹣+cHX+cNa+=0.1000mol•L﹣1始终成立第13页(共37页)15.常温下;向20.00mL 0.1mol•L﹣1的甲胺CH3NH2溶液中滴加0.1 mol•L﹣1的盐酸;混合溶液的pH与相关微粒浓度比值的对数关系如图所示..下列说法不正确的是A.滴加盐酸10.00mL时;CH3NH2•H2O的电离程度大于CH3NH3+的水解程度B.滴定过程中水的电离程度先增加后减小C.滴加盐酸20.00mL时;cCl﹣>cCH3NH3+>cCH3NH2•H2O>cH+>cOH﹣D.常温下;CH3NH2•H2O的电离常数为K b;则pK b=﹣1 g K b=3.416.H2C2O4为二元弱酸..20℃时;配制一组cH2C2O4+cHC2O4﹣+cC2O42﹣=0.100mol•L﹣1的H2C2O4和NaOH混合溶液;溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示下列指定溶液中微粒的物质的量浓度关系一定正确的是A.K2H2C2O4的数量级为10﹣4B.cNa+=0.100mol•L﹣1的溶液中cH++cH2C2O4=cOH﹣+cC2O42﹣第14页(共37页)C.cHC2O4﹣=cC2O42﹣的溶液中c Na+>0.100 mol•L﹣1+cHC2O4﹣D.PH=7.0的溶液中:cNa+=2cC2O42﹣第15页(共37页)17.常温时;100mL 0.10 mol•L﹣1H2A溶液用0.10mol•L﹣1的NaOH溶液滴定;滴定曲线如图所示..已知:pK a =﹣lgK a.下列说法不正确的是A.可用酚酞作滴定指示剂B.NaHA溶液呈酸性C.反应H2A+A2﹣⇌2HA﹣的平衡常数K=105.6D.Y点溶液中:cNa+=cOH﹣+3cHA﹣﹣cH+18.室温下两种一元弱酸中分子的物质的量分数δδHA=随pH的变化关系如图所示..下列判断正确的是A.水的电离程度:M=NB.HX的电离常数K;HX=1.0×10﹣5.5C.P点溶液中存在:cHX>cOH﹣>cX﹣第16页(共37页)D.等浓度的HY和NaY混合溶液中存在:cH+>cOH﹣第17页(共37页)19.常温下;将NaOH溶液滴入某一元酸HA溶液中;测得混合溶液的pH与离子浓度变化关系如图所示已知p=﹣lg.下列叙述不正确的是A.K a HA的数量级为10﹣5B.滴加NaOH溶液的过程中;保持不变C.m点所示溶液中cH++cNa+=cHA+cOH﹣D.n点所示溶液中:cNa+=cA﹣+cHA20.室温下;将0.01mo•L﹣1的一元酸HA溶液逐滴滴入10mL 0.01mol•L﹣1 NaOH溶液中;测得溶液pH与所加HA溶液体积的关系如图所示..下列说法正确的是A.a点溶液中由水电离出的cOH﹣=1.0×10﹣2mol•L﹣1B.b点所示溶液中:cNa+=cA﹣+cHA=0.01mol•L﹣1C.c点所示溶液中:cA﹣>cNa+>cH+>cOH﹣D.水的电离程度c>b>a第18页(共37页)第19页(共37页)21.常温下;在25mL氢氧化钠溶液中逐滴加入0.2mol•L﹣1醋酸溶液;滴定曲线如图所示下列说法正确的是A.该氢氧化钠溶液的物质的量浓度为0.2 mol•L﹣1B.B点对应的醋酸溶液体积为12.5mLC.D点的溶液中cCH3COO﹣>cNa+>cH+>cOH﹣D.二者恰好完全反应的点位于曲线B、C之间的某点22.常温下向20mL 0.1mol•L﹣1 Na2CO3溶液中逐滴加入0.1mol•L﹣1 HCl溶液40mL;溶液中含碳元素的各种微粒CO2因逸出未画出物质的量分数纵轴随溶液pH变化的部分情况如图所示..下列说法正确的是A.在同一溶液中;H2CO3、HCO3﹣、CO32﹣不能大量共存B.当pH=7时;溶液中各种离子CO32﹣除外的物质的量浓度的大小关系为:cCl﹣>cNa+>cHCO3﹣>cH+=cOH﹣C.0.1mol/L Na2CO3溶液中cOH﹣﹣cH+=cH2CO3+cHCO3﹣D.当pH=8时;NaHCO3溶液的物质的量浓度为0.1mol/L第20页(共37页)23.在25℃时;甘氨酸在水溶液中解离情况如图:改变溶液pH值;三种甘氨酸相关离子的分布分数α;平衡时某物种的浓度占各物种浓度之和的分数变化如图所示..当调节溶液的pH值使甘氨酸所带的净电荷为零;此时溶液的pH叫等电点..下列说法正确的是A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A﹣、A±、A+B.K2=10﹣2.34;且K2对应的解离基团为﹣NH3+C.在pH=9.60的溶液中加盐酸;αA±+αA++αA﹣保持不变D.甘氨酸的等电点pH约为6;且存在cA±=cA+=cA﹣24.25℃时;用浓度为0.1000mol•L﹣1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L﹣1的HX、HY 溶液;溶液pH随NaOH溶液体积的变化关系如图..下列说法正确的是A.K a HY的数量级为10﹣6第21页(共37页)B.a点时:cY﹣+cHY=0.1000mol•L﹣1C.b点时:cHX>cNa+>cX﹣>cOH﹣>cH+D.当VNaOH=20.00mL时;将所得两溶液混合;则cX ﹣+cY﹣+cOH﹣=cH++2 cNa+第22页(共37页)25.常温下;pH均为2、体积均为V0的HA、HB、HC溶液;分别加水稀释至体积为V;溶液pH随lg的变化关系如图所示;下列叙述错误的是A.常温下:K a HB>K a HCB.HC的电离度:a点<b点C.当lg=4时;三种溶液同时升高温度;减小D.当lg=5时;HA溶液的pH为726.常温下;取三份浓度均为0.1mol/L;体积均为1L的醋酸钠溶液中分别加入氯化铵固体、醋酸铵固体、氯化氢气体后所得溶液pH变化曲线如图溶液体积变化忽略不计;下列说法不正确的是A.曲线a、b、c分别代表加入醋酸铵、氯化铵、氯化氢B.A点处CNa+>cCH3COO﹣>cNH4+>cOH﹣>cH+C.由B点可知KaCH3COOH=KbNH3•H2O第23页(共37页)D.C点处cCH3COO﹣+CCl﹣+cOH﹣>0.1mol/L第24页(共37页)27.25℃时;分别向等体积、等物质的量浓度的NaBr、Na2CrO4溶液中滴加0.01mol•L﹣1 AgNO3溶液;根据溶液中平衡时相关离子浓度的关系图;下列说法错误的是A.AgNO3溶液中;cH+>cOH﹣B.K sp AgBr的数量级为10﹣12C.若向物质的量浓度均为0.01mol•L﹣1的NaBr和Na2CrO4混合溶液中滴加0.01mol•L﹣1 AgNO3溶液;先产生AgBr沉淀D.Ag2CrO4s+2Br﹣aq⇌2AgBrs+CrO42﹣aq平衡常数很大;故该反应趋于完全28.t°C时;已知:K sp AgCl=10﹣10;Ag2CrO4的沉淀溶解平衡曲线如图所示;则下列说法正确的是A.t℃时;Ag2CrO4的K sp数量级为10﹣9B.无法计算Y点与Z点的K spC.Ag2CrO4s+2Cl﹣ag⇌2AgCls+CrO42﹣aq的平衡常数:K=108D.在饱和Ag2CrO4溶液中加入K2CrO4;可使溶液由Y点变到X点最终变到Z点第25页(共37页)第26页(共37页)29.常温下;向20mL0.1mol•L﹣1HA溶液中滴加0.1mol•L﹣1的氨水;溶液的pH随氨水的体积关系如图所示..下列说法不正确的是A.HA的电离方程式为HA=H++A﹣B.B点时加入HA和氨水恰好完全反应C.A点所示溶液中cA﹣=2cNH4++2cNH3•H2OD.C点所示溶液中:cNH4+>cA﹣>cNH3•H2O30.已知:常温下;1K a1H2CO3=4.3×10﹣7;K a2H2CO3=5.6×10﹣11;2H2R及其钠盐的溶液中;H2R、HR﹣、R2﹣分别在三者中所占的物质的量分数α随溶液pH的变化关系如图所示..下列叙述错误的是A.在pH=1.3的溶液中:cNa+<cH2R+2cR2﹣B.等体积等浓度的NaOH溶液与H2R溶液混合后;溶液中水的电离程度比纯水小C.在pH=2的溶液中存在=10﹣3D.向Na2CO3溶液中加入过量H2R溶液;发生反应:CO32﹣+H2R═HCO3﹣+HR﹣第27页(共37页)31.某温度下;向50 mL CuCl悬浊液中慢慢加入NaI固体并搅拌;溶液中cCu+随cI﹣的变化关系曲线如图忽略溶液体积变化;已知:K sp CuI=1.0×l0﹣12;则下列说法正确的是A.CuCl悬浊液中加入NaI固体立即有CuI生成B.x=l0﹣6C.CuI悬浊液中加入淀粉会出现蓝色D.若c点CuCl未完全溶解;则曲线bc段内;cCl﹣:cI﹣=10632.25℃时;将浓度均为0.1mol L、体积分别为V a和V b的HX溶液与NH3•H2O溶液按不同体积比混合;保持V a+V b=100mL;V a、V b与混合液的PH的关系如图所示..下列说法正确的是A.K a HX>K b NH3•H2OB.b点时cNH4+>cHX>cOH﹣=cH+C.a、b、d几点中;水的电离程度d>b>a第28页(共37页)D.a→b点过程中;可能存在cX﹣<cNH4+第29页(共37页)33.常温时;1mol•L﹣1的CH3NH2和1mol•L﹣1的NH2OHNH2OH+H2O⇌NH3OH++OHˉ两种碱溶液;起始时的体积均为10mL;分别向两溶液中加水进行稀释;所得曲线如图所示V表示溶液的体积;pOH=﹣lgcOH﹣..下列说法不正确的是A.NH2OH的电离常数K的数量级为10﹣9B.CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣C.当两溶液均稀释至lg=4时;溶液中水的电离程度:NH2OH>CH3NH2D.浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:NH3OH+<cCH3NH3+ 34.25℃时;用0.1 mol•L﹣1NaOH溶液分别滴定10 mL 0.1 mol•L﹣1的一元酸HX和HY;滴定时溶液的pH随加入NaOH溶液体积的变化曲线如图所示..下列说法正确的是A.HX、HY均为弱酸;且K a HX<K a HYB.M、Q、N三点中水的电离:N>Q>MC.P点溶液中存在:cNa+>cY﹣>cHY>cOH﹣第30页(共37页)D.25℃时;Y﹣的水解常数的数量级为10﹣9第31页(共37页)35.已知:pc表示物质的量浓度的负对数..常温下;将amol一元弱酸HA与一定量盐酸或NaOH溶液混合;配制成100mL溶液;所得溶液pH与pcHA、pcA﹣的关系如图所示..下列叙述错误的是A.K a HA=10﹣5B.曲线L1;代表pH与pcA﹣的关系C.水的电离程度:X<Y<ZD.Y点为等物质的量浓度的HA和NaA的混合溶液36.25℃时;甲胺CH3NH2的电离常数pK b=3.38.甲胺是一元弱碱;碱性比NH3•H2O略强;在水中的电离方程式为CH3NH2+H2O⇌CH3NH3++OH﹣.25℃时;向20.0mLx mol﹣1稀硫酸中滴加0.10mol•L﹣1甲胺溶液;混合溶液中水电离的cH+与甲胺溶液体积之间的关系如图所示..下列说法正确的是A.x=0.10、V0=40.0第32页(共37页)B.25℃时;CH3NH32SO4的水解常数pK h=10.62C.N点对应的溶液中cCH3NH3+=2cSO42﹣D.Q点对应的溶液呈碱性第33页(共37页)37.水的电离平衡曲线如图所示;下列说法正确的是A.图中五点K W间的关系:B>C>A=D=EB.若从A点到D点;可采用在水中加入少量NaOH的方法C.若从A点到C点;可采用温度不变时在水中加入适量H2SO4 的方法D.若处在B点时;将pH=2的硫酸与pH=12的KOH等体积混合后;溶液显中性38.已知二元弱碱BOH2在水中存在如下电离平衡:BOH2 ⇌BOH++OH﹣;K b1=10﹣3.75;BOH+⇌B2++OH﹣;K b2=10﹣7.62.常温下;用0.1mol/L盐酸滴定25mL 0.1mol/L的BOH2溶液;得到如图所示的滴定曲线..下列说法不正确的是A.a点所得的溶液中:cBOH2=cBOH+B.b点所得的溶液中:cBOH2+cOH﹣=cB2++cH+C.c点所得的溶液中:cCl﹣<3cBOH+第34页(共37页)D.d点所得的溶液中:cB2+>cBOH+>cBOH2第35页(共37页)39.室温时;向100mL0.1mol/L NH4HSO4溶液中逐滴滴加0.1mol/L NaOH溶液;得到溶液pH与NaOH溶液体积的关系曲线如图所示假设溶液的体积有加和性..下列分析正确的是A.ab段和bc段发生的离子反应一定不同B.水的电离程度最大的是c点C.b点溶液中各离子浓度由大到小的排列顺序是:cNa+>cNH4+>cSO42﹣>cH+=cOH﹣D.NH4+的水解常数K b的能量级为10﹣1040.甲胺CH3NH2是一种一元弱碱;其电离方程式为:CH3NH2+H2O⇌CH3NH3++OH﹣常温下;向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸;混合溶液的pH与相关微粒浓度的关系如图所示..下列说法中错误的是A.b点对应加入盐酸的体积V<20.00mLB.常温下;根据a点可知甲胺的电离平衡常数Kb=10﹣3.4C.b点可能存在关系:cCl﹣>cCH3NH3+>cH+=cOH﹣第36页(共37页)D.V=20.00mL时;溶液呈弱酸性第37页(共37页)。
最新最全溶液中的离子平衡图像题复习选编1完整版.doc
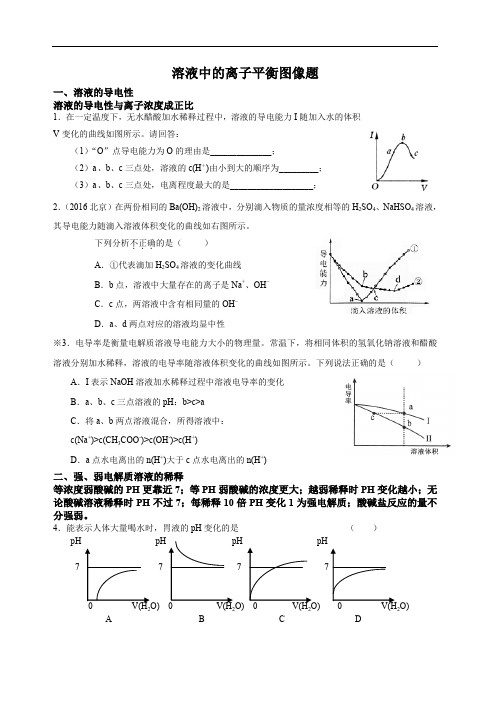
溶液中的离子平衡图像题一、溶液的导电性溶液的导电性与离子浓度成正比1.在一定温度下,无水醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答:(1)“O”点导电能力为O的理由是______________;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_________;(3)a、b、c三点处,电离程度最大的是___________________;2.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性※3.电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)二、强、弱电解质溶液的稀释等浓度弱酸碱的PH更靠近7;等PH弱酸碱的浓度更大;越弱稀释时PH变化越小;无论酸碱溶液稀释时PH不过7;每稀释10倍PH变化1为强电解质;酸碱盐反应的量不分强弱。
4.能表示人体大量喝水时,胃液的pH变化的是()7 7 7O)2222A B C D5.0.1 mol·L -1的醋酸与0.1 mol·L -1的盐酸,分别稀释相同的倍数,随着水的加入,溶液中c (H +)的变化曲线(如下图)正确的是( )6.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。
2024高考化学 易错专题14 水溶液中离子平衡图像(解析版)

易错专题14水溶液中离子平衡图像聚焦易错点:►易错点一稀释图像►易错点二滴定曲线►易错点三K W 、K sp 的图像►易错点四分布系数图像易错点一稀释图像【易错典例】例1(2023·浙江温州·三模)在一定温度下,冰醋酸稀释过程中溶液的导电能力与pH 的变化如图。
下列有关说法中正确的是A .a 点3CH COOH 溶液未达到电离平衡状态B .离子总浓度越大,溶液导电能力越强C .向a 、b 两点溶液中分别滴入同一NaOH 溶液至中性,溶液中的()3n CH COO -相同D .b 点后,溶液中加水稀释,所有离子浓度均减小B 【详解】A .加水稀释过程中,a 点、b 点都达到了电离平衡,故A 错误;B .导电能力与离子浓度和所带电荷数有关,因此离子总浓度越大,溶液导电能力越强,故B 正确;C .根据电荷守恒3n(CH COO )n(OH )n(Na )n(H )--+++=+,溶液呈中性,3n(CH COO )n(Na )-+=,a 点醋酸浓度大,向a 、b两点溶液中分别滴入同一NaOH 溶液至中性,a 点消耗的氢氧化钠溶液比b 点消耗的氢氧化钠溶液多,因此溶液中的()3n CH COO -是a 点大于b 点,故C 错误;D .b 点后,溶液中加水稀释,醋酸根、氢离子浓度减小,氢氧根浓度增大,故D 错误。
【解题必备】稀释图像(pH 与稀释倍数的线性关系)①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b ①MOH为强碱、ROH为弱碱②c(ROH)>c(MOH)③水的电离程度:a>b【变式突破】1.(2023·北京房山·一模)某温度下,将pH和体积均相同的HCl和3CH COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。
下列叙述不正确的是A.稀释前溶液的浓度:()()3HCl CH COOHc c<B.溶液中水的电离程度:b点<c点C.从b点到d点,溶液中()()c H c OH+-⋅逐渐增大D.在d点和e点均存在:()H c c+>(酸根阴离子)C【详解】A.稀释前两溶液的pH值相等,由于醋酸是部分电离,因此溶液的浓度:c(HCl)<c(CH3COOH),故A正确;B.b点pH值小于c点pH值,说明c点酸性弱,抑制水的电离程度小,水的电离程度大,因此溶液中水的电离程度:b点<c点,故B正确;C.从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误;D.在d点和e点均存在电荷守恒即c(H+)=c(酸根阴离子)+c(OH-),因此存在:c(H+)>c(酸根阴离子),故D正确。
微专题 水溶液中平衡图像的拓展与探析(解析版)

微专题水溶液中平衡图像的拓展与探析1(2023·全国·统考高考真题)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀B.b点时,c(Cl-)=c(CrO2-4),K sp(AgCl)=K sp(Ag2CrO4)C.Ag2CrO4+2Cl-⇌2AgCl+CrO2-4的平衡常数K=107.9D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀【答案】C【解析】根据图像,由(1.7,5)可得到Ag2CrO4的溶度积K sp(Ag2CrO4)=c2(Ag+)·c(CrO2-4)=(1×10-5)2×1×10-1.7=10-11.7,由(4.8,5)可得到AgCl的溶度积K sp(AgCl)=c(Ag+)·c(Cl)=1×10-5×1×10-4.8=10-9.8。
A.假设a点坐标为(4,6.5),此时分别计算反应的浓度熵Q得,Q(AgCl)=10-10.5,Q(Ag2CrO4)=10-17,二者的浓度熵均小于其对应的溶度积K sp,二者不会生成沉淀,A错误;B.K sp为难溶物的溶度积,是一种平衡常数,平衡常数只与温度有关,与浓度无关,根据分析可知,二者的溶度积不相同,B错误;C.该反应的平衡常数表达式为K=c(CrO2-4)c2(Cl-),将表达式转化为与两种难溶物的溶度积有关的式子得K=c(CrO2-4)c2(Cl-)=c(CrO2-4)⋅c2(Ag+)c2(Cl-)⋅c2(Ag+)=K sp Ag2CrO4K sp2AgCl=1×10-11.7(1×10-9.8)2=1×107.9,C正确;D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8和10-5.35,说明此时沉淀Cl-需要的银离子浓度更低,在这种情况下,先沉淀的是AgCl,D错误;故答案选C。
高中化学专题突破(十) 水溶液中离子平衡的两类特殊图像及分析(课件)

c(OH)- lg c(H+)
的关系如图所示。下列说法正确的是(
)
第1轮 化学
返回导航
第八章 水溶液中的离子平衡
A.H2A 的电离方程式为 H2A⇌H++HA- B.B 点溶液中,水电离出氢离子浓度为 1.0×10-8 mol·L-1 C.C 点溶液中,c(NH+ 4 )+c(NH3·H2O)=2c(A2-) D.25 ℃时,氨水的电离平衡常数为 Kb=b1-0-160
求 从图可知,c(CH3COO-)= 从图可知,
,从图可知,
lg K c(CH3COOH)时,pH=pK= c(C2O24- )=
c(HPO
2- 4
)=
4.76。K(CH3COOH)=c(H+)
c(HC2O- 4
)时
pH=4.2,
c(PO
3- 4
)时
pH =
=10-4.76,
K2=c(H+)=10-4. 2,lg K2 12.2,K3=c(H+)=10
当 pH>pKa 时,主要存 = δ2 , 当 pH < 1.2 =12.2 时 δ2=δ3;当 pH<2
含 在形式是 CH3COO-。δ0 时,H2C2O4 占优势;时,H3PO4 占优势;在 2< 义 与 δ1 曲线相交在 δ0=δ1 在 1.2<pH<4.2 区 pH<7.1 区间,H2PO- 4 占优
分布系数、 分布系数、
分布系数
δ3 为 PO34- 分布系数
第1轮 化学
返回导航
第八章 水溶液中的离子平衡
当 pH<pKa 时,主要存 当溶液的 pH=1.2 时 当溶液的 pH=2 时,δ0=
在形式是 CH3COOH; δ0=δ1,pH=4.2 时 δ1 δ1,pH=7.1 时 δ1=δ2,pH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③ 水的离子积常数只是温度的函数, 在同一曲线上的点,Kw相同。
④ T1>T2。
水的电离平衡曲线如图所示,下列说法中不正确的是( C )。
A.图中五个点对应的Kw间的关系为b>c>a=d=e B.若从a点到d点,可采用:恒温条件下,在水中加入少量 醋酸,提高溶液酸性 C.若从a点到c点,可采用:恒温条件下,在水中加入少量 醋酸铵,促进水的电离 D.100 ℃时,将pH=2的硫酸与0.01 mol·L-1的KOH溶液 等体积混合后,溶液中c(H+)=c(OH-)=10-6 mol·L-1
T1 T2
Qc<Ksp。 4. 溶度积常数只是温度的函数,在同一曲线上的点,Ksp
相同。
CCl-
真题重现
(2019·全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉 (CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错 误的是( B ) A.图中 a 和 b 分别为 T1、T2 温度下 CdS 在水中的溶 解度 B.图中各点对应的 Ksp 的关系为:Ksp(m)=Ksp(n)< Ksp(p)<Ksp(q) C.向 m 点的溶液中加入少量 Na2S 固体,溶液组成由 m 沿 mpn 线向 p 方向移动 D.温度降低时,q 点的饱和溶液的组成由 q 沿 qp 线 向 p 方向移动
2.难溶电解质溶解平衡相关图像
pAg 0
T1
T2 pCl
1. 直线一般表示溶解平衡中离子浓度的对数关系; 2. 直线上的点反映的是相应难溶电解质的饱和溶液,点
的数据可计算相应难溶电解质的溶度积常数; 3. 直线下的点反映的是难溶电解质的过饱和溶液还是不
饱和溶液,需要分析坐标表示的是浓度的对数(lg)关 系还是负对数(P=-lg)关系。
4. 溶度积常数只是温度的函数,在同一直线上的点,Ksp相同。
2.难溶电解质溶解平衡相关图像
例:pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
1. 直线AB上的点:c(M2+)=c(R2-); 2. 溶度积:CaSO4>CaCO3>MnCO3; 3. X点对CaCO3要析出沉淀,对CaSO4是不饱和溶液,能
3.酸碱中和滴定曲线
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线 盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高 突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱 碱反应) 室温下 pH=7 不一定是终点:强碱与强酸反应时,终点是 pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不 是 pH=7(强碱与弱酸反应终点是 pH>7,强酸与弱碱反应终点是 pH<7)
1.水的离子积常数相关图像
pOH
1.直线上的点的意义
2.温度的大小
3.溶液的酸碱性
T1
4.对称轴的意义
0
T2 pH
2.难溶电解质溶解平衡相关图像
CAg+ 0
1. 曲线上任意一点都达到了沉淀溶解平衡状态,Qc=Ksp; 2. 曲线上方区域的点均为当前温度下的方区域的点均为当前温度下的不饱和溶液,
继续溶解CaSO4; 4. Y点:c(SO42-)>c(Ca2+),二者的浓度积等10-5; 5. Z点:c(CO32-)<c(Mn2+),二者的浓度积等10-10.6。
真题重现
下图是某些难溶或微溶物在常温下的饱和溶液中的离子浓度关系,其中pM表示阳离子的物质的量浓 度的负对数,而pR表示阴离子物质担的负对数,据此分析下列说法中正确的是( A ) A.MnCO3在常温下的Ksp=2.5x10-11(已知100.4=2.5) B.三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 C.处于Y点的CaSO4溶液中C(Ca2+)>C(SO42-) D.Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液
变式训练
(2019·四川成都高三一诊)已知:pCu=-lg c(Cu+),pX=-lg c(X-)。298 K 时,Ksp(CuCl) =a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在 CuCl、CuBr、CuI 的饱和溶 液中阳离子和阴离子浓度关系如图所示。下列说法正
水溶液中离子平衡图像专题
人教版高中化学一轮复习
主要内容
1. 水的离子积常数相关图像 2. 难溶电解质溶解平衡相关图像 3. 酸碱中和滴定曲线 4. 酸碱中和滴定曲线与滴定过程中水电离H+浓度变
化图像关系 5. 酸碱中和滴定曲线与滴定过程中溶液导电性变化
的图像关系
1.水的离子积常数相关图像
① 对称轴上的点均为中性溶液, C(OH-)=C(H+) 。
3.酸碱中和滴定曲线
真题重现
(2018·全国卷Ⅲ)用 0.100 mol·L-1 AgNO3 滴定 50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲 线如图所示。下列有关描述错误的是( ) A.根据曲线数据计算可知 Ksp(AgCl)的数量级为 10-10 B . 曲 线 上 各 点 的 溶 液 满 足 关 系 式 c(Ag + )·c(Cl - ) = Ksp(AgCl) C.相同实验条件下,若改为 0.0400 mol·L-1 Cl-,反应 终点 c 移到 a D.相同实验条件下,若改为 0.0500 mol·L-1 Br-,反应 终点 c 向 b 方向移动
确的是( D )
A.298 K 时,在 CuCl 的饱和溶液中加入少量 NaCl,c(Cu+)和 c(Cl-)都减小
B.图中 x 代表 CuI 曲线,且 P 点 c(Cu+)=c(I-) C.298 K 时增大 M 点的阴离子浓度,则 y 上的点 向 N 点移动 D.298 K 时 CuBr(s)+I-(aq) ⇌ CuI(s)+Br-(aq) 的平衡常数 K 的数量级为 103 或 102
