红外光谱讲义-研究生
红外光谱PPT

红外光谱图
分子吸收红外光后,引起入射光强度的改 变,由此可记录红外吸收光谱,通常以波 长(m)或波数(cm-1)为横坐标,百分透过率 (T%)或吸光度(A)为纵坐标记录(红外光谱 图)
红外光谱图
横坐标:波数(v )400-4000cm-1;表示吸收峰的位置。
纵坐标:透过率(T%),表示吸收强度。
出现强、宽吸收带
2-丁醇的红外光谱图
2-溴苯酚的红外光谱图
羧酸3000-2500 cm-1范围的宽、散谱带为二聚 体羧基中O-H伸缩振动的特征谱带.
2-氯苯甲酸
N-H伸缩振动
含有N-H键的胺、酰胺及铵盐类在此峰区均出现N-H伸缩振动。 胺或酰胺中N-H伸缩振动出现在3500-3150 cm-1范围,弱或 中等强度吸收带,较O-H 谱带弱、尖。
1-己炔的红外光谱图
CN伸缩振动
腈基化合物中CN伸缩振动谱带在2250-2240 cm-1范围。CN键极性较CC键强,其谱带强度 也较CC 谱带强。CN与苯环或双键共轭, 谱 带向低波数位移20-30cm-1
丙烯腈的红外光谱图
第三峰区(1900-1500 cm-1)
双键(包括C=O,C=C,C=N,N=O等)的伸缩振动谱 带位于此峰区,利用该峰区的吸收带,对判断 双键的存在及双键的类型极为有用。另外,N-H 弯曲振动也位于此峰区。
振动光谱,分子所吸收的光能引起振动 能级的变化,多在中红外区域,叫红外 光谱。
电子光谱,分子所吸收的光能使电子激 发到较高的能级。一般表出吸收峰的波 长。电子光谱在可见及紫外区域内现。
红外光谱的基本概念
红外光谱
红外光谱:用波长2.5~25m ,频率4000 ~ 400cm-1的光波照射样品,引起分子内振动 和转动能级跃迁所产生的吸收光谱。红外光 谱是分子光谱,用于研究分子的振动能级跃 迁。
红外光谱_2

大
振动能 小
能级差 (eV) 1-20
0.05-1
吸收的辐射能 光谱
可见光和紫外 电子光 谱
11 中红外区
振动光
三、红外吸收产生的原理
辐射 分子振动能级跃迁 红外光谱 官能团 分子结构 分子的振动所需的能量远大于分子的转动所需的 能量,因此对应的红外吸收频率也有差异:
远红外区:波长长,能量低,对应分子的转动吸收
一个整体,其运动状态可分为平动、 f总=f振+f平+f转=3N
转动、振动三类。分子总自由度应
该等于平动、转动和振动自由度的 f振=3N -f平-f转
总和,即:
26
三、红外吸收产生的原理
每一种振动形式都会产生一个基频峰,即一个 多原子分子所产生的基频峰的数目应该等于分子所 具有的振动形式的数目。无论是线形分子还是非线 形分子其平动的自由度都等于3。
2
dx 则 m d t2 = - kx(1)
c c
1k
v = 2π m
(3)
x = A cos (2π v t + Ф) (2) 1k
用波数表示 = 2πc m
(波数)与K成 正比; 与原子质量成反比
对双原子分子来说,约合质量
m1 m2 μ=
代替m: =
m1+m2
1 2πc
k μ
发生振动能级跃迁需要的能量的大小取决于键两端原
样品吸收红外辐射的主要原因是: 分子中的化学键
因此, IR可用于鉴别化合物中的化学键类型,可 对分子结构进行推测。既适用于结晶质物质,也 适用于非晶质物质。 应用:有机化合物的结构解析 定性:基团的特征吸收频率 定理:特征峰的强度
6
二、红外光区的划分
红外光谱(最全最详细明了)课件

THANKS
感谢观看样ຫໍສະໝຸດ 制备固体样品液体样品
气体样品
注意事项
研磨成粉末,与KBr混合 压片或涂在ZnSe窗片上
。
稀释在适当的溶剂中, 涂在CaF2或ZnSe窗片
上。
通过干燥管进入光谱仪 。
避免样品中的水分和二 氧化碳干扰,确保样品
纯净。
实验操作
打开红外光谱仪电源,预热 稳定。
调整仪器至最佳状态,如光 路对中、调零等。
对实验操作的要求
总结词
红外光谱实验操作需要一定的技巧和经验,以确保结 果的准确性和可靠性。
详细描述
红外光谱实验涉及到样品的制备、仪器操作和谱图解析 等多个环节。每个环节都需要一定的技巧和经验,以确 保结果的准确性和可靠性。例如,在样品的制备过程中 ,需要选择合适的制样方法,以获得均匀、平整的样品 ;在仪器操作中,需要正确设置参数,以保证谱图的质 量;在谱图解析中,需要具备丰富的经验和专业知识, 以准确解析谱图特征。因此,进行红外光谱实验的人员 需要经过专业培训和实践经验的积累。
红外光谱(最全最详细 明了)课件
contents
目录
• 红外光谱基本原理 • 红外光谱与分子结构的关系 • 红外光谱的应用 • 红外光谱实验技术 • 红外光谱的局限性
01
红外光谱基本原理
红外光谱的产生
分子振动
分子中的原子或分子的振动,导致偶 极矩变化。
偶极矩变化
辐射吸收
分子吸收特定波长的红外光,导致振 动能级跃迁。
02
01 03
放入样品,记录光谱。
实验结束后,关闭仪器,清 理样品。
04
05
注意事项:保持室内温度和 湿度的稳定,避免仪器受到
红外光谱讲义

电子能级跃迁
E0
E = hn 其中 h 为普朗克常数 (6.626 × 10-34 焦耳· 秒) n 为频率
Polarizability——极化率 Polarity——极性 (related to dipole moment) 红外非活性 拉曼活性 Polarizability change 红外活性 拉曼非活性
可拆液体池,用 于非挥发性样品
密封液体池,用 于挥发性样品
气体样品制样
• 气体样品的测定:气体池
气体池:5cm光程(左);10cm光程(右)
• 傅立叶变换红外光谱仪(Fourier Transform IR Spectrometer):用干涉仪代替色散装置
– 70年代傅立叶变换光谱仪
2.2.1 傅立叶变换红外谱仪的结构
干涉仪 He-Ne 准直激光 光源
检测器
样品室
检测器检测到的干涉图
v1
v2 v3
A’(v2)
A(v1)
强度
红外光谱
瑞利散射
反斯托克斯
斯托克斯
瑞利散射:比入射光强弱 1000到10000倍 拉曼散射:比瑞利散射弱 10000到100000倍
n0 拉曼频移
n
H H H
H O O H H
芳香环的取代类型——弯曲振动区
羧酸
官能团区
指纹区
芳环上C—H伸缩振动 羧基上O—H伸缩振动 可能的氢键作用
波长 (mm)
0.15
波数 (cm-1)
0
12,800 4000
4000 3750 3500 3250 3000 2750 2500 2250 2000 1750 1500 1250 1000 750 Polyethylene
红外光谱(IR)讲义
6
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
2.4.3 常见基团的特征频率
7
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
8
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
9
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
18
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
19
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
20
10
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
11
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
12
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
13
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请全体班委整理, 请勿外传!
第二章
红外光谱
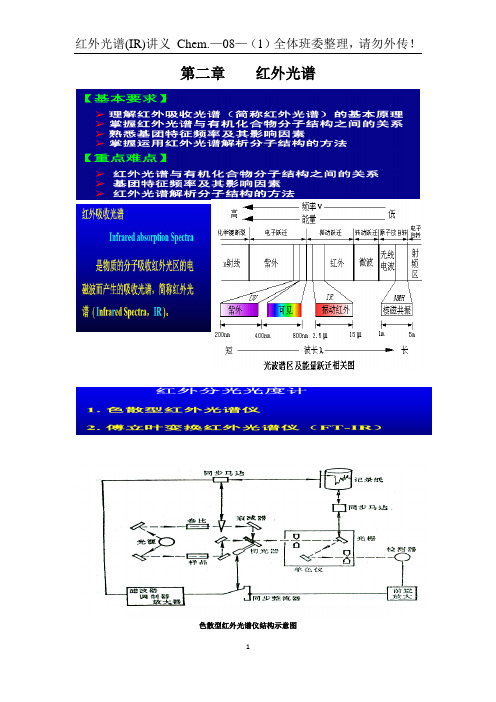
2.1 红外光及红外光谱 2.1.2 红外光谱仪
1、色散型红外光谱仪
色散型红外光谱仪结构示意图 1
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
色散型红外光谱仪工作原理(零点平衡法)
14
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
15
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
16
红外光谱(IR)讲义 Chem.—08— (1) 全体班委整理, 请勿外传!
红外光谱室实验讲义(红外辐射与黑体实验)

三、红外辐射源能量光谱分布测试(一)实验目的1. 了解测量红外辐射源能量光谱分布的意义2. 掌握测量红外辐射源能量光谱分布的方法3. 理解物体的温度与红外辐射能量的关系(二)实验原理红外辐射(俗称红外线)是波长在0.78~1000μm 的一段电磁波谱,是人眼看不见的光线,只有借助于仪器才能探测到并转换成人们可感受的信息,如数字、图像、曲线等。
凡温度在绝对零度以上的物体均能够发出红外辐射,其辐射的峰值波长与物体的温度有确定的关系:T b m =λ 式中 λm ——物体辐射的峰值波长T —— 物体的温度B —— 常数 (2898μm ·K )此为辐射度学中的维恩位移定律,意为只要物体有温度,则一定有固定波长的辐射,自然界的物体温度如果在-40℃~3000℃(233K ~3273K )范围,则根据上述公式,峰值辐射波长在0.88~12μm 之间,即人们通常所说的红外波段。
红外光谱仪器能将红外辐射源的辐射能量按波长的分布以曲线的形式给出。
我们可以清楚地看出一个红外辐射源在某个波长的相对辐射能量,进而可以验证维恩位移定律等红外辐射定律,并可以对红外辐射源进行深入的研究。
红外单色器的光学原理图如下图1 红外单色器光学原理图M1反射镜、M2准光镜、M3物镜,M4反射镜、M5 深椭球镜G 平面衍射光栅、S1入射狭缝、S2,S3出射狭缝、T 调制器入射狭缝、出射狭缝均为直狭缝,宽度范围0-2mm 连续可调,光源发出的光束进入入射狭缝1S ,1S 位于反射式准光镜2M 的焦面上,通过1S 射入的光束经2M 反射成平行光束投向平面光栅G 上,衍射后的平行光束经物镜3M 成像在2S 上。
(三)、实验仪器红外光栅光谱仪及配套附件;红外光源及驱动电源;电子稳压器;计算机及处理软件;打印机(四)、实验步骤首先按原理图检查各部分连接和摆放位置是否正确,经教师同意后,按下述步骤进行实验:1、打开红外辐射源的电源开关进行预热;2、打开计算机并进入相关程序,选定测量参数(相对强度、能量等),设置扫描波长范围、扫描间隔、幅度范围等参数;3、红外辐射源经预热达到稳定时,开始进行扫描,得到相应曲线;4、储测试结果,打印测试曲线;5、行相关计算,完成实验报告。
红外光谱课件(1)

32
第三章 红外光谱分析
§3-2 原 理
三、产生红外吸收的条件:
分子吸收辐射产生振转跃迁必须满足两个条件:
条件一:辐射光子的能量应与振动跃迁所需能量相等。
根据量子力学原理,分子振动能量Ev 是量子化的,即 EV=(V+1/2)h
为分子振动频率,V为振动量子数,其值取 0,1,2,…
分子中不同振动能级差为EV= Vh 也就是说,只有当EV=Ea或者a= V时,才可能发 生振转跃迁。例如当分子从基态(V=0)跃迁到第一激发态
(V=1),此时V=1,即a=
33
第三章 红外光谱分析
§3-2 原 理
条件二:辐射与物质之间必须有耦合作用
变形振动:基团键角发生周期性变化,但键长不变的 振动。又称弯曲振动或变角振动。
15
1、伸缩振动ν(stretching vibration)
对称伸缩振动
不对称伸缩振动
( s或 s)
( as 或 as)
AX2
AX3
16
2、弯曲振动 bending vibration
面内弯曲(β)
面外弯曲(γ)
2.振动频率
26
根据经典力学的Hooke定律:
振动频率 1 k 2
为化学键的振动频率;k 为化学键的力常
数,即两原子由平衡位置伸长0.1nm后的恢复
力;μ为双原子的折合质量,即
mAmB
mA mB
1 c
1 k 2c
27
用原子A、B的折合相对原子质量 ( 简称
原子量) 代替折合质量μ
§3-2 原 理
1、 红外吸收的产生: 红外光谱是分子直接吸收外来的电磁辐射、振动能
红外光谱讲稿

实验九红外光谱测定有机化合物的结构一、实验目的通过本实验,让学生复习红外光谱的基本原理,了解红外光谱仪的基本部件和光路走向。
通过实际操作,使学生了解红外光谱测定的样品处理及操作方法。
特别强调注意事项和简单谱图解析。
二、教学内容:1.红外光谱原理A. 光谱分析导论光谱分析法是基于物质对不同波长光的吸收、发射等现象而建立起来的一类光学分析法。
光谱是光的不同波长成分及其强度分布按波长或波数次序排列的记录,它描述了物质吸收或发射光的特征,可以给出物质的组成、含量以及有关分子、原子的结构信息。
由分子的吸收或发光所形成的光谱称为分子光谱(molecular spectrum),分子光谱是带状光谱。
B. 分子能级与分子光谱的形成分子具有不同的运动状态,对应每一种状态都有一定的能量值,这些能量值是量子化的称为能级。
每一种分子都有其特定的能级数目与能级值,并由此组成特定的能级结构。
处于基态的分子受到光的能量激发时,可以选择地吸收特征频率的能量而跃迁到较高的能级。
但是由于分子内部运动所牵涉到的能级变化比较复杂,分子吸收光谱也就比较复杂。
在分子内部除了电子运动状态外,还有核间的相对运动,即核的振动和分子绕着重心的转动。
每一种运动处在不同的能级上,因此分子具有电子能级、振动能级、转动能级。
红外光是波长范围为0.75~1000m的电磁波,可引起分子中基团的振动和转动能级跃迁,产生红外吸收光谱,也称分子振动-转动光谱。
C.红外光谱的产生当一束连续变化的各种波长的红外光照射样品时,其中一部分被吸收,吸收的这部分光能就转变为分子的振动能量和转动能量;另一部分光透过,若将其透过的光用单色器进行色散,就可以得到一带暗条的谱带。
若以波长或波数为横坐标,以百分吸收率为纵坐标,把这谱带记录下来,就得到了该样品的红外吸收光谱图,获得红外振动信息。
如下图,红外光谱图有以下三个基本参数:峰位:即吸收峰处于哪个波数区;峰强:即吸收峰面积或高度大小;峰形:即峰的宽窄度。
红外光谱第一节

m1.m2 m1+m2
K:化学键的力常数,单位为:103N/nm 。 一些键的伸缩力常数列于下表:
本讲稿第十一页,共六十一页
ν
表 某些键的伸缩力常数(×103N/nm)
键类型: —CC — > —C =C — > —C — C —
力常数:
15 17 9.5 9.9
4.5 5.6
ν :2400 2100 cm-1 1680 1500 cm-1 1300800 cm-1
分子振动当作谐振动处理时,其选律为 V = 1。 实际上,分子振动为非谐振动,非谐振动的选律不再局限于V
= 1,它可以等于任何整数值。即V = 1,2,3。所以IR谱
不仅可以观测到较强的基频带,而且还可以观测到较弱的泛频带。
V。 V1 基频带() ,基频峰,峰较强。 V。 V2 一级泛频带(2 - a),倍频峰,谱线较弱 V。 V3 二级泛频带(3 - b) 更弱, (a、b为非谐振动的修正值,a >b,b>o) 在红外光谱中通常只考虑两种跃迁: V。 V1;V。 V2
=1 3 0 7 C -O
1 2 + 1 6
5 .4
1 2 1 6
=1 1 6 0c m -1
=1 3 0 7 C = O
1 2
1 2 + 1 6
1 2 1 6
=1 7 3 0c m -1
本讲稿第十六页,共六十一页
1.2.1.2 非谐振子
本讲稿第十七页,共六十一页
在常温下,分子处于最低的振动能级,化学键 振动与简谐振动模型非常近似(仅当简谐量子 数V=3或4时,势能曲线才显著偏离简谐振动曲 线)。
本讲稿第二十页,共六十一页
1.2.2 多原子分子的振动
红外光谱(同济大学研究生精品课程)

饱和醛(酮)1740-1720 cm-1 ;强、尖;丌饱和向低波秱动;
酸酐的C=O
双吸收峰:1820~1750 cm-1 ,两个羰基振动偶合裂分; 线性酸酐:两吸收峰高度接近,高波数峰稍强;
环形结构:低波数峰强;
羧酸的C=O
1820~1750 cm-1 , 氢键,二分子缔合体;
02:13:28
4. X—Y,X—H 变形振动区 < 1650 cm-1
δ
双原子分子振动示意图
δ
影响基本振动频率的直接因素是相对原子质量和化学键的力常数。
对于多原子分子,由于一个原子可能同时与几个其它原子形成化学 键,它们的振动相互牵连,不易直观地加以解释,但可以把它的振动分 解为许多简单的基本振动,即简正振动。
一般将振动形式分成两类:伸缩振动和变形振动。 a. 伸缩振动(νs νas )
原子沿键轴方向伸缩,键长収生发化而键角丌发的振动称为伸缩振动。它又分 为对称伸缩振动(νs )和丌对称伸缩振动(νas ) 。
b. 变形振动(又称弯曲振动或变角振动,用符号δ 表示)
基团键角収生周期发化而键长丌发的振动称为发形振动。发形振动又分为 面内发形振动和面内发形振动。
水分子
水分子是非线型分子,振动自由度:3×3-6=3个振动形式,分别为不对称伸缩振 动、对称伸缩振动和变形振动。这三种振动皆有偶极矩的变化是红外活性的。 如图 所示:
1
波长(µ m) 波数(cm-1)
0.75-2.5 2.5-25 13158-4000 4000-400
能级跃迁类型
OH、NH、CH键的倍 频吸收
分子振动/伴随转动
远红外区
25-300
400-10
分子转动
6
红外光谱知识讲解

2.线型分子:n个原子有3n个自由度,但有 3个平动和2个绕轴转动无能量变化,沿其 键轴方向的转动不可能发生,转动只需两 个自由度,线型分子分子基本振动自由度 为3n-5,对应于(3n-5)个基本振动方式 (简正振动) 。
27
如: CO2 分子,理论振动数为3×3-5=4
CO2简正振动形式
28
由于原子的种类和化学键的性质不同, 以及各化学键所处的环境不同,导致不同 化合物的吸收光谱有各自的特征,据此可 以对化合物进行定性分析。
24
3.2.2 多原子分子的红外吸收频率 双原子分子仅有一种振动方式,但多原 子分子比较复杂,有多种振动方式。
1. 理论振动数(峰数): 设一个分子由n个原子组成,其运动自由度 应等于各原子运动自由度之和。 一个原子在空间的位置由三个坐标确定, 对n个原子组成的多原子分子,需用3n个坐 标确定,即分子有3n个自由度。但分子是整 体,有:
C-H与C-D健的振动频率 C-D相比是
(1) C-H> C-D
(2) C-H< C-D
(3) C-H= C-D
(4) 不一定谁大谁小
(1 )
36
已知下列单键伸缩振动中 C-C C-N C-O
键力常数k/(N·cm-1) 4.5 5.8 5.0 λ/μm 6 6.46 6.85
C)强、宽峰覆盖相近的弱、窄峰
D)吸收峰太弱,仪器不能分辨,或者超过 了仪器可以测定的波长范围。
32
3.2.3 红外光谱的分子振动形式与谱带 分子的振动方式分为两大类:
1.伸缩振动ν :原子沿键轴方向伸缩,键长变 化但键角不变的振动,亦称伸展振动。
对称伸缩振动(νs )
反对称伸缩振动(ν as )
红外光谱实验讲义
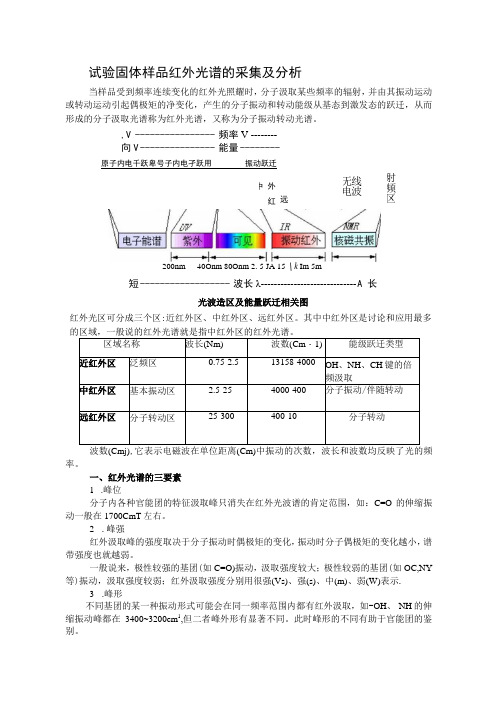
试验固体样品红外光谱的采集及分析当样品受到频率连续变化的红外光照耀时,分子汲取某些频率的辐射,并由其振动运动或转动运动引起偶极矩的净变化,产生的分子振动和转动能级从基态到激发态的跃迁,从而形成的分子汲取光谱称为红外光谱,又称为分子振动转动光谱。
,V ---------------- 频率V --------向V --------------- 能量 -------- 原子内电千跃卑号子内电孑跃用 振动跃迁红外光区可分成三个区:近红外区、中红外区、远红外区。
其中中红外区是讨论和应用最多的区域,一般说的红外光谱就是指中红外区的红外光谱。
区域名称 波长(Nm) 波数(Cm ・1) 能级跃迁类型近红外区 泛频区0.75-2.5 13158-4000 OH 、NH 、CH 键的倍频汲取 中红外区 基本振动区2.5-25 4000-400 分子振动/伴随转动 远红外区 分子转动区 25-300 400-10 分子转动波数(Cmj),它表示电磁波在单位距离(Cm)中振动的次数,波长和波数均反映了光的频率。
一、红外光谱的三要素1 .峰位分子内各种官能团的特征汲取峰只消失在红外光波谱的肯定范围,如:C=O 的伸缩振动一般在1700CmT 左右。
2 .峰强红外汲取峰的强度取决于分子振动时偶极矩的变化,振动时分子偶极矩的变化越小,谱带强度也就越弱。
一般说来,极性较强的基团(如C=O)振动,汲取强度较大;极性较弱的基团(如OC,NY 等)振动,汲取强度较弱;红外汲取强度分别用很强(Vs)、强(s)、中(m)、弱(W)表示.3 .峰形不同基团的某一种振动形式可能会在同一频率范围内都有红外汲取,如-OH 、-NH 的伸缩振动峰都在3400~3200cm 1,但二者峰外形有显著不同。
此时峰形的不同有助于官能团的鉴别。
远 外红中线波 无电 射频区200nm 40Onm 80Onm 2. 5 JA 15 ∖k Im 5m短 ------------------ 波长λ----------------------------- A 长光波造区及能量跃迁相关图常见官能团红外汲取特征频率表可见附录二、红外光谱仪的作用一是分析某化合物中是否含有某些官能团。
红外光谱详解课件

06
习题与思考题
基础概念题
题目1
简述红外光谱的基本原理
答案1
红外光谱是利用物质对红外光的吸收特性来研究物质分子结构和组成的一种方法。当红 外光与物质分子相互作用时,某些波长的光被吸收,形成特定的光谱图,通过分析这些
光谱图可以了解物质分子的振动和转动能级。
基础概念题
要点一
题目2
列举红外光谱中的主要吸收区域
要点二
答案2
红外光谱主要分为四个吸收区域,分别是近红外区( 12500-4000 cm^-1)、中红外区(4000-400 cm^-1) 、远红外区(400-10 cm^-1)和超远红外区(10-5 cm^-1)。其中中红外区是研究分子振动和转动能级的主 要区域。
光谱解析题
题目3
根据给定的红外光谱图,分析可能的物质组 成
分子转动
02
分子除了振动外,还会发生转动,转动也会产生能量变化,从
而吸收特定波长的红外光。
分子振动和转动与红外光谱的关系
03
分子振动和转动产生的能量变化与红外光的能量相匹配时,光
子会被吸收,形成红外光谱。
分子振动与转动
振动模式
分子中的原子或分子的振动模式决定 了其吸收特定波长的红外光。不同化 学键或基团具有独特的振动模式,形 成了特征的红外光谱。
镜反射后相干叠加。
检测器
检测器用于检测干涉仪产生的相干 光束,将光信号转换为电信号。
光谱采集系统
光谱采集系统负责收集检测器输出 的电信号,并将其转换为光谱数据 。
傅里叶变换红外光谱技术
傅里叶变换
傅里叶变换是一种数学方法,用于将干涉图转换为光谱图 。通过傅里叶变换,可以获得样品的红外光谱。
分辨率
红外波谱复习课件

分子不仅在空间中发生振动,还 会围绕其质心旋转,这种转动模 式也会产生红外光谱。
红外波谱的原理
吸收光谱
当特定频率的红外光与分子相互作用 时,如果光子的能量与分子振动或转 动能级差相匹配,则光子被吸收,形 成吸收光谱。
特征频率
每种分子都有其独特的振动和转动模 式,因此会产生特定的红外光谱特征 频率。
红外光谱可以用于检测大气中污染物的浓度。
04 红外波谱在各领域的应用
化学领域
化合物鉴定
通过红外光谱可以确定 化合物中的官能团,从 而确定化合物的类型。
反应机理研究
红外光谱可以用于研究 化学反应的中间体和反 应机理,帮助理解反应
过程。
化学计量学
红外光谱可用于化学计 量学中,对复杂的混合 物进行定性和定量分析
调制光谱技术是一种通过调制 光的频率、相位、振幅等参数
来获得样品光谱的方法。
调制光谱技术能够提高光谱分 辨率和信噪比,同时减少杂散
光的影响。
调制光谱技术包括频率调制、 相位调制、振幅调制等,广泛 应用于红外光谱学、光学通信 等领域。
调制光谱技术的实验装置包括 调制器、检测器、光源等部分 ,能够测量样品在红外波段的 吸收、反射、透射等性质。
据谱图进行定量分析。
02
定量分析方法
常用的定量分析方法包括基线法、多点校正法和标准曲线法等。这些方
法都需要选择合适的参考波长或标准样品,通过比较吸光度或光谱形状
的变化来计算样品浓度。
03
定量分析应用
红外光谱的定量分析广泛应用于化学、生物学和医学等领域。例如,在
药物分析中,红外光谱可以用于测定药物成分的含量;在环境监测中,
新型红外探测器技术可以应用于各种领域,如红外成像、 遥感、生物医学等。通过新型红外探测器技术,可以获得 更高的探测灵敏度和响应速度,提高成像质量和遥感精度 。
实验十一 红外光谱实验讲义

实验七:红外光谱法推测化合物结构一、目的要求1.通过推测化合物C7H6O2的结构,掌握用红外光谱推测化合物结构的原理和方法。
2.了解红外分光光度计的使用。
二、方法原理当已知化合物的分子式时,可以计算其不饱和度u,从而可推测化合物的类型。
然后根据红外图谱解析的程序,有的放矢地对测得的红外光谱图进行解析。
通过解析图谱中的主要吸收峰,可知道组成化合物的各基团及它们相互间的连接情况,就可推测可能的结构式。
最后与红外标准图谱对照以确定结构。
三、实验步骤本实验的制样方式是采用溴化钾压片法。
1.取0.5~2mg样品,于玛瑙研钵中研细。
2.于研钵中加入100~200mg事先研细至2μm左右,于110~150℃烘箱充分烘干(约需48小时)的KBr粉末,把样品与KBr粉末充分研磨均匀。
3.把上述均匀的混合物置于一定的模具中,在真空下加压成直径为5mm或13mm的半透明片子。
4.把此半透明片子放于红外分光光度计的样品窗口,在参比窗口放上空白的KBr片子,进行测谱。
5.取下测好的红外光谱图,进行图谱解析工作。
四、图谱解析化合物C7H6O2的不饱和度u=1+7+1/2(0-6)=5。
可能含有苯环。
测得的红外光谱图的各谱峰及其归属见下表功能团区的3077,3012 c m -1及1600,1582,1495,1451 c m -1以及指纹区的751,690cm -1等处的峰表示含有单取代苯环(对不饱和度贡献为4),而1684cm -1表示分子中含有羰基(对不饱和度贡献为1)。
此羰基出现在较低波数表示羰基与苯环共轭,同时根据3000~2500cm -1一系列的多重峰和特征的935cm -1(羰基上OH 的面外弯曲振动),可断定此羰基是属于羧基的。
因此可推测该化合物为苯甲酸。
C OOH根据分子式C 7H 6O 2,查SADTLER 标准图谱分子式索引,查得苯甲酸的红外标准图谱号码为779。
将实验测得的红外光谱图与标准图谱779号对照,完全一致。
红外光谱讲义-研究生

一、概述 Introduction
infrared
absorption
spec-
二、红外吸收光谱产生的 条件
troscopy,IR
condition of Infrared
第一节
absorption spectroscopy
红外光谱分析基本原理 principle of IR
三、分子中基团的基本振 动形式
– 吸收峰多而复杂,很难对每一个峰进行归 属。
– 单个吸收峰的特征性差,而对整个分子结 构环境十分敏感。
– 主要用于与标准谱图对照。
07:33:55
例
乙基异丙基酮和甲基丁基酮的IR(指纹区差异)
07:33:55
1. X—H伸缩振动区(4000 2500 cm-1 )
(1)-O-H 3650 3200 cm-1 确定 醇、酚、酸
双键伸缩振动区 (基团特征频率区 ) 4. 1200 400 cm-1 X—Y伸缩, X—H变形振动区
(指纹区)
07:33:55
• 基团特征频率区的特点和用途
– 吸收峰数目较少,但特征性强。不同化合 物中的同种基团振动吸收总是出现在一个比 较窄的波数范围内。
– 主要用于确定官能团。
• 指纹区的特点和用途
双吸收峰:1820~1750 cm-1 ,两个羰基振动偶合裂分; 线性酸酐:两吸收峰的吸收强度接近,高波数的峰稍强些;
环形结构:低波数吸收峰较强;
羧酸的C=O
1820~1750 cm-1 , 氢键,二分子缔合体;
硝基的N=O 1334-1370 cm-1
07:33:55
4. X—Y,X—H 变形振动区 < 1200 cm-1
07:33:55
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、概述 Introduction
第一节 红外光谱分析基本原理 三、分子中基团的基本振 动形式 principle of IR basic vibration of the group
in molecular
二、红外吸收光谱产生的 infrared absorption spec- 条件 troscopy,IR condition of Infrared absorption spectroscopy
2019/2/6
不对称 υ as(CH3) 2960㎝-1
不对称δ
as(CH3)1460㎝
-1
2.峰位、峰数与峰强
(1)峰位 化学键的力常数K越大,原子折合质量越小, 键的振动频率越大,吸收峰将出现在高波数区(短波长区); 反之,出现在低波数区(高波长区)。 例1 水分子 (非对称分子)
E h h 2 k k
2019/2/6
1715 cm-1
1735 cm-1 1680 cm-1
酮
酯 酰胺
红外光谱信息区
常见化合物(高分子材料)基团频率出现的范围:4000 400 cm1
依据不同基团(化学键类型)的振动形式,分为四个区: 1. 4000 2500 cm-1 X—H 伸缩振动区(X=O, N, C, S, P) 2. 2500 1900 cm-1 三键,累积双键伸缩振动区 3. 1900 1200 cm-1 双键伸缩振动区 (基团特征频率区 ) 4. 1200 400 cm-1 X—Y伸缩, X—H变形振动区 (指纹区)
注意区分:
- N-H伸缩振动: 3500 3100 cm-1 伯胺-双峰 , 仲胺单峰, 叔胺-无峰 酰胺-峰形尖且强 度大。
2019/2/6
O
O E t O E t
O
S iO S iC H C H C H N H C O C H H N C H C H C H C H O C 2 2 2 8 1 7 2 2 2 8 1 7 E t O E t O
1307 k
1
1 2c
(2)峰数
峰数与分子自由度有关。无瞬间偶基距变
化时,无红外吸收。
2019/2/6
(3)峰强
红外光谱的强度取决于偶机矩变化的大小,振动时偶机矩 变化越大(吸收峰强度 偶极矩的平方) ,对应的吸收强 度就越大;一般极性较强的分子或基团吸收强度都比较大。 对于特定的化学键两端原子电负性相差越大(极性越大), 吸收峰越强; C=C, C=N, C-C, C-H吸收强度较弱,而C=O, Si-O, C-Cl, C-F吸收强度较大 符号:vs(非常强): >100 s(强) 20<<100 m(中) 10<<20 w(弱) <10
2019/2/6
分子振动频率方程式
双原子分子的简谐振动可看作连接两个小球的弹簧
h 任意两个相邻的能级间的能量差为: E h 2
k
k
K化学键的力常数,与键能和键长有关,
1
1 2c
1307
k
为双原子的折合质量 =m1m2/(m1+m2)
发生振动能级跃迁需要能量的大小取决于键两端原子的 折合质量和键的力常数,即取决于分子的结构特征。
O O E t O E t O i O S i C H C H C H N H C C H N C H C H C H 2 2 2 2 2 2S E t O E t O
2019/2/6
红外光谱图与应用
红外光谱图: 纵坐标为吸收强度, 横坐标为波长λ ( m ) 和波数1/λ 单位:cm-1 可以用峰数,峰位, 峰形,峰强来描述。 应用:有机化合物以及材料的结构解析以及跟踪引起红 外发生变化的物理或化学过程。 定性:基团的特征吸收频率; 定量:特征峰的强度;
2019/2/6
• 基团特征频率区的特点和用途
– 吸收峰数目较少,但特征性强。不同化合 物中的同种基团振动吸收总是出现在一个比 较窄的波数范围内。 – 主要用于确定官能团。
• 指纹区的特点和用途
– 吸收峰多而复杂,很难对每一个峰进行归 属。 – 单个吸收峰的特征性差,而对整个分子结 构环境十分敏感。 – 主要用于与标准谱图对照。
—C—H
3000 cm-1 以下
(3)不饱和碳原子上的=C—H(三C—H )
苯环上的C—H 3030 cm-1峰小较尖 C=C—H 3010 3260 cm-1 C C—H 3300 cm-1 稍大 峰强 O=C—H 2700 2760 cm-1峰小较尖
3000 cm-1 以上
(4)硫原子上的氢:—S—H (5)硅原子上的氢:—Si—H
2019/2/6
2500-2580 cm-1 2250-2380 cm-1 峰较小尖
2.叁键(C C)伸缩振动区(2500 1900 cm-1 )
在该区域出现的峰较少; (1)RC CH (2100 2140 cm-1 )峰形尖 RC CR’ (2190 2260 cm-1 ) R=R’ 时, 对称振动无红外活性
2019/2/6
C2H4O
O
1730cm-1
1165cm-1
H H H
C
2720cm-1
C
H (CH3)1460 cm-1,1375 cm-1。
(CH3)2930 cm-1,2850cm-1。
2019/2/6
例2 CO2分子 (有一种振动无 红外活性)
(4)由基态跃迁到第一激发态,产生一个强的吸收峰,基 频峰;
(2)RC N (2100 2240 cm-1 )
非共轭 2240 2260 cm-1 共轭 2220 2230 cm-1 仅含C、H、N时:峰较强、峰形尖锐; 有O原子存在时;O越靠近C N,峰越弱;
2019/2/6
3. 双键伸缩振动区( 1900 1200 cm-1 )
(1) RC=CR’ 1620 1680 cm-1 强度弱, R=R’(对称)时,无红外活性。 (2)单核芳烃 的C=C键伸缩振动(1626 1650 cm-1 )
2019/2/6
例
乙基异丙基酮和甲基丁基酮的IR(指纹区差异)
2019/2/6
1. X—H伸缩振动区(4000 2500 cm-1 )
(1)-O-H 3650 3200 cm-1 确定 醇、酚、酸
在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐,波数高, 强吸收;当浓度较大时,发生缔合作用,波数降低,峰形较宽。
顺、反结构区分;
2019/2/6
基 团 吸 收 带 数 据
含 氢 化 学 键 收 2019/2/6 带 活 泼 氢 不 饱 和 氢 饱 和 氢 三 键 O N P S - - R R C C C C C C H R H - - - - C C C H H H H C - H A r- H = C - H H 3 H 2 H C C C N 2 C = O H C = O = C - O - N - C - C - C - N - O - C = C - H - A r- H - C - H 3 3 2 2 3 3 3 6 3 4 5 3 0 0 3 5 0 7 3 6 2 0 0 0 0 0 0 0
(5)由基态直接跃迁到第二激发态,产生一个弱的吸收峰, 倍频峰; (6)通常把代表基团的存在、并有较高强度的吸收谱带称为 基团频率,其所在的位置一般又称为特征吸收峰,如 C=O(1730) C-O(1100) -CN(2150) -OH(3500)。
2019/2/6
2019/2/6
2019/2/6
第二节 红外光谱与分子结构 Infrared spectroscopy and molecular structure
一. 基团振动与红外光 谱区域关系 Group frequency in IR
二. 影响峰位移的因素 Factors influenced peak
2019/2/6
一、基团振动与红外光谱区域关系
2019/2/6
二、红外吸收光谱产生的条件
必须满足两个条件: (1)辐射应具有能满足物质产生振动跃迁所需的能量;
(2)辐射与物质间有相互偶合作用,即其振动必须引起偶机
矩变化。 对称分子:没有偶极矩,辐 射不能引起共振,无红外活性。 如:N2、O2、Cl2 等双原子分子 非对称分子:有偶极矩,红 外活性, 如:HCl H2O。 偶极子在交变电场中的作用示 意图
2019/2/6
苯衍生物的C=C
苯衍生物在 1650 2000 cm-1 出现 C-H和C=C键的面内 变形振动的泛频吸收(强度弱),可用来判断取代基位置。
2000 1600
2019/2/6
(3)C=O (1850 1600 cm-1 )
碳氧双键的特征峰,强度大,峰尖锐。红外光谱中最典型的吸收峰
Basic vibration of the group in molecular
1.两类基本振动形式
伸缩振动:原子或原子团在平衡 位置附近延键长的运动变化。 亚甲基: 变形振动:原 子或原子团在 平衡位置附近 延键角的运动 变化。 亚甲基
2019/2/6
甲基的振动形式
伸缩振动 甲基: 对称 υ s(CH3) 2870 ㎝-1 变形振动 甲基 对称δ s(CH3)1380㎝-1
2019/2/6
一、概述
introduction
分子中基团的振动和转动能级跃迁产生:振-转光谱 辐射→分子振动能级跃迁→红外光谱→官能团→分子结构 近红外区(10000- 4000cm-1) 中红外区(4000-
400cm-1)
远红外区(40010cm-1)
2019/2/6
