第5章芳烃芳香性
5章 芳烃 芳香性

杂化轨道理论的解释: 苯分子中12个原子共面,其中六个碳原子均采 取sp2杂化,每个碳原子上还剩下一个与σ平面⊥的 p轨道,相互之间以肩并肩重叠形成π66大π键。
5.2 苯的结构 (structure of benzene)
H H H (a)
1200
H
1200
H H
120
0
C H C
C
C H
H
H C H
第五章
芳烃
芳香性
CH3 CH3 苯 甲苯 H C 联苯 三苯甲烷 CH3 二甲苯
芳烃按其结构分为三类:
单环芳烃
芳烃
多环芳烃
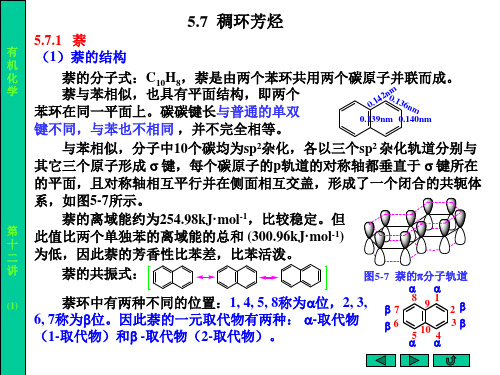
稠环芳烃 萘 菲
5.1 芳烃的构造异构和命名 5.1.1 构造异构 一元取代只有一个结构式,二、三、四元取 代各有三个异构体。 CH2CH3 CH(CH 3)2 CH3 例:
间二基苯 93%
(苯环钝化)
CH3 + HNO3
H2SO 4 30 C
CH3 。 NO2 +
邻硝基甲苯 58%
CH3
(苯环活化)
NO2
对硝基甲苯38%
5.4.1 亲电取代反应
(3) 磺化 (sulfonation)
¨ + ÅH2SO4
80 C
Å
SO3H
+ H2O
+ H2SO4 SO3
²ÅÅÅ Å î µ
第五章 芳烃 芳香性
5.4 单环芳烃的化学性质 5.4.1 取代反应 5.4.2 苯环上亲电取代反应机理
5.4.3 加成反应 5.4.4 氧化反应 5.4.5 聚合反应 (自学)
5.4 单环芳烃的化学性质 三种反应:√取代、加成、侧链上的反应 5.4.1 取代反应 (1) 卤化 (halogenation) Cl
第五章 芳烃

(4)多元取代苯: 用数字表明取代基位臵,小基团处于 1号位,取 代基位臵和最小。
CH3 CH3 CH3 CH2CH3 CH(CH3)2 C(CH3)3 CH3 CH2CH3 CH3
CH(CH3)2
1-甲基-3-异丙苯
1-甲基-4-叔丁苯 1,4-二甲基-2-乙苯
1-甲基-4-乙基-3-异丙苯
(5). 多官能团化合物 的命名
硝化反应机理:
+ H2O + NO 2 NO 2 +
快
HO + H2O H
NO2 + H2SO4Leabharlann NO 2+
HSO 4
NO2
H2O H
+
NO 2
+
+ NO 2
慢
•硝化反应中的亲电试剂是NO2+(硝酰正离子)
(c)磺化反应
苯与浓硫酸或发烟硫酸作用,环上的一个 氢原子被磺(酸)基(-SO3H)取代,生成苯 磺酸的反应。
•当含有不同官能团时,一般按官能团的优先次序确定母 体,排在前面优先考虑。
•除作母体的官能团外,其它官能团均作取代基。 •编号,命名。 官能团先后顺序:
—COOH、—SO3H、COOR、COCl、—CONH2、—CN、—CHO、— COR、—OH、—NH2、 —C=CR、—C=CHR、—OR、—R、—Cl、—NO2
HC C CH2-CH2-C CH
CH2=CH-C
C-CH=CH2 CH
CH2=CH-CH=CH-C
因苯不易进行加成和氧化反应,却较易进行取代反应。
C 6H6
+
Br2
FeBr3
C 6H5Br + HBr
大学有机化学重点知识总结第五章 芳烃 芳香性

NH2
Cl
OCH3
2-甲 氧 基 -6- 氯 苯 胺
OH
CH3
1
COCH3
3-甲基-4-羟基苯乙酮
大学有机化学重点知识总结第五章 芳烃 芳香性
§5.2 苯的结构
3H2
208.5 kJ/mol
H2
119.3 kJ/mol
苯的氢化热:208.5 kJ • mol-1 环己烯氢化热的3倍:
3×119.3 =357.9 kJ•mol-1
* 5、芳烃侧链的反应
大学有机化学重点知识总结第五章 芳烃 芳香性
一、 芳环上亲电取代反应
试剂中的亲电部分从芳环上取代一个H原子
4–羟基–3–甲氧基苯甲醛
大学有机化学重点知识总结第五章 芳烃 芳香性
C O O H> SO 3H> C O O R> C O C l > C O N H 2> C H O> CO> O H> N H 2> CC >
COOH
1
CC> O R> C l > N O 2
对 -甲 酰 基 苯 甲 酸
CHO
轨道; 6 个π 电子离域在6个C原子上。
p6 6
大学有机化学重点知识总结第五章 芳烃 芳香性
图 5.2 苯的闭合的π轨道 4.环状的共轭体系导致苯分子具有相当高的稳 定性。电子云完全平均化,故无单双键之分。
大学有机化学重点知识总结第五章 芳烃 芳香性
苯分子中的骨架
大学有机化学重点知识总结第五章 芳烃 芳香性
CH3 C CHCH3
2–甲基–3–苯基戊烷 2–苯基–2–丁烯
PhC CH
苯乙炔
CH2
第五章_芳烃_芳香性

23
O
CH2(CH2)3OH BF3 H
AlCl3 δ+ δ-
-H2O
CH2(CH2)3Cl BF3 H CH2CH2COCl
H
BF3
O
-HCl
2ClSO3H CCl4
SO3H + H2SO4 + HCl
24
AlCl3 -CuCl2 35~50℃, H2 Ni, △ 9O2 V2 O 5 Cl2 AlCl3 700~800℃
NH2
氨基活化苯环 K2Cr2O7 H2SO4
COOH COOH
49
萘环上二取代 α位: 原基团为第一类 进入同环上的α位
β位: 进入同环上的1位 α位: 进入异环上的α位,有2个 原基团为第二类 β位:进入异环上的α位,有2个
50
特殊
CH3
H2SO4
CH3
H H
C O C O
O
HO3S
CH3
HOOCH2CH2CC O
+
-CN, -SO3H , -NH3
29
-CO NH 2,
+
5.5.2 理论解释:甲苯取代定位机理 稳定 CH3 CH3 CH3 CH 3° 3 E E E E H H H H
CH3
CH 3
CH 3
CH3 3°
稳定
H
E
CH3 E H
H
CH3 E
E
H E CH 3
E H
H
CH 3 2° E H
E
不稳定
57
1984年,克罗托赴美国参加学术会议, 在莱斯大学参观,经化学系主任介绍, 认识了研究原子簇化学斯莫利教授, (R.E.Smally) 观看斯莫利教授和他研究生设计的激光超 团簇发生器,在氦气中用激光合碳化硅变成蒸 汽的实验,克罗托对这台仪器非常感兴趣,这 正是他所渴求的, 1985年8月-9月,三位科学家合作研究,用高 功率激光轰击石墨,使石墨中的碳原子汽化,
5第五章 芳烃 芳香性
O CCH2CH2CH3 Zn—Hg HCl,
CH2CH2CH2CH3 73%
5、氯甲基化反应 、
在无水ZnCl2存在下,芳烃与甲醛及 存在下,芳烃与甲醛及HCl作用,芳 作用, 在无水 作用 环上氢原子被氯甲基( 环上氢原子被氯甲基(—CH2Cl)取代 ) 与烷基化反应相似,芳环上不能连有强吸电基。 与烷基化反应相似,芳环上不能连有强吸电基。 实际操作中可以用多聚或三聚甲醛代替甲醛
FeCl3 25 0 C
Cl
卤素活性: 卤素活性:F2 > Cl2 > Br2 > I2 芳烃活性:烷基苯>苯 卤代苯 芳烃活性:烷基苯 苯>卤代苯
Cl 90%
Cl
Cl
Cl
Cl
Cl2 FeCl3
39%
Cl 55%
6%
CH3
Cl2, FeCl3 , CH3COOH 25 0C
CH3 Cl
CH3
CH3
浓HNO3 浓 H2SO4 50-60 C
NO 2
0
NO2 75-85%
NO2
NO2
NO 2 NO 2
浓 HNO3, 浓 H2SO4 100-110 C
93%
0
NO2
NO2
1%
6%
CH3
CH3
CH3
浓 HNO 3, 浓H 2SO 4 30 C
0
CH3
NO2
NO2
59%
NO2
37%
4%
硝化反应机理
O2N OH
简并轨道
6 p 6个p轨道
三、共振论对苯分子结构的解释
Kekulé 结构式 结构式:
第五章---芳烃--芳香性

第五章---芳烃--芳香性第五章 芳烃 芳香性(一) 出分子式为C 9H 12的单环芳烃的所有同分异构体并命名。
解:C H 2C H 2C H 3C H (C H 3)2C H 3C 2H 5C H 3C 2H 5正丙苯异丙苯邻甲基乙苯间甲基乙苯C H 3C 2H 5C H 3C H 3C H 3C H 3C H 3C H 3C H 3C H 3C H 3偏三甲苯均三甲苯CH H(4) 1,4-二甲基萘 酸 (6) 1-甲基蒽(7) 2-甲基-4-氯苯胺 (8) 3-甲基-4羟基苯乙酮 (9) 4-羟基-5-溴-1,3-苯二磺酸(三) 完成下列各反应式:解:红色括号中为各小题所要求填充的内容。
(1)+ C l C H 2C H (C H 3)C H 2C H 3C C H 3C H 3C H 2C H 33(2)+(过量)C H 2(3)N O 2NO 2+(主要产物)(4) 32O 40 CoO 2N(5) +(6) C C H 2O+H 2O H(7)(B )(15) F C H 2C l C H 2F3+(16)C H 2C H 3C H =C H 2N B S , 光C C l 4K O HC H C H 3rC H C H 2rBr B r C C l(四) 用化学方法区别下列各组化合物:(1) 环己烷、环己烯和苯 (2) 苯和1,3,5-己三烯解:(1) 环己环苯退色x(2) 1,3,5-(五) 写出下列各反应的机理:OC H 3C H C C H +- H +C C H 3O +(六) 己知硝基苯(Ph —NO 2)进行亲电取代反应时,其活性比苯小,—NO 2是第二类定位基。
试部亚硝基苯(Ph —NO)进行亲电取代反应时,其活性比苯大还是小?—NO 是第几类定位基?解:由于氧和氮的电负性均大于碳,在亚硝基苯所以亚硝基苯(Ph —NO)进行亲电取代反应时,(11) N H C 3(14)(16)(18)讨论:A.(10)的一元硝化产物为O C H3N O2而不是O C H3O2,因为与前者相关的σ-络合物中正电荷分散程度更大,反应活化能更低:22物:(1)O C H3N O2(2)C O O HC O O H(3)N O2N O2(4)NO2COOH(九) 将下列各组化合物,按其进行硝化反应的难易次序排列:(1) 苯、间二甲苯、甲苯(2) 乙酰苯胺、苯乙酮、氯苯解:(1)间二甲苯>甲苯>苯解释:苯环上甲基越多,对苯环致活作用越强,越易进行硝化反应。
大学有机化学第五章芳烃

⼤学有机化学第五章芳烃第五章芳⾹烃【⽬的要求】1、掌握单环芳烃的结构;单环芳烃的同分异构和命名;单环芳烃的化学性质;萘的结构及萘的化学性质;蒽和菲的结构;正确理解芳⾹性及H ückel 规则与芳⾹性的关系。
2、正确理解价键理论、分⼦轨道理论和共振论对苯分⼦结构的解释;熟悉苯的物理性质。
3、了解其它多环芳烃;⾮苯芳烃;芳烃的来源。
【教学内容】第⼀节单环芳烃⼀、苯的结构(⼀)苯的开库勒(Kekul é)结构式(⼆)苯分⼦结构的近代概念1、分⼦轨道理论对苯分⼦结构的认识2、共振论对苯分⼦结构的解释⼆、单环芳烃的异构和命名苯的⼀元取代物没有异构体,命名⼀般以苯为母体,烷基为取代基。
苯的⼆元取代物有三种异构体,命名时可⽤阿拉伯数字或“邻、间、对”字头表⽰取代基的不同位置。
CH 3CH 3CH 3CH 3CH 3邻⼆甲苯间⼆甲苯对⼆甲苯三、单环芳烃的物理性质四、单环芳烃的化学性质苯环是⼀个平⾯结构,离域的π电⼦云分布在环平⾯的上⽅和下⽅,它象烯烃的π电⼦⼀样,能够对亲电试剂提供电⼦,但是,苯环是⼀个较稳定的共轭体系,难以破坏,所以苯环很难进⾏亲电加成,易于亲电取代。
亲电取代是苯环的典型反应。
(⼀)、亲电取代反应芳烃的重要亲电取代反应有卤代、硝化、磺化和傅-克烷基化、酰基化反应等。
1、卤代反应在催化剂 (AlCl 3、FeX 3、BF 3、ZnCl 2、等路易斯酸) 的存在下,苯较容易和氯或溴作⽤,⽣成氯苯或溴苯。
这类反应称为卤代反应(halogenation)。
Br溴苯2、硝化反应苯与浓硫酸和浓硝酸(也称混酸)共热,苯环上⼀个氢原⼦被硝基(—NO 2)取代,⽣成硝基苯。
这个反应称为硝化反应(nitration)。
NO23、磺化反应苯与浓硫酸反应很慢,与发烟硫酸(含SO3的浓硫酸)反应较快,在室温下即可作⽤,苯环上的氢原⼦被磺酸基(—SO3H)取代⽣成苯磺酸。
这类反应称为磺化反应(sulfonation)。
芳烃芳香性
CH3
Cl
甲苯
(toluene)
氯苯
(chlorobenzene)
CH3
异丙苯
C H C H 3 (isopropyl-
benzene)
NO2
硝基苯
• 当苯环上连有两个以上取代基时,需标明取
代基位次或取代基间的相对位置。
①用阿拉伯数字表明相对位置
②仅有两个取代基,也常用邻、间、对
或 o– : ortho-; m– : meta-; p– : para-
反应机理:
第一步 碳正离子的生成:
C H 3
C H 3
C H C l+ A lC l3
C H + C lA lC l3
C H 3
C H 3
第二步 碳正离子作为亲电试剂进攻苯环,
形成 新的C-C 键:
H +
CH3 CH
慢
CH3
CHCH3 H
CH3
决定反应速率的一步
第三步 失去质子,生成烷基苯:
C H 3 C H H C H + 3C l A lC l3快
2 Cl
链增长: CH3
CH2
+ Cl
+ HCl
CH2
CH2Cl
+ Cl2
+ Cl
.......
CH2 与 C H 2 C HC H 2 相似, 比烷基自由基稳定。
当苯环上连接的烷基较长时,卤化反应 仍主要在α位,因为苄基型自由基比较稳 定。
O OO
C H 2 C H 3+
NB rP h C O O C P h O C C l4 ,8 0 ° C
第五章 芳烃 芳香性
第5章芳烃芳香性.
甲苯
异丙苯
2
5.1.2 苯的多元取代物 • 苯为母体,标出取代基的位置
CH3 CH3 CH3 CH3 CH3
CH3
1,2-二甲苯 邻二甲苯
1,3-二甲苯 间二甲苯
1,4-二甲苯 对二甲苯
3
CH3 CH3 CH3 CH3
CH3
CH3 CH3 CH3 CH3
1,2,3-三甲苯 连三甲苯
1,3,5-三甲苯 均三甲苯
均苯四甲酸二酐
38
(3) 聚合反应
CH CH2 n
过氧化苯甲酰 。 C
80 90
CH CH2
n 聚苯乙烯
39
5.5 苯环上亲电取代反应的定位规则 5.5.1 两类定位基
• 根据大量实验结果,把取代基分成两类: 与苯环直接相连的原子上 具有单键或带负电荷
具有重键或带正电荷
40
间位致钝基
(苯) 邻对位致钝基
18
CH3 +
CH3
Br
② 硝化 A 苯硝化
NO2 H2SO4 + HNO3 50-60℃ 混酸 H2SO4 + HO—NO2 .. H O NO2 H .. H O NO2 + H + H2SO4 NO2 + E H3O + HSO4
-
HSO4-
• 只用浓硝酸,不用浓硫酸,反应速度将慢很多
19
B 硝基苯继续硝化,比苯难,间位产物为主
• 物理方法测定,6个C和6个H共平面,
• C-C < 键长< C=C
8
5.2.1 价键理论 • C :SP2 • 六个轨道形成
6 6
,键长平均化
=>
第五章 芳烃 芳香性
酰化能力的强弱次序是:酰卤 > 酸酐 > 酸 环上连有-NO2,-SO3H,-COR,-CN等强吸电子基时,一般不反应
AlCl3的用量:
(1) 用酰氯时,>1equiv; (2) 用酸酐时,>2 equiv
烷基化反应可逆,酰基化反应不可逆
消耗1eqv. AlCl3
R CH3
Ph R Ph X Ph NO2
Ph:苯基(phenyl) 烷基苯
X
甲苯
Br
异丙苯
Cl NO2
卤代苯
溴苯
氯苯
硝基苯
② 苯环为取代基
2-苯基庚烷
③多取代苯的命名(P.196)
3
2
OH
1
H2N
4
COOH
2-羟基-4-氨基苯甲酸
2 苯的结构
平面共轭闭合大π 键
苯的共振结构式
贡献大
主要
③ a 位有吸电子基——异环取代
W E
W
W
E +
E
钝化的环
例:
NO2 HNO3 H2SO4 + NO2 NO2 NO2
NO2
产率
13%
45%
④ b 位有吸电子基——异环取代
E
W
W
W +
E
E
① >③ >④ >② >⑤
(4)①对二甲苯 ②对苯二甲酸 ③甲苯 ④对甲基苯甲酸 ⑤间二甲苯 ⑤ >① >③ >④ >②
(4)取代基的定位作用在合成上的应用
例 1:
Br 或 NO2 NO2 Br
有机化学第五章芳烃芳香性

芳烃与混酸作用,芳环上H原子被硝基取代生成硝基取代芳烃。
硝化反应
硝化剂:浓HNO3 + 浓H2SO4(简称混酸) 底物活性:烷基苯>苯>硝基苯
硝化反应机理
硝化反应
(c) 磺化反应
Sulfonation
芳烃与浓H2SO4作用,芳环上H原子被磺(酸)基-SO3H取代生成芳磺酸。
a. 磺化剂: 浓H2SO4 或 发烟H2SO4 b. 底物活性:烷基苯>苯>苯磺酸
氯苯的亲电取代定位分析
稳定 稳定
硝基苯的亲电取代定位分析
极不稳定 极不稳定
小结
决定性的极限结构
决定性的极限结构
Z供电,亲电试剂进攻邻对位有利 Z吸电,进攻邻对位不利
(2) 空间效应
空间效应越大,邻位异构体越少
R
p-
m-
CH3
58.4
37.2
4.4
CH2CH3
45
48.5
6.5
CH(CH3)2
磺化反应机理
机理:
取代反应的位置
磺化反应可逆
磺化反应是可逆的:强酸利于磺化,热的稀酸水溶液利于脱磺酸基。
(d). Friedel-Crafts 反应 在催化剂作用下,芳烃中芳环上氢原子被烷基或酰基取代的反应。 a. 常用催化剂:AlCl3、FeCl3、ZnCl2、(HF、BF3、H2SO4) b. 常用烷基化剂:卤代烃、烯烃(醇) c. 常用酰基化剂:酰卤、酸酐(酸)
烷基化反应可以通过醇或烯烃生成碳正离子,发生烷基化反应。
Friedel-Crafts酰基化反应
酰基化不可逆,产物单一。
AlCl3用量: 用酰氯时,用量 > 1 eqv. 用酸酐时,用量 > 2 eqv.
第十二讲 第五章 芳烃 芳香性(3)
H H
1,4-二氢萘 伯奇 二氢萘 伯奇(Birch)还原,优 还原, 还原 孤立双键不被 先还原较活泼的环。 先还原较活泼的环。 进一步还原。 进一步还原。
H2, Rh-C或Pt-C - 或 ,加 压
在强烈条件下加氢时,催化剂和反应条件不同,可得四氢化萘或十氢化萘: 在强烈条件下加氢时,催化剂和反应条件不同,可得四氢化萘或十氢化萘:
α-萘乙酸 萘乙酸
萘乙酸简称NAA:无色针状或粉末状晶体,m.p. 134. 5~135. 3℃, α-萘乙酸简称 萘乙酸简称 :无色针状或粉末状晶体, ℃ 难溶于冷水,易溶于热水、乙醇和乙酸等。是一种植物生长激素, 难溶于冷水,易溶于热水、乙醇和乙酸等。是一种植物生长激素,能促进 植物生根、开花、早熟、高产,对人畜无害。 植物生根、开花、早熟、高产,对人畜无害。 (b)氧化反应 ) ① 在较温和的条件下氧化得醌,产率较低。例如: 在较温和的条件下氧化得醌,产率较低。例如:
空间相互作用较大
H SO3H
H
空间相互作用较小
SO3H H
(3)
α-萘磺酸 萘磺酸
β-萘磺酸 萘磺酸
有 机 化 学
同时由于磺化反应是可逆反应,故高温使成为β 萘磺酸主要产物 萘磺酸主要产物。 同时由于磺化反应是可逆反应,故高温使成为β-萘磺酸主要产物。且 萘磺酸的热稳定性好于α 萘磺酸, β-萘磺酸的热稳定性好于α-萘磺酸,该反应是热力学控制的反应。 萘磺酸的热稳定性好于 萘磺酸 该反应是热力学控制的反应。 磺基易被其它基团取代,因此高温制得的β 萘磺酸是制备某些 取代 萘磺酸是制备某些β 磺基易被其它基团取代,因此高温制得的β-萘磺酸是制备某些β-取代 萘的桥梁。 制备β 萘酚 萘的桥梁。如:制备β-萘酚
第五章 芳烃 芳香性

• 第二类定位基-间位位定位基: (钝化
苯环) -N+(CH3)3, -NO2, -CN, -SO3H, -CHO, COCH3, COOH, -COOCH3, -CONH2, N +H 3 ;
B:苯环上取代反应定位规则的理论解释
• (1)电子效应
Z H Z E+ Z + E+ E Z
+ Z E + H E H
常用烷基化试剂:卤代烷,烯烃,醇, Cl 环醚; CH2=CH-Cl
不能做烷基化试剂
烷基化反应历程:
CH3CH2Cl + AlCl3 CH3CH2+AlCl4CH2CH3 + CH3CH2+AlCl4CH2CH3 + H+ + H
特点:可逆,歧化,重排
1). 可逆:芳烃可以在催化条件下烷 基化成为烷基苯,烷基苯也可在同 一催化剂存在下脱烷基成为芳烃。
二硝化主要产物为间二硝基苯;
NO2 + 浓 HNO3 浓 H2SO4 100~110℃ 93% NO2 + NO2 NO2 1% NO2 + NO2
NO2
6%
CH3 浓 HNO3 浓H2SO4 30℃
CH3 NO2 +
CH3 +
CH3
NO2 NO2
59%
37%
4%
硝化反应历程
H2SO4 + HONO2 H2O+ NO2 H2O + H2SO4 2H 2SO4 HNO3
• (一)苯系芳烃分类:
1.单环芳烃:分子中含有一个苯环;
2.多环芳烃:分子中含有两个或两个以上独立苯 环;
3.稠环芳烃:分子中两个或多个苯环彼此间共用 两个相邻碳原子而成的芳烃;
《有机化学》第五章芳香烃

CH(CH3)2
CH 2CH=CH 2
异丙苯
3-苯基丙烯
CH3 CH3
1,2-二甲苯 (邻二甲苯)
CH 3
CH3
CH3 1,3-二甲苯 (间二甲苯)
1,4-二甲苯 (对二甲苯)
CH 3
CH 3CHCH 2CHCH 3 CH3
CH3 C=C
C2H5
H
2-甲基-4-苯基戊烷
2-苯基-2-戊烯
芳基:Ar- 苯基: C6H5- , Ph
CH2CH3
+ CH3CH=CH2 无水AlCl3
CH(CH3)2
当苯环上有强的吸电子基时,烷基化反应不容易进行。
比较:烷基ห้องสมุดไป่ตู้与酰基化的异同
相同:① 催化剂相同 ② 反应历程相似 ③ 苯环上有吸电子基时不能发生付-克反应
不同:① 烷基化能发生异构化,而酰基化不能; ② 烷基化不停留在一取代物上,而酰基化停留 在一取代物上; ③ 二者催化剂用量不同,烷基化用量少,酰基 化用量多。
第五章 芳香烃
学习要求:
1.了解芳香烃的分类;掌握苯系单环芳烃的异构和命名 2. 掌握苯的结构及其化学性质 3. 掌握芳烃亲电取代的定位规律及其理论解释 4. 了解稠环芳香烃、非苯芳香烃;掌握休克尔规则
重点:
苯的结构及其化学性质;芳烃取代的定位规律及 休克尔规则
本章主要内容
第一部分 单环芳烃的概述及性质 第二部分 芳香烃的亲电取代反应历程 第三部分 芳烃亲电取代的定位规律 第四部分 稠环芳香烃概述 第五部分 休克尔规则和非苯芳香体系
二、亲电试剂与芳烃反应,得到中间体σ—配合物
H
+ Cl+
+ Cl
三、σ-配合物脱去一个质子,形成芳烃的取代产物
五章芳烃芳香性

CH3 H2SO4
CH3 SO3H
0℃
43%
100℃
13%
原因: 空间效应
CH3
SO3H 53% 79%
CH3
SO3H
4% 8%
(d)Friedel-Crafts 反应
在在无水氯化铝等催化剂作用下,芳烃与卤代烷和酸酐等 作用,环上氢原子被烷基或酰基取代的反应,分别称烷基 化反应和酰基化反应,统称Friedel-Crafts 反应。
苯的分子式为:C6H6,其C / H与乙炔类似 ,为 1∶1,可 见它具有高度的不饱和性,因而,应发生下面的反应:
KMnO 4 ,煮 沸
Br2 (加 成)
这就是说,要破坏苯环体系是比较困难的。
然而,苯环上的氢原子却容易被取代,如:
HNO3 + H2SO4 50 ~ 60 。C
NO2
淡黄色油状物,苦杏仁味
3H2
208.5 kJ/mol
氢化热低(208.5<3×119.3=357.9kj/mol),表明苯具有特 殊稳定性.
现代物理方法证明: 苯分子C6H6: 正六边形、共平面 键角120° 键长0.140nm(C-C: 0.154nm ;C=C:0.134nm)
H
H 120°
H
0.140nm H
120°
A B
邻(o-)
A
B
间(m-)
A
B
对(p-)
5.1.2 命名
以苯环为母体,烷基作为取代基。二个或多个取 代基,用阿拉伯数字表明相对位次。
二取代苯:
CH3 1 2 CH3
1CH3
2
3
CH3
1,2-二甲苯 1,3-二甲苯 邻二甲苯 间二甲苯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)在苯环中,由于形成了闭合环状共轭大π键,
使苯环稳定性增加
反应中总是苯环结构保持不变,
易发生取代,不易加成。
2021/3/11
第5章芳烃芳香性
13
三、单环芳烃的化学性质
1 芳环上亲电取代反应
当芳环与亲电试剂作用时的发生取代反应----亲电取代
反应:
+EY
E +HY
硝化 卤化
2021/3/11
磺化
偏三甲苯
(1,2,3- 三甲苯) (1,3,5-三甲苯) (1,2,4-三甲苯)
CH2CH3
CH2CH2CH3 • 选取最简单的取代基为1位,
CH3(CH2)3
将其它取代 基位号按尽可能
1–2乙021/基3/11–2–丙基–5–丁基苯第5章芳小烃芳的香性方向循苯环编号。 7
一. 芳烃的构造异构和命名
3)复杂芳烃的命名
命名时,通常以烃链为母体,以苯作为取代基。
CH3CH2CH CHCH3 CH3
CH3 C CHCH3
2–甲基–3–苯基戊烷
2–苯基–2–丁烯
PhC CH
苯乙炔
CH2
二苯基甲烷
2021/3课/11 堂练习:P153 习第题5章芳5烃.芳3香性
CH2 Cl
苄基氯
8
二 苯的结构
结构特点:
C H 3
苯基 (Ph)
2021/3/11
Байду номын сангаас
苯甲基 (苄基)
2-甲苯基 3-甲苯基 4-甲苯基 邻甲苯基 间甲苯基 对甲苯基
第5章芳烃芳香性
5
一. 芳烃的构造异构和命名
2)简单芳烃的命名
•简单的芳烃以苯环为母体,烷基作为取代基,称“某苯”
CH3
CH3 CHCH3
NO2
Cl
甲苯
异丙苯
硝基苯
氯苯
二取代苯的3个异构体:
CH3
CH3
CH3
CH3
1,2–二甲苯
1,3–二甲苯
邻二甲苯
2021/3o/1–1 二甲苯
间二甲苯
m第–5章二芳烃甲芳香苯性
CH3
CH3
1,4–二甲苯 对二甲苯
p–二甲苯 6
一. 芳烃的构造异构和命名
多取代苯: CH 3 CH 3
CH 3
CH 3
CH 3
CH 3
CH 3
CH 3
CH 3
连三甲苯
均三甲苯
Br2
1)苯只产生一种一元取代物(C6H6
C6H5Br)
Fe
苯中各个氢原子都是等同的;
2)苯起取代反应,而不起加成反应,苯环稳定性高;
如
2021/3/11
Pt + H2
+ 3H2
Pt
第5章芳烃芳香性
△ H= -119.3kJ/mol
估计:3×(-119.3)= -357.9kJ/mol
9
实测:-208.5kJ/mol
SO3H
+ H2SO4
+ H2O
2021/3/11
第5章芳烃芳香性
17
四 单环芳烃的化学性质
•苯与发烟硫酸则在室温下即生成苯磺酸
SO3H
+H2SO4•SO3
+H2SO4
注意:(1)反应通常可逆,利用这一性质,可将-SO3H 从苯环上去掉。
SO 3H + H2O 180℃
+ H2SO4
2021/3/11
第5章芳烃芳香性
18
四 单环芳烃的化学性质
(2)若反应条件强烈,可得二元取代产物。
SO3H
+
H2SO4 SO3
200-230 0C
问题:为什么没有邻、对位产物?
SO 3H
+ H2SO4
SO 3H
应用: (1)鉴别芳烃、苯(现象:溶于H2SO4,不分层);
(2) 有机合成中 “占位”,如:
O H
H 2 S O 4
O H
B r
2 m o lB r2
SO 3H NO2
H
X
第5章芳烃芳香性
图 5.4 芳环上亲电取代反应的类型
烷基化
R 酰基化
O
CR
14
三、单环芳烃的化学性质
1) 卤化
H + B r 2
F e
△
B r + H B r
注意:
(75%)
(1)卤化通常用Cl2、Br2;
(2)催化剂可用Fe粉或FeX3;
(3)若反应条件强烈,可得到二取代产物。 Cl
甲苯 氯苯 异丙(基)苯 邻二甲苯
(2) 多环芳烃 (3) 稠环芳烃
联苯
CH2
二苯基甲烷
2021/3/11
萘 蒽 第5章芳烃芳香性
菲
3
一. 芳烃的构造异构和命名
1 构造异构
当苯环侧链上的碳原子为3个以上时,产生构造
异构:
CH2CH2CH3
C H 3C H C H 3
丙苯
异丙苯
当苯环上连有2个以上的取代基时,则产生位置异
构, 二取代苯有3个异构体。
CH3
CH3
CH3
2021/3/11
C H第5章3芳烃芳香性
CH3
4
CH3
一. 芳烃的构造异构和命名
2 命名
1)芳基 P152
芳基:芳烃去掉一个H原子后所剩余的部分。
苯基(phenyl)可用C6H5-, Ph-表示; 芳基(aryl)可用Ar-。
C H 2
C H 3
C H 3
第五章 芳烃 芳香性
第 五 章 主要内容
一. 芳烃的构造异构和命名 二. 苯的结构 三. 单环芳烃的化学性质 四. 苯环上亲电取代反应的定位规则 五. 稠环芳烃 六.芳香性
第5章芳烃芳香性
概况 芳烃一般是指含有苯环结构芳香族化合物。
芳烃的分类:
CH3
(1) 单环芳烃
Cl
CH3CHCH3
CH3 CH3
NO 2
NO 2
发烟 H2SO4 浓 HNO3
110℃,5天
NO 2
O 2N
2021/3/11
问题:为什么 邻、对位产物很少?
NO 2
第5章芳烃芳香性
16
三、单环芳烃的化学性质
硝化反应主要用途:
(1)制备硝基芳烃。 (2)鉴别苯和芳烃(现象:溶于酸中,产物一般为黄 色油状液体)。 3)磺化
•苯与浓硫酸的反应速度很慢.
(共振理论要点:结构上相近和能量相同的极限结构式 参加共振,则其共振杂化体最稳定。
所以,在苯中的碳碳键,既不是单键,也不是双键,
而是介于单双键之间,六个碳碳键完全相等。
2021/3/11
第5章芳烃芳香性
12
三 单环芳烃的化学性质
苯结构特点: (1)苯环平面上下,有π电子云,是富电子基
可以与缺电子基团,即亲电试剂作用;
Cl
+ Cl 2 FeCl3
Cl Cl
+
Cl
问题202:1/3/1为1 什么间位产物很第少5章?芳烃芳香性邻用二途氯:苯制备卤对代二苯氯。苯15
三、单环芳烃的化学性质
2)硝化
+
HNO3
H2SO4
50℃
NO 2
+ H2O
注意: 若反应条件强烈,可得多元取代物。
NO 2 发烟 H2SO4 浓 HNO3 90℃
二 苯的结构
3)苯具有平面结构,苯分子中碳碳键键长完全等同。 (0.140nm)
杂化轨道理论解释:
C:sp2
2021/3/11
第5章芳烃芳香性 形成离域大π键 10
二 苯的结构
苯的分子模型
图 5.1 苯分子的轨道结构
2021/3/11
第5章芳烃芳香性
11
二 苯的结构
共振理论解释: 苯的真实结构是以下极限结构式的共振杂化体:
