无机及分析化学第2阶段测试题
2009级无机及分析化学2A卷
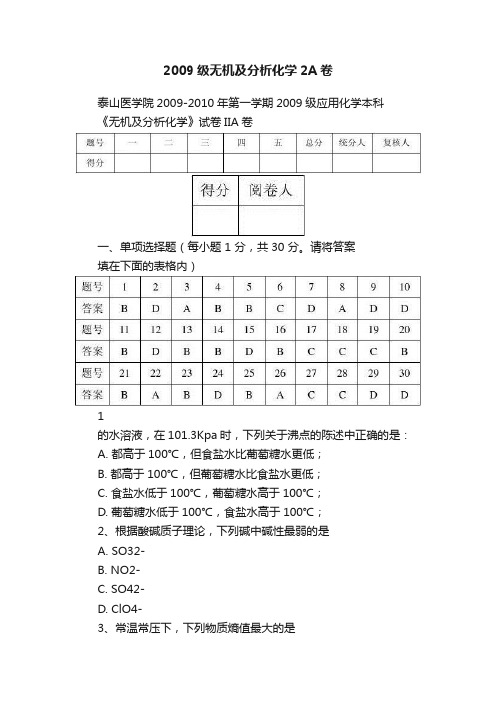
2009级无机及分析化学2A卷泰山医学院2009-2010年第一学期2009级应用化学本科《无机及分析化学》试卷IIA卷一、单项选择题(每小题 1 分,共30 分。
请将答案填在下面的表格内)1的水溶液,在101.3Kpa时,下列关于沸点的陈述中正确的是:A. 都高于100℃,但食盐水比葡萄糖水更低;B. 都高于100℃,但葡萄糖水比食盐水更低;C. 食盐水低于100℃,葡萄糖水高于100℃;D. 葡萄糖水低于100℃,食盐水高于100℃;2、根据酸碱质子理论,下列碱中碱性最弱的是A. SO32-B. NO2-C. SO42-D. ClO4-3、常温常压下,下列物质熵值最大的是A. F2B. HIC. H2OD. I24、某化学反应10min反应完成50%,进行20min完成100%,则此反应是A. 零级反应B. 一级反应C. 二级反应D. 三级反应。
5、0.10mol/L的H2CO3溶液,K1和K2分别是其一级和二级解离常数,则溶液中的H3O+和CO32-离子浓度是A. (0.1K1)1/2, K1B. (0.1K1)1/2, K2C. (0.1K2)1/2, K1D. (0.1K2)1/2, K26、在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为A. 化学计量点B. 滴定误差C. 滴定终点D. 滴定分析7、酸碱滴定中选择指示剂的原则是()A. 指示剂变色范围与化学计量点完全符合B. 指示剂应在pH =7.00时变色C. 指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D. 指示剂变色范围应全部落在滴定pH突跃范围之内8、关于以K2CrO4为指示剂的莫尔法,下列说法正确的是A. 本法可测定Cl-和Br-,但不能测定I-或SCN-B. 滴定应在弱酸性介质中进行C. 指示剂K2CrO4的量越少越好D. 莫尔法的选择性较强9、用Na2C2O4标定KMnO4溶液时,所用的稀酸为A. HNO3B. HClC. HClO3D. H2SO4E. HAc10、下列物质的浓度均为0.1000mol/L,不能用NaOH标准溶液直接滴定的是A. HCOOH (Ka=1.77×10-4)B. HAc (K a=1.76×10-5)C. H2SO4D. NH4Cl[K b(NH3)=1.79×10-5E. HF(Ka=3.53×10-4)11、下列一组数据中,有效数字为两位的是A. 0.320B. pKa=4.75C. 1.40%D. 0.04E. 5×10-612、在1mol/L的HCl中,用0.10mol/L Fe3+滴定0.10mol/L Sn2+,则化学计量点的电极电势是:已知在此条件下,Fe3+/Fe2+和Sn4+/Sn2+的条件电势为0.68V 和0.14V。
无机及分析化学试卷及答案(2)

无机及分析化学试卷及答案6一、填空题:(每空1分,共20分)1.热与功是系统状态发生变化时与环境之间的两种 形式。
系统向环境放热Q 0;环境对系统做功W 0。
2.根据反应类型的不同,滴定分析可分为 、 、和 四种滴定分析方法。
3. 17.593 + 0.00458 - 3.4856 + 1.68 =4. 在弱酸溶液中加水,弱酸的解离度变 ,pH 变 ;在NH 4Cl 溶液中,加入HAc ,则此盐水解度变 ,pH 变 。
5. 在含有Cl -和CrO 42-的混合溶液中,它们的浓度均为0.1mol/L,当逐滴加入Ag +时, 先沉淀。
[K sp Θ(AgCl)=1.77×10-10, K sp Θ(Ag2CrO4)=2.0×10-12]6. 根据电子排列顺序34号原子的核外电子排布为 。
7. [Co (NH 3)2(en)2]Cl 3的名称是 ;配位体是 ;中心体的配位数是 。
8. 分光光度计的基本组成部分为光源、 、 、 、显示器。
二、选择题:(每题2分,共30分)1.满足下列哪组条件的反应可自发进行? ( )A . △H> 0,△S>0,高温B . △H> 0,△S>0,低温C . △H< 0,△S<0 ,高温D . △H> 0,△S<0,低温 2.1.00克非电解质溶于20.0克水中,测定冰点是-0.50℃,该非电解质的相对分子量是( )(K f =1.86)A . 1.86 /( 0.50×0. 20) B. 1.86/(0.50×20.0)C. 0.50×20.0/1.86D. 1.86/( 0.50×0.020)3. 已知500K 时反应 SO 2(g)+1/2 O 2(g) =SO 3(g)的K P =50,则同温度下反应2SO 2(g)+O 2(g) =2SO 3(g)的K P ´ 为 ( )A. 4×10-4B. 2×10-2C. 4×10-2D. 25004. 对给定的化学反应,下列说法正确的是 ( )A . △G 越负,反应速度越快。
无机及分析化学作业2 第3章~第4 章试题及答案

无机及分析化学作业2第3章~第4 章一、填空(每小题2分,共20分)1.根据酸碱质子理论,NH4+的共轭碱是NH3;HCO3-的共轭酸是H2CO3。
2.在HAc水溶液中加入少量NaAc固体,可使HAc的解离度__减小___,这种现象叫做___同离子效应____。
若向相同的HAc水溶液中加入少量NaCl固体可使HAc 的解离度增大,这种现象叫做______盐效应___。
3.选择酸碱指示剂的原则是使其变色点的pH处于滴定的PH突跃范围内,所以指示剂变色点尽量靠近__化学计量点___。
4.用0.10mol/LNaOH溶液滴定0.10mol/L酒石酸溶液时,在滴定曲线上出现___1_____个突跃范围。
(酒石酸的p K a1﹦3.04,p K a1﹦4.37)5.已知柠檬酸的pKa1~pKa3分别为3.13,4.76,6.40。
则p K b2=__9.24____p K b3=__10.87__。
6.六亚甲基四胺的p K b=8.85,用它配制缓冲溶液的pH缓冲范围是_4.15-6.15__,NH3的p K b=4.76,其pH缓冲范围是_8.24-10.24___。
7.PbSO4和K sp为1.6×10-8, 在纯水中其溶解度为___1.3×10-4___ mol/L;在浓度为1.0×10-2 mol/L的Na2SO4溶液中达到饱和时其溶解度为__2.68____ mol/L。
8.AgCl, AgBr, AgI在2.0 mol/L NH3·H2O的溶解度由大到小的顺序为___AgCl › AgBr ›AgI__。
9.莫尔法分析Cl-时用_AgNO3为标准滴定溶液,用_K2CrO4_为指示剂。
指示剂的加入量控制在__0.005~0.006mol/L___为宜,指示剂浓度过高时,分析结果偏__低___,浓度过低使结果偏__高___。
10.AgCl的Ksp=1.8×10-10,Ag2CrO4的Ksp=2.0×10-12,而两个银盐的溶解度S(单位:mol/L)的关系是AgCl S _小于__ 42CrO Ag S 。
11-12-2无机2A卷

A.不受影响B.提前到达
C.推迟到达D.刚好等于化学计量点
19、在电势滴定中,以ΔE/ΔV~V(E为电动势,V为滴定剂体积)作图绘制滴定曲线,滴定终点为()
A.曲线突跃的转折点B.曲线的最大斜率点
C.曲线的最小斜率点D.曲线的斜率为零时的点
20、吸光光度分析中,在某浓度下以1.0cm比色皿测得透光率为T。若浓度增大1倍,则测得透光率应为()
16、使用磺基水杨酸分光光度法测定微量Fe3+时,光度计检测器直接测定的是()
A.入射光的强度B.吸收光的强度
C.透过光的强度D.散射光的强度
17、福尔哈德法测定Cl-时,溶液中忘记加硝基苯,在滴定过程中剧烈摇动,将使结果()
A.偏低B.偏高C.无影响D.正负误差不一定
18、用莫尔法测定Cl-,控制pH=4.0,其滴定终点将()
A. B. C. D.
三、填空题(每小题1分,共20分)
1、计算式的计算结果应有(⑴)位有效数字?
2、某样品6次测定结果为:0.3510,0.3486,0.3477,0.3519,0.3501,,0.3536。用Q检验法验证0.3536,则Q= (⑵),已知Q0.90= 0.56,则0.3536应(⑶)
2011-2012学年第2学期
《无机及分析化学2》试卷A答题纸
无机及分析化学试卷(2)

无机及分析化学试卷(2)学号:______________ 班级:______________ 姓名:______________ 大连工业大学2008--2009 学年第1学期《无机及分析化学》期中试卷共页第页考核对象:一、判断题(20分,每题1分)()1、同等质量的石墨和金刚石燃烧所放出的热量相等。
()2、用NaOH 溶液滴定相同pH 值的HAc 与HCl 溶液时,所消耗的碱溶液的体积相等。
()3、在滴定分析中,指示剂刚好发生颜色变化的转变点称为化学计量点。
()4、质量摩尔浓度是指每千克溶液中所含溶质的物质的量。
()5、离子浓度越大,所带电荷越多,离子间的相互牵制作用越大,活度系数就越大。
()6、溶度积常数K sp θ不标单位,这是因为它本身单位不固定。
()7、在对样品分析中,结果的精密度好则准确度一定高。
()8、在分析测定中,测定次数n 一定时,置信区间越小,则置信度越高。
()9、0.80mol ?L -1 NaH 2PO 4溶液与0.40 mol ?L -1 Na 2HPO 4溶液的pH 值近似相等。
()10、缓冲溶液H 2CO 3 -HCO 3- 缓冲范围的表达式是:pH= K a1±1.()11、温度一定,活化能大的反应速率小,活化能小的反应速率大。
()12、在酸碱滴定中,影响酸碱滴定pH 突跃的主要因素是酸碱的浓度强弱,滴定体系的浓度愈小,滴定突跃就愈小。
()13、0.01mol ·L -1的某酸HA 溶液的pH=4.0,则该酸的解离度为1%。
()14、浓度均为0.10 mol·L-1的NaCN (HCN 的K a θ = 6.17×10-10)和 NaAc(HAc 的K a θ = 1.74×10-5)溶液均不能用标准强酸直接滴定。
()15、Na 2CO 3水溶液的质子条件式为 [H +]=[OH -]-[HCO 3-]-[H 2CO 3]。
无机及分析化学(下)_华中农业大学中国大学mooc课后章节答案期末考试题库2023年

无机及分析化学(下)_华中农业大学中国大学mooc课后章节答案期末考试题库2023年1.影响螯合物稳定性的主要因素有螯环的大小和螯环的数目。
参考答案:正确2.关于外轨型与内转型配合物的区别,下列说法不正确的是()。
参考答案:通常外轨型配合物比内轨型配合物磁矩小3.pH值小于7的溶液一定是酸性的。
参考答案:错误4.pH值对EDTA滴定金属离子的突跃大小有很大影响,溶液pH值越小,则突跃越大。
参考答案:错误5.酸效应系数只是酸度的函数,只要溶液的pH一定,不论何种金属离子参与反应,酸效应系数一定。
参考答案:正确6.配位滴定中过量的EDTA不会使终点的颜色加深。
参考答案:正确7.酸碱滴定中,对于二氧化碳的影响,如果滴定和标定使用同一指示剂,其影响可以基本消除,对结果的影响可以忽略。
参考答案:正确8.碳酸钠因保存不当吸潮,直接作基准物质来标定HCl的浓度,结果将(偏高、偏低或无影响)参考答案:偏高9.只考虑酸效应时,MY越稳定,则配位滴定允许的pH越()。
参考答案:小10.有关Ringbom曲线的作用叙述错误的是()。
参考答案:确定单独滴定某一金属离子的最高pH11.pH玻璃电极的电极电势与待测试样的氢离子浓度成线性关系。
参考答案:错误12.只考虑酸效应的影响,下列说法正确的是()。
参考答案:pH越高,滴定曲线的突跃范围越大13.电势滴定法不用指示剂确定终点。
参考答案:正确14.通过测定E的变化确定滴定终点的方法叫电势滴定法。
参考答案:正确15.有关能斯特方程式下列说法正确的是()参考答案:利用能斯特方程式可以计算原电池的电动势16.碘量法的主要误差来源(1)单质碘的;(2)碘离子易被空气中的氧氧化。
参考答案:挥发17.EDTA直接滴定有色金属离子,终点时溶液呈现颜色的物质是 ( )。
参考答案:MY+In18.对于任意状态下的氧化还原反应,当相应原电池的电动势E >0,反应进行。
该反应的标准平衡常数与电动E 关。
无机及分析化学试卷及答案(2)

无机及分析化学试卷及答案得分统计表:一、填空题:(每空1分,共20分)1. 难挥发性非电解质稀溶液蒸汽压下降的原因是____________________________________。
2. 基元反应NO 2 + CO = NO + CO 2的速率方程为______________________。
3.测定某矿石中铁的含量时,获得如下数据:79.58%,79.45%,79.47%,79.50%,79.62%,79.38%。
置信度P 为90%时经Q 检验无可疑数据要舍弃,则标准偏差s 为________;置信度P 为90%时平均值的置信区间为______________。
(已知置信度为90%、n =6时,t =2.015)4. 已知HAc 的p K a Ө=4.76,则0.01mol ·L -1的HAc 溶液的pH 值为________。
5. 已知NH 3·H 2O 的解离平衡常数p K b Ө=4.76,则NH 3·H 2O-NH 4Cl 缓冲体系可用于配制pH 从____________到_______________之间的缓冲溶液。
6. 室温下,AB 2型难溶性物质的溶度积常数为K sp Ө,则其溶解度为____________;AB 型难溶性物质的溶解度为s mol ·L -1,则其溶度积常数为_______________。
7. 已知E Ө(Ag +/ Ag )=0.799V ,E Ө(Fe 3+/ Fe 2+)=0.771V ,则298.15K 时,反应Ag ++ Fe 2+→Ag (s )+Fe 3+的标准平衡常数K Ө为。
8. 原子R 的最外电子层排布式为m s m m p m , 则R 位于_____周期,_____族,其电子排布式是___________________。
9. 配合物[CoCl(NH 3)4(H 2O)]Cl 2命名为,中心离子的配位体为________________,配位数为。
无机及分析化学章节试题及答案.docx

第一章补充习题一、选择题1. 与0.58% NaCl 溶液产生的渗透压较接近的是溶液()。
(A) 0.1 mol/L 蔗糖溶液 (B) 0.2 mol/L 葡萄糖溶液 (C) 0.1 mol/L 葡萄糖溶液(D) 0.1 mol/L BaCb 溶液2. 25°C 时,总压为10 atm 时,下面几种气体的混合气体中分压最大的是:( )。
(A) O.lg H 2 (B) 1.0 g He (C) 1.0 g N 2 (D) 1.0 g CO 23. 气体与理想气体更接近的条件是( )。
6. 一定愠度下,等体积的甲醛(HCHO)溶液和葡萄糖(C6H12O6)溶液的渗透压相等,溶液中甲醛和葡萄糖的质量比是( )。
(A) 6 : 1(B)1 :6(C) 1:3(D) 3:1 7. 下列相同浓度的稀溶液,蒸气压最高的是( )o(A) HAc 溶液 (B) CaCh 溶液 (C)蔗糖水溶液 (D) NaCl 水溶液 8. 取相同质量的下列物质融化路面的冰雪,效果最好的是()。
(A)氯化钠 (B)氯化钙 (C)尿素[CO(NH 2)2] (D)蔗糖9. 在一定的外压下,易挥发的纯溶剂A 中加入不挥发的溶质B 形成稀溶液。
此稀溶液的沸点随着加的增加而 ()。
(A) 升高(B)降低 (C)不发生变化 (D) 无一定变化规律 10.室温25°C 时,0.1 mol/L 糖水溶液的渗透压为()o(A) 25 kPa(B) 101.3 kPa (C) 248 kPa (D) 227 kPa11. 盐碱地的农作物长势不良,甚至枯萎,其主要原因为()。
(A)天气太热 (B)很少下雨 (C)肥料不足 (D)水分从植物向土壤倒流12. 37°C,人体血液的渗透压为780kPa,与血液具有相同渗透压的葡萄糖静脉注射液浓度是()。
(A) 85 g/L (B) 5.4 g/L (C) 54 g/L (D)8.5 g/L 13. 有一半透膜,将水和某溶质水溶液隔开,其结果是()。
2010-2011无机与分析化学(二)期中试题

无机与分析化学(二)期中试题班级 姓名 考号 第 1 页无机与分析化学(二)期中试题题目 一 二 三 四 五 总分数分数 评卷人一、判断正误(每题1分,共10分)1. 所有的原电池反应均为氧化还原反应。
…………………………………….( )2. 配合物中,形成体的配位数不一定等于配位体的数目。
……………………( )3. 只有金属离子才能作为配合物的形成体。
..……………………..…..….…. ( )4. 用KMnO 4标准溶液滴定时,一般是在强酸性溶液中进行,所以可用盐酸和硝酸作滴定介质。
………………………………………………………..………..……( )5. 氧化还原电对中还原型物质生成沉淀时,电极电势将降低。
………..……..( )6. EDTA 是一个多齿配位体,能和金属离子生成环状结构的螯合物。
….…( )7. 难溶电解质AB 2的溶解度如用S mol ·L -1表示,其KΘsp 等于4S 3。
……..…( )8. 两种难溶电解质,KΘsp 小的,其溶解度一定小。
…………………………….( )9. 根据同离子效应,沉淀剂加得越多,沉淀越完全。
…………...…………….( ) 10. 一个自发进行的氧化还原反应,若两电对的标准电极电势值差很大,则可判断该反应的反应趋势很大。
………………………………………….…………..…..( )二、选择题(单选,每题2分,共30分)1. 用0.02mol·L -1 KMnO 4溶液滴定0.1 mol·L -1Fe 2+ 溶液和用0.002mol·L -1KMnO 4溶液滴定0.01mol·L -1 Fe 2+ 溶液两种情况下滴定突跃的大小将………………….( )(A) 相同 (B) 浓度大突跃越大 (C) 浓度小的滴定突跃大 (D) 无法判断 2. 1.0×10-5mol·L -1的AgNO 3溶液与等体积的1.0×10-5mol·L -1的BaCl 2溶液混合,下列说法正确的是(AgCl 的 KΘsp =1.8×10-10)………………………..……......….( )(A) 能生成沉淀 (B) 不能生成沉淀 (C) 沉淀分解 (D) 无法判断 3. 已知KΘsp (Ag 2CrO 4)=1.2×10-12)。
无机及分析化学2(山东联盟)智慧树知到课后章节答案2023年下山东农业大学

无机及分析化学2(山东联盟)智慧树知到课后章节答案2023年下山东农业大学山东农业大学第一章测试1.为测定某盐酸溶液的浓度,利用已知准确浓度的氢氧化钠溶液进行滴定操作,然后根据二者化学计量关系及消耗的氢氧化钠体积求算出盐酸溶液的浓度,这一测定方法是化学分析法。
A:对 B:错答案:对2.按照分析对象分类,分析方法可分为无机分析法和有机分析法。
A:错 B:对答案:对3.在分析化学中,超微量分析就是痕量成分分析。
A:错 B:对答案:错4.分析化学的任务包括定性分析、定量分析和结构分析,当我们要测定物质的化学结构、晶体结构或者空间分布信息,这属于A:结构分析 B:其他C:定量分析 D:定性分析答案:结构分析5.测定一铁矿石中的铁含量,称取铁矿石100克,分解后测得其中含铁量为0.05%,该分析过程为A:微量成分分析 B:超微量分析 C:常量分析 D:常量成分分析答案:微量成分分析;常量分析第二章测试1.有效数字是指分析工作中实际能测量到的数字,每一位都是准确的。
A:错 B:对答案:错2.从精密度好就可断定分析结果可靠的前提是系统误差小。
A:对 B:错答案:对3.系统误差是由一些不确定的偶然因素造成的。
A:错 B:对答案:错4.系统误差具有重复性、单向性和可测性。
A:错 B:对答案:对5.下列数据中有效数字位数错误的是A:5.0000(1位) B:3.08×(3位) C:5.0008(5位) D:0.3006(4位) 答案:5.0000(1位)6.pH=12.00有效数字位数是A:2位 B:0位 C:4位 D:1位答案:2位7.分析某样品得到四个分析数据,为了衡量其精密度的优劣,可用()表示A:相对相差 B:平均偏差 C:绝对误差 D:相对误差答案:平均偏差8.下列有关随机误差的论述中不正确的是A:随机误差是由一些不确定的偶然因素造成的。
B:随机误差具有单向性; C:随机误差出现正误差和负误差的机会均等; D:随机误差在分析中是不可避免的;答案:随机误差具有单向性;9.可用以减少测定过程中的随机误差的方法是A:进行空白试验 B:进行对照试验 C:增加平行试验的次数 D:进行仪器校准答案:增加平行试验的次数10.滴定分析法要求相对误差为±0.1%,若称取试样的绝对误差为0.0002g,则一般至少称取试样A: 0.3g B: 0.2g C: 0.4g D: 0.1g答案: 0.2g11.关于可用于减少系统误差的方法错误的是A:进行仪器校准 B:进行对照试验 C:进行空白实验 D:增加平行试验的次数答案:增加平行试验的次数12.空白试验所得的空白值是指A:用标准方法对已知组分的标准样品进行分析时所得值与真实值之差; B:不加试样,按照分析试样时同样的手续进行分析,所得的测定值;C:在已知分析试样中加入一定量标准样进行分析,所得的增加值; D:用分析试样时同样的方法,分析组成与待测试样相近的标准试样,所得的测定值;答案:不加试样,按照分析试样时同样的手续进行分析,所得的测定值;13.下列测定过程造成的误差不属于系统误差的是A:重量分析中杂质产生共沉淀 B: 配制溶液过程中,称量样品时,少量样品洒落到天平内; C:以失去少量结晶水的基准为基准物质标定NaOH溶液的浓度D:电位分析法测定自来水中的氯离子,配制溶液所用的蒸馏水中含有少量的氯离子;答案: 配制溶液过程中,称量样品时,少量样品洒落到天平内;14.下列有关精密度和偏差的论述中正确的是A:标准偏差比平均偏差表示分析结果更可靠 B:精密度对测定的结果的准确度没有影响 C:精密度可以通过误差的大小来评价 D:精密度能够反映系统误差的大小答案:标准偏差比平均偏差表示分析结果更可靠第三章测试1.化学计量点和滴定终点之间的差值称为终点误差。
无机及分析化学考试题_石河子大学

石河子大学《无机及分析化学》考题试卷一一、选择题(1分×20=20分)1.土壤中NaCl 含量高时,植物难以生存,这与下列稀溶液性质有关的是( )。
A. 蒸气压下降B. 沸点升高C. 凝固点降低D. 渗透压2.0.10mol·L -1的下列溶液凝固点降低程度最大的是( )。
A. C 6H 12O 6(葡萄糖)B. KNO 3C. C 3H 5(OH)3(甘油)D. CuSO 43.下列反应的标准摩尔焓等于其产物的标准摩尔生成焓的反应是( )。
A. SO 2(g)+21O 2(g) SO 3(g) B. N 2(g)+O 2(g) 2NO(g) C. H 2(g)+21O 2(g) H 2O(g) D. CO(g)+21O 2(g) CO 2(g) 4.某反应的速率常数k 的单位为L·mol -1·s -1,则该化学反应的反应级数为( )。
A. 0B. 1C. 2D. 35.反应 A(g)+2B(g) E(S)+D(g) 达平衡时,下列表述正确的是( )。
A.K (正反应)+ K (逆反应)=1B. Δr G m (正反应)×Δr G m (逆反应)=1C. K (正反应)×K (逆反应)=1D. Δr G m (正反应)+Δr G m (逆反应)=16.下述四个量子数不合理的一组是( )。
A. 2,0,1,B. 3,1,0,-C. 4,2,1,D. 2,1,0,-7.下列分子都没有极性的一组是( )。
A. SO 2 NO 2 CO 2B. SO 3 BF 3 NH 3C. CH 4 BF 3 CO 2D. PCl 3 CCl 4 H 2O8.下列混合溶液中两种离子能够共存的是( )。
A. CO -23和Al 3+B. MnO -4和SO -23C. Fe 3+和Cu 2+D. Cr 2O -27和I -9.向pH=2的缓冲溶液中通入H 2S(g)达饱和时(H 2S 浓度约为0.1mol·L -1),溶液中的c (S 2-)(mol·L -1)为:{K a1 (H 2S)=1.3×10-7,K a2 (H 2S)=7.1×10-15}( )。
无机及分析化学试卷及答案2

一 、填空题:(除了特别注明外,每空1分,共20分)1. 其元素的原子序数为26,则其电子层结构为 ,该元素所处在的周期、族分别为 、 。
2.随着溶液的pH 值增加,下列电对 Cr 2O 72-/Cr 3+、Cl 2/Cl -、MnO 4-/MnO 42-的E 值将分别 、 、 。
3.健康人血液的pH 值为7.45。
患某种疾病的人的血液pH 可暂时降到5.90,此时血液中c(H +)为正常状态的 倍。
4. 表示θm r H ∆=θm f H ∆(AgBr, s)的反应式为 。
5.[Co(en)2Cl 2]SO 4可命名为 ,中心离子配位数为 。
6.精密度高的测定准确度 高(填“一定”或“不一定”)。
7.Na 2HPO 4水溶液的质子条件式: 。
8.HF 的沸点比HI 高,主要是由于 。
9.沉淀滴定的莫尔法使用的指示剂和标准溶液分别是 , ,沉淀应在 介质中进行。
10. 用自由能判断反应的方向和限度时,必须在 条件下,该条件下,当ΔG > 0时反应 ,当ΔG <0 时则 ,当ΔG =0时,则反应处于 状态。
二、判断题(每小题1分,共10分):对 √;错 ×( )1、胶体分散系中,分散质粒子大小范围为>100nm( )2、化学反应的速率常数k 表征化学反应的快慢。
k 不随温度的变化而变化,但随反应物的浓度而变化。
( )3、螯合物比一般配合物更稳定,是因为其分子内存在环状结构。
( )4、pH =10.21的有效数字是四位。
( )5、[Co (NH 3)2 Cl 2]Cl 的系统命名为三氯二氨合钴(Ⅲ)。
( )6、多元弱酸的逐级电离常数总是K 1>K 2>K 3. ( )7、配位滴定中的金属指示剂就是一些金属元素。
( )8、吸热反应,升高温度,正反应速度加快,逆反应速度减慢,平衡向正反应方向移动。
( )9、偶然误差是由某些难以控制的偶然因素所造成的,因此是无规律可循的。
无机及分析化学II考试题
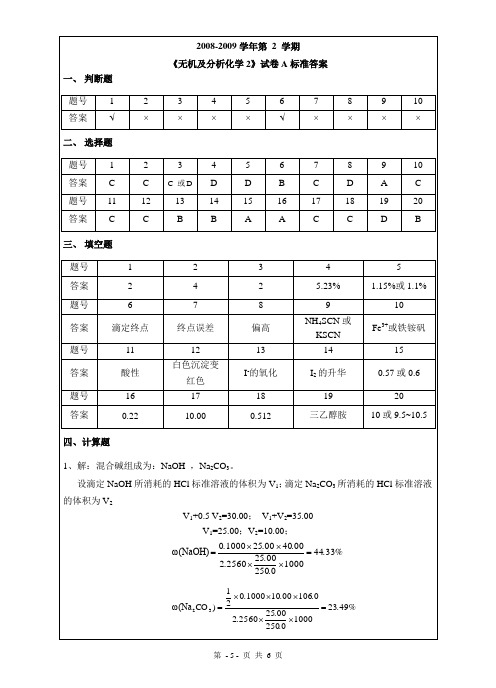
2
3
4
5
6
7
8
9
10
答案
√
×
×
×
×
√
×
×
×
×
二、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
C或D
D
D
B
C
D
A
C
题号
11
12
13
14
15
16Leabharlann 17181920
答案
C
C
B
B
A
A
C
C
D
B
三、填空题
题号
1
2
3
4
5
答案
2
4
2
5.23%
1.15%或1.1%
题号
6
7
8
9
10
答案
滴定终点
终点误差
偏高
NH4SCN或KSCN
A.增加称样量B.提高分析人员水平C.进行仪器校准D.增加平行试验次数
2、用25mL移液管移出的溶液的体积应记录为()。
A.25mLB.25.0 mLC.25.00mLD.25.000 mL
3、下列有关指示剂误差的叙述中正确的是()。
A.以NaOH溶液滴定HCl溶液时,用甲基橙作指示剂所引起的指示剂误差为正误差。
8、试剂空白就是与显色反应同样的条件取同样的溶液,不加显色剂所制备的参比溶液。()
9、pH玻璃电极的电极电势是玻璃膜内外两相界电势之差。()
10、浓度相等的A、B两物质溶液,用分光光度法在同一波长下测定,其摩尔吸光系数一定相等()。
无机及分析化学第2阶段测试题

无机及分析化学第2阶段测试题LT江南大学现代远程教育第二阶段测试卷考试科目:《无机及分析化学》(总分100分)时间:90分钟__________学习中心(教学点)批次:层次:专业:学号:身份证号:姓名:得分:(第5章沉淀的形成与沉淀平衡,第6章电化学基础与氧化还原平衡,第7章原子结构)(本课程计算涉及开方、乘方和对数等数学运算,故参加本课程的考试时必须携带计算器)一、填空题(30分,每空1分)1.CaCO3沉淀中加入HAc溶液,有现象,其离子反应方程式是。
2.Kθsp称为难溶电解质的溶度积常数,该常数大小与和有关。
3.在CaCO3(K spΘ= 3.36×10-9),CaF2(K spΘ= 3.45×10-11),Ca3(PO4)2(K spΘ= 2.07×10-33)这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为_________。
4.在原电池中流出电子的电极为________,在正极发生的是________反应,原电池可将________能转化为________能。
5.反应Cl2 (g) + 2Br-(s)2Cl-(eq) + Br2 (l)与Br2 (l) + 2I-(eq)2Br-(eq)+ I2 (s)均正向进行,其中最弱的还原剂为________它所在的氧化还原电对为,最强的还原剂为________,它所在的氧化还原电对为。
6.第三能级组包括________类原子轨道,分别是,,共有个原子轨道。
7.第四电子层有4个电子的某元素,其原子序数是________,价电子构型为,该元素属第________周期、________族,为(金属或非金属)元素,最高氧化数为。
8.第四周期有________种元素,这是因为第______能级组有类原子轨道,分别为,,,最多可容纳_______个电子。
二、选择题(16分,每题2分)1.难电离的HgCl2在水中的溶解度(mol·L-1)与其饱和溶液中下列物质的浓度最接近的是()(A). Hg2+离子(B). Cl-离子(C). HgCl+离子(D). HgCl2分子2.向饱和AgCl溶液中加水,下列叙述正确的是( )(A).AgCl的溶解度增大(B).AgCl的溶解度、Kθsp均不变(C).AgCl的Kθsp增大(D).AgCl的溶解度、Kθsp增大3. BaSO4的相对分子质量为233,Kθsp= 1×10-10,把1 m mol BaSO4置于10L 水中,有多少克BaSO4尚未溶解?()(A). 2.1g (B).0.21g(C). 0.021g (D).0.0021g4.下列化合物中,碳原子的氧化数为-3的是( )4.(6分)已知 E θ(Co 3+/ Co 2+)=1.83V , E θ(Co 2+/ Co)=-0.28V ,计算E θ(Co 3+/ Co)的值。
南通大学无机及分析化学(二)试卷.doc

无机及分析化学(二)试卷(A)一、选择题(共16分)1.(2分)下列各数中,有效数字位数为四的是()A.pH = 10.85B. 0.0089C. 0.0156D. 1.0002.(2分)C12(g)通入热的碱液,得到的主要产物是()A. ciof +crB. cio- +cr c. cio4 + cr D.不反应3.(2分)PbCh和HC1的反应产物是以下哪一种()A. PbCl4+H2OB. PbCb+HClOC. PbCl2+H2OD. PbC12+Cl24-H2O4.(2分)下列各组中正确表达了两对物质氧化性强弱顺序的是()A. HC1O >HC1O3SnO2>PbO2B. HC1O >HC1O3SnO2<PbO2C. HC1O <HC1O3SnO2<PbO2D. HC1O< HC1O3SnO2>PbO25.(2分)在(3产溶液中加入NH3 H2O后,主要产物是哪一种()A. [Cr(NH3)6]3+B. Cr(OH)3C. [Cr(H2O)6]3+D. [Cr(OH)6]3_6.(2分)符合朗伯■比尔定律的一有色溶液,当有色物质浓度增加()A.最大吸收波长改变B.摩尔吸光系数增加C.吸光度增加D.透光率增加7.(2分)下列物质用酸碱滴定法不能直接准确滴定的是()A. O.lmol L-1 HF(pKa = 3.18)B. 0.1mol L_1HCOOH(p/Ca = 3.45)C. 0」mol L" NaAc(pKa, HAC = 4.75)D. 0」mol-L_1乙胺(pKb = 3.25)& (2 分)已知1 g/C Z nY= 16.5 pH = 4.0 时,lgGY(H) = 8.6 lgK’ZnY 为 ( ) A. 25」 B. 7.9 C. 12.5 D. 20.5二、填空题(共19分)1.(2分)下列含氧酸盐热稳定性大小顺序是____________________________Na2CO3 ZnCO3 NaHCO3 CaCO32.(2分)下列含氧酸酸性大小顺序是___________________________________ HNO3 H3ASO4 H3PO4 HCIO43.(4分)写出下列各酸碱水溶液的质子条件式Na2CO3___________________________________________________________ HAc ______________________________________________________________ 4.(2 分)用O.lmol L^NaOH 滴定O.lmol L1某二元弱酸(pK°i = 2 pK a2 = 3),滴定过程中有 _______ 个突跃,可用 _____________ 为指示剂。
无机及分析化学第2阶段练习题20年江大考试题库及答案一科共有三个阶段,这是其中一个阶段。答案在最后

江南大学网络教育第二阶段练习题考试科目:《无机及分析化学》第章至第章(总分100分)__________学习中心(教学点)批次:层次:专业:学号:身份证号:姓名:得分:一单选题 (共8题,总分值8分,下列选项中有且仅有一个选项符合题目要求,请在答题卡上正确填涂。
)1. 已知Kθsp (Ag2SO4)= 1.20×10-5,Kθsp (AgCl)= 1.77×10-10,Kθsp (BaSO4)= 1.08×10-10,将等体积的0.0020mol·L-1的Ag2SO4与2.0×10-6mol·L-1的BaCl2溶液混合,将会出现()。
(1 分)B. AgCl沉淀A. BaSO4沉淀D. 无沉淀C. BaSO4与AgCl共沉淀2. 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀()。
(1 分)A. 溶解B. 增多C. 不变D. 无法判断3. 下列电极的电极电势与介质酸度无关的为()。
(1 分)D. AgCl/AgA. O2/H2OB. MnO4-/Mn2+C. H+/ H24. 在溴原子中,有3s、3p、3d、4s、4p各轨道,其能量高低的顺序是()。
(1 分)A. 3s< 3p< 4s< 3d< 4pB. 3s< 3p< 4s< 4p< 3dC. 3s< 3p< 3d< 4s< 4pD. 3s< 3p< 4p< 3d< 4s5. 由反应Fe(s) + 2Ag+(aq) Fe2+(aq) + 2Ag(s)组成的原电池,若将Ag+浓度减小到原来浓度的1/10,则电池电动势的变化为()。
(1 分)A. 0.0592VB. -0.0592VC. -118VD. 0.118V6. 1L Ag2C2O4饱和溶液中所含Ag2C2O4质量为0.06257g,Ag2C2O4的相对分子质量为303.8,若不考虑离子强度、水解等因素,Ag2C2O4的Kθsp是()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江南大学现代远程教育第二阶段测试卷
考试科目:《无机及分析化学》(总分100分)时间:90分钟
__________学习中心(教学点)批次:层次:
专业:学号:身份证号:
姓名:得分:
(第5章沉淀的形成与沉淀平衡,第6章电化学基础与氧化还原平衡,第7章原子结构)
(本课程计算涉及开方、乘方和对数等数学运算,故参加本课程的考试时必须携带计算器)
一、填空题(30分,每空1分)
1.CaCO3沉淀中加入HAc溶液,有现象,其离子反应方程式是。
2.Kθsp称为难溶电解质的溶度积常数,该常数大小与和有关。
3.在CaCO3(K spΘ= 3.36×10-9),CaF2(K spΘ= 3.45×10-11),Ca3(PO4)2(K spΘ= 2.07×10-33)这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为_________。
4.在原电池中流出电子的电极为________,在正极发生的是________反应,原电池可将________能转化为________能。
5.反应Cl2 (g) + 2Br-(s)2Cl-(eq) + Br2 (l)与Br2 (l) + 2I-(eq)2Br-(eq) + I2 (s)均正向进行,其中最弱的还原剂为________它所在的氧化还原电对为,最强的还原剂为________,它所在的氧化还原电对为。
6.第三能级组包括________类原子轨道,分别是,,共有个原子轨道。
7.第四电子层有4个电子的某元素,其原子序数是________,价电子构型为,该元素属第________周期、________族,为(金属或非金属)元素,最高氧化数为。
8.第四周期有________种元素,这是因为第______能级组有类原子轨道,分别为,,,最多可容纳_______个电子。
二、选择题(16分,每题2分)
1.难电离的HgCl2在水中的溶解度(mol·L-1)与其饱和溶液中下列物质的浓度最接近的是()
(A). Hg2+离子(B). Cl-离子
(C). HgCl+离子(D). HgCl2分子
2.向饱和AgCl溶液中加水,下列叙述正确的是( )
(A).AgCl的溶解度增大(B).AgCl的溶解度、Kθsp均不变
(C).AgCl的Kθsp增大(D).AgCl的溶解度、Kθsp增大
3. BaSO4的相对分子质量为233,Kθsp= 1×10-10,把1 m mol BaSO4置于10L 水中,有多少
克BaSO4尚未溶解?()(A). 2.1g (B). 0.21g
(C). 0.021g (D). 0.0021g
4.下列化合物中,碳原子的氧化数为-3的是( )
(A). CHCl3 (B). C2H2
(C). C2H4(D). C2H6
5.在半电池Cu2+|Cu溶液中,加入氨水后,可使该电对的电极电势值( ) (A).增大(B).减小
(C).不变(D).等于零
6.某电池反应A + B2+A2+ + B的平衡常数为104,则该电池在298K时的标准电动势是( ) (A).+0.060V (B).-0.119V
(C).-0.060V (D).+0.119V
7.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,该元素在周期表中属于( )
(A).ⅤB族(B).ⅢB族
(C).Ⅷ族(D).ⅤA族
8.下列各组数字都是分别指原子的次外层、最外层电子数和元素的常见氧化态,哪一组最符合于硫的情况?( )
(A).2,6,-2 (B).8,6,-2
(C).18,6,+4 (D).2,6,+6
三、是非题(10分,每题2分)
1.在任何给定的溶液中,若Q<Kθsp,则表示该溶液为过饱和溶液,沉淀从溶液中析出。
()
2.欲使Mg2+沉淀为Mg(OH)2,用氨水为沉淀剂的效果比用强碱NaOH的效果好得多。
()
3.电对的电极电势值不一定随pH的改变而改变。
()
4.除H、He外,p区元素的原子,最外层电子都是p电子。
( )
5.钴原子(原子序数=27)的价电子构型是4s2。
( )
四、问答题(10分,每题5分)
1.根据溶度积规则说明下列事实:
1)Fe(OH)3(Kθsp=2.79×10-39)沉淀溶解于稀盐酸溶液中;
2)BaSO4(Kθsp=1.08×10-10)沉淀难溶于稀盐酸溶液中。
(Kθa2,H2SO4=1.02×10-2)
2.写出Fe原子(原子序数为26)的核外电子排布式(电子层结构)和价电子构型,并指
出其在周期系中所属的周期、族和区。
五、用离子-电子法配平下列反应方程式(10分,每题5分)
1.HClO4 + H2SO3 → HCl + H2SO4
2.Cu + 2H2SO4 (浓) == CuSO4+ SO2+ 2H2O
六、计算题(24分)
1.(6分)计算难溶电解质Mg(OH)2在0.01mol·L-1 MgCl2溶液中的溶解度(mol•L-1),Kθsp =5.61×10-12。
2.(6分)欲从0.002 mol·L-1 Pb(NO3)2溶液中产生Pb(OH)2沉淀,问溶液的pH值至少为多少?Kθsp=1.42⨯10-20
3.(6分)计算298K时,105Pa H2在0.1 mol·L-1HAc溶液中的电极电势。
Kθa,HAC=1.80⨯10-5 4.(6分)已知Eθ(Co3+/ Co2+)=1.83V,Eθ(Co2+/ Co)=-0.28V,计算Eθ(Co3+/ Co)的值。
参考答案
一、填空题(30分,每空1分)
1.沉淀溶解,CaCO3 + 2HAc = Ca2++2Ac-+ CO2 + H2O
2.难溶电解质的本性;温度;
3.CaF2 CaCO3 Ca3(PO4)2
4.负极,还原反应,化学能,电能
5. Br-,Br2/ Br-,I-,I2/ I-
6.2;3s, 3p;4个
7.22;4s23d2;四;ⅣB;金属;4
8.18;四;3;4s;3d;4p;18
二、选择题(16分,每题2分)
1.D
2.B
3.B
4.D
5.B
6.A
7.C
8.B
三、是非题(10分,每题2分)
1.错 2.错 3.对 4.错 5.错
四、问答题(10分,每题5分)
1.
1)Fe (OH )3与盐酸作用生成难电离的水,平衡移动,使之溶解。
溶解反应为: Fe(OH)3↓ + 3H + Fe 3+ + 3H 2O 平衡常数为:3314393331079.2)100.1(1079.2)(][][⨯=⨯⨯===--ΘΘ++W sp K K H Fe K 因此,Fe(OH)3能溶于稀硫酸溶液中。
2)BaSO 4沉淀若与盐酸作用,生成强电解质硫酸,平衡不会发生移动,沉淀不能溶解。
溶解反应为:
BaSO 4↓ + H + Ba 2+ + HSO 4-
平衡常数为:8210421006.110
02.11008.1][]][[2---ΘΘ+-+⨯=⨯⨯===a sp K K H HSO Ba K 可以由此推断,溶解所需的酸度会很高,稀盐酸无法使之溶解。
2.
Fe 的原子序数为26,Fe 原子的核外电子排布式(电子层结构):1s 22s 22p 63s 23p 63d 64s 2 亦可写为[Ar] 3d 64s 2
Fe 原子的价电子层结构:3d 64s 2
Fe 属第四周期,第Ⅷ族,为d 区元素。
五、用离子-电子法配平下列反应方程式(10分,每题5分)
1.
ClO 4- + 8H + + 8e = Cl
- + 4H 2O +) 4×) SO 32-
+ H 2O - 2e = SO 42- + 2H + ClO 4- + 4SO 32- == Cl - + 4SO 42
- HClO 4 + 4H 2SO 3 == HCl + 4H 2SO 4
2.
SO 4 2- + 4H + + 2e = SO 2 + 2H 2O
+) Cu - 2e = Cu 2+
Cu + SO 4 2- + 4H + == Cu 2+ + SO 2 + 2H 2O
Cu + 2H 2SO 4 (浓) == CuSO 4 + SO 2 + 2H 2O
六、计算题(24分)
1.(6分)
c Mg2+= 0.01
c OH-= (K sp ө / c Mg2+) 1/2
=2.37×10-5mol/l
s = 0.5×c OH - =1.19×10-5mol/l
2.(6分)
Pb 2+ + 2OH -
Pb(OH)2(s ) 0.002 x 0.002·x 2 = 1.42⨯10-20
x = 2.66⨯10-9
pH = 14-[-lg(2.66⨯10-9)]
= 5.42
3.(6分)
[H +] =(0.1⨯1.80⨯10-5)1/2 =1.34⨯10-3
E (H +/H 2)= E θ(H +/H 2)+(0.0592 / 2 )lg ([H +]2100 / 105) =(0.0592 / 2 )lg[(1.34⨯10-3)2100 / 105]
= -0.171V
4.(6分)
0.423(v)2120.28)(1.831)Co Co (=+⨯-+⨯=+θϕ3。
