气体摩尔体积的概念及计算【含答案-习题-2015】
气体摩尔体积

判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA(╳ ) 3、常温常压,1molHe含有的原子数为NA ( √ ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( √ )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
的原子数相同( ╳
)
) ) )
2. 1molCO2占有的体积约是22.4L( 3. 标况下, 1molH2O的体积约是22.4L( 4. CO在标况下占有的体积约是22.4L(
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
5. 1molCO2和1molSO2所占有的体积相同,
所含的分子个数也相同(
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ╳ 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA( ) 3、常温常压,1molHe含有的原子数为NA ( ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
摩尔体积的计算

3、有关“物质的量”的计算关系 、有关“物质的量”
质量 ÷M ×M
m
物质的量 ×NA
分子 原子 离子
n
×vm ÷v m
÷NA
微粒数 N
电子 质子 中子
(标况) 标况)
V
下列说法正确的是 (D) ) (A)在标准状况下,1mol水和1molH2的 在标准状况下,1mol水和1molH 水和 体积都约是22.4L 体积都约是22.4L (B)2gH2和44gCO2的体积相等 (C)1mol某气体的体积为22.4L,则该气 1mol某气体的体积为22.4L, 某气体的体积为22.4L 体一定处于标准状况 (D)在标准状况下,1gH2和11.2LO2的物 在标准状况下, 质的量相等
即标准状况下的气体摩尔体积约为 即标准状况下的气体摩尔体积约为 气体摩尔体积 22. 4 Lmol-1
22.4L
[练习 练习] 练习
判断
1.标准状况下,1mol任何物质的体积都约 1. 标准状况下,1mol任何物质的体积都约 标准状况下 物质应是气体) 22.4L。 是22.4L(错,物质应是气体) 。
某密闭容器的质量为50g, 某密闭容器的质量为50g,当它装 50g 气体时,质量为58.8g 58.8g, 满CO2气体时,质量为58.8g,如果改 装CH4,其质量应为 ( D) A.3.2g B.58.8g C.22.4g D.53.2g
ห้องสมุดไป่ตู้
下列各物质所含原子数目, 下列各物质所含原子数目,按由大到小 顺序排列的是 ( D ) ① 0.5mol NH3 标准状况下22.4LHe ②标准状况下22.4LHe 时的9mL 9mL水 ③ 4℃ 时的9mL水 ④0.2mol H3PO4 A.①④②③ B.④③②① A.①④②③ B.④③②① C.②③④① D.①④③② C.②③④① D.①④③②
气体摩尔体积习题与答案详解

气体摩尔体积1.四种因素:①温度和压强②所含微粒数③微粒本身大小④微粒间的距离,其中对气态物质体积有显著影响的是( )A.②③④B.②④C.①③④D.①②④2.下列有关气体体积的叙述中,正确的是( )A.一定温度和压强下,各种气态物质体积的大小由构成气体的分子大小决定B.一定温度和压强下,各种气态物质体积的大小由构成气体的质量大小决定C.不同的气体,若体积不同,则它们所含的分子数也不同D.一定的温度和压强下,各种气体的物质的量决定它们的体积3.当温度和压强一定时,决定气体体积大小的主要因素是( )A.分子直径的大小B.分子间距离的大小C.分子间引力的大小D.分子数目的多少4.在标准状况下,与12 g H2的体积相等的N2( )A.质量为12 gB.物质的量为6 molC.体积为22.4 LD.分子数为6.02×10235.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中N A为阿伏加德罗常数的值)( )A.22.4ab cN ALB.22.4bcaN ALC.22.4acbN ALD.22.4bacN AL6.在标准状况下,由0.5 g H 2、11 g CO 2和4 g O 2组成的混合气体,其体积约为( ) A .8.4 L B .11.2 L C .14.0 LD .16.8 L7.同温同压下,用等质量的CH 4、CO 2、O 2、SO 2四种气体分别吹出四个气球,其中气体为CH 4的是 ( )8.在一定条件下,1体积气体A 2和3体积气体B 2完全反应生成了2体积气体X(体积在相同条件下测定),则X 的化学式是 ( ) A .AB 2 B .A 2B 3 C .AB 3D .AB 29.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是 ( ) A .甲的分子数比乙的分子数多 B .甲的物质的量比乙的物质的量少 C .甲的摩尔体积比乙的摩尔体积小D .甲的相对分子质量比乙的相对分子质量小 10.下列两种气体的分子数一定相等的是( ) A .质量相等的N 2和COB.体积相等的CO和C2H4C.等温、等体积的O2和N2D.等压、等体积的N2和CO211.标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为________;混合气体中甲烷的体积为________;一氧化碳的质量为________。
高考化学一轮复习真题考点集训气体摩尔体积(含解析)

【考点训练】气体摩尔体积【知识点的认识】1、气体摩尔体积:(1)概念:单位物质的量的气体所占的体积.(2)符号:Vm .(3)单位:L/mol(L•mol-1).(4)计算公式:气体摩尔体积(Vm)=气体体积(V)/物质的量(n).(5)标况下(0℃、101kPa)气体摩尔体积约为22.4L/mol,在25℃和101kPa条件下,气体摩尔体积约为24.5L/mol.2、决定物质体积大小的因素:1)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小.2)决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小.3)影响气体分子间平均距离大小的因素:温度和压强.温度越高,体积越大;压强越大,体积越小.当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值,故粒子数一定时,其体积是一定值.总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外].②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等.3、物理量之间的关系:n=m/M=N/NA=V/Vm.【命题方向】本考点主要考察气体摩尔体积的概念单位和前提条件,需要重点掌握.题型一:气体摩尔体积的概念和单位典例1:下列有关气体摩尔体积的描述中正确的是()A.单位物质的量的气体所占的体积就是气体摩尔体积 B.通常状况下的气体摩尔体积约为22.4L C.标准状况下的气体摩尔体积约为22.4L D.相同物质的量的气体摩尔体积也相同分析:A、气体摩尔体积就是单位物质的量的气体所占的体积;B、气体摩尔体积22.4L/mol适用于标况下的气体;C、标准状况下气体摩尔体积Vm=22.4L/mol;D、根据V=nVm来回答.解答:A、气体摩尔体积就是单位物质的量的气体所占的体积,故A正确;B、气体摩尔体积22.4L/mol只适用于标况下的气体,故B错误;C、标准状况下气体摩尔体积Vm=22.4L/mol,故C错误;D、气体摩尔体积只与气体的存在条件有关,与物质的量无关,故D错误.故选A.点评:本题考查学生摩尔体积的概念,可以根据所学知识来回答,难度不大.题型二:“22.4L/mol”的适用条件典例2:下列说法正确的是()A.在标准状况下,1mol水的体积是22.4L B.1molH2所占的体积约为22.4LC.在标准状况下,NA个分子所占的体积约为22.4L D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L分析:A、根据气体摩尔体积的使用范围判断;B、根据气体摩尔体积的使用条件判断;C、根据气体摩尔体积的使用范围判断;D、根据气体摩尔体积的定义判断.解答:A、气体摩尔体积的使用范围是气体,水是液体,故A错误.B、在标况下,1molH2所占的体积约为22.4L,没有前提条件,故B错误.C、未注明该物质的状态,不能确定其体积,故C错误.D、在标准状况下,1mol任何气体所占的体积约为22.4L,任何气体既指纯净物又指混合物,故D正确.故选:D.点评:本题考查的是气体摩尔体积,注意气体摩尔体积的使用范围、条件,正确理解定义中“任何”的含义.题型三:物理量之间的关系典例3:先求出ng该混合气体含有的分子数,再求出混合气体物质的量,最后根据标准状况下的气体摩尔体积求出体积.分析:先求出ng该混合气体含有的分子数,再求出混合气体物质的量,最后根据标准状况下的气体摩尔体积求出体积.解答:根据其组分及其含量相同,所以其质量与分子数成正比,设ng该混合气体含有的分子数为x 个,质量与分子数的比列式为:mg:b=ng:x,x=ng×bmg=nbm;ng该混合气体含有的物质的量为:n=NNA=nbmNA=nbmNAmol,其体积为:V=n×Vm =nbmNAmol×Vm =nbmNAmol×22.4l/mol=22.4nbmNAL故选:A.点评:本题考查了物质的量、质量、气体摩尔体积之间的关系,题目难度不大,灵活运用公式是解题的关键,这种类型的题在高考选择题中经常出现.【解题思路点拨】对“1mol任何气体所占的体积都约是22.4L”的理解:1)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离.在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下气体摩尔体积都约是22.4L/mol.2)标准状况:指0℃、1.01×105Pa的状态.温度越高,体积越大;压强越大,体积越小.故在非标准状况下,其值不一定就是“22.4L”.但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4升.3)1mol气体在非标准状况下,其体积可能为22.4L,也可能不为22.4L.如在室温(20℃,一个大气压)的情况下气体的体积是24L.4)此概念应注意:①气态物质;②物质的量为1mol;③气体状态为0℃和1.01×105Pa(标准状况);④22.4L体积是近似值;⑤Vm的单位为L/mol和m3/mol.5)适用对象:纯净气体与混合气体均可.一、选择题(共15小题)1.决定气体体积的主要因素是:①气体分子直径②所含微粒数③气体相对分子质量④微粒间的距离()A.只②③④ B.只②④ C.只①③④ D.①②③④全部2.标准状况下的1molH2的体积约为()A. 11.2L B. 22.4L C. 33.6L D. 44.8L3.36.5gHCl气体体积是()A. 11.2L B. 22.4L C. 5.6L D.无法确定4.相同状况下,下列气体所占体积最大的是()A. 80gSO2 B. 16gO2 C. 32gH2S D. 3gH25.已知m mol某气体的质量为a g,则b g该气体在标准状况下的体积(L)为() A. B. C. D.6.标准状况下,112mL某气体的质量是0.17g,该气体可能是()A. O2 B. N2 C. H2S D. CO27.标准状况下有①6.72L CH4②3.01×1023个HCl③13.6g H2S④0.2mol NH3,下列对四种气体的关系从小到大表示不正确的是()A.体积④<①<③<② B.密度①<④<③<②C.质量④<①<③<② D.氢原子数④<②<③<①8.等质量的①CH4、②H2、③HCl、④SO2,在标况下体积由大到小顺序是() A.②>①>③>④ B.④>③>①>② C.③>②>④>① D.①>④>②>③9.相同物质的量的各种固体或液体的体积并不相同,其主要原因是() A.粒子大小不同 B.粒子质量不同C.粒子间距离不同 D.粒子间作用力不同10.设N A为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是()A.L B. C. D.L11.下列有关气体体积的叙述中,正确的是()A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定C.不同的气体若体积不同,则它们所含的分子数也不同D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L12.下列说法正确的是()A.在标准状况下,1mol水的体积是22.4LB. 1molH2所占的体积一定是22.4LC.在标准状况下,N A个任何分子所占的体积约为22.4LD.在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L13.已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105Pa条件下的体积是(N A 表示阿伏加德罗常数的值)()A.L B.LC.L D.L14.下列叙述正确的是()A. 1mol任何气体的体积都为22.4LB. 1mol任何物质在标准状况下所占的体积都为22.4LC.标准状况下,1mol水所占的体积都为22.4LD.标准状况下,22.4L的任何气体的物质的量都是1mol15.下列说法正确的是()A.在标准状况下,1mol水的体积是22.4LB. 1molH2所占的体积约为22.4LC.在标准状况下,N A个分子所占的体积约为22.4LD.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L【考点训练】气体摩尔体积-1参考答案与试题解析一、选择题(共15小题)1.决定气体体积的主要因素是:①气体分子直径②所含微粒数③气体相对分子质量④微粒间的距离()A.只②③④ B.只②④ C.只①③④ D.①②③④全部考点:气体摩尔体积.专题:化学用语专题.分析:由于气体的分子间距离远大于分子本身大小,则决定气体体积的因素主要是气体的分子数目以及分子间距离,以此解答.解答:解:由于气体的分子间距离远大于分子本身大小,则决定气体体积的因素主要是气体的分子数目以及分子间距离,而气体的分子数目一定时,气体分子间距离为影响体积大小的主要因素,与气体分子的质量、分子间作用力大小无关,故选B.点评:本题考查阿伏伽德罗定律及其应用,侧重于学生的分析能力的考查,注意分子的大小不影响气体体积,为易错点.2.标准状况下的1molH2的体积约为()A. 11.2L B. 22.4L C. 33.6L D. 44.8L考点:气体摩尔体积;物质的量的相关计算.专题:计算题.分析:标准状况下,V m=22.4L/mol,代入公式V=n•V m计算.解答:解:标准状况下,V m=22.4L/mol,1molH2的体积V=n•V m=1mol×22.4L/mol=22.4L,故选:B.点评:本题考查V=n•V m计算,题目比较简单,明确标准状况下,V m=22.4L/mol是解题的关键.3.36.5gHCl气体体积是()A. 11.2L B. 22.4L C. 5.6L D.无法确定考点:气体摩尔体积.专题:阿伏加德罗常数和阿伏加德罗定律.分析:必须知道气体摩尔体积,才能根据物质的量计算出气体的体积,据此进行判断.解答:解:36.5gHCl气体,物质的量是1mol,由于不知道气体摩尔体积,无法计算出1mol氯化氢的体积,故选:D.点评:本题考查了气体摩尔体积,必须告诉气体所处条件,才能根据物质的量计算出气体所占体积,本题难度不大.4.相同状况下,下列气体所占体积最大的是()A. 80gSO2 B. 16gO2 C. 32gH2S D. 3gH2考点:气体摩尔体积;摩尔质量.专题:化学用语专题.分析:根据质量和体积之间的关系公式V=来计算.解答:解:根据公式:V=可知,相同状况下,气体的Vm是相等的,所以体积和物质的量成正比,A、80gSO2的物质的量为1.25mol;B、16gO2的物质的量为0.5mol;C、32gH2S的物质的量为0.94mol;D、3g氢气的物质的量为1.5mol;所以3g氢气的物质的量最大,即体积最大.故选D.点评:本题是对课本知识的考查,要求学生熟记计算公式,并灵活运用.5.已知m mol某气体的质量为a g,则b g该气体在标准状况下的体积(L)为() A. B. C. D.考点:气体摩尔体积;物质的量的相关计算.专题:计算题.分析:计算该气体的摩尔质量,利用n=计算bg该气体的物质的量,再根据V=nVm计算体积.解答:解:m mol某气体的质量为a g,所以该气体的摩尔质量为M==g/mol,则bg该气体的物质的量为n==mol,所以标准状况下,bg该气体的体积为mol×22.4L/mol=L.故选C.点评:本题考查常用化学计量数的有关计算,难度不大,加强基础知识的掌握.6.标准状况下,112mL某气体的质量是0.17g,该气体可能是()A. O2 B. N2 C. H2S D. CO2考点:气体摩尔体积;物质的量的相关计算.专题:阿伏加德罗常数和阿伏加德罗定律.分析:标准状况气体的体积换算物质的量,n=;摩尔质量M=,依据摩尔质量计算判断.解答:解:标准状况气体的体积换算物质的量,n===0.005mol;气体摩尔质量M===34g/mol;气体中H2S摩尔质量符合;故选:C.点评:本题考查了气体摩尔体积和物质的量的换算,质量和物质的量计算摩尔质量,理解概念是解题关键,题目较简单.7.标准状况下有①6.72L CH4②3.01×1023个HCl③13.6g H2S④0.2mol NH3,下列对四种气体的关系从小到大表示不正确的是()A.体积④<①<③<② B.密度①<④<③<②C.质量④<①<③<② D.氢原子数④<②<③<①考点:气体摩尔体积;摩尔质量;物质的量的相关计算.专题:化学用语专题.分析: A、根据V=nVm=Vm=Vm来计算,或者根据阿伏伽德罗定律的推论:同温同压下,体积之比等于物质的量之比来回答;B、根据=来计算或者根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比;C、根据m=nM=M=M来计算;D、根据公式计算氢原子的物质的量,进而计算氢原子数.解答:解:A、3.01×1023个HCl的体积V=Vm=0.5mol×22.4L/mol=11.2L,13.6gH2S的体积V=Vm=×22.4L/mol=8.96L,0.2molNH3的体积V=0.2mol×22.4L/mol═4.48L,所以体积关系为:④<①<③<②,故A正确;B、根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比,所以密度关系为:①<④<③<②,故B正确;C、6.72LCH4的质量是m=M=×16g/mol=4.8g,3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2molNH3的质量是0.2mol×17g/mol=3.4g,所以质量关系是④<①<③<②,故C正确;D、6.72LCH4的物质的量为0.3mol,所以氢原子的物质的量为1.2mol,3.01×1023个HCl的物质的量为0.5mol,所以氢原子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,所以氢原子的物质的量为0.8mol,0.2molNH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是②<④<③<①,故D错误.故选D.点评:本题考查学生有关物质的量的相关计算知识,可以根据所学内容来回答,较简单.8.等质量的①CH4、②H2、③HCl、④SO2,在标况下体积由大到小顺序是() A.②>①>③>④ B.④>③>①>② C.③>②>④>① D.①>④>②>③考点:气体摩尔体积.专题:阿伏加德罗常数和阿伏加德罗定律.分析:同温同压下,质量相等,由PV=nRT可推知,体积与摩尔质量成反比,即相对分子质量越大,体积越小.解答:解:由于n=,代入PV=nRT,得PV=RT,所以同温同压下,质量相等,体积与摩尔质量成反比,所以相对分子质量越大,体积越小,①CH4、②H2、③HCl、④SO2的相对分子质量分别为16、2、36.5、64,所以在标况下体积由大到小顺序为②>①>③>④.故选A.点评:本题考查气体摩尔体积的有关计算,难度不大,本题也可令质量为某值,求出各物质的物质的量,比较其大小判断,但较上述解法稍微麻烦.9.相同物质的量的各种固体或液体的体积并不相同,其主要原因是()A.粒子大小不同 B.粒子质量不同C.粒子间距离不同 D.粒子间作用力不同考点:气体摩尔体积.专题:化学用语专题.分析:影响物质体积的因素有粒子数目、粒子本身大小以及粒子间的距离.对于固体、液体粒子本身的大小远大于粒子间的距离.解答:解:影响物质体积的因素有微粒数目、粒子本身大小以及粒子间的距离等因素.对于气体来说,温度、压强决定气体粒子间距,气体粒子间的距离远大于粒子本身的大小,粒子本身可以忽略不计.所以在同温同压下,相同物质的量的气体体积约相等.对于固体、液体来说,粒子本身的大小远大于粒子间的距离,粒子间的距离可以忽略不计,不同的固体、液体物质粒子大小不同,所以相同物质的量的各种固体或液体的体积,取决于粒子本身的大小.故选A.点评:本题考查影响气物质体积大小的因素,题目难度不大,注意影响气体体积的因素,同温同压下,相同物质的量的气体体积约相等,与气体分子种类无关.10.设N A为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是()A.L B. C. D.L考点:气体摩尔体积.专题:阿伏加德罗常数和阿伏加德罗定律.分析:先求出ng该混合气体含有的分子数,再求出混合气体物质的量,最后根据标准状况下的气体摩尔体积求出体积.解答:解:根据其组分及其含量相同,所以其质量与分子数成正比,设ng该混合气体含有的分子数为x个,质量与分子数的比列式为:mg:b=ng:x,x==个;ng该混合气体含有的物质的量为:n===mol,其体积为:V=n×V m =mol×V m =mol×22.4l/mol=L故选:A.点评:本题考查了物质的量、质量、气体摩尔体积之间的关系,题目难度不大,灵活运用公式是解题的关键,这种类型的题在高考选择题中经常出现.11.下列有关气体体积的叙述中,正确的是()A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定C.不同的气体若体积不同,则它们所含的分子数也不同D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L考点:气体摩尔体积.专题:化学用语专题.分析: A、因为温度和压强一定时,不同气体的分子之间的平均距离都是大概相同的,分子很小,此时决定气体体积大小的主要因素就是分子数;B、因为温度和压强一定时,不同气体的分子之间的平均距离都是大概相同的,分子很小,此时决定气体体积大小的主要因素就是分子数;C、根据分子数N=nN A=N A来回答;D、气体摩尔体积22.4L/mol,必须适用于标况下的气体.解答:解:A、因为温度和压强一定时,不同气体的分子之间的平均距离都是大概相同的,分子很小,此时决定气体体积大小的主要因素就是分子数,故A错误;B、因为温度和压强一定时,不同气体的分子之间的平均距离都是大概相同的,分子很小,此时决定气体体积大小的主要因素就是分子数,故B正确;C、根据分子数N=nN A=N A,若体积不同,不同状态下气体的Vm也不同,所以它们所含的分子数也可能相同,故C错误;D、气体摩尔体积22.4L/mol,必须适用于标况下的气体,故D错误.故选B.点评:本题考查学生影响分子体积的音素,可以根据所学知识来回答,难度不大.12.下列说法正确的是()A.在标准状况下,1mol水的体积是22.4LB. 1molH2所占的体积一定是22.4LC.在标准状况下,N A个任何分子所占的体积约为22.4LD.在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L考点:气体摩尔体积.分析: A、标况下,水是液态;B、氢气所处的状态不明确;C、在标况下,只有N A个气体分子的体积才是22.4L;D、应用气体摩尔体积,也适用混合气体;解答:解:A、标况下,水是液态个,故A错误;B、氢气所处的状态不明确,故所占的体积不一定是22.4L,故B错误;C、在标况下,只有N A个气体分子的体积才是22.4L,故C错误;D、28gCO与N2的混合气体,一氧化碳和氮气摩尔质量相同,物质的量为1mol,在标准状况下混合气体体积约为22.4L,故D正确;点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.13.已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105Pa条件下的体积是(N A 表示阿伏加德罗常数的值)()A.L B.LC.L D.L考点:气体摩尔体积.专题:阿伏加德罗常数和阿伏加德罗定律.分析:依据质量、微粒数、气体摩尔体积、阿伏伽德罗常数等物理量计算判断;主要依据关系为:n===;解答:解:a g气体X2中含有b个X原子,气体摩尔质量设为M,则×2=mol,M=g/mol;0℃、1.01×105Pa条件是标准状况,c g该气体的体积==L=L故选A.点评:本题考查了物质的量与质量、摩尔质量、气体摩尔体积、微粒数的换算关系,关键是熟练掌握各物理量的换算关系.14.下列叙述正确的是()A. 1mol任何气体的体积都为22.4LB. 1mol任何物质在标准状况下所占的体积都为22.4LC.标准状况下,1mol水所占的体积都为22.4LD.标准状况下,22.4L的任何气体的物质的量都是1mol考点:气体摩尔体积.专题:化学用语专题.分析: A、状况不知,标况下,1mol任何气体的体积都为22.4L;B、状态必须是气体物质;C、水是液体;D、标准状况下,22.4L的任何气体的物质的量都是1mol.解答:解:A、状况不知,标况下,1mol任何气体的体积都为22.4L,故A错误;B、状态必须是气体物质,故B错误;C、水是液体,故C错误;D、标准状况下,22.4L的任何气体的物质的量都是1mol,故D正确;故选D.点评:本题考查气体摩尔体积的适用条件和范围,只有在标况下的气体才适用,比较容易.15.下列说法正确的是()A.在标准状况下,1mol水的体积是22.4LB. 1molH2所占的体积约为22.4LC.在标准状况下,N A个分子所占的体积约为22.4LD.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L考点:气体摩尔体积.专题:化学用语专题.分析: A根据气体摩尔体积的使用范围判断;B根据气体摩尔体积的使用条件判断;C、根据气体摩尔体积的使用范围判断;D根据气体摩尔体积的定义判断.解答:解:A、气体摩尔体积的使用范围是气体,水是液体,故A错误.B、在标况下,1molH2所占的体积约为22.4L,没有前提条件,故B错误.C、未注明该物质的状态,不能确定其体积,故C错误.D、在标准状况下,1mol任何气体所占的体积约为22.4L,任何气体既指纯净物又指混合物,故D正确.故选:D点评:本题考查的是气体摩尔体积,注意气体摩尔体积的使用范围、条件,正确理解定义中“任何”的含义.。
高中化学——物质的量 气体摩尔体积

物质的量气体摩尔体积课标解读要点网络1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(V m)、阿伏加德罗常数(N A)的含义。
2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.了解相对原子质量、相对分子质量的含义,并能进行有关计算。
物质的量摩尔质量1.物质的量、阿伏加德罗常数2.摩尔质量(1)概念:单位物质的量的物质所具有的质量,符号为M,单位为g·mol-1或kg·mol-1。
(2)数值:当微粒的摩尔质量以g·mol-1为单位时,在数值上等于该微粒的相对分子(或原子)质量。
(3)关系:物质的量、物质的质量与摩尔质量关系为n=mM或M=mn或m=n·M。
[补短板](1)物质的量及其单位(摩尔)不能描述宏观物质的数量。
(2)使用摩尔作单位时,必须指定化学式或指明微粒的种类,如1 mol H 不能描述为1 mol 氢等。
(3)6.02×1023是个纯数值,没有任何物理意义,它与阿伏加德罗常数(N A)的关系应理解为6.02×1023是阿伏加德罗常数(N A)的数值的近似值。
(4)摩尔质量、相对分子质量、质量是三个不同的物理量,具有不同的单位。
如H2O的摩尔质量为18 g·mol-1,H2O的相对分子质量为18,1 mol H2O的质量为18 g。
但若不指明各单位,数值也不一定相等。
如H2O的摩尔质量也可以是0.018 kg·mol-1。
(5)摩尔质量与温度、压强、物质的量多少无关。
[基础判断](1)1 mol OH-的质量是17 g·mol-1。
()(2)N A代表阿伏加德罗常数的数值,22 g CO2中含有的氧原子数为N A。
()(3)n mol O2中分子数为N,则阿伏加德罗常数为Nn。
()(4)H2SO4的摩尔质量和相对分子质量的数值均为98。
气体摩尔体积
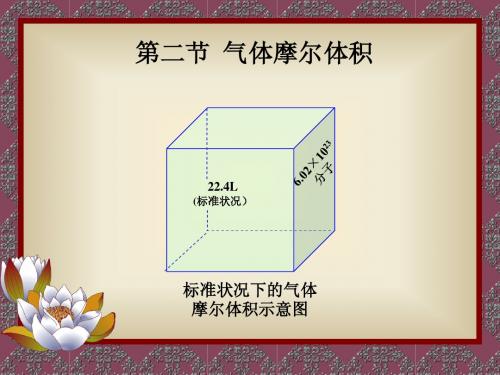
(2)推论:
①同温、同压下,气体的体积之比=分子数之比= 物质的量之比 V1 :V2 = n1 :n2 = N1 : N2 例:42gN2与11gCO2在相同条件下的体积之比 为 。
(2)推论:
三、习题课:
1、有关相对密度和平均分子量方面: 例1:依照阿伏加德罗定律,下列说法中正确的 是( )(98年高考题) A、同温同压下,两种气体的体积之比等于摩尔 质量之比。 B、同温同压下,两种气体的物质的量之比等于 密度之比。 C、同温同压下,两种气体的摩尔质量之比等于 密度之比。 D、同温同体积下,两种气体的物质的量之比等 于压强之比。
③>②>⑤>④>①
[讨论] 请列出标准状况下求算气体体积可能的方法: 1、V=m/ ρ
2、V=n×Vm
(V=m/M×Vm 作业 (1)0.5molHCl占有的体积是多少? (2)33.6LH2的物质的量是多少? (3)16gO2的体积是多少? (4)44.8LN2中含有的N2分子数是多少?
ρ
V=N/NA×Vm)
例3:某物质A在一定条件下加热分解: 2A=B+2C+4D ,生成物全为气体,测得 混和气体对氢气的相对密度为11.3,则A 的式量为 . 例4:用向上排空法收集一烧瓶CO2气体, 测得烧瓶内气体对H2的相对密度为19.5, 将其倒置于盛有NaOH溶液的水槽中, 一段时间后进入烧瓶中的NaOH溶液的 体积占烧瓶容积的 。
3、有关摩尔电子质量方面: 例7:某金属粉末20.75g,跟过量的稀硫酸反应, 共生成标况下的H2 11.2L,则下列金属的组合可 能的是( ) A、Al Fe B、Al Mg C、Mg Cu D、Fe Zn 4、有关气体摩尔休积方面的综合计算: 例8:常温下100mLH2和O2的混和气体点燃爆炸后恢 复到原温度时,剩余气体的体积为10mL,则原混和 气体的可能组成是 ;若原混和气体的温 度高于100℃,点燃爆炸后恢复至原温度,其体积 变 为70mL,则原混和气体的可能组成是 。
化学必修一 知识讲解-气体摩尔体积-基础

m【学习目标】气体摩尔体积1、理解气体摩尔体积的含义。
2、掌握气体摩尔体积的有关计算。
【要点梳理】要点一、 影响物质体积大小的因素1. 影响物质体积大小的因素: 从微观来看,影响物质体积大小的因素有三个:微粒个数、微粒大小、微粒间距离。
1 mol 任何物质中的粒子数目都是相同的,即约为 6.02×1023。
因此,1 mol 物质的体积大小主要取决于构成物质的粒子的大小和粒子之间的距离。
2. 影响固体(或液体)物质体积大小的主要因素有两个:微粒个数和微粒自身大小 要点诠释:固态或液态物质,粒子之间的距离是非常小的,故 1 mol 固态或液态物质的体积主要取决于粒子的大小,不同的固态或液态物质,粒子的大小是不相同的,因此,1 mol 不同的固态或液态物质的体积是不相同的(见下图)。
固体液体 气体3. 影响气体物质体积大小的主要因素有两个:微粒个数和微粒间距离 。
要点诠释:对于气体来说,粒子之间的距离远大于粒子本身的直径,气体体积与微粒间的距离有关,与粒子本身的直径大小关系不大。
当压强和温度一定时,气体微粒间距离一定,所以当气体分子数一定,则气体体积一定;反之,在压强和温度一定时,相同体积的任何气体分子数相等,这就是常说的阿伏加德罗定律。
如果气体的物质的量为 1 mol ,则其体积主要取决于气体粒子之间的距离。
而在同温同压下,任何气体粒子之间的平均距离可以看成是相等的,1 mol 任何气体都具有相同的体积 (见上图)。
要点二、气体摩尔体积1、气体摩尔体积的含义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号是 V m ,它的常用单位是 L·mol -1 和 m 3·mol -1。
关于物质的量(n )、气体的体积(V )和气体摩尔体积(V m )之间的计算公式为 VV V m = n 。
可变形为 V=n·V m 与 n = V 。
2、标准状况下气体摩尔体积:在标准状况(指 0℃、101 kPa ,记作:STP )下,气体A 摩尔体积约为 22.4 L·mol -1。
气体摩尔体积
提示:正确,因同温、同压下,相同体积的任何气体 都含有相同数目的分子.
返回
4.气体摩尔体积为22.4 L/mol.
(
)
提示:错误,22.4 L/mol是标准状况下的气体摩尔体 积,非标准状况下的气体摩尔体积不一定是22.4 L/mol. 5.0℃、101 kPa和25℃、101 kPa两种情况下,气体摩尔
解析:A项,1 mol O2含2 mol O,在标准状况下的 体积为22.4 L;B项,1 mol O3和1.5 O2均含3 mol O;
C项;CH3COOH为弱酸,在水中部分电离,HCl溶
于水完全电离;D项,CO2与C6H12O6的物质的量相 同时,碳原子数之比为1∶6,氧原子数之比为1∶3。 答案:C
(
)
解析:摩尔质量的单位是g· -1,g是质量的单位。 mol
答案:C
返回
3.能表示阿伏加德罗常数数值的是
A.1 mol金属钠含有的电子数
( C )
B.标准状况下,22.4 L苯所含的分子数 C.0.012 kg12C所含的原子数 D.16 g18O所含的原子数
返回
解析:1 mol Na 含有 11 mol 电子,所含电子数是阿伏加 德罗常数的 11 倍;标准状况下,苯为液体,不能用气体 摩尔体积进行计算;16 g18O 的物质的量为 n(18O)= 16 g <1 mol,即所含原子数小于阿伏加德罗常数。 18 g · -1 mol
体积都为22.4 L/mol.
(
)
提示:错误,因气体摩尔体积的大小与温度、压强有关,温
度越高、压强越小,Vm越大.25℃、101 kPa条件下,Vm
=24.5 L/mol. 返回
考点一、气体摩尔体积
气体摩尔体积
27
2.7
10
Pb
固
6.02×1023
207
11.3
H2O
液
6.02×1023
18
1(40C)
H2SO4
(纯)
液
6.02×1023
98
1.83
固体物质
18.3cm
10cm 3
6.02× 10 23 个原子 6.02× 10 23 个原子 207克
7.2cm 3
6.02× 10 个原子 56克
23
27克
单位物质的量(1mol)的气体具有的体积叫做气体摩尔体积。
计算一下1摩尔固体、液体物质的体积。填写下列表格:
物质 状态 1mol 物质所 含微粒数 1mol 物质质 量(g)
密度(200 C )
(g/cm3)
体积( 200 C ) (cm3)
Fe
固
6.02×1023
56
7.8
Al
固
6.02×1023
答案:B
7.如果a g某气体中含有该气体的分子数为b, 则c g该气体在标准状况下的体积是(各选项 中NA为阿伏加德罗常数)( ) A.22.4bc/(aNA)L B.22.4ab/(cNA)L C.22.4ac/(bNA)L D.22.4/(acNA)L
答案:A
[阿伏加德罗定律] 在相同的温度和压强下,相同体 积的任何气体都含相同数目的粒 子(相同物质的量)。
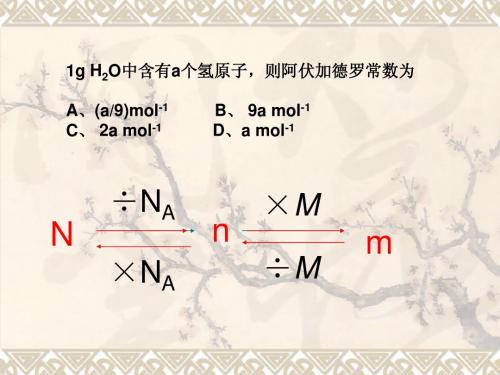
1g H2O中含有a个氢原子,则阿伏加德罗常数为 A、(a/9)mol-1 C、 2a mol-1 B、 9a mol-1 D、a mol-1
N
÷NA ×NA? 答:单位物质的量的物质所具有的质量 叫摩尔质量 (m=n×M)
化学气体的摩尔体积计算练习题及

化学气体的摩尔体积计算练习题及答案解析化学中,气体的物理性质是非常重要的研究内容之一。
其中之一就是气体的摩尔体积计算。
摩尔体积是指1摩尔气体所占据的体积。
在理想气体状态下,摩尔体积可以根据气体的物质量和气体分子的摩尔质量来计算。
下面是几道常见的摩尔体积计算练习题及答案解析。
练习题一:某种气体在标准状态下,物质量为20g,摩尔质量为40g/mol。
求该气体的摩尔体积。
解析:首先,我们需要知道在标准状态下,气体的摩尔体积为22.4 L/mol。
根据这个信息,我们可以得到以下计算公式:摩尔体积 = 标准摩尔体积 * (物质量 / 摩尔质量)代入题目中的数值,可以得到:摩尔体积 = 22.4 L/mol * (20g / 40g/mol)摩尔体积 = 11.2 L答案:该气体的摩尔体积为11.2 L。
练习题二:某气体占据了100 mL的体积,在标准状态下,该气体的摩尔质量为32g/mol。
求该气体的物质量。
解析:根据题目中给出的信息,我们可以使用以下计算公式来计算物质量:物质量 = 摩尔质量 * (摩尔体积 / 标准摩尔体积)代入题目中的数值,可以得到:物质量 = 32g/mol * (100 mL / 22.4 L/mol)物质量 = 14.29g答案:该气体的物质量为14.29g。
练习题三:某种气体在标准状态下的摩尔体积为15 L,摩尔质量为36g/mol。
求该气体的物质量。
解析:与练习题二类似,我们可以使用以下计算公式来计算物质量:物质量 = 摩尔质量 * (摩尔体积 / 标准摩尔体积)代入题目中的数值,可以得到:物质量 = 36g/mol * (15 L / 22.4 L/mol)物质量 = 24.11g答案:该气体的物质量为24.11g。
练习题四:某种气体在标准状态下,物质量为50g,摩尔质量为28g/mol。
求该气体的摩尔体积。
解析:根据题目中给出的信息,我们可以使用以下计算公式来计算摩尔体积:摩尔体积 = 标准摩尔体积 * (物质量 / 摩尔质量)代入题目中的数值,可以得到:摩尔体积 = 22.4 L/mol * (50g / 28g/mol)摩尔体积 = 40 L答案:该气体的摩尔体积为40 L。
专题1 物质的分类及计量 第2单元 第2课时 气体摩尔体积

第2课时气体摩尔体积发展目标体系构建1.知道气体摩尔体积的概念,能够利用物质的量、气体摩尔体积、标准状况下气体的体积三者之间的关系,进行简单的计算。
2.了解阿伏加德罗定律及其推论,并能够运用阿伏加德罗定律解决简单问题。
一、影响物质体积大小的因素在相同条件下,微粒数相同的不同固态物质或液态物质的体积是否相同?[提示]不相同。
因为固态物质、液态物质体积主要受微粒的数目和微粒本身的大小不同影响,而不同的固态物质、液态物质的微粒大小各不相同。
二、气体摩尔体积气体摩尔体积适用范围是气体,是否必须为纯净气体?[提示]不是。
气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状况下0.2 mol H2和0.8 mol O2的混合气体约为22.4 L,但要特别注意以混合气体中气体之间不发生化学反应为前提。
[知识延伸] 阿伏加德罗定律1.内容:同温同压下相同体积的任何气体都含有相同数目的微粒。
2.适用范围:阿伏加德罗定律及其推论仅仅适用于气体,可以是单一气体,也可以是混合气体,对固体和液体不适用。
3.“三同定一同”规律:同温、同压、同体积、同分子数中只要有“三同”则必有第“四同”。
相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?[提示]相同。
在同温、同压下,同体积的不同气体具有相同的微粒数。
1.判断正误(正确的打“√”,错误的打“×”。
)(1)在相同条件下,1 mol任何物质的体积均相同。
(×)(2)当温度和压强一定时,1 mol气体的体积均为22.4 L。
(×)(3)标准状况下,1 mol任何物质的体积都约为22.4 L。
(×)(4)当温度和压强一定时,相同物质的量的气体的体积相同。
(√)2.设N A 表示阿伏加德罗常数的值,下列叙述中正确的是( ) A .常温常压下,11.2 L CO 2所含的原子数为1.5N A B .常温常压下,48 g O 3含有的氧原子数为3N A C .标准状况下,22.4 L H 2O 所含分子数为N A D .标准状况下,22.4 L H 2所含原子数为N AB [常温常压(非标准状况)下,11.2 L CO 2的物质的量不是0.5 mol ,所含原子数不是1.5N A ;48 g O 3的物质的量为1 mol ,所含氧原子数为3N A ;标准状况下,H 2O 为液态,不能应用气体摩尔体积计算其物质的量;标准状况下,22.4 L H 2的物质的量为1 mol ,所含氢原子数为2N A 。
第二节 第二课时 气体摩尔体积

解析:同温同压下,体积比等于物质的量之比,(a/M甲)∶ (2a/M乙)=1∶2,则M甲∶M乙=1∶1,同温同压下,密度之比 等于其摩尔质量之比,因此甲和乙密度之比为1∶1,故A说法 正确;因为不知甲和乙气体分子组成,因此无法判断原子数 之比,故B说法错误;同温同体积下,压强之比等于其物质的 量之比,即等质量的甲和乙的压强之比为1∶1,故C说法正 确;摩尔质量在数值上等于其相对原子质量或相对分子质 量,故D说法正确。 答案:B
2.气体摩尔体积 (1)概念:单位物质的量的气体所占的体积,符号为Vm。 (2)单位:L·mol-1或L/mol。 (3)表达式:气体摩尔体积=气气体体所的占物的质体的积量,即Vm=Vn。 (4)标准状况下,气体摩尔体积约为 22.4 L·mol-1。
1.标准状况下,1 mol任何物质的体积都约是22.4 L吗? 提示:不是。物质的状态有气体、固体或液体,在标准 状况下,1 mol气体的体积约为22.4 L,而1 mol固体或液 体的体积均不是22.4 L。
2.当1 mol气体的体积为22.4 L时,能否说明该气体一定处于 标准状况下?
提示:不能。标准状况下,1 mol气体的体积均约为22.4 L, 但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标 准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩 气体),也能使1 mol气体的体积变为22.4 L。
5.在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。 则: (1)混合气体的平均摩尔质量是________________。 (2)CO2和CO的体积之比是________________。
解析:(1)混合气体的物质的量=11.2 L/(22.4 L·mol-1)=0.5 mol,混合气体平均摩尔质量=15 g/(0.5 mol)=30 g·mol-1; (2)设CO与CO2的物质的量分别为x mol、y mol,根据二者 质量及物质的量,则:x+y=0.5、28x+44y=15,解得:x =176、y=116,故CO2和CO的体积之比是116 mol∶176 mol= 1∶7。 答案:(1)30 g·mol-1 (2)1∶7
气体摩尔体积

2mol×32g/mol+8mol×28g/mol M= 2mol + 8mol = 28.8g/mol 既混合气体的平均相对分子质量为 28.8 。
练习1:
某水煤气中H2和CO的体积分数都是50%,求 平均相对分子质量,若H2和CO的质量分数都 是50%,求平均相对分子质量。
【练习2】 碳酸铵在150 oC完全分解生成氨、二
②液体质量差量法 例2:天平两端各放一只质量相等的烧 杯,内盛等体积等浓度的足量稀盐酸,将 物质的量都为a mol的铝和镁分别放入左 盘和右盘的烧杯中,反应完毕后,在哪一 盘的烧杯中加入多少克同种金属才能平衡。 练习. 把 5g锌放入35g未知浓度的稀硫酸 中, 反应停止后,锌有剩余,取出锌,称量溶液 质量为36.5g ,求反应前稀硫酸的质量分数。
(A)XY3 (C)X3Y (B)XY (D)X2Y3
推论2:同温、同体积,气体的压强之比=分子 数之比 P n
1 —— = — 1 T、V相同, P2 n2
【练习4】常温下,在一容积不变的密闭容器 中,氯气与氨气刚好完全反应生成氯化铵和氮 气。求反应前后容器中的压强之比。 11︰1
[练习5] 求标准状况下氢气和氧气的密度比? 解:标准状况下,1mol的气体 2g/mol (H2)= 22.4L/mol 32g/mol (O2)= 22.4L/mol D---相对密度 H2 1 M1 MH2 任何气体 D= = M D= =M 2 2 O2 O2 (同温同压下) 推论3:同温同压下,任何气体的密度之比 =摩尔质量之比(既相对分子质量之比)
5、氢气和氧气的混和气体,在 120 oC 和一 大气压下体积为 a L,点燃后发生反应,待气体 恢复至原来温度和压强时,其体积为 b L。问原 混和气体中氢气和氧气各多少升?
1.3.2气体摩尔体积

3.36 L 1.12 L -1 -1 栏 m(CH4)= × 2 g 〃 mol + × 16 g 〃 mol 目 22.4L mol 1 22.4L mol 1 链
1.1 g = 0.3 g + 0.8 g=1.1 g , 则 M = = 5. 5 g〃 mol-1, 故 B 项正确; 0.2 mol
栏 目 链 接
特别提示:阿伏加德罗定律的特征是“四同”——同温、 同压、同体积、同分子数,其中 “ 三同定一同,二同定比 例”。
栏 目 链 接
尝 试 应 用 2.(双选题)两个体积相同的容器,一个盛有 NO,另一 个盛有N2和O2,在同温、同压下,两容器内的气体一定具有 相同的( )
栏 目 链 接
L· mol-1 或m3· __________ mol-1 。
(2)常用数值 :标准状况下(0 ℃,101 kPa),气体摩尔
-1 22.4 L· mol 体积约为________________。
栏 目 链 接
V 与 n 之 间 的 关 V Vm __________________________________________ 。
(3)Vm
、
系
式
n
知 清
识 单 2.影响物质体积的因素。
栏 目 链 接
相同
知 清
识 单
3.阿伏加德罗定律。 压强 下,相同体积的任何气体含 温度 相同________ 相同________ 相同 数目的分子。 有________
栏 目 链 接
自 检
学 测 1 . 在指定的条件下,下列各物质的体积由大到小的顺 序是________________。 ①1 mol CO2气体(常温常压) ②1.5 mol O2(常温、常压) ③56 g铁块(常温常压)
高一- 气体摩尔体积

1、复述标准状况的含义,识别标准状况和通常状态2、比较微粒数目、微粒大小和微粒之间的平均距离等因素对物质三态体积大小的影响3、解释相同温度和压强下,1mol 不同气态物质体积基本相同的原因4、气体摩尔体积的有关计算,复述气体摩尔体积的定义及表示方法5、归纳相同温度和压强下,气体体积与物质的量之间的正比关系,在标准状况下应用物质的量与气体体积之间的关系进行简单计算.兴趣起航问题讨论1:决定物质体积大小的因素有哪些?固体、液体、气体的体积主要有哪些因素决定?在相同条件下,1 mol 固态、液态物质所具有的体积各不相同,而1 mol 气态物质所具有的体积却大致相同。
那为什么不同状态的物质体积的大小不一样呢?体积的大小跟哪些因素有关呢?举例:10 个乒乓球与20 个乒乓球谁占的空间大?10 个乒乓球与10 个足球谁占的空间大?乒乓球与足球都为10 个,乒乓球的球与球之间是 5 米,均匀分布,谁占的空间大?问题讨论2:1 mol 物质在特定条件下所具有的体积n 一、影响物质体积大小的因素微粒的大小(物质的本性)、微粒间距的大小(由温度与压强共同决定)、微粒的数目(物质的量的大小)。
1. 气体体积的主要影响因素:微粒间距的大小和微粒的数目。
①微粒间距取决于温度和压强。
在相同的温度、压强下,任何气体分子间的距离可以看成是相等的。
因而, 在相同的温度和压强下,分子数相同的任何气体都具有相同的体积。
②温度和压强一定时,1mol 任何气体的体积都为一个定值。
③对于气体的体积一定要标明状态(温度、压强)。
2. 固体体积的主要影响因素:微粒的大小和微粒的数目。
1mol 固态物质、液态物质含有的微粒数相同, 这就使得固态物质、液态物质的体积主要取决于粒子的大小。
由于构成不同固态、液态物质的微粒本身的大小不同,所以 1mol 固态、液态物质的体积不同。
二、气体摩尔体积1. 定义:单位物质的量的气体所占有的体积,叫做气体的摩尔体积。
气体摩尔体积

外因影响因素: 温度、压强
10
决定体积大小的因素: 粒子数目、粒子间距、粒子大小
1mol物质, 即粒子数一定
决定体积大小的因素: 粒子间距、粒子大小
气体间距很大 固体、液体的粒 子间间距很小
粒子间间距决 定体积大小
粒子大小决 定体积大小
同温同压下,间距相同, 所以体积相同
温度压强决定 间距大小
各种粒子大小不同, 所以体积不同11
22
讨论:
1、从n=N/NA,我们可以得出 微粒数与物质的量成正比。 2、从n=V/Vm,我们也可以得出: 同温同压下,气体的体积与其物质的量成正比。 同温同压下,相同体积的任何气体其物质的量相同。 3、综合两式,得到:
同温同压下,相同体积的任何气体都含有 相同数目的粒子。(阿伏加德罗定律)
23 23
固体物质或液体物质的体积
主要决定于粒子的大小,所以, 1mol不同的固体物质或液体物质
的体积不同。
12
气体物质的体积主要决定于 气体分子间的平均距离,所以,
在标准状况下,1mol气体的体积 所占的体积都约为22.4L。 标准状况: 温度0℃、压强 101 kPa的状况。
13
探究结论:
1、同温同压下,物质的量相同
20
3.标准状况下,若两种气体所占 体积不同,其原因是( D ) A.气体的性质不同 B.气体分子的大小不同 C.气体分子间的平均距离不同 D.气体的物质的量不同
21
二、气体摩尔体积的影响因素
温度、压强和分子数是影响 气体体积的决定因素,即与分子 间距离的大小和分子数有关,与 分子本身的体积大小无关。
同温同压下,相同体积的任何气体都含有 相同数目的粒子。(阿伏加德罗定律)
气体摩尔体积
3、阿佛加德罗定律之所以能够成立的本质原因是在一 定温度和压强下 D ( )
A.气体体积的大小只随分子数的多少变化
B.相同体积的气体含有相同的分子数
C.不同气体分子的大小几乎相等
D.不同气体分子间的平均距离几乎相等
4、某条件下W完全分解,其反应方程式
4W→X3(g)+2Y(g),测得生成物组成的混合气体与H2的
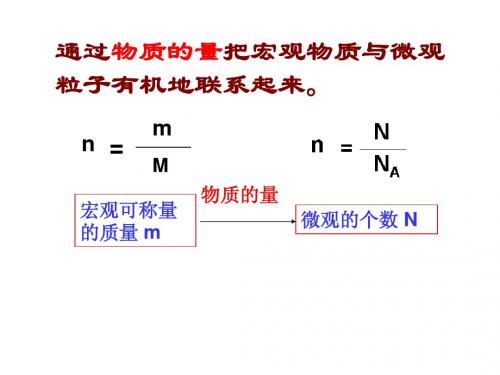
3.01×1023个
体积(V)
÷ Vm
×Vm
质量 (m)
÷M
×M
物质的量
(n)
×NA ÷NA
微粒数 (N)
宏观形式
微观形式 分子 原子 离子 电子等
阿伏伽德罗定律及其推论
讨论:
相同条件下,等物质的量气体所占的体积几乎相同?
T.P相同
d相同
n相同
V 相同
一、阿伏伽德罗定律
阿伏伽德罗定律:相同温度和压力下,相同
Mr = Mr1n1% +Mr2n2% + ............
四、气体相对分子质量的计算
(3) 相对密度法(T, P相同条件下)
M1 Mr1 = - =- D= - ρ 2 M2 Mr2
(4) 标准密度法
ρ1
(D为相对密度)
M = ρV m
M = 22.4ρ (标准状况下)
1、已知阿伏加德罗常数、物质的摩尔质量及摩尔体
V2 P1 =- - P 2 V1
...................
(Boyle定律)
四、气体相对分子质量的计算
(1) 摩尔质量法
当摩尔质量以g · mol-1为单位时,在数值上等
于该分子的相对分子质量。 (2) 物质的量分数或体积分数法 m总 = M1n1% +M2n2% + ............ M = n总
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【基础过关】
1、等质量的下列物质在常温常压下体积最大的是(B)
A、浓硫酸
B、CO2
C、铁粉
D、冰水混合物
2、同温同压下,下列关于氢气和氧气的叙述正确的是(B)
①等体积的氢气和氧气所含的分子数相等;
②氢分子间的平均距离和氧分子间的平均距离几乎是相等的;
③氢分子和氧分子大小相同;
④氢分子和氧分子本身的大小对气体体积的影响可以忽略不计。
A、①②③
B、①②④
C、①④
D、②③
3、下列有关气体体积的叙述正确的是(B)
A、一定温度和压强下,气体体积的大小由构成气体的分子大小决定
B、一定温度和压强下,气体体积的大小由气体的分子数决定
C、不同的气体,若体积不同,则他们所含的分子数也不同
D、1 mol 任何气体所占的体积都约为22.4 L
4、标准状况是气体所处的一种特殊条件,指的是(C)
A、20 ℃、101 kPa
B、20 ℃
C、0 ℃、101 kPa
D、101 kPa
5、下列说法正确的是(B)
A、1 mol 任何气体的气体摩尔体积都约为22.4 L/mol
B、0℃、101 kPa 下,相同体积的H2和O2具有相同的分子数
C、1 mol 气体的体积为22.4 L ,则该气体一定处于标准状况下
D、2 mol CO2的体积约为44.8 L
6、(双选题)下列说法正确的是(A、D)
A、标准状况下,1 mol CO2 的体积是22.4 L
B、1 mol H2所占的体积一定是22.4 L
C、标准状况下,6. 02 × 10 23 个Cu 原子所占的体积约是22.4 L
D、标准状况下,28 g N2与CO 的混合气体的体积为22.4 L
7、下列说法正确的是(D)
A、1 mol O2和1 mol H2所占的体积相同,均约为22.4 L
B、1 mol H2和1 mol H2O 所含分子数相同,在标准状况下体积约为22.4 L
C、1 mol 干冰所占体积为22.4 L
D、常温常压下,1 mol CH4的体积大于22.4 L
8、标准状况下,0.5 mol O2的体积是(C)
A、0.5 L
B、12.25 L
C、11.2 L
D、22.4 L
9、某气体的质量为9.2 g ,在标准状况下的体积为44.8 L ,则该气体的摩尔质量为(D)
A、18.4
B、18.4 g/mol
C、46
D、46 g/mol
10、下列选项中,所含分子数最少的是(C)
A、0.8 mol CO2
B、标准状况下,11.2 L NH3
C、3.6 g 水
D、6. 02 × 10 23 个氯气分子
11、(1)、标准状况下,33.6 L N2的物质的量为 1.5,其分子数为9.03 × 10 23;
(2)、0.4 mol 某气体的体积为9.8 L ,则该气体的摩尔体积为24.5 L/mol ,气体所处的条件不是(填“是”或“不是”)标准状况。
12、在一个恒容密闭容器中盛有11 g 气体X(X 的摩尔质量为44 g/mol)容器内压强为1 × 10 4 Pa 。
若在相同温度下,继续把气体X 充入容器,使容器内压强增加到5 × 10 4 Pa ,则这时容器内气体X 的分子数约为(C)
A、3.3 × 10 23
B、3.3 × 10 24
C、7.5 × 10 23
D、7.5 × 10 22
13、在一定温度和压强下,1 体积的A2气体和3 体积的B2气体化合生成2 体积的C 气体,怎C
的化学式为(A)
A、AB3
B、AB
C、A3B
D、A2B3
14、在标准状况下,有以下4 种气体:① 6.72 L 甲烷;② 3. 01 × 10 23个氯化氢分子;③ 13.6 g 硫化
氢;④0.2 mol NH3。
下列对这4 种气体的判断不正确的是(A)
A、体积:④< ① < ② < ③
B、密度:① < ④<③ < ②
C、质量:④< ① < ③ < ②
D、所含氢原子数:② < ④< ③ < ①
【能力提升】
1、【2015·南京师大附中】在标准状况下,与 12 g H 2 的体积相等的 N 2 的( B )
A 、质量为 12 g
B 、物质的量为 6 mol
C 、体积为 22.4 L
D 、物质的量为 12 mol
2、【2015·华中师大一附中】若 a g 某气体中含有的分子数为 b ,则 c g 该气体在标准状况下的体积是 (用 N A 表示阿伏伽德罗常数的值( A )
A 、L 4.22A N a b c ⋅⋅
B 、L 4.22A N b
C 、L 4.22A b N a ⋅
D 、L A
N b b c ⋅⋅ 3、【2015·杭州学军中学】同温同压下,气体 A 与氧气的质量比为 1∶2 ,体积比为 1∶4 ,则气体 A 的相对分子质量是( D )
A 、16
B 、17
C 、44
D 、64
4、【2015·浙江省镇海中学】在标准状况下,一个充满 Cl 2 的恒容密闭容器的质量为 74.6 g ,若改充氮 气其质量为 66 g ,则容器的容积为( C )
A 、11.2 L
B 、5.6 L
C 、4.48 L
D 、2.24 L
5、【2015·山东师大附中】体积相同的甲、乙两容器中,一个充满 NH 3 ,另一个充满 H 2 和 N 2 的混合 气体。
同温同压下,两个容器内的气体密度相同,则下列判断正确的是( D ) ①两容器内原子总数相同; ②两容器内分子总数相同; ③混合气体中,N (H 2)∶ N (N 2)= 3∶1 ; ④两容器内,N (H )∶ N (N )= 3∶1 ;。
A 、①②③④
B 、①②③
C 、②③④
D 、②
6、【2015·厦门一中】同温同压下,x g 甲气体和 y g 乙气体占有相同的体积。
根据阿伏伽德罗定律判 断,x ∶y 可以表示( C )
A 、甲与乙的物质的量之比
B 、等质量的甲与乙的分子个数之比
C 、甲与乙的密度之比
D 、等质量的甲与乙的压强之比
7、【2015·武汉外国语学校】已知 1 mol 不同气体在不同条件下的体积如表所示。
(1)、由上表数据分析得出的结论:① 1 mol 任何气体在标准状况下的体积都约为22.4L ;
②1 mol 不同的气体,在不同的条件下,体积不一定(填“一定”、“一定不”、“不一定”);
(2)、理论依据:相同条件下,1 mol 任何气体的体积几乎相等,原因是①气体分子数目相等
;②相同条件下,气体分子间的平均距离几乎相等。
(3)、应用:在标准状况下,求4 g O2的体积(写出计算过程)。
2.8 L (解答过程:略)
8、【2015·临川一中】某液态化合物甲由元素X 、Y 组成,该混合物能在氧气中燃烧,生成元素X 和
Y 的氧化物乙和丙。
已知甲、乙、丙均为AB2型化合物,且化合物乙和丙均能使澄清石灰水变浑浊。
一定量的化合物甲在一定量的O2中恰好完全燃烧,冷却后,在标准状况下能得到体积为672 mL 、密度为2.56 g/L 的乙、丙混合气体。
(1)、参加反应的O2的物质的量是;
(2)、化合物甲的摩尔质量是;
(3)、化合物甲的分子中X 、Y 两元素的质量比是3∶6 ,则X 、Y 两元素分别是和(填元素符号);化合物甲在氧气中燃烧的化学方程式为。
