PRADAXA(甲磺酸达比加群酯dabigatranetexilate
达比加群酯-阿哌沙班和利伐沙班

2012.03.28
石药集团欧意药业 有限公司
一种达比加群酯化 合物、制备方法及
其药物组合物
专利保护内容 达比加群酯的甲磺酸盐一水合物,其制备方法及药物组合物
法律状态
20120509 实质审查的 生效
CN102558153
2012.07.11
北京阜康仁生物科 达比加群酯的新药 包括苯磺酸盐、马来酸盐、苯甲酸盐、草酸盐、乳酸盐、富马酸盐、酒
Drug Name PRADAXA PRADAXA
Active Ingredients
Strength
DABIGATRAN ETEXILATE 75MG MESYLATE 达比加群酯甲磺酸盐
DABIGATRAN ETEXILATE 150MG MESYLATE
PRADAXA (NDA) 022512 DABIGATRAN ETEXILATE MESYLATE BOEHRINGER INGELHEIM October 19, 2010 1 New molecular entity (NME) P Priority review drug
药代动力学:
吸收:10mg的利伐沙班的绝对生物利用度较高(80-100%)。利伐沙班吸收迅速,服用后 2-4小时达到最大浓度(Cmax)。进食对利伐沙班10mg片剂的生物利用度或Cmax无明显 影响,因此服用利伐沙班10mg片剂的时间不受就餐时间的限制。利伐沙班的药代动力 学基本呈线性,直至达到约每日1次15mg剂量。更高剂量时,利伐沙班显示出溶出限
患者,以预防静脉血栓形成(VTE) • 原研厂家:德国拜耳与美国的强生共同开发 • 上市情况: 2008年在欧盟及加拿大等地上市,
2009年6月在中国正式上市,2011年在美国上市, 至今已在全球50多个国家上市。 • 化合物专利到期:2020年 • 晶型专利到期:2026年
预防房颤血栓形成新药Pradaxa被获准上市

这 一份 指 南 。 Q
前列腺癌药物
增 加 糖 尿 病 和 心脏 病 风 险
如 果血块进 入 大脑就 会 引起致 残 性 的卒 中。 ” 多房颤 患者 服 用华 法 很 林。 这种 药物 需要 频繁 的血 液检 查 以进 行监 测 , r aa就不 需要 这 么 Pa x d
麻 烦的监 测 。
尽 管如此 ,r aa Pa x 也像其他的抗凝 药一样有 包括威胁 生命的 出 d 血 在 内的副 作 用 。其 他 副 作 用 包括 胃肠 道 症状 ( 包括 消化 不 良, 胃部
卒 中发 生。
在 一 个 临床 试 验 中, 用 Paa a 患者 比服 用华 法 林 ( 豆素 , 服 r x的 d 香
Ino e ) 患者卒 中发 生 率较低 。 atvn 的 美 国 食 品 药 品 管 理 局 心 血 管 和 肾脏 产 品 部 门的 主 任 Noma r n
Sok r g 博 士在 新 闻发 布会 上说 :房 颤 患者血 栓 形成 的 几率很 高 , tc bi e d “
这些药, 而应该 和他 们 的 医生谈 谈 。
在开始使 用任何一种 此类药物治疗之前 ,患者应该告诉他们 的
医生 自己是 否患有糖 尿病 、 心脏痛 以及心脏病或卒 中发作 的病 史。 他
们也应该 汇报任 何关 于高血压 、 高胆 固醇或 者吸烟 的情况。Q
T et 、 rla 亮丙瑞 林( i u )诺 雷德 ( oa e ) sr Va r、 d Z l x 。以上 所有 药物仍 然 d
达比加群酯胶囊说明书

达比加群酯胶囊说明书达比加群酯胶囊(泰毕全)用于预防心节律异常(心房颤动)患者中风和血栓的发生。
下面是学习啦小编整理的达比加群酯胶囊说明书,欢迎阅读。
达比加群酯胶囊商品介绍通用名:达比加群酯胶囊生产厂家: Boehringer Ingelheim International GmbH.批准文号:国药准字J20130064药品规格:110mg*10粒药品价格:¥198元达比加群酯胶囊说明书【通用名称】达比加群酯胶囊【商品名称】达比加群酯胶囊(泰毕全)【英文名称】DabigatranEtexilateCapsules(Pradaxa) 【拼音全码】DaBiJiaQunZhiJiaoNang(TaiBiQuan)【主要成份】甲磺酸达比加群酯。
化学名:3-[[[2-[[[4-[[[(己氧基)羰基]氨基]亚氨甲基]苯基]氨基]甲基]-1-甲基-1H-苯并咪唑-5-基]羰基](吡啶-2-基)氨基]丙酸乙酯甲磺酸盐分子式:C34H41N7O5CH4O3S分子量:723.86【性状】达比加群酯胶囊(泰毕全)为胶囊剂,内容物为黄色颗粒。
【适应症/功能主治】用于预防心节律异常(心房颤动)患者中风和血栓的发生。
【规格型号】110mg*10s【用法用量】用水送服,餐食或餐后服用均可。
请勿打开胶囊。
成人的推荐剂量为每日口服300mg,即每次1粒150mg的胶囊,每日两次,应维持终生治疗。
【不良反应】1.在关键部位或器官发生症状性出血:眼内、颅内、椎管内或伴有骨筋膜室综合征的肌肉内出血、腹膜后出血、关节内出血或心包出血。
2.满足以下一项或一项以上标准的大出血被称为危及生命的出血:致死性出血、症状性颅内出血;伴有血红蛋白至少下降50g/L的出血;需要输血或血细胞至少达4个单位的出血,伴有低血压而需静脉使用升压药的出血;必须外科手术治疗的出血。
3.与接受华法林治疗者相比,随机接受达比加群酯每次110mg、每日两次和每次150mg.每日两次的患者,总体出血、危及生命的出血和颅内出血风险呈显著下降(p 【禁忌】1.已知对活性成分或达比加群酯胶囊(泰毕全)任一辅料过敏者。
甲磺酸达比加群酯新技术产业化研究
98 |仅用几年时间其全球销售收入就已超过15亿美元。
2013年3月,达比加群酯获NMPA 批准在中国上市,用于成年非瓣膜性心房颤动患者的卒中和全身性栓塞预防,剂型为胶囊剂,如今该药业已纳入我国乙类药品医保药品报销目录。
总而言之,达比加群酯将会以其性能优异和副作用小的特点不断拓展市场空间,市场前景非常看好。
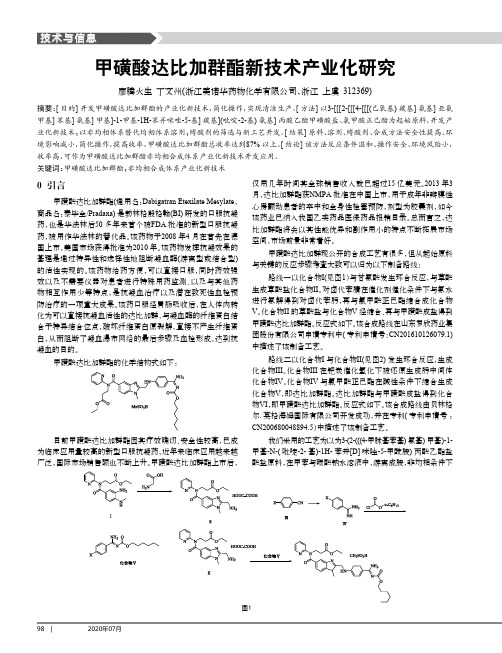
甲磺酸达比加群现公开的合成工艺有很多,但从起始原料与关键的反应步骤考查大致可以归为以下制备路线:路线一以化合物I(见图1)与甘氨酸发生环合反应,与草酸生成草酸盐化合物II 。
对卤代苯腈在催化剂催化条件下与氨水进行氨解得到对卤代苯肟,再与氯甲酸正己酯缩合成化合物V 。
化合物II 的草酸盐与化合物V 经缩合、再与甲磺酸成盐得到甲磺酸达比加群酯。
反应式如下。
该合成路线在山东罗欣药业集团股份有限公司申请专利中(专利申请号:CN201610126079.1)中描述了该制备工艺。
路线二以化合物I 与化合物II(见图2)发生环合反应,生成化合物III 。
化合物III 在钯炭催化氢化下被还原生成肟中间体化合物IV 。
化合物IV 与氯甲酸正己酯在碱性条件下缩合生成化合物V ,即达比加群酯。
达比加群酯与甲磺酸成盐得到化合物VI ,即甲磺酸达比加群酯。
反应式如下。
该合成路线由贝林格尔.英格海姆国际有限公司开发成功,并在专利(专利申请号:CN200680048894.5)中描述了该制备工艺。
我们采用的工艺为以为3-(2-(((4-甲脒基苯基)氨基)甲基)-1-甲基-N-(吡啶-2-基)-1H-苯并[D]咪唑-5-甲酰胺)丙酸乙酯盐酸盐原料,在甲苯与碳酸钠水溶液中,游离成胺,非均相条件下0 引言甲磺酸达比加群酯(通用名:Dabigatran Etexilate Mesylate ,商品名:泰毕全/Pradaxa)是勃林格殷格翰(BI)研发的口服抗凝药,也是华法林后50多年来首个被FDA 批准的新型口服抗凝药,被用作华法林的替代品。
pradaxa 特异性逆转剂Praxbind获FDA批准

pradaxa 特异性逆转剂Praxbind获FDA批准pradaxa特异性逆转剂Praxbind获FDA批准,Praxbind获批用于接受泰毕全(达比加群酯)治疗的患者,在急诊手术、介入性操作、或者出现危及生命或无法控制的出血并发症,需要逆转达比加群酯的抗凝效应时使用。
作为新型口服抗凝药物pradaxa的首个特异性逆转剂 -- Praxbind,目前已获得FDA的批准。
正如多年前pradaxa问世之时一样,Praxbind的成功获批意味着勃林格殷格翰又一次引领了抗凝治疗领域的进步。
专家预期临床实践可能会很少用到Praxbind,但是即便如此,pradaxa的首个特异性逆转剂的问世也增强了患者和医生使用pradaxa的信心。
在医疗领域pradaxa的问世解决了传统抗凝血药物华法林诸多的局限性,成为了近代医疗史上的重要一笔。
pradaxa (达比加群酯)减少缺血性卒中风险方面优于华法林的唯一口服抗凝药。
pradaxa (达比加群酯)是最前沿的新一代口服抗凝药物直接凝血酶抑制剂(DTI), 基于在全球范围内获得证实的有效性和安全性,pradaxa (达比加群酯)可为需要接受抗凝治疗的房颤患者提供相较于华法林治疗的明显的受益,来自RE-LY研究的具有突破性的结果,以及诸多其他研究数据均支持pradaxa (达比加群酯)能为房颤患者提供广泛的获益,其中就包括该药在缺血性卒中保护方面优于华法林。
近50年来全球最大型心房颤动预后临床试验-- RE-LY(长期抗凝治疗随机评估)是一项全球、随机、双盲、非劣效性Ⅲ期临床试验,共有44个国家900多个研究中心参与,入选了18113例患者。
结果显示,与华法林标准治疗方案组相比,pradaxa (达比加群酯)150mg每日2次口服治疗组的缺血性卒中发生风险和出血性卒中发生风险分别降低了25%和74%,总体出血发生率和危及生命的出血发生率也获得了显着的下降;而pradaxa (达比加群酯)110mg每日2次口服适用于特定的房颤患者人群(出血风险稍高者),该剂量方案在降低卒中发生风险方面非劣效于华法林治疗,显着减少了总体出血事件发生率和大出血事件发生率。
泰毕全

泰毕全(Pradaxa) ®泰毕全(Pradaxa)®,是最前沿的新一代口服抗凝药物直接凝血酶抑制剂(DTIs),用于预防非瓣膜性房颤患者的卒中和全身性栓塞。
泰毕全(Pradaxa)®可提供有效的、可预测的、稳定的抗凝效果,同时较少发生药物相互作用,无药物食物相互作用,无需常规进行凝血功能监测或剂量调整。
1药品信息基本信息【中文商品名】泰毕全®【英文商品名称】Pradaxa®【通用名】达比加群酯胶囊【汉语拼音】Dabijiaqunzhi Jiaonang【英文通用名称】Dabigatran Etexilate Capsules【主要成分】达比加群酯【规格】(1)110 mg (以达比加群酯计)和(2)150 mg(以达比加群酯计)【剂型】胶囊剂【单位】盒【包装】双铝泡罩包装:每盒10粒(1×10粒/板),每盒30粒(3×10粒/板)或每盒60粒(6×10粒/板)胶囊【贮藏】密封,在25ºC以下干燥保存。
【有效期】36 个月【生产企业】Boehringer Ingelheim Pharma GmbH & Co.KG【主要成分】达比加群酯化学名称:β-丙氨酸, N-[[2-[[[4-[[[(己氧基)羰基]氨基]亚氨基甲基]苯基]氨基]甲基]-1-甲基-1H-苯并咪唑-5-基]羰基]-N-2-嘧啶-,乙酯,甲磺酸盐化学分子式:C34H41N7O5·CH4O3S化学结构式:1nn/products/prescription_medicines/fczz.html【分子量】723.86 (甲磺酸盐)627.75 (游离物)【性状】本品为胶囊剂,内容物为黄色颗粒。
药品包装外观图适应症预防存在以下一个或多个危险因素的成人非瓣膜性房颤患者的卒中和全身性栓塞(SEE):∙先前曾有卒中、短暂性脑缺血发作或全身性栓塞∙左心室射血分数<40 %∙伴有症状的心力衰竭,纽约心脏病协会(NYHA)心功能分级≥ 2级∙年龄≥ 75岁∙年龄≥ 65岁,且伴有以下任一疾病:糖尿病、冠心病或高血压用法用量用水送服,餐时或餐后服用均可。
FDA 第四次批准Pradaxa

FDA 第四次批准Pradaxa基于临床3期实验数据,和肝素相比,Pradaxa安全和疗效均达标。
这个药物给成千万个有深静脉血栓形成(DVT) 和髋关节置换术后肺栓塞(PE)风险的美国人提供了新选择。
Boehringer Ingelheim制药公司今天宣布,FDA 批准Pradaxa® (dabigatran etexilate mesylate) 用于预防深静脉血栓形成(DVT) 和髋关节置换术后肺栓塞(PE)的患者。
估计在美国每年进行30万髋关节置换手术。
没有预防性抗凝治疗,原发性髋关节手术患者的DVT的发生率分布在40%-60%。
Boehringer Ingelheim医学管理部高级副总裁Sabine Luik, MD,说'在这五年内,Pradaxa是FDA的第四次批准,这个里程碑证实了公司为病人和临床医生的抗凝护理的演变。
Pradaxa拥有最长久的口服临床经验,并且我们一直致力于它的研究。
当医生和病人选择Pradaxa,可能增添一层保证,知道它唯一一个具有五年以上的使用在临床经验的口服抗凝药和特定的逆转剂'。
FDA基于两项随机、双盲、3 期临床试验结果给予批准。
具体结果如下:其一,称为RE-NOVATE™,3,494 例病人随机分成3组,接受预防性治疗两个剂量的Pradaxa (220 毫克或150 毫克) 每天一次和服用肝素40 毫克每天一次,为期28 到35 天。
第一组在手术当天给予Pradaxa 110 毫克和220 毫克每日之后;第二组在手术当天给予75 毫克和每日150 毫克剂量每日。
其二,称为RE-NOVATE II™,2,055 例患者随机分为预防性治疗用Pradaxa 220 毫克每日一次或用肝素40 毫克每日一次使用28 到35 天。
患者使用Pradaxa,手术当天给予药110 毫克和之后220 毫克每日。
第一个试验结果表明,服用Pradaxa 220 毫克的患者复合静脉血栓栓塞总数较低(VTE,包括DVT和PE) 和全因死亡率(6.0%) 比服用肝素40毫克全因死亡率(6.7%)低。
甲磺酸达比加群酯说明书译文汇总

处方信息摘要本摘要不包括所有使用所需的全部信息PRADAXA的安全性和有效性请参阅完整处方信息PRADAXA®(甲磺酸达比加群酯)胶囊为口服使用,美国首次批准日期:2010最近的重大变化黑框警告4/2013剂量和用法(2.3) 12/2013禁忌症(4) 12/2012警告和注意事项(5.1) 4/2013警告和注意事项(5.2) 11/2012警告和注意事项(5.3) 12/2012适应症和用途PRADAXA是一种直接凝血酶抑制剂适用于在有非瓣膜性房颤患者中减低卒中和全身性栓塞风险(1)用法与用量• CrCl >30 mL/min的患者:150 mg口服,每天2次 (2.1)• CrCl 15-30 mL/min的患者:75 mg口服,每天2次 (2.1)•治疗期间按临床指征评估肾功能并相应调整治疗(2.2)•指导患者不要咀嚼、弄破、或打开胶囊 (2.3)•查阅有关转换至其他口服或非口服抗凝药或从其他口服或非口服抗凝药转换过来的推荐 (2.4,2.5)•根据需要在侵入性或外科手术前可暂时停止PRADAXA,然后再及时开始(2.6)剂型和规格胶囊:75 mg 和150 mg (3)禁忌症•活动性病理性出血(4)•对PRADAXA严重超敏性反应史(4)•机械性人工心脏瓣膜(4)警告和注意事项•出血风险:PRADAXA可能引起严重的、有时是致命性出血。
及时评价失血的体征和症状。
(5.2)•生物人工心脏瓣膜:建议不要用PRADAXA(5.3)•P-gp 诱导剂和抑制剂:影响达比加群暴露(5.4)不良反应大多数普通的不良反应(>15%)是胃炎样症状和出现(6.1)报告可疑不良反应,联系Boehringer Ingelheim Pharmaceuticals, Inc. at (800) 542- 6257 or (800) 459-9906 TTY or FDA at 1-800-FDA-1088 or /medwatch.药物相互作用•P-gp诱导剂利福平:避免与PRADAXA共同给药(5.4)•P-gp抑制剂决奈达隆和全身性酮康唑在中度肾功能不全(CrCl 30-50 mL/min)患者中:考虑减低PRADAXA剂量至75 mg每天2次(7)•P-gp抑制剂在严重肾功能不全(CrCl <30 mL/min)患者中:建议不使用PRADAXA (7)特殊人群使用老年人使用:随年龄出血风险增加 (8.5)见17,患者咨询信息和用药指南完整处方信息:目录*警告:停止PRADAXA的患者无充足连续抗凝增加中风的危险1. 适应症和用途2. 用法与用量2.1推荐剂量2.2给药调整2.3对患者指导2.4从华法林转换或转换至华法林2.5从非口服抗凝药转换或转换至非口服抗凝药2.6手术和干预3. 剂型和规格4. 禁忌症5. 警告和注意事项5.1中断PRADAXA增加中风风险5.2出血风险5.3心脏瓣膜修复患者的血栓栓塞和出血事件5.4 P-gp诱导剂和抑制剂对达比加群暴露的影响6. 不良反应6.1临床试验经验6.2上市经验7. 药物相互作用8. 特殊人群使用8.1妊娠8.2生产和分娩8.3哺乳母亲8.4儿童使用8.5老年人使用8.6肾功能不全10. 药物过量11. 一般描述12. 临床药理学12.1作用机制12.2药效学12.3药代动力学13. 非临床毒理学13.1致癌性,致突变性和生育损害14. 临床研究16如何供应/贮存和处置17. 患者咨询资料17.1对患者指导17.2出血17.3胃肠道不良反应17.4侵入性或外科手术17.5伴随用药17.6人工心脏瓣膜*从完整的处方信息中删除部分或子部分未列出完整处方信息1. 适应症和用途PRADAXA适用于降低非瓣膜性房颤患者卒中和全身性栓塞的风险。
达比加群酯作用原理

达比加群酯作用原理达比加群酯(Dabigatran etexilate)是一种口服抗凝血药物,它的作用原理是通过特定的机制来抑制血液凝结过程,从而预防和治疗血栓相关疾病。
下面将详细介绍达比加群酯的作用原理。
达比加群酯属于一种直接抗凝药物,它与传统的华法林等间接抗凝药物不同。
传统的间接抗凝药物作用于凝血系统中的维生素K依赖性凝血因子,通过抑制这些因子的合成来达到抗凝作用。
而达比加群酯则直接抑制凝血系统中的一种凝血酶,称为凝血酶IIa。
凝血酶是凝血过程中的关键酶,它能将凝血因子II(即凝血酶原)转化为凝血酶,从而引发血液凝结。
而达比加群酯能够与凝血酶IIa 结合,并通过竞争性抑制凝血酶原的结合,从而阻断凝血酶的形成,进而抑制血液凝结过程。
在体内,达比加群酯通过口服后经过肠道吸收,进入血液循环。
一旦达到疗效浓度,它开始发挥抗凝作用。
达比加群酯与凝血酶IIa结合后,通过与其多个位点的非共价相互作用,形成一种稳定的复合物。
这种复合物能够有效地阻断凝血酶IIa对凝血因子的作用,从而抑制凝血酶的活性。
与传统的华法林等间接抗凝药物相比,达比加群酯具有更为明确的抗凝机制。
传统的间接抗凝药物需要定期监测国际标准化比值(INR),并根据结果调整剂量,以确保抗凝效果在安全范围内。
而达比加群酯使用更为简便,不需要定期监测INR,且剂量调整较为简单,因此在临床上更受欢迎。
需要注意的是,达比加群酯的作用是可逆的,即停药后凝血功能会逐渐恢复正常。
因此,在需要持续抗凝治疗的患者中,需定期服用达比加群酯以保持抗凝效果。
同时,达比加群酯也存在一些副作用和注意事项,如出血风险增加、与其他药物的相互作用等,患者在使用时需要谨慎。
总结起来,达比加群酯作为一种直接抗凝药物,通过抑制凝血酶IIa 的活性来预防和治疗血栓相关疾病。
它的作用机制简单明确,使用方便,因此在临床上得到广泛应用。
但患者在使用时需要遵循医生的指导,注意剂量和用药时间,以确保安全有效地进行抗凝治疗。
达比加群酯胶囊说明书

达比加群酯胶囊说明书达比加群酯胶囊(泰毕全)用于预防心节律异常(心房颤动)患者中风和血栓的发生。
下面是学习啦小编整理的达比加群酯胶囊说明书,欢迎阅读。
达比加群酯胶囊商品介绍通用名:达比加群酯胶囊生产厂家: Boehringer Ingelheim International GmbH.批准文号:国药准字J20130064药品规格:110mg*10粒药品价格:¥198元达比加群酯胶囊说明书【通用名称】达比加群酯胶囊【商品名称】达比加群酯胶囊(泰毕全)【英文名称】DabigatranEtexilateCapsules(Pradaxa) 【拼音全码】DaBiJiaQunZhiJiaoNang(TaiBiQuan)【主要成份】甲磺酸达比加群酯。
化学名:3-[[[2-[[[4-[[[(己氧基)羰基]氨基]亚氨甲基]苯基]氨基]甲基]-1-甲基-1H-苯并咪唑-5-基]羰基](吡啶-2-基)氨基]丙酸乙酯甲磺酸盐分子式:C34H41N7O5CH4O3S分子量:723.86【性状】达比加群酯胶囊(泰毕全)为胶囊剂,内容物为黄色颗粒。
【适应症/功能主治】用于预防心节律异常(心房颤动)患者中风和血栓的发生。
【规格型号】110mg*10s【用法用量】用水送服,餐食或餐后服用均可。
请勿打开胶囊。
成人的推荐剂量为每日口服300mg,即每次1粒150mg的胶囊,每日两次,应维持终生治疗。
【不良反应】1.在关键部位或器官发生症状性出血:眼内、颅内、椎管内或伴有骨筋膜室综合征的肌肉内出血、腹膜后出血、关节内出血或心包出血。
2.满足以下一项或一项以上标准的大出血被称为危及生命的出血:致死性出血、症状性颅内出血;伴有血红蛋白至少下降50g/L的出血;需要输血或血细胞至少达4个单位的出血,伴有低血压而需静脉使用升压药的出血;必须外科手术治疗的出血。
3.与接受华法林治疗者相比,随机接受达比加群酯每次110mg、每日两次和每次150mg.每日两次的患者,总体出血、危及生命的出血和颅内出血风险呈显著下降(p 【禁忌】1.已知对活性成分或达比加群酯胶囊(泰毕全)任一辅料过敏者。
济南众腾医药甲磺酸达比加群酯项目转让

甲磺酸达比加群酯项目介绍
一、基本信息
通用名:甲磺酸达比加群酯
英文名:Dabigatran etexilate mesylate
商品名:Pradxax (泰毕全)
申报类型:3+6
剂型及规格:胶囊,75mg 、110mg 、150mg
结构式: N N OCH 2CH 3O O N N HN CH 3NH NH O O .CH 3SO 3H
CAS:872728-81-9
分子式:C 34H 41N 7O 5·CH 4O 3S
分子量:723.84 甲磺酸达比加群酯是一种白色至类白色结晶性粉末。
一个在纯水中饱和溶液溶解度为1.8 mg/mL 。
它易溶于甲醇,微溶于乙醇,略微溶于异丙醇。
达比加群酯Pradaxa (dabigatran)由德国勃林格殷格翰公司开发,于2008年4月在德国和英国上市,2010年在美国上市,2011年在日本上市,用于伴有心律异常(心房纤维性颤动)的患者以预防中风和血液凝结。
为近期成功开发的具有多种特点的新型抗凝血药物,这是继华法林之后50年来上市的首个新类别口服抗凝血药物,本品的上市,是抗凝血治疗领域和潜在致死性血栓预防领域的一项重大进展,具有里程碑意义。
国内进口制剂已上市,只有一家药企在申报(南京华威医药)。
二.项目进度:
已完成原料中试放大及制剂处方摸索,正在进行临床前的其他研究,待报临床。
三.合作方式:
转让原料及制剂全套申报资料,具体合作方式可详谈。
Pradaxa 达比加群 被推荐可部分替代华法林

达比加群酯是最前沿的新一代口服抗凝药物直接凝血酶抑制剂(DTIs),针对急性
和慢性血栓栓塞性疾病的预防及治疗这一急需满足的临床需求。
直接凝血酶抑制剂通过特异性阻滞凝血酶(游离型和结合型)活性而发挥强大抗凝疗效,凝血酶是血栓形成过程中的具有核心作用的酶。 与作用于不同凝血因子的维生素K拮抗剂不同,达比加群酯可提供有效的、可预测的、稳定的抗凝效果,同时较少发生药物相互作用,无药物食物相互作用,无需常规进行凝血功能监测或剂量调整。
我国房颤抗凝治疗严重不足
上海交通大学医学院附属瑞金医院终身教授、主任医师、博士研究生导师戚文航教授介绍说,目前临床应用预防房颤脑卒中的抗拴药物主要为阿司匹林和华法林。然而,由于现有药物存在诸多局限性,许多房颤患者并未接受有效的血栓预防治疗。
据介绍,传统“金标准”华法林的局限性包括治疗窗较窄、难以预测的剂量效应、诸多药物相互作用和药物食物相互作用、起效和失效较慢等,而且使用华法林需进行常规监测和剂量调整才能达到应有的抗凝疗效;而阿司匹林虽然使用方便,但在高危患者卒中预防方面的保护作用并不充分。
继华法林之后,50多年来首个被批准上市的新一代抗凝药达比加群酯Pradaxa(泰毕全)已在全球81个国家,包括中国获批上市,使用患者达到130万人,是现今全球临床应用经验最丰富的新型口服抗凝药。
新型抗凝药物帮助预防卒中 达比加群(Pradaxa,商品名:泰毕全)
Mar 112013 2013/03/11 Posted by China News 心脏病学, 药理学
心房颤动是一种“心血管流行病”,可使卒中发生率至少增高4—5倍,并导致多种不良后果。日前,新型口服抗凝药达比加群酯(Pradaxa,商品名:泰毕全)获国家食品药品监督管理局颁发的进口药品注册证,被批准用于成年非瓣膜性心房颤动患者的卒中和全身性栓塞预防。
达比加群酯不良反应的文献调查分析

达比加群酯不良反应的文献调查分析边原; 于楠; 郝梦琳; 周杨林【期刊名称】《《实用药物与临床》》【年(卷),期】2019(022)008【总页数】5页(P871-875)【关键词】达比加群酯; 药物不良反应; 文献分析【作者】边原; 于楠; 郝梦琳; 周杨林【作者单位】电子科技大学医学院四川成都610054; 四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部个体化药物治疗四川省重点实验室四川成都610072【正文语种】中文0 引言达比加群酯(Dabigatran etexilate,商品名:Pradaxa)是一种新型的直接凝血酶抑制剂,其在体内转化为具有直接抗凝血活性的达比加群而发挥抗凝活性。
达比加群酯于2008年4月、2010年10月分别在欧洲和美国上市,是美国FDA批准上市的第1个新型口服抗凝药物。
2013年在中国上市,现已被临床广泛用于预防和减少非瓣膜性房颤患者的卒中和全身性静脉血栓[1]。
与传统抗凝药物华法林相比,达比加群酯同为口服用药且起效快,患者依从性更好。
此外,其还具有强效、无需频繁检测凝血功能、药物相互作用较少等优点[2]。
然而,由于达比加群酯国内上市的时间较短,其药物不良反应(ADR)数据参考主要来自RE-LY的临床试验[3]。
随着临床使用达比加群酯的不断深入,其不良反应报道亦逐渐增多。
本文通过检索国内外数据库,对达比加群酯的ADR报道进行回顾性分析,探讨其一般发生规律及特点,为更合理的临床用药提供参考。
1 资料与方法1.1 资料来源以达比加群酯(Dabigatran etexilate)、药物不良反应(Adverse drug reactions)等为关键词,检索中文数据库-中国学术期刊全文数据库(CNKI)、万方数据库、维普中文科技期刊数据库(VIP),外文数据库-PubMed、Web of Science、Science Direct、Scifinder等,收集关于达比加群酯致不良反应的案例报道,并逐篇查阅原文。
PRADAXA(甲磺酸达比加群酯dabigatranetexilate

PRADAXA®(甲磺酸达比加群酯dabigatran etexilate mesylate)使用说明书2012年12月版处方资料重点这些重点不包括安全和有效使用PRADAXA所需所有资料。
请参阅下文为PRADAXA的完整处方资料PRADAXA® (甲磺酸达比加群酯[dabigatran etexilate mesylate])胶囊为口服使用美国初始批准:2010最近重大变化(红色为修改部分)剂量和给药方法(2.2,2.4,2.6) 1/2012禁忌证(4) 12/2012警告和注意事项(5.3,5.4) 1/2012警告和注意事项(5.1) 11/2012警告和注意事项(5.2) 12/2012适应证和用途PRADAXA是一种直接凝血酶抑制剂适用于在有非瓣膜性房颤患者中减低卒中和全身性栓塞风险(1)剂量和给药方法(1)对患者有CrCl >30 mL/min:150 mg口服,每天2次 (2.1)(2)对患者有CrCl 15-30 mL/min:75 mg口服,每天2次 (2.1)(3)治疗期间临床上指示时评估肾功能和从而调整治疗(2.2)(4)指导患者不要咀嚼,弄破,或打开胶囊 (2.3)(5)对转换至或来其他口服或非肠道抗凝建议的评述 (2.4,2.5)(6)侵入性或手术前当可能暂时终止PRADAXA,然后及时再开始(2.6)剂型和规格胶囊:75 mg和150 mg (3)禁忌证(1)活动性病理性出血 (4)(2)对PRADAXA严重超敏性反应史(4)(3)机械性人工心脏瓣膜 (4)警告和注意事项(1)出血风险:PRADAXA可引起严重和,有时,致命性出血。
及时评价失血的体征和症状。
(5.1)(2)生物人工心脏瓣膜:建议不要用PRADAXA(5.2)(3)暂时终止:避免治疗失误缩小卒中风险(5.3)(4)P-gp 诱导剂和抑制剂:对达比加群暴露影响 (5.4)不良反应最常见不良反应(>15%)是胃炎样症状和出血(6.1)为报告怀疑不良反应,联系Boehringer Ingelheim Pharmaceuticals,Inc. 电话(800) 542-6257或(800) 459-9906 TTY或FDA电话1-800-FDA-1088或/medwatch.药物相互作用(1)P-gp诱导剂利福平[利福平]:避免与PRADAXA共同给药 (5.4)(2)P-gp抑制剂决奈达隆[dronedarone]和全身性酮康唑[ketoconazole]在患者有中度肾受损(CrCl 30-50 mL/min):考虑减低PRADAXA剂量至75 mg每天2次 (7)(3)P-gp抑制剂在有严重肾受损患者(CrCl <30 mL/min):建议不使用PRADAXA (7)特殊人群中使用老年人使用:随年龄出血风险增加 (8.5)完整处方资料1 适应证和用途PRADAXA适用于在有非瓣膜性房颤患者中减低卒中和全身性栓塞的风险。
FDA批准Praxbind,为抗凝剂Pradaxa第一个逆转剂_tangzhongming

FDA批准Praxbind,为抗凝剂Pradaxa第一个逆转剂_tangzhongmingFDA批准Praxbind,为抗凝剂Pradaxa第一个逆转剂Praxbind批准为特异性紧急情况2015年10月16日美国食品和药品监管局(FDA)授权加快批准Praxbind (idarucizumab)为正在用抗凝剂Pradaxa(达比加群[dabigatran])患者使用在紧急情况期间当需要逆转Pradaxa的血液稀释效应[blood-thinning effects]时。
FDA药品评价和研究中心血液学和肿瘤产品室主任Richard Pazdur,M.D.说:“Pradaxa的抗凝剂作用对有些患者是重要和挽救生命,但其中也有情况逆转药物作用是医疗上必要的,” “今天的批准为医学社会提供一个重要工具为在紧急或危及生命情况当出血不能控制时处理用Pradaxa。
”2010年FDA批准Pradaxa在有心房颤动患者中预防卒中和全身血凝,以及为深静脉血栓形成和肺栓塞治疗和预防。
Praxbind是特异性地为Pradaxa批准的第一个逆转剂和通过结合至药物中和其效应作用。
Praxbind溶液是为静脉注射。
在三项试验涉及共计283例健康志愿者用Pradaxa研究Praxbind 的安全性和有效性(即,不需要抗凝剂人们)。
在给予Praxbind健康志愿者,参加者的血液Pradaxat 量立即减低(测定非结合达比加群血浆浓度)持续共至少24小时阶段。
在这项研究中,来自使用Praxbind最常见副作用是头痛。
另外试验包括123例用Pradaxa患者由于不能控制出血或因为需要紧急手术接受Praxbind。
在这项正在进行试验中,根据实验室测试,在接受Praxbind四小时内89%患者中Pradaxa的抗凝剂效应被晚期逆转。
在这项患者试验,最常见副作用是低钾,混乱,便秘,发热和肺炎。
Pradaxa逆转效应暴露患者来自所患疾病血栓和卒中的风险(例如心房颤动)。
欧洲EMEA推荐批准新的口服抗凝血药物Pradaxa(dabigatran etexilate)

欧洲EMEA推荐批准新的口服抗凝血药物Pradaxa
(dabigatran etexilate)
佚名
【期刊名称】《中国新药杂志》
【年(卷),期】2008(17)4
【摘要】近日,欧洲药品评价局( European Medicines Evaluation Agency, EMEA)下属的欧洲人用医疗产品委员会(The Committee for Medicinal Products in Human Use, CHMP)发布了一份积极的意见,推荐批准勃林格殷格翰公司的口服抗凝血药物 Pradaxa( dabigatran etexilate)上市,
【总页数】1页(P325-325)
【关键词】欧洲药品评价局;抗凝血药物;EMEA;口服;European;Human;医疗产品;委员会
【正文语种】中文
【中图分类】R979.5;R973.2
【相关文献】
1.新型口服抗凝药dabigatran etexilate [J], 黄赛杰;徐佳骏
2.FDA批准抗凝血新药Pradaxa [J],
3.欧盟批准口服抗凝血药dabigatran etexilate [J],
4.FDA批准抗凝血新药Pradaxa [J], 张翼
5.欧盟批准勃林格殷格翰公司新型口服抗凝血药dabigatran etexilate [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
美FDA批准达比加曲酯预防非瓣膜性心房纤维性颤动患者中风

美FDA批准达比加曲酯预防非瓣膜性心房纤维性颤动患者中
风
马培奇
【期刊名称】《上海医药》
【年(卷),期】2011(32)3
【摘要】2010年10月,美国FDA批准了Boehringer Ingelheim公司开发的达比加曲酯(dabigatran etexilate/Pradaxa),用于降低非瓣膜性心房纤维性颤动患者的中风和全身血栓栓塞风险。
达比加曲酯属口服直接凝血酶抑制剂,是在美国50多年来获得批准的第一个新口服抗血凝药物。
【总页数】1页(P147-147)
【关键词】心房纤维性颤动;FDA批准;非瓣膜性;中风;患者;直接凝血酶抑制剂;预防;血栓栓塞
【作者】马培奇
【作者单位】
【正文语种】中文
【中图分类】R541.75
【相关文献】
1.达比加群酯用于非瓣膜病心房颤动患者卒中预防的临床应用建议 [J], 中华心血管病杂志编辑委员会血栓栓塞防治循证工作组
2.利伐沙班、达比加群酯和华法林用于高龄非瓣膜性心房颤动患者抗凝治疗的效果与安全性 [J], 穆山丹
3.利伐沙班与达比加群酯预防非瓣膜性心房颤动患者发生缺血性脑卒中的效果 [J], 董文;叶小彬
4.利伐沙班和达比加群酯及华法林在非瓣膜性心房颤动患者抗凝治疗中的安全性分析 [J], 谢瑞
5.利伐沙班、达比加群酯在高龄非瓣膜性心房颤动患者抗凝治疗中有效性与安全性研究 [J], 梁春波;马瑾华;刘岩;李红帅;刘艳霞
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PRADAXA®(甲磺酸达比加群酯dabigatran etexilate mesylate)使用说明书2012年12月版处方资料重点这些重点不包括安全和有效使用PRADAXA所需所有资料。
请参阅下文为PRADAXA的完整处方资料PRADAXA® (甲磺酸达比加群酯[dabigatran etexilate mesylate])胶囊为口服使用美国初始批准:2010最近重大变化(红色为修改部分)剂量和给药方法(2.2,2.4,2.6) 1/2012禁忌证(4) 12/2012警告和注意事项(5.3,5.4) 1/2012警告和注意事项(5.1) 11/2012警告和注意事项(5.2) 12/2012适应证和用途PRADAXA是一种直接凝血酶抑制剂适用于在有非瓣膜性房颤患者中减低卒中和全身性栓塞风险(1)剂量和给药方法(1)对患者有CrCl >30 mL/min:150 mg口服,每天2次 (2.1)(2)对患者有CrCl 15-30 mL/min:75 mg口服,每天2次 (2.1)(3)治疗期间临床上指示时评估肾功能和从而调整治疗(2.2)(4)指导患者不要咀嚼,弄破,或打开胶囊 (2.3)(5)对转换至或来其他口服或非肠道抗凝建议的评述 (2.4,2.5)(6)侵入性或手术前当可能暂时终止PRADAXA,然后及时再开始(2.6)剂型和规格胶囊:75 mg和150 mg (3)禁忌证(1)活动性病理性出血 (4)(2)对PRADAXA严重超敏性反应史(4)(3)机械性人工心脏瓣膜 (4)警告和注意事项(1)出血风险:PRADAXA可引起严重和,有时,致命性出血。
及时评价失血的体征和症状。
(5.1)(2)生物人工心脏瓣膜:建议不要用PRADAXA(5.2)(3)暂时终止:避免治疗失误缩小卒中风险(5.3)(4)P-gp 诱导剂和抑制剂:对达比加群暴露影响 (5.4)不良反应最常见不良反应(>15%)是胃炎样症状和出血(6.1)为报告怀疑不良反应,联系Boehringer Ingelheim Pharmaceuticals,Inc. 电话(800) 542-6257或(800) 459-9906 TTY或FDA电话1-800-FDA-1088或/medwatch.药物相互作用(1)P-gp诱导剂利福平[利福平]:避免与PRADAXA共同给药 (5.4)(2)P-gp抑制剂决奈达隆[dronedarone]和全身性酮康唑[ketoconazole]在患者有中度肾受损(CrCl 30-50 mL/min):考虑减低PRADAXA剂量至75 mg每天2次 (7)(3)P-gp抑制剂在有严重肾受损患者(CrCl <30 mL/min):建议不使用PRADAXA (7)特殊人群中使用老年人使用:随年龄出血风险增加 (8.5)完整处方资料1 适应证和用途PRADAXA适用于在有非瓣膜性房颤患者中减低卒中和全身性栓塞的风险。
2 剂量和给药方法2.1 推荐剂量对有肌酐清除率(CrCl) >30 mL/min患者,PRADAXA的推荐剂量是150 mg有或无食物口服,每天2次。
对有严重肾受损患者(CrCl 15-30 mL/min),PRADAXA的推荐剂量为75 mg每天2次 [见在特殊人群中使用(8.6)和临床药理学(12.3)]。
对有CrCl <15 mL/min或透析患者不能提供给药建议。
2.2 给药调整开始用PRADAXA治疗前评估肾功能。
当临床上指示定期评估肾功能(即,在在临床情况可能伴肾功能下降更频)和从而调整治疗。
发生急性肾衰而用PRADAXA患者终止PRADAXA和考虑另外抗凝治疗。
在有中度肾受损(CrCl 30-50 mL/min)患者中,同时使用P-gp抑制剂决奈达隆或全身性酮康唑可预计产生严重肾受损观察到达比加群暴露相似。
考虑减低PRADAXA剂量至75 mg每天2次 [见药物相互作用(7)和临床药理学12.3)]。
一般说来,不需要评估抗凝作用程度。
当需要时,使用一种活化部分凝血活酶时间(aPTT)或蝰蛇毒凝血时间(ECT),而不是国际标准化比率 (international normalized ratio, INR),评估患者对PRADAXA抗凝活性[见警告和注意事项(5.1)和临床药理学(12.2)]。
2.3 对患者指导指导患者整吞胶囊。
胶囊的破裂,咀嚼,或内容变空可能导致增加暴露[见临床药理学(12.3)]。
如在计划时间1剂PRADAXA没有服用,应尽可能在相同天立即服用;如果下次计划剂量前至少6小时不能服用应跳过丢失剂量。
为补上丢失剂量PRADAXA剂量不应加倍。
2.4 从华法林转化或转化至华法林[Warfarin]当患者从华法林治疗转化至PRADAXA,当INR低于2.0时终止华法林和开始PRADAXA。
当从PRADAXA转化至华法林,根据肌酐清除率如下调整华法林开始时间:●对CrCl ≥50 mL/min,终止PRADAXA前3天开始华法林。
●对CrCl 30-50 mL/min,终止2天PRADAXA前开始华法林。
●对CrCl 15-30 mL/min,终止PRADAXA前1天开始华法林。
●对CrCl <15 mL/min,不能做建议。
因为PRADAXA可增加INR,只有PRADAXA 已停止至少2天后INR将更佳反映华法林的效应[见临床药理学(12.2)].2.5 转化自或至非肠道抗凝对当前接受一种非肠道抗凝患者,下一次在非肠道药物已给药时间前0至2小时开始PRADAXA或在连续给予非肠道药物终止的时间(如,静脉未分离肝素)。
对当前服用PRADAXA患者,等待12小时(CrCl ≥30 mL/min)或24小时(CrCl <30 mL/min)末次剂量PRADAXA后开始用非肠道抗凝治疗前[见临床药理学(12.3)]。
2.6 手术和干预如果可能,因为增加出血的风险,侵入性或手术前终止PRADAXA 1至2天(CrCl ≥50 mL/min)或3至5天(CrCl <50 mL/min)。
对患者进行重大手术,脊髓穿刺,或放置脊髓或硬膜外导管或口考虑较长时间,可能需要患者完全止血[见在特殊人群中使用(8.6)和临床药理学(12.3)]。
如果手术不能延迟,有增加出血的风险[见警告和注意事项(5.1)]。
应权衡出血风险和干预的紧迫性[见警告和注意事项(5.3)]。
3 剂型和规格150 mg胶囊有淡蓝色的不透明帽印有黑色的Boehringer Ingelheim公司符号和奶油色不透明体印有黑色“R150”。
75 mg胶囊有奶油色的不透明帽有黑色的Boehringer Ingelheim公司符号和奶油色不透明体印有黑色的“R7”。
4 禁忌证有以下患者禁忌PRADAXA:●活动性病理性出血[见警告和注意事项(5.1)和不良反应(6.1)].●对PRADAXA严重超敏性反应史(如,过敏反应或过敏性休克) [见不良反应(6.1)].●机械性人工心脏瓣膜 [见警告和注意事项(5.2)]5 警告和注意事项5.1 出血风险PRADAXA增加出血风险和可能致明显和,有时,致命性出血. 及时评价任何失血体征或症状(如,血红蛋白和/或血红细胞比容下降或低血压)。
有活动性病理性出血患者终止PRADAXA [见剂量和给药方法(2.2)]。
出血的风险因子包括同时使用增加出血风险其他药物(如,抗血小板药物,肝素,溶纤维蛋白治疗,和慢性使用非甾体抗炎药NSAIDs)。
有肾受损患者中PRADAXA 的抗凝活性和半衰琪增加[见临床药理学(12.2)]。
不能得到对达比加群特异性逆转剂。
血液透析可能去除达比加群;但是支持使用血液透析作为治疗出血临床经验有限[见药物过量(10)]。
在临床试验中可能考虑使用但未曾评价激活的凝血酶原复合物浓缩剂(aPCCs,如,FEIBA),或重组凝血因子VIIa,或凝血因子II,IX或X浓缩物。
硫酸鱼精蛋白和维生素K 预计不会影响达比加群的抗凝活性。
存在血小板减少情况中考虑给予血小板浓缩物或曾使用长效抗血小板药物。
5.2 有人工心脏瓣膜患者中血栓栓塞和出血事件在 RE-ALIGN试验中在有双叶[bileaflet]机械性人工心脏瓣膜患者评价PRADAXA的安全性和疗效,其中有双叶机械性人工心脏瓣膜患者(最近植入或纳入前3个月以上植入)被随机化至剂量调整华法林或150,220,或300 mg PRADAXA1天2次。
RE-ALIGN在PRADAXA治疗组当与华法林治疗组比较由于发生显著更多血栓栓塞事件(瓣膜血栓形成,卒中,短暂性脑缺血发作,和心肌梗死)和过量重大出血(主要地术后心包积液需要干预的血流动力学损害)提早结束。
双叶机械性人工心脏瓣膜移植的术后3天内开始用 PRADAXA患者以及纳入植入瓣膜前3个月患者均见到这些出血和血栓栓塞事件。
因此,有机械性人工心脏瓣膜患者禁忌使用PRADAXA [见禁忌证(4)]。
尚未研究使用PRADAXA为预防血栓栓塞事件在有房颤患者在其他形式瓣膜心脏壁情况中,包括存在生物人工心脏瓣膜而不建议使用。
5.3 暂时终止PRADAXA终止抗凝,包括PRADAXA,对活动性出血,选择性外科手术,或侵入性操作,使患者处在卒中风险增加。
缩小治疗失误。
5.4 P-gp诱导剂和抑制剂对达比加群暴露的影响PRADAXA与P-gp诱导剂(如利福平)的同时使用减低对达比加群暴露和一般说来应避免[见临床药理学(12.3)]。
P-gp抑制作用和受损的肾功能是导致达比加群暴露增加主要独立因子[见临床药理学(12.3)]。
有肾受损患者中同时使用P-gp抑制剂与任何单独因子所见比较预计产生达比加群暴露增加。
有中度肾受损患者中(CrCl 30-50 mL/min),当决奈达隆或全身性酮康唑s与PRADAXA共同给药时,考虑减低PRADAXA剂量至75 mg每天2次。
有严重肾受损(CrCl 15-30 mL/min)患者避免使用PRADAXA和P-gp 抑制剂同时使用[见药物相互作用(7)和在特殊人群中使用(8.6)]。
6 不良反应6.1 临床试验经验因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
RE-LY(随机化评价长期抗凝治疗)研究提供使用两种剂量PRADAXA和华法林的安全性资料[见临床研究(14)]。
表1描述患者数及其暴露。
展示110 mg给药组资料有限因为这个剂量未被批准。
在RE-LY中药物终止对PRADAXA 150 mg导致治疗终止的不良反应率为21%和对华法林16%。
最频繁不良反应导致终止PRADAXA是出血和胃肠道事件(即,消化不良,恶心,上腹痛,胃肠道出血,和腹泻)。
