01.对溴乙酰苯胺的绿色合成
【设计性实验报告】由苯胺为起始原料合成对溴苯胺

由苯胺为起始原料合成对溴苯胺摘要:对溴苯胺是非常重要的有机化工原料,其一般合成路线是由苯为原料,经要经历硝化、还原、保护、溴代、去保护等多个步骤合成最终产物。
而本实验是从这个合成路线的中间步骤开始,以中间体苯胺为原料进行合成保护、溴代、去保护三个步骤进行合成对溴苯胺。
关键词:对溴苯胺;合成;苯胺Synthesized from aniline as starting materials Bromoaniline Abstract:Bromoaniline is very important organic chemical raw materials, the general synthetic route is from benzene as raw material to undergo nitration, reduction, protection, bromination, and many other steps to protect the final product synthesis. The present study is an intermediate step in the synthetic route begins with aniline as raw materials for synthetic intermediates protection, bromo, to protect three steps synthesis Bromoaniline.Keyword:aniline;para-bromoaniline;synthesis1引言对溴苯胺是一种重要的染料原料,如偶氮染料、哇琳染料等,它也是有机合成和医药合成的重要中间体。
对溴苯胺的相对分子质量为172.03,熔点为66.4℃,有毒(LD50mg/kg),其毒性较抓苯胺更强,可经过皮肤吸收,具有溶血性,能引起膀脱癌。
最新对溴苯胺的全合成

对溴苯胺的全合成以苯胺为原料合成对溴苯胺化学与环境学院摘要:对溴苯胺是非常重要的有机化工原料,本合成过程要经历还原、保护、溴代、去保护等多个步骤。
本实验以本实验以10mL苯胺为初始原料,用醋酸将苯胺乙酰化制成乙酰苯胺,再用溴单质亲电取代乙酰苯胺对位上的氢生成对溴乙酰苯胺,最后在酸性条件下把对溴乙酰苯胺转化为目标产物对溴苯胺,称量得到其质量为1.86g.Abstract: 4-Bromoanlines is very important organic chemical raw materials, its synthesis process go through reduction, protection, bromination, to protect and a number of steps.In this experiment, 10mL as aniline the raw material. And then acetic acid made aniline acetylation to acetanilide. Bromine replace the Acetanilide hydrogen generated on the bit by the Electrophilic substitution and generate para-Bromoacetanilide.At last, under acidic conditions Bromoacetanilide is turned into bromo aniline---the target product. The mass of the target product is 1.86g.关键词:苯胺对溴苯胺乙酰苯胺Key words:aniline 4-Bromoanlines acetanilide1.前言:乙酰苯胺是白色有光泽片状结晶或白色结晶粉末,在水中再结晶析出呈正交晶片状。
有机实验报告:对溴苯胺的全合成

对溴苯胺的全合成陈烁丹(华南师范大学化学与环境学院 20112401018)摘要对溴苯胺是非常重要的有机化工原料,常被用作染料原料,如偶氮染料、喹啉染料等,医药及有机合成的中间体等。
本实验合成过程以硝基苯为原料,经历制备苯胺、乙酰苯胺、对溴乙酰苯胺等中间体的过程,最终制得目标产物对溴苯胺。
其合成过程经历硝化、还原、保护、溴代、去保护等多个步骤,可以制得纯度较高的对溴苯胺。
同时,使用了芳烃硝化、硝基的还原、氨基的保护与去保护、芳烃卤代等方法。
通过实验可得,用此实验方法制备对溴苯胺,操作方法简单,可控性强,相对于其他方法产率较高。
关键词合成;对溴乙酰苯胺;对溴苯胺The Total Synthesis of P-bromo-anilineChen ShuodanAbstract P-bromo-aniline is very important to the organic chemical raw materials, dyes were often used as raw materials, such as the azo dyes, KuiLin dyes, medicine and synthetic organic intermediates, etc. The synthesis process of nitrobenzene in as raw material, through preparation aniline, acetyl aniline, bromine acetyl aniline intermediates such as to the process, finally made of bromine aniline target product. The synthesis process include nitrification, reduction and protection experience, bromination, to protect the and so on many steps of the synthesis process, which can be made of high purity of aniline bromide.At the same time grasp aromatics nitrification, the reduction, and the nitro amino protection and to protect, halogenated aromatics methods.Through the experiment, the experimental method with the preparation of bromine aniline, operate simple methods and the control is strong, the rate of the production is higherKeywords synthesis; P-bromoaniline; P-bromo-aniline前言对溴苯胺的合成方法多种多样,通过查找文献可以得到三种常用的对溴苯胺合成方法。
对溴苯胺合成

对溴苯胺的全合成对溴苯胺的全合成摘要:本文给出了一种合成对溴苯胺的方法,以硝基苯为起始原料,逐步合成三个中间体:苯胺、乙酰苯胺、对溴乙酰苯胺,最后合成得到目标产物对溴苯胺。
合成过程要经过还原、保护、溴代、去保护多个步骤,涉及水蒸气蒸馏、重结晶、趁热过滤等基本操作技术。
关键词:硝基苯;对溴苯胺;全合成1. 引言对溴苯胺是一种重要的染料原料,如偶氮染料、哇琳染料等,它也是有机合成和医药合成的重要中间体。
对溴苯胺的相对分子质量为172.03,熔点为66.4℃,不溶于水,易溶于乙醇和乙醚。
有毒,其毒性较苯胺更强,可经过皮肤吸收,具有溶血性,能引起膀胱癌。
关于对溴苯胺的合成已经有一些报道。
例如,利用催化加氢法进行制备,以W-4型Raney-Ni为催化剂,双氰胺为脱溴抑制剂(助催化剂),甲醇为溶剂,以对溴硝基苯催化加氢[1] 还原制备对溴苯胺。
还有利用超声波辐射促进对溴苯胺的合成,在室温下超声波环境中合[2]成制备对溴苯胺的中间体对溴乙酰苯胺,然后水解重结晶得到对溴苯胺。
本文提供了一种适合在普通实验室操作的合成对溴苯胺的方法,使用的试剂简单易得,无须使用复杂的仪器,但反应时间稍长。
以硝基苯为起始原料,在酸性条件下用金属还原成苯胺,然后进行酰基化反应得到乙酰苯胺,再将其溴化制得对溴乙酰苯胺,最后在酸性条件[3]下去保护生成目标产物。
2.原理部分2.1中间体苯胺的制备芳胺的制取不可能用任何方法将-NH2导入芳环上,而是经过间接的方法来制取。
芳香硝基化合物还原是制备芳胺的主要方法。
实验室常用的方法是在酸性介质中用金属进行化学还原,可以得到相应的芳香族伯胺。
常用的还原剂有铁-盐酸、铁-醋酸、锡-盐酸等。
反应式如下:2.2中间体乙酰苯胺的制备胺的酰基化在有机合成中有着重要的作用。
作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物,以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第一类定位基变为中等强度的第二类定位基,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻很大,往往选择性地生成对位取代物。
合成对溴苯胺

以硝基苯为起始原料合成对溴苯胺摘要以硝基苯为起始原料设计合成了对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺,各中间体的颜色、形状等物理性质均符合文献数据,理论产量较高。
通过本实验的合成步骤,能较为有效和便捷地合成对溴苯胺,提供了一个较好的合成方法。
关键词硝基苯;对溴苯胺;苯胺;乙酰苯胺;对溴乙酰苯胺;合成1 前言本实验以硝基苯为起始原料合成对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺。
)导入芳环上,而是经过间接方法来制苯胺的制取不可能用任意直接方法将氨基(-NH2取。
将硝基苯还原就是制取苯胺的一种重要的方法。
实验室常用的还原剂有锡-盐酸、二氯化锡-盐酸,铁-盐酸、铁-醋酸及锌-醋酸等。
用锡-盐酸作还原剂时,作用较快,产率较高,但价格较贵,同时,酸碱用量较多,铁-盐酸的缺点是反应时间较长,但成本低,酸的用量仅为理论量的1/40,如用铁-醋酸,还原时间还能显著缩短。
综合考虑,本实验选择锡-盐酸作还原剂。
乙酰苯胺可以通过苯胺与酰基化试剂如乙酰氯、乙酸酐或冰醋酸作用来制备。
乙酰氯、乙酸酐与苯胺反应过于剧烈,不宜在实验室内使用,而冰醋酸与苯胺反应比较平稳,容易控制,且价格也最为便宜,故本实验采用冰醋酸做酰基化试剂。
苯环卤代反应:卤素对苯环上的取代反应属亲电取代反应。
常用的催化剂有铁、铝、磷及其卤化物等。
苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。
对溴乙酰苯胺在酸性条件下去保护生成对溴苯胺,这是常见的去保护基的方法。
243N O21.H C l3.N aO HN H2C H3C O O HN H C O C H32,H A cN H C O C H3B rH C lN H2B r图1 合成流程图表1 对溴苯胺的物理常数2实验部分2.1 主要仪器与试剂硝基苯;锡粒;浓盐酸;乙醚;氯化钠;氢氧化钠;冰醋酸;锌粉;活性炭;溴;乙醇;亚硫酸氢钠。
圆底烧瓶;回流冷凝管;空气冷凝管;刺形冷凝管;水蒸气蒸馏装置;保温漏斗;电动搅拌器;抽滤瓶;布氏漏斗。
有机化学实验-对溴苯胺的全合成

有机化学实验论文题目:对溴苯胺的全合成论文著者:专业名称:化学所在院系:化学与环境学院指导老师:***提交时间: 2012年5月对溴苯胺的全合成(华南师范大学化学与环境学院2010级化学1班)摘要本实验以硝基苯为起始原料,在酸性条件下用锡将硝基苯还原为苯胺;苯胺在锌粉的催化下与乙酸发生酰基化反应合成乙酰苯胺;乙酰苯胺在乙酸催化下与溴发生卤代反应合成对溴乙酰苯胺;对溴乙酰苯胺在酸性条件下去保护生成对溴苯胺。
本实验对溴苯胺的产率为40.7%,并测得熔点为66.5℃。
关键词对溴苯胺;酰基化反应;溴代反应;对溴乙酰苯胺。
The Synthesis of 4-BromoanilineAbstract With nitrobenzene as starting material, under the acid conditions, the aniline is reduced by Tin to Aniline; In zinc catalytic, aniline and acetic acid acylation reaction synthesis of acetanilide; Halogenated synthetic reaction occurs in acid catalysis, acetanilide and bromine 4-Bromoacetanilide. Under acidic conditions, 4-Bromoacetanilide generated on 4-Bromoaniline. The yield of this experiment is 40.7%, and the melting point of 4-Bromoaniline is 66.5℃.Keyword 4-Bromoaniline; acylation; Bromination; Bromoacetanilide.引言对溴苯胺是非常重要的有机化工原料,它是染料原料(如偶氮染料、喹啉染料等)、医药及有机合成中间体。
4-溴乙酰苯胺制备的半微量实验研究

4-溴乙酰苯胺制备的半微量实验研究
张洪权;郑平;田露
【期刊名称】《黑龙江医药科学》
【年(卷),期】2009(032)004
【摘要】4~溴乙酰苯胺的合成是微型有机合成实验中比较经典的实验。
在微型
4-溴乙酰苯胺合成实验中,因仪器黏附等损耗相对于原料用量的比例较大等原因,使所得产物的产量减少,产率偏低。
为此,我们将微量试剂用量增至半微量与之微量进行对比研究,并对实验条件进行了优化。
【总页数】1页(P26-26)
【作者】张洪权;郑平;田露
【作者单位】湖北第二师范学院化学与生命科学系,湖北,武汉,430205;湖北第二师范学院化学与生命科学系,湖北,武汉,430205;湖北第二师范学院化学与生命科学系,湖北,武汉,430205
【正文语种】中文
【中图分类】R914
【相关文献】
1.4-(2-溴乙酰基)甲磺酰苯胺 [J], 顾红;许同桃
2.2,6-二溴-4-甲基乙酰苯胺的一步合成 [J], 安丰梅;王鹏
3.2-溴4-氟乙酰苯胺的合成工艺研究综述 [J], 尹丽华;姚路路
4.微量、半微量法合成乙酰苯胺 [J], 王桂艳;张瑞仁;王旭
5.2-溴-4-氟乙酰苯胺在雄性大鼠体内的毒物动力学行为 [J], 朱狄峰;童振轩;洪雅雯;陈超;赵剑岚;平丽
因版权原因,仅展示原文概要,查看原文内容请购买。
对溴苯胺的全合成

对溴苯胺的全合成1(华南师范大学化学与环境学院,广州 510006)2(华南师范大学化学与环境学院有机化学研究所,广州 510006)摘要对溴苯胺是非常重要的有机化工原料,其合成过程要经历硝化、还原、保护、溴代、去保护等多个步骤。
本实验合成过程以硝基苯为原料,经历制备苯胺、乙酰苯胺、对溴乙酰苯胺等中间体的过程,最终制得目标产物对溴苯胺。
通过该实验方法可制备纯度较高的对溴苯胺,操作方法简单,可控性强。
关键词对溴苯胺;亲电取代;全合成The Total Synthesis of p-bromo-anilineAbstract p-bromo-aniline is very important to the organic raw materials, whose synthesis process include nitrification, reduction and protection, bromination, deprotection and much more steps. The synthesis process uses nitrobenzene as raw material, through intermediates such as aniline, acetyl-aniline, p-bromine-acetyl-aniline, finally acquire the target product p-bromine-aniline. The synthesis method can acquirehighly purified p-bromo-aniline, which has a simple method of operation and a strong controllability.Keywords p-bromoaniline; electrophilic substitution; total synthesis1 前言1.1 对溴苯胺及其应用概述对溴苯胺是一种重要的染料原料,如偶氮染料、喹啉染料等,它也是有机合成和医药合成的重要中间体。
对溴苯胺的全合成
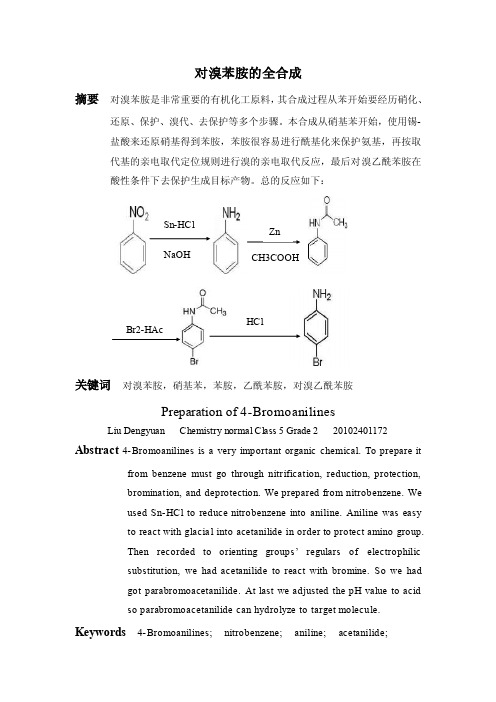
对溴苯胺的全合成摘要 对溴苯胺是非常重要的有机化工原料,其合成过程从苯开始要经历硝化、还原、保护、溴代、去保护等多个步骤。
本合成从硝基苯开始,使用锡-盐酸来还原硝基得到苯胺,苯胺很容易进行酰基化来保护氨基,再按取代基的亲电取代定位规则进行溴的亲电取代反应,最后对溴乙酰苯胺在酸性条件下去保护生成目标产物。
总的反应如下:关键词 对溴苯胺,硝基苯,苯胺,乙酰苯胺,对溴乙酰苯胺Preparation of 4-BromoanilinesLiu Dengyuan Chemistry normal Class 5 Grade 2 20102401172Abstract 4-Bromoanilines is a very important organic chemical. To prepare itfrom benzene must go through nitrification, reduction, protection, bromination, and deprotection. We prepared from nitrobenzene. We used Sn-HCl to reduce nitrobenzene into aniline. Aniline was easy to react with glacial into acetanilide in order to protect amino group. Then recorded to orienting groups ’ regulars of electrophilic substitution, we had acetanilide to react with bromine. So we had got parabromoacetanilide. At last we adjusted the pH value to acid so parabromoacetanilide can hydrolyze to target molecule.Keywords 4-Bromoanilines; nitrobenzene; aniline; acetanilide;Sn-HClNaOH Zn CH3COOHBr2-HAc HClParabromoacetanilide1 前言1.1 对溴苯胺的物化性质H2N Br结构式:相对分子量:172.03密度:1.4970(液体,99.6℃)熔点:66.4 ℃沸点:沸点时分解毒性LD50(mg/kg):有毒,其毒性较氯苯胺类更严重,可经表皮吸收。
合成对溴苯胺-图文

合成对溴苯胺-图文以下是为大家整理的合成对溴苯胺-图文的相关范文,本文关键词为成对,苯胺,图文,,您可以从右上方搜索框检索更多相关文章,如果您觉得有用,请继续关注我们并推荐给您的好友,您可以在教育文库中查看更多范文。
以硝基苯为起始原料合成对溴苯胺摘要以硝基苯为起始原料设计合成了对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺,各中间体的颜色、形状等物理性质均符合文献数据,理论产量较高。
通过本实验的合成步骤,能较为有效和便捷地合成对溴苯胺,提供了一个较好的合成方法。
关键词硝基苯;对溴苯胺;苯胺;乙酰苯胺;对溴乙酰苯胺;合成1前言本实验以硝基苯为起始原料合成对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺。
苯胺的制取不可能用任意直接方法将氨基(-nh2)导入芳环上,而是经过间接方法来制取。
将硝基苯还原就是制取苯胺的一种重要的方法。
实验室常用的还原剂有锡-盐酸、二氯化锡-盐酸,铁-盐酸、铁-醋酸及锌-醋酸等。
用锡-盐酸作还原剂时,作用较快,产率较高,但价格较贵,同时,酸碱用量较多,铁-盐酸的缺点是反应时间较长,但成本低,酸的用量仅为理论量的1/40,如用铁-醋酸,还原时间还能显著缩短。
综合考虑,本实验选择锡-盐酸作还原剂。
乙酰苯胺可以通过苯胺与酰基化试剂如乙酰氯、乙酸酐或冰醋酸作用来制备。
乙酰氯、乙酸酐与苯胺反应过于剧烈,不宜在实验室内使用,而冰醋酸与苯胺反应比较平稳,容易控制,且价格也最为便宜,故本实验采用冰醋酸做酰基化试剂。
苯环卤代反应:卤素对苯环上的取代反应属亲电取代反应。
常用的催化剂有铁、铝、磷及其卤化物等。
苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。
对溴乙酰苯胺在酸性条件下去保护生成对溴苯胺,这是常见的去保护基的方法。
no2浓h2so4浓hno31.hcl2.sn(Fe)3.naohnh2锌粉ch3coohnhcoch3br2,hAcnhcoch3hclnh2brbr图1合成流程图表1对溴苯胺的物理常数相对分子量或原子量172.03物质密度1.4970(液体,99.6℃)熔点(℃)溶解情况不溶于水,易溶于乙醇和乙醚。
有机设计实验

有机设计实验重要化工原料——对溴苯胺的合成【实验目的】1,了解掌握制备对溴苯胺的原理及方法2,了解保护基团在合成中的应用。
3,了解胺的酰基化在有机合成中的应用。
4,学习通过降低基团活性得到目标产物的方法。
【实验原理】对溴苯胺是非常重要的有机化工原料,它是染料原料(如偶氮染料、喹啉染料等)、医药及有机合成中间体。
以苯胺为起始原料设计合成了对溴苯胺,不能直接通过卤代反应实现合成过程,由于氨基是强给电子基,和溴反应很难停留在一元取代的阶段,因此,要制备对溴苯胺,必须先将苯环的活性降低。
胺的酰基化在有机合成中有着重要作用。
作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物,以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第I类定位基变为中等强度的第I类定位基,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻很大,往往选择性地生成对位取代物。
溴乙酰苯胺是通过苯环卤代反应合成的,卤素对苯环上的取代属于亲电取代反应,常用的催化剂有铁、铝、磷及其卤化物等。
苯环上有乙酰氨基,乙酰氨基是邻对位取代基团,由于空间位阻大,主要产物是对溴乙酰苯胺。
乙酰氨基酸性条件下不稳定,可在酸性条件下去保护,生成对溴苯胺。
乙酰苯胺可由苯胺与乙酰化试剂,如乙酰氯、乙酐或乙酸等直接作用来制备。
反应活性是乙酰氯>乙酸酐>乙酸。
但由于乙酰氯和乙酸酐的价格较贵,本实验采用纯的乙酸作为乙酰化试剂。
以苯胺为起始原料合成对溴苯胺的方法如下:在本实验中,先将苯胺乙酰化再进行溴代反应,当溴代完毕再水解将乙酰基除去,能较为有效和便捷地合成对溴苯胺。
【仪器试剂】1,仪器:电动搅拌器;水浴锅;三口烧瓶;温度计;烧杯;刮刀;50ml圆底烧瓶;刺形冷凝管;直形冷凝管;接液管;量筒;保温漏斗;电热套;恒压滴液漏斗;抽滤瓶;布氏漏斗;尾接管;锥形瓶;pH试纸。
2,试剂:苯胺;冰醋酸;锌粉;活性炭;溴;乙醇;亚硫酸氢钠;浓盐酸;20%氢氧化钠。
乙酰苯胺制备的绿色化研究

Synthesis of Acetanilide under Greener Conditions
ZHANG Li LI Kang-Lan BAI Lin
(Institute of Green Chemistry Experiment and Teaching,Lanzhou City University,Lanzhou Gansu 730070)
Abstract:Acetanilide can be prepared from aniline in several ways, using glacial acetic acid or acetic anhydride as starting materials. The fractional distillation, reflux, dry distillation, reflux-dry distillation and microwave irradiation heat are present methods. From both green chemistry point of view and experimental procedure, the reflux-dry distillation is preferred for laboratory synthesis because their notable improvement in shorting time, improving yield and simplifying procedure. Key words:acetanilide;reflux-dry distillation;microwave irradiation;green chemistry experiment
对溴苯胺的全合成

对溴苯胺的全合成
对溴苯胺的全合成
林思丽[1]
【期刊名称】《《信息周刊》》
【年(卷),期】2019(000)033
【摘要】对溴苯胺(BrC6H4NH2)是非常重要的有机化工原料,其合成具有十分重要的意义。
本实验合成过程中以苯胺为原料,经历制备乙酰苯胺、对溴乙酰苯胺等中间体的过程,最终制得纯度较高的目标产物。
其中,过程包括氨基的保护与去保护、芳烃卤化等制备方法,分馏、重结晶、减压过滤等操作技术。
通过该实验方法可制备纯度较高的对溴苯胺,而且操作简单,原料易得,但产率较低,反应步骤繁多,仍需进一步改进。
【总页数】2页(1-2)
【关键词】对溴苯胺; 氨基保护; 全合成
【作者】林思丽[1]
【作者单位】[1]华南师范大学
【正文语种】中文
【中图分类】G
【相关文献】
1.乙酰乙酰苯胺类化合物导向的2,2-二溴乙酰苯胺衍生物的合成[J], 刘卫兵; 陈翠; 邱会华
2.N-(-3'-氨基-4'-溴代)苯甲酰-2-甲基-5-溴代苯胺的合成[J], 梁娅; 魏荣宝; 谢秀荣; 贾辰熙; 张涛
3.水溶剂法合成2,6-二溴-4-三氟甲氧基苯胺 [C], 刘鹏; 王宇; 毛春晖; 黄海军。
对溴乙酰苯胺的制备

对溴乙酰苯胺的制备化学与环境学院有机化学实验报告实验名称对溴乙酰苯胺的制备【实验目的】1、学习芳烃卤化反应理论,掌握芳烃溴化方法;2、熟悉溴的物理化学性质及其使用操作方法;3、巩固重结晶及熔点技术。
【实验原理】(包括反应机理)素对苯环上的取代属于亲电取代反应,常用的催化剂有铁、铝、磷及其卤化物等。
苯环上有乙酰氨基,乙酰氨基是邻对位取代基团,由于空间位阻大,主要产物是对溴乙酰苯胺。
【主要试剂及物理性质】外观名称分子量熔点/℃沸点/℃乙酰苯胺135.165 114.3 304 白色有光泽片状结晶对溴乙酰苯胺214.059 167~169 353.4 浅黄色晶体溴单质159.808 -7.2 58.76 深棕红色乙酸60.05 16.6 117.9 无色有刺激性气味液体乙醇46.07 -114.3 78.4 无色有酒香气味液体【仪器装置】1、主要仪器:磁力搅拌器、水浴锅、250mL三口烧瓶、恒压滴液漏斗、温度计、量杯、抽滤瓶、布氏漏斗、真空泵、冷凝管2、实验装置:【实验步骤及现象】反应装置抽滤装置实验步骤实验现象(1)将250mL三口烧瓶至于水浴锅中,再置于磁力搅拌机上、再装上温度计、恒压滴液漏斗,并在恒压低液漏斗上连接气体吸收装置,以吸收反应中的溴化氢。
安装搅拌滴加回流装置,在100mL锥形瓶中,将3.5g乙酰苯胺溶于15.0mL乙醇中,再将1.31g溴溶解于3mL冰乙酸中,一边搅拌一边慢慢地将溴-冰醋酸溶液加至乙酰苯胺的醇溶液中,滴加速度以棕红色的溴色较快退去为宜。
(1)将溴-冰醋酸溶液加至乙酰苯胺的醇溶液中,棕红色的溴快速扩散,溶液由橙黄色变为黄色,再变为浅黄色;(2)滴加完毕,在45℃浴温下,继续搅拌反应1h,再将浴温提高至60℃,在搅拌一段时间,直到反应混合物液面不再有红棕色蒸汽溢出。
在搅拌下将反应物慢慢变加至100mL水中,此时既有固体析出。
若有黄色,可加入饱和的亚硫酸氢钠水溶液洗涤,使溶液黄色恰好退去。
以苯胺为起始原料合成溴苯胺

以苯胺为起始原料合成对溴苯胺华南师范大学化学与环境学院姓名:学号:一、摘要:以苯胺为起始原料设计合成了对溴苯胺,其中要合成三个中间体,分别为乙酰苯胺、对溴乙酰苯胺,各中间体的颜色、形状等物理性质均符合文献数据,理论产量较高。
通过本实验的合成步骤,能较有效和便捷地合成对溴苯胺,提供一个较好的合成方法。
关键词:苯胺、对溴苯胺、乙酰苯胺、对溴乙酰苯胺二、引言产物性质对溴苯胺是一种重要的染料原料,如偶氮染料,哇琳染料等,它也是有机合成和医药合成的重要中间体。
对溴苯胺的相对分子质量为172.03,有毒,可经皮肤吸收,具有溶血性,能引起膀脱癌。
对溴苯胺不溶于水,易溶于乙醇和乙醚,从60%乙醇中析出为正交晶系双锥体针状结晶。
其制备或来源方法有:(1)以对硝基苯胺为原料,在硫酸中与亚硝酸钠反应,生成重氮盐,再在溴化亚铜作用下,与氢溴酸反应,生成硝基溴苯,进一步在氢溴酸中用铁粉还原而得;(2)以苯为原料,在铁粉的作用下,与溴反应,生成溴苯,再与混酸(硫酸和硝酸)反应,生成邻硝基溴苯及对硝基溴苯(其中邻位占35%,对位占65%),使二者分离,再按(1)进行而得。
(3)以对溴乙酰苯胺为原料,在氢氧化钠溶液中,用水蒸气回流而得。
原料及产物用途(1)苯胺可用于染料、医药、橡胶、树脂、香料等的合成。
(2)对溴乙酰苯胺是有机合成原料,可以制退热止痛药。
(3)对溴苯胺是染料原料(如偶氮染料、喹啉染料等)、医药及有机合成中间体。
(4)对溴联苯是激光染料、液晶材料、农药、医药等许多精细化工产品的关键中间体。
通过对溴联苯可以制得烷基联苯、环己基联苯,然后引入氰基就制得常用的联苯氰类液晶化合物;还可作为超高效杀鼠剂溴鼠灵、溴敌隆的起始原料。
三、实验原理苯胺很容易进行酰基化反应,即氨基中的氢原子被酰基取代,这样可以保护芳胺的氨基。
卤素对苯环上的取代反应属亲电取代反应,常用的催化剂有铁、铝、磷及其卤化物等。
苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。
以苯胺为起始原料合成溴苯胺

以苯胺为起始原料合成对溴苯胺华南师范大学化学与环境学院姓名:学号:一、摘要:以苯胺为起始原料设计合成了对溴苯胺,其中要合成三个中间体,分别为乙酰苯胺、对溴乙酰苯胺,各中间体的颜色、形状等物理性质均符合文献数据,理论产量较高。
通过本实验的合成步骤,能较有效和便捷地合成对溴苯胺,提供一个较好的合成方法。
关键词:苯胺、对溴苯胺、乙酰苯胺、对溴乙酰苯胺二、引言产物性质对溴苯胺是一种重要的染料原料,如偶氮染料,哇琳染料等,它也是有机合成和医药合成的重要中间体。
对溴苯胺的相对分子质量为172.03,有毒,可经皮肤吸收,具有溶血性,能引起膀脱癌。
对溴苯胺不溶于水,易溶于乙醇和乙醚,从60%乙醇中析出为正交晶系双锥体针状结晶。
其制备或来源方法有:(1)以对硝基苯胺为原料,在硫酸中与亚硝酸钠反应,生成重氮盐,再在溴化亚铜作用下,与氢溴酸反应,生成硝基溴苯,进一步在氢溴酸中用铁粉还原而得;(2)以苯为原料,在铁粉的作用下,与溴反应,生成溴苯,再与混酸(硫酸和硝酸)反应,生成邻硝基溴苯及对硝基溴苯(其中邻位占35%,对位占65%),使二者分离,再按(1)进行而得。
(3)以对溴乙酰苯胺为原料,在氢氧化钠溶液中,用水蒸气回流而得。
原料及产物用途(1)苯胺可用于染料、医药、橡胶、树脂、香料等的合成。
(2)对溴乙酰苯胺是有机合成原料,可以制退热止痛药。
(3)对溴苯胺是染料原料(如偶氮染料、喹啉染料等)、医药及有机合成中间体。
(4)对溴联苯是激光染料、液晶材料、农药、医药等许多精细化工产品的关键中间体。
通过对溴联苯可以制得烷基联苯、环己基联苯,然后引入氰基就制得常用的联苯氰类液晶化合物;还可作为超高效杀鼠剂溴鼠灵、溴敌隆的起始原料。
三、实验原理苯胺很容易进行酰基化反应,即氨基中的氢原子被酰基取代,这样可以保护芳胺的氨基。
卤素对苯环上的取代反应属亲电取代反应,常用的催化剂有铁、铝、磷及其卤化物等。
苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。
对溴苯胺的绿色反应研究

对溴苯胺的绿色反应研究中文摘要溴代苯胺是一类很重要的化工中间体,在医药、染料、颜料等精细化工产品的合成中应用广泛。
本论文综述了绿色化学的理念、卤代芳胺的研究进展及其应用、合成对溴苯胺的多种方法等。
通过实验室自主制备的溴化试剂合成了对溴苯胺,该方法操作简便、条件温和、后处理容易、无毒无污染,能获得较高纯度的产品,通过核磁共振氢谱确证了结构,并且发现了一种新的未知化合物。
在实验中探究得出了反应的最佳条件,同时探究了使用不同催化剂对产品产率的影响。
关键词:绿色化学,溴化,对溴苯胺,催化剂The Research of the Green Reaction ofp-bromoanilineAbstractBromaniline is a kind of important intermediates which is widely used for the synthesis of fine chemical products,such as medicine, dyes and pigments. This paper has summarized the concept of Green Chemical, the research progress of halogenated aromatic amine and applications, the various methods of synthesis aniline bromine, etc.Through the brominated reagent that prepared in laboratory independently,we synthesis the bromine aniline, this method is simple, easy to mild conditions and post-processing. Non-toxic, no pollution, and can get high purity products, The structure of the products were confirmed by 1H NMR spectra, and found a kind of new unknown compounds. During experiments, we also have explored the optimal condition, and the yield influence of different catalysts.Key Words: Green Chemical, Bromination,p-bromoaniline,catalyst对溴苯胺的绿色反应研究1.前言1.1绿色化学的产生及其发展1.1.1绿色化学的产生化学渗透在人类生活的各个角落,小到锅碗瓢盆等生活用品,大到宇宙航天等高科技材料,无不与化学有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实 验 教 学 教 案 用 纸
对溴乙酰苯胺的绿色合成(8学时)
一、实验目的
1.学习苯胺乙酰化的原理与操作 2.掌握绿色化学中芳烃溴代方法
二、实验原理
1.苯胺的乙酰化
2.芳烃的溴代
NaBr +
H 2SO 4HBr +NaHSO 4
HBr
+
H 2O 2Br 2+
H 2O NHCOCH 3
+
Br 2
HBr
NHCOCH 3
+
2NHCOCH 3
NaBr +
H 2SO 4
H 2O 2
++
NHCOCH 3
+
Br
H 2O NaHSO 4
+N -phenylacetamide N -(4-bromophenyl)acetamide
sodium bromide
sulfuric acid
hydrogen bromide
hydrogen peroxide
dibromine
water sodium hydrogen sulfate
实验教学教案用纸
三、实验试剂与仪器
1.试剂:苯胺、冰乙酸、锌粉、溴化钠、乙醇、33% H2O2、浓硫酸。
2仪器:回流反应装置,蒸馏装置
四、实验内容
(一).乙酰苯胺的合成
(1)在250mL圆底烧瓶中加入20mL新蒸馏的苯胺0.22mol)、30mL冰醋酸(0.52mol)及少许锌粉(约0.3g)。
依次安装蒸馏头、刺形分馏柱、温度计套管、温度计、乳胶管,
固定实验装置,将乳胶管伸入50mL烧杯内,收集蒸出的水和乙酸。
(2)用电热套将圆底烧瓶中的溶液缓慢加热,使反应物保持微沸约15min。
然后逐渐升高温度,保持温度计读数在105℃左右,约经过45min,反应生成的水及部分醋酸可蒸出(约15mL)。
当温度计的读数下降时,反应即到达终点,停止加热。
(3)在不断搅拌下,将反应物趁热慢慢倒入盛有100mL冷水的500mL烧杯中,继续搅拌,充分冷却,使粗乙酰苯胺成细粒状完全析出。
用布氏漏斗进行抽滤,用20~50mL冷水
洗涤粗产品。
将粗产品分成两份,分别转移到盛有150mL热水的烧杯中,继续加热至沸,如果仍有未溶解的油珠,需补加适量热水,直到油珠溶解完全,再多加20%的热水。
稍冷,加入约1g活性炭,煮沸几分钟,趁热用经热水预热好的布氏漏斗迅速过滤,冷却滤液,待析出晶体后,用布氏漏斗抽滤,将产物转移至一个预先称重的表面皿中,晾干。
纯乙酰苯胺为无色片状晶体,熔点为114.3℃。
(二).对溴乙酰苯胺的合成
1、在100 mL三口瓶上配置电动搅拌器、回流冷凝管和恒压滴液漏斗。
2、向三口瓶中加入3.4 g(0.025 mol)乙酰苯胺、15 mL95%的乙醇,6 mL 33% H2O2和2.6 g NaBr室温下,边搅拌边滴加2 ml H2SO4,滴加速度以生成溴的颜色较快褪去或微微回流。
实验教学教案用纸(微沸)为宜。
3、滴加完毕,继续搅拌5至10分钟。
停止搅拌,让其自然冷却,析出结晶。
4、彻底冷却后,抽滤,并用冷水洗涤滤饼饼抽干,放在空气中自然晾干后,得到较大颗粒的白色针状晶体。
5、洗涤滤饼的母液中此时又析出较多的晶体,抽滤,用冷水洗涤滤饼并抽干,分别放在空气中自然晾干后,得到略带颜色的较细颗粒的针状晶体。
6、把两次得到的晶体产品分别称重,以总质量计算反应的产率。
五、实验记录
六、实验思考与讨论
1、胺酰化的意义是什么?
答:一方面可以保护氨(胺)基,因为酰胺不易起氧化反应,同时由于酰胺碱性较小,通过在酸或碱的环境中水解,氨基又很容易得到再生。
另一方面以酰胺键代替酯键可以改善药物的稳定性和药理活性对于一级、二级芳香胺,酰化后可以降低对氧化剂的敏感性,提高其稳定性;氨基酰化后,可以降低苯环的亲电取代活性,使反应由多元取代变为一元取代;由于酰基的空间效应,往往选择性地生成对位产物。
药理意义:在药物分子中引入酰基,可增加药物的脂溶性,有利于体内吸收,提高疗效;将酯键改造为酰胺键可以提高水解稳定生,延长药物作用时间;通过酰化反应,还可使药物毒副作用降低
2、酰化试剂有哪些?为什么选择冰醋酸?
3、反应混合物中有尚未反应的乙酸,会对乙酰苯胺的结晶析出产生不利影响吗?若有影响,如何克服?。
