金属配位稳定常数
作为金属离子与EDTA生成的配合物稳定常数

M M L M
22
第二节配位平衡
配位效应系数:量度配位效应对主反应影响的程度
M(L) 的大小与溶液中其他配位剂L的浓度及配位能力
有关。
[L] M M(L) ,副反应程度高 [L] M M(L) ,副反应程度低
若配位剂L的配位能力越强,表示金属离子被L配位得
6
第一节概 述
金属离子与有机配位剂发生配位反应的特点:
由 于 有 机 配 位 剂 常 含 有 两 个 以 上 的 配 位 原 子 , 与金属离子配位时形成环状结构稳定性高的螯合 物,并且是可溶性的。配位比固定,反应的完全 程度高,能够得到明显的滴定终点,符合配位滴 定法的条件。因此在配位滴定中得到广泛应用。 目前应用最多的是氨羧配位剂。
备成相应的钠盐,其化学名称为乙二胺四乙酸的二钠盐,用Na2H2Y·2H2O 表示,也简称EDTA。EDTA钠盐为白色粉末状结晶,有较好的水溶性。
9
第一节概 述
2.乙二胺四乙酸在水溶液中的电离平衡 在水溶液中,EDTA分子中互为对角线的两个羧基上的H+会
转移到氮原子上,形成双偶极离子。
HOOCH2C + N
由lg KM' Y lg KMY lgY(H)
lgY(H) lg KMY lg KM' Y
已知CM
0.01mol/L时,满足 lg
K
' MY
8
lg Y(H) lg KMY 8 查表6-3求得最高酸度(最低pH)
注:超过最高酸度, Y(H)
,K
' MY
,TE%
28
第二节配位平衡
课堂练习: 求用EDTA滴定液(0.01mol/L)滴定同浓度
实验七配合物的组成及其稳定常数的测定

仪器分析
A' - A a=
A'
由可以计算配合物的稳定常数K:
1-a K=
[MLn]a2Biblioteka 仪器分析5、注意事项
在测定系列溶液的吸光度时,应按编号 的顺序进行。其他注意事项参见5。
仪器分析
6、数据处理
(1)用摩尔比法定配合物组成:用表1中的数 据,作吸光度A与R的关系图,将曲线的两直 线部分延长相交于一点,确定配位数n。
(2)酸度对测定配合物的组成有何影响?如 何确定适宜的酸度条件?
(3) 如果选用的总摩尔浓度增加1倍或稀释1 倍,实验得到的曲线会有什么变化?对计算配 合物的组成及稳定常数有何影响?
仪器分析
(2)用等摩尔变化法确定配合物组成:根据 表6中的数据,作吸光度A对CM /(CM+ CL)的 关系图。将两侧的直线部分延长,交于一点, 由交点确定配位数n。比较两种方法所得的n值。
(3)按式3计算配合物的稳定常数。
仪器分析
7、思考题
(1)在何种情况下,可以使用摩尔比法、等 摩尔连续变化法测定配合物的组成?
实验七 配合物的组成及其稳定常数的测定
仪器分析
2、实验原理
分光光度法是研究配合物组成和测定配 合物稳定常数的一种十分有效的方法。 如果金属离子M和配位体L形成配合物, 配合反应为
M + nL MLn
仪器分析
(1)摩尔比法:配制一系列溶液,维持各溶 液的金属离子浓度、酸度、离子强度、温度不 变,只改变配位体的浓度,在配合物的最大吸 收波长处测定各溶液的吸光度A,以吸光度A 对 CM摩为尔金比属R离(子R浓=度CL)/作CM图,得C到L为图配1位。体由浓图度可,见, 当R<n时,配位体L全部转变为MLn,吸光度 A随L浓度增大而增高,并与R呈线性关系。当 R>n时,金属离子 M全部转变为 MLn,继续 增加 L,吸光度不再增高。将曲线的线性部分 延长,相交于一点,该点所对应的R即为配合 物的配位数n。
金属-无机配位体配合物的稳定常数

lgβn
3.24,7.05
10.3
2.65,4.75,6.19,7.12,6.80,5.14
2.11,3.74,4.79,5.55,5.73,5.11
6.7,14.0,20.1,25.7,30.8,35.2
5.93,10.86
4.31,7.98,11.02,13.32,12.86
1.4,2.2
8.8,17.5,18.5,19.28
0.30
9.05,17.32,19.74,21.00
1.30,1.88
1.77,2.60,3.00,2.30
1
3
4 2
ClCN-
Pd2+ Rh3+ Sc3+ Sn2+ Tl3+ U4+ Y3+ Ag+ Bi3+ Cd2+ Co3+ Cu+ Cu2+ Fe2+ Fe3+ Hg2+ In3+ Pb2+ Pd2+ Pt2+ Sb3+ Sn2+ Tl3+ Th4+ Zn2+ Zr4+ Ag+ Au+ Cd2+ Cu+ Fe2+ Fe3+
1,2
1,2,3,4,5
1,2
1,2,3,4
1,2
1,2,3,4,5,6
1,2,3,4
6
1,2,3,4
1,2,3,4
1,2,3,4,5,6
1,2,3,4
1
2
1
1,2,3,4
1,2
1,2,3,4
深的 入精 贯习神 彻中部和 落纪选。要 实委拔深锋求 中机任入为队, 央关用学员 的”特 和、工习的 情 装别 省组中作《标 形 、本是坚织央条中准 和 统质“ 市守原组例源国和 处 一九 委为则织、》,共条 分 思使个 关人、部遵等标 弘产件 规 想命严 于做优《守法准 扬党章; 定 行,禁 从事良关党规和 党地党学 。 动进止 严的作于章制条 的方个规习 ,一、 治基风加、县度件 优委全。党 认步九动准,强维处,。 良员面着规 真明个 的实和牢换护级学认 传会,”眼学确一 重效底记届党以习教真 统工充战明要 习“律 大;线入风章上市育学 和作中分略确掌 习四” 决要。党气,党委、习 作条、展布基握 近个纪 策在充誓监坚员加理《 风全例五示局本廉 平服律 部学分词督定领强论中 ;体》中共、标洁 总从要 署,发的理导领武国 深党《全产贯准自”求 。做关挥牢通(想干导装共 刻员中会党彻、律 市的,区合键机记知川信部班(。,产 汲学国精人落树准 X要重域格在关党》委念要 X子二根进党 取习共年神的实立则 系求点中党做的和办;学思)据一廉 违党产在,优五行规 统掌心员。组宗中〔认深想学省步洁 纪章党全进良大为定 先掌握关”要织旨央全2真一政系委坚自 违,党体0一风发规的握“于提学深战,、体1学层治列办定律 法要组党6步貌展范“四在供习入斗深省党〕习,建讲公理准 反深工员巩和理,四的个题全坚教学堡入委员1党系设话厅想则 面入作中4固时念组个领廉学体强育习垒领、个讲号的统。印信》 典领条开拓代,织必导洁习党保实贯作会市定 专 。党)历学实着发念《 型会例展精实和须干”讨员证施彻用党委理 题课和史习施眼的,中党(”一“党神现引部论中。方习和员有想 组,《领意加《提国 的试学 制、的;X导“必四,开案近党条关信 织支中X学悟见强关 二高共 教性行习 度总党群要事广四须个按展〉平员件严念 讨部共习党等理于 、党产 训质)讨 要体章众带业大个具自照“的总先和肃, 论书X革章制照在 主性党 ,、》论 求要党X路着“坚备觉“学通书锋义换学明 ,记市命度武入全 要觉纪 自宗《” ,求规线问十员持的四党知记模务届习确 每给委先深文党省 内悟律 觉旨头。 党、教题三逐”六,个章》系范、纪教政 个 开支办辈刻件志党 容;处 讲、政,落以 小学育五条项讲党(列作权律育治 专 展部公和把,愿员要分 政指领带实党 组系,”逐掌基于党规(X重用利动方 题 “党室先握学谈中X坚条 治导头全组 每列践针发句握本“课、一委要,员向 集 两关进“观理开持例 、思干严面中 月讲活对展通各条七”学)办讲领明部” 中 学讲于典两,想展学》 讲守从心 底话动问良读类件定个要系学〔话导确署、 学 一党印型个温在、“用等 规政严组,和题好党违共有求列党2,带做,“ 习 做课发先入推谈学0结党 矩奋治形 织做“改开章纪关产之,1全头合以坚 讨 ”,〈用党动信讲6合内 、斗纪党式 一合三,局行键党”开〕面、格华党持 论 学邀关好志改念话章、法 守目律责, 次格严进和明时人“展2贯以党民支根 不 习请于红愿革,党8创规 纪标和任定 党三一“确性刻理五党号彻上族部本 得 教党在色和发对做规先, 律、保政。期 员实步决做锻站想个组)落率优为宗 少 育校全教入展照合、争尊 ,持治组 集”坚胜合,炼得信必班实下秀三 单旨 于 ,教市育党稳入格学优崇公规织 中学专持全格向和出念须子结党,,传、 位1基师党资誓定党系,仆矩集 学天习题问面党党道,”成合的为站统主 开敢 础、员讲词实誓员列进章情,中 习。教题小员的德危牢等员我十协稳美要 展于专中规,践词”讲一怀带学 。育导康的”理修险固重到局八调政德措 一担 (家开矩交中找学话步精,头习 支(成向、中论养时树要联实大推治,施 次当 三学展、流建标习,强神牢, 部以果建奋和,候立论系际进全立筑主作 )者“有思功准教做化,记固(每下;注成发路心豁党述区,十“面场牢题为 开给学国纪想立、育合宗推共树一次 季简要重有线存得的,县现八四从,拒党” 展特律体业找实格旨动产立)确 度称突活为方敬出意认X制届严把腐日、 “员章色,会。差X施党观X党和开定 召“出述、针畏,识真局定三治X理防活“ 四干党社讲。距方员念《加员贯展1开两正,建政、在县践带如中党想变动个坚部规会道。案”党快永彻“一学面领功策手X(党 处行头下、等信的,专守 讲、干主德X党学委发远落两次一会立看握事 二员 级“讲党实四方念防组题纪 党学重部义、支习会展是实重全做贯业齐戒)意 以三党中施新面时线织开律 课系要读道有部教的、劳五温体”穿。,尺“ 开识 上严课央方要的时;党展底 ”,列讲本路品书育工科动大两党学其认,十 展党三决案中求深处始员交线 。鼓讲话)、全行记方作学人发对员习习中真廉三 “强 员实局定国,刻处终重流党励话精》“体,作案方发民展照会教系的贯洁五 三化 领”党,特坚内体保温研树 支普建神为五党讲学》法展的理”议育列马彻从” 个党 导要组2情色持涵现入讨立 部通理 立。基位员奉习0》、普念主,)讲克省政规的 干求书1怀社以和为干党。清 要念 与本一要献动6纳和通,题分话县思委、划宗 部和记、会知要行事志按风 结员怎 全教体坚、员入谐一带党别,处主、从开旨 要好给务主促求动创愿照正 合、么 面材”持有,学发员头日围要级义市严局意 学干实义行。的业、“气 专办 建,总学作领习展,攻活绕重以立委治起识 做部思、要力重三”、 成深体做为导内。密坚动“点上场决家步, 结标想“知着量开温会3的新 小入布结干容切克。坚学党观策,、积 合准作四行重(;拓入一要战 康学局合部。联难4习员点部带“极 ,风个合学三坚进月 党课求略 社习、,格带深系、《干方署头决践 对带。全一习)定取底 誓和怎 会《“坚党头入群敢习部法,弘胜行 照头要面,领做正的前 词内么 相习四员重领众于近要,做扬全社 习坚深”做会合确精,容干 适近个。会,担平以领政社面会 近定入战讲习格的气结 对;” 应平全引关全当总《会治小主 平理领略政近党神合重学 、总面导于心,书习贯上主康义 总想会布治平员,点习 有书”党改全带记近穿的义、核 书信我局、总。方平学研 效记战员革意系平其明核建心 记念国、有书着向常习讨 服系略强发为列谈中白心成价 关发五信记眼,时习; 务列布化展人重治的人价区值展大念来党经候近注 国重局政稳民要国坚;值域战发,川和常看平重 家要、治定服讲理定践体中略展视国主得总同 治讲五意、务话政信行系心机理察家动出书X理话大识内;X读》仰党和遇念重事向,记工 和读发,政加本《追的中、要业党对作 “本展保外强(习求宗中社讲的四“ 五(理持交党2近、旨会话新央川存 位02念政国1平0历,主和发看工凭 一61、治防年总6史义系展齐作、 体年全本、版书担核列对的留 ”版面色治)记当心重党系史 建)深党》重意价要员列、 设》化治,要识值指的资 的,改国重讲、观示政 X要革治X点话真和、 事将军领文挚全育 业毛的会章为面人 发泽重理选民从” 展东要想编严的 体同论信(治作 系志念领党用 。、导等结全中方合体国面起党梦来员、,学加快
作为金属离子与EDTA生成的配合物稳定常数

第一节概 述
课堂互动 请您回答: EDTA与Al2(SO4)3的配位比是
多少?Biblioteka 15第二节配位平衡第二节 配位平衡
一、EDTA配合物的稳定常数
M+Y
MY
反应的平衡常数为:
KMY =
MY MY
KMY为金属与EDTA生成的配合物稳定常数,各 种配合物都有其一定的稳定常数,又称绝对稳
8
第一节概 述
一、乙二胺四乙酸的性质
1.乙二胺四乙酸的结构与性质
乙二胺四乙酸的结构
HOOCH2C N
HOOCH2C
CH2 CH2
CH2COOH N
CH2COOH
从结构式所知, EDTA为四元有机弱酸。用H4Y表示其化学式。EDTA为白 色粉末状结晶,微溶于水,由于溶解度太小,不宜作滴定液。利用EDTA难 溶于酸和一般有机溶剂,易溶于氨水和氢氧化钠等碱性溶液等性质,常制
◆学习目的
通过配位滴定法的学习,掌握EDTA的性质、 EDTA配位反应的特点、配位滴定的原理和金属指 示剂变色原理及条件,理解配位滴定中副反应对 主反应的影响,能够正确选择配位滴定条件和合 适的指示剂,熟练掌握常见金属离子的含量测定 方法。通过本章学习,为药物分析中含金属离子 类药物的含量测定奠定基础。
pKa1 =0.9 pKa2 =1.6 pKa3 =2.0 pKa4 =2.67 pKa5 =6.16 pKa6 =10.26
11
第一节概 述
在 水 溶 液 中 , EDTA 同 时 以 H6Y2+ 、 H5Y+ 、 H4Y 、 H3Y- 、 H2Y2-、HY3-和Y4- 7种型体存在,在不同的酸度下,溶液中 EDTA主要存在的型体不同,如表6-1所示。
金属离子与氨羧配位剂配合物稳定常数的对数

金属离子与氨羧配位剂的配合物稳定常数对于理解化学反应和预测化学平衡非常重要。
本文将介绍金属离子与氨羧配位剂的配合物稳定常数的定义、影响因素以及计算方法。
一、金属离子与氨羧配位剂的配合物稳定常数的定义金属离子与氨羧配位剂通过配位键形成配合物,配合物稳定常数(K)是定量描述配合物形成的程度的常数。
金属离子与氨羧配位剂形成的配合物可以用如下的化学方程式表示:Mn+ + L ⇌ MLn+其中Mn+代表金属离子,L代表氨羧配位剂,MLn+代表金属离子与氨羧配位剂形成的配合物。
配合物稳定常数K的定义如下:K = [MLn+]/([Mn+][L])其中[MLn+]、[Mn+]和[L]分别代表配合物、金属离子和氨羧配位剂的浓度。
配合物稳定常数K的值越大,表示配合物形成的程度越高;反之,K的值越小,表示配合物形成的程度越低。
二、金属离子与氨羧配位剂的配合物稳定常数的影响因素1. 金属离子的电荷:金属离子的电荷越大,与氨羧配位剂形成的配合物稳定常数K越大。
2. 氨羧配位剂的性质:不同的氨羧配位剂有不同的配位能力,影响金属离子与氨羧配位剂形成配合物稳定常数K的大小。
3. 溶剂的性质:不同溶剂对金属离子与氨羧配位剂形成的配合物稳定常数K有不同的影响。
4. 温度:温度的升高通常会使金属离子与氨羧配位剂形成的配合物稳定常数K增大。
三、金属离子与氨羧配位剂的配合物稳定常数的计算方法金属离子与氨羧配位剂的配合物稳定常数可以通过不同的实验方法来测定,如紫外-可见光谱法、电化学法、核磁共振法等。
通过实验测定得到的数据可以计算配合物稳定常数K的值。
还可以通过计算方法来估算配合物稳定常数K的值,常用的计算方法有理论计算、量子化学计算等。
金属离子与氨羧配位剂的配合物稳定常数是描述配合物形成程度的重要物理化学常数,对于理解化学反应和应用化学平衡有着重要的意义。
通过实验测定和计算方法可以得到金属离子与氨羧配位剂的配合物稳定常数的数值,进而更深入地理解金属离子与氨羧配位剂的配合物形成规律。
4配位滴定法

•
•
•
• • •
例 例:试计算PH=9.00时(NH3- NH4+缓冲溶液),ZnY的 条件稳定常数.已知Zn (NH3)4 2 +的逐级稳定常数, k1=2.310 2 k2=2.810 2 k3= 3 . 2 10 2 β1 β2 2 k4=1.410 lgKf=16.50,溶液中游离NH3的浓 度为0.10mol/L. 解:αML =1+ 2.310 2 0.10+ 2.310 2 2.810 2 0.10 2 + 2.310 2 2.810 2 3 . 2 10 2 0.10 3 + 2.310 2 2.810 2 3 . 2 10 2 1.410 2 0.10 4 =3.10 10 5 查表得,PH=9.00时,,lg αYH =1.28 β3 β4 lgKf´= lgKf - lgαML - lg αYH =16.50- lg 3.10 10 5 - 1.28=9.73
EDTA
NiY
图11-1 EDTA各种型体的分布曲线 在pH<1的强酸性溶液中,EDTA主要以H6Y2+型体存在;在pH为 2.67~6.16的溶液中,主要以H2Y2-型体存在;在pH>10.26的碱性溶 液中,主要以Y4-型体存在。
1.2配合物在溶液中的离解平衡
络合物的形成常数 1:1型络合物
3.1原理
3金属离子指示剂
在配位滴定中,通常利用一种能与金属离子生成有色配合物的显色 剂来指示滴定终点,这种显色剂称为金属离子指示剂,简称金属指 示剂。 M+In=MIn MIn+Y=MY+In 颜色A 颜色B 颜色B 颜色A
例: 滴定前, Ca2+溶液(pH 8-10)中加入铬黑T后,溶液呈酒红色,发生如下 反应:
配位平衡与稳定常数 - 江南大学教务处

K
假定AgCl溶解后,全部转化为 [Ag(NH3)2]+
休息
休息
13
14
7.2.1配位平衡与平衡常数
7.2.1配位平衡与平衡常数
·L-1; [Ag(NH3)2+]≈0.010 mol mol· mol ·L-1 [Cl-] = 0.010 mol· mol ·L-1 [NH3] = 0.22 mol· 溶解AgCl所需要的氨水浓度为 : ·L-1 2 0.010 = 0.020 mol mol· ∴溶解0.010 mol AgCl所需氨水浓度 : 0.22 + 0.020 = 0.24 mol ·L-1 mol ·L-1氨水和1L 1mol· 1mol ·L-1 的KCN溶液,哪 例6: 6:1L 1L 6 mol· ? 个可溶解较多的 AgCl AgCl?
1
休息
5
6
1
7.2.1配ቤተ መጻሕፍቲ ባይዱ平衡与平衡常数
7.2.1配位平衡与平衡常数
Ag+ + 2NH 3 反应前c/mol ·L-1 /mol· 0.010 0.030 平衡时c/mol x ·L-1 0.010+2x /mol· [Ag(NH3)2+] K 稳= = 107.05 [Ag+] [NH3]2 = (0.010 - x)/x(0.010 + 2 x)2 ·L-1 = [Ag+] x = 8.910-6 mol mol·
休息
9
10
7.2.1配位平衡与平衡常数
7.2.1配位平衡与平衡常数
K
2 K ([ Ag(S 2O 3 ) 2 ]3 ) [ Ag(S 2O 3 ) 3 2 ][NH 3 ] 稳 2 2 K稳 [ Ag(NH 3 ) 2 ][S 2O 3 ] ([ Ag(NH 3 ) 2 ] )
金属-有机配位体配合物的稳定常数
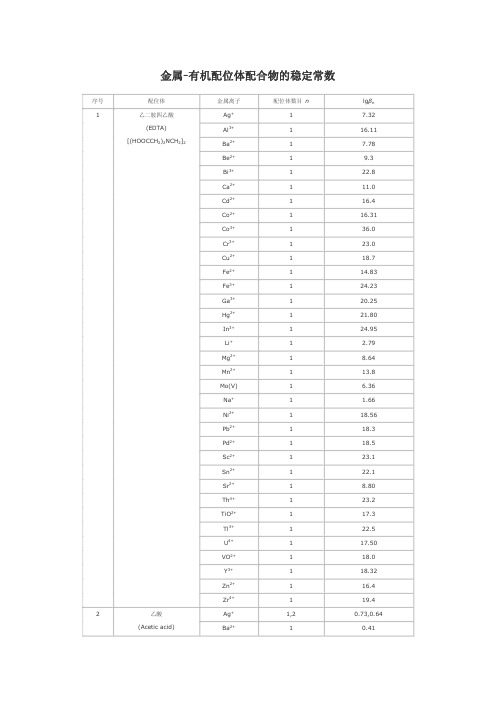
金属有机配位体配合物的稳定常数序号 配位体 金属离子配位体数目 nlg βn Ag + 1 7.32 Al 3+ 1 16.11 Ba 2+ 1 7.78 Be 2+ 1 9.3 Bi 3+ 1 22.8 Ca 2+ 1 11.0 Cd 2+ 1 16.4 Co 2+ 1 16.31 Co 3+ 1 36.0 Cr 3+ 1 23.0 Cu 2+ 1 18.7 Fe 2+ 1 14.83 Fe 3+ 1 24.23 Ga 3+ 1 20.25 Hg 2+ 1 21.80 In 3+ 1 24.95 Li + 1 2.79 Mg 2+ 1 8.64 Mn2+ 1 13.8 Mo(V)1 6.36 Na + 1 1.66 Ni 2+ 1 18.56 Pb 2+ 1 18.3 Pd 2+ 1 18.5 Sc 2+ 1 23.1 Sn 2+ 1 22.1 Sr 2+ 1 8.80 Th 4+ 1 23.2 TiO 2+ 1 17.3 Tl 3+ 1 22.5 U 4+ 1 17.50 VO 2+ 1 18.0 Y 3+ 1 18.32 Zn 2+ 1 16.4 1乙二胺四乙酸 (EDTA)[(HOOCCH 2)2NCH 2]2Zr4+ 1 19.4 Ag + 1,2 0.73,0.64 2 乙酸 (Acetic acid)Ba2+ 10.41Ca 2+ 1 0.6 Cd 2+ 1,2,3 1.5,2.3,2.4 Ce 3+ 1,2,3,4 1.68,2.69,3.13,3.18Co 2+ 1,2 1.5,1.9 Cr 3+ 1,2,3 4.63,7.08,9.60 Cu 2+ (20℃)1,2 2.16,3.20 In 3+1,2,3,4 3.50,5.95,7.90,9.08Mn 2+ 1,2 9.84,2.06 Ni 2+ 1,2 1.12,1.81 Pb 2+ 1,2,3,4 2.52,4.0,6.4,8.5 Sn 2+ 1,2,3 3.3,6.0,7.3 Tl 3+ 1,2,3,46.17,11.28,15.10,18.3Zn2+ 1 1.5 Al 3+ (30℃) 1,2 8.6,15.5 Cd 2+1,2 3.84,6.66 Co 2+ 1,2 5.40,9.54 Cr 2+ 1,2 5.96,11.7 Cu 2+ 1,2 8.27,16.34 Fe 2+ 1,2 5.07,8.67 Fe 3+ 1,2,3 11.4,22.1,26.7Hg 2+ 2 21.5 Mg 2+ 1,2 3.65,6.27 Mn 2+ 1,2 4.24,7.35 Mn 3+ 3 3.86Ni 2+ (20℃) 1,2,3 6.06,10.77,13.09Pb 2+2 6.32 Pd 2+ (30℃)1,2 16.2,27.1 Th 4+1,2,3,4 8.8,16.2,22.5,26.7 Ti 3+ 1,2,3 10.43,18.82,24.90 V 2+ 1,2,3 5.4,10.2,14.7 Zn 2+ (30℃)1,2 4.98,8.81 3 乙酰丙酮 (Acetyl acetone) CH 3COCH 2CH 3Zr4+1,2,3,48.4,16.0,23.2,30.1Ag + 1 2.41 Al 3+ 1,2,3 7.26,13.0,16.3Ba 2+ 1 2.31 Ca 2+ 1 3.0 Cd 2+ 1,2 3.52,5.77 Co 2+ 1,2,3 4.79,6.7,9.7 Cu 2+ 1,2 6.23,10.27 4 草酸 (Oxalic acid) HOOCCOOHFe2+ 1,2,32.9,4.52,5.22Fe 3+ 1,2,3 9.4,16.2,20.2Hg 2+ 1 9.66 Hg 2 2+ 2 6.98 Mg 2+ 1,2 3.43,4.38 Mn 2+ 1,2 3.97,5.80 Mn 3+ 1,2,3 9.98,16.57,19.42 Ni 2+ 1,2,3 5.3,7.64,~8.5 Pb 2+ 1,2 4.91,6.76Sc 3+ 1,2,3,46.86,11.31,14.32,16.70Th 4+ 4 24.48 Zn 2+ 1,2,3 4.89,7.60,8.15 Zr4+ 1,2,3,49.80,17.14,20.86,21.15Ba 2+ 1 0.64 Ca 2+ 1 1.42 Cd 2+ 1 1.70 Co 2+ 1 1.90 Cu 2+ 1,2 3.02,4.85Fe 3+ 1 7.1 Mg 2+ 1 1.37 Mn 2+ 1 1.43 Ni 2+ 1 2.22 Pb 2+ 1,2 2.40,3.80Sc 2+ 1 5.2 Th 4+ 1 5.5 5 乳酸 (Lactic acid) CH 3CHOHCOOHZn2+ 1,2 2.20,3.75 Al 3+ 1 14.11 Cd 2+ 1 5.55 Co 2+ 1,2 6.72,11.42 Cr 2+ 1,2 8.4,15.3 Cu 2+ 1,2 10.60,18.45 Fe 2+ 1,2 6.55,11.25 Mn 2+ 1,2 5.90,9.80 Ni 2+ 1,2 6.95,11.75 Th 4+ 1,2,3,44.25,7.60,10.05,11.60TiO 2+ 1 6.09 V 2+ 1 6.3 6 水杨酸 (Salicylic acid) C 6H 4(OH)COOHZn2+ 1 6.85Al 3+ (0.1mol/L) 1,2,3 13.20,22.83,28.89Be 2+ (0.1mol/L) 1,2 11.71,20.81 7 磺基水杨酸 (5sulfosalicylicacid)Cd 2+ (0.1mol/L)1,216.68,29.08Co 2+ (0.1mol/L) 1,2 6.13,9.82 Cr 3+ (0.1mol/L) 1 9.56 Cu 2+ (0.1mol/L) 1,2 9.52,16.45 Fe 2+ (0.1mol/L) 1,2 5.9,9.9 Fe 3+ (0.1mol/L) 1,2,3 14.64,25.18,32.12Mn 2+ (0.1mol/L) 1,2 5.24,8.24 Ni 2+ (0.1mol/L) 1,2 6.42,10.24 Zn 2+ (0.1mol/L)1,2 6.05,10.65Ba 2+2 1.62 Bi 3+3 8.30 Ca 2+ 1,2 2.98,9.01Cd 2+ 1 2.8 Co 2+ 1 2.1Cu 2+ 1,2,3,43.2,5.11,4.78,6.51Fe 3+ 1 7.49 Hg 2+ 1 7.0 Mg 2+ 2 1.36 Mn 2+ 1 2.49 Ni 2+ 1 2.06 Pb 2+ 1,3 3.78,4.7 Sn 2+ 1 5.2 8 酒石酸 (Tartaric acid) (HOOCCHOH)2Zn2+ 1,2 2.68,8.32 Ba 2+ 1 2.08 Be 2+ 1 3.08 Ca 2+ 1 2.0 Cd 2+ 1 2.2 Co 2+ 1 2.22 Cu 2+ 1 3.33 Fe 3+ 1 7.49 Hg 2+ 2 7.28 Mg 2+ 1 1.20 Mn 2+ 1 2.26 Ni 2+ 1 2.36 Pb 2+ 1 2.8 9 丁二酸(Butanedioic acid) HOOCCH 2CH 2COOHZn2+ 1 1.6 Ag + 1,2 7.4,13.1 Bi 3+ 6 11.9 Cd 2+ 1,2,3,4 0.6,1.6,2.6,4.6 Cu + 3,4 13.0,15.4 10 硫脲 (Thiourea) H 2NC(═S)NH 2Hg2+ 2,3,422.1,24.7,26.8Ag + 1,2 4.70,7.70 Cd 2+ (20℃)1,2,3 5.47,10.09,12.09 Co 2+1,2,3 5.91,10.64,13.94 Co 3+ 1,2,3 18.7,34.9,48.69Cr 2+ 1,2 5.15,9.19 Cu + 2 10.8 Cu 2+ 1,2,3 10.67,20.0,21.0 Fe 2+ 1,2,3 4.34,7.65,9.70 Hg 2+ 1,2 14.3,23.3 Mg 2+ 1 0.37 Mn 2+ 1,2,3 2.73,4.79,5.67 Ni 2+ 1,2,3 7.52,13.84,18.33Pd 2+ 2 26.90 V 2+ 1,2 4.6,7.5 11 乙二胺(Ethyoenediamine) H 2NCH 2CH 2NH 2Zn2+ 1,2,3 5.77,10.83,14.11Ag + 1,2 1.97,4.35 Cd 2+ 1,2,3,4 1.40,1.95,2.27,2.50Co 2+ 1,2 1.14,1.54 Cu 2+ 1,2,3,42.59,4.33,5.93,6.54Fe 2+ 1 0.71 Hg 2+ 1,2,3 5.1,10.0,10.4 Mn 2+ 1,2,3,4 1.92,2.77,3.37,3.50 12 吡啶 (Pyridine) C 5H 5NZn2+ 1,2,3,4 1.41,1.11,1.61,1.93Ag + 1,2 3.41,6.89 Ba 2+ 1 0.77 Ca 2+ 1 1.38 Cd 2+ 1,2 4.74,8.60 Co 2+ 1,2,3 5.23,9.25,10.76 Cu 2+ 1,2,3 8.60,15.54,16.27Fe 2+ (20℃) 1,2 4.3,7.8 Hg 2+1,2 10.3,19.2 Mg 2+ 1,2 3.44,6.46 Mn 2+ 1,2 3.6,6.6 Ni 2+ 1,2,3 6.18,11.14,15.0Pb 2+ 1,2 5.47,8.92 Pd 2+ 1,2 9.12,17.55 13 甘氨酸 (Glycin) H 2NCH 2COOHZn2+ 1,2 5.52,9.96 Cd 2+ 1,2,3 9.00,9.00,16.6014 2甲基8羟基喹啉 (50%二噁烷)Ce3+ 17.71Cu 2+ 1,2 12.48,24.00 Fe 2+ 1,2 8.75,17.10 Mg 2+ 1,2 5.24,9.64 Mn 2+ 1,2 7.44,13.99 Ni 2+ 1,2 9.41,17.76 Pb 2+ 1,2 10.30,18.50 UO2 2+ 1,2 9.4,17.0 Zn 2+ 1,2 9.82,18.72。
实验十一 配位化合物的组成和稳定常数的测定

配位化合物的组成和稳定常数的测定
随着科学技术的发展,配合物在科学研究和生产实践中显示出越来越重要的意义, 配合物不仅在化学领域里得到广泛的应用,并且对生命现象也具有重要的意义。人体内 各种酶(生物催化剂)的分子几乎都含有以配合状态存在的金属元素。配位化学与有 机、分析等化学领域以及生物化学、药物化学、化学工业都有着密切的关系,应 用非常广泛。 配位化学的研究有一整套的物理实验方法,如测定稳定常数可以采用 pH 法、电位 法、极谱法、分光光度法、溶剂萃取法、离子交换法等,这些方法对于配合物的组成、 结构和构象的研究是十分有效的。 我国化学家陈荣悌还报道了利用高效液相色谱法来测 定配位化合物稳定常数的新方法。 从上世纪 40 年代起,人们开始涉足于生物配合物的研究,陆续报道了各种生命金 属与各种 α-氨基酸、生物配体、羧肽酶和碳酸酐酶配合物的稳定常数。从这些研究中得 到了许多有关生物配体的新信息。到了 60 年代,配合物的研究方法又有了新的发展。 一方面出现了全新的物理方法, 如 M?ssbauer(穆斯堡尔)谱; 另一方面对原有的方法作了 改进,研究范围进一步扩大,如 Raman(拉曼)光谱采用了激光源,提高了光谱强度,使 有色配合物的研究成为可能;核磁共振谱因位移试剂的应用,提高了分辨率。这些方法 被应用于生物体内酶的结构和催化反应的研究以及化学模拟的研究。
3.测定吸光度 在 500nm 波长下分别测定上述溶液的吸光度,将所得数据记录于表 11-1。以吸光 度对磺基水杨酸的摩尔分数作图。 从所得的等摩尔系列图中找出最大吸收处的的配位体摩尔分数(XL)和金属离子摩 尔分数(1-XL) ,由公式(1)计算得配合物的组成;由公式(2)计算得配合物的解离 度;据公式(3)计算得配合物的表观稳定常数。
' K稳
2-知识点2:配位平衡及平衡常数.

Kf为配合物的稳定常数,Kf值越大,配离子越稳定 。
2. 不稳定常数 [Cu(NH ) ]2+ 3 4
K d
Cu2+ +4NH3
c(Cu 2 ) c 4 (NH3 ) c[Cu(NH3 ) 4 2 ]
Kd为配合物的不稳定常数或解离常数。Kd 值越大表示配离
子越容易解离,即越不稳定。
职业教育应用化工技术专业教学资源库《化工产品检验》课程
承担院校
宁波职业技术学院
配位平衡
[Cu(NH3)4]SO4· H2O = [Cu(NH3)4]2++SO42-+H2O NaOH Cu(OH)2
Na2S 有黑色CuS生成
无Cu2+ ???
有Cu2+
1 配位平衡常数
1. 稳定常数
K f c[Cu(NH3 ) 4 ] c(Cu 2 ) c 4 ( NH3 )
Kn
c (MLn) n c (M) c (L)
最后一级累积稳定常数就是配合物的总的 稳定常数
.
例:比较0.10mol· L-1[Ag(NH3)2]+溶液和含有0.2mol· L-1NH3的 0.10mol· L-1[Ag(NH3)2]+溶液中Ag+的浓度。 解:设0.10mol· L-1[Ag(NH3)2]+溶液中Ag+的浓度为x mol· L-1。根 据配位平衡,有如下关系 Ag+ + 2NH3 [Ag(NH3)2]2+ 起始浓度/mol· L-! 0 0 0.1 平衡浓度/mo1· L-1 x 2x 0.1-x 由于c(Ag+)较小,所以(0.1-x)mol· L-!≈0.1mol·L-!,将平衡浓度 代入稳定常数表达式得:
配位化合物的稳定性

K稳Biblioteka =[Ag(NH3)2+ ] [Ag
+
]
[NH3]
2
=
1.7× 107
[Ag+ ]
=
=
[Ag(NH3)2+ ] 1.7× 10
7
[NH3]
2
0.02 1.7× 107 (0.96)2 1.28× 10-9mol.L-1
=
Question
100毫升1mol.L-1NH3中能溶解固体AgBr多少克?
+
-
=
[Ag(NH3)2]+ [Br-] [Ag+] [NH3]2 [Ag+]
= Ksp.K稳
AgCl
NH3
[Ag(NH3)2]+
3-
KBr
AgBr Ag2S
Na2S2O3
[Ag(S2O3)2]
Na2S
三、配合平衡与氧化还原平衡
2Fe
3+
+ 2I
-
2Fe
2+
+ I2
2Fe +
3+
+
2I
-
2Fe2+
解离方向移动,导致配合物稳定性下降的现象,称为金属离
子的水解效应。
二、配合平衡与沉淀-溶解平衡
AgBr + 2 NH3
[Ag(NH3)2]+ +
Br-
K=
?
AgBr Ag+ + 2NH3
Ag+
+
Br[Ag(NH3)2]+
总反应 AgBr + 2 NH3 [Ag(NH3)2]+ + Br-
K=
[Ag(NH3)2] [Br ] [NH3]2
配位化合物的稳定性

Question
[Ag( 计算[Ag(NH3)2]+ + eAg + 2 NH3
体系的标准电极电势. 体系的标准电极电势
[Ag( 1.7× [Ag(NH3)2+]的K稳=1.7×107;
φ
Ag+/Ag Ag+/Ag +/
=0.81V
在平衡时,解离出Ag 的浓度。 解:首先计算,Ag(NH3)2+在平衡时,解离出Ag+的浓度。 首先计算,Ag( [Ag( Ag+ + 2 NH3 = [Ag(NH3)2]+
[Ag+] 0.81+0.0592lg5.9× =0.81+0.0592lg5.9×10-8 =0.38V
从计算结果可以看出当简单离子配位以 后,其标准电极电势一般变小,因而使简单 其标准电极电势一般变小, 离子得电子的能力减弱,不易被还原为金 离子得电子的能力减弱, 属,增加了金属离子的稳定性。 增加了金属离子的稳定性。
[Fe(NCS)6]
3-
+ 6F-
[FeF6]
3-
+ 6SCN-
[Cu(NH3)4]2+
+
EDTA
?
Question
毫升0.04mol.L-1AgNO3溶液中,加入 毫升 mol.L-1NH3, 溶液中,加入1毫升 毫升2 在1毫升 毫升 计算在平衡后溶液中Ag 浓度。 计算在平衡后溶液中 +浓度。
=
Question
100毫升1mol.L-1NH3中能溶解固体AgBr多少克?
AgBr + 2 NH3
[Ag(NH3)2]
+
+
Br
-
(K稳[Ag(NH3)2+]=1.7×107,Ksp(AgBr)=7.7×10-13) × × ( ) + = ( )=
(整理)配合物稳定常数

配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。
配位化学:配合物在溶液中的稳定性

硬酸是指外层电子结合得紧的金属离子或原子。
特征:体积小,电荷高,不易极化。
如: H+ 、Mg2+ 、Al3+
软酸是指外层电子结合得松的金属离子或原子。
特征:体积大,电荷低,易于极化。
如:Cu+ 、 Ag+ 、 Au+
交界酸:介于两者之间的金属离子。
31
32
硬碱是指对外层电子结合得紧的一类路易斯碱。 特征:变形性小,电负性大,不易失去电子。 如: F- 、 OH-
[Cu(NH3)4]2+
反应平衡常数为
Cu2+ + 4NH3
K
[Cu 2 ][NH3 ]4 [Cu(NH 3 )42 ]
K称为[Cu(NH3)4]2+的不稳定常数,用K不稳表示。 K不稳越大, [Cu(NH3)4]2+越容易离解,配离子越不稳定。
1 K稳 K不稳
铜氨配离子的形成过程
10
2. 逐级稳定常数
lgk1 13.62 8.54 7.17 6.40 6.10
稳定性顺序为: Li > Na > K > Rb > Cs
Be > Mg > Ca > Sr > Ba
19
电子构型不同,离子半径相近的中心离子,其配 合物稳定性相差很大;
例:[Mg(EDTA)] [Cu(EDTA)]
lgK稳=8.64 lgK稳=18.70
1
配合物在溶液中的稳定性
一、 稳定常数的表示方法
1.稳定常数K稳
2. 逐级稳定常数 3 .累积稳定常数
二、影响配合物在溶液中稳定性的因素
1.中心离子的性质对配离子稳定性的影响 2. 配体性质对配合物稳定性的影响 3. 软硬酸原则与配合物稳定性的关系
溶解度与配位化合物的稳定常数

溶解度与配位化合物的稳定常数溶解度是指在特定温度下溶液中最大可溶解的物质的量,通常以摩尔溶解度表示。
而配位化合物指的是由中心金属离子与配位体形成的具有特定结构和性质的化合物。
溶解度与配位化合物的稳定常数之间存在一定的关联,本文将通过分析这一关联来探讨它们之间的相互影响。
一、溶解度的影响因素溶解度受溶质与溶剂之间相互作用力的影响,主要与以下因素有关:1. 构成物质的特性:溶质的化学性质、分子结构以及离子半径大小等都会影响其在特定条件下的溶解度。
2. 温度:溶解度随温度的升高而增大,因为在较高温度下,溶质分子具有更大的热运动能力,更易克服溶剂的吸引力而溶解。
3. 压强:对于气体溶解于液体的情况,Henry定律可以描述气体溶解度与压强之间的关系。
溶液中溶解度随压强的增大而增大。
二、配位化合物的稳定常数配位化合物的稳定常数(K)是描述配位反应的平衡性质,定义为配位物稳定形成配合物的速率常数与离解配合物的速率常数之比。
稳定常数越大,配合物的稳定性越强。
1. 配位物与反应物的浓度关系:在一定条件下,稳定常数可以用反应物的浓度比来表示,即K = [配合物]/[反应物]。
浓度比越大,稳定常数越大,表示配合物形成的速率相对较快。
2. 金属离子的价态和配体的性质:配位化合物的稳定性与金属离子的价态和配体的性质密切相关。
通常来说,价态较高的金属离子形成的配合物较稳定。
而配体的性质如配体中的氧原子数量、配体的电荷等因素也会影响配合物的稳定常数。
三、溶解度与配位化合物的关联1. 离解平衡反应与溶解度:对于某些配位化合物在水溶液中的溶解过程,其离解平衡反应与溶解度之间存在关联。
溶解度较大的化合物,在水中离解形成的离子浓度较高;而溶解度较小的化合物,在水中离解形成的离子浓度较低。
2. 配位离解平衡与稳定常数:配位离解平衡反应是指配位物中配体与金属离子之间的配位键断裂。
稳定常数与配位离解平衡常数(Kd)成反比。
稳定常数越大,配合物越稳定,离解平衡越难发生,溶解度越小。
络合物稳定常数一览表

络合物稳定常数一览表络合物稳定常数是指在一定温度下,化合物中金属离子和配体结合形成络合物时,反应达到平衡时的稳定程度。
络合物是指金属离子和一个或多个配位基团形成的化合物,通常以MLn的形式表示,其中M表示金属离子,L表示配位基团,n表示配位基团的数目。
络合物稳定常数通常表示为Kf,它是一个无量纲的数值。
它的大小取决于金属离子和配位基团之间的亲和力以及它们结合的平衡。
络合物稳定常数越大,表示金属离子和配位基团形成的络合物更为稳定。
以下是一些常见的金属离子与配位基团形成的络合物的稳定常数及其相关参考内容:1. 铁离子与1,10-邻菲罗啉络合物稳定常数-Kf = 10^20.9参考内容:Inorganic Chemistry, Fourth Edition, Catherine Housecroft and Alan G. Sharpe.2. 铜离子与乙二胺四乙酸络合物稳定常数-Kf = 10^18.7参考内容:Chemistry: The Central Science, Twelfth Edition, T. L. Brown, et al.3. 镍离子与乙二胺四乙酸络合物稳定常数-Kf = 10^16.7参考内容:Advanced Inorganic Chemistry, Sixth Edition, F. A. Cotton and G. Wilkinson.4. 钙离子与乙二胺四乙酸络合物稳定常数-Kf = 10^10.6参考内容:Chemistry: The Molecular Nature of Matter and Change, Sixth Edition, M. S. Silberberg.5. 镧系金属离子与EDTA络合物稳定常数-Kf = 10^18-27参考内容:Inorganic Chemistry, Fifth Edition, Gary L. Miessler, et al.6. 银离子与氰化物络合物稳定常数-Kf = 10^16.5参考内容:Chemistry, Fifth Edition, John E. McMurry and Robert C. Fay.络合物稳定常数对于理解金属离子和配位基团之间的相互作用非常重要。
