配合物稳定常数
配合物的稳定常数

4—1、配合物的稳定常数 、 1.稳定常数 ------K f 稳定常数
Ag
+
θ
NH3H2O
Ag2O (黑褐色)
Cl -
这一实验结果 说明溶液中存在游 NH3H 离的Ag . 离的2O +Ag(NH3)2+
无 A gC l
+
I-
AgI
H 2S
Ag 2 S
既存在 Ag
[CN − ] = x = 3.47 × 10 −3 (mol ⋅ dm −3 )
2.50 × 0.40 = x2
解得: 解得: 显然AgI可以很好地 溶解在 溶解在KCN溶液中。 溶液中。 显然 溶液中 6.配位平衡与氧化还原平衡 配位平衡 ——计算形成配合物 ——计算形成配合物的衍生电极电势 [例9—12] 计算 例
0. 1 = 2 x
解得: 解得:
[Cu 2+ ] = 1.29 × 10 −10 (mol ⋅ dm −3 )
同理解得
0.10mol ⋅ dm −3Cu (en) 2+ 2
[Cu 2+ ] = 8.5 × 10 −8 mol ⋅ dm −3
显然稳定性: 显然稳定性
Cu(EDTA)2-﹥ Cu(en)22+
0.0591
因此
而K =
3+ 3 )6
3+ 2+ 3 ) 6 / Co ( NH 3 ) 6
= 0.056(V )
(2)假设 )假设Co(NH3)6 中与空气中的O 发生如下反应: 中与空气中的 2发生如下反应:
3、配位平衡 与电离平衡 、 θ θ − − − K θ 与K a 或K θ 与K b之间的关系 f f
配合物条件稳定常数计算公式

配合物条件稳定常数计算公式配合物是指两种或两种以上物质组成的化合物,其中包含有多种不同的原子或分子,通常表示为AXn的形式,其中A表示核心物质,X表示配体,n表示配体的数量。
配合物的稳定性取决于其条件稳定常数的大小,条件稳定常数(Condition Stability Constant,简称Kc)是指在一定温度下,配合物在平衡状态下,各组分浓度之比的乘积与平衡常数之比。
计算配合物条件稳定常数的公式如下:Kc = [AXn]c / ([A]c [X]c^n)其中,[AXn]c表示配合物浓度,[A]c表示核心物质浓度,[X]c表示配体浓度,n表示配体的数量。
例如,计算铁蓝蛋白(Fe(III)Tptz)的条件稳定常数:Fe(III)Tptz的结构式为Fe(III)(Tptz)3,则Kc = [Fe(III)(Tptz)3]c / ([Fe(III)]c [Tptz]c^3)如果[Fe(III)(Tptz)3]c = 0.1 mol/L,[Fe(III)]c = 0.2 mol/L,[Tptz]c = 0.3 mol/L,则Kc = 0.1 / (0.2 * (0.3^3)) = 0.025根据条件稳定常数的大小可以判断配合物的稳定性。
如果Kc大于1,则配合物相对稳定;如果Kc小于1,则配合物相对不稳定。
在实际应用中,条件稳定常数是一个很重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。
例如,在配合物的合成过程中,如果想要获得稳定的配合物,就可以通过控制反应条件,使得条件稳定常数达到较大的值;如果想要解除配合物,就可以通过改变反应条件,使得条件稳定常数达到较小的值。
总之,配合物条件稳定常数是一个重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。
27、何谓配合物的稳定常数

何谓配合物的稳定常数
在溶液中,金属离子M n+与配位剂Y 4
的配位反应如下:
M n+ + Y 4 ⇌ M Y n-4 当配位反应达到平衡时:K My =]
][[][44-+-Y M MY n n 式中:][4-n MY ——金属离子与EDTA 形成的配合物的浓度;
[Y 4-]——未配位的EDTA 阴离子的浓度;
[M n+
]——未配位的游离的金属离子的浓度。
K My 是配合物的稳定常数,也叫形成常数。
配合物的稳定常数越大,表示形成的配合物越稳定。
由于稳定常数只考虑了溶液中金属离子(M n+)、配位剂阴离子(Y 4)和配合物(MY n-4)三者之间的平衡关系,没有考虑酸度等因素对配位平衡的影响,因此,它不能说明配合物的实际稳定程度。
配合物的稳定常数的数值通常很大,为了方便,常用其对数值表示。
例如: 69.842210]
][[][2==-+--Y Mg MgY K MgY 69.8lg 2=-MgY。
配合物的稳定常数的测定

配合物的组成和不稳定常数的测定(物理化学 李俊)一、目的要求1. 掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2. 通过实验,掌握测量原理和分光光度计的使用方法, 二、实验原理1,用等摩尔连续递变法测定配合物的组成“递变法” 实际上是一种物理化学分析方法。
可用来研究当两个组分混合时, 是否发生化 合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是 :在保持总浓度不变的前提 下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
在本实验中就是测定不同摩尔分数时溶液的光密度值 D ,作光密度对摩尔分数的曲线 图,如图 3- 1,所示。
从曲线上光密度的极大值 D 极大所对应的摩尔分数值,即可求出配位数n 值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子 M 溶液和配位体 L 溶液。
在维持总体积不变的条件下, 按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔 分数之比。
若溶液中只有配合物 MLn 具有颜色,则溶液的 D 与 MLn 的含量成正比。
从 D-X 图上曲线 的极大位置即可直接求出 n ,但当配制成的溶液中除配合物外, 尚有金属离子 M 及配位体 L 与配合物在同一波长 λ最大 下也存在一定程度的吸收时,所观察到的光密度 D 并不完全由配 合物 MLn 的吸收所引起, 必须加以校正。
所以选择适当的波长范围, 仅使配合物设X L 为D极大时L 溶液的体积分数M 溶液的体积分数为 则配合物的配MLn 有吸收,M 和L 都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn ,溶液的光密度值 D 不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值 D 趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M 完全配合时的配合物浓度)。
配位物的稳定常数

配位物的稳定常数
配位物的稳定常数是指配离子在溶液中形成时,配位原子(金属离子)和它所结合的原子(配位体)之间化学键的强度。
配位物的稳定性通常用它的稳定常数来衡量,它代表配位物的稳定性,同时也是配位物形成平衡的平衡常数。
因此,配位物的稳定常数也可以用配离子的稳定常数或不稳定常数来表示。
同类型配位物的稳定性可以通过比较它们的稳定常数来确定。
配位物的稳定常数可以通过多种方法来计算,例如平衡常数法、电离平衡法、速率方程法等。
同时,配合物的稳定性也与沉淀之间转化的可能性有关,因为配离子的稳定性直接决定了它们与沉淀之间转化的可能性。
对于具体的配位物来说,其稳定性可以通过加入不同的电解质或其他物质来进行实验研究。
例如,对于Ag(CN)2-和Ag(NH3)2+,可以通过加入NaOH或Na2S来观察是否有Cu(OH)2或CuS沉淀生成,从而判断它们的稳定性。
此外,一些无机化合物的稳定性也可以通过软酸与软碱、硬酸与硬碱的化合物稳定性的概念进行研究,例如软酸Cu易与软碱CN生成稳定的配合物。
配合物稳定常数

配合物稳定常数————————————————————————————————作者:————————————————————————————————日期:ﻩ配合物稳定常数Stability Constants of Coordination Compounds络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I ≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数Stability Constants ofMetalIon-InorganicCoordinationCompounds序号(No.) 配位体(Ligand)金属离子(Metalion)配位体数目n(Number of ligand)lgβn1NH3Ag+ 1,2 3.24,7.05Au3+ 4 10.3Cd2+1,2,3,4,5,6 2.65,4.75,6.19,7.12,6.80,5.14Co2+1,2,3,4,5,6 2.11,3.74,4.79,5.55,5.73,5.11Co3+1,2,3,4,5,6 6.7,14.0,20.1,25.7,30.8,35.2Cu+1,2 5.93,10.86Cu2+1,2,3,4,5 4.31,7.98,11.02,13.32,12.86Fe2+1,21.4,2.2Hg2+1,2,3,4 8.8,17.5,18.5,19.28Mn2+1,2 0.8,1.3Ni2+1,2,3,4,5,62.80,5.04,6.77,7.96,8.71,8.74Pd2+1,2,3,4 9.6,18.5,26.0,32.8Pt2+ 6 35.3Zn2+1,2,3,4 2.37,4.81,7.31,9.462 Br-Ag+1,2,3,4 4.38,7.33,8.00,8.73Bi3+1,2,3,4,5,6 2.37,4.20,5.90,7.30,8.20,8.30Cd2+1,2,3,4 1.75,2.34,3.32,3.70,Ce3+10.42Cu+ 2 5.89Cu2+10.30Hg2+1,2,3,49.05,17.32,19.74,21.00In3+1,2 1.30,1.88Pb2+1,2,3,4 1.77,2.60,3.00,2.30Pd2+1,2,3,4 5.17,9.42,12.70,14.90Rh3+2,3,4,5,6 14.3,16.3,17.6,18.4,17.2Sc3+1,2 2.08,3.08Sn2+1,2,3 1.11,1.81,1.46Tl3+1,2,3,4,5,6 9.7,16.6,21.2,23.9,29.2,31.6U4+ 1 0.18Y3+ 1 1.323Cl-Ag+1,2,4 3.04,5.04,5.30Bi3+1,2,3,42.44,4.7,5.0,5.6Cd2+1,2,3,4 1.95,2.50,2.60,2.80Co3+11.42Cu+2,3 5.5,5.7Cu2+1,20.1,-0.6Fe2+ 1 1.17Fe3+29.8Hg2+1,2,3,4 6.74,13.22,14.07,15.07In3+1,2,3,4 1.62,2.44,1.70,1.60Pb2+1,2,3 1.42,2.23,3.23Pd2+1,2,3,4 6.1,10.7,13.1,15.7Pt2+2,3,4 11.5,14.5,16.0Sb3+1,2,3,4 2.26,3.49,4.18,4.72Sn2+1,2,3,41.51,2.24,2.03,1.48Tl3+1,2,3,48.14,13.60,15.78,18.00Th4+1,21.38,0.38Zn2+1,2,3,4 0.43,0.61,0.53,0.20Zr4+1,2,3,40.9,1.3,1.5,1.24 CN-Ag+2,3,4 21.1,21.7,20.6Au+ 2 38.3Cd2+1,2,3,45.48,10.60,15.23,18.78Cu+2,3,4 24.0,28.59,30.30Fe2+635.0Fe3+ 6 42.0Hg2+ 4 41.4Ni2+431.3Zn2+1,2,3,4 5.3,11.70,16.70,21.605F-Al3+1,2,3,4,5,6 6.11,11.12,15.00,18.00,19.40,19.80Be2+1,2,3,4 4.99,8.80,11.60,13.10Bi3+ 1 1.42Co2+ 1 0.4Cr3+1,2,3 4.36,8.70,11.20Cu2+10.9Fe2+10.8Fe3+1,2,3,5 5.28,9.30,12.06,15.77Ga3+1,2,3 4.49,8.00,10.50Hf4+1,2,3,4,5,69.0,16.5,23.1,28.8,34.0,38.0Hg2+1 1.03In3+1,2,3,4 3.70,6.40,8.60,9.80Mg2+1 1.30Mn2+1 5.48Ni2+10.50Pb2+1,2 1.44,2.54Sb3+1,2,3,4 3.0,5.7,8.3,10.9Sn2+1,2,3 4.08,6.68,9.50Th4+1,2,3,48.44,15.08,19.80,23.20TiO2+1,2,3,4 5.4,9.8,13.7,18.0Zn2+10.78Zr4+1,2,3,4,5,69.4,17.2,23.7,29.5,33.5,38.36I-Ag+1,2,3 6.58,11.74,13.68Bi3+1,4,5,6 3.63,14.95,16.80,18.80Cd2+1,2,3,4 2.10,3.43,4.49,5.41Cu+28.85Fe3+11.88Hg2+1,2,3,412.87,23.82,27.60,29.83Pb2+1,2,3,42.00,3.15,3.92,4.47Pd2+424.5Tl+1,2,30.72,0.90,1.08Tl3+1,2,3,411.41,20.88,27.60,31.82 7OH-Ag+1,22.0,3.99Al3+1,49.27,33.03As3+1,2,3,414.33,18.73,20.60,21.20Be2+1,2,39.7,14.0,15.2Bi3+1,2,412.7,15.8,35.2Ca2+11.3Cd2+1,2,3,4 4.17,8.33,9.02,8.62Ce3+14.6Ce4+1,213.28,26.46Co2+1,2,3,4 4.3,8.4,9.7,10.2Cr3+1,2,410.1,17.8,29.9Cu2+1,2,3,47.0,13.68,17.00,18.5Fe2+1,2,3,45.56,9.77,9.67,8.58Fe3+1,2,311.87,21.17,29.67Hg2+1,2,310.6,21.8,20.9In3+1,2,3,410.0,20.2,29.6,38.9Mg2+12.58Mn2+1,3 3.9,8.3Ni2+1,2,34.97,8.55,11.33Pa4+1,2,3,414.04,27.84,40.7,51.4Pb2+1,2,37.82,10.85,14.58Pd2+1,213.0,25.8Sb3+2,3,424.3,36.7,38.3Sc3+18.9Sn2+110.4Th3+1,212.86,25.37Ti3+112.71Zn2+1,2,3,4 4.40,11.30,14.14,17.66Zr4+1,2,3,414.3,28.3,41.9,55.38NO3-Ba2+10.92Bi3+1 1.26Ca2+10.28Cd2+10.40Fe3+1 1.0Hg2+10.35Pb2+11.18Tl+10.33Tl3+10.929P2O74-Ba2+14.6Ca2+1 4.6Cd3+15.6Co2+1 6.1Cu2+1,26.7,9.0Hg2+212.38Mg2+1 5.7Ni2+1,2 5.8,7.4Pb2+1,27.3,10.15Zn2+1,28.7,11.010SCN-Ag+1,2,3,44.6,7.57,9.08,10.08Bi3+1,2,3,4,5,6 1.67,3.00,4.00,4.80,5.50,6.10Cd2+1,2,3,41.39,1.98,2.58,3.6Cr3+1,21.87,2.98Cu+1,212.11,5.18Cu2+1,2 1.90,3.00Fe3+1,2,3,4,5,6 2.21,3.64,5.00,6.30,6.20,6.10Hg2+1,2,3,49.08,16.86,19.70,21.70Ni2+1,2,3 1.18,1.64,1.81Pb2+1,2,30.78,0.99,1.00Sn2+1,2,31.17,1.77,1.74Th4+1,21.08,1.78Zn2+1,2,3,41.33,1.91,2.00,1.6011S2O32-Ag+1,28.82,13.46Cd2+1,2 3.92,6.44Cu+1,2,310.27,12.22,13.84Fe3+1 2.10Hg2+2,3,429.44,31.90,33.24Pb2+2,35.13,6.35 12SO42-Ag+11.3Ba2+1 2.7Bi3+1,2,3,4,51.98,3.41,4.08,4.34,4.60Fe3+1,2 4.04,5.38Hg2+1,21.34,2.40In3+1,2,31.78,1.88,2.36Ni2+1 2.4Pb2+12.75Pr3+1,2 3.62,4.92Th4+1,23.32,5.50Zr4+1,2,3 3.79,6.64,7.77ﻬ金属-有机配位体配合物的稳定常数(表中离子强度都是在有限的范围内,I≈0。
紫外光谱法测定配合物的稳定常数

紫外光谱法测定配合物的稳定常数
定义配合物组成及其稳定常数的测定定量分析结构分析定性分析
应用范围定义紫外光谱是分子中某些价电子吸收了一定波长的电磁波,由低能级跃近到高能级而产生的一种光谱,也称之为电子光谱编辑本段原理
当分子中的电子吸收能量后会从基态跃迁到激发态,然后放出能量(辐射出特征谱线)。
回到基态而辐射出特征普线的波长在紫外区中就叫做紫外光谱目前使用的紫外光谱仪波长范围是200~800nm.其基本原理是用不同波长的近紫外光(200~400nm)依次照一定浓度的被测样品溶液时,就会发现部分波长的光被吸收。
如果以波长入为横坐标(单位nm),吸收度(absorbance)A 为纵坐标作图即得到紫外光谱(ultra violet spectra,简称UV)编辑本段应用范围
定性分析在有机化合物的定性分析中,紫外一可见光谱适用于不饱和有机化合物,尤其是共钜体系的鉴定,以此推断未知物的骨架结构。
此外,可配合红外光谱、核磁共振波谱法和质谱法进行定性鉴定和结构分析,因此它仍不失为是一种有用的辅助方法。
一般有两种定性分析方法,比较吸收光谱曲线和用经验规则计算最大吸收波长amax,然后与实测值进行比较。
1。
2013-第五章--配合物的稳定性

与反应对应的形成常数叫逐级稳定常数,分别用
k1、k2、k3和 k4表示。
K稳=k1·k2·k3·k4
lg
K稳=Klgfθ1k1+lgk2+lgk3+lgk4
2. 稳定常数的应用
① 判断配位反应进行的方向
Ag(NH3)2+ +2CN -
Ag(CN)2- + 2NH3
查表求
Kf Ag(NH3)2+ = 1.7×107 Kf Ag(CN)2- = 1.0×1021
5-1. 配合物的稳定常数 1.配合物的稳定常数和不稳定常数
稳定常数:
Cu2++4NH3
Cu(NH3)42+
K稳=
[Cu(NH3)42+] [Cu2+][NH3]4
不稳定常数: Cu(NH3)42+ Cu2++4NH3
1 K不稳 = ——
K稳
K不稳= [Cu2+][NH3]4 [Cu(NH3)42+]
K = 5.8×1013平衡常数很大,说明上述反应很完全。
② 计算溶液中有关离子的浓度
③ 讨论难溶盐生成或溶解的可能性
④ 计算电极电势
① 判断配位反应进行的方向
Ag(NH3)2+ +2CN -
Ag(CN)2- + 2NH3
可以看作是 下列两个反 应的总和:
Ag(NH3)2+ Ag++2CN-
Ag++2NH3 Kd Ag(NH3)2+ Ag(CN)2- Kf Ag(CN)2-
[Cu(H2O)3NH3]2+ + H2O
[Cu(H2O)3NH3]2+ + NH3
[Cu(H2O)2(NH3)2]2+ + H2O
2.2.3.2 认识配合物的稳定性

[H6Y 2 ] [H5Y ] [Y 4 ] [NY ] [Y 4 ] [Y 4 ]
[Y 4 ]
[Y 4 ]
[Y 4 ]
Y Y(H) Y(N) 1
(2)金属离子的副反应和副反应系数
M的副反应:辅助配位效应
羟基配位效应 配位效应
学习情境三:铅铋合金中 铅铋的分析
二、 配合物稳定常数
1. 稳定常数(形成常数)
Cu2 4NH3
[Cu(NH3 )4 ]2
K稳
[Cu(NH3)24 ] [Cu2 ][NH3]4
K 稳 :配合物的稳定常数
。
K稳值越大,配离子越稳定。
2. 不稳定常数(离解常数)
[Cu(NH3 )4 ]2
1.66 Ca2+ 10.69 Zn2+ 16.50 Th4+ 23.2
Li+
2.79 Mn2+ 14.04 Pb2+ 18.04 Cr3+ 23.4
Ag+
7.32 Fe2+ 14.33 Ni2+ 18.67 Fe3+ 25.1
Ba2+
7.76 Ce3+ 15.98 Cu2+ 18.80 V3+
25.90
107.31 103.00 109.46 104.00 3.1105
pH
11 lg Zn(0H )
5.4
, Zn(OH )
2.5 105
Zn Zn(NH3 ) Zn(OH ) 1 5.6 105
(3)条件稳定常数(表观稳定常数,有效稳定
Sr2+
8.63 Co2+ 16.3 Hg2+ 21.8 Bi3+ 27.94
(整理)配合物稳定常数

配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。
配合物稳定常数
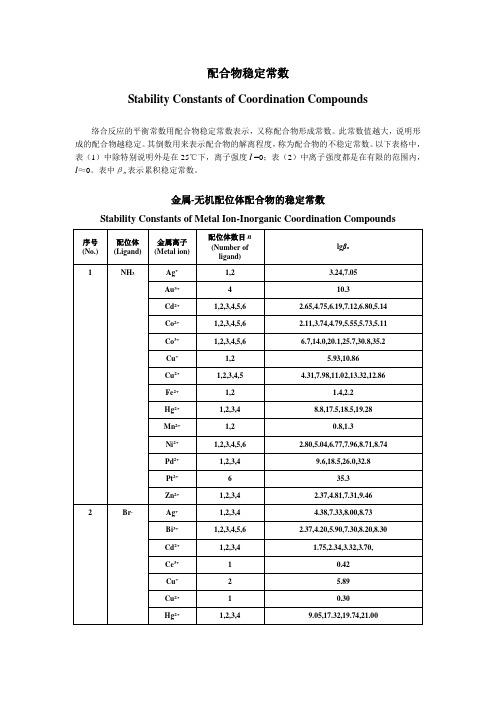
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值lgαY(H) Values of EDTA。
配合物的不稳定常数和稳定常数

多齿配体──与中心离子结合(配位)的配 位原子不止一个的配位体称多齿配体。如: 乙 二 胺 ( * NH2─CH2─CH2─H2N* ) ( 双 齿 配 体)、氨基三乙酸( * N(CH3COO*H)3 ) ( 四齿 酸体 ) 、 EDTA (四乙酸乙二胺)(六齿配体) 二、配位数 4与中心原子结合的配位原子的数 O 目称为中心原子的配位数。如: O 配位数= 配位原子数 2+:Cu2+的配位数是4 [Cu(NH ) ] 3 4 C—CH2—N—CH2—CH2—N—CH2—C 单齿配体: [Fe(H2O)6]3+:Fe3+的配位数是6。 O =配体数 O 配位数 3-:Co3+的配位数是 [Co(en) ] 2 6。 3 2 双齿配体: 一般说来,金属离子的半径越大, 配位数=配体数× 2(Y4-)的结构简式 EDTA 电荷越高,配位数越大。
§1 §2 §3 §4
配体的 分类
单齿配体──指只有一个配位原子的配体。 如NH3、H2O、卤离子等
三、配合物的 中心原子 配合物依 据中心原 子的分类
提供空价电子轨道与配位体形成配位 键的金属离子可原子称为配合物的形 成体(又称中心离子或中心原子)。
单核配合物──只有一个中心原子的配合物 称单核配合物。如 [Cu(NH3)4]SO4 多核配合物──含有不止一个中心原子的 配合物称多核配合物。
解得: x=1.28×10-9 (mol·L-1) 答:溶液中Ag+离子的平衡浓度是1.28×10-9 mol·L-1
§1 §2 §3 §4
三、讨论难溶 盐生成或溶解 的可能性 例2 解: <1> AgBr <2> Ag++2NH3 <1>+<2>得: AgBr+2NH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值lgαY(H) Values of EDTA。
