高中一轮复习:弱电解质的电离
2025年高考化学一轮复习配套课件第8章水溶液中的离子反应与平衡第1讲弱电解质的电离平衡

第1讲 弱电解质的电离平衡
内
容
索
引
01
强基础 增分策略
02
增素能 精准突破
03
研专项 前沿命题
04
明考向 真题演练
【本章体系构建】
【课程标准】
1.从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质
和反应。
2.认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。
3.能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水
电解质分子总数的百分比。
(2)表示方法。
α=
已电离的弱电解质分子数
溶液中原有弱电解质的总分子数
×100%
(3)影响因素。
温度
升高温度,电离平衡向
右 移动,电离度
增大
同时影响电离度和 降低温度,电离平衡向 左 移动,电离度 减小
电离常数
浓度
当弱电解质溶液浓度增大时,电离度 减小 ;
电离度改变,但是电 当弱电解质溶液浓度减小时,电离度 增大
3
答案 A
解析
(CO 2(H + )
3 )·
a 2 (H2CO3)= (HC O - ) =10-10.25,实验
3
1 溶液的 pH 为 10.25,c(H+)=
+
10-10.25 mol·
L-1,则 c(HCO-3 )=c(CO2),根据电荷守恒,c(Na
)>c(HCO
3
3)
=c(CO23 ),A 正确;向混合溶液中滴几滴酚酞,加水稀释,溶液红色变浅,说明 pH
下列有关说法正确的是(
)
A.实验 1 溶液中存在:c(Na+)>c(HCO-3 )=c(CO23 )
高三一轮复习 第八章 第1讲弱电解质的电离平衡

知识梳理·题型构建
问题引导下再学习
问题一:弱电解质的电离平衡是如何建立的?
在一定条件下(如温度、压强等),当弱电解质 电离 的速率和 离子结合成分子 的速率相等时,电离过程达到了平衡。
问题二:电离平衡的特征
知识梳理·题型构建
问题引导下再学习
问题三:影响电离平衡的条件有哪些?
①内因:弱电解质本身的性质。 ②外因: 升高温度,电离平衡向 电离 方向移动,电离程 a.温度: 度 增大 ,原因是电离过程 吸热 。 加水稀释,使弱电解质的浓度减小,电离平衡 b.浓度: 向 电离 的方向移动,电离程度 增大 。 c.同离子效应: 例如:向CH3COOH溶液中加入CH3COONa固体,溶液 中c(CH3COO-) 增大 ,CH3COOH的电离平衡向 左 ,(填 “左”或“右”)移动.
-
+
2- +CO3
cH cH · cHCO3 - Ka1= cH2CO3 ,Ka2= cHCO3
-
2- · cCO3
。
⑴特点:多元弱酸的电离以第一步电离 为主,且K1>> K2 。
第一步电离产生的H+抑制第二步的电离
⑵影响因素:电离平衡常数与其他化学平衡常数一样 只与 温度 有关,与电解质的浓度无关,升高温度,K 值 增大 ,原因是电离是吸热过程 。
⑶应用:弱酸/碱的电离平衡常数能够反映酸/碱性 的 相对强弱 。K越大,电离程度 越大 ,酸/碱性 越强 。
课堂检测:
已知室温时,0.1 mol· -1某一元酸HA在水中有 L
10-5 mol· -1 L 1.0%电离,此酸的电离平衡常数为
+ - ____________。 解析 HA +A H
0.1-x x x=0.1×1.0%=10
高三化学一轮复习——弱电解质的电离
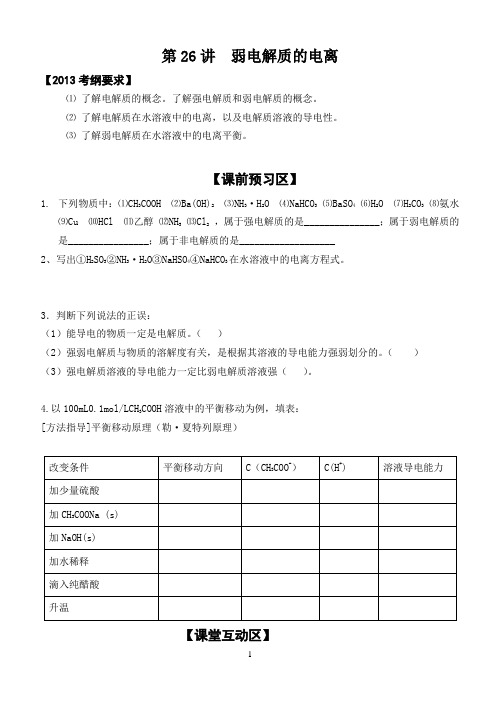
第26讲弱电解质的电离【2013考纲要求】⑴了解电解质的概念。
了解强电解质和弱电解质的概念。
⑵了解电解质在水溶液中的电离,以及电解质溶液的导电性。
⑶了解弱电解质在水溶液中的电离平衡。
【课前预习区】1.下列物质中:⑴CH3COOH ⑵Ba(OH)2⑶NH3·H2O ⑷NaHCO3 ⑸BaSO4 ⑹H2O ⑺H2CO3 ⑻氨水⑼Cu ⑽HCl ⑾乙醇⑿NH3⒀Cl2,属于强电解质的是_______________;属于弱电解质的是________________;属于非电解质的是___________________2、写出①H2SO3②NH3·H2O③NaHSO4④NaHCO3在水溶液中的电离方程式。
3.判断下列说法的正误:(1)能导电的物质一定是电解质。
()(2)强弱电解质与物质的溶解度有关,是根据其溶液的导电能力强弱划分的。
()(3)强电解质溶液的导电能力一定比弱电解质溶液强()。
4.以100mL0.1mol/LCH3COOH溶液中的平衡移动为例,填表:[方法指导]平衡移动原理(勒·夏特列原理)【课堂互动区】一、电离平衡常数常温下,有甲乙两份等体积的浓度均为0.1mol/L的氨水,pH=11。
该求该氨水的电离平衡常数及电离度_________________________________【归纳总结】(1)K a、K b反映了弱电解质的相对强弱。
(2)K a、K b、K w、K sp、K只与有关。
二、影响电离平衡的因素(见预习案中表格)【归纳总结】外界条件对弱电解质电离平衡的影响(见预习区表格)①浓度:同一弱电解质溶液,浓度越小,电离,电离度②温度:升温,电离,k ③同离子效应:电离④化学反应:电离(填“促进”or“抑制”)【例1】向冰醋酸中逐滴加水,导电能力随加水体积的变化曲线如下。
研究图中 a b c三点,探究如下问题:(1) 电离度最大的点是。
(2) n(H+)最大。
高三一轮复习 专题11 弱电解质的电离平衡

弱电解质的电离平衡1、已知0.1 mol·L -1的醋酸溶液中存在电离平衡:CH 3COOH CH 3COO -+H +,要使溶液中c (H +)/c (CH 3COOH)的值增大,可以采取的措施是( )①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水A .①②B .①③C .②④D .③④2、向V mL BaCl 2溶液中加入一定体积的0.05 mol/L 硫酸溶液,两者恰好完全反应,且反应后溶液的pH 为3.0.原BaCl 2的物质的量浓度为 ( )A .5.05×10-4 mol/LB .5.05×10-3 mol/LC .1.01×10-4 mol/LD .1.01×10-3 mol/L3、(2010·试题调研,山东威海期中)常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO 2,发生如下反应:NaA +CO 2+H 2O===HA +NaHCO 32NaB +CO 2+H 2O===2HB +Na 2CO 3, 则等物质的量浓度的HA 和HB 的强弱是( )A .HA 较强B .HB 较强C .两者一样D .无法比较4、.(1)将等质量的锌粉分别投入10 mL 0.1 mol·L -1 的盐酸和10 mL 0.1 mol·L -1的CH 3COOH 溶液中。
①若锌不足量,反应快的是________; ②若锌过量,产生氢气的量的关系为________。
(2)将等量的锌粉分别投入c (H +)均为1 mol·L -1、体积均为10 mL 的盐酸和醋酸中。
①若锌不足量,反应快的是________; ②若锌过量,产生氢气的量的关系为________。
5、在一定温度下,有a.盐酸 b .硫酸 c .醋酸三种酸:(1)当三种酸物质的量浓度相同时,c (H +)由大到小的顺序是__________________。
高考化学一轮复习 课练 弱电解质的电离平衡试题

回夺市安然阳光实验学校课练25 弱电解质的电离平衡————————[狂刷小题夯基础]——————————[练基础]1.已知次磷酸(H3PO2)为一元酸,欲证明它是弱电解质,下列操作方法不正确的是( )A.用物质的量浓度相同的NaCl溶液和NaH2PO2溶液进行导电性实验,比较灯泡的亮度B.用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸溶液,比较消耗碱液的体积C.加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深D.常温下,稀释0.1 mol·L-1次磷酸溶液至原溶液体积的100倍,测得pH 在4~5之间2.在氨水中存在电离平衡:NH3·H2O NH+4+OH-。
下列情况能引起电离平衡正向移动的有( )①加水②加NaOH溶液③通入HCl ④加CH3COOH ⑤加NH4Cl固体A.②③⑤ B.①④⑤C.①③④ D.③④⑤3.常温下0.1 mol·L-l氨水的pH=a,下列措施能使溶液pH=a-1的是( )A.将溶液稀释到原体积的10倍B.加入适量的氯化铵固体C.加入等体积0.1 mol·L-1烧碱溶液D.加入等体积0.1 mol·L-1盐酸4.常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lgc H +c OH -随加入NaOH的物质的量的变化如图所示。
下列叙述正确的是( )A.HX的酸性弱于HYB.a点由水电离出的c(H+)=10-12mol·L-1C.c点溶液中:c(Y-)>c(HY)D.b点时酸碱恰好完全反应5.(多选)常温下pH=1的两种一元酸溶液a和b,其pH与稀释倍数的关系如图所示,则下列结论正确的是( )A.a酸比b酸的电离程度小B.b酸比a酸容易电离C.b酸是弱酸,a酸是强酸D.pH=1时,b酸的物质的量浓度比a酸大6.已知:在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数如下表:弱电解质电离平衡常数(K a )HClO K a=4.7×10-8H2CO3K a1=4.2×10-7K a2=5.6×10-11H2SO3K a1=1.54×10-2K a2=1.02×10-7下列微粒在溶液中不能大量共存的是( )A.SO2-3、HCO-3 B .ClO-、HCO -3C.HSO-3、CO2-3 D.HClO、HCO-37.浓度均为0.1 mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg VV0的变化关系如图所示。
高三化学一轮复习弱电解质的电离平衡

证对市爱幕阳光实验学校高三化学一轮复习:弱电解质的电离平衡学习目标:1.了解强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。
2..理解弱电解质的电离平衡,以及温度、浓度条件对电离平衡的影响。
3.了解电离平衡常数及其用【旧知回忆】电解质和非电解质练习:1以下物质中Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。
_______ ___是电解质,___________是非电解质,___________既不是电解质,也不是非电解质。
2写出以下物质的电离方程式: NaOH ____________________ H2SO4:____________________ NaHCO3___________________NaHSO4:___________________注意:离子型的电解质在水溶液中或熔融状态下都可以导电,而共价型的电解质只有在水溶液中才能导电【知讲解】一、电解质的强弱1:强电解质与弱电解质的区别说明:1:电解质的强弱与溶解性无关。
2:电解质的强弱与日夜的导电性无关。
3: 电解质的强弱与化学键没有必然的联系。
练习:以下电解质中:NaCl、NaOH,NH3·H2O、CH3COOH,BaSO4,AgCl,Na2O,K2O,Na2O2_____________________________是强电解质____________________________是弱电解质⒉电离方程式的书写⑴强电解质用号:弱电解质用⑵多元弱酸分步电离,且第一步电离远远大于第二步电离,如碳酸:、⑶多元弱碱分步电离一步写完,如氢氧化铁:。
二、弱电解质的电离1.电离平衡:。
2.电离平衡的特征:①弱:只有才会存在电离平衡;②动:电离平衡是平衡;③:V电离 V结合〔填﹥,=或﹤〕④:条件一与的浓度一;⑤变:条件改变,破坏,发生移动。
3.弱电解质电离平衡的移动(1)弱电解质的电离平衡符合原理(2)影响弱电解质电离平衡的因素有:①温度:;②浓度:;③同离子反:参加与弱电解质具有相同离子的强电解质,将电离;④参加能反的物质,将电离。
【高考】化学一轮复习全国版精选弱电解质的电离ppt课件

说明
①OA段导电能力随加水量的增多导电能力增强,原因 是冰醋酸发生了电离,溶液中离子浓度增大。
②AB段导电能力减弱的原因,随水的加入,溶液的体 积增大,离子浓度变小,导电能力减弱。
拓展归纳
外界条件对电离平衡影响的四个不一定 (1)稀醋酸加水稀释时,溶液中不一定所有的离子浓度 都减小。 因为温度不变,KW=c(H+)·c(OH-)是定值,稀醋酸加 水稀释时,溶液中的c(H+)减小,故c(OH-)增大。 (2)电离平衡右移,电解质分子的浓度不一定减小,如 对于CH3COOH CH3COO-+H+,平衡后,加入冰醋 酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理, 只能“减弱”而不能消除,再次平衡时,c(CH3COOH)比 原平衡时大。
(3)相同离子:在弱电解质的溶液中,加入与弱电解质 具有相同离子的强电解质,电离平衡向逆反应方向移动, 电离程度 减小 。
(4)加入能与电离出的离子反应的物质:电离平衡向正 反应方向移动,电离程度 增大 。
(四二) 溶液的导电能力
电解质溶液导电能力取决于溶液中自由移动离子浓度 和离子所带电荷数。自由移动离子浓度越大,离子所带电 荷数越多,则导电能力越强。将冰醋酸、稀醋酸加水稀 释,其导电能力随加水的量的变化曲线如图所示。
2.(2018·山西五校第一次联考)下列关于醋酸性质的描述,不能
证明它是弱电解质的是
()
A.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1
B.醋酸溶液中存在CH3COOH分子
AC项.,101mmL oplH·L=-11的的醋醋酸酸溶溶液液中与c足(H量+)锌约粉为反10应-3 生m成olH·L2-111,2 说mL
NH4Cl固体,相当于增大c(NH
2021届高三化学一轮复习——电离度-电离平衡常数(知识梳理及训练)

2021届高三化学一轮复习——电离度 电离平衡常数(知识梳理及训练)核心知识梳理1.电离度(1)电离度概念与表达式一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中已经电离的弱电解质分子数占弱电解质分子总数的百分数。
(常用符号α表示) 可用数学式表示为α=已电离弱电解质分子数弱电解质分子初始总数×100%或α=已电离弱电解质物质的量(mol )弱电解质初始总物质的量(mol )×100%或α=已电离弱电解质浓度(mol·L -1)弱电解质初始浓度(mol·L -1)×100% 即α=Δcc×100%(c :弱电解质初始浓度,Δc :已电离弱电解质浓度)(2)意义:衡量弱电解质的电离程度,在相同条件下(浓度、温度相同),不同弱电解质的电离度越大,弱电解质的电离程度越大。
(3)影响因素温度升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大问题思考20 ℃时,在0.5 L 0.2 mol·L-1的HA 溶液中,有0.01 mol·L-1的HA 电离成离子,求该温度下的电离度。
答案 α=0.01 mol·L -10.2 mol·L -1×100%=5%。
2.电离平衡常数 (1)①填写下表(25 ℃)弱电解质 电离方程式 电离常数 NH 3·H 2O NH 3·H 2O NH +4+OH -K b =1.8×10-5 CH 3COOH CH 3COOHCH 3COO -+H +K a =1.8×10-5 HClOHClOH ++ClO -K a =3.0×10-8②CH 3COOH 酸性大于(填“大于”“小于”或“等于”)HClO 酸性,判断的依据:相同条件下,电离常数越大,电离程度越大,c(H+)越大,酸性越强。
高三化学第一轮专题复习弱电解质的电离平衡学案

高三化学第一轮专题复习水溶液中的离子平衡——弱电解质的电离编者严秀英【学习目标】1、了解电解质在水溶液中的电离,以及电解质溶液的导电性。
2、了解电解质、强电解质和弱电解质的概念。
3、了解弱电解质在水溶液中的电离平衡。
【自主学习】一、强电解质与弱电解质1.电解质与非电解质电解质是指的化合物;非电解质是指的化合物。
2.强电解质与弱电解质强电解质是指在水溶液里电离成离子的电解质;弱电解质是指在水溶液里分子电离成离子的电解质。
从物质的类别来看,一般地说,强电解质为、、及等;弱电解质为、、及等。
3.电离方程式的书写(1)强电解质:如H2SO4的电离方程式 .(2)弱电解质:①一元弱酸、弱碱一步完成,如NH3·H2O:;CH3COOH: .②多元弱酸分步电离,且第一步电离程度远大于第二步.如H2CO3的电离方程式为:, .③书写多元弱碱的电离方程式时,一步完成.如Fe(OH)3 .(3)酸式盐:①强酸的酸式盐.如NaHSO4的电离方程式为:,②弱酸的酸式盐.如NaHCO3的电离方程式为:。
二、弱电解质的电离平衡1、电离平衡的建立在一定条件下(如:温度、浓度),当弱电解质的速率和的速率相等时,电离过程就达到了平衡状态。
2.电离平衡的特征3、影响电离平衡的因素内因:弱电解质本身的性质外因:电离平衡属于化学平衡,受外界条件如温度、浓度等因素的影响,其规律遵循勒夏特列原理.以弱电解质AB的电离为例:AB A++B-,填写下列空白:温度、加水稀释、 c(AB)、 c(A+)或c(B-),均可使平衡右移.温度、 c(AB)、 c(A+)或c(B-),均可使平衡左移.加入其它电解质,如①加入与弱电解质电离出的离子相同的离子,电离平衡移动,电离程度;②加入与弱电解质电离出的离子反应的离子,电离平衡移动,电离程度。
对于醋酸CH3COOH CH3COO— + H+,外界条件改变对平衡的影响(填写下表)三、电离平衡常数1、表达式⑴对于一元弱酸HA: HA A— + H+,平衡常数表达式K= 。
弱电解质的电离平衡2022年高考化学一轮复习过考点(解析版)

考点41 弱电解质的电离平衡一、强电解质和弱电解质1.电解质和非电解质电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下均以分子形式存在,因而不能导电的化合物。
2.强电解质和弱电解质(1)实验探究盐酸和醋酸的电离程度取相同体积、0.1 mol·L-1的盐酸和醋酸,比较它们pH 的大小,试验其导电能力,并分别与等量镁条反应。
观察、比较并记录现象。
酸0.1 mol·L-1盐酸0.1 mol·L-1醋酸pH 较小较大导电能力较强较弱与镁条反应的现象产生无色气泡较快产生无色气泡较慢实验结论实验表明盐酸中c(H+)更大,说明盐酸的电离程度大于醋酸的电离程度(2)强电解质弱电解质概念在水溶液中能全部电离的电解质在水溶液中只能部分电离的电解质电解质在溶液中的存在形式只有阴、阳离子既有阴、阳离子,又有电解质分子化合物类型离子化合物、部分共价化合物共价化合物实例①多数盐(包括难溶性盐);②强酸,如HCl、H2SO4等;③强碱,如KOH、Ba(OH)2等①弱酸,如CH3COOH、HClO等;②弱碱,如NH3·H2O等;③水1.电离平衡状态(1)概念:在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程(3)电离平衡的特征2.电离方程式的书写(1)强电解质完全电离,在写电离方程式时,用“===”。
(2)弱电解质部分电离,在写电离方程式时,用“”。
①一元弱酸、弱碱一步电离。
如CH3COOH:CH3COOH CH3COO-+H+,NH3·H2O:NH3·H2O NH+4+OH-。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如H2CO3:H2CO3H++HCO-3(主),HCO-3H++CO2-3(次)。
高三化学一轮复习【弱电解质的电离】

高三化学一轮复习弱电解质的电离11.25 ℃时,在20 mL 0.1 mol·L -1 NaOH 溶液中逐滴加入0.2 mol·L -1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是A.在C 点:c(CH 3COO -)>c(Na +)>c(H +)>c(OH -) B.在B 点:c(OH -)=c(H +),c(Na +)= c(CH 3COO -) C.在A点:c(Na +)>c(OH -)>c(CH3COO-)>c(H +)D.在C 点: c(CH 3COO -)+c(CH 3COOH)=2c(Na +) 2.关于强弱电解质,下列说法正确的是 A. 液态HC1和液态H 2O 中都不存在离子 B. 室温下,硫酸溶液的pH —定小于醋酸溶液C. 二种弱电解质在一定条件下可以相互反应生成强电解质D. NaX 在水中的电离方程式为NaX=Na ++X -,因此HX 是一种强电解质 3.现将浓度相等、体积分别为V 1、V 2的H 2SO 4、NaOH 溶液混合,测量混合液温度,结果如图(已知:V 1+V 2=60mL )。
下列叙述错误的是 A. 实验的环境温度低于22℃ B. 混合溶液的导电能力:M>N C. P 点混合溶液呈中性D. 若将H 2SO 4改为CH 3COOH ,P 点温度低于28℃ 4.下列说法正确的是A. 弱电解质溶液的导电能力一定比强电解质溶液弱B. 将等体积、等浓度的NaOH 溶液和氨水各稀释一倍后,两者中和等浓度盐酸的能力氨水强于NaOH 溶液C. 物质的量浓度相同的磷酸钠溶液和磷酸溶液所含PO 3-4浓度也相同D. 如果盐酸中c(H +)是醋酸溶液中c(H +)的2倍,则c (HCl) <2c (CH 3COOH) 5.下列说法正确的是A. 0.1mol/LpH 为4的NaHB 溶液中:c(HB -)>c(H 2B)>c(B 2-)B. 左图表示25℃时,用0.1mol·L -1盐酸滴定20mL0.1mol·L -1NaOH 溶液,溶液的pH 随加入酸体积的变化C. 在pH=2的NaHSO 4溶液中c(H +)=c(OH -)+ c(SO 42-)D. pH=2的两种一元酸x 和y ,体积均为100 mL ,稀释过程中pH 与溶液体积的关系如图所示,分别滴加NaOH 溶液(c=0.1mol·L -1)至pH=3,消耗NaOH 溶液的体积为V x 、V y ,则x 为强酸,y 为弱酸且V x >V y6.下列实验操作能达到预期实验目的的是 选项 实验目的实验操作A 比较H 2SO 4和H 2CO 3酸性强弱 分别测定饱和H 2SO 4和H 2CO 3溶液的pHB 实验室制取CO 2 将稀硫酸滴入CaCO 3固体中C 制备Fe(OH)3胶体将饱和FeCl 3溶液滴入NaOH 溶液中 D除去乙酸乙酯中的CH 3COOH加入饱和Na 2CO 3溶液,振荡后静置,分液7.室温下将l0mL c(H +)=0.00lmol/L 的醋酸溶液加水稀释10倍后,下列说法正确的是 A.醋酸的电离程度增大,c(H +)亦增大B. 溶液中()()33c CH COO c CH COOH -不变C. 溶液中导电粒子的数目增多D. 再加入l0mL c(OH -)=0.00lmol/L 的NaOH 溶液,混合液呈中性8.相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是 A. 强酸溶液产生较多的氢气 B. 弱酸溶液产生较多的氢气 C. 两者产生等量的氢气 D. 无法比较两者产生氢气的量9.常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。
2024届高三化学一轮复习+微专题课时训练:弱电解质的电离平衡

2024届新高考化学第一轮复习微专题课时训练弱电解质的电离平衡一、选择题(共15题)1、H2S水溶液中存在电离平衡:H2S H++HS-和HS-H++S2-。
若向H2S溶液中 ( )A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小2、硼酸(H3BO3)大量用于玻璃工业,可以改善玻璃制品的耐热、透明性能,提高机械强度等。
硼酸水溶液呈弱酸性,原因是其能够结合水电离出来的氢氧根离子从而释放出氢离子。
以下说法正确的是() A.往纯水中加入少许硼酸,水的电离程度增加B.等浓度的硼酸与碳酸相比,硼酸酸性强C.H3BO3为三元酸D .1 mol H 3BO 3最多能和1 mol 甲醇发生酯化反应3、一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )A .a 、b 、c 三点溶液的pH :c<a<bB .a 、b 、c 三点CH 3COOH 的电离程度:c <a <bC .用湿润的pH 试纸测量a 处溶液的pH ,测量结果偏小D .a 、b 、c 三点溶液用1 mol·L -1NaOH 溶液中和,消耗NaOH 溶液的体积:c <a <b4、由于血液中存在如下平衡过程: CO 2(g) CO 2(aq)、CO 2(aq)+H 2O(l)H 2CO 3(aq)、H 2CO 3(aq)H +(aq)+HCO -3(aq),使血液的pH 维持在7.35~7.45。
如超出这个范围会造成酸中毒(pH 过低)或碱中毒(pH 过高),急性中毒时需静脉注射NH 4Cl 或NaHCO 3进行治疗。
下列叙述正确的是( )A .血液中CO 2浓度过高会导致酸中毒,使血液中c HCO -3c H 2CO 3的值增大B .治疗碱中毒时,患者需降低呼吸频率,以增加血液中CO 2浓度C.急性酸中毒时,救治方式是静脉注射NH4Cl溶液D.酸或碱中毒时,会导致血液中的酶发生水解5、如图所示,烧杯中的溶液为2 mol·L-1 CH3COOH溶液,接通直流电源。
