人类免疫缺陷病毒抗体定量测定
MP人类免疫缺陷病毒(HIV1+2型)抗体检测试剂盒(免疫印迹法)

新加坡MP生物医学亚太有限公司生产的HIV-1+2抗体免疫印迹试剂(HIVBLOT 2.2)1)原理wB是将HIV蛋白经SDS-PAGE,由于蛋白分子大小不同而分离开来,然后再把这些已分离的不同蛋白带转移到硝化纤维膜上,以后用不同的方式,包括非常敏感的免疫酶法,检测HIV抗体。
每一条硝化纤维膜上均含有经电泳分离过的HIV抗原。
若有相应抗体就会与硝化纤维膜条上的抗原带相结合。
然后与抗人的IgG酶结合物反应。
在底物作用下,硝化纤维膜条带上呈现紫色,表示阳性反应。
2)基本检测程序(1)准备试剂:配制稀释洗涤液、印迹缓冲液、工作酶结合溶液。
(2)湿润膜条:用镊子从塑料管中小心取出所需的硝化纤维膜条,其中包括3条对照(强阳性、弱阳性、阴性对照各1条),并且将有编号的膜面向上放入分析槽中,随后加人2 ml 已经稀释好的洗液,室温(22~28℃)振荡浸泡至少5 min,然后吸干槽内液体。
(3)加样:每槽中加入2 ml印迹缓冲液和20ul待检标本或对照血清(每个标本都需换新的移液头)。
(4)孵育:盖上盖子,室温振荡1 h(也可采用室温振荡16~18 h)。
(5)洗涤:小心打开盖子,吸干槽内液体,避免标本交叉污染。
加入2 ml已经稀释的洗涤液,室温浸泡振荡5 min,再吸干槽内液体。
如此反复洗涤3次。
(6)酶结合:加入2 ml工作酶结合溶液,盖上盖子,室温振荡1 h(如果在6步骤中采用室温振荡16~18 h的,则此步酶反应步骤中室温振荡30 min)。
(7)洗涤:吸干槽内液体,再洗涤3次。
(8)显色:加入2 ml底物溶液,室温振荡15 min。
(9)终止:吸干槽内液体,加入蒸馏水终止反应,反复3次,随后用镊子小心取出膜片于滤纸巾上,并开始读膜片结果。
(10)结果判定标准:每次实验须设立对照血清,如阳性对照必须全部条谱带均出现;弱阳性对照可以谱带不全,但必须够判定阳性的结果;阴性对照则无反应谱带。
如果对照血清的结果未出现正确的谱带,则此次实验无效,须重做。
人类免疫缺陷病毒抗体定量测定作业指导书

人类免疫缺陷病毒抗体定量测定作业指导书一、目的:规范人类免疫缺陷病毒抗体测定的标准操作程序,确保人类免疫缺陷病毒抗体测定的结果准确有效。
二、适用范围:在AutoLumo A2000化学发光检测仪上定量测定人血清中的人类免疫缺陷病毒抗体。
三、临床意义人类免疫缺陷病毒(俗称艾滋病病毒,英文名称是Human Immunodeficiency Virus,缩写为HIV)是一种能生存于人的血液中并攻击人体免疫系统的病毒。
HIV侵入人体后主要攻击的是一种带有CD4表面抗原的淋巴细胞(T4淋巴细胞),这种细胞是免疫系统的基本组成部分,HIV通过大量、不断地复制与释放,导致T4淋巴细胞大量死亡,使人体内T4淋巴细胞明显减少,感染者免疫功能遭到严重破坏,造成免疫缺陷,降低或失去对各种致病因素的抵抗能力,临床表现为各种机会性感染与肿瘤[1]。
有的发生神经系统病变或症状,可能与神经系统的机会性感染(弓形虫病、新隐球菌感染等)有关,同时可能是亲神经型HIV毒株的直接作用造成的。
最终,病人通常死于严重的感染和肿瘤[2]。
四、方法原理本试剂盒采用双抗原夹心法原理进行检测。
以HIV 抗原包被磁微粒,辣根过氧化物酶标记HIV抗原制备酶结合物,通过免疫反应形成抗原-抗体-酶标记抗原复合物,该复合物催化发光底物发出光子,发光强度与HIV抗体的含量成正比。
五、标本的采集与处理5.1.采用正确医用技术收集血清样本(详见标准血液标本前处理流程)。
5. 2.样本中勿添加叠氮钠作为防腐剂。
5.3.样本中的沉淀物和悬浮物可能会影响试验结果,应离心除去,并确定样本未变质方可使用。
5.4.样本处理、收集后在室温放置不可超过8小时;如果不在8小时内检测需将样本放置在2~8℃的冰箱中;若需48小时以上保存或运输,则应冻存于-20℃以下,避免反复冻融。
使用前恢复到室温,轻轻摇动混匀。
六、标本拒收标准1)严重溶血、脂血 2)标本标识不明七、仪器与材料7.1.仪器:适用于Lucy2、Lumo、AutoLumoA2000化学发光检测仪。
HIV抗体检测解读

HIV抗体检测解读HIV(人类免疫缺陷病毒)是一种通过感染人体免疫系统而导致艾滋病的病毒。
HIV抗体检测是一种常用的方法,用于检测人体是否感染了HIV病毒。
在本篇文章中,我们将解读HIV抗体检测的结果以及如何正确理解这些结果。
一、HIV抗体检测的原理HIV抗体检测的原理是通过检测人体血液样本中是否存在特定的HIV抗体,来判断一个人是否感染了HIV病毒。
这些抗体是人体免疫系统产生的,用于抵御HIV病毒入侵。
如果检测结果呈阳性,表示人体产生了针对HIV的抗体,即感染了HIV病毒。
反之,如果检测结果呈阴性,表示人体没有产生这些特定的抗体,即没有感染HIV病毒。
二、HIV抗体检测方法1. 首次筛查:常用的HIV抗体检测方法是酶联免疫吸附试验(ELISA)或免疫膜层析法(Immunochromatographic assay)。
这些方法能够快速、准确地筛查出是否感染了HIV病毒。
2. 确认诊断:如果首次筛查呈阳性,需要进行进一步的确认诊断。
确认诊断通常采用Western blot或免疫荧光抗体法(Immunofluorescence assay),以验证是否确实感染了HIV病毒。
三、HIV抗体检测结果的解读1. 阴性结果:如果HIV抗体检测结果是阴性,说明在检测时未发现HIV病毒相关抗体。
但需注意,阴性结果并不代表完全没有感染HIV病毒的风险。
在感染初期,尤其是病毒进入人体后的数周内,抗体水平可能还不足以被检测出来。
因此,如果曾有可能感染HIV病毒的风险行为,建议定期检测以确保结果的准确性。
2. 假阳性结果:HIV抗体检测可能会出现假阳性结果,即检测结果呈阳性,但实际上并未感染HIV病毒。
常见的原因包括免疫系统异常、患有其他疾病等。
如果初步检测结果呈阳性,需进一步进行确认诊断以确定感染情况。
3. 真阳性结果:HIV抗体检测结果呈阳性,意味着人体产生了特定的HIV抗体,感染了HIV病毒。
在确认感染情况后,应及时寻求专业医疗机构的帮助,接受综合治疗和护理。
人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)标准操作规程

1、 检验申请单独检验项目申请:人类免疫缺陷病毒抗体{缩写抗HIV (1+2)]测定。
临床医生根据需要提出检验申请。
2、 标本采集与处理2.1标本采集2.1.1常规静脉采血约2ml ,不抗凝,置普通试管中,或采用含分离胶的真空采血管。
也可采集血浆,用肝素、EDTA 或枸橼酸盐抗凝。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml 的全血标本,或少于0.1ml 的血清或血浆。
2.1.5.2对检测结果可能有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在置1-2h 后将标本离心分离出血清或血浆,避免溶血。
离心必须达到3000rpm 15min ,离心后的血清中不能含有颗粒物和微量纤维蛋白。
2.2.2标本保存时间:室温(15-25℃)下可稳定48h ,普通冰箱中(2-8℃)稳定7d ,在-20℃最多可保存4周。
避免反复冻融。
不可使用热灭活的标本。
2.2.3已完成测试的标本保持完整的识别号,置4-8℃冰箱内保存7d 。
2.3标本采集的注意事项采血前使受检者保持平静、松弛,避免剧烈活动。
医院检验科免疫室 体诊断试剂盒(酶联免疫法)标准操作规程 生效日期: 年 月 日版本:第1版第 页,共 页3.方法原理本实验采用HIV 特异性抗原gp160和gp36等包被微孔反应板,用gp36、gp41标记辣根过氧化物酶。
当待测标本中存在HIV 抗体时,该抗体和固化的抗原结合于反应板上,并进一步与酶结合物相结合,在TMB 底物参与反应的情况下,产生显色反应。
人类免疫缺陷病毒(HIV) 检测

④检测时,先将硝基纤维素膜细条恢复室温,再与待检血清(用稀释 液稀释后)共同浸泡,37℃孵育60min(需用振荡摇床)。 ⑤取出硝基纤维素膜细条,用洗涤液洗涤5次,每次5min(用振荡摇 床)。 ⑥加酶标记抗人IgG 抗体,于37℃孵育60min(需用振荡摇床)。 ⑦洗涤同⑤。 ⑧加酶底物,显色10~20min。终止反应(放置于室温观察)。
第 4页
(1)ELISA 间接法检测HIV 抗体:将待测的血清稀释后按HIV 酶标诊断试剂盒的说明进行操作;该法的特异性和敏感性强, 操作简单、快速安全,比较适合大批量标本和筛选实验,但对 HIV 感染初期病人不能检测到抗体是其不足之处。
第 5页
(2)蛋白印迹试验:ELISA 法确诊的阳性标本应做蛋白印迹试 验以确证。
人类免疫缺陷病毒(HIV) 检测
第 1页
人类免疫缺陷病毒(HIV)是引起人类艾滋病(获得性免疫缺 陷综合征,AIDS)的病原体。
第 2页1.方法第 Nhomakorabea页有检测HIV 抗原和检测HIV 抗体两种。前者可用组织细胞培养 法、核酸检测法及免疫酶标法;后者有凝集试验、免疫荧光试 验、蛋白印迹试验及放射免疫试验和免疫酶标技术等。 目前世界上常用酶联免疫吸附试验(ELISA)间接法作为经典筛 选试验,蛋白印迹试验作为确证试验。
第 12 页
谢谢大家!
第 13 页
第 10 页
(2)蛋白印迹试验:AIDS病人血清中的抗HIV 抗体与HIV的 多肽片段(外膜蛋白与核心蛋白)特异性结合后可形成多条蛋 白区带。强阳性反应显示HIV 几个基因组编码的全部蛋白带, 弱阳性反应显示两条或几条显色较弱的蛋白带,阴性反应则无 任何蛋白带显示。
第 11 页
3.注意事项 (1)使用公认的HIV 酶标诊断试剂盒,不同厂家的试剂盒有可 能操作有异,应严格按说明书操作;不同厂家的产品有不同的 阳性判断标准,应按说明书慎重判断。 (2)鉴于HIV 及有关试验过程的特殊危险性,应严格规范实验 室操作规程,增加试验结果的准确性;严格规范安全防范措施, 防止感染;阳性结果应重复试验。
两种方法检测人类免疫缺陷病毒抗体性能评价

成 为 当 今 世 界 面临 的最 严 峻 挑 战 之 一 。截 止 2 1 0 0年 1 O月 底 , 初 筛 阳性 检 出 率 较 高 , 差异 具 有 统计 学 意 义 。 表 1 2 筛 查 试 剂 检 测 结果 种
我 国 统 计 报 告 艾 滋 病 感 染 者 疫 情 还 在 上 升 , 滋 病 监 测 变 得 更 艾 为 重 要 _ 。为 此 , 者 把 在 进 修 期 间所 做 的人 类 免 疫 缺 陷 病 毒 1 ] 作
・92・ 5
检 验 医学 与临 床 2 1 0 2年 4月 第 9卷 第 8期
L bMe l , r 0 2 Vo. , . a dCi Api2 1 , 19 No 的 责 任 [ , 7 以及 提 高 医护 人 员 的 自我 防 护 ] 意 识 及 保 护 医 患 双 方 的 利 益 的 观 点 不 一 致 。
英科新创人类免疫缺陷病毒抗体检测试剂盒(胶体金法)操作规程

人类免疫缺陷病毒抗体检测试剂盒(胶体金法)操作规程英科新创(厦门)操作步骤1.将待测标本从存储条件下取出,平衡至室温并编号2.将所需数量的测试试剂从包装盒取出平衡至室温3.用微量加样器取60μl待检血清/血浆标本滴加到试剂加样处4.加样后,阳性标本可在1-30分钟内检出,超过30分钟将对实验结果造成影响。
因此建议30分钟内最终观察并记录实验结果结果判读1.阳性结果:测试条在测试区和对照区位置各出现一条紫红色条带。
如果检测区的紫红色条带隐约可见,建议对实验重复检测,并使用其他方法确认2.阴性结果:测试条只在对照区位置出现一条紫红色条带3.无效结果:对照区未出现紫红色条带,表明不正确的操作或试剂已变质损坏或是试剂中抗体含量过高。
在此情况下,应再次仔细阅读说明书,并用新的试剂条重新测试。
如果问题依然存在,应立即停止使用此批号产品,并与当地供应商联系注意事项1.本试剂用于体外诊断,仅用于人全血、血清或血浆样品,其它体液样本可能得不到准确结果2.本试剂用于定性检测人全血、血清或血浆样品中HIV1/2型抗体,对于所有使用本试剂条检测的结果必须进一步验证3.样品的加样建议用微量加样器准确加入4.实验环境应保持一定湿度、避风,避免在过高温度下进行试验5.测试条从包装取出后,应尽快实验,避免放置于空气中过长时间,导致受潮6.对于那些含有感染源和怀疑含有感染源的物质应有合适的生物安全保证程序下列有关注意事项:(1)带手套处理样品和试剂(2)不要用嘴吸样(3)在处理样本时不能吸烟、吃食物、喝饮料、美容和处理隐形眼镜(4)用消毒剂对溅出的样品进行消毒(5)使用后的试剂和样本等废弃物应按国家相关规定妥善处理(6)超出有效期的试剂不能使用7.检测线颜色深浅的程度与样品中抗体滴度没有一定的必然联系8.任何一种测试都不能绝对保证样品中没有低浓度抗体存在,任何时候都不能排除暴露和感染的可能9.对于下列物质在所给出的浓度下对测试结果不造成影响:胆固醇200mg/ml;血红蛋白≤178g/L;甘油三酯≤200mg/ml;胆红素≤1.6mg/100ml。
HIV定量检测(病毒载量)

HIV定量检测(病毒载量)HIV载量人类免疫缺陷病毒(Human Immunodeficiency Virus, HIV)属于单股正链核糖核酸(RNA)逆转录病毒科慢病毒亚科,是艾滋病的主要病原体,主要传播途径为性传播、血液传播和母婴传播。
至今,艾滋病仍然是无有效疗法的致命性传染病。
HIV基因组是两条相同的正链RNA,每条RNA长约9.2-9.8kb。
HIV载量是指血浆中的病毒负荷,即体内复制的病毒的数量,它可以准确地反映血液中病毒的活跃程度。
病毒载量检测的重要性在艾滋病的预防过程中,艾滋病高危人群的诊断是“防艾”的关键环节。
血清中HIV RNA是病毒复制和艾滋病进程的确切标志。
所以血清中HIV RNA的检测已经成为诊断艾滋病的金标准方法,也是通过国家认证的临床PCR实验室常规检测项目之一,在艾滋病确诊、用药、疗效预判以及康复治疗过程中具有重要的指导意义。
检测HIV-1病毒载量可以监控和预测病程,指导艾滋病病人的HAART治疗,包括确定治疗时机、选择治疗方案、评价治疗效果;并且结合疾病临床症状和其他实验指标,还可用于早期感染的辅助诊断。
另外,检测血浆HIV-1病毒载量还可作为婴儿早期HIV感染的辅助诊断以及采供血机构样品的窗口期检测方法。
具体来说包括:⑴ 监测抗病毒药物治疗效果。
抗病毒药物治疗前后,定期病毒载量分析和监测,结合CD4+T淋巴细胞计数,有助于抗病毒药物治疗方案的确定和修改。
⑵ 监测疾病进展。
定期检测HIV-1病毒载量,有助于监测感染者和病人的病程变化,结合CD4+T淋巴细胞计数,为抗病毒药物治疗提供病毒学依据。
⑶ 诊断急性HIV-1感染。
针对HIV-1抗体筛查阴性、近期有流行病学史的个体,或确证结果不确定,核酸定量检测可用于诊断HIV-1急性期感染。
⑷ 确定HIV-1感染。
针对HIV-1抗体筛查阳性或确证结果不确定的个体,结合流行病、和临床病史和CD4+T淋巴细胞计数等,使用核酸定量检测帮助确定HIV-1感染。
两种方法检测人类免疫缺陷病毒抗体结果比较

两种方法检测人类免疫缺陷病毒抗体结果比较朱武军(贵州省贵阳市第六人民医院检验科550005)【摘要】目的比较化学发光法与酶联免疫吸附试验(ELISA)法检测人类免疫缺陷病毒抗体(抗一HIV)的一致性。
方法收集45份室间质评样本,分别用两种方法进行检测。
结果化学发光法检测样本的吸光度/临界值比值明显高于ELISA法,两种方法对抗HIV检出率差异有统计学意义(Y2—25.002,P<o.01)。
结论化学发光法检测抗一HIV较ELISA法敏感性高、假阳性少,可以推广应用。
【关键词】化学发光法;酶联免疫吸附试验;人类免疫缺陷病毒;对比研究中图分类号:R446.61;R512.91 文献标志码:B 文章编号:1672—9455(2009)06—0455—02艾滋病即获得性免疫缺陷综合征,是由人类免疫缺陷病毒(HIV)引起的严重疾病,迄今仍无法有效治疗,除了行为干预等社会学手段外,阻断输血传播,及时发现HIV感染者并采取针对性措施,是目前疫情控制的重要技术手段。
由于HIV进入人体后需要经过一段时间才会产生HIV抗体(抗一HIV),这一时间医学上称为“窗口期”。
艾滋病研究的重点领域之一就是尽可能缩短“窗口期”,而达到这一目的最重要的手段就是高质量的艾滋病诊断试剂盒和敏感性高的检测方法。
化学发光标记方法是近年来发展起来的一种新的非放射性免疫分析技术。
为比较化学发光法与酶联免疫吸附试验(ELISA)法检测抗一HIV的一致性,本文对同一份标本采取两种方法进行检测,现将结果报道如下。
1材料与方法1.1 标本来源所有标本均来自贵州省临床检验中心2006~2008年全省室间质评样本,一20℃以下保存。
1.2仪器化学发光仪KPS-KM(北京科美东雅生物技术有限公司生产);酶标仪Muhiskan MK3(芬兰);洗板机(芬兰雷勃Wwllwash Plus)。
1.3试剂ELISA法检测试剂由北京万泰生物药业股份有限公司提供,批号120080101;化学发光法试剂为北京科美东雅生物技术有限公司生产,批号20070920。
人类免疫缺陷病毒抗体检测

人类免疫缺陷病毒抗体检测(ELISA)1. 原理在微孔条上预包被纯化基因工程人类免疫缺陷病毒I型和II型(HIV-1/HIV-2)抗原(合成肽或基因重组蛋白),采用双抗原夹心法检测血清或血浆中人类免疫缺陷病毒抗体。
样品加入包被抗原反应孔,在随后的温育过程中,若样品中含特异抗体,则该抗体与包被抗原形成抗原抗体复合物被吸附到固相,再加入酶标记的HIV-1/HIV-2抗原,最终形成抗原-抗体-酶标抗原复合物,洗涤除去未结合的游离酶,加入显色剂后显色。
2. 标本采集2.1 采集前病人准备:受检者应空腹2.2 标本种类:血清或血浆2.3 标本要求:采集病人静脉血2ml(可用EDTA抗凝),室温放置不超过4小时,分离血清备用。
3. 标本储存:2-8°C保存不应超过48小时,-20°C不应超过3个月,-70°C 长期保存,应避免反复冻融。
4. 标本运输:密封,室温运输。
5. 标本拒收标准:污染、标本量不足、严重溶血或脂血标本不宜作此项检测。
6. 试剂6.1 试剂名称:人类免疫缺陷病毒抗体诊断试剂盒6.2 试剂生产厂家:北京万泰生物工程有限公司。
6.3 包装规格:96Test/Kit6.4 试剂盒组成:包被反应板,HIV酶标记物,阳性对照血清,阴性对照血清,浓缩洗涤液,底物A,底物B,终止液,封口膜,密封袋。
6.5 试剂储存条件及有效期:2-8°C避光保存,有效期6个月。
7. 仪器设备7.1 仪器名称:自动酶标仪7.2 仪器厂家:Rayto7.3 仪器型号:RT-61008. 操作步骤8.1 平衡:将试剂盒各组分取出,平衡至室温(18-25°C),微孔板开封后,余者及时以自封袋封存。
8.2 配液:浓缩洗涤液配制前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
8.3 编号:将微孔条固定于支架,按序编号。
8.4 加样:用加样器在微孔反应条板孔中加入样品100l;空白孔不加任何液体;阴性对照孔和阳性对照孔,每孔分别加入阴阳对照各100l,标好位置。
人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则

附件3人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则一、前言人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)检测试剂是指运用免疫学及分子生物学等方法原理对人血清、血浆或其他体液中的特定的HIV生物学标记物,涉及HIV 1型(HIV-1 )p24抗原、HIV抗体、HIV核酸、HIV基因耐药突变等进行定量或定性分析的试剂。
据《体外诊断试剂注册管理办法(试行)》(国食药监械〔2023〕229号)的分类原则,该类产品作为第三类体外诊断试剂(In Vitro Diagnostic,IVD)管理,属高风险管理产品。
本指导原则制定的重要目的是让申请人明确在注册申报过程中对本类试剂在临床研究方面重点关注内容,同时规范注册申请人对于注册申报资料中有关临床研究资料的规定。
本指导原则是对HIV检测试剂临床研究的一般性规定,申请人应依据具体产品的特性对临床研究资料的内容进行充实和细化。
申请人还应依据具体产品的特性拟定其中的具体内容是否合用,若不合用,需具体阐述其理由及相应的科学依据。
本指导原则只是针对HIV检测试剂的特点,强调需重点考虑的问题,临床实验的基本规定应符合《体外诊断试剂临床研究技术指导原则》(国食药监械〔2023〕240号)的规定,涉及临床实验协议、方案、报告的撰写等。
本指导原则不涉及行政审批规定,不作为法规强制执行。
本指导原则是申请人和技术审评人员的指导文献,假如有可以满足适合的法规规定的其他方法,也可以采用,但是需要提供具体的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善、科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、合用范围HIV生物学标记物是指机体在感染HIV后,在不同的感染阶段出现的生物学标记物,涉及:HIV抗体、HIV-1p24抗原、HIV核酸、HIV 基因耐药突变等。
人类免疫缺陷病毒标准操作规程(胶体金法)
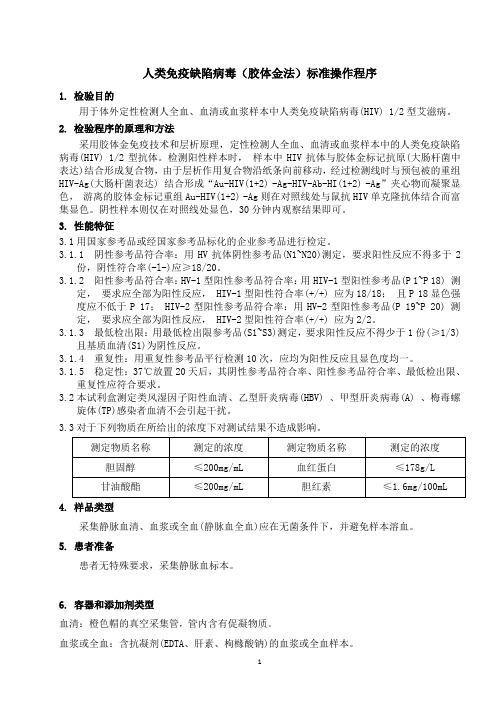
人类免疫缺陷病毒(胶体金法)标准操作程序1.检验目的用于体外定性检测人全血、血清或血浆样本中人类免疫缺陷病毒(HIV) 1/2型艾滋病。
2.检验程序的原理和方法采用胶体金免疫技术和层析原理,定性检测人全血、血清或血浆样本中的人类免疫缺陷病毒(HIV) 1/2型抗体。
检测阳性样本时,样本中HIV抗体与胶体金标记抗原(大肠杆菌中表达)结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线时与预包被的重组HIV-Ag(大肠杆菌表达) 结合形成“Au-HIV(1+2) -Ag-HIV-Ab-HI(1+2) -Ag”夹心物而凝聚显色,游离的胶体金标记重组Au-HIV(1+2) -Ag则在对照线处与鼠抗HIV单克隆抗体结合而富集显色。
阴性样本则仅在对照线处显色,30分钟内观察结果即可。
3.性能特征3.1用国家参考品或经国家参考品标化的企业参考品进行检定。
3.1.1阴性参考品符合率:用HV抗体阴性参考品(N1~N20)测定,要求阳性反应不得多于2份,阴性符合率(-l-)应≥18/20。
3.1.2阳性参考品符合率:HV-1型阳性参考品符合率:用HIV-1型阳性参考品(P 1~P 18) 测定,要求应全部为阳性反应, HIV-1型阳性符合率(+/+) 应为18/18;且P 18显色强度应不低于P 17; HIV-2型阳性参考品符合率:用HV-2型阳性参考品(P 19~P 20) 测定,要求应全部为阳性反应, HIV-2型阳性符合率(+/+) 应为2/2。
3.1.3最低检出限:用最低检出限参考品(S1~S3)测定,要求阳性反应不得少于1份(≥1/3)且基质血清(S1)为阴性反应。
3.1.4重复性:用重复性参考品平行检测10次,应均为阳性反应且显色度均一。
3.1.5稳定性:37℃放置20天后,其阴性参考品符合率、阳性参考品符合率、最低检出限、重复性应符合要求。
3.2本试利盒测定类风湿因子阳性血清、乙型肝炎病毒(HBV) 、甲型肝炎病毒(A) 、梅毒螺旋体(TP)感染者血清不会引起干扰。
乙肝表面抗原、丙型肝炎病毒、人类免疫缺陷病毒、梅毒螺旋体等术前四项抗体检测临床意义

乙肝表面抗原、丙型肝炎病毒、人类免疫缺陷病毒、梅毒螺旋体等术前四项抗体检测临床意义乙肝表面抗原(HBsAg)HBsAg 为 HBV S 基因表达的包膜蛋白质,包括不同相对分子质量组分,包括大蛋白(L 蛋白)、中蛋白(M 蛋白)、小蛋白(S 蛋白)。
HBV 感染者的血液中主要有 Dane 颗粒、球形颗粒、管形颗粒三种不同形式,三种最终形成 HBsAg 复合体。
HBsAg 是乙肝患者体内最先发现的 HBV 相关性抗原,是 HBV 感染的特异性标志。
HBsAg 定量检测在自然病史分析、抗病毒治疗管理中具有较大的临床应用价值,广泛应用于感染阶段监测、治疗应答评估、新药研发、疾病机制等领域;在特殊类型患者中也有一定的应用价值,如预测乙肝孕妇早产发生风险等。
HBsAg 临床意义解读:❶HBsAg 阳性可见于 HBV 急慢性感染。
世界卫生组织定义中,慢性乙肝病毒感染是患者血清中 HBsAg 持续存在至少超过 6 个月的状态,急性 HBV 感染为血中一过性出现 HBsAg。
❷血清 HBsAg 水平可作为慢性乙型肝炎(CHB)抗病毒治疗疗效评估、治疗终点判断标准。
❸对于未治疗的 CHB 患者,特别是低病毒载量的 HBeAg 阴性患者,HBsAg 检测可了解疾病进展并监测预后。
❹CHB 患者的复发率与停药时 HBsAg 水平密切相关。
治疗刚结束时 HBsAg 水平≤ 2 log10 IU/mL 的患者未发生临床复发;而治疗结束后 12 和 24 个月时,> 3 log10 IU/mL 的患者复发率高达55.7% 和 83.4%。
❺HBsAg 滴度与 HBV DNA、共价闭合环状脱氧核糖核酸(cccDNA)水平相关:当慢性乙型肝炎(CHB)的 HBeAg 阳性时,血清 HBsAg 水平与肝内 cccDNA 和 HBV DNA 呈正相关。
图 2 HBsAg 和 cccDNA(A)以及 HBsAg 和肝内 HBV DNA(B)的最佳拟合线散点图❻监测 HBsAg 可帮助决定对干扰素应答不佳患者是否实施终止治疗,应答良好者,可据其 HBsAg 变化水平行个体化治疗。
人类免疫缺陷病毒抗体诊断试剂标准操作程序

人类免疫缺陷病毒(HIV )抗体诊断试剂(双抗原夹心、胶体金法)标准操作程序【目的】保证检测结果准确可靠,为临床诊断提供可靠的参考依据.【该SOP变动程序】本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、科主任。
【用途】无偿献血人员的现场检测或HIV感染的临床初筛。
【标本的采取和保存】1.采集静脉的血清、血浆样本必须在无菌条件下,并避免样品溶血。
2.如果血清和血浆样品收集后7天内检测,样品必须放在2--8C保存,如果大于7天则须冷冻保存。
3.常规抗凝剂不影响实验结果。
4.溶血、粘稠及高脂标本不适于本试剂。
含有特殊物质的标本可能会导致检测结果不稳定,在检测前须清除。
5.在标本中加0.1%NaN3不影响实验结果。
【基本原理】本品采用胶体金免疫检测技术,快速定性检测血清(浆)样本中的HIV (1+2)型抗体。
本品在玻璃纤维素膜上预包被胶体金标记的重组HIV抗原gp41,gp120和gp36的主要表位(Au-HIV-Ag),在硝酸纤维素膜上检测线和对照线处分别包被重组HIV抗原gp41,gp120和gp36的主要表位(HIV-Ag)和抗HIV单克隆抗体。
检测阳性样本时,血清样本中的HIV抗体与胶体金标记的抗原结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线时与预包被的重组HIV-Ag结合形成“Au-HIV(1+2)-Ag-HIV-Ab-HIV(1+2)-Ag” 夹心物而凝聚显色,游离的胶体金标记重组Au-HIV(1+2)-Ag则在对照线处与抗HIV单克隆抗体结合而富集显色,30分钟内观察结果即可。
【操作程序】1.将待测标本从储存条件下取出,平衡至室温并编号。
2.将胶体金试纸条从包装盒中取出,打开铝箔包装袋,平置台面上。
3.用微量加样器取50ul样本血清或血浆,加到试纸条指示箭头下端的加样处。
4.加样后,阳性标本可在1 30分钟内检出。
经过确证试验,反应时间超过30分钟将对实验结果的观察造成影响,因此,建议30分钟再最终观察并记录实验结果。
人类免疫缺陷病毒抗体检测(乳胶法)

人类免疫缺陷病毒(HIV1/2)抗体检测(乳胶法)【样本要求】静脉采血后离心获得血清、血浆样本,不同的抗凝剂如柠檬酸钠,肝素钠,EDTA,草酸钠,枸橼酸钠的血浆标本均可,在2-8℃条件下可保存一周,长期保存需-20C冷冻,应避免反复冻融,发臭、溶血等异常样本请勿使用。
【检验方法】在进行检测前必须先完整阅读使用说明书,并将试剂、样本和缓冲液恢复至室温(20℃-30℃)1.从原包装铝箔袋中取出试剂。
2.将试剂放在干净的平台上,用一次性塑料吸管吸取1滴血清、血(25 Ul)于加样孔(S)中,随后加入1滴缓冲液(的40ul),开始计时。
3.等待红色条管的出现,检测结果应在15-20分钟判读,20分钟后判读结果无效【检验结果的解释】阳性(+):两条红色条出现。
一条带位于检测区内(T),另一条带位于质控区内(C)。
阴性(-):仅质控区(C)出现一条红色条,在检测区内(T)无红色条带出现。
无效:质控区(C)未出现红色条带,表明不正确的操作过程或试剂已变质损坏。
在此情况下,应再次仔细阅读说明书,并用新的试剂新检测。
如果问题仍然存在,应立即停止使用此批号产品,并与当地供应商联系【检验方法的局限性】1.本试剂仅用于体外诊断2.本试仅用于检测人血清、直浆样本,用其它样本或溶液检测的结果可能有误。
3.本试剂为定性检测。
无法确定样本中HIV抗体的水平。
4.本试剂仅用于HIV抗体初筛检测,HIV抗体确认应遵循相关法规和标准在有资质的HIV确认实验室进行。
5.阳性结果须经相关确证方法的确认或经过国家法定的其他方式处理。
6.受分析灵敏度所限,阴性结果不能完全排除艾滋病毒感染的可能性,可能系样本中抗体浓度低于本产品的灵敏度所致,对于有怀疑的结果建议采用灵数度更高的其他类方法进行复核。
人免疫缺陷病毒抗体测定

人免疫缺陷病毒抗体测定1.样品的接收、登记和处理1.1 采血3-4ml,收集到促凝管中(可采用常规用量的肝素或枸橼酸钠抗凝)1.2检查样品的状况,有无严重溶血、微生物污染、血脂过多以及黄疸等情况。
如果污染过重或者认为样品不能被接受,要将样品情况立即通知送样人。
1.3仔细核对样本与送检单,然后编号1.4样品为全血(抗凝),用3.000r/min离心15min,血清/血浆备用。
打开标本容器时要小心,以防内容物泼溅。
样品处理时若内容物有可能溅出,则应在生物安全柜中戴手套进行。
同时应戴口罩、防护眼镜,以防皮肤或粘膜污染。
1.5 每天上午进行样品的检测。
节假日(短期1周内)进行检测的样品存放于2~8℃,需长期存放的样品,应置于-20℃以下。
需保存的血清在采集、保存过程中应注意无菌操作。
2.检测方法和步骤2.1检测方法(一)酶联免疫吸附试验(ELISA)2.1.1 基本原理以珠海丽珠试剂股份有限公司的ELISA(双抗原夹心法)为例。
采用双抗原夹心ELISA方法检测血清或血浆中人类免疫缺陷病毒HIV(1+2)型抗体。
在微孔条中预包被高纯度HIV(1+2)抗原,通过检品中抗HIV抗体桥连作用,与后面加入的HRP 标记抗原结合,HRP对底物TMB作用显色。
通过酶标仪检测吸光度(OD值)从而判定检品中是否存在抗HIV抗体。
2.1.2检测步骤实验准备:试验开始前将试剂和样品放置在室温(18~23℃),平衡30分钟后使用。
配液:将浓缩洗液用蒸馏水或去离子水20倍稀释备用备好试剂盒、待检样品和外部对照质控血清后,按试剂盒说明书以及质控和安全防护要求进行筛查检测。
准备实验原始记录表2.1.3 实验操作2.1.3.1装好所需使用数目的孔条,每孔均加入50μl样品稀释液。
留一孔作空白对照,暂不加任何液体。
另设3个阴性对照孔,1个HIV-1阳性对照孔,若需要可再设1个HIV-2阳性对照孔。
2.1.3.2每孔加入50μl待检样品及对照(对照要后加),加样时吹打混匀则效果更佳。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、目的:规范人类免疫缺陷病毒抗体测定的标准操作程序,确保人类免疫缺陷病毒抗体测
定的结果准确有效。
二、适用范围:在AutoLumo A2000化学发光检测仪上定量测定人血清中的人类免疫缺陷病
毒抗体。
三、临床意义
人类免疫缺陷病毒(俗称艾滋病病毒,英文名称是Human Immunodeficiency Virus,缩写为HIV)是一种能生存于人的血液中并攻击人体免疫系统的病毒。
HIV侵入人体后主要攻击的是一种带有CD4表面抗原的淋巴细胞(T4淋巴细胞),这种细胞是免疫系统的基本组成部分,HIV通过大量、不断地复制与释放,导致T4淋巴细胞大量死亡,使人体内T4淋巴细胞明显减少,感染者免疫功能遭到严重破坏,造成免疫缺陷,降低或失去对各种致病因素的抵抗能力,临床表现为各种机会性感染与肿瘤[1]。
有的发生神经系统病变或症状,可能与神经系统的机会性感染(弓形虫病、新隐球菌感染等)有关,同时可能是亲神经型HIV毒株的直接作用造成的。
最终,病人通常死于严重的感染和肿瘤[2]。
四、方法原理
本试剂盒采用双抗原夹心法原理进行检测。
以HIV抗原包被磁微粒,辣根过氧化物酶标记HIV抗原制备酶结合物,通过免疫反应形成抗原-抗体-酶标记抗原复合物,该复合物催化发光底物发出光子,发光强度与HIV抗体的含量成正比。
五、标本的采集与处理
5.1.采用正确医用技术收集血清样本(详见标准血液标本前处理流程)。
5. 2.样本中勿添加叠氮钠作为防腐剂。
5.3.样本中的沉淀物和悬浮物可能会影响试验结果,应离心除去,并确定样本未变质方
可使用。
5.4.样本处理、收集后在室温放置不可超过8小时;如果不在8小时内检测需将样本放
置在2~8℃的冰箱中;若需48小时以上保存或运输,则应冻存于-20℃以下,避免反复冻融。
使用前恢复到室温,轻轻摇动混匀。
六、标本拒收标准
1)严重溶血、脂血 2)标本标识不明
七、仪器与材料
7.1.仪器:适用于Lucy2、Lumo、AutoLumoA2000化学发光检测仪。
7.2.试剂:AutoLumo A2000专用人类免疫缺陷病毒抗体试剂
试剂准备:本试剂为即用型试剂,可以直接放在仪器上。
试剂盒于2~8℃储存,有效期12个月。
试剂盒应防止冷冻,避免强光照射。
试剂盒开启使用后,2~8℃保存可使用1个月。
试剂盒可适应1周内常温运输,运输过程中应轻拿轻放,避免重压,防止雨
雪淋湿和阳光曝晒。
试剂机载稳定性
1.试剂包(磁微粒混悬液、酶结合物、样品稀释液)竖直向上存放,
在2~10℃环境下冷藏保存2小时后,才可上机使用。
首次
使用后,机载或在2~10℃环境下稳定期为28天。
2.校准品开瓶后保存于2~8℃,稳定期可维持1个月;若需使用更长
时间,应根据需要进行分装,于-20℃冻存(可以保存2个月),
但应避免反复冻融。
3.试剂在2~8℃保存可稳定至标签上所标示的有效期。
7.3.质控液:推荐使用安图配套质控品或第三方质控品BioRAD QC
八、检验方法
8.1.消耗品检查:
根据仪器说明装载或检查消耗品是否充足。
参考相应的仪器系统操作说明。
8.2.试剂包装载:
试剂包首次上机前,轻轻地倒转试剂包多次以混合新试剂包内的成分,避免产生气泡。
不要倒转已经打开的试剂包。
仪器通过扫描试剂包条码自动获得测试所需的参数。
如果特殊情况下仪器无法识别条码,可以手工输入。
参考相应的仪器系统操作说明。
8.3.测试:
将样本容器放置在仪器配套样本架中,每次测试样本量为100μl。
装载样本架,在仪器软件界面中输入样本信息。
选择“运行”开始测试,系统自动进行试验操作。
参考相应的仪器系统操作说明。
8. 4.定Cutoff值:
仪器通过扫描条码卡自动获取测试所需的参数。
8.4.2.如果特殊情况下仪器无法识别条码卡,可以手工输入。
将阴阳性对照转移至样本容器,放置在仪器配套样本架中。
8.4.4.装载样本架,在仪器软件界面中输入Cutoff值信息。
8.4.5.选择“运行”开始测试,生成Cutoff值。
8.4.6. Cutoff值有效期为28天。
8.4.7.参考相应的仪器系统操作说明。
出现以下情况需要重新生成Cutoff值:
质控结果经重复测定后仍然超出范围;
试剂盒或发光底物液的批号更改;
超出Cutoff值有效期限;
仪器重要部件更换或维修。
8.5.质控:
8.5.1. 使用至少两个分析物水平的质控品进行质控。
8.5.2. 出现以下情况需要进行质控:
8.5.2.1.测试试剂盒使用超过24小时;
8.5.2.2. 更换新的试剂盒;
8.5.2.3.重新生成新的Cutoff值;
8.5.2.4.停机。
8.5.3. 各实验室需根据自身情况建立适合本实验室的可接受范围,以确保合适的测
试性能。
8.5.4. 质控值应落在规定的范围内,如出现失控,应采取纠正措施。
九、参考范围
9.1. Cutoff值=阳性对照孔平均发光值*0.4。
仪器操作时,自动计算并保存每批试剂的
Cutoff值。
9.2. 待测样本发光值<Cutoff值时,检测呈阴性反应。
9.3. 待测样本发光值≥Cutoff值时,检测呈阳性反应,严格按照《全国艾滋病检测技术
规范》进行复检及确认。
9.4. 有效性判断:阳性对照孔平均发光值/阴性性对照孔平均发光值应大于10,否则应
重新试验。
十、检验结果的解释
10.1. 检测为阴性的样本,提示未感染或未产生足够可以检测到的抗体。
10.2. 由于方法学或免疫特异性等原因,使用不同生产商的试剂对同一份样本进行检测
可能会得到不同的检测结果,因此不同试剂检测所得结果不应直接相互比较,以
免造成错误的医学解释,建议实验室在发给临床医生的检测报告中注明所用试剂
特征。
系列监测中如果改变试剂类型,则应进行额外的连续性检测并与原有试剂
结果进行平行比较以重新确定基线值。
10.3. 本试剂盒检测结果不是确认指标,用本试剂盒检测结果为临界值附近的可疑标本
以及阳性标本,应严格按照《全国艾滋病检测技术规范》进行复检及确认。
十一、检验方法的局限性
11.1.本产品检测结果仅供临床参考,不应作为临床诊治的唯一依据,对患者的临床
管理应结合其症状/体征、病史、其他实验室检查、治疗反应及流行病学等信息
综合考虑。
11.2.严重溶血、脂血或浑浊的样本可能会造成不正确的结果。
11.3.样本中的异嗜性抗体或类风湿因子会干扰检测结果,必须结合患者病史,临
床检查和其他临床资料来综合评估检测结果。
11.4.本品用于血清和血浆样本的测定,用于其他体液样本测定的可靠性尚未得到
充分确认。
十二、产品性能特征
12.1.阴性符合率:符合中国食品药品检定研究院阴性参考品的规定;
12.2.阳性符合率:符合中国食品药品检定研究院阳性参考的规定;
12.3.精密性:符合中国食品药品检定研究院精密性参考品的规定;
12.4.最低检出限:符合中国食品药品检定研究院最低检出限参考品的规定;
12.5.干扰物质:1g/L血红蛋白、0.4g/L胆红素和30g/L甘油三酯对本试剂盒检测结果无
显着影响;HBsAb、HBeAb IgG、HBcAb IgM、HCV IgG抗体、HAV IgG抗体、HEV IgG抗体、梅毒特异性抗体、ANA、类风湿因子、EB病毒IgG抗体、TORCH IgG 抗体、TORCH IgM抗体阳性样本对检测结果无显着影响;
12.6.抗凝剂的影响:使用EDTA、枸橼酸钠或肝素抗凝剂对检测结果无显着影响;
12.7.方法学对比:与SFDA批准上市的试剂盒对比检测1256份临床样本,阳性符合率
99.29%,阴性符合率:99.28%,总体符合率:99.28%。
