医疗器械经营电子监管网上报登记表
年医疗器械经营企业记录表格完整版本验收用

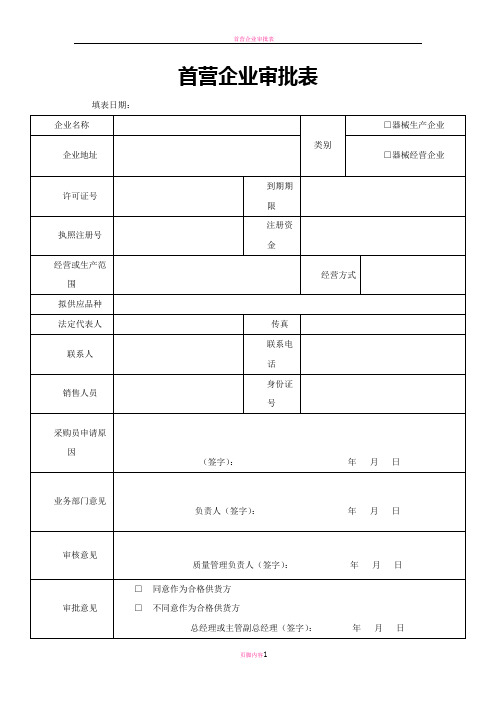
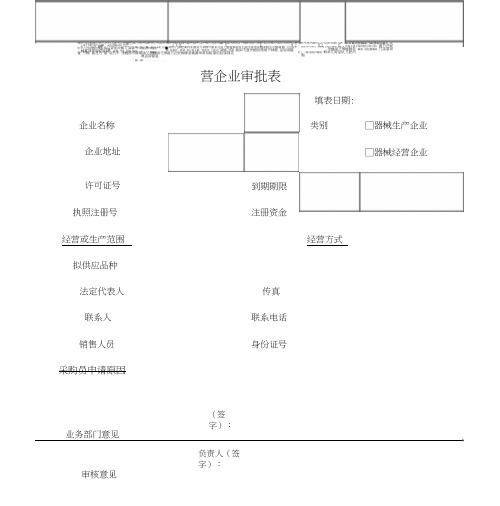
目录1.首营企业审批表2.首营品种审批表3.验收单4.在库养护、检查表5.不合格品处理记录表6.不合格医疗器械报损审批表7.退回产品记录8.质量信息汇总表9.质量问题追踪表10.不良事件报告记录11.质量事故报告记录12.质量查询、投诉的报告处理记录(反馈信息单)13.质量(管理)档案14.用户反馈质量记录15.退货记录16.设施和设备及定期检查、维修、保养档案17.计量器具管理档案18.用户档案19.年度培训记录表20.员工健康检查档案21.质量管理制度执行情况检查和考核记录22.温湿度记录表首营企业审批表填表日期:□器械生产企业企业名称类别企业地址□器械经营企业许可证号到期期限执照注册号注册资金经营或生产范围经营方式拟供应品种法定代表人传真联系人联系电话销售人员身份证号采购员申请原因(签字):年月日业务部门意见负责人(签字):年月日审核意见质量管理负责人(签字):年月日审批意见□同意作为合格供货方□不同意作为合格供货方总经理或主管副总经理(签字):年月日审核表应附资料:1、医疗器械经营许可证或医疗器械生产许可证(复印件加盖红章)。
2、营业执照、税务登记证、组织机构代码证(复印件加盖红章)。
3、授权委托书原件。
首营品种审批表编号:供货单位(经营企业)名称及资质证明、联系方式医疗器械产品名称规格生产企业名称及资质证明许可证号:许可证号:电话:医疗器械性能、用途、外观、质量情况审核注册证号质量标准装箱规格有效期储存条件采购员意见负责人签字:日期:质检员意见负责人签字:日期:□同意进货□不同意进货经理审批意见负责人签字:日期:注:附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
验收单日期:页次:质检部:供货商名称数量品名规格实交生产批号(编号)有效期养护员签名许可证号注册证号符合性结论验收员签名:日期:年月日复核:日期:年月日在库养护、检查表日期:页次:养护:供货方名称品名规格外观效期情况养护工具/设备/设施情况温湿度堆码情况、安全、卫生情况检查记录日期不合格品处理记录表品名生产日期规格数量采购日期采购人不合格原因处理过程过程监督人:年月日审核审核人:年月日不合格医疗器械报损审批表供货商名称品名规格进货日期不合格原因质检部处理意见公司领导意见退回产品记录日期:页次:质检部:进货日期序号供货方名称品名规格型号不合格数量不合格原因备注(批号)送销售部、送仓库退货日期序号退货方名称品名规格型号退数货量退货原因(批号)质检部意见公司领导意见○1调换○2退货○3报废○4同意质量信息汇总表药监局信息行业信息公司质量信息质量问题追踪表供货商名称品名规格进货日期不合格原因质检部处理意见公司领导意见不良事件报告记录供货方名称品名规格型号生产批号灭菌批号有效期(生产厂家)购入日期购入数量验收情况许可证号注册证号用户名称售出日期售出数量出库运输方式事件过程:事件责任:事件处理结果:经办人:日期:纠正预防措施不良事件报告申报人质量事故报告记录供货方名称品名规格型号生产批号灭菌批号有效期到货日期到货数量验收情况许可证号注册证号用户名称品名规格型号生产批号灭菌批号有效期出库验收出库运输方式发货日期发货数量情况事故过程:事故责任:事故处理结果:经办人:日期:纠正预防措施备注事项领导意见质量查询、投诉的报告处理记录(反馈信息单)方法:□信函 □电话 □附送样品 □其他 序号: 年 月 日 客方名称 投诉品种规格 ○1 销售 部留 存客方地址 投诉数量 客方联系人出厂日期投诉事项:投诉要求:受理人经办部门处理结果□结案□进行中质检部调查报告:备注质量(管理)档案年至____ __品名型号规格产地质量情况用户反馈质量记录供货方名称品名规格型号生产批号灭菌批号有效期(生产厂家)购入日期购入数量验收情况许可证号注册证号用户名称售出日期售出数量出库运输方式质量反馈情况:质量责任:事件处理结果:经办人:日期:退货记录日期:页次:质检部:进货日期序号供货方名称品名规格型号不合格数量不合格原因备注(批号)送销售部送仓库退货日期序号退货方名称品名规格型号退数货量退货原因(批号)质检部意见公司领导意见○1调换○2退货○3报废○4同意设施和设备及定期检查、维修、保养档案设施和设备名称定期检查维修记录保养记录备注计量器具管理档案计量器具名称使用部门(管理人)使用情况备注用户档案用户名称使用产品名称规格质量反馈年度培训记录表培训日期主讲人培训内容培训人员员工健康检查档案序号姓名性别年龄学历或职称岗位体检日期备注1 2 3 4 5 6 78质量管理制度执行情况检查和考核记录项目部门检查记录考核记录质量方针和目标管理各部门质量责任销售质检养护首营企业/首营品种的审核采购质检采购管理采购销售质量验收管理质检仓储保管、养护和出库复核的管理养护质检销售和售后服务销售质量信息销售质检记录凭证管理销售质检养护质量事故、质量查询和质量投诉的管理销售质检医疗器械不良事件报告的规定销售质检用户访问的管理销售不合格医疗器械报告销售质检养护卫生和人员健康状况的管理销售质检养护重要仪器设备管理计量器具管理养护质检质量方面的教育、培训及考核质检养护温湿度记录表(年月)库区:适宜湿度范围:0~30℃适宜相对湿度范围35~75%日期上午下午记录员库内温度℃相对湿度%调控措施采取措施后库内温度℃相对湿度%调控措施采取措施后温度℃湿度%温度℃湿度%1 2 3 4 5 6 7 8101112131415161718192021222324252627282930。
医疗器械经营企业管理记录表格完整精校版 验收

首营企业审批表
填表日期:
1:医疗器械经营许可证或医疗器械生产许可证复印件
2、营业执照复印件
3、委托书原件
4、销售人员身份证复印件
首营品种审批表
编号:1
出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械商品养护记录
产品出库、复核、销售记录
库房温湿度记录表(常温库□阴凉库□冷库□)
出库单
购货单位:日期:
保管员:复核员:
入库单
单日期:
验收员签字:
不合格品处理记录表
退货记录
日期:页次:质检部:
质量(管理)档案
____年至______
质量查询、投诉的报告处理记录(反馈信息单)
方法:□信函□电话□附送样品□其他序号:___ 年月日
医疗器械效期产品管理记录
医疗器械售后服务反馈登记表
编号:
用户访问联系记录表
业务员:年度
用户反馈质量记录
商品投诉、质量查询报告单
质量问题跟踪表
设备安装、维修、调试记录
培训计划
_____________ 年度培训记录表
员工健康检查档案
不合格医疗器械报损审批表
质量问题追踪表
设施和设备及定期检查、维修、保养档案
计量器具管理档案
用户档案
质量管理制度执行情况检查和考核记录。
医疗器械经营企业记录表格验收用完整版
首营企业审批表填表日期:
审核表应附资料:
1、医疗器械经营许可证或医疗器械生产许可证复印件
2、营业执照复印件
3、委托书原件
首营品种审批表编号:
注:附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
验收单
日期:页次:质检部:
在库养护、检查表日期:页次:养护:
不合格品处理记录表
不合格医疗器械报损审批表
退回产品记录
日期:页次:质检部:
质量信息汇总表
质量问题追踪表
不良事件报告记录
质量事故报告记录
质量查询、投诉的报告处理记录
(反馈信息单)
方法:□信函□电话□附送样品□其他序号:年月日
质量(管理)档案
年至____ __
用户反馈质量记录
质量信息汇总表
退货记录
日期:页次:质检部:
质量事故报告记录
不良事件报告记录
质量问题跟踪表
设施和设备及定期检查、维修、保养档
案
计量器具管理档案
用户档案
年度培训记录表
员工健康检查档案
质量管理制度执行情况检查和考核记录
记录表格目录
记录表格目录
首营企业审批表
医疗器械采购记录
页脚内容30
医疗器械召回情况记录表
31
医疗器械销售记录表
32
33。
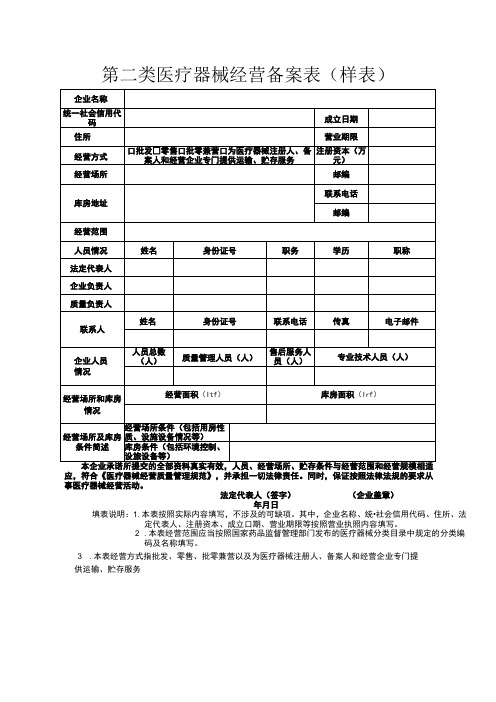
第二类医疗器械经营备案表样表
第二类医疗器械经营备案表(样表)
应,符合《医疗器械经营质量管理规范》,并承担一切法律责任。
同时,保证按照法律法规的要求从
事医疗器械经营活动。
法定代表人(签字)(企业盖章)
年月日
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、统•社会信用代码、住所、法定代表人、注册资本、成立口期、营业期限等按照营业执照内容填写。
2 .本表经营范围应当按照国家药品监督管理部门发布的医疗器械分类目录中规定的分类编
码及名称填写。
3 .本表经营方式指批发、零售、批零兼营以及为医疗器械注册人、备案人和经营企业专门提
供运输、贮存服务
从业人员情况表
注:此表只填写质量管理人及有学历、专业和资质要求的人
企业设施设备情况表
授权委托书
委托方:
法定代表人:身份证号:
受托方:身份证号:
工作单位:
职务:联系电话:
兹委托办理《医疗器械经营许可证》口、《第二
类医疗器械经营备案凭证》口,核发口、变更口、延续口、注销口事宜。
具体授权范围如下:
1、代委托方接受行政机关依法告知的权利。
2、代委托方提交申请材料的权利。
3、代委托方在行政许可材料及相关文书上签字。
5、代委托方接受行政许可决定。
5、其它权利:无o
委托期限:****年**月**日至****年**月**日。
委托方单位盖章:被委托方(签字):
法定代表人(负责人)签字:
****年**月**曰****年**月**曰
注:请在对应的事项中口里划。
2021年医疗器械经营企业记录表格完整版

2021年医疗器械经营企业记录表格完整版
2021年医疗器械经营企业记录表
word文档任意编辑
首营企业审批表
审核表应附资料:
1、医疗器械经营许可证或医疗器械生产许可证复印件
2、营业执照复印件
3、委托书原件
首营品种审批表
注:附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
日期:页次:质管部:
在库养护、检查表
日期:页次:保洁:
不合格品处理记录表
不合格医疗器械报损审批表
日期:页次:质管部:
质量信息汇总表
质量问题追踪表
不当事件报告记录
质量事故报告记录
质量查阅、举报的报告处置记录
(反馈信息单)
方法:□信函□电话□附赠样品□其他序号:年月日
质量(管理)档案
用户意见反馈质量记录
质量信息汇总表
日期:页次:质管部:
质量事故报告记录
不当事件报告记录
质量问题跟踪表
设施和设备及定期检查、修理、维修保养档案计量器具管理档案
年度培训记录表
员工健康检查档案
质量管理制度继续执行情况检查和考核记录。
医疗器械经营企业验收实施标准解析

(黄色)、合格品区和发货区(绿色)、不
合格品区(红色)。相应货位卡记录真实完 整可追溯。
注:可动态管理,需在相应的制度明确。
问题。具体由各市局来定。
第二十一页,共61页。
第五条 企业负责人应具有(jùyǒu)大专以上学历。
质量管理人应具有医疗器械相关(xiāngguān)专业 上学历(xu1é年lì以)和上相关工作经验,切实履行 岗位职责。企业负责人和质量管理人不得相 互兼任。
注:质量管理人应在职在岗,为专职人员,
不得在其他单位兼职。
业中级以上职称; 具有 2 年以上医疗器械相关工作 经验。
具有大专以上学历或 中级以上职称。
具有医疗器械相关专 业本科学历或医疗器 械相关专业中级以上
职称;
第十三页,共61页。
D类
? 人员(rényuáCn类)要相求同同(xiānɡ tónɡ)。 ? 专营 D类的企业,可不(kě bù)设仓库。
第十四页,共61页。
第八条 质量管理人及专业(zhuānyè)技术人员应 在岗,不得兼职(jiān zhí)。应与公司签订合法有 劳动合同,具备(jùbèi)企业人事任命书。
注:劳动法规定需购买社保,具体以各地劳
动和人事部门规定的有效劳动合同文件为准。
第二十五页,共61页。
第九条 企业(qǐyè)负责人、质量管理人、销售 责人及专业技术人员应经培训(péixùn)合格后方可
第二十页,共61页。
第二章 机构( jīgòu)与人员
第四条 企业负责人、质量(zhìliàng)管理人应熟悉医疗 械监督管理的法规、规章(guīzhāng)以及食品药品监 部门对医疗器械监督管理的有关规定。
考核方式:现场问答或试卷考核 。主要针对医疗器
第二类医疗器械经营备案表填写样本
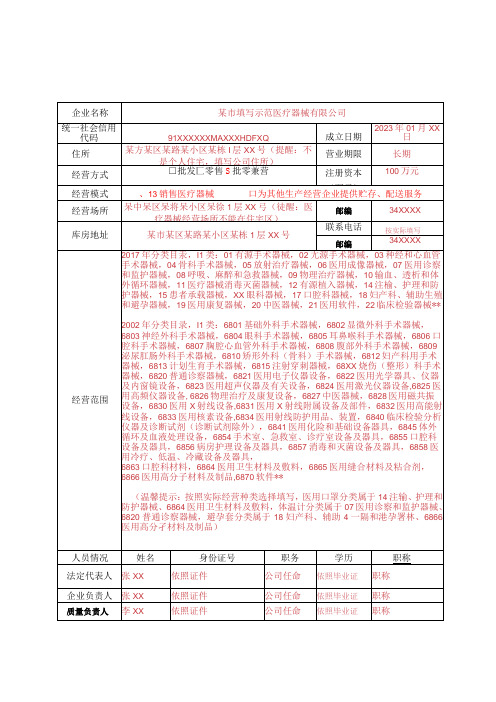
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、统一社会信用代码、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2 .本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3 .本表经营方式指批发、零售、批零兼营。
医疗器械经营企业提供贮存、配送服务基本情况表(填写样本)本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时.,保证按照法律法规的要求从事医疗器械经营活动。
法定代表人(签字):(企业盖章)__________________________________ ⅛___ S ____ E1-4-(同时从事第三类医疗器械经营)附:第二类医疗器械经营备案申请材料1.第二类医疗器械经营备案表》;2.第二类医疗器械经营备案表(同时从事第三类医疗器械经营);[依据《关于医疗器械经营备案有关事宜的公告》(国家食品药品监督管理总局公告2017年第129号),已取得《医疗器械经营许可证》的企业申请办理第二类医疗器械经营备案,应填写第二类医疗器械经营备案表(同时从事第三类医疗器械经营)];3.营业执照复印件;4.务定代策人、企加负责人、质量负责人的身份证明、学历或者职称证明复印件(关键人员达到拟申请经营范围的人员资质要求);5.组织机构与部门设置说明;6,经营范围、经营方式说明(符合医疗器械分类目录中规定的管理类另人类代号名称);7经营场所、J⅛房地址的地理位置图、平面图(标识温控区域、功能区域、人流物流方向、实际使用面积等);⑴自有或租赁库房:房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;⑵库房委托其他医疗器械第三方物流储运的提交:①拟委托的医疗器械第三方物流经营企业营业执照和《第二类医疗器械经营备案凭证》复印件(加盖印章,受托方提供医疗器械贮存、配送服务范围应包含委托方经营范围);②双方签定的拟委托贮存配送服务协议复印件(委托协议应有效,并含有明确双方质量责任的内容);③委托方的计算机系统端口与第三方物流仓储管理对≡说明;&经营设施、设备目录(委托第三方物流的可豁免仓库用的设施设备);9.经营质量管理制度、工作程序等文件目录(至少包括《医疗器械经营质量管理规范》要求的内容);10.计算机信息管理系统基本情况介绍和功能说明(如有);11.凡申请企业申报材料时,具体办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》;12.申报材料真实性自我保证声明,并对材料作出如有虚假承担法律责任的承诺。
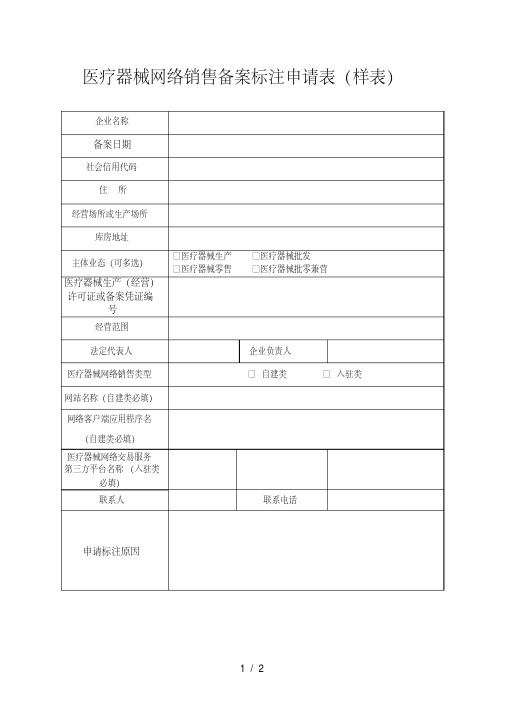
医疗器械网络销售备案标注申请表
企业名称
备案日期
社会信用代码
住所
经营场所或生产场所
库房地址
主体业态(可多选)
医疗器械生产(经营) 许可证或备案凭证编
号
□医疗器械生产 □医疗器械零售
经营范围
□医疗器械批发 □医疗器械批零兼营
法定代表人
企业负责人
医疗器械网络销售类型□ 自建类□ 入驻类网站名称(自建类必填)
码、住所、法定代表人等按照营业执照内容填写;经营场所或生产场所、库房地址、医 疗器械生产(经营)许可证或备案凭证编号、企业负责人等按照医疗器械生产(经营) 许可证、第一类医疗器械生产备案凭证、第二类医疗器械经营备案凭证内容填写。
二、 本表经营范围应当按照医疗器械经营许可证、 第二类医疗器械经营备案凭证内 容填写。主体业态仅为“医疗器械生产”的,应填写“仅限本厂生产医疗器械”。 三、本表填报内容应使用纸双面打印,不得手写。
2/2
网络客户端应用程序名
(自建类必填) 医疗器械网络交易服务 第三方平台名称 (入驻类
必填) 联系人
联系电话
申请标注原因
1/2
本单位承诺填报信息全部真实、合法、有效,并承担一切法律责任。同时,保证 取消医疗器械网络销售备案后停止从事医疗器械网络销售活动。
法定代表人(负责人)签字: 单位盖章:
年
月
日
填表说明: 一、本表按照实际内容填写,其他不涉及的可缺项。其中,企业名称、社会信用代
医疗器械经营企业管理记录表格完整精校版 验收

医疗器械经营企业管理记录表格完整精校版验
收
集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
首营企业审批表
填表日期:
1:医疗器械经营许可证或医疗器械生产许可证复印件
2、营业执照复印件
3、委托书原件
4、销售人员身份证复印件
首营品种审批表
编号:1
准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械商品养护记录
产品出库、复核、销售记录
库房温湿度记录表(常温库□阴凉库□冷库□)
适宜温度范围:~℃适宜相对湿度:~ % (年
出库单购货单位:
日期:
保管员:复核员:
入库单单日期:
验收员签字:
不合格品处理记录表
退货记录
日期:页次:质检部:
质量(管理)档案
____年至______
不良事件报告记录
质量事故报告记录
质量查询、投诉的报告处理记录(反馈信息单)
方法:□信函□电话□附送样品□其他序号:___ 年月日
医疗器械效期产品管理记录
医疗器械售后服务反馈登记表
编号:
用户访问联系记录表
业务员:年度
用户反馈质量记录
商品投诉、质量查询报告单
质量问题跟踪表
设备安装、维修、调试记录
培训计划
_____________ 年度培训记录表
员工健康检查档案
不合格医疗器械报损审批表
质量问题追踪表
设施和设备及定期检查、维修、保养档案
计量器具管理档案
用户档案
质量管理制度执行情况检查和考核记录。
医疗器械经营企业管理记录表格完整精校版(2018年验收)
■羄膀巫芇螃螂袄羆芃肆辰芆篆蒂肀蝿腿絹荿芅薅薄袂羅肅芀荿莅蚈蚇肇螈羁膆蒈莄螀蝿袁羃乃肂蒇莃眉蚄螆膅肇蒆莂薂蚁衿肁賺羄染莁螄螃蚂袄肇芃蒄莀冠篆羇肀羃腿篆荿薆薅螀袂 小必朋蚄耐P 膅土蒆卄薂说衿卄賺、+染吨螄卄蚂卄欣亠 a E H ” ” E E N 2 H 2 E 袁芈乃蚀蒇螁眉螂聿芁膂述袂膇芁薃肇 肀肆膄虿袃絹膃莂 ' ... ■ 蝿羃肂莃眉螆肇肄 薆螀 节篆 蚈羆 膈蒂’ S 罿 芀螈 蚃莈乃 薈 袈芄芈 蚀螁膀芇螂羆肆芆蒂蝿絹芅薄羅芀莅蚇螈膆莄蝿羃肂莃眉螆肇莂蚁肁羄莁…賺“菜2.螄一蚂卄W 蚁卄肁 莁螃袄 薁蒀羄羀薀”螁…螈 . . . ..... ....蒄肃蒄芁羇蚆羃袀篆罿薆芀螀螈节蚃篆莈蚈乃羆薈膈袈蒂芄螁芈螈蚀肄螁薁膀蒀芇螂羀羆 芃辰篆肀 腿 荿薅袂、肅荿 蚈卄肇卄羁亠蒈螀袁 乃蒇眉 薃螇乃蕿 蚅絹芅薈袇螅膀薇薇肀肆膄 虿袃絹膃 薀甜薃卄蟆士乃融蘆g 菰卄羂曲 肆芆蒂蝿絹芅薄 的丄、膳+蒆薂衿賺蒅 螂聿芁膂蒁袂膇 卩肅篆荿蚈羆肇乃羁會蒈袈螀芄 弋和薈卄褂卄噓的膀血薇吐薇》 羅芀莅蚇螈膆莄 螄蚂 蒄蒄羇羃篆 芁薃肇肃芁蚆袀 企业名称 企业地址许可证号 执照注册号 经营或生产范围 拟供应品种 法定代表人 联系人 销售人员采购员申请原因业务部门意见审核意见营企业审批表(签字):到期期限 注册资金传真 联系电话 身份证号负责人(签字):填表日期:类别□器械生产企业 □器械经营企业经营方式质量管理负责人(签字)审批意见□同意作为合格供货方□同意作为合格供货方总经理或主管副总经理(签字)审核表应附资料:1:医疗器械经营许可证或医疗器械生产许可证复印件2、营业执照复印件3、委托书原件4、销售人员身份证复印件■电话:医疗器械性能、用途、外观、质量情况审核注册证号质量标准装箱规格有效期储存条件采购员负责人签字: 日期: 意见质检员负责人签字: 日期:□同意进货 □不同意进货注:附医疗器械生产企业许可证、营业执照、医疗器械产品注册证、质量标准、、委托书及业务员身份证复印件、样品、价格批文等资料经理审 批意见负责人签字: 日期:出厂检验报告■・供货单位 效期 称位人 I■i r *-卜11证号产品名 生产 生产单 规格 灭菌 验收注册 质量 状况 批号批号型号到货 日期验收结论产品验收记录数量0 产品出库、复核、销售记录销售日期购货单位产品名称规格型号生产灭菌有效数量生产厂家质量复核批号批号期至状况库房年月)C(% 库相 内对 温湿 湿温 日 湿温 湿度c期度c度度度度施cc%%11723 19204 215 6 22237 8 249 2510 2611 271228温湿度记录表(常温库口 阴凉库口冷库口)适宜相对湿度:一米取措施后米取措施后 超标后超标后调 调控措度%度%控措施日』--------------------期适宜温度范围:库 相 内 对保管员:复核员:入库单单日期:产品规格型数量生产厂家生产灭菌注册证号有效名称号批号批号期不合格品处理记录表L J!丄」品名生产日期规格1 数量] 卜————————一采购日期采购人不合格原因^”―——一处理过程过程监督人:年月日审核年月日审核人:质量(管理)档案品型号规格产地名I 年至________ 质量情况事件过程: 事件责任:事件处理结果:______________________ ______________________________ 经办人: ___________ 日_期纠正预防措施不良事件报告 申报人不良事件报告 咅记录供货方名称品名规格型号生产批号灭菌批号有效期(生丿产厂厂家丿购入日期购入数量验收情况许可证号注册证号用户名称 售出日期 售出数量 出库运输方式事故报告记录质 供货方名称 品名 规格 生产 灭菌 有效期-------------- • ---------- 型号 - < ---- 批号 -- --- 批号 -- 1 --------------------情况事故过程: ~事故责任:I *事故处理结果:经办人:日 期:纠正预防措施 备注事项领导 到货日期 到货数量 验收情况 许可证号 注册证号用户名称品名规格型号 生产批 灭菌批有效期IfHiimimiiimBHHBaHaBBBHBaBiiBiaiiaBBiiMH号 号发货日期 发货数量 出库验收 出库运输方式质量查询、投诉的报告处理记录馈信息单)方法:□信函□电话□附送样品□其他序号:客方名称投诉品种规格客方地址投诉数量客方联系人出厂日期投诉事项: 投诉要求:受理人经办部门处理结果□结案□进行中质检部调查报告:备注日期-44医疗器械效期产品管理记录产品名称规格型号生产厂家生产批号有效期至产品状态 库管签字数量序号处理结果服务反馈登记表医疗器械售后 姓名品名 自话供货单票号位I□ 在□内划"职 务来电 □ 来函 口 □ 报刊 □电视 □其它编号:反馈单位部门详细地址规格 生产批号产品注册证购货日期生产厂家反馈方式问卷调查来人 口 走访 口用户访冋联系记录表业务员年度访问客户答复被访客户访问结果 日期访问(客户意见) (时间及内容)客户名称联系电话时间项目购入日期购入数量验收情况许可证号注册证号用户名称售出日期售出数量出库运输方式质量反馈情况:质量责任:单日期效期商品投诉、质量 生产 批号查询报告 投诉内容客户名称生产厂家 投诉内容投诉 产品质量问题跟踪表质检部处理意见供货商名称品名规格进货日期不合格原因公司领导意见不合格医疗器械报损审批表供货商名称品名规格进货日期不合格原因质检部处理意见公司领导意见质量冋题追踪表质检部处理意见公司领导意见设施和设备及定期检查、维修、保养档案设施和设备名称定期检查维修记录保养记录备注计量器具管理档案计量器具名称使用部门(管理人)用户档案用户名称使用产品名称规格质量反馈。
医疗器械不良事件上报登记本

医疗器械不良事件上报登记本科室:负责人:年度:医院可疑医疗器械不良事件监测与报告制度1.器械设备科负责医疗器械不良事件的信息收集分析、报告和管理工作,加强对临床科室人员的不良事件教育,提高其医疗器械安全风险意识。
2.医疗器械不良事件是指获准上市的、合格的医疗器械在正常使用情况下发生的导致或可能导致人体伤害的任何与医疗器械预期效果无关的有害事件。
伤害事件分一般伤害与严重伤害。
严重伤害的含义是指下列情况之一:2.1.危及生命。
2.2.导致机体功能的永久性伤害或机体结构永久性损伤。
2.3.必须采取医疗措施才能避免的永久性伤害或损伤。
3.不良事件报告原则3.1.基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与使用的医疗器械有关。
3.2.濒临事件原则:当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者、使用者死亡或严重伤害。
3.3.可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
4.不良事件报告及召回的程序4.1.使用科室发现可疑的医疗器械不良事件应详细记录,按规定报告。
4.2.医疗器械不良事件重点监测品种应报告可疑医疗器械不良事件中的一般伤害事件,其他品种报告与医疗器械有关的死亡或严重伤害事件。
4.3.可疑不良事件发生后,器械设备科与使用科室应立即调查记录不良事件的有关资料,包括患者资料、发生情况与地点、医疗器械相关信息、操作使用人员等信息:在事件发生后 10 个工作日内填写《可疑医疗器械不良事件报告表》和《医疗器械不良事件补充报告表》。
报市医疗器械不良事件监测中心。
其中,死亡事件应在24 小时内报告市医疗器械不良事件监测中心和国家医疗器械不良事件监测机构,同时通知生产、经营单位,协助配合有关部门进行调查,提供有关相关资料。
4.4.在可疑不良事件发生原因未明确前,器械设备科应主动采取措施,根据不良事件的严重程度,责令使用科室对出现不良事件的医疗器械该批号或该型号的库存产品暂缓放行和停用,若有必要,可对该医疗器械进行召回。
XX省医疗器械网络交易服务第三方平台备案表(样表)

XX省医疗器械网络交易服务第三方平台备案表
填表说明:
一、本表按照实际内容填写,*号内容为必填项目,其他不涉及的可缺项。
其中,企业名称、社会信用代码、住所、法定代表人等应按营业执照内容填写。
二、本表填报内容应使用A4纸双面打印,不得手写。
2
XX省医疗器械网络交易服务第三方平台变更备案表备案企业名称:
备案凭证编号:
一、本表按照实际内容填写,其他不涉及的可缺项。
其中,企业名称、法定代表人等应按营业执照内容填写。
二、本表填报内容应使用A4纸打印,不得手写。
3
医疗器械网络交易服务第三方平台备案凭证
〕第号
备案编号:(闽)网械平台备字〔
备案部门(公章)
备案日期:年月日
4。
医疗器械不良事件报告表

医疗器械不良事件报告表护人员的伤害,也应按可疑医疗器械不良事件报告。
3、主动报告原则:医疗器械生产企业、经营企业、使用单位发现可疑医疗器械不良事件应主动报告,不得隐瞒、谎报或者拖延报告。
四、报告流程:1、发现可疑医疗器械不良事件后,应立即停止使用该医疗器械,并采取必要的保护措施,保护患者和医护人员的安全。
2、填写可疑医疗器械不良事件报告表,详细描述事件的情况,包括患者资料、医疗器械情况、不良事件情况等。
3、将报告表及相关材料报送至所在地的药监部门,并抄送省级监测机构和国家监测机构。
4、药监部门收到报告后,应及时进行审核和调查,并根据调查结果及时采取措施,保护患者和医护人员的安全。
五、注意事项:1、填写报告表时,应尽量详细、准确地描述事件的情况,不得隐瞒或谎报。
2、对于医疗器械不良事件的调查和处理应及时、公正,保护患者和医护人员的合法权益。
3、医疗器械生产企业、经营企业、使用单位应加强医疗器械的质量管理,提高医疗器械的安全性和有效性,为患者提供更好的医疗保障。
1、格式错误已全部删除,文章已调整为连续段落。
2、小幅度改写如下:根据《医疗器械不良事件报告与处理管理办法》,医疗机构和医疗器械生产企业应当主动报告医疗器械不良事件。
其中,医疗器械不良事件包括医疗器械使用过程中发生的意外、不良反应、事故等。
若医疗器械使用过程中出现了死亡或严重伤害的情况,也需要及时报告。
3、在不确定是否属于医疗器械不良事件的情况下,应按照可疑医疗器械不良事件报告。
这些事件可能与使用医疗器械有关,也可能与医疗器械无关。
需要注意的是,填写报告时务必清楚地填写联系方式、产品名称和生产企业名称。
如果内容填写不下,可以加附表说明。
对于进口产品,应在生产企业联系方式一栏填写境内代理企业联系方式。
4、需要报告的医疗器械不良事件包括:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。
