燃烧和缓慢氧化
化学反应中的氧化反应

化学反应中的氧化反应一、氧化反应的定义氧化反应是指物质与氧(O)发生的化学反应。
在这个过程中,物质失去电子或者氢原子,同时氧原子获得电子或者氢原子。
氧化反应通常伴随着能量的释放,例如热能、光能和电能等。
二、氧化反应的基本类型1.燃烧反应:燃烧反应是一种剧烈的氧化反应,通常发生在有机物与氧气之间。
燃烧反应可以分为完全燃烧和不完全燃烧两种类型。
2.缓慢氧化:缓慢氧化是指一些物质与氧气发生的缓慢的化学反应,例如铁的生锈、食物的腐败等。
3.还原反应:还原反应与氧化反应相反,是指物质获得电子或者氢原子的过程。
在氧化反应中,还原剂被氧化,同时氧化剂被还原。
三、氧化反应的特征1.氧化反应通常伴随着能量的释放,例如燃烧反应可以产生热能和光能。
2.氧化反应可以使物质的颜色、状态发生改变,例如金属氧化后变黑、食物氧化后变质等。
3.氧化反应可以是可逆的,也可以是不可逆的。
可逆氧化反应指反应物和生成物之间可以相互转化,例如铁与氧气的反应;不可逆氧化反应指反应物和生成物之间不能相互转化,例如烧碱(氢氧化钠)的燃烧。
四、氧化反应的应用1.生产领域:氧化反应在生产领域中有着广泛的应用,例如炼铁、炼油、化工产品的生产等。
2.科学研究:氧化反应在科学研究中具有重要作用,例如研究物质的结构和性质、探索新的合成方法等。
3.环境保护:氧化反应在环境保护中也有一定的应用,例如利用氧化反应处理废水、废气等。
4.生活方面:氧化反应在日常生活中也随处可见,例如食物的变质、金属的腐蚀等。
总结:化学反应中的氧化反应是一种物质与氧发生的化学反应,具有广泛的应用和重要的意义。
掌握氧化反应的基本概念、类型和特征,有助于我们更好地理解和应用化学知识。
习题及方法:1.习题:判断以下反应是否为氧化反应,并说明理由。
a)2H2 + O2 -> 2H2Ob)2Fe + 3O2 -> 2Fe2O3c)该反应是氢气与氧气的反应,生成水。
这是一个典型的燃烧反应,属于氧化反应。
第四节--燃烧和缓慢氧化

第四节燃烧与缓慢氧化[知识目标]1.了解燃烧的概念、燃烧的条件和灭火原理。
2.了解燃烧和爆炸、缓慢氧化、自燃等现象之间的区别和联系。
3.常识性介绍常见易燃物和易爆物的安全知识。
[能力目标]1.培养学生的实验能力和观察能力。
2.培养学生的分析综合能力,并使学生逐步了解内因和外因之间的辩证关系。
3.培养学生的好奇心和敢于质疑,勇于探索的创新意识和品质,同时有意渗透防火意识的培养。
[教材分析]教材内容主要分为两部分,第一部分着重于描述燃烧的概念、燃烧的条件和灭火原理。
第二部分着重描述燃烧和爆炸、缓慢氧化、自燃等现象之间的区别和联系。
[教学重点]燃烧的条件和灭火的原理。
[教学难点]燃烧和爆炸、缓慢氧化、自燃等现象之间的区别和联系。
[教学方法]实验学习法、问题解决法、讲述法[课时安排]两课时第一课时[教学过程]【引入】在研究氧气的化学性质时,我们知道许多物质可以在氧气或空气中燃烧。
在本节中,我们将学习燃烧、燃烧的条件、缓慢氧化等方面的知识。
【板书】第四节燃烧与缓慢氧化【提问】试完成氧气性质实验中各化学反应的文字表达式,并说明各反应的条件和反应现象。
【讨论】由上述各反应,概括出物质燃烧的共同特征和反应实质。
待征——发光、发热实质——剧烈的氧化反应【板书】一.燃烧可燃物跟空气中的氧气发生的一种发光发热的剧烈的氧化反应。
【讲述】燃烧与人类的关系非常密切,从古人的照明、取暖到现在的生产、生活等许多方面,都离不开可燃物在燃烧中发出的光和热。
【提问】生活中有许多燃烧现象,你能根据这些现象列举一些使物质燃烧的方法吗?【回答】用火柴、打火机、烟火、炉火等火源将纸、煤、酒精灯等引燃,用电子打火点烟、钻木取火等。
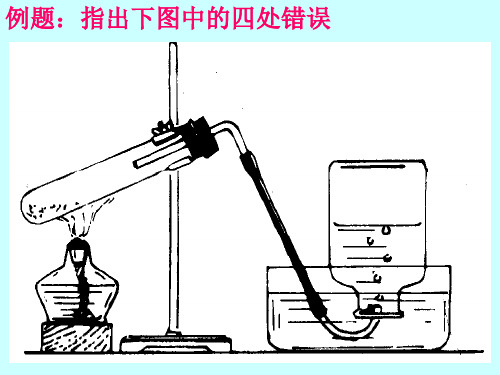
【演示】在烧杯中放入半杯80℃左右的热水,在烧杯上放一块薄铜片,在铜片的两端分别放一小粒白磷和一小堆红磷,过一会儿后白磷燃烧起来而红磷不燃烧。
【提问】通过对上述实验进行分析,可燃物在什么条件下才能够燃烧?【板书】二.燃烧的条件和灭火的原理1.燃烧的条件⑴可燃物要与氧气接触。
第四节 燃烧和缓慢氧化

第四节燃烧和缓慢氧化【知识讲解】一.燃烧的条件:可燃物在发生燃烧时需要什么条件?[演示1]红磷和白磷的燃烧条件播放视频操作步骤:在烧杯中倒入一定量的开水,向开水中投入一小块白磷。
烧杯上盖一片薄的铜片,铜片上一端放一小堆干燥的红磷,另一端放一小块已用滤纸吸去表面上水的白磷。
实验现象;不久,铜片上的白磷产生白烟并燃烧起来,而水中的白磷和铜片上的红磷并没有燃烧。
结论:要使可燃物燃烧,需要同时满足两个条件:①可燃物要与氧气接触②可燃物达到着火点(可燃物达到燃烧时所需的最低温度)[演示2]向放在热水中的白磷供给氧气播放视频现象:当向白磷供给氧气时,白磷会发生“水下燃烧”的现象。
结论:灭火的原理根据可燃物发生燃烧所必需的两个条件,可得出灭火的两种方法:①使可燃物跟空气隔绝②将可燃物的温度降到着火点以下二.燃烧的现象可燃物在燃烧时,发生不同的现象,跟两个因素有关。
(1)与可燃物的性质即内因有关:不同的物质,燃烧时会产生不同的现象。
例如,镁在空气中即可剧烈地燃烧,发出耀眼的白光,而铁丝在空气不能燃烧,在氧气中也会剧烈地燃烧,火星四射。
(2)取决于可燃物与氧气的接触面积和氧气的浓度即外因,与氧气的接触面积越大,氧气的浓度越高,燃烧就会越剧烈。
例如,硫在空气中燃烧,发出淡蓝色的火焰,而在氧气中燃烧,发出的是明亮的蓝紫色的火焰。
如果急速的燃烧发生在有限的空间内,就会在短时间内聚积大量的热量,使气体的体积迅速膨胀而引起爆炸。
若在空气中混有可燃性的气体和粉尘,它们接触到明火,就有发生爆炸的危险,所以,在油库、面粉加工厂、纺织厂和煤矿的矿井内都写有“严禁烟火”的字样。
三.缓慢氧化和自然(1)什么是缓慢氧化?燃烧是可燃物跟空气中氧气发生的一种发光发热的剧烈的氧化反应,但并不是所有的氧化反应都像燃烧那样剧烈,表现出发光、发热,有些氧化反应进行得很慢,甚至不易被察觉,这种氧化称其为缓慢氧化。
例如,动植物的呼吸,食物的腐败,酒和醋的酿造,金属的腐蚀,农家肥的腐熟等都含有缓慢的氧化。
燃烧、爆炸、缓慢氧化、自燃的联系与区别

大树起火
消防人员正在灭火
被劈开的部分树干
焦糊的树干和树上的绿叶 相映成趣
什么原因导致了大树 起火的呢?
难道真有天火吗!?
一 缓慢氧化
定义:进行得很缓慢,甚至在短时间内不易 察觉的氧化反应。
例题:下列哪些反应属于缓慢氧化? A动植物的呼吸 B 食物的腐烂 C 镁的燃烧 D 酿酒 E 农家肥的腐熟 F 金属生锈 G 锅炉爆炸 H 灯泡变黑 答案:ABDEF
下列有关缓慢氧化,燃烧和自燃说法 正确的是: A 缓慢氧化不放热 B 它们不一定化学变化 C 它们本质上都是氧化反应 D 缓慢氧化最终会引发自燃
下列关于爆炸的叙述正确的 A.
爆炸是气体物质剧烈燃烧的结果, 所以一定发生化学变化 B. 爆炸是一种现象,当气体体积在一 个受限制的空间内急剧膨胀时,就会 发生爆炸,这种现象可能因化学变化 或物理变化引起的 C. 爆炸都会伴有发光、发热的现象 D. 爆炸是缓慢氧化的必然结果
A.燃烧一定要有氧气参加 B. 燃烧反应都属于氧化反应 C. 镁等活泼金属着火不能用二氧化碳 来灭火 D. 镁在空气、二氧化碳气体中燃烧都 是放热反应
C
下列说法中正确的是
①呼吸作用、食物腐烂、铁生锈是缓慢氧化 ②燃烧不一定发光、发热③急速的燃烧一定 会发生爆炸④自燃是由缓慢氧化引起的⑤白 磷在空气中和氧气中的着火点不同⑥燃烧、 自然、缓慢氧化的共同点是都属于氧化反应, 并都有热量产生 A.①②③ B.③④⑤ C.①④⑥ D.②③⑤
缓慢
不发光,但发热
跟氧气接触,缓慢氧化 先缓 产物的热量来不及散失, 慢后 达到着火点 剧烈
先不发光,但发 热,后发光、发 热
历史故事:
从前,古罗马帝国的一支庞大的船队耀武 扬威的出海远征。船队驶近红海时,突然,一 艘装有草料的最大的给养船上冒出滚滚浓烟, 遮天蔽日。远征的战船只好收帆转舵,返航回 港。 远征军的统帅下决心要查出给养船起火的 原因,但查来查去,没有找到任何人为纵火的 证据。
燃烧与缓慢氧化的共同点

燃烧与缓慢氧化的共同点燃烧和缓慢氧化是常见的化学反应过程,它们在很多方面都存在共同点。
本文将从反应速率、反应物消耗和产物生成等方面,探讨燃烧和缓慢氧化的共同点。
燃烧和缓慢氧化都是与氧气的反应过程。
燃烧通常是指快速氧化反应,产生大量能量和火焰。
而缓慢氧化是指反应速率较慢,没有明显的火焰产生。
但无论是燃烧还是缓慢氧化,都需要氧气作为反应的氧化剂。
燃烧和缓慢氧化都需要能量的输入。
燃烧反应是放热反应,通常会释放大量的热能和光能。
而缓慢氧化反应虽然速率较慢,但仍然需要能量的输入才能进行。
例如,食物的缓慢氧化过程需要人体提供的能量。
燃烧和缓慢氧化都会消耗反应物。
燃烧反应中,燃料是主要的反应物,它在与氧气反应后被完全消耗,生成二氧化碳、水等产物。
而缓慢氧化反应中,反应物的消耗速率较慢,但也会逐渐被氧气氧化,生成较稳定的产物。
例如,金属的缓慢氧化会生成金属氧化物。
燃烧和缓慢氧化还有一个共同点是它们都是氧化反应。
在燃烧反应中,燃料与氧气发生氧化还原反应,燃料的碳氢化合物被氧气氧化为二氧化碳和水。
在缓慢氧化反应中,物质与氧气发生氧化反应,原子或分子中的氧化态发生改变。
燃烧和缓慢氧化反应的速率都可以受到外界因素的影响。
温度是影响反应速率的重要因素,燃烧和缓慢氧化反应都随着温度的升高而加快。
总结起来,燃烧和缓慢氧化在反应速率、反应物消耗和产物生成等方面存在共同点。
它们都需要氧气作为反应的氧化剂,都需要能量的输入,都会消耗反应物,并且都是氧化反应。
燃烧是快速氧化反应,产生大量能量和火焰;而缓慢氧化是较慢速率的氧化反应,没有明显的火焰产生。
无论是燃烧还是缓慢氧化,都可以受到温度和催化剂等外界因素的影响。
通过对燃烧和缓慢氧化共同点的探讨,我们可以更好地理解这两个反应过程的本质和特点。
燃烧、爆炸、缓慢氧化和自燃之间的联系与区别

燃烧、爆炸、缓慢氧化、自燃之间的区别和联系燃烧、爆炸、缓慢氧化、自燃之间的区别和联系是本单元的学习难点,也是中考的考点。
下面进行详细释疑。
1、燃烧常见的燃烧是一种发光发热的剧烈的氧化反应。
不同的可燃物燃烧的现象也有所不同,例如,酒精在空气中燃烧发出火焰(明火),木炭在空气中燃烧保持红热,木材在空气中燃烧既有明火又保持红热。
燃烧现象除了与可燃物的性质有关以外,还与可燃物跟氧气的接触面积和氧气的浓度有关,接触面积越大,氧气浓度越高,燃烧就越剧烈。
例如,劈碎了木材比大木块燃烧得快些,可燃物在氧气中燃烧比在空气中燃烧剧烈。
2、爆炸可燃物的燃烧现象还与燃烧空间有关,如果急速的燃烧发生在有限的空间,就会在短时间内聚积大量的热,使气体的体积迅速膨胀而引起爆炸。
例如,火药在鞭炮内(空间有限)燃烧而发生爆炸。
若把一个鞭炮剖开,点燃其中的火药,则不发生爆炸。
在油库、面粉加工厂、纺织厂和煤矿的矿井内,都写有“严禁烟火”的字样,就是因为这些地方的空气中常混有可燃物的气体或灰尘,它们接触明火,就有发生爆炸的危险。
3.、缓慢氧化有些氧化反得进行很慢,甚至不易觉察,这种氧化叫做缓慢氧化。
例如,动植物的呼吸,食物腐烂、钢铁生锈等都在发生缓慢氧化。
物质在缓慢氧化的过程中,也会产生热量。
例如,葡萄糖在人体内缓慢氧化产生热量维持人的体温和提供运动所需要的能量。
4、自燃某些可燃物发生缓慢氧化产生的热量没有及时散失,越积越多,引起可燃物温度升高,若达到了可燃物的着火点,不经点火就自发燃烧。
例如白磷的着火点较低(40℃),白磷放置空气中,很短时间发生自燃,再如,在秋冬季常出现由柴草缓慢氧化而引起自燃,导致发生山火。
燃烧、爆炸、缓慢氧化、自燃概念的比较注意:爆炸现象不一定都是化学变化引起的。
如:气球爆炸、锅炉爆炸等则是物理变化。
例题下列说法正确的是()A.铁丝在纯氧气中能燃烧而在空气中不燃烧,说明铁丝的着火点因不同物质而改变B.硫在空气中燃烧产生淡蓝色火焰,而在氧气中燃烧产生蓝紫色火焰,说明燃烧现象与氧气的浓度有关C.爆炸就是发生了急剧的化学变化D.缓慢氧化最终必引起自燃解析:A是错误的,因为可燃物的着火点是物质本身固有的属性,是一个定值;B是正确的,因为影响燃烧现象的因素与可燃物与氧气的接触面积、浓度有关。
燃烧和缓慢氧化教案

第四节燃烧和缓慢氧化教学目的 :知识:了解燃烧和燃烧的条件、灭火的原理;了解爆炸、缓慢氧化和自然现象以及它们与燃烧之间的区别和联系。
能力:在学生了解以上氧化反应后,引导学生联系生产及生活实验得出防火、灭火及预防自然的一些有效措施。
思想教育:使学生逐步了解内因是变化的根据,外因是变化的条件。
外因只有通过内因才能起作用的辨证思想。
重点难点:了解燃烧的条件。
教学方法:实验讨论法。
教学用具:仪器:烧杯、球胆、玻璃管、薄铜片(或铝片)、试管。
药品:白磷、红磷、热水(60以上)、氧气。
教 学 过 程教师活动学生活动教学意图【引入】天上的火,来到人间,火在大地燃烧,让愚昧化作文明,火在宇宙燃烧,使黑暗趋向光明!火为什么能推动人类历史前进? 那时人们如何保留火种? 今天让我们对火,即燃烧作一个初步的科学解释。
【板书】燃烧:可燃物跟空气中的氧气发生的一种发光、发热的剧烈的氧化反应。
【演示实验】白磷的燃烧 根据已学知识可能回答:火发出的光能驱赶猛兽、邪恶。
火发生出的热使人由生食肉改熟食。
不断在火上添加干树枝使火不灭。
记录、复述。
观察实验现象,并思考。
引发兴趣对燃烧做一个初步解释。
【问题讨论】为什么铜片上白磷燃烧而水中白磷和铜片上红磷没有燃烧? 怎样使铜片上红磷燃烧?根据观察回答:铜片上白磷燃烧是达到着火的温度而且又与空气中氧气接触,而水中白磷没与氧气接触,铜片上红磷附1:课堂练习一1.把一小块白磷放在盛有80水的烧杯中,白磷并不燃烧,这是因为()(A)温度没有达到着火点(B)温度超过着火点(C)白磷的质量太小(D)白磷没与氧气接触2.用水可以熄灭着火的木材,这是因为()(A)水蒸发吸热,降低了木材的着火点(B)水的密度比木材大(C)水蒸发吸热,提高了木材的着火点(D)大量水蒸发吸热,使温度降低到其着火点以下,而且水蒸气又起飞着使可燃物与空气隔绝的作用3.将下列灭火措施的标号填在各小题后的括号内:(A)隔绝空气(B)移开可燃物(C)使可燃物的温度低于着火点①油锅着火时,加上锅盖()②消防队员用冷水浇灭燃着的可燃物()③将沙土铺洒在燃烧的化学药品上()④草原着火时,在着火点周围割除草,打出防火道()附2:课堂练习二4.在空气中发生的燃烧、缓慢氧化和自然现象的相同点是()(A)都产生热(B)都发光(C)都很剧烈(D)都需达到着火点5.不能考虑用于油井灭火的措施是()(A)设法阻止石油喷射(B)设法使火焰绝空气(C)设法降低石油着火点(D)设法降低油井温度6.下列变化属于氧化反应的是()(A)二氧化碳使澄清石灰水变浑浊(B)加热高锰酸钾制氧气(C)酒和醋的酿造(D)镁条在氧气中燃烧7.用坩埚钳夹住镁条在酒精灯火焰上点燃,镁带燃烧发出。
燃烧和缓慢氧化

第四节 燃烧和缓慢氧化年级__________ 班级_________ 学号_________ 姓名__________ 分数____一、选择题(共42题,题分合计84分)1.使蜡烛燃烧得更旺的方法是( )A .通入氧气B .通入氮气C .通入空气D .通入稀有气体2.用水可以灭火,主要是因为( )A .水吸热变成水蒸气,降低了可燃物的着火点B .水的密度比空气大C .水蒸发吸热,提高可燃物的着火点D .大量水蒸发吸热,使可燃物温度降低到着火点以下,而且水蒸气又使可燃物与空气隔绝3.下列关于自燃的说法中正确的是()A .物质不需要任何条件就能燃烧的现象叫自燃B .凡是能发生缓慢氧化的物质都能自燃C .自燃是不需要点燃也不需要氧气的燃烧D .自燃是由缓慢氧化引起的自发燃烧,不需要点燃,但需要氧气4.下列四种变化有一种与其它三种变化在本质上不同,它是()A.蒸发B.氧化C.燃烧D.生锈5.在家中厨房里锅内的菜油不慎着火了,将油锅端离炉火后仍继续燃烧,此时灭火的最好方法是()A.立即泼水B.将锅内的油倒掉C.盖严锅盖D.向锅内撒入沙子6.下列说法中正确的是()A.燃烧、缓慢氧化、自燃都是氧化反应B.可燃物急速燃烧一定引起爆炸C.缓慢氧化一定引起自燃D.灭火的方法之一是降低可燃物的着火点7.现在高层建筑越来越多,高层建筑发生大火灾而造成的损失也越来越严重,尤其人员的伤亡更为突出。
经调查,多数死亡的人员是由于逃生不当跳楼摔死的。
为此专家呼吁,每个人都应懂得防火知识,学会逃生。
当高层楼房下层失火时,下列逃生措施正确的是()①沿楼梯迅速下楼②用湿毛巾捂住口鼻③匍匐前进寻找逃生出口④封闭房门⑤迅速转移到阳台用绳索下坠⑥跳楼A.①②③④B.②③④⑤C.③④⑤⑥D.①②③④⑤8.夏天的黑夜里,在田野中常出现"鬼火",实际上是磷生成的磷化氢与空气中的氧气接触发生()A.燃烧B.缓慢氧化C.爆炸D.自燃9.下列关于燃烧、爆炸、缓慢氧化、自燃的比较中不正确的是()A.都是氧化反应B.都要达到着火点C.都有氧气参加反应D.都放出热量10.下列变化属于化学变化的是()A.氧气在常压,-183℃时变成淡蓝色液体B.镁条长时间放置,表面失去光泽C.水加热时产生气泡D.液态空气蒸发11.下列不属于缓慢氧化的是()A.人和动物的呼吸作用B.带火星的木条伸入盛氧气的集气瓶中C.金属铁在潮湿的空气中长期放置而生锈D.未密封的酒精在空气中质量越来越少12.下列不包括缓慢氧化过程的是()A.白磷自燃B.人和动物的呼吸作用C.金属铁在潮湿的空气中长期放置而生锈D.未密封的酒精在空气中质量越来越少13.采用"使可燃物降低温度到'着火点'以下"措施灭火的是()A.林地着火时,在着火地周围把草木植被清除,开辟出防火道。
高一必修2化学燃烧和缓慢氧化教案

高一必修2化学燃烧和缓慢氧化教案高一必修2化学燃烧和缓慢氧化教案作为一名专为他人授业解惑的人民教师,编写教案是必不可少的,教案是教学活动的总的组织纲领和行动方案。
那么优秀的教案是什么样的呢?下面是小编为大家收集的高一必修2化学燃烧和缓慢氧化教案,欢迎大家借鉴与参考,希望对大家有所帮助。
教学目标知识目标:了解燃烧和燃烧的条件,了解灭火的原理;了解爆炸、缓慢氧化和自燃现象,及它们与燃烧之间的区别和相互联系。
能力目标:在学习了以上知识后,引导学生联系生产和生活实际,得出防火、灭火、及预防自燃的有效措施,培养学生解决实际问题的能力。
情感目标:培养学生热爱科学、相信科学、依靠科学的科学态度;使学生了解内因是变化的根据,外因是变化的条件,外因只有通过内因起作用的观点。
分析教材在氧气的性质和用途后,安排了燃烧和缓慢氧化。
这样能使学生认识燃烧、缓慢氧化、自燃、爆炸等现象,了解其基本原理。
本节教学内容较多,其中包括有发热发光现象的剧烈氧化(燃烧),有不发光热、现象也并不显着的缓慢氧化(金属的腐蚀和呼吸等)。
在燃烧的问题上,讲到了燃烧的条件,又要学生讨论灭火的条件,简单地提到了在有限空间里发生急速燃烧时的爆炸,也谈到了从缓慢氧化自发地转变为剧烈氧化的自燃。
为了使学生很好地抓住中心,教材中指出,所有这些现象的本质都是氧化。
只是由于条件不同而发生了不同的现象。
从而使学生自然的认识到:自然界的一切规律都受到一定条件的制约,而规律又是一切事物固有的必然性,只要有必要的条件存在,变化就会依一定方式进展。
如果学生能对以上氧化反应的各个外因条件了解得比较全面、透彻,就完全有可能想出防火、灭火和预防自燃的基本原理,乃至一些有效措施。
教学建议要求学生了解:①物质在空气里起氧化反应的时候是否有燃烧现象,决定于温度是否达到这种物质的着火点;②物质在空气里的燃烧的急速程度,取决于可燃物跟氧气的接触面积大小;③而急速的燃烧是否会引起爆炸,则决定于可燃物所处空间的大小和是否有气态生成物产生。
九年级化学第二章 第三节 氧气的制法 第四节 燃烧和缓慢氧化人教四年制知识精讲

九年级化学第二章 第三节 氧气的制法 第四节 燃烧和缓慢氧化人教四年制【同步教育信息】一. 本周教学内容第二章 第三节 氧气的制法 第四节 燃烧和缓慢氧化二. 重点、难点重点:1. 氧气的制法2. 燃烧、缓慢氧化、自燃、爆炸之间区别与联系。
难点:催化剂概念的理解三. 知识要点1. 氧气的制法:(1)工业制法:根据液态氮和液态氧的沸点不同,采用低温蒸发分离液态空气的方法得到大量氧气,属于物理变化。
)()(C 183C 196后气化先气化氧气再升温至氮气升温至液态空气加压降温空气−−−−−−→−−−−−−−→−−−−−→−︒-︒-(贮存在蓝色钢瓶中)(2)实验室制法:a. 反应原理:加热加热二氧化锰无色气体黑色粉末绿色晶体紫黑色晶体氧气二氧化锰锰酸钾高锰酸钾白色固体白色固体氧气氯化钾氯酸钾⎪⎪⎩⎪⎪⎨⎧−−→−−−−→−+++)()()()()()( 注意:① 还有些药品在实验室也可以制取氧气,但没有上述两种药品使用起来方便。
② 高锰酸钾稍稍加热就可以分解产生氧气,但在加热时常常易飞溅,因此用高锰酸钾制氧气时要在试管口部放一团棉花,以防止高锰酸钾粉末进入导管堵塞导管。
③ 单独加热氯酸钾需加热很长时间至融化后才会有氧气产生,为加快其反应速率,可加入二氧化锰作为催化剂。
催化剂在化学反应里具有“一改二不变” 的特点。
“一改”是指改变化学反应速率。
“二不变”是指反应前后催化剂本身的质量和化学性质不发生改变。
这里的“改变化学反应速率”不单指加快,也包括减慢。
例如,在食用油中加入0.01~0.02%的没食子酸正丙酯,可延缓油脂的酸败。
能加快反应速度的催化剂又叫正催化剂,能减慢化学反应速度的催化剂又叫负催化剂。
通常所说的催化剂,如果没有特别加以说明,是指能加快反应速度的正催化剂。
催化剂对反应速度的影响极大,有时能使反应速度增大数百万倍。
在化工生产中使用催化剂,可以大大提高单位时间内产品的产量,催化理论的研究和催化剂的运用在化学科学领域里占有重要地位。
九年级化学上册第七章燃烧及其利用知识点总结

第七章燃烧及其利用课题1 燃烧和灭火考试要求:认识燃烧、缓慢氧化、爆炸的条件及其防火、灭火、防爆炸的措施一、燃烧1、概念:可燃物与空气中氧气发生的一种发光、放热的剧烈的氧化反应。
2、条件:(1)可燃物(2)氧气(或空气)(3)温度达到着火点(三者缺一不可,否则不能燃烧)如右图所示:A、薄铜片上的白磷燃烧而红磷不燃烧,说明了燃烧需要温度达到着火点;B、薄铜片的白磷燃烧而水中的白磷不燃烧,说明了燃烧需要氧气白磷的着火点低,应贮存在装有水的试剂瓶中3、燃烧与缓慢氧化的比较相同点:都是氧化反应、都放热;不同点:前者发光、反应剧烈,后者不发光、反应缓慢二、灭火的原理和方法(考点一)1、燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以达到灭火的目的2、灭火的原理:(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下。
3、泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般的失火外,还可以扑灭电器、油、气等燃烧引起的失火。
液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等处的失火4、泡沫灭火器的反应原理,利用碳酸钠与浓盐酸迅速反应产生大量的二氧化碳来灭火化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑二、爆炸(考点二)概念发生条件防范措施燃烧可燃物与氧气发生的一种发光、发热的剧烈的氧化反应可燃物;与空气或氧气接触;温度达到着火点可燃物与其他物品隔离;与空气隔离;降低温度至着火点以下②化学变化的爆炸:可燃物在有限空间内急速燃烧,放出的热使气体的体积迅速膨胀③可燃性气体(氢气、一氧化碳、甲烷)或粉尘(面粉、煤粉)与空气或氧气混合,遇到明火可能会发生爆炸;可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险④油库、面粉加工厂门口贴有“严禁烟火”的标志:空气中常混有可燃性气体或粉尘,接触到明火,就有发生爆炸的危险⑤可燃物与氧气的接触面积越大,燃烧越剧烈常见灭火的方法(考点三)①油锅着火,用锅盖盖灭②电器着火,先应切断电源③煤气泄漏,先应关闭阀门,再轻轻打开门窗,切忌产生火花④酒精在桌面上燃烧,用湿抹布扑盖⑤扑灭森林火灾,将大火蔓延前的一片树木砍掉其它:A、生煤炉火时,需先引燃纸和木材,因为纸和木材的着火点比煤低,容易点燃B、室内起火,如果打开门窗,会增加空气的流通,增加氧气的浓度,反应剧烈,燃烧更旺C、用扇子扇煤炉火,虽然降低了温度,但没有降至着火点以下,反而增加了空气的流通,所以越扇越旺。
【化学课件】燃烧和缓慢氧化
第四节 燃烧和缓慢氧化
二、燃烧的现象
1、影响现象的因素
(1) 可燃物的性质
(2) 可燃物与氧气的接触面积
(3) 氧气的浓度
三、缓慢氧化和自燃
1、缓慢氧化 定义:进行得很缓慢的氧化反应
例:动植物呼吸 食物腐败 金属生锈 酒的酿造
2、自燃:由缓慢氧化习,天天向上。
四、缓慢氧化、燃烧、自燃的共同点
都 是 氧化反应
五、燃烧和缓慢氧化的比较
相同点:都是物质与氧发生的氧化反应 不同点:燃烧反应剧烈、快速、发光放热 缓慢氧化反应慢、产生热量、 不发光
六、常见易燃物易爆物的安全知识
常见易燃物、易爆物:
硫、磷、酒精、液化石油气、 氢气
1、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之毁灭。——卢梭 2、教育人就是要形成人的性格。——欧文 3、自我教育需要有非常重要而强有力的促进因素——自尊心、自我尊重感、上进心。——苏霍姆林斯基 4、追求理想是一个人进行自我教育的最初的动力,而没有自我教育就不能想象会有完美的精神生活。我认为,教会学生自己教育自己,这是一种 最高级的技巧和艺术。——苏霍姆林斯基 5、没有时间教育儿子——就意味着没有时间做人。——(前苏联)苏霍姆林斯基 6、教育不是注满一桶水,而且点燃一把火。——叶芝 7、教育技巧的全部奥秘也就在于如何爱护儿童。——苏霍姆林斯基 8、教育的根是苦的,但其果实是甜的。——亚里士多德 9、教育的目的,是替年轻人的终生自修作准备。——R.M.H. 10、教育的目的在于能让青年人毕生进行自我教育。——哈钦斯 11、教育的实质正是在于克服自己身上的动物本能和发展人所特有的全部本性。——(前苏联)苏霍姆林斯基 12、教育的唯一工作与全部工作可以总结在这一概念之中——道德。——赫尔巴特 13、教育儿童通过周围世界的美,人的关系的美而看到的精神的高尚、善良和诚实,并在此基础上在自己身上确立美的品质。——苏霍姆林斯基 14、教育不在于使人知其所未知,而在于按其所未行而行。——园斯金 15、教育工作中的百分之一的废品,就会使国家遭受严重的损失。——马卡连柯 16、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不能在他的身 上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。——苏霍姆林斯基 17、教育能开拓人的智力。——贺拉斯 18、作为一个父亲,最大的乐趣就在于:在其有生之年,能够根据自己走过的路来启发教育子女。——蒙田 19、教育上的水是什么就是情,就是爱。教育没有了情爱,就成了无水的池,任你四方形也罢、圆形也罢,总逃不出一个空虚。班主任广博的爱 心就是流淌在班级之池中的水,时刻滋润着学生的心田。——夏丐尊 20、教育不能创造什么,但它能启发儿童创造力以从事于创造工作。——陶行知
燃烧缓慢氧化自燃的相同点

燃烧缓慢氧化自燃的相同点1基本概念⑴缓慢氧化是物质与氧气发生的不易被察觉的氧化反应。
⑵自燃是缓慢氧化释放的热量得不到及时的释放,温度不断升高,温度达到可燃物的着火点而引起的燃烧。
⑶燃烧是一种伴有放热发光现象的剧烈的氧化反应。
⒉联系:本质相同,都是氧化还原反应。
⒊区别:表现不一样,主要是指反应的剧烈程度不同,燃烧最大,再是缓慢氧化。
并不是所有的氧化反应都像燃烧那样剧烈,并不一定都发光发热(至少肉眼看不出来、手感觉不到)。
当缓慢氧化放出的热量得到积累,使温度升高,从而达到着火点是,物体会自发燃烧,叫做自燃。
因此自燃是缓慢氧化长期作用的结果。
缓慢氧化不一定会引起自燃;燃烧一定是化学变化。
2 缓慢氧化与自燃有些氧化反应进行得很慢,甚至完全察觉不到(至少察觉不到是何时开始的),这类氧化反应叫做缓慢氧化。
⑴常温下,许多金属、非金属及有机物都能发生缓慢的氧化反应。
在日常生活中,缓慢氧化的例子很多,如人和动物的呼吸、食物的腐败、农家肥的腐熟、钢铁的锈蚀、橡胶和塑料的老化等,都包含着缓慢氧化。
粮食、蔬菜、水果贮存的过程中,不断放出水分和二氧化碳,质量会减少。
植物含水越多,呼吸作用越旺盛。
⑵自燃就是没有点火,物质自发地燃烧。
物质在缓慢氧化过程中产生的热量,如果不能及时散发,就会越积越多,引起温度的升高。
当温度达到该物质的着火点时,便可能燃烧起来。
这种由缓慢氧化而引起的自发燃烧叫做自燃。
缓慢氧化也可能产生可燃性物质。
食物的腐败、农家肥的腐熟、橡胶和塑料的老化等,都可能发生自燃现象。
露在地表的煤层,由于气候炎热,发生缓慢氧化反应而导致自燃。
贮存棉花、饲草的仓库,沾满机器油的破布、棉丝等堆积时间长了,通风不好有时就会自燃。
在干燥的季节,森林也会自燃。
燃烧和缓慢氧化

【案例1】燃烧和缓慢氧化教师是这样提出问题的:“1854年5月30日,英国战舰‘欧罗巴’按照作战命令开始了远涉重洋的远航,它的船舱里结结实实地装满了供战马吃的草料。
两个多月后,船舱突然冒出熊熊大火,大火迅速吞没了整艘战舰,片刻之间战舰便葬身海底,全舰官兵、战马无一生还。
事后,化学家们根据英国军事保安部门提供的材料,准确地找到了‘纵火犯’——草料。
草料怎么成了‘纵火犯’呢?”这一案例中,教师提出的问题需要运用“着火点”、“缓慢氧化”、“自燃”等主要概念进行解释,毫无疑问,教师设计的这一探究问题,很好地激发了学生的好奇心和探究欲望。
化学课程标准中,对“提出问题”这一要素的教学目标是:◇能从日常现象或化学学习中,经过启发或独立地发现一些有探究价值的问题◇能比较清楚地表达所发现的问题要达到这样的教学目标,就需要教师在化学教学中有意识地培养学生提出问题的能力。
在此,我们提供以下几种策略。
1.培养兴趣,让学生留心学习生活和社会生活中与化学相关的各种现象“兴趣是最好的老师”。
兴趣是个体行动的巨大动力,它可以引导学生走进科学的殿堂。
在探究性学习中培养学生对化学及相关问题的兴趣,他们就会留心自然、观察社会生活中与化学相关的各种现象,产生积极的情感。
相反,如果学生没兴趣,他们就会熟视无睹,一切现象和事物如过眼烟云,不会引起他们的注意。
在化学教学中培养和保持学生的兴趣我们采取如下一些方法和策略。
(1)设计新颖的课堂引入。
【案例2】二氧化碳的性质——魔术引入教师表演“清水变牛奶’’的魔术。
教师用玻璃管向澄清的石灰水中吹气,直至澄清的石灰水变浑浊。
然后教师告诉学生试管中的“清水”是澄清的石灰水让学生解释为什么向其中吹气后会变浑浊,由此引出二氧化碳的性质。
【案例3】《氯气》——故事引入1773年,舍勒在研究过程中惊奇地发现,当把黑锰矿(二氧化锰)和浓盐酸混合加热时,很快就产生了一种黄绿色的气体。
舍勒简直兴奋到了极点,因为在当时人们很少能看到有色气体。
燃烧与缓慢氧化PPT课件

对应 实验
现象
结论
着火点 触
1是
否
热水中 的白磷
不燃烧
结论1
2
否
是
铜片上 的红磷
不燃烧
结论2
3是
是
铜片上 燃烧
的白磷
结论2
当红磷与氧气接触而温度未达 到着火点时也不能发生燃烧
温度是是否与 否达到氧气接
对应 实验
现象
结论
着火点 触
1是
否
热水中 的白磷
不燃烧
结论1
2
否
是
铜片上 的红磷
不燃烧
结论2
3是
研究问题的一般方法
提收提 设验 得 出集出 计证 出 问信假 方假 结 题息设 案设 论
温度是是否与 否达到氧气接
对应 实验
现象
结论
着火点 触
1是
否
热水中 的白磷
不燃烧
结论1
2
否
是
铜片上 的红磷
不燃烧
3是
是
铜片上 燃烧
的白磷
结论1
当白磷的温度达到着火点而没 有与氧气接触时,不能发生燃烧
温度是是否与 否达到氧气接
距今70--20万年前 北京人用火取暖、 烧烤食物
燃素学说
舍勒 (C.W.Scheele
1742-1786)
普利斯特里 (J.Priestley 1733-1804)
拉瓦锡 (voisier
1743-1794)
木炭、蜡烛、硫在空气和氧气 中的燃烧现象
一、燃 烧
通常所说的燃烧是指可燃物与空 气中的氧气发生的一种发光、发热的 剧烈氧化反应。
..\..\动画\尘炸试验.swf
燃烧、缓慢氧化与自燃的关系

燃烧、爆炸、缓慢氧化、自燃之间的区别和联系燃烧、爆炸、缓慢氧化、自燃之间的区别和联系是本单元的学习难点,也是中考的考点。
下面进行详细释疑。
1、燃烧常见的燃烧是一种发光发热的剧烈的氧化反应。
不同的可燃物燃烧的现象也有所不同,例如,酒精在空气中燃烧发出火焰(明火),木炭在空气中燃烧保持红热,木材在空气中燃烧既有明火又保持红热。
燃烧现象除了与可燃物的性质有关以外,还与可燃物跟氧气的接触面积和氧气的浓度有关,接触面积越大,氧气浓度越高,燃烧就越剧烈。
例如,劈碎了木材比大木块燃烧得快些,可燃物在氧气中燃烧比在空气中燃烧剧烈。
2、爆炸可燃物的燃烧现象还与燃烧空间有关,如果急速的燃烧发生在有限的空间,就会在短时间内聚积大量的热,使气体的体积迅速膨胀而引起爆炸。
例如,火药在鞭炮内(空间有限)燃烧而发生爆炸。
若把一个鞭炮剖开,点燃其中的火药,则不发生爆炸。
在油库、面粉加工厂、纺织厂和煤矿的矿井内,都写有“严禁烟火”的字样,就是因为这些地方的空气中常混有可燃物的气体或灰尘,它们接触明火,就有发生爆炸的危险。
3.、缓慢氧化有些氧化反得进行很慢,甚至不易觉察,这种氧化叫做缓慢氧化。
例如,动植物的呼吸,食物腐烂、钢铁生锈等都在发生缓慢氧化。
物质在缓慢氧化的过程中,也会产生热量。
例如,葡萄糖在人体内缓慢氧化产生热量维持人的体温和提供运动所需要的能量。
4、自燃某些可燃物发生缓慢氧化产生的热量没有及时散失,越积越多,引起可燃物温度升高,若达到了可燃物的着火点,不经点火就自发燃烧。
例如白磷的着火点较低(40℃),白磷放置空气中,很短时间发生自燃,再如,在秋冬季常出现由柴草缓慢氧化而引起自燃,导致发生山火。
燃烧、爆炸、缓慢氧化、自燃概念的比较物理变化。
例题下列说法正确的是()A.铁丝在纯氧气中能燃烧而在空气中不燃烧,说明铁丝的着火点因不同物质而改变B.硫在空气中燃烧产生淡蓝色火焰,而在氧气中燃烧产生蓝紫色火焰,说明燃烧现象与氧气的浓度有关C.爆炸就是发生了急剧的化学变化D.缓慢氧化最终必引起自燃解析:A是错误的,因为可燃物的着火点是物质本身固有的属性,是一个定值;B是正确的,因为影响燃烧现象的因素与可燃物与氧气的接触面积、浓度有关。
燃烧和缓慢氧化

[ 解题指导 ]
• [ 分析 ]此题主要考查燃烧的条件。可燃 物燃烧必须同时具备两个条件,(1)可 燃物与氧气或空气充分接触;(2)使可 燃物达到着火点。 • [ 答案 ]1)燃烧并产生白烟;不燃烧; 不燃烧。2)白磷在水中燃烧,因为水中 白磷温度达到并超过了其燃点,又与氧气 接触,同时具备燃烧的两个条件。 • [ 点拨 ] 解决此题的关键是对可燃物燃 烧条件的应用——可燃物燃烧必须同时具 备两个条件。
一.通常的燃烧和燃烧的条件
2)可燃物燃烧的条件: a.可燃物与氧气接触; b.使可燃物达到着火 点(使可燃物燃烧 达到的最低温度)。 • 可燃物燃烧必须同 时具备这两个条件。
一.通常的燃烧和燃烧的条件
2)可燃物燃烧的条件:
水火相容
可燃物必须同时具 备燃烧的两个条 件,燃烧才能发 生。
一.通常的燃烧和燃烧的条件
• 3.灭火的原理——根据可燃物 燃烧的条件 1)与氧气脱离接触(隔绝空气); 例: 熄灭酒精灯 2)降低温度到‘着火点’以下。 例:用水灭火、风力灭火 • 综合灭火:二氧化碳灭火器。
二.燃烧的现象:
• 不同物质燃烧时的现象各不相同,即 使同一物质在空气中或氧气中燃烧的 现象也不相同。如:碳、硫、磷、蜡 烛等物质的燃烧。决定物质燃烧时现 象的主要因素有: • 1.可燃物燃烧的三个因素: 1)与可燃物的性质有关; 2)与氧气的接触面积和氧气的浓度有 关——接触面积越大, 3)氧气的浓度越大则燃烧越剧烈。
2.爆炸:“急速的燃烧发生在有限的空间” 爆炸的种类有很多,不一定都是化学变化 三.缓慢氧化和自燃:
[ 能力测试 ] 一.选择题
1.下列不包括缓慢氧化过程的是 ( ) A.白磷自燃 B.人和动物的呼吸作用 C.金属铁在潮湿的空气中长期放置 而生锈 D.未密封的酒精在空气中质量越来 越少。
第九讲氧化还原反应

第九讲氧化还原反应知识回顾一、燃烧和缓慢氧化1.燃烧燃烧是一种剧烈的发光发热的化学反应。
燃烧不一定要有氧气参加,比如金属镁(Mg)和二氧化碳反应生成氧化镁和和炭(C)。
2.缓慢氧化常温下,许多金属、非金属及有机物都能发生缓慢的氧化反应。
动植物的呼吸,食物的腐烂,酒和醋的酿造,农家肥料的腐熟等变化过程中都包含物质的缓慢氧化。
缓慢氧化不断放出水分和二氧化碳,质量会减少,虽然不剧烈,不发光,但要放热。
解读课标1.氧化还原反应的本质 --- 从电子的得失(或偏移)认识氧化还原反应钠在氯气中剧烈燃烧生成氯化钠,氢气在氯气中剧烈燃烧生成氯化氢:点燃2Na+Cl2 = 2NaCl H2+Cl2=2HCI原子失电子的反应(或电子对偏离)→氧化反应化学反应氧化还原反应原子得电子的反应(或电子对偏向)→还原反应氧化剂:得到电子(或电子对偏向),化合价降低,具有氧化性还原剂:失去电子(或电子对偏离),化合价升高,具有还原性。
2.氧化性、还原性强弱的判断根据得失电子的难易程度来判断氧化性和还原性的相对强弱,而并非根据得失电子的多少来判断。
(1)根据金属活动性顺序表判断金属单质的还原性强弱顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>Cu>Hg>Ag>Pt>Au对应金属阳离子氧化性强弱顺序Ag+>Hg2+>Fe3+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+(2)根据非金属单质活动性顺序表判断非金属单质的氧化性强弱顺序:F 2>O2>Cl2>Br2>I2>S(在某些条件下Cl2>O2)相应其阴离子的还原性强弱顺序:S2->I->Br->CI->F-(3)根据氧化还原反应方程式来判断在同一化学反应中有“氧生还,还生氧,强强生弱弱”。
