第十四章 β- 二羰基化合物
合集下载
有机化学第十四章

COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
两种产物在性质上有较大差别, 两种产物在性质上有较大差别,可分离
分子内Claisen 酯缩合(Dieckmann狄克曼缩合) 酯缩合( 狄克曼缩合) 分子内 狄克曼缩合
CH2CH2COOC2H5 CH2CH2COOC2H5 O
C2H5C O + CH2COOC2H5 CN CH3
乙酸铵-乙酸
C6H6
CH3 C2H5
C C COOC2H5 CN 85%
CHO
+
CH2(COOH)2
哌啶,95~100℃ ℃ -H2O
CH C(COOH)2
- CO2
CH CHCOOH (80%~95%)
五、Michael加成 加成
O + CH2(COOC2H5)2 C2H5ONa C2H5OH CH(COOC2H5)2 90% (C2H5)3N,叔丁醇 叔 O
三、丙二酸二乙酯的合成及应用
1、制备 、
CH2COONa Cl
NaCN
CH2COONa CNOC H 2 5
腈化反应
水解、 水解、成酯反应
2、应用 、 (1)制备取代乙酸(一取代或二取代): )制备取代乙酸(一取代或二取代): 脱H+,生成钠盐 生成钠盐
步2
制备甲基酮或烷基取代酸: 制备甲基酮或烷基取代酸:
①稀OH -,②H+,③∆ 酮式分 解 ①40%OH-,②H+,③∆ 酸式分解
CH3 CH3COCCOOC2H5 CH2CH2CH3
CH3 CH3COCHCH2CH2CH3
CH3 CH3CH2CH2CHCOOH
第14章β-二羰基化合物

(1)乙酰乙酸乙酯的制备 乙酰乙酸乙酯的制备
的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
第十四章_β-二羰基化合物
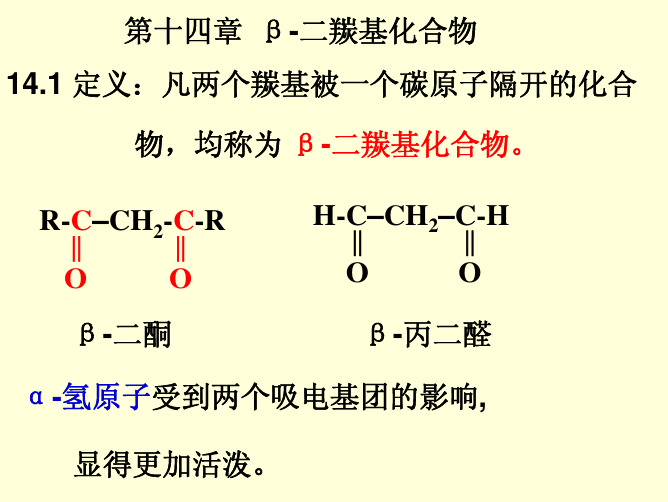
第十四章 β-二羰基化合物 14.1 定义:凡两个羰基被一个碳原子隔开的化合
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
第十四章 β-二羰基化合物

+
1
O
2 3
例2:由 CH2(COOC2H5)2
解:
Oδ CH2(COOC2H5)2 O CH(COOC2H5)2
H2O/H
+
CH2-COOH
4 5
ONaOC2H5
+
+
δ
CH(COOC2H5)2 O CH(COOH)2
-CO2
CH3COOH
O
CH2COOH
25
本章要点
⑴丙二酸酯的制备和应用。 ⑵克莱森酯缩合反应。 ⑶乙酰乙酸乙酯的应用。 ⑷互变异构。 ⑸麦克尔反应。
C-CH3
②制二酮 β- 二酮 二酮(1,3-二酮 : 二酮): 二酮
O O CH3CCHCOC2H5
O
-
Na
+
R-C-Cl or (RCO)2O
1,4-二酮: 1,4-二酮: 二酮
O O 2 CH3-C-CH2-C-OC2H5
5%NaOH H+ NaOC2H5
O O CH3CCHCOC2H5 C=O R
6
①制备烃基取代乙酸
(ⅰ)
烃基不同, 烃基不同,分步取代 利用丙二酸酯α 碳上的烷基化反应是制备 烃基取 碳上的烷基化反应是制备α 利用丙二酸酯α-碳上的烷基化反应是制备α-烃基取 代乙酸最有效的方法。 代乙酸最有效的方法。
7
8
②制备二元羧酸
Br Br
2CH2(COOC2H5)2
H2O/H+
NaOC2H5
酮式
O C
5%NaOH
H
+
O CH 3 C-CH 2 - C-CH
1,5-二羰基化合物 (1,2-加成产物)
第14章_β-二羰基化合物和有机_[1]...
![第14章_β-二羰基化合物和有机_[1]...](https://img.taocdn.com/s3/m/489a41b68762caaedd33d446.png)
不含α-H的酯如草酸二乙酯、甲酸酯、碳酸二乙酯 苯甲酸酯等在酰化反应中可分别引入-COCO2C2H5, -CHO, -COOC2H5, -COPh基团。
2. 酰基化反应
使用草酸酯得到的产物既是β-酮酯,又是α-酮 酯。由于α-酮酯在加热时可脱去羰基,为合成取 代丙二酸酯及相关化合物提供一条方便的途径。
3. 迈克尔加成反应
活泼氢化合物在催化量碱(常用醇钠,季铵碱及 苛性碱等)作用下与α, β-不饱和化合物发生1, 4-加成的反应称为Michael加成反应。
催化量 C2H5ONa + CH2=CHCCH3 C2H5OH O O (H5C2O2C) 2CH CH2CH2CCH3
CH2(CO2C2H5)2
COOC2H5 C2H5ONa PhCH2CO2C2H5 + COOC2H5 COOC2H5 C CO2C2H5 O 178° C
Ph HC
PhCH(COOC2H5)2
Ph HC
COOC2H 5 C CO 2C 2H 5 O
H 3O+
COOH Ph CH C COOH - CO2 O
PhCH2COCOOH
CH 3 O O
2-甲基-1,3-环戊二酮
练习14.2
14.1.2 β-二羰基化合物活泼氢的酸性
• β-二羰基化合物的两个羰基之间的α-氢原子的 酸性,由于其相应阴离子的共振稳定化而大大增 强。 pKa在9~13之间。 在碱的作用下,活性亚甲基上的质子具有酸性,易 脱去形成二羰基碳负离子或烯醇负离子,存在着酮 式和烯醇式的互变异构。
+ NaX
C
OC2H5 + C2H5OH
二烃基乙酰乙酸酯
α-烃基乙酰乙酸乙酯的应用
第14章 β-二羰基化合物

14.3 丙二酸酯的制备及其在有机合成上的应用
丙二酸二乙酯的制备: ①丙二酸二乙酯的制备 氯乙酸钠
◆丙二酸二乙酯分子中的α 丙二酸二乙酯分子中的α
-亚甲基上的氢非常活泼, 亚甲基上的氢非常活泼, 亚甲基上的氢非常活泼 在醇钠作用下失H形成碳负离子 形成碳负离子: 在醇钠作用下失 形成碳负离子
钠盐 碳负离子为强亲核试剂 强亲核试剂,可与卤烷发生一烃基或二烃 ◆碳负离子为强亲核试剂 可与卤烷发生一烃基或二烃 基取代反应. 基取代反应
CH2(COOC2H5)2
2 C2H5ONa Br(CH2)5Br
COOC2H5 COOC2H5
物料比1: 物料比 :1
COOH
用丙二酸酯为原料的合成法常称为丙二酸酯合成法 丙二酸酯合成法。 ◆用丙二酸酯为原料的合成法常称为丙二酸酯合成法。
14.4 乙酰乙酸乙酯的合成与 —克莱森 克莱森Claisen(酯)缩合反应 克莱森 酯 缩合反应
14.2 β-二羰基化合物的结构及反应特征 二羰基化合物的结构及反应特征
酸性:亚甲基同时受到两个羰基的影响, ① 酸性:亚甲基同时受到两个羰基的影响,使α-H 有较强的酸性(比醇和水强)。 有较强的酸性(比醇和水强)。 互变异构:酮式与烯醇式之间的互变。 二羰基 ②互变异构:酮式与烯醇式之间的互变。β-二羰基 共轭效应, 化合物,由于烯醇式存在共轭效应 能量降低, 化合物,由于烯醇式存在共轭效应,能量降低, 因而比较稳定。 因而比较稳定。 例如: 例如:
14.1 β-二羰基化合物的概念与典型化合物 二羰基化合物的概念与典型化合物 分子中含有两个羰基官能团的化合物叫二羰基化合物; ◆分子中含有两个羰基官能团的化合物叫二羰基化合物; 其中两个羰基为一个亚甲基相间隔的化合物叫β 二羰 其中两个羰基为一个亚甲基相间隔的化合物叫β-二羰 基化合物。 基化合物。 ◆β-二羰基化合物的亚甲基对两个羰基来说都是α位置, 二羰基化合物的亚甲基对两个羰基来说都是α 位置, 二羰基化合物的亚甲基对两个羰基来说都是 所以α 特别活泼 也叫含有活泼亚甲基的化合物。 特别活泼。 所以α-H特别活泼。 也叫含有活泼亚甲基的化合物。
第十四章 β-二羰基化合物

第十四章 β-二羰基化合物
(一) 命名下列化合物:
CH3 (1) HOCH2CHCH2COOH
(3) CH3CH2COCH2CHO
O (2) (CH3)2CHCCH2COOCH3
OH (4) (CH3)2C=CHCH2CHCH3
CHO
(5) ClCOCH2COOH
(7)
OCH3 NO2
OCH3 (6) OH
O
O
CH3C CH2C OC2H5 ( 以下同)
来自三乙 (1) 分析:
O
H3C C CH CH3
CH3
上2个 CH3I
O CH3C
解:
O CH2C
OC2H5
C2H5O-Na+ CH3 I
O CH3C
O CHC CH3
OC2H5
C2H5O-Na+ CH3 I
O CH3C
CH3 O CC CH3
(1) 稀OH- , (2) H+, (3) ∆
OC2H5
酮式分解
O H3C C CH CH3
CH3
CH3OH HI CH3I
OH
CH3CHCH2CH2CH2CH3
H2 Ni
(2) 分析:
O CH3CCH2CH2CH2CH3
上BrCH2CH2CH3
来自三乙
O
O
OO
CH3C CH2COC2H5 C2H5O-Na+ CH3CH2CH2Br CH3C CHCOC2H5
CH3
来自丙二
CH2(COOC2H5)2 C2H5O-Na+
解:
CH3CH=CHCOOC2H5
CH3CH CH2COOC2H5 CH(COOC2H5)2
(一) 命名下列化合物:
CH3 (1) HOCH2CHCH2COOH
(3) CH3CH2COCH2CHO
O (2) (CH3)2CHCCH2COOCH3
OH (4) (CH3)2C=CHCH2CHCH3
CHO
(5) ClCOCH2COOH
(7)
OCH3 NO2
OCH3 (6) OH
O
O
CH3C CH2C OC2H5 ( 以下同)
来自三乙 (1) 分析:
O
H3C C CH CH3
CH3
上2个 CH3I
O CH3C
解:
O CH2C
OC2H5
C2H5O-Na+ CH3 I
O CH3C
O CHC CH3
OC2H5
C2H5O-Na+ CH3 I
O CH3C
CH3 O CC CH3
(1) 稀OH- , (2) H+, (3) ∆
OC2H5
酮式分解
O H3C C CH CH3
CH3
CH3OH HI CH3I
OH
CH3CHCH2CH2CH2CH3
H2 Ni
(2) 分析:
O CH3CCH2CH2CH2CH3
上BrCH2CH2CH3
来自三乙
O
O
OO
CH3C CH2COC2H5 C2H5O-Na+ CH3CH2CH2Br CH3C CHCOC2H5
CH3
来自丙二
CH2(COOC2H5)2 C2H5O-Na+
解:
CH3CH=CHCOOC2H5
CH3CH CH2COOC2H5 CH(COOC2H5)2
第十四章 β二羰基化合物

C6H5
COOCH3 + CH3CH2CH2COOEt
NaH
N
COCHCOOEt
CH2CH3 N
3)分子内酯缩合( Dieckmann缩合) 建立五、六元脂环系 CH2COOEt CH3CH2ONa
实例 1
CH2CH2CO2C2H5 Na, C2H5OH(少量)
CH2CH2CO2C2H5
C6H5CH3
CO2C2H5 O
实例 2
CH3 CH2CHCO 2C2H5 CH2CH2CO2C2H5
CH3 CO2C2H5 O
CH3 O
CO2C2H5
CH3 O-
CO2C2H5
实例 3
O
O
CH3CH2C-CH2CH2CH2-COC2H5
酸等)
例如,用丙二酸二乙酯法合成下列化合物,其结构分析如下:
引入
CH3
原有
CH3 CH2 CH COOH
引入
原有 COOH
引入 CH2 CH2COOH CH2 CH2COOH
原有
原有 CH3 CH2 CH COOH
引入
CH2COOH
COOC2H5 CH2
C2H5ONa
COOC2H5
COOC2H5
_ CH
基的亲核加成反应;还原变为3-羟基丁酮酸乙 酯。
烯醇式结构:CH3C=CHCOOC2H5
OH
证据:烯烃性质-加溴(使溴水褪色);烯醇式 结构-三氯化铁水溶液显色;醇的性质—与三 氯化磷,乙酰氯反应等
乙酰乙酸乙酯实际是酮式和烯醇式混合物, 酮式和烯醇式混合物是互变异构,两者 处于平衡状态,互相转换。
原因如下:
1、羰基( C O)是个吸电子能力较强的基团,两个羰基对它们 中间有亚甲基的吸电子诱导作用一致,具有加和性,使得α-H的 活性增强。
COOCH3 + CH3CH2CH2COOEt
NaH
N
COCHCOOEt
CH2CH3 N
3)分子内酯缩合( Dieckmann缩合) 建立五、六元脂环系 CH2COOEt CH3CH2ONa
实例 1
CH2CH2CO2C2H5 Na, C2H5OH(少量)
CH2CH2CO2C2H5
C6H5CH3
CO2C2H5 O
实例 2
CH3 CH2CHCO 2C2H5 CH2CH2CO2C2H5
CH3 CO2C2H5 O
CH3 O
CO2C2H5
CH3 O-
CO2C2H5
实例 3
O
O
CH3CH2C-CH2CH2CH2-COC2H5
酸等)
例如,用丙二酸二乙酯法合成下列化合物,其结构分析如下:
引入
CH3
原有
CH3 CH2 CH COOH
引入
原有 COOH
引入 CH2 CH2COOH CH2 CH2COOH
原有
原有 CH3 CH2 CH COOH
引入
CH2COOH
COOC2H5 CH2
C2H5ONa
COOC2H5
COOC2H5
_ CH
基的亲核加成反应;还原变为3-羟基丁酮酸乙 酯。
烯醇式结构:CH3C=CHCOOC2H5
OH
证据:烯烃性质-加溴(使溴水褪色);烯醇式 结构-三氯化铁水溶液显色;醇的性质—与三 氯化磷,乙酰氯反应等
乙酰乙酸乙酯实际是酮式和烯醇式混合物, 酮式和烯醇式混合物是互变异构,两者 处于平衡状态,互相转换。
原因如下:
1、羰基( C O)是个吸电子能力较强的基团,两个羰基对它们 中间有亚甲基的吸电子诱导作用一致,具有加和性,使得α-H的 活性增强。
第14章 β-二羰基化合物(2012)

CO2H
Michael加成 加成
亲核取代 -CH(COOC H ) 2 5 2 亲 核加 成 (α,β-不饱和醛酮的亲核加成----Michael加成) 不 加
Michael加成是非常有用的合成 5—二羰基化合物的反应 加成是非常有用的合成1, 加成是非常有用的合成 二羰基化合物的反应
O CH2(COOC2H5)2 + NaOC2H5 HOC2H5 CH(COOC2H5)2 O - CO2 CH2COOH 90% 酸化 水解 CH(COOC2H5)2 OH
14.3 乙酰乙酸乙酯的反应及其在有机合成中的应用 乙酰乙酸乙酯的反应及其在有机合成中的应用
1. 乙酰乙酸乙酯的酯缩合逆反应 乙酰乙酸乙酯的酯缩合逆反应
O O
O-
O
CH3C-CH2-COC2H5
C2H5O-
CH3C-CH2-COC2H5 OC2H5
O CH3-COC2H5
O
+
-
CH2-COC2H5 O CH3-COC2H5
3. 乙酰乙酸乙酯的酸式分解 乙酰乙酸乙酯的酸式分解
OO-
O
O
CH3C-CH2-COC2H5
-OH(浓) (
CH3C-CH2-C-OC2H5 OH OH
O
O CH3-COH
+ -CH2-COH + C2H5OH2O H2用下, 在浓碱作用下,α−与β−位碳原子间断裂生成二分子羧酸。 位碳原子间断裂生成二分子羧酸。
生成的烯醇式稳定的原因 (1)形成共轭体系,降低了体系的内能 )形成共轭体系,
(2)烯醇结构可形成分子内氢键(形成较稳定的六元环体系) )烯醇结构可形成分子内氢键(形成较稳定的六元环体系)
苯酚的烯醇与酮式互换
第十四章 β-二羰基化合物

* *
• 水解、加热脱羧——1,5-二羰基化合物
例2:
• 水解、加热脱羧——1,5-二羰基化合物
(3)酸式分解——在浓碱(40% NaOH)中加热, 和 的C-C键断裂而生成两个分子的乙酸:
(4) 乙酰乙酸乙酯烃基化反应--与卤烷亲核取代反应
A: 一烃基取代
• -碳原子上的烃基化反应.
再反应
B: 二烃基取代
注意:两个卤代烃(不 同)分步取代,否则产 物复杂化 • 得到的 -烃基取代的乙酰乙酸乙酯,再进行酸式或酮 式分解,可制得甲基酮、二酮、一元或二元羧酸。 • 还可用来合成酮酸及其他环状或杂环化合物。
补充1:
如三级卤代烃易 消除!不行!
解:
烃基不同,分 步取代!
解:
(2) 合成二元羧酸 例如:合成丁二酸、己二酸
物料比(2:1)-直链 + CH2I2 (醇钠)成环
2 C2H5ONa CH2I2
COOC2H5 COOC2H5 COOC2H5 COOC2H5
COOH COOH
补充2: 作业8(4)
2
2
补充3: (3)环状一元羧酸
n=2, 易开环
• 二卤化物(Br(CH2)nBr,n=3~7)与丙二酸酯的成 环反应
CH2 (COOC2H5 )2
2 C2H5ONa
COOC2 H5 COOC2 H5
Br(CH2)5Br
注意物料比1:1
COOH
• 利用丙二酸酯为原料的合成方法,常称为丙二酸酯 合成法。
• 酮式分解得:-二酮
补充8
(1)与-卤代酮(Cl-CH2COR)反应
• 酮式分解——1,4-二酮 • 酸式分解——-酮酸
(2)与Br-(CH2)nCOOC2H5反应 • 酸式分解——二元酸 HOOC-(CH2)n+1COOH
• 水解、加热脱羧——1,5-二羰基化合物
例2:
• 水解、加热脱羧——1,5-二羰基化合物
(3)酸式分解——在浓碱(40% NaOH)中加热, 和 的C-C键断裂而生成两个分子的乙酸:
(4) 乙酰乙酸乙酯烃基化反应--与卤烷亲核取代反应
A: 一烃基取代
• -碳原子上的烃基化反应.
再反应
B: 二烃基取代
注意:两个卤代烃(不 同)分步取代,否则产 物复杂化 • 得到的 -烃基取代的乙酰乙酸乙酯,再进行酸式或酮 式分解,可制得甲基酮、二酮、一元或二元羧酸。 • 还可用来合成酮酸及其他环状或杂环化合物。
补充1:
如三级卤代烃易 消除!不行!
解:
烃基不同,分 步取代!
解:
(2) 合成二元羧酸 例如:合成丁二酸、己二酸
物料比(2:1)-直链 + CH2I2 (醇钠)成环
2 C2H5ONa CH2I2
COOC2H5 COOC2H5 COOC2H5 COOC2H5
COOH COOH
补充2: 作业8(4)
2
2
补充3: (3)环状一元羧酸
n=2, 易开环
• 二卤化物(Br(CH2)nBr,n=3~7)与丙二酸酯的成 环反应
CH2 (COOC2H5 )2
2 C2H5ONa
COOC2 H5 COOC2 H5
Br(CH2)5Br
注意物料比1:1
COOH
• 利用丙二酸酯为原料的合成方法,常称为丙二酸酯 合成法。
• 酮式分解得:-二酮
补充8
(1)与-卤代酮(Cl-CH2COR)反应
• 酮式分解——1,4-二酮 • 酸式分解——-酮酸
(2)与Br-(CH2)nCOOC2H5反应 • 酸式分解——二元酸 HOOC-(CH2)n+1COOH
第14章 β-二羰基化合物

CH3CCH2C-OH
CH3CCH2C-OH
十一、某酯类化合物A (C5H10O2),用乙醇钠的乙醇溶液处理,得到另一个 酯B (C8H14O3),B 能使溴水褪色,将B用乙醇钠的乙醇溶液处理后,再与碘 乙烷反应,又得到另一个酯C (C10H18O3). C和溴水在室温下不反应。把C用 稀碱水解再酸化,加热,即得一个酮D (C7H14O), D不发生碘仿反应。用锌 汞齐还原则生成3-甲基己烷,试推测A,B,C,D的结构,并写出各步反应式。 解:A,B,C,D的结构及各步反应式如下:
CH3CCH2C-OCH2CH3
ClCH2COOEt O O Cl2 , P ClCH2COOEt
CH3 C-CH-C-OCH2CH3 CH2 COOEt
CH3CCHC-OCH2CH3 + Na
4. 2,7-辛二酮
O O CH3CH2OH H+ CH2 = CH2 Cl2 O O + ClCH2 CH2Cl CH3CCHC-OCH2CH3 Na O O O CH3C-CH2 CH2 (1) 5 % NaOH (2) H
(A) CH3CH2COOEt C2 H5 (C) CH3CH2COCCOOEt CH3
(B) CH3 CH2COCHCOOEt CH3 C2 H5 (D) CH3CH2COCH CH3
CH3CH2 COOEt C2H5ONa
(A) C2 H5ONa
CH3CH2COCHCOOEt (B) CH3
Na CH3 CH2COCCOOEt CH3 C2H5I
(1) O 3 (2) Zn, H
5% NaOH
+
CHO CHCHCHO
∆
CHO
2
CH3COCH2 COO C2H5 NaOC2H5 CH3 Cl CHCOC2 H5
β二羰基化合物

O
H
快
R CH C
R' +
O H
R C CH R' + OH
OH
§14.1.2 化合物的结构对酮-烯醇平衡的影响 单羰基化合物在平衡状态下,烯醇式异构体的含量很少。
具有β-二羰基结构的化合物在平衡状态下,烯醇式的含量较高。
原因一:分子内氢键;原因二:C=C键和C=O键共轭
H3C
CH
C
C
OC2H5
O
§14.1.1 酸和碱对酮-烯醇平衡的影响
酸催化:
O:
RCH2 C
R' + H
H O +H
快
+O RCH2 C
H
R' + H2O
+O R CH C
H
H
R' +
H
:O
H
慢
R C CH R' + H3O+
OH
碱催化:
O R CH C
H
R' +
慢
: OH
O R CH C R'
O
R CH C R' + H2O
OC2H5
OC2H5离 去
O
O
H3C C CH2 C OC2H5
二、交叉酯缩合:两种酯均有α -H ,四产物,无价值。 只有一种酯有α -H ,两种产物,易分离。
HCOOC2H5
+ CH3COOC2H5 OC2H5
HCOCOCH2COOC2H5
+ CH3COCH2COOC2H5 + C2H5OH
CH3COCHCOOC2H5
第十四章 β-二羰基化合物

分析: 产物为甲基酮, 分析:(1) 产物为甲基酮,合成时一定要经过酮式分解 (2) 将目标化合物的结构与丙酮进行比较,确定 将目标化合物的结构与丙酮进行比较, 引入基团。 引入基团。 (3) 最后确定合成路线。 最后确定合成路线。 注意:当引入基团不同时, 注意:当引入基团不同时,通常是先引入活性较高 和体积较大的基团
O O O O CH3 C OC2H5
=
+
CH3 C OC2H5
=
=
=
① C2H5ONa ② CH3COOH
CH3 C CH2 C OC2H5
反应机理: 反应机理:
CH2 C OC2H5
C2H5O
+
CH2 C OC2H5
O OC2H5 O
CH2 C OC2H5
O
O
CH3 C
+
CH2 C OC2H5
的酯与不含α-H的酯 如:甲酸酯、苯甲酸酯、 的酯(如 甲酸酯、苯甲酸酯、 含α-H的酯与不含 的酯与不含 的酯 乙二酸酯和碳酸酯)之间不仅可以缩合,而且具有 乙二酸酯和碳酸酯 之间不仅可以缩合, 之间不仅可以缩合 应用价值。 应用价值。如:
O H C OC2H5 + CH3CH2COOC2H5 C2H5ONa O H C CHCOOC2H5 CH3
Cl(CH2)nCOOC2H5
O O CH3 C CH C OC2H5
= =
(CH2)nCOOC2H5
O 酸式分解 CH2 C OH (CH2)nCOOH
=
二元酸
1. 合成甲基酮
经乙酰乙酸乙酯合成: 经乙酰乙酸乙酯合成:
引入基团
引 入基 团
CH3 CH3COCH2CH3 CH3COCHCH2CH3
第十四章b二羰基化合物

O R' O
-NaX
CH3 C
C R
C
OC2H5
① R最好用1°,2°产量低,不能用3°和 乙烯式卤代烃(??碱性条件下)。
②二次引入时,第二次引入的R′要比R活泼。 (一般是体积先大后小)
③ RX也可是卤代酸酯和卤代酮。
(b) 酰基化:
OO CH3 C CH C OC2H5 Na
RCOX -NaX
2 CH3COOH + C2H5OH
OO CH3 C CH C OC2H5
ŨOH
CH3COOH + RCH2COOH + C2H5OH
R
OO
ŨOH
CH3 C CH C OC2H5
CH3COOH + RCOCH2COOH + C2H5OH
COR
14.3 丙二酸二乙酯
(1)制法:可以从氯乙酸的钠盐来制备丙二酸二乙酯。
H3C C
C C CH3 H
碳负离子和氧负离子都具有亲核性能,但反
应主要发生在亲核的碳原子上。
亚甲基活泼氢的性质:
1.酸性
α-H很活泼,具有一定的酸性,易与金属钠、乙醇 钠作用形成钠盐。
O
O
CH3 C CH2 C OC2H5 C2H5ONa
OO CH3 C CH C OC2H5 Na
Hale Waihona Puke pKa =1114.1.2 烯醇负离子的稳定性
乙酰乙酸乙酯:又叫β-丁酮酸乙酯。
以酮式和烯醇式两种结构以动态平衡而同时存在的互 变异构体。
1.互变异构现象
白() 白()
NaHSO3 OO
NH2OH CH3-C-CH2-C-OC2H5
Na H2 有活性氢 Br2/CCl4 溴褪色(具双键)
第14章β-二羰基化合物-1

EtONa R'X
R C R'
COOEt H3O COOEt
R C R'
COOH -CO2 COOH
R CHCOOH R'
先上大基团还是小基团; 先上大基团还是小基团;
COOC2H5 C2H5ONa CH2 COOC2H5
_
COOC2H5 CH COOC2H5 CH3CH2Br
COOC2H5 CH3CH2CH COOC2H5
O CH3 C CH2 92.5% O C OC2H5 CH3 OH C CH 7.5% O C OC2H5
O O CH3 C CH2 O C OC2H5 40% NaOH 成酸分解
O CH3C CH2 O C OC2H5 EtONa CH3C RX O CH3C CH O C OC2H5 O CH3C O CH R CH O
O 2 CH3COC2H5 (1) EtONa (2) H3O O O
CH3CCH2COC2H5
反应机理: 反应机理:
O CH3COC2H5 EtONa O CH2COC2H5 O CH3COC2H5 CH3 O C O CH2COC2H5
OC2H5
具有α 原子的酯可发生此反应; 原子的酯可发生此反应 具有α-H原子的酯可发生此反应; 羰基酯的方法 合成β 羰基酯的方法。 合成β-羰基酯的方法。
O R''X R R'' O O R''CR'' O R O R'' R' R''COCl 或 (R''CO)2O R O O R R'' R'' O R' CHCH2COR'' O R'' O R' R R' O O R'
第十四章 β-二羰基化合物

CH3
二取代乙酸 试剂:CH3 X
CH3CH2CH2 X
CH2(COOC2H5)2
CH3CH2
CHCOOH CH3
2-甲基丁酸
CH2(COOC2H5)2
① C2H5ONa ② CH3I ① C2H5ONa ② CH3CH2Br
CH3CH2CH(COOC2H5)2
NaOH H2O H+
CH3CH2C(COOC2H5)2 CH3
OH H2C
O C O CH2 C OC2H5
O CH3 CH
OH O CH C OC2H5
CH
CH3
×
CH3 C
2. 乙酰乙酸乙酯在合成上的应用
(1)乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用Claisen酯缩合反应合成。
O CH3 C OC2H5
+
O ① C2H5ONa CH3 C OC2H5
=
O O CH3 C CH2 C OC2H5
R X
O O CH3 C CH C OC2H5 Na+
RCOX
O O CH3 C CH C OC2H5 R O O CH3 C CH C OC2H5 R C =O
这是一个亲核取代反应,主要生成烃基化和酰基化产物。 这里卤代烷常用伯卤代烷或仲卤代烷,叔卤代烷容易消除而 不能用;乙烯型和芳基型卤代烃也不能用。
α-碳原子上的两个氢原子均可被烃基取代。
O O O R’ O ① C2H5ONa CH3 C C C OC2H5 CH3 C CH C OC2H5 X
② R’
R
R
(5)乙酰乙酸乙酯在合成上的应用
① dil. OH
O O CH3 C CH C OC2H5 R ( 酸式分解 ) ( 酮式分解 )
二取代乙酸 试剂:CH3 X
CH3CH2CH2 X
CH2(COOC2H5)2
CH3CH2
CHCOOH CH3
2-甲基丁酸
CH2(COOC2H5)2
① C2H5ONa ② CH3I ① C2H5ONa ② CH3CH2Br
CH3CH2CH(COOC2H5)2
NaOH H2O H+
CH3CH2C(COOC2H5)2 CH3
OH H2C
O C O CH2 C OC2H5
O CH3 CH
OH O CH C OC2H5
CH
CH3
×
CH3 C
2. 乙酰乙酸乙酯在合成上的应用
(1)乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用Claisen酯缩合反应合成。
O CH3 C OC2H5
+
O ① C2H5ONa CH3 C OC2H5
=
O O CH3 C CH2 C OC2H5
R X
O O CH3 C CH C OC2H5 Na+
RCOX
O O CH3 C CH C OC2H5 R O O CH3 C CH C OC2H5 R C =O
这是一个亲核取代反应,主要生成烃基化和酰基化产物。 这里卤代烷常用伯卤代烷或仲卤代烷,叔卤代烷容易消除而 不能用;乙烯型和芳基型卤代烃也不能用。
α-碳原子上的两个氢原子均可被烃基取代。
O O O R’ O ① C2H5ONa CH3 C C C OC2H5 CH3 C CH C OC2H5 X
② R’
R
R
(5)乙酰乙酸乙酯在合成上的应用
① dil. OH
O O CH3 C CH C OC2H5 R ( 酸式分解 ) ( 酮式分解 )
有机化学第14章 β-二羰基化合物
工业上乙酰乙酸乙酯可用二乙烯酮与乙醇作用制得:
乙酰乙酸乙酯为无色具有水果香味的液体,沸点181℃(稍有分解),
微溶于水,可溶于多种有机溶剂。乙酰乙酸乙酯对石蕊呈中性,但能 溶于稀氢氧化钠溶液。它不发生碘仿反应。
2.乙酰乙酸乙酯的性质
乙酰乙酸乙酯可在稀碱(或稀酸)的作用下,水解生成乙酰乙酸,
后者在加热的条件下,脱羧生成酮。这种分解称为酮式分解,可用
键形成一个稳定的六元环,另一方面烯醇式羟基氧原子上的未共用
电子对与碳碳双键和碳氧双键是共轭体系,发生了电子的离域,降 低了分子的能量的缘故。
酮—烯醇互变异构现象在羰基化合物中较为普遍,但它们的烯
醇式含量是不同的。
(在室温条件下)
14.2 乙酰乙酸乙酯的合成及应用
1.乙酰乙酸乙酯的合成
乙酰乙酸乙酯可用Claisen酯缩合反应合成。乙酸乙酯在强碱 (如乙醇钠、金属钠等)的催化下缩合,然后酸化,即可得到乙酰乙 酸乙酯。
曾讨论过烯醇式和酮式的互变异构现象。
但β-二羰基化合物的烯醇式结构却具有一定的稳定性。如β-
丁酮酸乙酯(又称为乙酰乙酸乙酯,俗称三乙),通常是以酮式和烯
醇式两种异构体的混合物形式存在的。
这种能够互相转变的两种异构体之间存在的动态平衡现象就 称为互变异构现象。
乙酰乙酸乙酯的两种异构体,可在较低的温度下,用石英容器精馏
反应式表示为:
另外,乙酰乙酸乙酯如与浓碱共热,则α-和β-碳原子之间的键
发生断裂,生成两分子乙酸盐。一般β-羰基酸都发生此反应,这种
分解称为酸式分解。
乙酰乙酸乙酯分子中亚甲基上的氢原子比较活泼,与醇钠等强碱
作用,可以生成钠的衍生物,后者可与卤代烷发生取代反应,生成烷
基取代的乙酰乙酸乙酯;在需要时还可以生成二烷基取代的乙酰乙酸 乙酯,使用更强的碱如叔丁醇钾替代乙醇钠进行反应效果更好。
第十四章 β-二羰基化合物

ÓÓ á ÓÓ á
5% NaOH ÓÓ·Ó Ó 40% NaOH ÓÓ·Ó á Ó
O R' 侧链 CH3C-CH-R + CO2 + C2H5OH R' R-CHCOONa + CH3COONa + C2H5OH
12
制环状的甲基酮:
O O
2H5
O
O
2H 5
-
CH 3 -C-CH-C-OC
NaOC
2H 5
酮式分解
9
(2) 成酸分解
O O CH3C-CH2-COC2H5
NaO H
40% NaOH
O 2 CH3C-ONa + C2H5OH
酸式分解
10
3、乙酰乙酸乙酯在合成上的应用
(1)制甲基酮
制一烃基取代的甲基酮:
O O
NaOC2H5
CH3C-CH2-COC2H5
ÓÓÓ
O O CH3C-CH-COC2H5
O C-OC2H5 CH2 C-OC2H5 O
H2O/H
+
NaOC2H5
O C-OC2H5 CH C-OC2H5 O
-CO2
-
Na+
RX
O C-OH R- CH C-OH O
O C-OC2H5 R- CH C-OC2H5 O
150-200 C
Ó
H R-CH-COOH
ÓÓÓÓú ÓÓ ù Ó á
19
O C-OC2H5 R- CH C-OC2H5 O
4
乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成 —Claisen酯缩合反应
H CH 2 COOC 2 H 5
乙酸乙酯 NaOC
5% NaOH ÓÓ·Ó Ó 40% NaOH ÓÓ·Ó á Ó
O R' 侧链 CH3C-CH-R + CO2 + C2H5OH R' R-CHCOONa + CH3COONa + C2H5OH
12
制环状的甲基酮:
O O
2H5
O
O
2H 5
-
CH 3 -C-CH-C-OC
NaOC
2H 5
酮式分解
9
(2) 成酸分解
O O CH3C-CH2-COC2H5
NaO H
40% NaOH
O 2 CH3C-ONa + C2H5OH
酸式分解
10
3、乙酰乙酸乙酯在合成上的应用
(1)制甲基酮
制一烃基取代的甲基酮:
O O
NaOC2H5
CH3C-CH2-COC2H5
ÓÓÓ
O O CH3C-CH-COC2H5
O C-OC2H5 CH2 C-OC2H5 O
H2O/H
+
NaOC2H5
O C-OC2H5 CH C-OC2H5 O
-CO2
-
Na+
RX
O C-OH R- CH C-OH O
O C-OC2H5 R- CH C-OC2H5 O
150-200 C
Ó
H R-CH-COOH
ÓÓÓÓú ÓÓ ù Ó á
19
O C-OC2H5 R- CH C-OC2H5 O
4
乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成 —Claisen酯缩合反应
H CH 2 COOC 2 H 5
乙酸乙酯 NaOC
第十四章 β-二羰基化合物

其中两个羰基由一个亚甲基间隔的化合 物,叫做β-二羰基化合物。例如:
一、β-二羰基化合物的酸性和烯醇负离子的稳定性 构造式 羰基化合物的pKa值 pKa 名称
乙酸乙酯
丙酮 丙二酸二乙酯 25 20
乙酰乙酸乙酯 ( β-丁酮酸酯)
2,4-戊二酮 (乙酰丙酮)
13
11 9
β-二羰基化合物的酸性所以比一般羰基化合物强 得多,是由于它们能发生互变异构而生成稳定的烯醇 式结构所致。 以用2,4-戊二酮为例,它在碱的作用下生成的负 离子如下式所示:
第十四章 β-二羰基化合物
学习提要
1、掌握β-二羰基化合物的酸性和烯醇负离子的稳 定性规律,学习其碳负离子的反应,包括烃化和酰 化反应。 2、学习酯缩合反应及其机理
3、学习乙酰乙酸乙酯和丙二酸乙酯在有机合成上 的应用
4、掌握麦克尔加成反应及其在合成含氧化合物上 的应用
二羰基化合物: 分子中含有两个羰基官能团的化合物。
CH3 CH2 CH COOH 引入 CH2COOH
二、乙酰乙酸乙酯在有机合成上的应用 1、制备(克莱森酯缩合法)
2、应用: 乙酸乙酯的烃化、水解和脱羧结合进行可以得到 各种甲基酮和酸。
例1:合成
O CH3 C CH2 CH2 原 引
经结构分析,需引入
CH2
O CH3 C CH CH2CH=CH2 原
(1,4-加成)
O
O
EtONa + CH2(CO2Et)2 CH3CO2H
CH(CO2Et)2
二、丙二酸酯在有机合成上的应用 1、制备
2、应用 用途:用于合成各种类型的羧酸(一取代乙酸, 二取代乙酸,环烷基甲酸,二元羧酸等)。
例如,用丙二酸二乙酯法合成下列化合物,其结 构分析如下:
一、β-二羰基化合物的酸性和烯醇负离子的稳定性 构造式 羰基化合物的pKa值 pKa 名称
乙酸乙酯
丙酮 丙二酸二乙酯 25 20
乙酰乙酸乙酯 ( β-丁酮酸酯)
2,4-戊二酮 (乙酰丙酮)
13
11 9
β-二羰基化合物的酸性所以比一般羰基化合物强 得多,是由于它们能发生互变异构而生成稳定的烯醇 式结构所致。 以用2,4-戊二酮为例,它在碱的作用下生成的负 离子如下式所示:
第十四章 β-二羰基化合物
学习提要
1、掌握β-二羰基化合物的酸性和烯醇负离子的稳 定性规律,学习其碳负离子的反应,包括烃化和酰 化反应。 2、学习酯缩合反应及其机理
3、学习乙酰乙酸乙酯和丙二酸乙酯在有机合成上 的应用
4、掌握麦克尔加成反应及其在合成含氧化合物上 的应用
二羰基化合物: 分子中含有两个羰基官能团的化合物。
CH3 CH2 CH COOH 引入 CH2COOH
二、乙酰乙酸乙酯在有机合成上的应用 1、制备(克莱森酯缩合法)
2、应用: 乙酸乙酯的烃化、水解和脱羧结合进行可以得到 各种甲基酮和酸。
例1:合成
O CH3 C CH2 CH2 原 引
经结构分析,需引入
CH2
O CH3 C CH CH2CH=CH2 原
(1,4-加成)
O
O
EtONa + CH2(CO2Et)2 CH3CO2H
CH(CO2Et)2
二、丙二酸酯在有机合成上的应用 1、制备
2、应用 用途:用于合成各种类型的羧酸(一取代乙酸, 二取代乙酸,环烷基甲酸,二元羧酸等)。
例如,用丙二酸二乙酯法合成下列化合物,其结 构分析如下:
第十四章 β-二羰基化合物
2–氧代环戊甲酸乙酯
二乙酰乙酸乙酯的合成及其应用
2 性质 1)互变异构现象 实验事实:
O
NaHS O3
O
CH 3CCH 2C OC2H5
能与
HCN NH 2OH
反应,具有酮的性质
等
O
O
能与
Na Br2/CCl 4
具有醇的性质
CH 3CCH 2C OC2H5
与 FeCl 3发 生 颜 色 反 应
二乙酰乙酸乙酯的合成及其应用
O
C2H5OC C
CH2COC2H5 + CH3CCH2COC2H5 + C2H5OH
2)分子内酯缩合——Dieckmann condensation
CH2CH2COOC2H5 CH2CH2COOC2H5 O
(1) NaOC2H5, C6H6, 80℃ (2) H3O+, 80%
H COOC2H5
己二酸乙酯
α-丙酮酸 或乙酰甲酸
β-丁酮酸或乙酰乙酸
O
O
β -丁酮酸乙酯或乙酰乙酸乙酯
CH 3CCH 2C OC2H5
一 酮–烯醇互变异构
O R2CCR' H OH R2C CR'
(互变异构)
由分子内的原子或基团连接的位置不同而产 生的异构——互变异构
1 酸和碱对酮–烯醇平衡的影响 酸催化的酮–烯醇互变异构:
H O R C H C R' + H:B H
快
O H C R'
H
慢
O H C R' + H:B
R C H
R C
B:
碱催化的酮–烯醇互变异构:
H O HO: + R C H C R'
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δ C
δC
δ C
δ O
βα
由于羰基的极化和共轭π 键的离域,不仅 羰基碳上带有部分正电荷, β C 上也带有 部分正电荷,因此与亲核试剂加成时就有两 种可能
C C C O + Nu
1,2加成
H CCCO
Nu
1,4-加成
CCCO H Nu
C C C OH Nu
C C C OH Nu
不稳定(互变) H CCCO Nu
引
例 2:合成
O CH3
引
CH3 C CH CH2CH=CH2
原
要分两次引入,先引入 CH3 再引入 CH2CH=CH2
9
例 3:合成
O
O
CH3 C CH2 C
原
引
O
C CH3
引
原
说明:乙酰乙酸乙酯合成法主要用其酮式分解制取酮,酸式分解制酸很少,制酸一般用 丙二酸二乙酯合成法。
§14.6 不饱和羰基化合物
OO CH3 C CH C OC2H5 稀 OH
COR
O
O
CH3 C CH2 C R
C2H5OH + CO2 C2H5OH + CO2
(b) 酸式分解 乙酰乙酸乙酯及其取代衍生物在浓碱作用下,主要发生乙酰基的断
3
例如:
裂,生成乙酸或取代乙酸,故称为酸式分解。
O
O
浓NaOH
CH3 C CH2 C OC2H5
反应主要发生在亲核的碳原子上。
亚甲基活泼氢的性质:
1.酸性
乙酰乙酸乙酯的α-C 原子上由于受到两个吸电子基(羰基和酯基)的作用,α-H 很活
2
泼,具有一定的酸性,易与金属钠、乙醇钠作用形成钠盐。
O
O
CH3 C CH2 C OC2H5 C2H5ONa
OO CH3 C CH C OC2H5 Na
pKa =11
R CHCOOH R'
COOC2H5 COOC2H5
NaOH H2O
(1) H
(2)
CO2
COOH
(3)丙二酸二乙酯在有机合成的应用 丙二酸二乙酯的上述性质在有机合成上用途很广,用于合成各种类型的羧酸(一取代乙 酸,二取代乙酸,环烷基甲酸,二元羧酸等)。 例如,用丙二酸酯合成法合成下列化合物,其结构分析如下:
R
COOC2H5
C
R' COOC2H5
4
2 CH2(COOC2H5)2
NaOC2H5 X(CH2)nX n = 3~7
CH(COOC2H5)2 (CH2)n CH(COOC2H5)2
C(COOC2H5)2 CH2I2
(CH2)n CH2 NaOC2H5
C(COOC2H5)2
2.水解脱羧
CH2(COOC2H5)2 (1) NaOC2H5 (2) Br(CH2)4Br
COOC2H5 CH2
COOC2H5
NaOC2H5
COOC2H5 Na CH
COOC2H5
pKa = 13
COOC2H5 Na CH
COOC2H5
RX -NaX
COOC2H5 R CH
COOC2H5
COOC2H5 R CH
COOC2H5
NaOC2H5
COOC2H5
RC
Na
COOC2H5
RX -NaX
(1)制法:可以从氯乙酸的钠盐来制备丙二酸二乙酯。
CH3COOH P Cl2 CH2COOH Cl
NaCN NaOH
CH2COONa C2H5OH
CN
H2SO4
COOC2H5 CH2
COOC2H5
(2)性质
1.酸性和烃基化:活泼亚甲基能与醇钠反应生成钠盐,产生的碳负离子(强亲核试剂)
与卤代烃反应,产生一烃基取代的丙二酸酯。
2.钠盐的烷基化和酰基化
乙酰乙酸乙酯的钠盐与卤代烃、酰卤反应,生成烃基和酰基取代的乙酰乙酸乙酯。
(a)烷基化:
OO CH3 C CH C OC2H5 Na
RX -NaX
OO CH3 C CH C OC2H5
R
CH3
OO C CH C
OC2H5
C2H5ONa CH3
O CC
O C
OC2H5
Na
R
R
R'X -NaX
④ Dieckmann 缩合反应 酯缩合反应也可在分子内进行,形成环酯,这种环化酯缩合反应又称为 Dieckmann 反应。 (己二酸酯和庚二酸酯在醇钠作用下进行自身的酯缩合反应)
注意!酯缩合常用的碱性催化剂是醇钠 RONa,不是醇加钠。醇加钠是一组还原剂,它要 将酯还原成醇。
它是合成五元环、六元碳环的一个方法。(并不是所有的二元酸酯都能发生环缩合,一般 局限于生成稳定的五、六碳环。所以,只是有α氢的己二酸酯和庚二酸酯才能起 Dieckmann 缩合)如:
第十四章 β-二羰基化合物
学习目的及基本要求: 1.掌握酯的水解和克莱森(Claisen)酯缩合历程。 2.掌握乙酰乙酸乙酯和丙二酸二酯在合成上的应用。 3. 理解互变异构。 4.理解合成路线设计的基本知识。 5.了解麦克尔加成的涵义和应用。 重点:酯的水解和克莱森(Claisen)酯缩合历程,乙酰乙酸乙酯和丙二酸二酯在合成上的 应用。 难点:互变异构,碳负离子和α,β-不饱和羰基化合物的共轭加成——麦克尔反应。 教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
C C Z +R H
(Z 代表能和 C=C 共轭的基团)
CCZ RH
CH3 C CH
R
一取代丙酮
+ CO2 + C2H5OH
① 浓 OH② H+
O R CH2 C OH + CH3COOH + C2H5OH
一取代乙酸
同理,二取代乙酰乙酸乙酯进行酮式分解将得到二取代丙酮;进行酸式分解将得到二取 代乙酸。
O
例 1:合成
CH3 C CH2 CH2
经结构分析,需引入
CH2
原
COOC2H5 COOC2H5
丙二酸二乙酯及其取代衍生物水解生成丙二酸,丙二酸不稳定,易脱羧成为羧酸。
例如:
COOC2H5 R CH
COOC2H5
COONa
NaOH
(1) H
R CH
H2O
COONa (2)
R CH2COOH CO2
R COOC2H5 C
R' COOC2H5
NaOH H2O
(1) H (2) CO2
当酯的α-碳上只有一个氢时,由于增加了烃基的诱导效应,酸性减弱了,进行酯缩合反应 时,需要使用比醇钠更强的碱(如ph3CNa,NaH),夺取酯的α氢,形成较稳定的α负碳离子,才 能迫使反应朝右方进行。
② 交叉 Claisen 缩合 如两个酯只有一个酯有α—H,相互缩合就能得到一个单纯产物。
7
③ 酮与酯缩合 酮的α-H 比酯的α-H 活泼:
不饱和羰基化合物是指分子中即含有羰基,又含有不饱和烃基的化合物,根据不饱 和键和羰基的相对位置可分为三类。
(1) 烯酮(RCH=C=O) (2) α,β-不饱和醛酮(RCH=CH-CHO) (3) 孤立不饱和醛酮 (RCH=CH(CH2)nCHO) n≥1 孤立不饱和醛酮兼有烯和羰基的性质,α,β-不饱和醛酮、烯酮有其特性及用途,下面 我们主要讨论这两类化合物。 14.6.1 乙烯酮 最简单且最重要的烯酮是乙烯酮。 14.6.2α,β-不饱和醛酮 α,β-不饱和醛酮的结构特点是碳碳双键与羰基共轭,故α,β-不饱和醛酮兼有烯烃、 醛、酮和共轭二烯烃的性质,若与亲电试剂加成,则应加到碳碳双键上,若与亲核试剂加成 则应加到羰基上,但其特性反应是共轭加成。 1.共轭加成(1,2-加成或 1,4-加成)
14.1.2 烯醇负离子的稳定性
乙酰乙酸乙酯:又叫 β-丁酮酸乙酯,简称三乙,是酮式和烯醇式互变异构的一个最著名的 例子。
(1)性质:在室温下为无色液体,无色有水果香味的液体;沸点 180.4CO;微溶于水, 易溶于乙醚、乙醇等有机溶剂。以酮式和烯醇式两种结构以动态平衡而同时存在的互变异构 体。
1.互变异构现象
2 CH3COOH &#OH
CH3COOH + RCH2COOH + C2H5OH
R
OO
浓 OH
CH3 C CH C OC2H5
CH3COOH + RCOCH2COOH + C2H5OH
COR
14.3 丙二酸二乙酯
丙二酸二乙酯CH2(COOC2H5)2为无色液体,有芳香气味,沸点 199.3℃,不溶于水,易 溶于乙醇、乙醚等有机溶剂。
C OC2H5
CH
(2)烯醇负离子:在碱的作用下生成烯醇负离子,以 2,4-戊二酮为例
O H3C C
H2 O
OH
C C CH3
O H3C C
O C C CH3 H
O H3C C
O H3C C
O C C CH3 H
O C C CH3 H
14.2β-二羰基化合物碳负离子的反应
由共振结构式可知,碳负离子都具有带负电荷的碳原子或氧原子,都具有亲核性能,但
14.4.酯缩合反应: ① 克莱森(Claisen)缩合反应- 乙酰乙酸乙酯的合成
这类反应称为 Claisen 缩合反应 历程:
6
乙酸乙酯的酸性是很弱的(Pka~24),而乙醇钠又是一个比较弱的碱(乙醇Pka~15.9)。 因此,可以想到乙酸乙酯形成的负离子在平衡体系中是很少的。这也就是说,用乙氧负离子 把乙酸乙酯变为 -CH2COOC2H5是很困难的。但是在实际上为什么这个反应会进行的如此完全呢? 其原因就是最后产物乙酰乙酸乙酯是一个比较强的酸(Pka~11),形成很稳定的负离子,可 以使平衡朝产物方向移动。体系中乙酸乙酯负离子浓度虽然很低,但一形成后,就不断的反应, 结果使反应完成。
