第七章 消除反应汇总
第十七讲 第七章 卤代烃 相转移催化反应 邻基效应

有 机 化 学
反应相似, 反应也常伴有重排反应发生。例如: 反应也常伴有重排反应发生 与SN1反应相似, E1反应也常伴有重排反应发生。例如: 反应相似
CH3
CH3 CH3 CH3 C2H5OH 甲基迁移 CH3 C CH2 H+ CH3 C CHCH3 CH3 C CH2 重排 C CH2Br 解离 CH3 CH3 CH3 CH3
Br
第 十 七 讲 (6)
Br CH3 CH CH CH2 H H 2 1 HO
过渡态I较稳定
2
CH3 CH2 CH HO
CH2 H
1 9%
CH3CH2CH CH2 (Ⅳ)
过渡态II较不稳定
有 机 化 学
C2H5O-
81% 47% 14% 2%
19% 53% 86%
CH3CH2CHCH3 Br
(CH3)3CO-
C C
Cl H β´
β
反式消除
B
H C C X
CH3 H
OH HCl
(CH3)2CH Cl
(CH3)2CH
CH3
(I) )
(CH3)2CH
(II) )
H
有 机 化 学
反应中, 在E2反应中,试剂碱不直接参与加快碳卤键的断裂作用,而进攻β−氢 反应中 试剂碱不直接参与加快碳卤键的断裂作用, 原子, 反应中那样明显。 原子,其空间效应不像 SN2 反应中那样明显。因而卤代烷β−氢原子的多少 决定E2反应速率的快慢 所以卤代烷的反应活性顺序为: 反应速率的快慢, 决定 反应速率的快慢,所以卤代烷的反应活性顺序为: 叔卤代烷>仲卤代烷 伯卤代烷。 仲卤代烷>伯卤代烷 叔卤代烷 仲卤代烷 伯卤代烷。 同理,新孟基氯(新氯孟烷)在强碱作用下消除HCl生成 生成75%的3-孟烯 同理,新孟基氯(新氯孟烷)在强碱作用下消除 生成 的 孟烯 孟烯, 规则。 和25%的2-孟烯,也证明了是反式消除,消除的取向遵循 的 孟烯 也证明了是反式消除,消除的取向遵循Saytzff规则。 规则
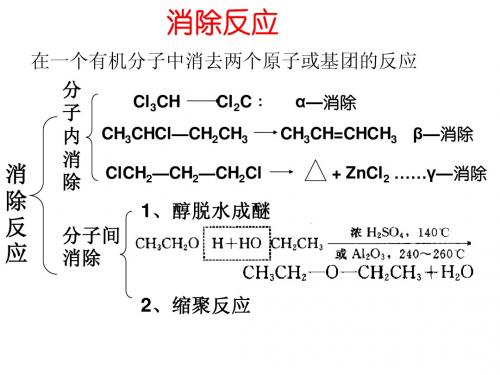
消除反应

化学术语
01 内容简介
03 反应速率 05 反应机理
目录
02 分类 04 消除规则
消除反应又称脱去反应或是消去反应,是指一种有机化合物分子和其他物质反应,失去部分原子或官能基 (称为离去基)的有机反应。消除反应发生后,生成反应的分子会产生多键,为不饱和有机化合物。消除反应可 使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度。
内容简介
消除反应 (elimination reaction)又称脱去反应或消去反应,是一种有机反应,一般为一有机化合物分子 和其他物质反应,失去部分原子或官能团(称为离去基)。反应后的分子会产生多键,为不饱和有机化合物。消 除反应分为下列两种:β消除反应:较常见,一般生成烯类。α消除反应:生成卡宾类化合物。离去基所接的碳 为α碳,其上的氢为α氢,而隔壁相邻接的碳及氢则为β碳及β氢。化合物会失去β氢原子的称为 β消除反应, 会失去α氢原子的称为α消除反应。
有些反应物在 β碳原子上连有比氢更容易被路易斯碱(见酸碱理论)作用的基团或者根本没有 β氢,它们 就有可能发生不涉及失去 β氢的消除。连二卤代烷在碘离子或锌的作用下发生的脱卤反应和 α,α-二烷基β -卤代酸的脱羧反应都属于这种情况。
谢谢观看
在E1C和E1CB中,反应均分两步进行,各自的活性中间体碳正离子和碳负离子都具平面结构,一般不存在立 体选择性问题。但在E2中,只有离去基团、α和β碳及β氢四者处于共平面的空间位置,才有利于协同反应的进 行,而符合这种要求的空间排列有两种:离去基团和β氢在α、β碳同一边时,发生顺式消除;离去基团和β氢在 α、β碳的两边时,发生反式消除。在大多数情况下,E2为反式消除,但不排除顺式消除的可能性,甚至有些反 应物由于结构的限制,只能发生顺式消除。
消去反应
高等有机化学—消除反应
23
反应底物的结构影响
4.1 反应底物的结构影响
(1)对E1和E2的影响
底物分子-碳上支链增多,消去反应的活性就增
大。E1消除时,-碳上支链增多,碳正离子更稳定;
E2消除,消除β-H的机会增大,形成的烯烃更稳定;
而β-碳有强吸电基时倾向于E1cb。
高等有机化学—消除反应
24
2.4 其它消除反应
另外还有1,4-消除和1,5-消除反应等等。1,3-消
除或1,4-消除可以看作是分子内的取代反应。
还有一类消除是从链或环中消除一部分碎片,
这类反应称为挤出反应。
高等有机化学—消除反应
11
消除反应
消除反应概念 消除反应类型 消除反应机理 消除反应影响因素
高等有机化学—消除反应
(2)进攻试剂体积
大体积的强碱易发生E2,而不利于SN2
高等有机化学—消除反应
27
离去基影响
4.3 离去基影响
好的离去基有利于E1和E2,不好的离去基如
F-、R4N+有利于E1cb(强吸电性,使β-H酸性增
加)
高等有机化学—消除反应
28
溶剂影响 4.4 溶剂影响
极性大的溶剂对单分子有利,对双分子不利
高等有机化学—消除反应 5
α-消除反应
2.1 α-消除反应(1,1-消除反应)
在同一个原子上消除两个原子或基团形成卡宾或乃 春的反应称为α-消除,又称1,1-消除反应。
高等有机化学—消除反应
6
α-消除反应
高等有机化学—消除反应
7
α-消除反应
高等有机化学—消除反应
8
β-消除反应
2.2 β-消除反应
《消除反应》课件

化学实验
消除反应常常用于化学实验中,帮助学生理解化 学反应的过程和特性。
Байду номын сангаас
总结
消除反应在工业生产和化学实验中扮演着至关重要的角色。了解消除反应的 分类和应用领域有助于更好地理解化学反应的本质。
类型分类
消除反应还可以根据反应类型进行分类,包括 氧化还原反应、酸碱反应、置换反应等。
具体案例分析
1
酸碱中和反应
介绍酸碱中和反应的过程,以及产生的产物。
2
金属与酸反应
分析金属与酸发生消除反应时,产生的气体和其他产物。
3
燃烧反应
讲解燃烧反应中产生的气体和其他副产物。
消除反应的应用
化肥生产
消除反应在化肥生产过程中扮演着重要角色,提 高了农作物的产量和质量。
消除反应
介绍《消除反应》PPT课件,包括定义、意义、分类、案例分析和应用。让 你了解化学反应中消除反应的重要性及应用领域。
前言
消除反应是化学反应中常见的一种,对工业生产和化学实验都具有重要意义。 我们将在本课件中深入探讨它的背景和重要性。
什么是消除反应
消除反应是指反应物转变为产物时,分子中的某些组分被消除的过程。这个 过程通常会伴随着能量的释放。
消除反应的意义
工业生产
消除反应在工业生产中起到了至关重要的作 用,例如在化肥合成、燃料燃烧等过程中。
化学实验
化学实验中常常会用到消除反应,如酸碱反 应、金属与酸反应等,它们都是消除反应的 具体应用。
消除反应的分类
物理状态分类
根据反应物和产物的物理状态不同,消除反应 可以分为气体到气体、液体到气体等几种不同 的类型。
消除反应

H
C
H2 C
H
卡宾的反应
(2) 与碳碳双键的加成
CH3CH = CHCH3 + CH2N2
光
CH3CH
CHCH3 ( 80%)
CH2 + CH2
二环 4,1,0 庚烷
在烯烃存在下的卡宾,可与双键加成得到环丙烷的衍生物。
HCCl3 + (CH3)3COK CCl2 + (CH3)3C-OH + KCl
CH2N2 重氮甲烷
紫外光 或加热
CH2 + N2
卡宾的结构
R
'
R
三线态
卡宾的反应
(1) 插入反应(insertion) 卡宾能把自身插入到大多数分子的C-H键中去。
C H+ CH2 C H2 C H
C
H+
CH2
C C H2
E1CB反应:生成Hofmann烯
N(CH3)3OH CH3 CH2 CH CH3 CH3 CH2 N(CH3)3 CH CH2
CH3
CH2
CH
CH2 95%
E2:大多数消除遵守Saytzess规则,但也有例 外(即趋向与Hofmann规则)
几个特殊例子:
CH 3(CH 2)3CHCH 3 L
CH3CH=C(CH3)2 + CH3CH2 90%
C CH3
CH2 10%
• Hofmann法则:季铵碱分解时,生成双键碳 原子上烷基最少的烯烃。
CH3CH2CHCH3 HO N(CH3)3 △ CH3CH2CH=CH2 + CH3CH=CHCH3 + N(CH3)3 95% 5%
E1:主要是生成Saytzess烯
高等有机化学消除反应

消除反应在有机合成中应用
形成碳碳双键或三键
立体选择性合成
通过消除反应可以方便地构建碳碳双 键或三键,这是有机合成中常用的手 段之一。
一些消除反应具有立体选择性,可以 用于合成具有特定立体结构的化合物。
构建复杂分子骨架
消除反应还可以用于构建复杂分子的 骨架,例如通过分子内的消除反应可 以形成环状化合物。
影响因素及改进方法
01
底物结构
底物结构对消除反应有很大影响,如卤代烃中卤素原子的种类和位置、
醇类化合物中羟基的位置等都会影响反应速率和产物分布。
02
反应条件
反应温度、溶剂种类、碱性强度等反应条件也会影响消除反应的进行。
03
改进方法
针对底物结构和反应条件的影响,可以采取相应的改进方法,如优化底
物结构、调整反应条件、使用催化剂等,以提高消除反应的效率和选择
A
B
C
D
催化剂种类和用量
对于使用过渡金属催化剂的烯烃消除反应, 催化剂种类和用量也是影响反应效率和选 择性的重要因素之一。
反应温度和溶剂
反应温度和溶剂对烯烃消除反应也有重要 影响,需要根据实际情况进行优化选择。
03 炔烃和芳香族化合物消除 反应
炔烃和芳香族化合物消除特点
高选择性
炔烃和芳香族化合物的消除反应 通常具有高度的选择性,能够生 成特定的产物。
消除反应特点
反应后生成物分子中的化学键总数减少,多数消除反应为可逆反应,甚至完全 可逆。
消除反应分类及机理
分类
根据反应物和产物的结构以及反应机 理的不同,消除反应可分为E1、E2 、E1cb三种类型。
机理
消除反应的发生往往伴随着碳正离子 、碳负离子、自由基等中间体的生成 ,这些中间体的稳定性和反应活性决 定了消除反应的速率和选择性。
第七章 消除反应

υ=k[RX][B:-]
双分子消除历程,二级反应
2. 反应活性(Reaction activity )
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同) 反应底物卤代烃的活性: 3º >1º >2º
1. 羧酸酯的热消除:
在无外加试剂存在下,通过加热,失去β-氢和羧 酸根,生成烯烃。
H O H O C H R R H H O + H O C R
R
H
H O
H C R
R
H
H
H O
反应特点:1) 高温,不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
环状化合物(Ⅰ)的热消除,只得化合 物(Ⅱ),为顺式消除。
(I) (II)
L
(2)
L: S(CH3)2 I / II 6.7
底物结构的影响
N(CH3)3 ~50
(CH3)3CCH2C(CH3)2 Br
EtO
(CH3)3CCH2C CH2 CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。 (2)产物中取代基的空间关系:反应产物 是以顺式还是反式异构体为主
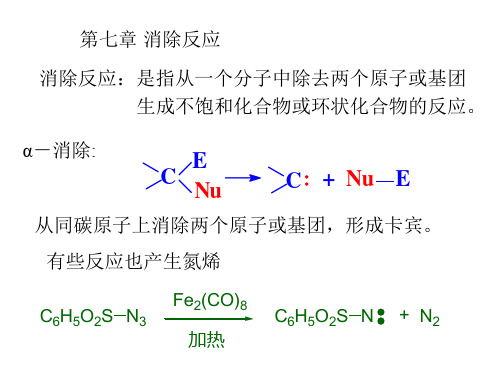
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个 小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应 H
有机化学基础知识点整理消除反应的类型与机理

有机化学基础知识点整理消除反应的类型与机理有机化学基础知识点整理:消除反应的类型与机理消除反应是有机化学中常见的一类反应,指的是有机化合物中某些官能团的原子能够从分子中脱离,形成双键或多键的过程。
本文将对消除反应的类型与机理进行整理和讨论。
一、消除反应的类型1. β-消除反应(β-elimination):在这类反应中,反应物中被消除的官能团的碳原子位于其它一个官能团的邻近位置(称为α-位置)。
β-消除反应包括酸催化的酮和醇之间的酸催化脱水反应、亲电或自由基卤代烷的脱氢反应等。
2. 酸碱消除反应(acid-base elimination):这类反应是指在有机化合物中,碱(底)与酸(质子)之间的相互作用,形成共价键的过程。
酸碱消除反应通常伴随着质子转移过程,形成共轭碱和共轭酸。
3. 位阻消除反应(steric elimination):当有机化合物中的某些基团因空间位阻而难以共存时,会发生位阻消除反应。
此类反应通常伴随着碳-碳键的形成和氢原子的消失。
二、消除反应的机理1. β-消除反应机理:在β-消除反应中,一般需要通过两个步骤实现。
首先是进行质子转移,形成双质子化物种(dioprotonated species)。
接下来,发生临近的亲核取代,生成亚胺离子(carbanion)。
最后,质子转移再次发生,从而得到产物。
2. 酸碱消除反应机理:酸碱消除反应的机理可以分为两类,即E1机理和E2机理。
E1机理主要发生在溶液中,其中步骤一是质子转移,形成共轭碱。
随后,发生β-消除,生成亚胺离子和产品。
E2机理则是在碱性条件下发生,过程包括质子转移和立即的消除反应,直接得到产物。
3. 位阻消除反应机理:位阻消除反应的机理与β-消除反应较为相似。
首先,发生质子转移,生成炔基离子。
接着,发生脱氢反应,生成亚胺离子。
最后,质子转移再次发生,从而获得产物。
三、应用与举例1. β-消除反应的应用:β-消除反应在有机合成中具有重要的应用价值。
消除反应
一、分子内消除
• 1、卤代烃的消除反应
γ β α β CH3CH2CH2CHCH3 乙乙乙 乙乙 CH3CH2CH=CHCH3 + CH3CH2CHC=CH2 69% 31% Br
H3C H3C CH2 C
CH3
KOH 乙醇
H3C CH C
71%
CH3 CH3 +
H3C H3C CH2 C CH2
CH3 CH3 C CH3 OC2H5
溶剂解反应,无碱存在的醇溶液 消除产物 CH3 C2H5—C—Cl CH3 CH3 CH3 H3C—C—CH2—C—CH3 Cl CH3 34%
取代产物 66%
65%
35%
CH3 CH3 100% CH3 H3C—C—CH2—C—CH3—C—CH3 CH3 Cl CH3
CH3— — CH(CH3)2 + (CH3)3COH
H2SO4
• 给出这一反应各步历程
-H2O + H2SO4 (CH3)3COH (CH3)3COH2
+
(CH3)3C -H
CH3-
+
(CH3)2C=CH2
- CH(CH3)2
(CH3)3C—H + CH3—
— C —CH3 CH3
CH3 CH3-C -CH3 CH2 +C CH3CH3
2-丁烯(主要产物) 丁烯(主要产物) 丁烯 80%
仲丁醇
1-苯基 丙醇 苯基-2-丙醇 苯基
1-苯基丙烯(共轭烯, 苯基丙烯(共轭烯, 苯基丙烯 唯一产物) 唯一产物)
H2SO4
OH
CH3CH2OH E1反应机理 反应机理
H2SO4
CH2=CH2 + H2O
消除反应

α-消除 :从同碳原子上消除两个原子或基团,
形成卡宾(碳烯)。
C H X C:+ H-X (1,1-消除)
CHCl3 + (CH3)3COK 如:
: CCl2 +
(CH3)3COH + KCl
γ -消除 :消除的两个原子或基团在1,3-位上。
X H C—R R—C H CH2 H
O 如:NaOH + ClCH2-CH2CH2—C—CH3 γ β α
例如:1-溴-1,2-二苯 丙烷按E2历程进行消除 反应时,其中一对对映 体只生成顺式-1,2-二苯 丙烯,另一对对映体只 生成反式-1,2-二苯丙烯。
B H CH3 Br C6H5 H H C6H5 CH3 H Br C6H5 C6H5 CH3 C6H5 H C6H5
(1R,2R)
C6H5 CH3 H Br H C6H5
当可以形成稳定的共轭烯烃,则以形成共轭烯烃为主要产物。
5.消除反应的立体化学
在E2消除中,过渡态所涉及五个原子(包括碱) 必须位于同一平面。
B H C C L
B H L C C
C
C
(I)
(II)
在(I)中H和L从相反方向消除称为反式消除或 对向消除,而(II)称为顺式消除或同向消除。一 般情况下反式消除更有利,因为在( I )中为对位 交叉构象,这种过渡态的能量比重叠式构象(II) 所需的能量小。
进行热消除反应的底物: RCH2CHOCOCH3 反应特点:1)不需碱作催化剂 1 R S 2)环状过渡态机理 RCH2CHOCSCH3 3)通常是顺式消除。 R1
热消除遵循Hofmann规则,优先得到取代程度较低的烯烃
CH3 CH3 CH CH CH3 OCOCH3 CH3 H2C CH CH + CH3 (80%) CH3 CH C (20%) CH3 CH3
消去反应优质获奖课件

t-Bu
H
+
E1 t-Bu
H
优势构象
H OTs e
H
H
t Bu
处于反式旳氢在e键上,与OTs不在一种 平面上,反应按E1机理进行。
环不能翻转,不然有很大旳排斥张力,反应速度缓慢
总之要求消除旳原子或基团必须处于反叠共平面旳关系
C2H5
6
eH
1
OH-
a H
2
H CH3
NaOH EtOH
aX (1S,2S,6S)
ClCH2CH2CH(OC2H5)2
NaOH EtOH
CH2
CHCH(OC2H5)2
卤代烯烃脱卤需要使用NaNH2/液NH3强碱
CH3(CH2)5C=CH2 Br
NaNH2 液NH3
CH3(CH2)5C CH2 90%
若能形成共轭烯烃时,一般只需要使用NaOH/H2O即可
OCOCH3 羟基维生素A
无
H
H 顺式消除
H
因为环旳刚性,Me3N-Cα-Cβ-H不能 同处一种平面,但Me3N -Cα-Cβ-D共 平面。是顺叠构象,所以进行顺式消除。
热解消除反应
化合物在加热时发生消除反应,不需要其他试 剂旳作用
O
H
O
+ HO
R
O
R
反应历程为Ei历程,被消除旳两个原子或原子 团在它们离开旳同步彼此形成新键,为顺势消 除,反应过程中形成环状过渡态中间体。
△
或 hv
CH2 +N2
△ R2C=C=O 或 hv CHCl3+NaOH
R2C +CO CCl2+NaCl+H2O
R N OSO2Ar+ B- BH R N + ArSO3-
消除反应机理

CH3
CH3 C X CH3
X慢-
CH3 CH3 C +
CH2 H
OH -
CH3 CH3
C=CH 2
•意义 E1和SN1常同时发生,是两个互相平行、竞争的反应。
何者占主导,主要取决于碳正离子在第二步反应中,消除质子或
与20试22/6剂/3 结合的相对趋势
1
( 2 ) 双 分 子 消 除 反 应 ( E2 ) (bimolecule elimination reaction)机理
CH3CHCH2OH CH3
CH3 CH3 C OH
2022/6/3
CH3
11
•命名
——简单的醇采用习惯命名法(烃基后加“醇”)和衍生物命名
法(以甲醇为母体)
CH3CH2CHOH
CH3
仲丁醇(习惯命名法)、甲基乙基甲醇(衍生物命名法)
——复杂的醇用系统命名法 选择含有羟基的最长碳链为主链 ,碳原子的编号从靠近羟基的一端开始,按次序规则将支链的位次 、名称及羟基的位次在母体名称前依次注明。不饱和醇选择同时含 有羟基和不饱和键的最长碳链为主链:第三个为乙基
+
H 2O
H3P O4 195℃, 2MPa
(CH 3)2CHOH
工业制醇的另一种方法——直接水合法。与间接水合法相比,可 减少硫酸对设备的腐蚀。
注意:仅乙烯可得伯醇,其余得仲、叔醇。
2022/6/3
16
•炔烃加成及构造异构
硫酸汞的硫酸溶液作催化剂,生成中间产物烯醇(羟基与双键碳 原子直接相连),它很快重排成醛或酮,例如:
CH3(CH 2)7CH=CH 2
①B2H6 , 二 甘 醇 二 甲 醚 ② H2O2/OH-
CH3(CH 2)7CH2CH2OH(癸醇)
有机化学基础知识点消除反应的机理和规律

有机化学基础知识点消除反应的机理和规律有机化学中,消除反应(Elimination Reaction)是指一个或多个原子、离子或分子从一化合物中脱离,形成一个或多个化合物的过程。
消除反应是有机合成中的一种重要反应类型,其在有机化学的理论和实践中有着广泛的应用。
本文将介绍有机化学基础知识点消除反应的机理和规律。
一、消除反应的机理消除反应的机理通常可以分为两种常见类型:β消除和α消除。
1. β消除在β消除反应中,反应物中的一个氢原子和与其相邻的一个β位碳原子一起被去除,产生一个双键。
β消除反应一般分为E2和E1两种机理。
E2机理是指消除反应中发生过程化学步骤同时进行。
它是一个一步反应,反应速率受到底物中碱性位点浓度和反应化学步骤的速率常数的影响。
E1机理是指消除反应中发生过程在两个步骤中进行。
首先,底物发生醒目或离子化,生成一个中间的碳正离子(或是碳正离子的共轭碱)和一个阴离子。
然后,中间体和阴离子相互反应,生成产物。
2. α消除在α消除反应中,反应物中的一个氢原子和相邻的一个α位碳原子一起被去除,产生一个双键。
简单来说,α消除反应是通过α位碳上一个相邻的碳-氢键断裂和产生一个新的双键。
二、消除反应的规律消除反应的规律可以从多个方面进行解释:1. 反应底物的结构消除反应通常发生在有机化合物的饱和键上,如碳氢化合物、卤代烃和醇等。
饱和碳原子上的氢原子可以通过消除反应被去除,形成一个新的双键。
2. 反应条件消除反应的进行需要适当的反应条件。
例如,在使用碱性条件下进行β消除反应时,碱性溶液可以提供足够的负电荷来帮助氢原子离去,进而促进消除反应的进行。
3. 消除反应类型的选择消除反应的类型选择主要取决于底物的结构以及反应条件。
在选择反应类型时,需要考虑底物的性质、产物稳定性、反应速率等因素。
4. 反应机理的理解理解消除反应的机理可以帮助我们准确预测和控制反应过程。
通过了解反应机理,我们可以选择合适的反应条件,优化反应过程,并预测产物的结构。
第七章消除反应(完)
B
H
X
BH
消去的 H 和 X 必须在
同一平面上,才能满足
逐渐生成的 p轨道最大
X
限度的交叠。
交叉式构象 H与X为反式共平面
负电荷相距较远
考虑顺式共平面消除(顺式消除)
B
H
X
CC
BH
X
CC
负电荷相距较近, 有排斥作用
CC
X
B
H
BH
X
H与X为顺式共平面
重叠式构象, 较不稳定。
结论:顺式消 除比反式消除 难发生
1、E1历程 遵从Saytyeff规则,形成热力学稳定的烯烃, 如果空阻过大时则遵从Hofmann消除
(CH3)3CCH2
CH3 C Cl NaOH
H2O CH3
(CH3)3CCH2
C CH2+CH3 CH3
CH3 C CH=CMe2 CH3
2、E1cb历程
遵从Hofmannn规则
H R' R CH2 C CH B-
B: 中性或带负电荷,如:OR-, OH-, H2O等。 L: X,SO2R, NO2, CN, NR3+,SR2+等。
动力学为二级动力学,反应速度与反应物的 浓度有关,也与碱浓度有关。
V=k[反应物] [B]
* *反反应应为为协协同同反反应应,,氢氢提提取取和和离离去去基基团团的的脱脱掉掉发发生生在在同同一 一步步骤骤,,从从来来没没有有鉴鉴定定到到过过中中间间体体。。
-E2可变过渡态理论 协同的一步反应,无任何中间体,而E1和E1cb均为
二步反应。多数情况下E2键的断裂和形成并非协 同的,而且有先有后,为此提出了可变过渡理论。
过渡态中C-H键断裂程度增加
有机化学中的消除反应

有机化学中的消除反应有机化学中的消除反应是一种重要的反应类型,指的是有机物分子中的某种官能团或原子被去除,形成新的化学物质。
消除反应在有机合成、药物合成和生物化学等领域具有广泛的应用。
本文将介绍消除反应的机理、反应条件以及常见的消除反应类型。
一、消除反应的机理消除反应的机理可能有多种,其中最为常见的是亲核消除和酸催化消除。
1. 亲核消除机理亲核消除指的是一个亲核试剂攻击一个带有β氢的有机物分子,使其失去一个氢和一个卤素或其他官能团。
这个过程可以通过两个连续的步骤来描述:步骤一:亲核试剂攻击有机物分子中的碳原子,形成一个碳-亲核试剂中间体。
步骤二:中间体失去一个氢和一个卤素或其他官能团,产生消除产物和亲核试剂。
亲核消除通常需要存在β氢的有机物分子,而且该分子还要有足够的活化能,以便亲核试剂攻击。
2. 酸催化消除机理酸催化消除是以酸作为催化剂的消除反应。
酸可以使有机物中的其它官能团偏离其正常的反应路径,从而促使消除反应发生。
酸催化消除通常发生在酸性条件下,例如在浓硫酸或磷酸存在下进行。
二、常见的消除反应类型在有机化学中,存在多种消除反应类型,以下是其中几种常见的类型:1. β-消除β-消除是指当有机物分子中存在β位可活化的官能团时,它们往往会在适当的条件下发生消除反应。
常见的β-消除类型有:醇酸消除、亲核取代消除、脱氢消除等。
2. α-消除α-消除是指在有机物分子中,某个官能团与α位所连接的碳原子发生消除反应。
常见的α-消除类型有:鉍消除、卤素氢消除、萘环开启等。
3. 氧化消除氧化消除是指一种官能团在氧化剂的作用下发生消除,常见的氧化消除类型有:胺氧化消除、过氧化消除等。
4. 还原消除还原消除是指通过还原剂的作用,使含有特定官能团的有机物分子发生消除。
常见的还原消除类型有:酮醛消除、羧酸还原消除等。
三、消除反应的应用消除反应在有机合成中具有广泛的应用价值,常用于构建碳碳键和碳氧键等。
它可以用于合成具有复杂结构和功能的分子,例如天然产物合成、药物合成等。
第七章卤代烃-2

δ−
β β'
EtOH CH3CH
CH3 CCH3 +
CH3 CH3CH2C 次要 CH2
主要
Br b
− Br
H CH3CH
CH3 H C CH2 b
Br CH3 H CH3CH2C
δ+
δ−
CH
a H CH3
较不稳定
Br CH3 CH3CH CCH3 CH3 CH3CH2C CH2
CH3CH
CHCH3 + CH3CH2CH 次要
CH2
主要
HO H CHCH3 Cl
δ− δ−
a a H CH3CH CH Cl OH b H CH2 b CH3CH2C Cl
δ−
CH3CH
CH3CH
CHCH3
较稳定
H CH2
OH
CH3CH2CH
CH2
较不稳定
E1 反应
CH3 CH3CH2CCH3 Br
H C H C
H H
乙烯
三取代烯烃
R H C R C R R
二取代烯烃
H C H C R R C R C H H
一取代烯烃
R H C H C H
>
>
≈
>
R C H C
H
R
R C C H
>
R H
有 van der waals 排斥力
trans
cis
烯烃相对稳定性的测定——烯烃的氢化热 烯烃相对稳定性的测定——烯烃的氢化热
E1机理+ 正碳离子重排 E1机理 机理+
CH3 H3C C H3C CH Br CH3 − Br H3 C CH3 C CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E1 历程
因为先生成碳正离子,顺、反消除均能发生, 同时得到Z和 E烯烃,没有立体选择性。 但是位阻大的基团CH C CH2CH3
Cl
CH3
CH3
H3CH2C
CH2CH3
minor
CH3CHCH2CH3 - OCH3
Br
CH3CHCH2CH2CH3 - OH
Cl CH3
CH3CCH2CH3
- OH
Cl
CH3CH=CHCH3 + CH2=CHCH2CH3
80%
20%
CH3CH=CHCH2CH3 + CH2=CHCH2CH2CH3
67%
33%
CH3 CH3C=CHCH3 +
70%
3º苄基型 > 3º烯丙型 > 2º苄基型 > 2º烯丙型 >3º > 1º苄基型 ~ 1º烯丙型 ~ 2º> 1º> 乙烯型
(与SN1反应相同)
卤代烃: RI > RBr > RCl > RF
(与SN1反应相同)
醇的脱水反应往往在酸性条件下,先质子化 后进行,因此醇的脱水反应以E1反应为主。
CH3 CH2=CCH2CH3
30%
过渡态分析
影响E2反应区域选择性的因素:
1)碱的结构( Base Structure)
CH3 CH3CH-CCH3 + RO -
CH3 Br Base
CH3CH2O -
CH3 CH3C=CCH3 +
CH3 More substituted
product
79%
CH3 CH3CHC=CH2
(与SN1反应相同)
3. 区域选择性 ( Regiochemistry )
一般遵循Saytzeff规则,生成多取代烯烃为主(稳定)。
特殊情况:
当离去基团的体积大时,碱不易进攻1位的氢,易进攻2位的氢。
CH3CH2CH2 CH CH3EtONa CH3CH2CH2CH CH2 + CH3CH2CH CHCH3
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同)
反应底物卤代烃的活性:
3º>2º>1º
(与SN2反应相反)
3.区域选择性(Regiochemistry)
从含氢较少的β-碳上消去得到取代基较多的 烯烃 — Saytzeff Rule
HX R CCR
HH
RCH CHR + HX
(3)γ-消除(或1,3-消除)反应
HX
R
R
R
NaOH + Cl
O
CH2 CH2 CH2 CCH3
γ
β
α
R +HX
O CCH3 + NaCl + H2O
另外还有1,4-消除和1,5-消除反应等等。这些消 除等可以看作是分子内的取代反应。
重点讨论β-消除反应
容易发生E1cB反应物质具有的特点:
① b-碳原子上连有强的吸电子基,从而使 b-氢具有较强的酸性,容易离去,且碳 负离子得以稳定;(NO2、CN、羰基等)
② 离去基团难离去,即C-L键不易断裂
例如:
1. 季铵碱的Hofmann消去反应,因为季铵阳离子强烈
的吸电子作用,其b-氢具有较强的酸性,容易离 去,因此也具有似E1cB历程,得到反Zaitsev 规
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个
小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应
H
RCX
RC
R
R
如: CH2I2+Zn → :CH2
(2)β-消除(或1,2-消除)反应
HL
单分子消除反应
E1 历程的特点:
1.易于解离为碳正离子的化合物,消除反应 按E1历程进行。如叔卤代烃
2.E1和SN1为竞争反应。 通常高温和强碱有利于E1反应,但在极性
溶剂及没有强碱存在时, SN1反应快,且 产物稳定。 3.有利于E1反应的因素:使正碳离子稳定的 给电子基团;好的离去基团,电离能力强 的高介电常数极性溶剂。
CH3
CH2CH3
H3CH2C
CH3
major
2、E1cB 历程
双步反应: 第一步:反应物先与碱作用,失去β氢原子,
生成反应物的共轭碱负碳离子; (速率决定步骤) 第二步:负碳离子失去 L并生成π键 反应速率不仅与反应物浓度成正比,也与碱
的浓度有关。二级反应
E1cB反应:单分子共轭碱消除反应 (碳负离子历程)
则为主的烯烃。
OH
这种选择性被称为
H
Hofmann取向 (Hofmann Orientation)
CH3CHCH2CH2 C H2 NH2(CH3)2
例如:
2. 氟代烃,因为氟的碱性强,难以离去,发生似 E1cB反应,得到反Zaitsev规则为主的烯烃
3. 区域选择性 ( Regiochemistry )
一般遵循反Saytzeff规则,生成少取代烯烃为主(稳定)。
E2 Reaction
1.反应机理(Mechanism )
在碱的作用下,C - L 键的断裂与C - H 键的断 裂同时进行,这是一个协同的双分子反应。
υ=k[RX][B:-] 双分子消除历程,二级反应
2. 反应活性(Reaction activity )
CH3 Less substituted
product
21%
(CH3)3CO -
27%
73%
CH3CH2(CH3)2CO -
19%
81%
(CH3CH2)3CO -
8%
92%
碱的体积增大,多取代产物减少
本章主要内容
一、消除反应历程 二、影响消除反应的因素 三、其它1,2 -消除反应 四、热解消除反应
一、消除反应历程
消除反应的历程 — E1, E2, and E1cB
H
E1
-H
B:
-LG
LG E2
H
H
LG
E1cB B:
-H
LG
-LG
E1 Reaction
1. 反应机理
一级反应 υ = k C C
(1)
L
(2)
(I)
(II)
L: S(CH3)2 N(CH3)3
I / II 6.7
~50
底物结构的影响
(CH3)3CCH2C(CH3)2 EtO (CH3)3CCH2C CH2
Br
CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。
