元素周期表(高考总复习 )
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
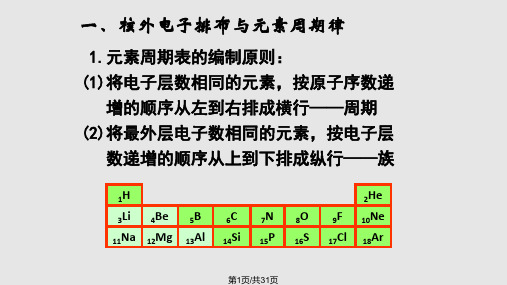
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
高考化学必背元素周期表64个-全文

高考化学必背元素周期表64个-全文化学是高考科学类的一门重要科目,其中元素周期表是化学研究的基础。
为了帮助学生掌握化学知识,以下是高考化学必须背诵的64个元素的周期表。
周期表的构成:1 1H HeL Li BeNa Mg 3 4 5 6 7 8 9 10K Ca Sc Ti V Cr Mn Fe Co NiRb Sr Y Zr Nb Mo Tc Ru Rh PdCs Ba *La Hf Ta W Re Os Ir PtFr Ra **Ac Rf Db Sg Bh Hs Mt Ds*Ce **Th Pr Nd Pm Sm Eu Gd Tb DyHo Er Tm Yb Lu化学元素:1. 氢 H2. 氦 He3. 锂 Li4. 铍 Be5. 硼 B6. 碳 C7. 氮 N8. 氧 O9. 氟 F10. 钠 Na11. 镁 Mg12. 铝 Al13. 硅 Si14. 磷 P15. 硫 S16. 氯 Cl17. 钾 K18. 钙 Ca19. 钪 Sc20. 钛 Ti21. 钒 V22. 铬 Cr23. 锰 Mn24. 铁 Fe25. 钴 Co26. 镍 Ni27. 铜 Cu28. 锌 Zn29. 镓 Ga30. 锗 Ge31. 砷 As32. 硒 Se33. 溴 Br34. 铷 Rb35. 铍 Sr36. 锶 Y37. 锆 Zr38. 铌 Nb39. 钼 Mo40. 锝 Tc41. 钌 Ru42. 铑 Rh43. 钯 Pd44. 银 Ag45. 镉 Cd46. 铟 In47. 锡 Sn48. 锑 Sb49. 碲 Te50. 碘 I51. 钡 Ba52. 铯 Cs53. 钡 Ba54. 铯 Cs55. 钡 Ba56. 锕 La78. 铌 Nb79. 钨 W80. 铼 Re81. 锇 Os82. 铱 Ir83. 铂 Pt84. 金 Au85. 汞 Hg86. 铊 Tl87. 铅 Pb88. 铋 Bi89. 钍 Th90. 镧 Pr91. 铈 Nd92. 镨 Pm93. 钕 Sm94. 铕 Eu95. 铽 Gd96. 镝 Tb97. 铒 Dy98. 铥 Ho99. 铪 Er 100. 钇 Tm 101. 铯 Yb 102. 铽 Lu以上是高考化学必背的64个元素及其位置。
高三化学总复习实用课件:必考5-1 元素周期表(人教版)_杜海彦

2.了解原子的结构及同位素的概念
3.了解原子核外电子排布规律 4.掌握元素周期律的实质 5.掌握同一周期元素性质的递变规律与原子结构的关系 6.常握同一主族元素性质递变规律与原子结构的关系 7.理解离子键、共价键的含义。理解极性键和非极性键, 了解分子间作用力,初步了解氢键
(2)性质方面
①最活泼的非金属元素,或气态氢化物最稳定的元素
是F。 ②最活泼的金属元素,或最高价氧化物对应的水化物
碱性最强的元素,或阳离子氧化性最弱的元素是Cs。
③单质在常温下呈液态的非金属元素是Br。 ④最高价氧化物及其水化物既能与强酸反应又能与强 碱反应的元素是Be、Al。 ⑤元素的气态氢化物和它的最高价氧化物对应的水化 物起化合反应的元素是N。
同主族、邻周期元素原子序数之差为上一周期元素所在周
期所含元素种数; ②位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,
同主族、邻周期元素原子序数之差为下一周期元素所在周
期所含元素种数。例如,氯和溴的原子序数之差为:35- 17=18(溴所在第四周期所含元素的种数)。
(2)同周期ⅡA族和ⅢA族元素原子序数素、同位素的概念及原子组成微粒间的关系、元
素周期律、元素周期表的结构及其应用、元素的金属性和
非金属性的判据及递变规律是主流试题,在填空题中会综 合考查元素性质、原子结构及元素在元素周期表中位置三 者之间的关系。 以元素及其化合物知识为载体,注重知识的整合,用 物质结构理论进行现象解释、定性推断将是2011年高考命 题的热点。
都具有较强的 还原性, 元素性质 金属性逐渐 增强 最高正价均为+1价 物理 (除Cs外)都呈 银白色, 密度逐渐 增大 (钾反常), 降低 熔点逐渐 性质 密度较小,熔点较低 单质 还原性逐渐 增强 。与 性质 化学 都具有较强的 还原性 O2反应越来越 容易, 性质 产物越来越复杂。
高考总复习考试元素周期表和元素周期律

高考总复习 元素周期表与元素周期律【考纲要求】1.掌握元素周期律的实质。
了解元素周期表的结构(周期、族)及其应用。
2.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA 族和ⅦA 族为例,掌握同一主族内元素性质的递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
【考点梳理】要点一、元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号为原子序数。
原子序数=核电荷数=核内质子数=核外电子数(原子中) 2.编排原则(1)周期:将电子层数相同的元素按原子序数递增的顺序从左到右排列,排成一个横行;(2)族:把最外层电子数相同的元素(个别除外)按电子层数递增顺序从上到下排列,排成一个纵行。
3.元素周期表的结构(“七横十八纵”)表中各族的顺序:ⅠA 、ⅡA 、ⅢB …ⅦB 、ⅠB 、ⅡB 、ⅢA ……ⅦA 、0(自左向右)。
4.原子结构与周期表的关系 (1)电子层数=周期数(2)最外层电子数=主族序数=最高正化合价(除F 、O ) (3)质子数=原子序数 要点二、元素周期律1.定义:元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。
2.实质:元素的性质随着元素原子序数的递增而呈周期性变化的实质是元素原子的核外电子排布的周期性变化。
注:元素的性质主要是指原子半径、化合价、元素的金属性和非金属性等3个短周期:一、二、三周期元素种数分别为2、8、8种 3个长周期:四、五、六周期元素种数分别为18、18、32种1个不完全周期:七周期元素种数为26(非排满)种 周期(7个) 主族(7个):ⅠA ~ⅦA 副族(7个):ⅠB ~ⅦB Ⅷ(1个):表中第8、9、10三个纵行 0族(1个):表中最右边 族元素周期表4.1—18号元素的有关知识5.金属元素与非金属元素在周期表中有相对明确的分区现象。
如图所示,虚线的右上角为非金属元素,左下角为金属元素。
高考化学复习元素周期表和元素周期律

元素周期表和元素周期律元素周期律:(1)元素原子核外电子排布的周期性变化:结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
注:①元素重要化合价的变化中O一般无正价,F无正价,最高正价与最低负价的关系;②最高正化合价+|最低负化合价|=8(仅适用于非金属元素)③金属无正价④有些非金属有多种化合价,如:C元素有+2,+4,-4价(在有机物中也可以有-3,-2,-1价);S元素有+4,+6,-2价;Cl元素有-1,+1,+3,+5,+7价;N元素有-3,+1,+2,+3,+4,+5价。
(4)元素的金属性和非金属性的周期性变化:电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
①.元素的金属性:指元素气态原子失去电子的能力。
元素金属性强弱判断的实验依据:a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;c.金属单质间的置换反应例:比较1:①镁与2mL1mol/L 盐酸反应②铝与2mL1mol/L 盐酸反应32222l 6l 2l l 3g 2HCl MgCl H A HC A C H ↑↑+=+反应比较容易M +=+反应更加容易所以金属性:l Mg A > 比较2:⑴钠与水反应(回忆)⑵镁与水反应【实验5-1】2222222()22()Na H O NaOH H Mg H O Mg OH H ++↑++↑冷=碱性:2aOH Mg(OH)N >金属性:Na Mg Al >>②元素的非金属性:指元素气态原子得到电子的能力。
元素非金属性强弱判断的实验依据:a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;c.非金属单质间的置换反应非金属性:l r F C >>B >I对于同一周期非金属元素:如2i l S P S C 、、、等非金属单质与2H 反应渐趋容易,其气态氢化物的稳定性为:432i l S H PH H S HC <<<上述非金属元素最高价氧化物对应水化物的酸性强弱顺序为:2334244i l H S O H PO H SO HC O <<<非金属性:i l S P S C <<< 结论: a g l i l N M A S P S C金属性逐渐减弱,非金属性逐渐增强(5)元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
高考化学专题元素周期表

第3课时元素周期表一、元素周期表的结构1.元素周期表的编排原则(1)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(2)纵行原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
2.元素周期表的结构(1)周期①数目:元素周期表有7个横行,即有7个周期。
②分类短周期:第1、2、3周期,每周期所含元素的种类数分别为2、8、8。
长周期:第4、5、6、7周期,每周期所含元素的种类数分别为18、18、32、32。
③周期数=电子层数。
(2)族①数目:元素周期表有18个纵行,但只有16个族。
②分类主族,共7个(由长、短周期元素构成,族序数后标A)。
副族,共7个(只由长周期元素构成,族序数后标B)。
第Ⅷ族,包括8、9、10三个纵行。
0族,最外层电子数是8(He是2)。
③主族序数=最外层电子数。
(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
(1)元素周期表的结构(2)列序数与族序数的关系①列序数<8,主族和副族的族序数=列序数;②列序数=8或9或10,为第Ⅷ族;③列序数>10,主族和副族的族序数=列序数-10(0族除外)。
例1下列关于元素周期表的说法正确的是()A.在元素周期表中,每一纵行就是一个族B.主族元素都是短周期元素C.副族元素都是金属元素D.元素周期表中每个长周期均包含32种元素考点元素周期表的结构题点元素周期表的结构答案 C解析A项,第8、9、10三个纵行为第Ⅷ族;B项,主族元素由短周期元素和长周期元素共同组成。
例2(2017·聊城高一检测)若把元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列。
按此规定,下列说法错误的是() A.只有第2列元素的原子最外层有2个电子B.第14列元素形成的化合物种数最多C.第3列元素种类最多D.第18列元素都是非金属元素考点元素周期表的结构题点元素周期表的结构答案 A解析周期表中各族元素的排列顺序为ⅠA、ⅡA、ⅢB→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA→ⅦA、0族,18列元素与以上对应,所以A项中为ⅡA族,最外层有2个电子,但He及多数过渡元素的最外层也是2个电子,故A项错误;第14列为碳族元素,形成化合物种类最多,故B项正确;第3列包括镧系和锕系元素,种类最多,故C项正确;第18列为稀有气体元素,全部为非金属元素,故D项正确。
2025版高考化学总复习第5章物质结构与性质元素周期律第17讲元素周期表和元素周期律考点二元素周期律

第17讲元素周期表和元素周期律考点二元素周期律.自主小练1.易错辨析:正确的打“√”,错误的打“×”。
(1)第三周期非金属元素含氧酸的酸性从左到右依次增强。
( × )[提示]第三周期非金属元素的非金属性从左到右依次增强,最高价含氧酸的酸性从左到右依次增强。
(2)第二周期元素从左到右,最高正价从+1递增到+7。
( × )[提示]第二周期元素中,O没有最高正价,F没有正价。
(3)元素的气态氢化物越稳定,元素的非金属性越强,氢化物水溶液的酸性也就越强。
( × )[提示]元素的气态氢化物越稳定,非金属性越强,但其水溶液的酸性与元素非金属性没有必然联系。
(4)同周期元素从左到右,原子半径逐渐减小,离子半径也逐渐减小。
( × )[提示]同周期元素从左到右,原子半径逐渐减小,金属元素的阳离子半径逐渐减小,但金属阳离子核外电子层数比同周期非金属元素的阴离子核外电子层数少1,所以金属阳离子半径小于同周期非金属元素的阴离子半径。
(5)可以根据金属活动性顺序表判断元素原子电离能的大小。
( × )[提示]金属活动性顺序与元素相应的电离能大小顺序不完全一致,故不能根据金属活动性顺序表判断元素原子电离能的大小。
(6)Cl-、S2-、Ca2+、K+半径依次减小。
( × )[提示]核外电子排布相同的粒子,核电荷数越大半径越小,所以S2-半径最大,Ca2+半径最小,故错误。
(7)原子的最外层电子数是2的元素,一定是ⅡA族元素。
( × )[提示]不一定。
可以是0族元素He和过渡元素等。
(8)同一周期元素,从左至右,元素的第一电离能逐渐增大。
( × )[提示]同一周期元素中,第ⅡA、VA族中由于元素价电子排布处于全空和半满状态,表现出的第一电离能比同周期相邻元素的大,如I(N)>I(O)。
(9)Ga与As位于同一周期,原子序数Ga<As,则根据元素周期律,原子半径Ga小于As,第一电离能Ga大于As。
2024年高考化学元素周期表知识点总结(2篇)

2024年高考化学元素周期表知识点总结2024年高考化学考试中,元素周期表是一个重要的考点。
掌握元素周期表的基本知识,理解元素周期表的结构和规律,对于解答选择题和计算题等各类试题都至关重要。
下面是2024年高考化学考试的元素周期表知识点总结。
一、元素周期表的分类元素周期表是按照元素的原子序数(即核外电子的数目)和相似性等规律排列的。
在2024年高考中,会考察以下几个方面的分类:1. 元素的主族和副族:元素周期表分为A族(主族)和B族(副族)两大类。
主族元素是周期表的第1A至8A组,副族元素是周期表的1B至8B组。
2. 元素的金属、非金属和类金属:元素周期表中,大多数元素为金属,少数元素为非金属,还有一部分元素是类金属(也称过渡元素)。
3. 元素的周期和组:元素的周期是指横向排列的行数,而元素的组则是指纵向排列的列数。
在元素周期表中,周期从1至7,组从1到18。
二、元素周期表的结构和规律1. 周期表的横向趋势规律:元素周期表的每个周期代表了一层电子壳,周期数越大,电子壳层数越多。
同时,周期表中,原子半径逐渐增大,离原子核越远,电子云也相应扩大。
2. 周期表的纵向趋势规律:元素周期表的每个主族代表了一个电子云中最外层电子的主要能级。
向下排列的元素,原子半径逐渐增大,电子云扩大;而向上排列的元素,原子半径逐渐减小,电子云缩小。
3. 元素周期表的原子半径和电离能规律:元素周期表中,原子半径随着周期数的增加而减小,原子半径随着组数的增加而增大。
电离能则是指原子失去一个电子所需要的能量,电离能随着周期数的增加而增大,电离能随着组数的增加而减小。
4. 元素周期表的化合价规律:元素的化合价一般是由元素的主族和副族决定的。
主族元素的化合价通常等于它们在周期表上的组数;而副族元素的化合价通常等于它们在周期表上的组数减去10。
三、常见元素和其特点以下是一些常见元素和其特点的简要总结:1. 氢(H):最轻的元素,原子量为1。
2024年新人教版高考化学一轮复习讲义(新高考版) 第6章 第31讲 元素周期表、元素的性质

2024年新人教版高考化学一轮复习讲义(新高考版)第31讲元素周期表、元素的性质复习目标1.掌握元素周期表的编排原则和整体结构。
2.掌握元素周期律的内容和本质。
3.掌握元素的原子半径、金属性、非金属性、第一电离能、电负性等的变化规律。
内容索引考点一 元素周期表的结构与价层电子排布考点二 元素周期律 电离能、电负性答题规范(3) 电离能规范答题的两个类型真题演练 明确考向课时精练><元素周期表的结构与价层电子排布1.元素周期表的编排原则(1)周期:把相同的元素,按 的顺序从左到右排成的横行。
(2)族:把不同横行中 相同的元素,按 的顺序从上而下排成的纵列。
必备知识电子层数目原子序数递增最外层电子数电子层数递增2.原子结构与元素周期表的关系(1)原子结构与周期的关系原子的最大能层数=周期序数。
(2)原子结构与族的关系①主族元素的价层电子排布特点主族ⅠA ⅡA ⅢAⅣA排布特点______________________主族ⅤAⅥAⅦA排布特点___________________n s 1n s 2n s 2n p 1n s 2n p 2n s 2n p 3n s 2n p 4n s 2n p 5②0族元素的价层电子排布:He为1s2;其他为n s2n p6。
③过渡元素(镧系、锕系元素除外)的价层电子排布:(n-1)d1~10n s1~2。
(3)原子结构与元素周期表分区的关系①元素周期表分区②各区价层电子排布特点分区价层电子排布s区n s1~2p区n s2n p1~6(除He外)d区(n-1)d1~9n s1~2(除钯外)ds区(n-1)d10n s1~2f区(n-2)f0~14(n-1)d0~2n s2(4)金属与非金属的分界线①分界线:沿着元素周期表中___________________与______________________的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
高考化学元素周期表常见元素性质与考点总结

高考化学元素周期表常见元素性质与考点总结在高考化学中,元素周期表是一个极其重要的知识点,其中常见元素的性质以及相关考点更是重中之重。
理解和掌握这些元素的性质,对于解决化学问题、提高化学成绩具有关键作用。
首先,我们来谈谈氢(H)元素。
氢是元素周期表中的第1 号元素,是宇宙中含量最多的元素。
它通常以单质氢气(H₂)的形式存在,具有可燃性。
在化学反应中,氢元素既能表现出氧化性,又能表现出还原性。
例如,氢气与氧气反应生成水时,氢气表现出还原性;而在金属氢化物(如氢化钠 NaH)中,氢元素则呈现出-1 价,表现出氧化性。
高考中,关于氢元素的考点常常涉及氢气的制备、性质以及氢在化合物中的化合价等。
接下来是氦(He),它是一种稀有气体元素。
氦气化学性质非常稳定,一般不参与化学反应。
由于其不易发生反应的特性,常用于填充气球、飞艇等。
高考中对于氦元素的考查相对较少,但了解其惰性特点还是很有必要的。
锂(Li)是碱金属元素中的一员。
它是一种银白色的金属,质地较软。
锂的密度很小,在电池领域有着广泛的应用。
在化学性质方面,锂具有较强的还原性,能与水缓慢反应生成氢氧化锂(LiOH)和氢气。
高考中,关于锂元素的考点可能涉及锂的化合物的性质、锂电池原理等。
铍(Be)元素,它属于碱土金属。
铍具有较高的熔点和硬度,在航空航天等领域有一定应用。
铍的化学性质相对稳定,在常温下不易与氧气、水等发生反应。
高考中铍元素出现的频率较低,但对于其基本性质也要有所了解。
硼(B)是非金属元素,在自然界中主要以化合物的形式存在。
硼的单质硬度较大,常用于制造耐磨材料。
硼元素在有机化学中也有重要的应用,例如硼酸在医药领域的使用。
高考中,硼的考点可能涉及硼的化合物的结构和性质。
碳(C)是生命的基础元素,其单质存在多种同素异形体,如金刚石、石墨和 C₆₀等。
金刚石硬度极高,而石墨则具有良好的导电性。
碳能形成众多的有机化合物,这使得碳元素在化学中具有极其重要的地位。
2023届高考人教版化学复习课件原子结构 元素周期表专题

。
2+的中子数为
(3)56
Fe
26
,核外电子数为
。
(4)上述 9 种微粒中有
种核素,含有
种元素。
。
答案 (1)核素 同位素
16
16
(2) 8 O2 和 8 O3
(3)30 24 (4)7 5
关键能力 考向突破
考向1
核素、同位素等易混概念辨析
【典例1】 (2020浙江7月选考,7)下列说法正确的是(
原子光谱
(1)原子的状态:
①基态原子:处于 最低能量
状态的原子。
②激发态原子:基态原子吸收能量后,它的电子会跃迁到 较高能级
,
变为激发态原子。
(2)原子光谱:不同元素原子的电子发生跃迁时会 吸收
或 释放
不同
的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光
谱。在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分
)
①质子数相同的粒子一定是同种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是质量数
A.②③④⑥
B.①②④⑤
C.①②⑤⑥
D.③④⑤⑥
答案 C
解析 粒子包括原子、分子、离子等。H2O与Ne的电子数、质子数均相
(3)有关元素的相对原子质量与核素质量数的注意事项。
①原子的相对原子质量≠原子的质量数。
②只有具体的原子才有质量数,元素没有质量数。
③某核素的质量数可视为该核素的近似相对原子质量。
元素周期表(高考总复习)

元素周期表1.发展历程2.编排原则例1.判断正误,正确的打“√”,错误的打“×”(1)现行元素周期表的编排依据是相对原子质量( )(2)一个横行即是一个周期,一个纵行即是一个族( )(3)最外层电子数相同的元素一定是同族元素( )(4)每一周期都是碱金属元素开始,稀有气体元素结束( ) 答案(1)×(2)×(3)×(4)×3、元素周期表的结构要点解释:常见族的特别名称:第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
点拨:例2.元素周期表中所含元素种类最多的族是哪一族?答案ⅢB族。
例3.现行元素周期表元素种类最多的周期是哪一周期?答案第六周期。
1.结构特点元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数原子半径/nm碱金属元素锂Li 3]1 2 0.152钠Na 11]1 3 0.186钾K 19]1 4 0.227铷Rb 37]1 5 0.248铯Cs 55]1 6 0.265(2)得出结论:碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
2.碱金属的性质(1)物理性质(2)化学性质2熔成小球,浮于水面,四处游动,有轻熔成小球,浮于水面,四处游动,有“嘶例4.判断正误,正确的打“√”,错误的打“×”(1)碱金属元素原子的次外层电子数都是8个( )(2)化合物中碱金属元素的化合价都为+1价( )(3)碱金属元素的原子半径随核电荷数的增大而增大( )(4)碱金属单质的化学性质活泼,易失电子发生还原反应( )(5)Li在空气中加热生成LiO2( )答案(1)×(2)√(3)√(4)×(5)×例5.钾与水(含酚酞)反应的实验现象能表明钾的一些性质,请连一连。
(1)钾浮在水面上A.钾与水反应放热且钾的熔点较低(2)钾熔化成闪亮的小球B.钾与水反应剧烈,放出的热使生成的H2燃烧(3)钾球四处游动,并有轻,微的爆鸣声C.钾的密度比水小(4)溶液变为红色D.钾与水反应后的溶液呈碱性答案(1)—C (2)—A (3)—B (4)—D例6.下列各组比较不正确的是( )A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH<NaOH<KOH答案 B解析锂的活泼性比钠弱,与水反应不如钠剧烈,A正确;还原性:K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应,B错误;碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs,C正确;从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH,D正确。
2024年高考化学总复习第二部分考点精练第24讲元素周期表和元素周期律及其应用

第24讲元素周期表和元素周期律及其应用层次1基础性1.下列有关元素周期表的说法正确的是()A.在元素周期表中,第10、11列元素均为ds区B.在元素周期表中,第四周期第9列是铁元素C.根据原子核外电子排布的特点,Cu在周期表中位于d区D.某基态原子的价层电子排布式为5d16s2,则该元素位于周期表中第六周期第ⅢB族2.(2024·吉林长春模拟)下列有关原子结构与元素性质的叙述不正确的是()A.基态原子的p能级上半充满的元素一定位于p区B.X、Y元素同周期且电负性:X>Y,则第一电离能:Y<XC.某主族元素的逐级电离能(单位: kJ·mol-1)分别为738、1 451、7 733、10 540……据此推知该元素在第ⅡA族D.第三周期元素中第一电离能介于Mg和S之间的元素只有1种3.已知Z为第三周期元素原子的核电荷数,Y表示相应元素的有关性质,其中曲线描述与元素有关性质相符的选项是()A.a中Y表示原子半径B.b中Y表示元素的电负性C.c中Y表示元素的最高正价D.d中Y表示元素的第一电离能4.(2024·山东滨州期初统考)氨硼烷(NH3·BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
氨硼烷在催化剂作用下与水反应产生氢气:NH3·BH3+2H2O NH4BO2+3H2↑,下列说法不正确的是()A.原子半径:B>N>O>HB.第一电离能:N>O>BC.元素的电负性:O>N>BD.氢化物的稳定性:NH3>H2O>BH35.已知X、Y元素同周期,且电负性:X>Y,下列说法错误的是()A.第一电离能:Y可能大于XB.气态氢化物的稳定性:H m Y<H n XC.X、Y一定存在最高价含氧酸,且酸性:X>YD.X和Y形成化合物时,X显负价,Y显正价6.(2024·湖南长郡中学月考)如图所示物质是由原子序数依次增大的五种短周期主族元素X、Y、Z、Q、W形成的,基态Q原子核外成对电子数是未成对电子数的3倍,下列说法正确的是()A.气态氢化物的稳定性:Y>Z>QB.简单离子半径:Z>Q>WC.第一电离能:Q>Z>WD.简单阴离子的还原性:Q>Z>X7.(2024·浙江金华十校联考)如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,下列说法正确的是()A.31d和33d属于同种核素B.第一电离能:d>e,电负性:d<eC.气态氢化物的稳定性:a>d>eD.a和b形成的化合物不可能含共价键层次2综合性8.(2024·山东青岛期初调研)著名的观赏石——崂山璐石主要成分可表示为Y x Fe y[Z4O10](OH)2·W3(OH)6,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0。
2024届高考化学总复习:元素周期表与元素周期律课件

6.“序、层”“序、价”规律 (1)“序、层”规律 ①若一种阳离子与一种阴离子电子层数相同,则“阴前阳 后”,即阴离子在前一周期,阳离子在后一周期,阳离子的原子 序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数 大。
核心素养
1.宏观辨识与微观探析:从原子结构的角度认识元素周 期表的编排原则和分区,能从原子结构的角度解释元素 性质及递变规律。 2.证据推理与模型认知:能利用元素在元素周期表中的 位置和原子结构,分析、预测、比较元素及其化合物的 性质,建立元素周期律性质判断思维模型,并用模型解 决实际问题;根据同类元素的性质相似性和递变性理解 元素周期律;理解元素周期表与周期律的关系。 3.微观探析与科学探究:在探究同周期、同主族元素性 质递变性的实验中设计探究方案并进行合作探究实验。
答案:D
[思维建模] 直接相邻的原子数关系 (1)“┰”“┸”型元素原子序数之间的规律 ①直接相邻的“┰”型元素原子序数的关系如图所示。
②直接相邻的“┸”型元素原子序数的关系如图所示。
(2)“╂”型元素原子序数之间的规律 第ⅢA 族→0 族区域内满足“╂”型元素原子序数的关系,如 图所示。
(3)元素周期表中元素原子序数的序差规律 ①同周期第ⅡA 族与第ⅢA 族元素的原子序数之差有以下三 种情况:第二、三周期(短周期)相差 1,第四、五周期相差 11,第 六、七周期相差 25。
④同一周期,金属元素越靠前,其金属性越强;同一主族, 金属元素越靠下,其金属性越强。
⑤金属与盐溶液的置换反应,若A元素的单质能置换出 B元 素的单质,则A元素的金属性强于B元素。
人教版高中化学高考总复习单选题 课时作业15元素周期表元素周期律

课时作业15 元素周期表元素周期律一、单项选择题(本题包括6个小题,每小题只有1个选项符合题意)1.硒是人体必需的微量元素,如图是硒在周期表中的信息,关于硒元素的说法错误的是()A.位于第四周期B.质量数为34C.原子最外层有6个电子D.相对原子质量为78.962.下列说法正确的是()A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6B.所有的非金属元素都分布在p区C.原子核外电子排布式为1s1的原子与原子核外电子排布式为1s22s1的原子的化学性质相同D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称为过渡金属元素3.B和Al为同族元素,下列说法错误的是()A.BF3和AlF3都可以与F-形成配位键B.H3BO3为三元酸,Al(OH)3呈两性C.共价键的方向性使晶体B有脆性,原子层的相对滑动使金属Al 有延展性D.B和Al分别与N形成的共价晶体,均具有较高硬度和熔点4.如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是()A.y轴表示的可能是第一电离能B.y轴表示的可能是电负性C.y轴表示的可能是原子半径D.y轴表示的可能是形成基态离子转移的电子数5.元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是()A.某元素原子的第二电子层电子轨道表示式为B.某元素在某种化合物中的化合价为+4C.某元素的原子最外层上电子数为6D.某元素的原子价层电子排布式为5s25p16.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得诺贝尔化学奖。
下列说法正确的是()A.基态Fe2+与Fe3+中未成对的电子数之比为6∶5B.同一周期中,第一电离能:I1(B)>I1(Be)>I1(Li)C.第一电离能:I1(Li)>I1(Na),原因是Na的电子层数多,原子半径大D.Co位于元素周期表中的ds区二、不定项选择题(本题包括4个小题,每小题有1个或2个选项符合题意)7.下列说法不正确的是()A.某价电子排布式为4f75d16s2的基态原子,该元素位于周期表中第六周期第ⅢB族B.在元素周期表中,s区、d区和ds区的元素都是金属元素C.当碳原子的核外电子排布由转变为时,释放能量,由激发态转化成基态D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或88.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表1.发展历程2.编排原则例1.判断正误,正确的打“√”,错误的打“×”(1)现行元素周期表的编排依据是相对原子质量( )(2)一个横行即是一个周期,一个纵行即是一个族( )(3)最外层电子数相同的元素一定是同族元素( )(4)每一周期都是碱金属元素开始,稀有气体元素结束( )答案(1)×(2)×(3)×(4)×3、元素周期表的结构要点解释:常见族的特别名称:第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
例2.元素周期表中所含元素种类最多的族是哪一族?答案ⅢB族。
例3.现行元素周期表元素种类最多的周期是哪一周期?答案第六周期。
1.结构特点元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数原子半径/nm碱金属元素锂Li 3]1 2 0.152钠Na 11]1 3 0.186钾K 19]1 4 0.227铷Rb 37]1 5 0.248铯Cs 55]1 6 0.265(2)得出结论:碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
2.碱金属的性质(1)物理性质(2)化学性质碱金属化学反应方程式反应程度产物复杂程度活泼性Li 4Li+O22Li2ONa 2Na+O2Na2O2K K+O2KO2Rb -Cs -钾钠熔成小球,浮于水面,四处游动,有轻熔成小球,浮于水面,四处游动,有“嘶例4.判断正误,正确的打“√”,错误的打“×”(1)碱金属元素原子的次外层电子数都是8个( )(2)化合物中碱金属元素的化合价都为+1价( )(3)碱金属元素的原子半径随核电荷数的增大而增大( )(4)碱金属单质的化学性质活泼,易失电子发生还原反应( )(5)Li在空气中加热生成LiO2( )答案(1)×(2)√(3)√(4)×(5)×例5.钾与水(含酚酞)反应的实验现象能表明钾的一些性质,请连一连。
(1)钾浮在水面上A.钾与水反应放热且钾的熔点较低(2)钾熔化成闪亮的小球B.钾与水反应剧烈,放出的热使生成的H2燃烧(3)钾球四处游动,并有轻,微的爆鸣声C.钾的密度比水小(4)溶液变为红色D.钾与水反应后的溶液呈碱性答案(1)—C (2)—A (3)—B (4)—D例6.下列各组比较不正确的是( )A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH<NaOH<KOH答案 B解析锂的活泼性比钠弱,与水反应不如钠剧烈,A正确;还原性:K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应,B错误;碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs,C正确;从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH,D正确。
归纳总结碱金属的原子结构与化学性质的关系(1)相似性原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。
碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
(2)递变性随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
①②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
1.原子结构元素名称氟(F) 氯(Cl) 溴(Br) 碘(I)原子序数9 17 35 53原子结构示意图最外层电子数7 7 7 7电子层数 2 3 4 5原子半径由小到大(2)得出结论:卤族元素原子结构的共同点是最外层电子数都是7,不同点是电子层数和原子半径不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
2.卤族元素单质的性质(1)物理性质(2)化学性质①与H2反应a反应条件化学方程式产物稳定性F2暗处H2+F2===2HF 很稳定Cl2光照或点燃H2+Cl22HCl 较稳定Br2加热H2+Br22HBr 不稳定I2不断加热H2+I22HI 很不稳定b.222反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。
②卤素单质间的置换反应实验操作实验现象化学方程式静置后,液体分层,上层无色,下层橙红色2NaBr+Cl2===2NaCl+Br2静置后,液体分层,上层无色,下层紫红色2KI+Br2===2KBr+I2b.得出结论:Cl2、Br2、I2三种卤素单质的氧化性由强到弱的顺序是Cl2>Br2>I2,相应卤素离子的还原性由强到弱的顺序是I->Br->Cl-。
提醒因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
例7.判断正误,正确的打“√”,错误的打“×”(X代表卤素)(1)卤素单质与水反应均可用X2+H2O===HXO+HX表示( )(2)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强( )(3)卤素单质的颜色从F2―→I2按相对分子质量增大而加深( )(4)将F2通入NaCl溶液中可置换出Cl2( )答案(1)×(2)×(3)√(4)×解析(1)F2与H2O反应为2F2+2H2O===4HF+O2,不可用X2+H2O===HXO+HX表示。
(2)HX的热稳定性随核电荷数的增加而减弱。
(4)F2性质极活泼,遇盐溶液先和水反应,故不能将卤素从它的盐溶液里置换出来。
例8.已知还原性I->Br->Cl->F-,试从原子结构的角度分析原因。
答案还原性即微粒失去电子的能力。
按I-→Br-→Cl-→F-的顺序,离子的半径逐渐减小,原子核对最外层电子的吸引力逐渐增大,失去电子的能力逐渐减弱,故还原性逐渐减弱。
例9.下列对卤素的说法不符合递变规律的是( )A.F2、Cl2、Br2、I2的氧化性逐渐减弱B.HF、HCl、HBr、HI的热稳定性逐渐减弱C.F-、Cl-、Br-、I-的还原性逐渐增强D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大解析从F→I原子半径依次增大,单质氧化性逐渐减弱,则阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色逐渐变深,密度也逐渐增大。
答案 D归纳总结卤素的原子结构与化学性质的关系(1)相似性(X表示卤素元素)卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质都是活泼的非金属单质,都具有较强的氧化性。
①与H2反应:X2+H22HX。
②与活泼金属(如Na)反应:2Na+X22NaX。
③与H2O反应a.X2+H2O===HX+HXO(X=Cl、Br、I);b.2F2+2H2O===4HF+O2。
④与NaOH溶液反应X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。
(2)递变性(X表示卤素元素)随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。
①②与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF<HCl<HBr<HI。
③卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2只能生成低价卤化物(如FeI2)。
④氢化物都易溶于水,其水溶液酸性依次增强。
⑤最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。
1.原子结构⎧⎧⎨⎪⎨⎩⎪⎩质子原子核原子中子核外电子2.原子核外电子的排布(1)原子核外电子运动的特点原子核外电子绕着原子核高速运动时没有确定的轨道的,就好像一团云雾“带负电荷的云雾”笼罩在原子核周围.电子密集的地方,电子出现的机会多;反之,电子云稀疏的地方,电子出现的机会少.电子的能量并不相同,能量低的,受核电荷的吸引大,通常在离核近的区域运动;能量高的,在离核远的区域运动.根据电子的能量差异和运动空间离核的远近不同,核外电子分别处于不同的电子层上.【注意】核外电子是客观存在的,电子层是人为规定的.最外层电子数为该元素(主族元素)的最高正价,最低负价为该元素的最高正价—8.(2)在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:①核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层.②原子核外各电子层最多容纳2 n2个电子.③原子最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)④次外层电子数不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数不能超过32个电子层数(n)1 2 3 4 5 6 7符号K L M N O P Q最多容纳电子数(2 n2)2 8 18 32 2 n2能量大小K<L<M<N<O<P<Q3.原子半径由于原子核在原子中只占很少的一部分,原子半径主要是由最外层电子界定的.原子半径的判断依据:①根据电子层数判断:电子层越多,原子半径越大.②当电子层数相同时,根据质子数判断:由于12kQ eF=r电,故质子数越多,F电越大,原子半径越小.③当电子层数、质子数相同时,根据最外层电子数判断,电子数越多,充斥的轨道越多,原子半径越大.4:核素元素:具有相同核电荷数的同一类原子的总称.核素:具有一定数目的质子和中子的一种原子,叫做核素.如11H 、21H 、31H各为一种核素.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素. 同位素核素之间的关系质量数(A) = 质子数(Z) + 中子数(N)原子A zx n b代表的含义X :该元素的元素符号;Z :该原子的原子核内质子数; A :该原子的质量数;b :微粒个数;n :微粒所带的电荷数同素异形体:同种元素不同的单质.例如:氧气和臭氧,金刚石和石墨,红磷和白磷.例10.下列符号代表几种元素?几种原子?它们的关系?4018Ar 4019K 4020Ca 4119K 4220Ca 40+19K【答案】代表3种元素,6种原子.4020Ca 和4220Ca 、4119K 和4019K 是同位素;4018Ar 、4019K 、4020Ca 、40+19K 质量数相同;4019K 、4119K 、40+19K 属于同种元素;4020Ca 和4220Ca 属于同种元素.1.元素X的原子结构示意图为,则X在周期表中的位置是( )A.第三周期第ⅤA族B.第二周期第ⅦA族C.第二周期第ⅤA族D.第三周期第ⅦA族2.下表为元素周期表的一部分(数字为原子序数),其中X为35的是( )3.某元素的原子最外层有2个电子,则该元素是( )A.金属元素B.稀有气体元素C.第ⅡA族元素D.以上叙述都可能4.下列关于元素周期表的说法正确的是( )A.元素周期表短周期中有6种金属元素B.元素周期表中第ⅦA族有4种非金属元素C.元素周期表中第一、二、三周期为短周期D.元素周期表中第ⅠA族全部是金属元素5.元素A、B、C、D在元素周期表中的位置如下所示。
