杂环化学综述
大学有机化学第十七章杂环

杂环化合物也可以发生还 原反应,如喹啉可以还原 为二氢喹啉。
还原反应通常涉及还原剂 对杂环的攻击,导致电子 转移和还原产物的生成。
杂环化合物在有机合成中的
06
应用
作为合成子构建复杂分子结构
01 杂环化合物作为合成子
杂环化合物具有丰富的反应性和多样的结构,可 以作为合成子用于构建更复杂的分子结构。
02 杂环合成策略
在天然产物的全合成中,杂环的合成是关键步骤 之一。通过设计合理的合成路线,可以实现杂环 的高效构建。
03 实例分析
以某些具有代表性的天然产物为例,阐述杂环化 合物在天然产物全合成中的应用。
在药物设计和合成中的应用
药物分子的结构特点
许多药物分子都含有杂环结构,这些结构对于药物与靶标 的相互作用具有重要影响。
咪唑
由两个氮原子和三个碳原子组成的五元杂环化合物,具有芳香性。咪唑及其衍生物在医药和农药等领域有重要应 用,如抗真菌药物克霉唑、抗寄生虫药物甲硝唑等。
噻唑
由一个硫原子、一个氮原子和三个碳原子组成的五元杂环化合物,具有芳香性。噻唑及其衍生物在染料、农药和 医药等领域有广泛应用,如杀菌剂稻瘟灵、抗癫痫药物卡马西平等。
大学有机化学第十七 章杂环
目录
• 杂环化合物概述 • 五元杂环化合物 • 六元杂环化合物 • 杂环化合物的合成方法 • 杂环化合物的反应与机理 • 杂环化合物在有机合成中的应用
01
杂环化合物概述
定义与分类
定义
杂环化合物是指分子中含有杂原子(非碳原子)的环状 有机化合物。
分类
根据杂原子的种类和数量,杂环化合物可分为单杂环和 多杂环两大类。其中,单杂环又分为含氮杂环、含氧杂 环和含硫杂环等。
呋喃
(推荐)《杂环化学》PPT课件

五元杂环
六元杂环 苯并杂环 杂环并杂环
呋喃
O N
噁唑
O
吡啶
N
噻吩
S N
噻唑
S
N 嘧啶
N
N
吡咯
H
N
咪唑
N 吡唑
N H
N H
吡喃
O
吲哚
N H
N
N
N
N H
嘌呤
喹啉
N
N 异喹啉
5
3. 大环
冠醚
O
O
O
O
O
O
O
杯芳烃
环糊精
OH
HO O OHOHO
OHO OH O
HO OH
O OH
O
OH
OOH
HO O
O
OHO
OH
O
CH3
O
β-呋喃甲酸
O
COOH
O SS
CH2C CH2CH O
CH3 CH3
链状呋喃萜
O
CH2SH
面包香料
R'
R'
O
R''
O
R''
烤肉香料
呋喃香料
H3C O
O HO
OCH3
O
苯并呋喃衍生物
O
30
CH3
2.1.2噻吩及衍生物 2.1.2.1噻吩
(一)合成方法
A:Paal-knorr法
R
R P4S6
CN CH 3
40
2.1.2.2噻吩衍生物
苯并噻吩
S
OR +
SNa
Cl
OR S
硫代-3-吲哚吩
杂环化学总结
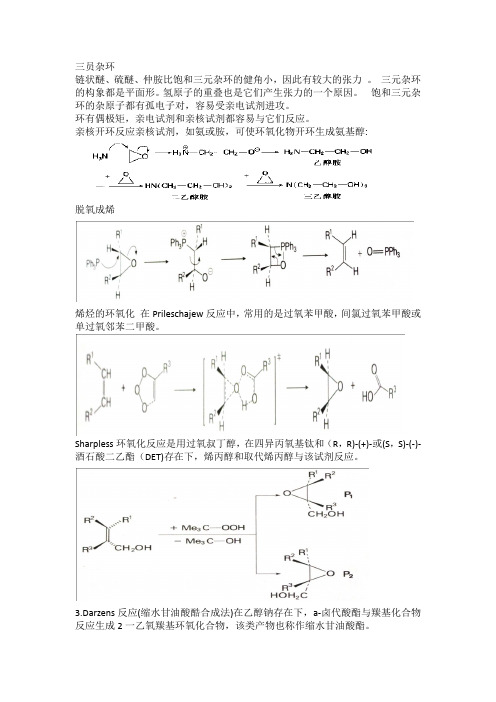
三员杂环链状醚、硫醚、仲胺比饱和三元杂环的健角小,因此有较大的张力。
三元杂环的构象都是平面形。
氢原子的重叠也是它们产生张力的一个原因。
饱和三元杂环的杂原子都有孤电子对,容易受亲电试剂进攻。
环有偶极矩,亲电试剂和亲核试剂都容易与它们反应。
亲核开环反应亲核试剂,如氨或胺,可使环氧化物开环生成氨基醇:脱氧成烯烯烃的环氧化在Prileschajew反应中,常用的是过氧苯甲酸,间氯过氧苯甲酸或单过氧邻苯二甲酸。
Sharpless环氧化反应是用过氧叔丁醇,在四异丙氧基钛和(R,R)-(+)-或(S,S)-(-)-酒石酸二乙酯(DET)存在下,烯丙醇和取代烯丙醇与该试剂反应。
3.Darzens反应(缩水甘油酸酷合成法)在乙醇钠存在下,a-卤代酸酯与羰基化合物反应生成2一乙氧羰基环氧化合物,该类产物也称作缩水甘油酸酯。
Corey合成法该合成方法是由卤化三烷基锍盐或卤化三烷基亚砜盐衍生的S一叶立德与羰基化合物反应四员杂环1.β-氨基酸环化脱水制得【2+2】环加成反应(1)亚胺十烯酮.亲电取代反应呋喃发生亲电取代反应的速度要比苯快。
原因如下:①呋喃的共振能比苯低;②呋喃环上每个原子的电子密度大于1,而苯环上每个原子的 电子密度等于1。
1,4-二羰基化合物(Paal-Knorr反应)在酸碱平衡中,酸加到1,4-二羰基体系13中的一个羰基上,使第2个羰基能与其发生分子内亲核反应形成14;最后,在酸催化下,发生β-消除反应。
.Feist-Benary合成a-卤代羰基化合物和β-酮羧酸酯发生环缩合反应生成3-呋喃酸。
噻吩噻吩的芳香性小于苯大于呋喃,原因:①因为硫和氧相比有较低的电负性,硫上的电子对能更有效地共轭;②硫,作为第二短周期的元素,能够扩展其八隅体。
噻吩的亲电取代反应活性和苯甲醚相近。
反应机制与呋喃相同,取代反应发生在2-位或2,5-位。
光异构化反应最简单的方法是1,4-二碳基化合物硫化后再环化脱水,这和呋喃的Paal-Knorr合成类似。
药物有机化学——杂环
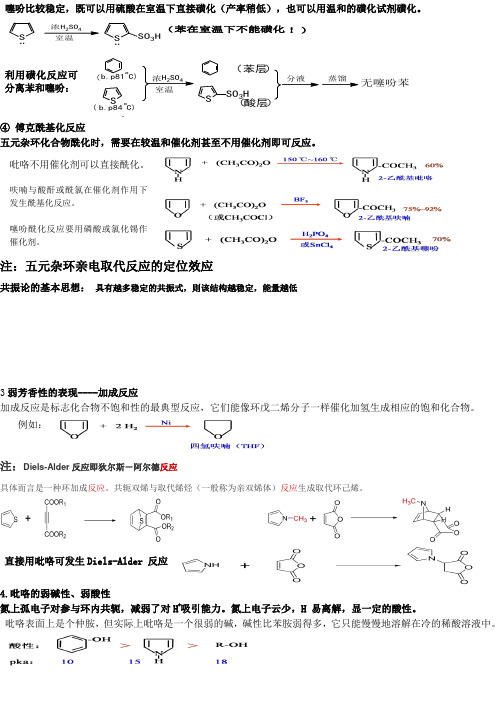
注:五元杂环亲电取代反应的定位效应Diels-Alder反应即狄尔斯-阿尔德反应直接用吡咯可发生Diels-Alder 反应+吸引能力。
氮上电子云少,H 易离解,显一定的酸性。
三五元杂环化合物1呋喃、噻吩、吡咯的结构与芳香性呋喃、噻吩、吡咯都是平面结构,环上所有原子都是SP2 杂化,各原子均以SP2 杂化轨道重叠形成σ键。
碳未杂化的P 轨道中有一个电子,杂原子的P 轨道中有一对电子,P 轨道互相平行重叠,形成闭合的共轭体系。
二几个常见的杂环1.吡咯`呋喃`噻吩均具有芳香性②硝化反应五元杂环化合物与硝酸(强氧化剂)反应,得不到预期产物,而是芳环被破坏。
呋喃, 噻吩和吡咯易氧化, 一般不用硝酸直接硝化; 通常用比较温和的非质子硝化试剂,如:乙酰基硝酸酯,反应在低温下进行。
③磺化反应吡咯、呋喃不能直接用硫酸磺化,因为它们在浓硫酸中不稳定,会发生聚合,通常用一种温和的磺化剂——吡啶三氧化硫进行磺化。
HH£¡²»ÄÜÓÃÇ¿ËáNC5H5N S O3N SO3HO SO3HC5H5N S O3O»Ç»¯¡à¤¡¡¡¡ò¡¡¡¡¡¡¡¡¡。
有机化学中的杂环化合物

有机化学中的杂环化合物有机化学是研究含有碳元素的化合物的科学,而杂环化合物则是其中的一个重要分支。
杂环化合物指含有不同种类的原子构成的环状分子结构,较为复杂且具有广泛的应用领域。
本文将介绍杂环化合物的特点、合成方法以及其在药物研发、材料科学等领域的应用。
一、杂环化合物的特点杂环化合物相对于纯碳环化合物而言,在结构上更加多样化复杂。
其分子结构中含有不同种类的原子,例如氧、氮、硫等,这些原子的加入使得杂环化合物具有更多的化学性质和应用价值。
与其它类型的有机化合物相比,杂环化合物不仅具有较高的化学活性,还表现出更多的生物活性,因此在医药领域中具有重要的地位。
二、杂环化合物的合成方法1. 环加成反应:环加成反应是最常用的合成杂环化合物的方法之一。
该反应通过在分子中引入一个或多个非常活泼的碳原子,进而使其与分子内的其它部分发生反应,从而形成杂环结构。
环加成反应的应用十分广泛,不仅可以用于合成天然产物和药物分子,也可以用于构建新型材料等领域。
2. 脱水缩合反应:脱水缩合反应是另一种常用的杂环化合物合成方法。
在这类反应中,两个或多个分子通过脱水缩合形成新的分子,并在过程中形成杂环结构。
这种方法的优点是原料易得且反应条件温和,适用于大规模合成。
3. 氧化反应:氧化反应是一种引入氧原子的方法,常用于合成含有杂环结构的化合物。
具体来说,通过选择合适的氧化剂,可以将杂环化合物中的氢原子氧化为羟基或羰基等含氧官能团,从而形成具有新特性的分子结构。
三、杂环化合物在药物研发中的应用由于其特殊的结构和多样的化学性质,杂环化合物在药物研发中具有广阔的应用前景。
大量的已上市药物以及正在研发的新药都含有杂环结构。
杂环化合物在这一领域的应用主要表现在两个方面:1. 抗肿瘤药物:许多抗肿瘤药物都是杂环化合物,其通过与癌细胞中的特定酶或DNA结合,从而抑制癌细胞的生长和分裂。
其中,典型的例子包括含有异喹啉、吡嗪等杂环结构的药物。
这些药物的研发和应用使得抗癌治疗取得了重大突破。
第十三章杂环化合物

第三节 重要的杂环化合物及其衍生物~糠醛 重要的杂环化合物及其衍生物~
一、呋喃衍生物
1.糠醛 1.糠醛 糠醛具有芳香醛的特征。性质与苯甲醛相似, 糠醛具有芳香醛的特征。性质与苯甲醛相似,可 以发生氧化、还原、歧化及环上取代等反应。 以发生氧化、还原、歧化及环上取代等反应。 2.呋喃唑酮 呋喃唑酮( 2.呋喃唑酮(痢特灵 ) 3.呋喃妥因( 3.呋喃妥因(呋喃坦丁 ) 呋喃妥因
三、重要的生物碱
1.烟碱 1.烟碱
又名尼古丁 剧毒,属吡啶衍生物类生物碱。 又名尼古丁,剧毒,属吡啶衍生物类生物碱。为 尼古丁, 无色或微黄色液体,在烟草中以柠檬酸盐或苹果酸盐 无色或微黄色液体, 的形式存在。烟碱也是有效的农业杀虫剂。 的形式存在。烟碱也是有效的农业杀虫剂。 2.麻黄碱
Pd
S
+ 2H2
0.2~0.4MPa
S 四氢噻吩 N H 四氢吡咯
N H
Ni + 2H2 200℃
第四节 六元杂环化合物
一、吡啶的结构
..
N原子为sp2杂化
. .
. .
. .
吡啶π电子数符合休克尔规则,具有芳香性。 吡啶π电子数符合休克尔规则,具有芳香性。吡 啶的芳香性比苯弱。 啶的芳香性比苯弱。
呋喃
噻吩
吡咯
二、呋喃、噻吩、吡咯的性质 呋喃、噻吩、
呋喃存在于松木焦油中,其蒸气遇到浸过盐酸的 呋喃存在于松木焦油中, 松木片时呈绿色 叫做松木片反应 绿色, 松木片反应。 松木片时呈绿色,叫做松木片反应。此现象可用来鉴 定呋喃。 定呋喃。 噻吩存在于煤焦油的粗苯及石油中,在浓硫酸存 噻吩存在于煤焦油的粗苯及石油中, 在下,与靛红一同加热显示蓝色 反应灵敏。 蓝色, 在下,与靛红一同加热显示蓝色,反应灵敏。可用来 检验噻吩。 检验噻吩。 吡咯存在于煤焦油和骨焦油中,其蒸气或其醇溶 吡咯存在于煤焦油和骨焦油中, 液能使浸过盐酸的松木片呈红色 红色, 液能使浸过盐酸的松木片呈红色,此反应可用来鉴定 吡咯。 吡咯。
化学结构杂环

化学结构杂环
化学中的杂环化合物指的是分子中含有杂环结构的有机化合物。
杂环是由碳原子和非碳原子构成的环状结构,其中非碳原子被称为杂原子,常见的杂原子有氮、氧和硫等。
杂环化合物是数目最庞大的一类有机化合物,可以分为脂杂环和芳杂环两大类。
在杂环化合物中,由于杂原子的种类与数目、环的元数与环数不同,可以将杂环类药物分成许多不同的大类,例如吡啶类、喹啉类、托烷类、吩噻嗪类、苯并二氮杂卓类、呋喃类、吡唑酮类、嘧啶类等。
杂环化合物普遍存在于药物分子的结构之中,例如某些生物碱、维生素、抗生素等。
由于其独特的结构和性质,杂环化合物在化学、生物学和医学等领域有着广泛的应用。
以上内容仅供参考,建议查阅关于杂环的书籍或咨询化学领域专业人士获取更全面和准确的信息。
有机化学:第十五章 杂环化合物

5 6
7
4 3
2
81
OH 8-羟基喹啉
NH2
1 65
7
2 49 8 3
6-氨基嘌呤
O
4 5
3 CO2H
CH3 1 6 5 N
N 7 CH3
6
12
Br 7
2
O
3
N4 N
8
9
CH3
6-溴吲哚-3-羧酸 1,3,7-三甲基嘌呤-2,6-二酮
标氢:当杂环上含有饱和原子时,往往存在互变异构
体,命名时用“位置编号” +“H” (大写斜体)写在词 首加以区别,并给饱和原子尽可能低的编号。
度的碱性,可成盐。
2.吡啶的水溶性
吡啶氮原子上的一对未共用电子能与水 形成氢键,吡啶能与水互溶,但吡啶环上引 入羟基或氨基后,化合物的水溶性却明显降 低,且引入的羟基或氨基数目愈多,水溶性 愈差,主要原因是溶质分子间缔合(分子间 氢键等),抑制了与水分子间的缔合。
3. 碱性:
吡啶环N原子的一对孤电子对处于sp2杂化轨道上, 它并不参与环上的共轭体系,因此可能和质子结合或 给出电子,呈现弱碱性。吡啶中氮原子上的未共用电 子对处于sp2杂化轨道中,s成分较大,受N的束缚力较 强,给出电子倾向较小,与 H+ 的结合力较弱,所以碱 性较弱。
· ·
·
· ·
N
·
··
叔胺 N
pKb: ~ 4
8.8
N
NH2
H
9.37
~ 14
碱性:叔胺 > 吡啶 > 苯胺 > 吡咯
+ HCl N
· Cl N+ H 吡啶盐酸盐
4.化学反应
⑴
通过氮原子上的未共用电子对,吡啶可以
杂环

杂环化合物一,定义和分类分子中含有由碳原子和其它原子共同组成的环的化合物称为杂环化合物.杂环中的非碳原子称为杂原子,最常见的杂原子有N,O,S等.象环醚,内酯,环酐及内酰胺等似乎也应属于杂环化合物.但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质又与相应的脂肪族化合物类似,因此,一般不放在杂环化合物中讨论.本章讨论的是环系比较稳定,并且在性质上具有一定芳香性的杂环化合物.根据环数的多少分为单杂环和多杂环;单杂环又可根据成环原子数的多少分为五元杂环及六元杂环等;多杂环稠杂环,桥杂环及螺杂环,其中以稠杂环较为常见.二,命名杂环化合物的名称包括杂环母体及环上取代基两部分.杂环母环的命名有音译法和系统命名法2种.音译法:是用外文谐音汉字加\"口\"偏旁表示杂环母环的名称.如呋喃等.系统命名法:是把杂环看作杂原子转换了相应碳环中的碳原子,命名时以相应的碳环为母体,在碳环名称前加上杂原子的名称,称为\"某(杂)某\".如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘. 杂环母环的编号规则(1)含1个杂原子的杂环,从杂原子开始用阿拉伯数字或从靠近杂原子的碳原子开始用希腊字母编号.(2)如有几个不同的杂原子时,则按O,S,-NH-,-N=的先后顺序编号,并使杂原子的编号尽可能小.(3)有些稠杂环母环有特定的名称和编号原则.杂环的命名如下:2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑α-硝基吡咯γ-甲基吡啶3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺α-呋喃甲醛α-噻吩磺酸β-吡啶甲酰胺三,五元杂环化合物(一)吡咯,呋喃和噻吩1,结构与芳香性吡咯环的4个碳原子和1个氮原子都以SP2杂化轨道成键.环上各原子以σ键相连成平面环状结构.氮原子的P轨道(有2个电子)与各碳原子的4个P轨道相互侧面重叠,并垂直于σ键所在的平面,形成了具有6个π电子的闭合共轭体系.呋喃,噻吩的结构与吡咯相似,不同的是呋喃中的氧原子和噻吩中的硫原子都有两对末共用电子对.其中一对参与共轭体系,另一对处于SP2杂化轨道内.以上3种五元杂环,成环原子均参加共轭,π电子数又符合休克尔规则,因此都具有芳香性.但由于环中杂原子的电负性大小不同,电子云密度平均化程度也不同,所以芳香性强弱有所差异.其中氧原子的电负性较大,不易提供电子参与共轭体系,因此呋喃环上电子云密度平均化程度较小,芳香性也较弱.硫原子电负性在三者中最小,参与共轭的双是一对3P电子,电子受核约束力较小容易供出,因此噻吩环上电子云密度平均程度较大,芳香性较强.但它们的芳香性都小于电子云密度高度平均化的苯环.它们的亲电取代反应比苯容易进行.2,物理性质吡咯为无色液体,其蒸气遇盐酸浸过的松木片显红色,可检验吡咯及其低级同系物.呋喃为无色液体,它遇盐酸浸过的松木片显绿色.噻吩为无色而有特殊气味的液体,在浓硫酸的存在下,与靛红作用显蓝色.3,化学性质(1)酸碱性吡咯的碱性很弱(pKa=0.4),不能与稀酸或弱酸成盐.反而能与干燥的氢氧化钾加热生成盐,表现出弱酸性.+ KOH由于氮原子上的末共用电子对参与环的共轭体系,使其电子云密度降低,减弱了它接受质子的能力.所以吡咯的碱性很弱.+ H+(2)亲电取代反应多π芳杂环的杂原子提供了2个电子参与环的共轭,使环碳原子电子云密度有所增大,因而亲电取代反应比苯容易进行,而其中又以α位较大,所以亲电取代反应主要发生在α位上.上述几个杂环的亲电取代反应活性为:吡咯 > 呋喃 > 噻吩 > 苯①卤代反应吡咯,呋喃和噻吩在室温与氯或溴反应很激烈,得到多卤代产物.若要得到一氯代和一溴代产物,需用溶剂稀释并在低温下进行反应.+ Br2+ Br2②硝化反应吡咯和呋喃在强酸性条件下会由于质子化,而破坏环和芳香性,进而聚合成树脂状物质.噻吩用混酸作硝化剂时,共轭体系也会被破坏.因此它们的硝化反应需用较缓和的硝酸乙酰酯作硝化剂并在低温下进行.+ CH3COONO2+ CH3COONO2+ CH3COONO2③磺化反应吡咯和呋喃的磺化反应也需在较缓和的条件下进行,常用吡啶与三氧化硫的混合物作磺化剂.+ 吡啶三氧化硫+ 吡啶三氧化硫噻吩比较稳定,可直接用浓硫酸进行磺化反应.尽管噻吩的活性在三者中最差,但反应仍比苯快得多.噻吩在室温下即能与浓硫酸作用,生成可溶于水的α-噻吩磺酸.苯在同样的条件下不反应.利用这种区别可从粗苯中除去少量的噻吩. (3)还原反应吡咯,呋喃和噻吩均可进行催化加氢反应,被还原为饱和的杂环化合物,并失去芳香性.+ H2 四氢吡咯+ H2 四氢呋喃+ H2 四氢噻吩4,重要的衍生物(1)血红素:血红素是吡咯的重要衍生物,它的基本骨架是卟吩环.(2)叶绿素:是绿色植物叶的和绿色基中特有的色素,与蛋白质等结合构成叶绿体,直接参与植物的光合作用,使太阳能转变为化学能,将二氧化碳和水合成为糖类.(3)呋喃坦啶:又名呋喃妥英,为杀菌剂,主要用于泌尿系统感染.(4)呋喃丙胺(F-30066):有抗日本血吸虫病的作用,对急性日本血吸虫病的退热作用明显.(5)速尿:为强利尿药,主要用于心脏性浮肿,肝硬化引起的腹水,肾性浮肿等,与降压药合用,可增强降压作用.(二)吡唑,咪唑和噻唑1,结构与芳香性吡唑,咪唑和噻唑的电子结构与含1个杂原子的五元杂环相似,因此都具有一定程度的芳香性.环上的另一个杂原子所具有的末共用电子对没有参与共轭体系.如咪唑的第3位氮原子保留了末共用电子对,能结合H+而显示碱性.2,化学性质吡唑与咪唑有互变异构现象.以甲基衍生物为例,氮原子可以在2个氮原子间互变.因此吡唑中的3-位与5-位相同,咪唑中的4-位与5-位相同.常表示为3(5)-甲基吡唑和4(5)-甲基咪唑.由于吡唑,咪唑和噻唑比吡咯或噻吩增加了1个吸电性的氮原子,所以它们的亲电取代反应活性明显降低,对氧化剂也不敏感,有酸存在时不致破坏共轭体系,只有成盐后亲电取代反应更难进行. 3,重要的衍生物(1)安乃近:又名罗瓦尔精,有解热镇病和抗风湿等作用.用于发热,头痛,神经痛和风湿性关节炎等.(2)嘧啶唑:具有消炎,解热和镇痛作用,并有很好的镇静,肌肉松弛作用.(3)甲硝基乙唑:又名灭滴灵,为口服杀滴虫药.(4)西咪替丁:又名甲氰咪胍,用于胃溃疡,十二指肠溃疡等.四,六元杂环化合物(一)吡啶1,结构与芳香性吡啶环上的5个碳原子和1个氮原子也都以SP2杂化轨道相互重叠,形成以σ键相连的环平面.环上每个原子的P轨道相互侧面重叠,且垂直于环平面,构成具有6个电子的闭合共轭体系.与吡咯不同的是,吡啶环上氮原子的末共用电子对占据着SP2杂化轨道,没有参与环的共轭.吡啶的结构也符合休克尔规则,因此具有芳香性.由于环中氮原子的电负性比碳原子大,所以环上碳原子电子云密度降低,形成缺π芳杂环,它的亲电取代反应比苯难进行.2,物理性质吡啶是具有特臭的无色液体.能以任何比例与水互溶,同时又能溶解大多数极性和非极性有机化合物.3,化学性质(1)碱性吡啶分子的氮原子上有1对末参与共轭的电子,能结合H+而显碱性,吡啶的碱性比脂肪胺和氨弱,而近似于芳胺.三甲胺氨吡啶苯胺pKa 9.8 9.3 5.23 4.6吡啶能与无机酸成盐.+ HCl •HCl(2)亲电取代反应由于吡啶分子中氮原子的电负性比碳原子大,环上碳原子电子云密度有所降低;同时,在亲电取代反应中试剂通常是酸性,使氮原子先与酸结合成吸电性的铵离子,因而环上碳原子电子云密度更加降低.所以,吡啶比苯难进行亲电取代反应,其反应条件要求较高.吡啶环上碳原子的电子云密度普遍降低,而其中以β位降低的较少,所以亲电取代反应主要发生在β-位.+ Br2+ 混酸+ 浓H2SO4 + HgSO4若吡啶环上有第一类定位基时,能使吡啶环活化.它们的亲电取代反应就可以在较温和的条件下进行,取代位置由第一类定位基决定.+ Br2+ 浓H2SO4 + KNO3(3)氧化还原反应吡啶环上的电子云密度因氮原子的存在而降低,因此环对氧化剂比较稳定.当环上有烃基时,烃基容易被氧化.+ KMnO4+ KMnO4吡啶比苯容易还原,在常压下就可以被还原为六氢吡啶.六氢吡啶又名哌啶,为无色液体,能与水混溶.它的碱性(pKa=11.2)比吡啶强,性质与脂肪仲胺相似,在有机反应中用作碱性试剂.4,重要吡啶衍生物烟酸和烟酰胺:烟酸是维生素B族中的一种,能促进细胞的新陈代谢,并有血管扩张作用.烟酰胺是辅酶I的组成成分,作用与烟酸相似.烟酸烟酰胺β-吡啶甲酸β-吡啶甲酰胺尼可刹米和异烟肼:尼可米刹又名可拉明,为呼吸中枢兴奋药,用于中枢性呼吸和循环衰竭.异烟肼又名雷米封,为抗结核病药.尼可米刹异烟肼N,N-二乙基-3-吡啶甲酰胺 4-吡啶甲酰肼(二)嘧啶嘧啶为无色晶体,易溶于水.嘧啶的结构与吡啶相似,2个氮原子均以SP2杂化轨道成键,并都在1个SP2杂化轨道上保留了末共用电子对,因此其性质也与吡啶相似,但由于2个氮原子的相互影向,明显地降低了环上的电子云密度,使嘧啶的碱性(pKa=1.30)比吡啶弱得多,亲电取代反应比吡啶困难,而亲核取代反应则比吡啶容易.五,稠杂环化合物(一)吲哚吲哚为白色结晶,可溶于热水,乙醇及乙醚,有极臭的气味,但纯吲哚在浓度极稀时,有花的香味,可作香料用.吲哚使浸有盐酸的松木片显红色.吲哚具有芳香性,性质与吡咯相似.酸性(pKa=17.0)与吡咯相当.其亲电取代反应在杂环上进行,取代基主要进入β位.(二)喹啉和异喹啉喹啉为无色油状液体,有特殊气味.异喹啉为无色油状液体.它们微溶于水,易溶于有机溶剂.喹啉(pKa=4.90)的碱性比吡啶弱,异喹啉(pKa=5.42)的碱性比吡啶强.(三)嘌呤嘌呤为无色结晶,易溶于水,难溶于有机溶剂.嘌呤既有碱性(pKa=2.30)又有弱酸性(。
杂环化学

第二十章 杂环化合物 (Heterocyclic compounds)概述:杂环化合物:含有杂环的化合物,称为杂环化合物。
杂环:由碳原子和至少一个其它原子,如氧、硫、氮等组成的环。
杂环化合物来源、用途:有机化合物中约一半为杂环化合物。
许多杂环化合物存在于自然界中,并在生命体系中起着重要作用。
目前应用的药物中有很大一部分是杂环化合物。
此外,杂环化合物还用作杀虫剂、染料等。
杂环化合物分类:第一类:无芳香性的杂环化合物:OOOON HN H四氢呋喃 丁二酸酐 四氢吡咯 六氢吡啶例:第二类:具有一定程度的芳香性的杂环化合物:ONHN 呋喃 吡咯 吡啶例:一 分类和命名芳杂环的数目很多,可根据环大小、杂原子的多少以及单环和稠环来分类。
常见的杂环为五元、六元的单杂环及稠杂环。
稠杂环是由苯环及一个或多个单杂环绸合而成。
命名:采用外文名的音译,用带“口”字旁的同音汉字表示。
1 五元杂环Oβααβ12345S N Hfuran 呋喃噻吩吡咯thiophene pyrrole五元环中含两个或两个(至少有一个氮原子)以上的杂原子的体系称唑。
N H N 12345imidazole 咪唑N H N 12345pyrazole 吡唑S N 12345thiazole 噻唑O N 12345oxazole 噁唑 2 六元杂环N pyridine 吡啶N Npyrimidine 嘧啶NN pyridazine 哒嗪N Npyrazine 吡嗪3 稠杂环N15862347N 15862347N H 12345679N N N H 12345678quinoline 喹啉isoquinoline 异喹啉indole 吲哚purine 嘌呤二 吡咯、呋喃和噻吩 1 结构特点O 呋喃S噻吩N H吡咯平面结构 环上的原子均为sp 2杂化 闭环共轭体系 π电子数符合4m+2 具有芳香性Π56体系属于亲电取代反应活性:吡咯、呋喃、噻吩大于苯。
杂环化学

第二十章 杂环化合物杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。
本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。
环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。
组成杂环的原子,除碳以外的都叫做杂原子。
常见的杂原子有氧、硫、氮等。
前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。
杂环化合物种类繁多,在自然界中分布很广。
具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。
例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。
一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。
杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
20.1 杂环化合物的分类和命名为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。
最常见的单杂环有五元环和六元环。
稠杂环有芳环并杂环和杂环并杂环两种。
另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。
杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。
译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。
例如:呋喃 咪唑 吡啶 嘌呤furan imidazole pyridine purine杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。
含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。
第二十章 杂环化合物

N Pr-n
Pr-n
1. HNO3/H2SO4 2. SOCl2 3. NH4Cl 4. H2/Pd
H N H2NOC H2N
OC2H5
N P r-n
COCl
20-46
O O H2N C OC2H5 NH C N CH3 NaOH/C 2H5OH, H2O N P r-n
20-47
下列系列反应是美国辉瑞公司抗高血压药品Istin的商业合成路线,该药的年销售额 达30亿美元,根据其合成路线回答下列问题。
喹啉的氧化还原反应
Sn + HCl
N
HNO3 [O]
N H COOH N COOH
பைடு நூலகம்
20-42
喹啉的合成—斯克洛浦(Skraup)合成
CH2-OH CH-OH CH2-OH HC O CH CH2 H H N ..
H2SO4 - H2O
NH CH2 CH H HO C H
NH H2N + N
C6H5NO2
EtO2C
EtO2C Step 5
1、提出 STEP 1反应条件和该反应的机理。 2、写出 STEP 2反应机理并说明为什么需要两当量的NaH。 3、 STEP 3的反应试剂为邻氯苯甲醛和六氢吡啶,写出该步的反应机理。 4、写出STEP 5 的反应试剂和该反应的机理。 附加题: 5、建议STEP 4 反应试剂和该反应的机理 20-48
20-37
喹
啉
5 6 7 8
4 N 1 3 2
多种抗疟疾药物,均含有喹啉环
20-38
喹啉的亲电取代反应
Br
Br2 HgSO4
+ N
NO2
N Br
+
有机化学精品课件——杂环化合物

杂环化合物在染料合成中具有重要作用,因为它们可以提供鲜艳的色彩和优良的染色性能。例如,偶氮染料和酞菁染料等杂环染料在纺织品、皮革和纸张等领域广泛应用。
杂环化合物作为染料合成的关键组分,能够提高染料的色牢度和稳定性,同时降低生产成本和对环境的污染。
有机化学精品课件——杂环化合物
汇报人:
2023-12-30
杂环化合物的定义与分类杂环化合物的结构与性质杂环化合物的合成与反应机理杂环化合物的应用杂环化合物的研究进展与展望
目录
杂环化合物的定义与分类
01
总结词
杂环化合物是指分子中至少含有一个杂原子(非碳原子)的环状化合物。
详细描述
杂环化合物是环状有机化合物中的一大类,其分子结构中至少含有一个杂原子(非碳原子),这些杂原子可以是氮、氧、硫等。这些原子与环上的碳原子共同构成一个环状结构。
杂环化合物在材料科学中具有广泛的应用,因为它们可以提供优良的物理和化学性能。例如,聚酰亚胺、聚醚醚酮等杂环高分子材料在航空航天、电子和汽车等领域广泛应用。
杂环化合物作为材料合成的关键组分,能够提高材料的耐热性、耐腐蚀性和机械性能等,同时降低生产成本和提高生产效率。
杂环化合物的研究进展与展望
05
谢谢您的观看
THANKS
在合成过程中,需要注意控制反应条件,如温度、压力、催化剂等,以保证合成效率和产物的纯度。
杂环化合物的合成方法还可以据具体需要采用一些特殊的方法,如分子内的亲核取代反应、分子内的亲电取代反应等。
亲电反应机理是指反应过程中,试剂首先进攻杂环化合物上的电子云密度较低的部位,从而形成正碳离子中间体。然后,正碳离子中间体再与试剂发生反应,形成新的键,最终生成产物。
phil baran 杂环化学讲义

phil baran 杂环化学讲义
(最新版)
目录
1.介绍 Phil Baran 的杂环化学讲义
2.杂环化学的重要性
3.讲义的主要内容
4.讲义的价值和影响
正文
Phil Baran 的杂环化学讲义是一本关于杂环化学的权威教材,对现代有机化学领域产生了深远影响。
杂环化学是研究杂环化合物的合成、反应、性质和应用的科学,它在药物、材料、农药等领域有着广泛的应用。
杂环化学的重要性体现在其广泛的应用上。
杂环化合物具有丰富的化学性质和生物活性,可以用于合成各种有机化合物,包括许多药物和材料。
因此,杂环化学在现代有机化学中占据了重要的地位。
Phil Baran 的杂环化学讲义主要包括杂环化合物的合成、反应、性质和应用等方面的内容。
书中详细介绍了各种杂环化合物的合成方法,包括经典的 Sonogashira 反应、Mukaiyama-Michael 反应等,以及近年来发展起来的各种新型反应。
此外,书中还介绍了杂环化合物的反应、性质和应用,包括杂环化合物的取代反应、加成反应、环化反应等,以及杂环化合物在药物、材料、农药等领域的应用。
Phil Baran 的杂环化学讲义对有机化学领域产生了深远的影响。
许多有机化学家都从这本书中学习到了杂环化学的知识,并将其应用到科研和生产实践中。
第1页共1页。
杂环化学综述

噻唑类化合物在农药和医药领域的应用穆惠芳2014111130杂环化合物是以含有一个或多个杂原子(O、N或S)的五元或六元环系或稠环系为主的一类化合物。
自从Anderson在1857年从骨焦油中分离出吡咯,Scheele在1870年制出呋喃和Meyer在1882年发现噻吩以来,至今一个多世纪中,被发现、制备的杂环化合物的数目已达到惊人的数字。
20世纪三十年代拜耳斯坦有机化学手册记载的杂环化合物数目约占当时已知的数十万种有机化合物的1/3。
到1971年,已知的数百万种有机化合物中,有一半以上是杂环化合物。
近几十多年来,杂环化合物在有机化合物中所占的比例仍是有增无减。
噻唑环是一类重要的五元芳香杂环,含有氮和硫杂原子,具有丰富的电子,易形成氢键、与金属离子配位以及∏-∏堆积、静电和疏水作用等多种非共价键相互作用,这种结构赋予了噻唑类化合物许多特殊的性能,在众多领域具有广泛的潜在应用,引起众多工作者的极大关注,相关研究工作包括其合成方法日趋增多。
尤其是随着一系列噻唑类化合物成功用于临床和农业生产,噻唑类化合物的研发成为近些年来研究的热点领域之一。
基于噻唑类化合物的研发与其特殊性能的应用,以及近年来的新发展,本文综述了噻唑类化合物在医药、农药、领域的应用。
一、农药领域的应用噻唑类化合物作为农药以其优良的除草活性、高效的植物生长调控作用以及低毒的杀菌和杀虫效果在农业领域得到广泛应用,为促进畜牧业、林业的发展和确保农作物丰收做出了杰出贡献。
因此,噻唑类农药的研发得到广泛重视,已开发出许多高效、对人畜低毒和经济的农药,如杀菌剂噻呋酰胺(1,Thifluzamide)、噻唑菌胺(2,Ethaboxam)、苯噻菌胺(2,Metsulfovax)和除草剂苯噻草胺(4,Mefenacet)等。
然而近些年来,随着农药大量、广泛的使用,其对生态环境的负面影响也逐渐暴露,加之日益严重的耐药性、农药残留等问题,现有农药的使用已逐渐受到各方面关注和质疑,迫切要求开发新的对环境无害和绿色环保的新农药。
S-17杂环化合物课件

2
N1
喹啉
quinoline
5 6
4 3
7
N2
8
1
异喹 啉
isoquinoline
4
5
3
6 7
2
N1 H
吲哚
indole
O
苯 并呋喃 benzofuran
6
1N 5 N7
2
8
N3 4
N9 H
嘌呤
purine
8
9
1
7
2
6 5
3
N 10
4
吖啶
acridine
前面所讲的内酯、内酰胺、环氧乙烷等从结构上来看,也 属于杂环化合物,但其性质与同类的开链化合物相似。且 很容易开环形成链状化合物。
杂环化合物种类繁多,数量庞大,是有机化合物中数量最 大的一类。广泛存在于自然界中,很多在动植物体内起着 重要的生理作用。如:中草药的有效成分生物碱、血红素、 叶绿素、核酸的碱基等,都是含氮杂环化合物;为数不少 的维生素、抗生素以及一些植物色素和植物染料都含有杂 环;目前合成的杂环化合物也是为数众多,不少合成药物, 合成染料、新型高分子材料也含有杂环结构。在现代药物 中,杂环化合物占了相当大的比重。因此可以说:杂环化 合物在生命科学中占有重要地位;杂环化学是有机化学的 一个重要组成部分。
键长没有完全均匀化
N 0.1383nm
二. 化学性质
1.亲电取代反应
杂原子具有吸电诱导效应,又具有供电共轭效应。 吡咯中氮的供电共轭效应大于吸电诱导效应。
a. 亲电取代反应的活性
吡咯 > 呋喃 > 噻吩 >> 苯
溴化相对速度:3*1018 6*1011 5*1011
1
b. 亲电基团一般进入杂原子的邻位
1-杂环化合物及其应-概述

第一节 杂环化合物的一般描述
● 概念:构成环系的原子除碳原子外,还含有其它原子,这类化合物称 杂环化合物(heterocyclic compound)。组成环系的非碳原子称为杂原子 (heteroatom)。
杂环化合物的类别
0、I族,常态几乎没有稳定的化合物存在 金属杂环化合物 非金属杂环化合物
H3C H3C
氯化血红素
C H2
C H3
N
F+e
N C l-
NN
C H2 C H3
COOH
COOH
维生素等 维生素B1 青霉素钠
N
NH3+ClCH2
+NCl-
H3C N
S
CH3 CH2CH2OH
O CH2C-NH
H S CH3
N O
CH3 COONa
维生素B12
发维生素B12 ,又名钴胺素,存在于动物肝脏中,为暗红色针状结晶, 是抗恶性贫血的药物。
● 杂环化合物与有机、无机化合物的关系:
杂环化合物
有机杂环化合物 无机杂环化合物
有机化合物
链状物 碳环
环状物 杂环
二维(平面) 环属性
三维(立体)
饱和环 非饱和环(含芳环)
● 由于杂环化合物所含杂原子的数目、种类、位置及其环的大小和键 的属性差异而导致杂环化合物的种类繁多,数目庞大,约占有机化合物的 65%以上。
黄连素是黄色结晶,m.p.145℃,味苦,易溶于水,难溶于有机溶剂。 黄连素具有抑制痢疾杆菌、链球菌及葡萄糖球菌的等作用,临上用于治 疗痢疾及胃肠炎等。
颠茄碱(莨菪碱、阿托品)
CH3 N
H H
OCC O CH2OH
杂环总结——精选推荐

杂环总结⼀,绪论1,杂环化合物的定义杂原⼦:⾮碳原⼦,如:氧、硫、氮等。
杂环:由碳原⼦和杂原⼦构成的环。
杂环化合物:环中⾄少含有⼀个杂原⼦的化合物。
2,杂环化学:是研究杂环化合物的分⼦结构、物理和化学性质、制法及其应⽤的⼀门学科,是有机化学的组成部分。
3,杂环化合物分类⑴按环的⼤⼩:主要有五元环、六元环⑵按杂原⼦的数⽬:⼀个、两个…杂原⼦⑶按环的形式:单杂环、稠杂环 4.根据杂环有⽆芳⾹性可分为:(1)芳⾹杂环芳符合休克尔规则( Huckel Rule),即具有(4n ⼗2)个离域电⼦的杂轮烯。
富电⼦杂环:呋喃,吡咯,噻吩等。
乏电⼦杂环:吡啶,嘧啶。
(2)⾮芳⾹杂环---脂杂环所有饱和的、部分饱和的杂环以及反芳⾹性的杂轮烯。
杂环化合物的俗称:furan pyrrole thiophene imidazole oxazole 呋喃吡咯噻吩咪唑噁唑thiazole pyran pyridine pyrimidine pyrazine 噻唑吡喃吡啶嘧啶吡嗪indole quinoline purine carbazole吲哚喹啉嘌呤咔唑4,杂环化合物命名⑴从杂原⼦开始编号,并使取代基位次最⼩例如:,5,含两个或多个相同杂原⼦的单环体系若同⼀环上有多个相同的杂原⼦,应使杂原⼦所在位次的编号最⼩;⽤⼆、三、四等作为词头来表⽰喊相同杂原⼦的个数。
6. 含两个或多个不同杂原⼦的单环体系含多个杂原⼦,按标2.1中的顺序列出(O、S、N次序);使各杂原⼦的位次的编号最⼩;带取代基的或有H的杂原⼦为1号。
例:7.由单键连接的相同环系根据环的个数可⽤词头⼆,三,四等来表⽰。
8. 含⼀个苯的双环体系稠环体系:⾄少有两个相邻的原⼦被两个或更多个环所共⽤的体系。
有⼀些苯并稠杂环的俗名:只有杂环有俗名,则⽤词头“苯并”和杂环的俗名相结合来命名。
9杂环没有俗名,需要看做整体来进⾏编号。
①使尽可能多的环放在横坐标上;②使环中最⼤的编号在纵坐标的最上边。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[xxxxxxx]
杂环化学论文
[噻唑类化合物在医药领域的应用]
作者:[xxxxxx]
指导教师:[xxx]
专业名称:[精细化工]
学号:xxxxxxxxxxxxxxxxxx
2015年7月11日
噻唑类化合物在医药领域的应用
xxx
xxxxx
摘要:噻唑类化合物广泛应用于医药领域。
综述了噻唑类化合物在抗结核、抗癌、抗病毒、消炎镇痛、降血糖等领域显示出广阔的应用前景。
关键字:噻唑杂环化合物医药病毒抗癌
一.前言
杂环化合物是以含有一个或多个杂原子(O、N或S)的五元或六元环系或稠环系为主的一类化合物。
自从Anderson在1857年从骨焦油中分离出吡咯,Scheele 在1870年制出呋喃和Meyer在1882年发现噻吩以来,至今一个多世纪中,被发现、制备的杂环化合物的数目已达到惊人的数字。
近几十多年来,杂环化合物在有机化合物中所占的比例仍是有增无减。
噻唑环是一类重要的五元芳香杂环,含有氮和硫杂原子,具有丰富的电子,易形成氢键、与金属离子配位以及∏-∏堆积、静电和疏水作用等多种非共价键相互作用,这种结构赋予了噻唑类化合物许多特殊的性能,在众多领域具有广泛的潜在应用,引起众多工作者的极大关注,相关研究工作包括其合成方法日趋增多。
尤其是随着一系列噻唑类化合物成功用于临床,噻唑类化合物的研发成为近些年来研究的热点领域之一。
基于噻唑类化合物的研发与其特殊性能的应用,以及近年来的新发展,本文综述了噻唑类化合物在医药领域的应用。
二.医药领域的研究与应用
噻唑类化合物作为药物显示出巨大的开发价值,至今已有众多噻唑类药物用于临床治疗多种疾病,为保障人类健康发挥着重要作用。
噻唑类化合物相关医药研究工作众多,较为活跃,在抗结核、抗癌、抗病毒、消炎镇痛、降血糖等领域显示出广阔的应用前景。
(一)、抗结核类噻唑化合物
结核病是由结核杆菌引起的死亡率较高的感染性疾病,临床上使用的抗结核药物如利福平等数十种药物,具有高效的杀菌活性。
但是随着耐药菌株频发和临床药物的不良反应如胃肠道反应和肝损害等导致现有抗结核药物疗效降低、毒副作用大,临床应用受到限制,因此亟待开发新类型的抗结核药物。
以噻唑类化合物为代表的新型抗结核分枝杆菌含氮芳杂环类化合物得到广泛而又深入的研究,噻唑、三唑和二唑等唑类化合物具有与分支杆菌细胞壁相似的脂溶系数,可干扰细胞壁的生成,抑制菌株的繁殖。
三唑硫醇类噻唑12具有优良的抗结核分枝杆菌的能力。
(二)、抗癌类噻唑化合物
癌症已成为人类健康的严重威胁之一,抗癌药物的研发得到广泛的重视,成为全世界医药研究最多的领域之一。
尽管有多种抗癌药物用于临床,但癌症的频发与多样性以及抗癌药物的高毒性、低选择性使现有临床药物远不能满足用药需求,新抗癌药物的开发仍是药物化学工作者十分紧迫的重要课题。
噻唑类化合物是抗癌药物研发的重要方向之一。
已有多种噻唑类化合物如帕米格雷(15,Pamicogrel)、噻唑呋林(16,Tiazofurine)成功用于临床,在癌症治疗过程中起着重要作用。
磺氯苯脲(Sulofenur)是临床上广泛使用的治疗肺癌、胃癌和子宫癌等癌症
的一线药物,然而由于口服剂量受限和临床出现的毒副作用,限制了其进一步使
用。
用噻唑啉酮修饰得到的磺氯苯脲衍生物17表现出广谱的抗癌活性,对小细
胞肺癌、结肠癌、黑色素瘤、卵巢癌等癌细胞株均显示出有效的抗增殖能力。
(三)、抗病毒类噻唑化合物
近些年来,噻唑类化合物在抗病毒领域取得许多重要成果,尤其是抗HIV 药物利托那韦(22,Ritonavir)。
因此,噻唑类化合物成为抗病毒领域的热点之一,以噻唑环构建新结构的抗病毒药物已经成为抗病毒药物研发的重要方法。
以黄病毒属包膜蛋白为靶点,通过数据库模拟、结构修饰、再经体外活性筛选得到抗病毒活性好、细胞毒性低的噻唑衍生物23对生物体酶解作用具有一定
的抵抗力,可以有效地抑制黄热病毒增殖,半数有效浓度值为5±1。
7mol/L,治疗指数达到37,显示出高效低毒的优点。
(四)、消炎镇痛类噻唑化合物
炎症是机体的一种防御机制,临床常表现为红肿、疼痛。
噻唑类化合物作为消炎镇痛药物的研发工作主要包括两方面:一是用噻唑环对现有临床消炎镇痛药物的修饰,如对吡罗昔康修饰得到的噻唑类消炎镇痛药物美洛昔康、舒多昔康(25,Sudoxicam)具有高效、低毒的优点;二是以噻唑为中心引入其他消炎镇痛药效基团构建新结构消炎镇痛药物,如临床药物法奈替唑(26,Fanetizole)、芬替酸(27,Fentiazac)等。
(五)、降血糖类噻唑化合物
随着生活水平的提高,肥胖症的发病率越来越高,糖尿病患者趋于低龄化,引起了人们的极大关注,众多相关工作致力于降血糖药物的研发。
现有降血糖药物主要包括磺酰脲类、双胍类、苯丙氨酸类、噻唑烷二酮类等。
其中噻唑烷二酮类药物作为胰岛素增敏剂是临床使用最为广泛的降血糖药物之一,具有疗效好、生物利用度高、药物相互作用小等优点。
噻唑烷二酮降血糖药物的成功鼓励着科学工作者研究开发更加有效的噻唑类降血糖药物,许多研究主要是以影响糖类代谢的催化酶为靶点,以具有优良亲和能力的噻唑环为中心构建新型噻唑类降血糖化合物。
果糖-1,6-二磷酸酶(FBPase)抑制剂是临床治疗2-型糖尿病的一线药物。
噻唑类FBPase抑制剂30已进入临床实验阶段,并且表现出良好的降血糖效果和较高的生物利用度,有望成为第一个口服FBPase酶抑制剂[83]。
此外,含有噻唑基团的香豆素衍生物31显示出明显的抑制α-淀粉酶的效果,同时还发现该化合物和病原性微生物的DNA具有很强的键和能力,可使DNA丧失继续复制的功能[84]。
可见,噻唑类化合物在医药领域研究活跃,在抗菌、抗癌、抗病毒、消炎镇
痛、和降血糖等众多领域取得了许多重要研究成果,显示出巨大的发展前景。
综上所述,噻唑类化合物在医药领域具有广泛的潜在应用,且已取得许多杰出的研究成果,成为非常活跃的研究领域之一。
随着噻唑类化合物相关研究工作的深入和诸如计算机模拟技术改进、酶和受体作用靶点数据库的健全等现代技术手段的发展,对噻唑类化合物的应用研发必将更加广泛。
可能在以下几方面:(1)噻唑类化合物在材料领域的研究工作相对较少,除持续开发传统噻唑类染料研究工作外,噻唑类材料研发将向光电材料领域进一步延伸;(2)在生物染色剂领域,噻唑黄以其独特的荧光特性受到持续关注外,开发新型噻唑类核酸染色剂将成为化学、生物学和医学的研究热点之一;(3)随着超分子识别领域的蓬勃发展,噻唑环以其独特的杂原子五元芳香体系,在研发高选择性、高灵敏度、良好的稳定性且操作简单、安全可靠的超分子化学传感器中将发挥着重要作用。
由此可见,我们有理由相信,随着噻唑类化合物在各个领域更加深入的研究,新一代的噻唑类化合物必将为促进人类社会进步作出卓越贡献。
参考文献:
1.黄光, 杨吉春, 李慧超, 张静, 刘长令. 具有农药活性的噻唑类化合物的研究进展. 农
药, 2011, 50(2): 79–82
2.张一宾, 张怿. 世界农药新进展. 北京: 化学工业出版社, 2007
3. 陈万义. 新农药的研发—方法•进展. 北京: 化学工业出版社, 2007
4. 王艳, 周成合. 三唑类药物研究新进展. 中国科学: 化学, 2011, 41(9): 1492–1456。
