元素推断题解题策略
【高中化学】高中化学元素推断题大题解题策略

【高中化学】高中化学元素推断题大题解题策略高中化学
元素推理问题,大问题解决策略,仅供参考。
元素或物质推断类试题
这类问题主要以元素周期律、元素周期表知识或物质间的转换关系为命题点,以提供
周期表、元素性质文本描述或方框图转换的形式展示问题的根源,然后设计了一系列书面
的化学术语、离子半径比、金属或非金属强度判断、溶液中离子浓度的测定及相关的简单
计算。
推理问题的完整形式有:推理元素或物质、写作术语和判断性质。
高中化学元素推断题大题解题策略
对于元素推断问题,你通常可以在草稿纸上画一个只包含短周期元素的周期表,然后
根据该表进行推断。
(1)对有突破口的元素推断题,可利用题目暗示的突破口,联系其他条件,顺藤摸瓜,各个击破,推出结论;
(2)对于没有明显突破的元素推理问题,可以利用指示条件的限制逐步缩小推理范围,充分考虑元素之间的关系进行推理;
(3)有时限定条件不足,则可进行讨论,得出合理结论,有时答案不止一组,只要能
合理解释都可以。
若题目只要求一组结论,则选择自己最熟悉、最有把握的。
有时需要运
用直觉,大胆尝试、假设,再根据题给条件进行验证也可。
高中化学元素推理问题的总体思考
高中化学元素推断题解题的一般思路和方法:读图审题→找准"突破口"→逻辑推理→
检验验证→规范答题。
解答的关键是迅速找到突破口,一般从物质特殊的颜色、特殊性质
或结构、特殊反应、特殊转化关系、特殊反应条件等角度思考。
突破口不易寻找时,也可
从常见的物质中进行大胆猜测,然后代入验证即可,尽量避免从不太熟悉的物质或教材上
没有出现过的物质角度考虑,盲目验证。
5-4第四讲 元素推断题的解题策略及思维模型

元素特征信息 A的单质是密度最小的物质 B的单质能与冷水剧烈反应,所得强碱性溶液 中含有两种电子数相同的阴、阳离子 C的原子最外层电子数是其内层电子数的三倍
D E F
D与B同周期,该周期中D的简单离子半径最小
B、C、E组成的36电子的化合物Y是家用消毒
剂的主要成分 F元素最高正价与最低负价的代数和为4
R (1)元素T的名称是________________。 (2)J和氢元素组成的化合物A的每个分子由4个原子组成, 已知充分燃烧a g A物质时生成1 mol二氧化碳气体和液态 水,并放出热量b kJ,则表示A物质燃烧热的热化学反应 方程式是_______________________________________。
【典例1】 短周期元素A、B、C的原子序数依次增大,其原子 的最外层电子数之和为10,则A与C在周期表中位置上下 相邻,B原子最外层电子数等于A原子次外层电子数,下 列有关叙述不正确的是 ( )。 A.A与C可形成共价化合物 B.A的氢化物的稳定性大于C的氢化物的稳定性 C.原子半径A<B<C D.B的氧化物的熔点比A的氧化物熔点高 解析 A与C在周期表中位置上下相邻,A、C同主族,且 A在第二周期,B原子最外层电子数等于A原子次外层电子 数,B为镁元素,据A、B、C三原子的最外层电子数之和 为10,则A为碳元素,C为硅元素,A与C可形成共价化合 物SiC,CH4稳定性大于SiH4稳定性,MgO为离子晶体, A的氧化物为分子晶体,原子半径B>C>A。 答案 C
ΔH=-2b kJ· mol (3)B、D
-1
(4)2NH3· 2O+3H2O2===N2↑+8H2O H (5)< (6)光导纤维、石英玻璃、石英钟表、建筑材料等
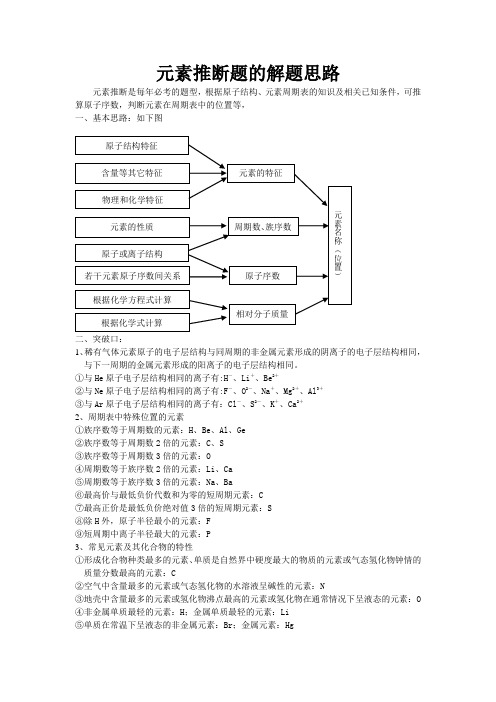
元素推断题的解题思路

元素推断题的解题思路以“位—构—性”三者关系为中心,利用原子结构和元素周期律的知识推断未知元素并回答相关问题是高考常见题型。
一、根据原子结构:原子序数(或质子数、核外电子数),原子或离子结构示意图和核外电子排布中任一项都是元素原子特有的结构特点。
记住1-36号元素的原子结构及电子排布特征,记住具有稀有气体原子电子层结构的离子(特别是氖型、氩型离子)(1)电子数等于电子层数的是H(2)最外层电子数是次外层电子数一半的是Li 、Si(3)最外层电子数是次外层电子数二倍的是C(4)最外层电子数是次外层电子数三倍的是O(5)最外层电子数是内层电子总数一半的是Li 、P(6)某元素原子的外围电子排布为2n n ns np +,则n 只能取2,即2422s p ,为O(7)2X -离子与氩原子具有相同的电子层结构,则X 是S二、根据元素周期表中的位置:周期序数=电子层数、主族元素价电子层数=族序数=最高正价、最高正价与最低负价的绝对值之和为8(H 、O 、F 除外)对于短周期元素:(1)族序数等于周期序数的元素有H 、Be 、Al(2)族序数等于周期序数2倍的是C 、S(3)族序数等于周期序数3倍的是O(4)周期序数等于族序数2倍的是Li(5)周期序数等于族序数3倍的是Na(6)最高正价与最低负价的绝对值相等的有C 、Si(7)最高正价是最低负价绝对值3倍的是S三、利用元素的性质、存在和用途的特殊性(1)原子半径最小的是H(2)形成化合物种类最多的元素,或单质是自然界硬度最大的元素是C(3)空气中含量最多的元素,或气态氢化物的水溶液呈碱性的元素是N(4)地壳中含量最多的元素,或氢化物的沸点最高的元素,或氢化物在通常状况下呈液态的元素是O(5)地壳中含量最多的金属元素Al(6)最活泼的非金属元素,或无正价的元素,或气态氢化物最稳定,电负性最大的元素F(7)单质在常温下呈液态的非金属元素Br(8)最高价氧化物及其水化物既能与强碱反应,又能与强酸反应的元素有Be、Al(9)元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素是N(10)同一周期,第一电离能最小的元素位于IA族,电负性最大的位于VIIA族四、利用化学计算:进行化学式计算,电子层上电子数的计算,求出相对原子质量、核外电子数或化合价例、Q、R、X、Y、Z五种元素的原子序数依次递增,已知:(1)Z的原子序数为29,其余的均为短周期主族元素ms mp(2)Y原子价电子外围电子排布n n(3)R原子核外L层电子数为奇数(4)Q、X原子p轨道的电子数分别为2和4。
元素推断题解题策略

(9) 最 活 泼 的 非 金 属 元 素 ( 或 无 正 价 的 元 素 、 无含氧酸的非金属元素、其无氧酸可腐蚀 玻璃的元素,其气态氢化物最稳定的元素 或阴离子的还原性最弱的元素):F。
(10)自然界最活泼的金属元素(或最高价氧化 物的水化物碱性最强的元素、阳离子氧化性 最弱的元素):Cs。
2.化合物的特性
(11)内层电子数是最外层电子数2倍的原子:Li、 P。
2.熟悉主族元素在周期表中的特殊位置 (1)族序数等于周期数的元素:H、Be、Al。 (2)族序数等于周期数2倍的元素:C、S。 (3)族序数等于周期数3倍的元素:O。 (4)周期数是族序数2倍的元素:Li。 (5)最高正价与最低负价代数和为零的短周期元素:C、Si。 (6)最高正价是最低负价绝对值3倍的短周期元素:S。 (7)除H外,原子半径最小的元素:F。 (8)最高正价不等于族序数的元素:O、F。
(1)Al2O3、Al(OH)3的两性 (2)SO2、HClO、Na2O2、H2O2的漂白性 (3)HClO4为最强的无机含氧酸 (4)HF是HX中唯一的弱酸
(5)NH3是中学阶段唯一的碱性气体 (6)H2O是常温常压的无色液体氢化物
如图表示元素周期表前四周期的一部分,关于元素 X、Y、Z、W的叙述正确的是( )
ห้องสมุดไป่ตู้
(7) 最 外 层 电 子 数 是 次 外 层 电 子 数 4 倍 的 原 子 : Ne;
(8)电子层数与最外层电子数相等的原子:H、 Be、Al;
(9) 核 外 电 子 总 数 为 最 外 层 电 子 数 2 倍 的 原 子 : Be;
(10)次外层电子数是最外层电子数2倍的原子: Si、Li;
元素推断题的解题策略 一、元素推断题的思维流程
元素推断题的常见解题方法

元素推断题的常见解题方法元素推断题是考查物质结构、元素周期表(律)、元素性质等知识的重要题型,同时也是考查分析、推理、判断等思维能力的常用手段。
其命题空间广阔,知识渗透性强,是高考的重点和热点。
如何才能快速准确突破这类题型,以下解题方法,以供参考。
一、从元素“位-构-性”突破1. 利用元素位置【例题1】短周期元素X 、Y 、Z 在周期表中的位置如图所示。
试回答: (1)X 元素单质的化学式___若X 核内中子数与质子数相等,X 单质的摩尔质量是___。
(2)Y 元素的原子结构示意图是_______。
(3)Z 单质的晶体类型属于_______Z 与钠形成的化合物的电子式_______。
解:由X 、Y 、Z 都是短周期元素,结合周期表可知X 、Y 、Z 分别是一、二、三周期的He 、F 、S ,由此易得各问答案如下:(1)He 4g/mol (2)(3)分子晶体2. 利用原子结构【例题2】W 、X 、Y 、Z 四种短周期元素,W 原子核内只有一个质子,X 原子的电子总数与Z 原子的最外层电子数相等,W 原子与X 原子的最外层电子数之和与Y 原子的最外层电子数相等。
Z 原子的最外层的电子数是次外层电子数的3倍。
则(1)元素名称X Y Z W 。
(2)写出W 4XY 2Z 的结构简式__________该化合物的名称是 。
解:由题意结合原子结构特点依次得出W 是H ,Z 是O ,X 是C ,Y 是N 故答案是(1)X 是碳、Y 是氮、Z 是氧、W 是氢(2)CO(NH 2)2 尿素。
3. 利用元素特性【例题3】A 、B 、C 、D 均为短周期元素,B 、A 可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B 与D 能形成一种极易溶于Na +[:S :]2- Na + .. ..水的碱性气体X,B与C能形成极易溶于水的酸性气体Y。
X分子与B2A分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性;请回答:(1)元素符号A B C D 。
元素推断题的解题思路与方法

元素推断题的解题思路与方法北京陈铁强一、推断题题型的特点化学推断题由于综合性强,突出对学生能力的考查,备受高考命题专家的推崇,是历年高考试题必考的一类题型。
这是将基本概念、基本理论、元素化合物知识、有机化学知识与化学实验及简单计算有机结合起来的综合性试题。
在高三复习中抓住推断题,不仅能进一步加深元素及其化合物的有关知识,还能培养分析推理、观察思维、获取信息及综合应用的能力。
二、元素推断题的常见类型元素推断题包括两种题型:一种为文字推断题,另一种为框图推断题。
“文字推断题”属高考必考题型,其考查的知识覆盖面广,综合性强,涉及物质结构、元素、化合物,甚至包括化学计算、化学实验等知识的综合考查,命题方式灵活、形式多样。
“框图推断题”作为一种高考的常见题型,主要特点是:结构紧凑、文字表述少、包含信息多、综合性强、思维能力要求高。
三、元素推断题的解题方法与基本思路解答此类题目的关键是抓住元素、化合物的特性,挖掘解题“题眼”,并以此为突破口解题。
此类试题常见的解题方法为“审→找→析(推)→验→答”五步。
即:(1)审:审清题意,题干→问题→框图,迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2)找:找“题眼”,即找到解题的突破口,此步非常关键。
(3)析(推):从“题眼”出发,联系新信息及所学知识,大胆猜测,应用正、逆向思维、发散收敛思维、横向纵向思维等多种思维方式,进行综合分析、推理,初步得出结论。
(4)验:验证确认,将结果放入原题检验,完全符合条件才算正确。
(5)答:按题目的要求写出答案。
近年化学高考中的元素推断题赏析例1. (2012年四川高考化学题)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:(1)B中所含元素位于周期表中第周期,族。
高考化学一轮复习精品课件:热点专题课 元素推断题的解题策略

解析:R 的单质是一种常见的半导体材料,R 应是硅元素,则 L 是碳元素,M 为氮元素,T 为硫元素,W 为氯元素。 (3)中 b 项, 通常元素的非金属性越强, 其对应单质的氧化性越强, 而该反应中碳所表现出的是还原性。
答案:(1) ⅦA ∶N⋮⋮N∶
(2)SiO2+2NaOH===Na2SiO3+H2O (3)acd 高温 (4)2Cl2+SiO2+2C=====SiCl4+2CO
金属性 L 强于 R c.W 的核电荷数比 T 多,原子半径比 T 小,得电子能力强, 则非金属性 W 强于 T d.同温、同物质的量浓度的 Na2LO3 和 Na2TO4 溶液的 pH: Na2LO3>Na2TO4,则非金属性 T 强于 L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备 RW4,该 反应中除 RW4 外的另一种产物可用于工业炼铁。制备 RW4 的化 学方程式为__________________________。
(1)规律: ①同一周期中元素的原子序数一般比左边元素原子序数大 1,比右边元素的原子序数小 1。
②同主族上下周期元素的原子序数关系
(2)应用举例:
①条件: 短周期元素 A、B、C 在元素周期表中的相对位 置如图所示。已知 B、C 两种元素所在族序数之和 是 A 元素所在族序数的 2 倍,B、C 两种元素的原 子序数之和是 A 元素的原子序数的 4 倍。
答案:C
3.(2013· 北京海淀期中)L、M、R、T、W 是原子序 数依次增大的短周期主族元素,M、T 在周期表 中的相对位置如右表;L 与 R 原子的最外层电子 数相同, R 的单质是一种常见的半导体材料。 请回答下列问题:
(1)T 原子的结构示意图为________,元素 W 在周期表中位于第 ________族,M 单质分子的电子式为________。
高考化学元素或物质推断类试题答题技巧

高考化学元素或物质推断类试题答题技巧1500字高考化学试题中的元素或物质推断类试题通常要求考生利用已有的化学知识和实验结果,通过观察、推理和判断等方法推断出未知物质或未知性质的物质。
这类试题需要考生具备扎实的化学理论知识和实际操作经验,并且具备良好的观察分析能力和推理判断能力。
以下是一些常见的答题技巧:1. 全面掌握化学元素和物质常见的性质和反应规律。
在面对未知物质时,首先应将其与已知的化学元素或物质进行对比,了解其可能的性质和反应规律。
例如,已知溴水可以与有机物反应生成溴代烷类,未知物质是一种无色液体,可以推断它可能是溴水。
2. 注意观察物质的物理性质和化学性质。
通过观察物质的颜色、形态、溶解性、燃烧性等物理性质,可以得到一些初步的推断。
例如,未知物质呈现为白色固体、不溶于水,可以推测其可能是一种无机盐类。
3. 利用化学反应进行鉴别。
通过与已知物质进行化学反应,可以进一步确定未知物质的性质。
例如,将未知固体与盐酸反应产生气体,并用氧气进行点燃,发生明亮的火焰和“喀喀”声,可以推断未知物质可能是一种金属。
4. 合理运用实验方法和技术。
在进行实验观察时,要注意控制变量,遵循实验原则,避免误操作和误判。
例如,在进行火焰试验时,要选择合适的实验器材和实验条件,确保实验的准确性和可靠性。
5. 注意化学知识的综合运用。
化学元素或物质推断类试题往往需要考生综合运用化学知识和实验结果进行推理和判断。
在解答这类试题时,要对已有的化学知识进行逐个分析和对比,并合理运用知识进行推断和判断。
6. 注意总结和归纳。
在解答完试题后,要对解题过程和结果进行总结和归纳,挖掘出解题中的关键信息和规律性内容,以便更好地掌握和应用化学知识。
总之,高考化学元素或物质推断类试题考察了考生对化学知识的掌握和应用能力,需要考生具备扎实的理论基础,熟悉常见的化学实验结果和反应规律,并能够运用观察分析、推理判断等方法进行推断和鉴别。
通过合理运用答题技巧,考生可以在考试中高效解答这类试题并取得好成绩。
第五章 学案29 元素推断题的思维捷径和解答技巧

学案29元素推断题的思维捷径和解答技巧元素推断题主要考查元素周期表中“位、构、性”的关系及学生利用物质结构和性质进行综合推断的能力。
该类题目综合性强,难度大,所占分值较高。
学生需要掌握短周期所有元素的结构特点、它们在元素周期表中的位置和性质以及掌握它们形成的化合物的性质,在此基础上综合分析,得到答案。
一、元素推断题的一般思路二、有关推断必备知识与题型分析题型一由主族元素在周期表中的位置推断解题指导 1.牢记元素周期表的结构(能区分长短周期、主副族、每周期的元素数目等)是求解的基础,一定要“心中有表”。
2.熟悉主族元素在周期表中的特殊位置(1)族序数等于周期数的元素:H、Be、Al。
(2)族序数等于周期数2倍的元素:C、S。
(3)族序数等于周期数3倍的元素:O。
(4)周期数是族序数2倍的元素:Li。
(5)周期数是族序数3倍的元素:Na。
(6)最高正价与最低负价代数和为零的短周期元素:C、Si。
(7)最高正价是最低负价绝对值3倍的短周期元素:S。
(8)除H外,原子半径最小的元素:F。
(9)最高正价不等于族序数的元素:O、F。
(10)第三周期原子半径最大的元素:Na。
典例导悟1(2010·青岛二模)短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是()A.A与C可形成共价化合物B.A的氢化物的稳定性大于C的氢化物的稳定性C.原子半径A<B<CD.B的氧化物的熔点比A的氧化物熔点高听课记录:变式演练1近年来我国政府强化了对稀土元素原料的出口管制,引起了美、日等国家的高度关注与不满。
所谓“稀土元素”是指镧系元素及第五周期ⅢB族的钇(39Y),它们被称为工业味精。
它们在军工生产、高科技领域中有极为重要的作用,下列有关“稀土元素”的说法正确的是()A.它们的原子核外均有5个电子层B.它们的原子最外层均含有3个电子C.它们均是金属元素D.76Y、80Y中子数不同,化学性质不同题型二由元素及其化合物的性质推断解题指导掌握常见元素及其化合物的特性是关键,解决这一关键的关键在于平时的积累。
高考化学元素化合物推断题的一般策略与方法

高考化学元素化合物推断题的一般策略与方法元素化合物推断题是一类综合性很强的试题,其中不仅包含元素及化合物性质和社会生活、环境保护、化学计算等知识,有时还可引入学科间综合。
它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。
下面就对推断题的一般题眼及其解题技巧与方法进行分析和讨论。
一、解推断题的一般思维策略1.立足基础:框图题重点考察元素及化合物的基础知识,立足于中学阶段常见物质与反应,故要熟练掌握一些代表性物质的基本性质:如色、态、味、化学性质等。
夯实基础是求解推断题的前提。
及时的进行一些总结和记忆是非常有必要的。
⑪焰色反应:Na+(黄色)、K+(紫色)⑫浅黄色固体:S或Na2O2或AgBr⑬使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)⑭有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3]蓝色[Cu(OH)2]、黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)黄色(AgI、Ag3PO4)、白色[Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3]有色气体:Cl2(黄绿色)、NO2与溴蒸气(红棕色)⑮特征反应现象:2.抓住特性:很多物质表现出特殊的物理或化学性质,具有一些特征反应,或在反应中能产生特殊现象,以硫元素及其化合物为例:S为淡黄色固体,H2S与O2、X2、Fe3+、SO2反应可产生淡黄色单质硫;SO2可被Fe3+、X2氧化,也可使品红溶液褪色,这些特殊信息有助于确定题目的突破口。
又如:A—若A为化合物,则A必为无氧弱酸的铵盐或不稳定弱酸的铵盐:(NH4)2S或NH4HS;(NH4)2CO3或NH4HCO3;(NH4)2SO3或NH4HSO3。
若A为单质则为铝。
受热分解产生2种或3种气体的反应:(1)铵盐(2)硝酸盐与水反应产生气体(1)单质(2)化合物强烈相互促进水解的物质:3.利用转化:无机物之间有一些重要的衍变关系,在物质之间按照一定规律反应时,会形成一定的特征的转化关系。
高二化学元素推断题解题策略

高二化学元素推断题解题策略一道题目的情境、立意、设问之间存在着必定的内在联系,而通过有效审题去挖掘这些联系是形成正确的解题思路的前提,因此我们审题时应注意规范。
下面我给大家共享一些(高二化学)元素推断题解题策略,盼望能够关心大家,欢迎阅读!高二化学元素推断题解题策略元素或物质推断类试题该类题主要以元素周期律、元素周期表学问或物质之间的转化关系为命题点,采纳供应周期表、文字描述元素性质或框图转化的形式来呈现题干,然后设计一系列书写化学用语、离子半径大小比较、金属性或非金属性强弱推断、溶液中离子浓度大小推断及相关简洁计算等问题。
此类推断题的完整形式是:推断元素或物质、写用语、判性质。
化学元素推断题大题解题策略元素推断题,一般可先在草稿纸上画出只含短周期元素的周期表,然后对比此表进行推断。
(1)对有突破口的元素推断题,可利用题目示意的突破口,联系其他条件,顺藤摸瓜,各个击破,推出结论;(2)对无明显突破口的元素推断题,可利用题示条件的限定,渐渐缩小推求范围,并充分考虑各元素的相互关系予以推断;(3)有时限定条件不足,则可进行争论,得出合理结论,有时答案不止一组,只要能合理解释都可以。
若题目只要求一组结论,则选择自己最熟识、最有把握的。
有时需要运用直觉,大胆尝试、假设,再依据题给条件进行验证也可。
化学元素推断题的一般思路化学元素推断题解题的一般思路和(方法):读图审题→找准突破口→规律推理→检验验证→规范答题。
解答的关键是快速找到突破口,一般从物质特别的颜色、特别性质或结构、特别反应、特别转化关系、特别反应条件等角度思索。
突破口不易查找时,也可从常见的物质中进行大胆猜想,然后代入验证即可,尽量避开从不太熟识的物质或教材上没有消失过的物质角度考虑,盲目验证。
高二学习化学的五大要点学习化学的五大要点——读课前必需预习,才能把握学习的主动权,要带着问题去听课。
首先粗读教材,把握教材的整体,然后找出重点、难点和疑点,理出头绪,想一想这一节的主要内容是什么,对疑难问题怎样理解,为什么要这样理解,从另一个角度理解行不行?如高一学习氧化还原反应概念,考虑为什么在不同阶段对这个概念有不同的提法,以便抓住本质,用电子转移的观点熟悉氧化还原反应,进一步认清氧化剂、还原剂在化学反应中的作用和关系。
元素推断题的解题思路
元素推断题的解题思路元素推断是每年必考的题型,根据原子结构、元素周期表的知识及相关已知条件,可推算原子序数,判断元素在周期表中的位置等,一、基本思路:如下图二、突破口:1、稀有气体元素原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
①与He原子电子层结构相同的离子有:H-、Li+、Be2+②与Ne原子电子层结构相同的离子有:F-、O2-、Na+、Mg2+、Al3+③与Ar原子电子层结构相同的离子有:Cl-、S2-、K+、Ca2+2、周期表中特殊位置的元素①族序数等于周期数的元素:H、Be、Al、Ge②族序数等于周期数2倍的元素:C、S③族序数等于周期数3倍的元素:O④周期数等于族序数2倍的元素:Li、Ca⑤周期数等于族序数3倍的元素:Na、Ba⑥最高价与最低负价代数和为零的短周期元素:C⑦最高正价是最低负价绝对值3倍的短周期元素:S⑧除H外,原子半径最小的元素:F⑨短周期中离子半径最大的元素:P3、常见元素及其化合物的特性①形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物钟情的质量分数最高的元素:C②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N③地壳中含量最多的元素或氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O④非金属单质最轻的元素:H;金属单质最轻的元素:Li⑤单质在常温下呈液态的非金属元素:Br;金属元素:Hg⑥最高价氧化物及其水化物既能与强酸反应又能与强碱反应的元素:Be、Al⑦元素的气态氢化物和它的最高价氧化物的水化物能起化合反应的元素:N;能起氧化还原反应的元素:S⑧元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F⑨短周期元素能形成A2B、A2B2型化合物的元素H、O或Na、O⑩短周期元素中两种元素的原子序数和是另两种元素的原子序数和的2倍的元素是:H、Na、O、S。
高考化学一轮复习微专题四元素推断题解题策略(含解析)

微专题四元素推断题解题策略一、位——构——性综合推断解题策略1.结构与位置互推是解题的核心(1)掌握四个关系式:①电子层数=周期数;②质子数=原子序数;③最外层电子数=主族序数;④主族元素的最高正价=主族序数(O、F除外),最低负价=主族序数-8。
(2)熟练掌握周期表的结构及周期表中的一些特殊规律:①“凹”型结构的“三短四长,七主七副八零完”;②各周期元素种类数;③稀有气体的原子序数及在周期表中的位置;④同主族上下相邻元素原子序数的关系。
2.性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:(1)元素的金属性、非金属性;(2)气态氢化物的稳定性;(3)最高价氧化物对应水化物的酸碱性;(4)金属与水或酸反应置换H2的难易程度。
3.结构和性质的互推是解题的要素(1)电子层数和最外层电子数决定元素原子的金属性和非金属性;(2)同主族元素最外层电子数相同,化学性质相似;(3)正确推断原子半径和离子半径的大小及结构特点;(4)判断元素金属性和非金属性的强弱。
二、常见元素推断1~20号元素的特殊的电子层结构(1)最外层有1个电子的元素:H、Li、Na、K;(2)最外层电子数等于次外层电子数的元素:Be、Ar;(3)最外层电子数是次外层电子数2倍的元素:C;(4)最外层电子数是次外层电子数3倍的元素:O;(5)最外层电子数是内层电子数总数一半的元素:Li、P;(6)最外层电子数是次外层电子数4倍的元素:Ne;(7)次外层电子数是最外层电子数2倍的元素:Li、Si;(8)次外层电子数是其他各层电子总数2倍的元素:Li、Mg;(9)次外层电子数与其他各层电子总数相等的元素S;(10)电子层数与最外层电子数相等的元素:H、Be、Al。
【典例剖析】1.元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+、Z-具有相同的核外电子层结构。
下列推测不正确的是( )A.同族元素中Z的氢化物稳定性最高B.同周期元素中X的金属性最强C.原子半径X>Y,离子半径X+>Z-D.同周期元素中Y的最高价含氧酸的酸性最强【答案】C【解析】元素X、Y、Z原子序数之和为37,说明它们是短周期元素,X+、Z-具有相同的核外电子层结构,则X、Z分别是Na和F,则Y的原子序数应为37-11-9=17,为氯元素。
元素推断题做题技巧

元素推断题做题技巧一、《元素推断题做题技巧,让你不再迷茫》同学们,咱们在化学学习中,经常会碰到元素推断题。
这可难倒了不少小伙伴,但别担心,今天我就来给大家分享一些超有用的做题技巧。
比如说,有一道题给了你一些元素的性质描述,像“某元素的单质是淡黄色固体”,这时候你就要想到硫元素啦,因为硫单质就是淡黄色的嘛。
再比如,题目说“某元素的最高价氧化物对应的水化物能和强酸、强碱都反应”,那这很可能是铝元素,因为氢氧化铝既能和盐酸反应,又能和氢氧化钠溶液反应。
还有哦,如果告诉你“某元素的原子最外层电子数是次外层电子数的两倍”,那这个元素就是碳元素啦。
所以呀,做元素推断题的时候,要多积累常见元素的特征性质,多回忆学过的知识,这样就能轻松搞定啦!二、《元素推断题做题技巧,轻松拿高分》嘿,朋友们!元素推断题是不是让你有时候感到头疼?别愁,我来给你支招。
咱们先来看一个例子。
题目说“有一种元素,它的气态氢化物的水溶液呈碱性”,这时候你就得想到氮元素,因为氨气的水溶液氨水是呈碱性的。
还有一种情况,如果说“某元素的原子核外有三个电子层,最外层电子数比次外层电子数少1”,那这肯定是氯元素。
另外呀,要注意一些特殊的规律。
比如,同周期从左到右金属性逐渐减弱,非金属性逐渐增强。
掌握了这些小技巧,元素推断题就不再是难题,高分轻松到手!三、《元素推断题做题技巧,一学就会》小伙伴们,元素推断题其实没那么可怕,学会这些技巧,你就能轻松应对。
比如说,题目提到“某元素的单质在常温下是黄绿色气体”,那想都不用想,肯定是氯元素。
这就要求咱们对常见元素单质的颜色和状态要熟悉。
再比如,“某元素的最高价氧化物对应的水化物是一种强酸,且该元素原子的质子数小于18”,那很可能是氮元素或者硫元素。
还有哦,如果告诉你“某元素的原子序数是11”,那你马上就能知道是钠元素。
多做几道题练练手,你会发现元素推断题真的很简单!四、《元素推断题做题技巧,让化学变得有趣》亲爱的同学们,化学中的元素推断题是不是让你觉得有点枯燥?其实掌握了技巧,它也可以很有趣哦!举个例子,“有一种元素,它的常见化合价有 +2 价和 +3 价,且 +2 价的化合物在空气中容易被氧化”,这说的就是铁元素。
元素推断题的解题策略

元素推断题的解题策略一、元素在周期表中的位置推断1.根据核外电子的排布规律(1)最外层电子规律某元素阴离子最外层电子数与次外层电子数相同,该元素位于第三周期。
若为阳离子,则位于第四周期。
(3)“阴上阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
2.根据元素周期表结构与原子电子层结构的关系(1)几个重要关系式①核外电子层数=周期数(对于大部分元素来说);②主族序数=最外层电子数=最高正价=8-|最低负价|(O 、F 除外);③|最高正价|-|最低负价|=⎩⎪⎨⎪⎧ 0——第ⅠA族中的H 和第ⅣA族2——第ⅤA族4——第ⅥA族6——第ⅦA族(2)熟悉主族元素在周期表中的特殊位置①族序数等于周期数的元素:H 、Be 、Al 。
②族序数等于周期数2倍的元素:C 、S 。
③族序数等于周期数3倍的元素:O 。
④周期数是族序数2倍的元素:Li 、Ca 。
⑤周期数是族序数3倍的元素:Na 、Ba 。
⑥最高正价与最低负价代数和为零的短周期元素:H 、C 、Si 。
⑦最高正价是最低负价绝对值3倍的短周期元素:S 。
⑧除H 外,原子半径最小的元素:F 。
二、由元素及其化合物的性质推断1.形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C 。
2.空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N 。
3.地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O 。
4.等物质的量的单质最轻的元素:H ;最轻的金属单质:Li 。
5.单质在常温下呈液态的非金属元素:Br ;金属元素:Hg 。
6.最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al 。
7.元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素:N ;能起氧化还原反应的元素:S 。
8.元素的单质在常温下能与水反应放出气体的短周期元素:Li 、Na 、F 。
元素推断题解题方法

元素推断题解题方法一、元素在周期表中的位置推断1.根据核外电子的排布规律(1)最外层电子规律最外层电子数(N) 3≤N<8N=1或2N>次外层电子数元素在周期表中的位置主族第ⅠA族、第ⅡA族、第Ⅷ族、副族、0族元素氦第二周期(Li、Be除外)(2)“阴三阳四”规律某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。
若为阳离子,则位于第四周期。
(3)“阴上阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律。
[例1]已知X、Y、Z为三种主族元素,可分别形成X n+、Y m+、Z n-三种离子,已知m>n且X、Y、Z三种原子的M层电子数均为奇数。
下列说法中不正确的是()A.三种离子中,Y m+的离子半径最小B.Z的最高价氧化物对应水化物的分子式为H n ZO4C.X、Y、Z一定在同一周期,且原子半径Z>X>Y D.三种元素相应的最高价氧化物对应水化物之间两两会发生反应解析根据题中X、Y、Z之间的相互关系,可以推断出X、Y、Z分别为Na、Al、Cl元素。
Na+、Al3+、Cl-三种离子中Al3+的离子半径最小,A项正确;Cl的最高价氧化物对应水化物的分子式为HClO4,B项正确;Na、Al、Cl元素同处于第三周期,其原子半径为Na>Al>Cl,即X>Y>Z,C项错误;氢氧化铝为两性氢氧化物,D项正确。
答案 C2.根据元素周期表结构与原子电子层结构的关系(1)几个重要关系式①核外电子层数=周期数(对于大部分元素来说);②主族序数=最外层电子数=最高正价=8-|最低负价|③|最高正价|-|最低负价|=⎩⎪⎨⎪⎧ 0——第ⅠA 族中的H 和第ⅣA 族2——第ⅤA 族4——第ⅥA 族6——第ⅦA 族(2)熟悉主族元素在周期表中的特殊位置 ①族序数等于周期数的元素:H 、Be 、Al 。
化学元素推断题技巧

化学元素推断题技巧
化学元素推断题是化学中比较基础但也比较重要的题型之一。
在化学课堂中,老师经常会出现关于元素化合物的推断题,为了解决这类问题,需要掌握一些技巧。
1. 掌握化学元素的基本特征
在推断元素化合物的时候,首先需要了解元素的基本特征,例如金属元素具有良好的导电、导热性和延展性等特征,非金属元素则相反。
此外,不同元素的化合物也具有不同的化学性质,例如氢氧化钠和氢氧化铜等化合物的颜色、溶解度都不同,这些特征可以作为推断元素的重要依据。
2. 掌握元素周期表的结构
元素周期表是化学元素组织的一种形式,其中元素按照一定规律排列。
了解周期表的结构和规律可以帮助推断元素的化学性质。
例如,周期表中同一周期的元素具有相同的电子排布,因此它们的化学性质也相似。
而同一族元素的化学性质则有很大的相似性。
3. 学会观察实验现象
化学实验中的现象可以提供宝贵的信息。
观察化合物的物理性质,例如颜色、溶解度、密度等,可以推断其中可能包含的元素。
同时,观察化合物在化学反应中的表现,例如与酸反应产生气体等现象,也可以作为推断元素的依据。
4. 利用化学方程式求解
化学方程式是描述化学反应的一种表达方式。
化学方程式可以帮助我们推断化合物中包含的元素。
例如,若一个化合物与氧气反应生成二氧化碳和水,那么这个化合物很可能包含碳、氧和氢等元素。
综上所述,掌握化学元素的基本特征、元素周期表的规律、观察实验现象和利用化学方程式可以帮助我们有效地推断元素化合物。
在日常学习和实验中多加练习,相信大家能够掌握这一技能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
隐藏的答案
公共汽车现在是要驶往A车站, 还是驶往B车站?
-sghgz-
—2—
想一想
【 例题 】X、Y、Z、W是原子序数依次增大的短周期元素, 且互 例题1】 、 、 、 是原子序数依次增大的短周期元素 是原子序数依次增大的短周期元素,
不同族;其中只有两种为金属; X原子的最外层电子数与次外层电子 不同族 其中只有两种为金属; 原子的最外层电子数与次外层电子 其中只有两种为金属 数相等; 与 、 与 这两对原子的最外层电子数之和均为 这两对原子的最外层电子数之和均为9。 数相等;X与W、Y与Z这两对原子的最外层电子数之和均为 。单质 Y和W都可与浓的 都可与浓的NaOH溶液反应。 溶液反应。 和 都可与浓的 溶液反应 请回答下列问题: 请回答下列问题: < < (1)Y、Z、W的原子半径由小到大的顺序是 Cl<S<Al 的原子半径由小到大的顺序是____________ (用元素符 、 、 的原子半径由小到大的顺序是 用元素符 号表示) 号表示) 。 (2)ZW2 的电子式是 的电子式是______________,它在常温下呈液态, 形成晶体时 , 它在常温下呈液态, 它在常温下呈液态 形成晶体时, 属于_________晶体。 晶体。 属于 晶体 分子 (3)工业生产单质 的原理是 工业生产单质Y的原理是 工业生产单质 的原理是_____________________________(用化学 用化学 方程式表示)。 方程式表示 。 (4)X与Y化学性质相似,则X与浓的 化学性质相似, 与浓的NaOH溶液反应的化学方程式是 与 化学性质相似 与浓的 溶液反应的化学方程式是 __________________________________ 。
②规范性
化学用语必须准确无误。 化学用语必须准确无误。 一个问题往往有几个要点, 一个问题往往有几个要点, 要全面考虑,谨防遗漏。 要全面考虑,谨防遗漏。
③完整性
“物质推断,回头一看” 物质推断,回头一看”
——解完全题后应仔细核对题中各条信息, ——解完全题后应仔细核对题中各条信息,必须做到所得结果与 解完全题后应仔细核对题中各条信息 所有信息相符,只要有一条不符,就得推倒重来。 所有信息相符,只要有一条不符,就得推倒重来。
-sghgz—8—
做一做
【例题 】已知周期表中,元素 、R、W、Y与元素 相邻。Y的最 例题2】已知周期表中,元素Q、 、 、 与元素 相邻。 的最 与元素X相邻
高化合价氧化物的水化物是强酸。回答下列问题: 高化合价氧化物的水化物是强酸。回答下列问题: 可以形成一种高温结构陶瓷材料。 的氯化物分子呈正四 (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四 ) 与 可以形成一种高温结构陶瓷材料 面体结构, 的氧化物的晶体类型是 面体结构,W的氧化物的晶体类型是 原子晶体 ; (2)Q的具有相同化合价且可以相互转变的氧化物是 NO2和N2O4 ; ) 的具有相同化合价且可以相互转变的氧化物是 形成的二元化合物中, 呈现最高化合价的化合物的化学 (3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学 ) 和 形成的二元化合物中 式是 As2S5 ; 个元素的氢化物分子中, (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸 ) 个元素的氢化物分子中 点从高到低排列次序是(填化学式) 点从高到低排列次序是(填化学式) NH3> AsH3 > PH3 ,其原因是 因为NH3中含有氢键 沸点最高;AsH3 的相对分子质量大于 3 , ; 中含有氢键, 沸点最高; 的相对分子质量大于PH 因为 AsH3的分子间作用力较强,沸点高于 3 的分子间作用力较强,沸点高于PH ②电子总数相同的氢化物的化学式和立体结构分别是 SiH4、PH3和H2S,结构分别为正四面体,三角锥和 形 ; ,结构分别为正四面体,三角锥和V形 所形成的结构陶瓷材料的一种合成方法如下: 的氯化物 (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物 ) 和 所形成的结构陶瓷材料的一种合成方法如下 的氢化物加热反应, 气体; 与Q的氢化物加热反应,生成化合物 的氢化物加热反应 生成化合物W(QH2)4和HCl气体;W(QH2)4在 气体 高温下分解生成Q的氢化物和该陶瓷材料 的氢化物和该陶瓷材料。 高温下分解生成 的氢化物和该陶瓷材料。上述相关反应的化学方程 各物质用化学式表示) 式(各物质用化学式表示)是 SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4 , 。
类比
-sghgz-
—4—
想一想
【 例题 】X、Y、Z、W是原子序数依次增大的短周期元素, 且互 例题1】 、 、 、 是原子序数依次增大的短周期元素 是原子序数依次增大的短周期元素,
不同族;其中只有两种为金属; X原子的最外层电子数与次外层电子 不同族 其中只有两种为金属; 原子的最外层电子数与次外层电子 其中只有两种为金属 数相等; 与 、 与 这两对原子的最外层电子数之和均为 这两对原子的最外层电子数之和均为9。 数相等;X与W、Y与Z这两对原子的最外层电子数之和均为 。单质 Y和W都可与浓的 都可与浓的NaOH溶液反应。 溶液反应。 和 都可与浓的 溶液反应 请回答下列问题: 请回答下列问题: < < (1)Y、Z、W的原子半径由小到大的顺序是 Cl<S<Al 的原子半径由小到大的顺序是____________ (用元素符 、 、 的原子半径由小到大的顺序是 用元素符 号表示) 号表示) 。 (2)ZW2 的电子式是 的电子式是______________,它在常温下呈液态, 形成晶体时 , 它在常温下呈液态, 它在常温下呈液态 形成晶体时, 属于_________晶体。 晶体。 属于 晶体 分子 (3)工业生产单质 的原理是 工业生产单质Y的原理是 工业生产单质 的原理是_____________________________(用化学 用化学 方程式表示)。 方程式表示 。 (4)X与Y化学性质相似,则X与浓的 化学性质相似, 与浓的NaOH溶液反应的化学方程式是 与 化学性质相似 与浓的 溶液反应的化学方程式是 __________________________________ 。
-sghgz—3—
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
实质为: 实质为: 2Al+6H2O=2Al(OH)3+3H2↑ + = Al(OH) NaOH= NaAlO 4H = + 2Al(OH)3+2NaOH=2NaAlO2+2H2O 2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O + + = + Be + 2H2O =Be(OH)2+H2↑ + Be(OH)2 +2NaOH =Na2BeO2+2H2O Be+2NaOH =Na2BeO2+H2↑ +
-sghgz—10—
元素推断题的解题思路
认真审题 找突破口 推断验证 规范答题
做记号
题干与问题相结合
细节决定成败
-sghgz-
—11—
-sghgz-
—9—
练一练
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金 、 、 、 是原子序数依次增大的同一短同期元素 是原子序数依次增大的同一短同期元素, 、 是金 属元素, 、 是非金属元素 是非金属元素。 属元素,Y、Z是非金属元素。 (1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该 、 各自的最高价氧化物对应的水化物可以反应生盐和水 各自的最高价氧化物对应的水化物可以反应生盐和水, 反应的离子方程式为____________________________。 反应的离子方程式为 Al(OH)3+OH-=AlO2-+2H2O 。 (2)W与Y 可形成化合物 2Y,该化合物的电子式为 与 可形成化合物W ,该化合物的电子式为_____________。 。 (3)X的硝酸盐水溶液显 酸 性,用离子方程式解释原因 的硝酸盐水溶液显______性 的硝酸盐水溶液显 ___________________________________________。 。 Al3++3H2O Al(OH)3+3H+ (4)Y的低价氧化物通入 单质的水溶液中,发生反应的化学方程式为 的低价氧化物通入Z单质的水溶液中 的低价氧化物通入 单质的水溶液中, SO2+Cl2+2H2O=H2SO4+ 2HCl = ___________________________________。 。 。 (5)比较 、Z气态氢化物的稳定性 HCl>_______(用分子式表示) 比较Y、 气态氢化物的稳定性 气态氢化物的稳定性_____> H2S。 (用分子式表示) 比较 (6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: 四种元素简单离子的离子半径由大到小的顺序是: 、 、 、 四种元素简单离子的离子半径由大到小的顺序是 S 2- > Cl - > Na + >______。 _____>_____>______>Al3+ 。 (7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得 的最高价氧化物为无色液体, 的最高价氧化物为无色液体 该物质与一定量水混合得 到一种稀溶液,并放出Q 的热量 写出该反应的热化学方程式: 的热量。 到一种稀溶液,并放出 kJ的热量。写出该反应的热化学方程式:_ -1。 __________________________________________________。 Cl2O7(l)+H2O(l)= )=2HClO4(aq);△H=-4Q kJ mol。 ) ( )= ; =
-sghgz—5—
一.元素推断题的解题思路
认真审题 找突破口 推断验证 规范答题
做记号
题干与问题相结合
细节决定成败
-sghgz-
