从小麦叶片中提取过氧化氢酶
POD 测定方法

植物体POD的测定※<原理>了解过氧化氢酶活性测定的几种方法,掌握用愈创木酚法分别测定过氧化氢酶和过氧化物酶的活性。
过氧化物酶广泛颁布于植物的各个组织器官中。
在有过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。
※<实验材料、试剂与仪器设备>1、实验仪器722型分光光度计、离心机、秒表、电子天平、研钵2、实验试剂愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L磷酸缓冲液(pH6.0)、反应混合液[100mmol/L磷酸缓冲液(pH6.0)50mL,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液冷却后,加入30%过氧化氢19uL,混合均匀保存于冰箱中]3、实验材料任何植物材料※<实验步骤>1、粗酶液的提取称取植物(小麦叶片)材料0.1g,加20mmol/LKH2PO4 5mL,于研钵中研磨成匀浆,以10000r/min离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO45mL溶液提取一次,全并两次上清液。
2、酶活性的测定取比色皿2只,于一只中加入反应混合液3mL,KH2PO41mL,作为校零对照,另一只中加入反应混合液3mL,上述酶液1mL(如酶活性过高可适当稀释),立即开启秒表,于分光光度计470nm波长下测量OD值,每隔30s读数一次。
以每分钟表示酶活性大小,即以△OD470/min.mg蛋白质表示,蛋白质含量测定按Folin法进行。
※<结果计算>以每分钟吸光度变化值表示酶活性大小,即以ΔA470/[min.g(鲜重)]表示之。
也可以用每min 内A470变化0.01为1个过氧化物酶活性单位(u)表示。
过氧化物酶活性[u/(g.min)]=式中:ΔA470——反应时间内吸光度的变化。
W——植物鲜重,g。
VT ——提取酶液总体积,mL。
Vs ——测定时取用酶液体积,mL。
生物药物分析实验课讲义

实验胃蛋白酶片的测定实验目的:掌握以胃蛋白酶测定法测定胃蛋白酶片中胃蛋白酶的效价。
实验原理:精密称取本品适量,加盐酸溶液制成每1mL中约含0.2-0.4个单位的溶液,照胃蛋白酶测定法,测定胃蛋白酶的效价。
实验部分:1.材料与设备血红蛋白试液、三氟醋酸溶液、盐酸溶液紫外可见分光光度计2.操作步骤1). 供试品溶液的制备取本品5片,置研钵中,加盐酸溶液少许,研磨均匀,移至250mL量瓶中,加上述盐酸溶液稀释至刻度,摇匀,精密称取适量,用上述盐酸溶液稀释制成每1mL中约含0.2-0.4个单位的溶液,作为供试品溶液。
2). 对照品溶液的制备精密称取酪氨酸对照品适量,加盐酸溶液稀释制成每1mL中约含0.5mg的溶液,作为对照品溶液。
3)供试品的测定取大小相同的试管6支,其中3支精密加入对照品溶液1mL,另3支精密加入供试品溶液1mL,置37℃±0.5℃水浴中,保温5分钟,精密加入预热至37℃±0.5℃的血红蛋白试液5mL,摇匀,并准确计时,在37℃±0.5℃水浴中反应10分钟,立即精密加入5%三氟醋酸溶液5mL,摇匀,滤过,取续滤液备用。
另取试管2支,各精密加入血红蛋白试液5mL,置37℃±0.5℃水浴中保温10分钟,再精密加入5%三氟醋酸溶液5mL,其中一支加供试品溶液1mL,另一支加上述盐酸溶液1mL,摇匀,滤过,取续滤液,分别作为供试品和对照品的空白对照,照紫外-可见分光光度法,在275nm的波长处测定吸光度,按下列公式计算,即得。
注意事项:思考题:实验三磷酸腺苷二钠片总核苷酸含量测定实验目的:掌握以胃蛋白酶测定法测定胃蛋白酶片中胃蛋白酶的效价。
实验原理:精密称取本品适量,加盐酸溶液制成每1mL中约含0.2-0.4个单位的溶液,照胃蛋白酶测定法,测定胃蛋白酶的效价。
实验部分:1.材料与设备血红蛋白试液、三氟醋酸溶液、盐酸溶液紫外可见分光光度计2.操作步骤1). 供试品溶液的制备取本品5片,置研钵中,加盐酸溶液少许,研磨均匀,移至250mL量瓶中,加上述盐酸溶液稀释至刻度,摇匀,精密称取适量,用上述盐酸溶液稀释制成每1mL中约含0.2-0.4个单位的溶液,作为供试品溶液。
H2O2对Pb胁迫下小麦幼苗抗氧化酶及细胞活性的影响

H2O2对Pb胁迫下小麦幼苗抗氧化酶及细胞活性的影响摘要:以小麦(triticum aestivum l.)为试验材料,采用完全营养液进行培养,外加适当浓度的过氧化氢(h2o2),同时以不加h2o2为对照,再以不同浓度pb溶液培养进行pb胁迫,检测小麦幼苗过氧化物酶(pod)、超氧化物歧化酶(sod)、过氧化氢酶(cat)的活性及丙二醛(mda)含量、根系活力及微核率等指标的变化,以探究外源h2o2对pb胁迫下小麦抗氧化酶及其细胞活性的影响。
结果表明,pb胁迫下小麦幼苗的生长代谢受到一定程度的抑制,主要表现为根系活力下降,pod、sod、cat活性增强,mda含量和微核率上升;经适当浓度h2o2处理后,pb胁迫小麦幼苗中pod、sod、cat活性及根系活力与对照相比有不同程度地上升,mda含量及微核率下降,这表明外加h2o2对pb胁迫小麦所受的伤害有一定的缓解作用,可增强小麦幼苗对重金属pb的抗性。
关键词:小麦(triticum aestivum l.);h2o2;pb胁迫;抗氧化酶;根系活力;微核率中图分类号:q945.78;s512.1 文献标识码: a 文章编号:0439-8114(2013)05-1007-05effect of hydrogen peroxide on antioxidant enzymes and cell activity of wheat seedlings under lead stressye ya-xin,lu dan-hua(school of chemistry and bioengineering, suzhou science & technology college, suzhou 215009,jiangsu, china)abstract: to explore the effect of exogenous h2o2 on antioxidant enzymes and other physiological indexes of wheat seedlings under lead stress, wheat seedlings cultivated in solution with different concentration of h2o2 were used to observe the variation of activity of peroxidase (pod),superoxide dismutase (sod), catalase (cat) and content of malondialdehyde (mda), root activity and micronucleus rate. the results showed that wheat seedlings were chronically harmed under heavy metal stress, as vigor of wheat seedling root decreased; pod, sod, cat activity and mda content, micronucleus rate increased. after being treated by h2o2 with appropriate concentration, pod, sod,cat activity, root vigor increased while mda content and micronucleus rate decreased in wheat seedlings under lead stress compared to control, indicating that exogenous h2o2 could reduce the damage caused by lead stress.key words: wheat(triticum aestivum l.); h2o2; lead stress; antioxidant enzymes; root activity; micronucleus rate目前,在令人担忧的环境问题中,cd、pb等重金属污染因对植被造成强烈冲击以及沿食物链的富集作用而倍受关注。
萌发的小麦种子提取酶液的原因

萌发的小麦种子提取酶液的原因
小麦种子是极其重要的园艺作物,它可以提供食物和经济收入。
研究表明,为了提高小麦种子的产量和质量,提取小麦种子中的酶液是非常有效的。
了解萌发的小麦种子提取酶液的原因,有助于改善其产量和质量。
第一,小麦种子在发芽过程中会分泌出酶。
小麦种子发芽前,存在低活性的植物酶,它们仅限于种子萌发的简单代谢过程,但当水分进入种子体时,这些酶开始分泌出来,活化种子,促进种子的生长发芽。
提取这些活性的酶,可以从种子中分离出来,可用于食品加工,也可以用于生物技术。
第二,小麦种子中的植物酶具有优良的功能,可以被应用在各个领域。
植物酶具有耐酸性、耐酒精性、耐温性、耐光性、耐氧性,它们也是很强的乳化剂和促进溶剂:们可以解离细胞壁,把被困的细胞护壁的物质溶解出来从而得到极为纯净的内液,可应用在日常生活中和实验室研究。
第三,提取酶液可以改善小麦种子的产量和质量。
小麦种子中含有很多有利于生长和抗性的物质,如蛋白质、碳水化合物、维生素、植物激素、氨基酸和无机盐等,它们都是种子发芽过程中必不可少的材料。
提取酶液,可以破坏种子表面的釉质层,提取出小麦种子中一部分植物物质。
这些物质可以添加到种子的包装材料中,可以提高种子的生长率和抗病性,以提高小麦种子的产量和质量。
综上所述,萌发的小麦种子提取酶液的原因可以归结为三点,即
小麦种子发芽前,存在低活性的植物酶;植物酶具有优良的功能;提取酶液可以改善小麦种子的产量和质量。
本文认为,了解萌发的小麦种子提取酶液的原因,有助于改善其产量和质量。
【课外阅读】探究蔬菜叶子中过氧化氢酶的催化效率

探究蔬菜叶子中过氧化氢酶的催化效率1、实验原理:蔬菜叶子中存在过氧化氢酶。
H 2O
2
过氧化氢酶 H
2
O+O
2
2、实验方法:观察法、对比法
3、实验目的:
了解蔬菜中过氧化氢酶的含量,激发对科学研究的兴趣。
4、实验方法和步骤
材料用具:新鲜干净的小白菜、菠菜、苦马菜、香菜、茼蒿菜五种蔬菜的叶子,小刀,研磨,五支试管,过氧化氢溶液,切菜板,器皿,胶头滴管,卫生香,火柴。
方法步骤:
(1)、取五支洁净试管,编上号。
在每支试管内滴2毫升过氧化氢溶液,放在试管架上。
(2)、把准备好的五种菜叶放在切菜板上切碎,然后放入研磨里捣碎,捣碎出汁后把它们分别移入每个器皿内(编上号)。
(3)、相同质量的各种菜质对号放入每支试管,轻轻振荡,用手指捂住试管口。
(4)、过一分钟后,把带火星的卫生香伸入试管,观察是否复燃。
5、观察后并填写记录表:
试管号
过氧化氢溶液
蔬菜
实验现象
1号
2毫升
小白菜
有气泡冒出,白沫逐渐声高,卫生香复燃
2号
2毫升
菠菜
有一些气泡冒出,白沫上升一截,火星明不复燃
3号
2毫升
苦马菜
有许多气泡冒出,白沫逐渐升高,卫生香复燃明亮
4号
2毫升
香菜
有少量气泡冒出,白沫很少,火星变化不明显
5号
2毫升
茼蒿菜
气泡产生比香菜多,卫生香火星更明亮,不复燃
6、结论
试验让我们了解到:不同种类的蔬菜中,过氧化氢酶的含量各不相同,催化效率差异很大,其中有五种蔬菜对过氧化氢酶的催化效率由高到低,依次是苦马菜,小白菜,茼蒿菜,菠菜,香菜。
测量酶方法

氮蓝四唑(NBT)法测定超氧物歧化酶(SOD)活力一、原理超氧物歧化酶(superoxidedismutase , SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生02,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除02,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
二、材料、仪器设备及试剂(一)材料;水稻或小麦叶片(二)仪器设备: 1.高速台式离心机; 2.分光光度计; 3.微量进样器; 4.荧光灯(反应试管处照度为4000Lx); 5.试管或指形管数支。
(三)试剂:1. 0.05mol/L 磷酸缓冲液(pH7.8);2. 130mmol/L 甲硫氨酸(Met )溶液:称1.9399gMet 用磷酸缓冲液定容至100ml(现用现配);3.750卩mol/L氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,(避光保存);4. 100卩mol/L EDTA- Na2溶液:称取0.03721gEDTA— Na2用磷酸缓冲液定容至1000ml ;5. 20卩mol/L核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml(避光保存)。
三、实验步骤1. 酶液提取取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml。
取1.5〜2ml于1000rpm下离心20min,上清液即为SOD粗提液。
2. 显色反应取5ml指形管(要求透明度好)4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂(酶)用量(ml)终浓度(比色时)0.05mol/L磷酸缓冲液 1.5130mmol/L Met溶液0.313mmol/L 750 卩mol/L NBT 溶液0.375 卩mol/L 100 卩mol/L EDTA—Na2 液0.310 卩mol/L 20 卩mol/L核黄素0.320卩mol/L酶液0.052支对照管以缓冲液代替酶液蒸馏水0.25总体积3.0 混匀后将1支对照管置暗处,其它各管于4000LX日光下反应20min (要求各管受光情况一致,温度高时间缩短,低时延长)。
过氧化氢酶活力的测定实验报告doc

过氧化氢酶活力的测定实验报告篇一:过氧化氢酶活性测定实验29 过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的过氧化氢溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的过氧化氢。
即可求出消耗的H2O2的量。
二、材料、仪器设备及试剂(一)材料:小麦叶片(二)仪器设备:1. 研钵;2. 三角瓶;3. 酸式滴定管;4. 恒温水浴;5. 容量瓶。
(三)试剂:1. 10%H2SO4;2. 0.2 mol/L pH7.8磷酸缓冲液;3. 0.1mol/L 高锰酸钾标准液称:取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制成1000ml,再用0.1mol/L 草酸溶液标定;4. 0.1mol/L H2O2市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68ml,稀释至1000ml,用标准0.1mol/L KMnO4溶液(在酸性条件下)进行标定;5.0.1mol/L 草酸:称取优级纯H2C2O4.2H2O 12.607g,用蒸馏水溶解后,定容至1000ml。
三、实验步骤(一)酶液提取:取小麦叶片2.5g加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转至容量瓶中,用同一缓冲液定容,4000rpm离心15min,上清液即为过氧化氢酶的粗提液。
(二)取50ml三角瓶4个(两个测定,另两个为对照),测定瓶加入酶液2.5ml,对照加煮死酶液2.5ml,再加入2.5ml 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO42.5ml。
过氧化氢酶米氏常数

过氧化氢酶米氏常数各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢篇一:过氧化氢酶动力学常数测定实验项目二、过氧化氢酶的活力和动力学常数测定姓名:赵家熙指导教师:谭志文实验室:6503 组员:①章恒炯②③成绩:第三部分:实验记录与分析一、酶活力测定(一)原始数据1.样品原始质量:2.标定数据:(1)KMnO4质量数及配制:158 (2)Na2C2O4质量数:134 (3)标定数据:/L(4)KMnO4实际浓度:/L3.样品滴定数据消耗高锰酸钾溶液(ml):实验(1)实验(2)对照(1)对照(2)(二)结果计算1.换算系数(1mL KMnO4溶液相当于多少mg H2O2)2.样品酶活计算(每克鲜重样品1min内分解H2O2的毫克数表示:mg H2O2/g?min)(A?B)?VT??V1?t酶活(mgH2O2/g·min)=酶活(mgH2O2/g·min)=(A-B)= VT====10min二、动力学常数的测定(一)原始数据(二)求出各管反应前的底物浓度[S]0和反应速度V0(三)以1/V0对1/[S]0作图(用excel 作图)1/s 1/v2008040(四)求出Km(mol/L)和Vmax (mmol/min)Km11?? vv[S]v如(三)中图maxmaxy=+ x=0时y=1/Vmaxy=0时x=-1/KmKm= Vmax=第四部分:课后研讨题1.总结本实验操作过程的注意事项。
1酶的提取和存放一般在0-4℃下进行。
2每个三角瓶内的酶促反应时间要精确控制在5min。
3各反应瓶的滴定终点微红色为同一标准。
4使用前应检查滴定管是否渗漏,滴定过程中应该保证逐滴加入。
2.影响过氧化氢酶活力测定的因素有哪些?1、温度,温度过高或者过低会降低过氧化氢酶的活性。
2、酸碱度,酸或碱浓度太高会使过氧化氢酶失活。
3.过氧化氢酶与哪些生化过程有关?R(Fe2+)+H2O2 = R(Fe3++OH-) R(Fe3+OH-)2+H2O2 = R(Fe2+)2+2H2O+O24.在反应速度的测定中,加入硫酸有哪些作用?终止反应,为下一步的滴定提供酸的环境。
过氧化物酶活性的测定

实验29 过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的过氧化氢溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的过氧化氢。
即可求出消耗的H2O2的量。
二、材料、仪器设备及试剂(一)材料:小麦叶片(二)仪器设备:1. 研钵;2. 三角瓶;3. 酸式滴定管;4. 恒温水浴;5. 容量瓶。
(三)试剂:1. 10%H2SO4;2. 0.2 mol/L pH7.8磷酸缓冲液;3. 0.1mol/L 高锰酸钾标准液称:取KMnO4(A R)3.1605g,用新煮沸冷却蒸馏水配制成1000ml,再用0.1mol/L 草酸溶液标定;4. 0.1mol/L H2O2市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68ml,稀释至1000ml,用标准0.1mol/L KMnO4溶液(在酸性条件下)进行标定;5. 0.1mol/L 草酸:称取优级纯H2C2O4.2H2O 12.607g,用蒸馏水溶解后,定容至1000ml。
三、实验步骤(一)酶液提取:取小麦叶片2.5g加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转至容量瓶中,用同一缓冲液定容,4000rpm 离心15min,上清液即为过氧化氢酶的粗提液。
(二)取50ml三角瓶4个(两个测定,另两个为对照),测定瓶加入酶液2.5ml,对照加煮死酶液2.5ml,再加入2.5ml 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO42.5ml。
过氧化氢酶的活力和动力学常数测定

一、酶活力测定(一)原始数据1.样品原始质量:嫩豆芽5.010g2.标定数据:(1)KMnO4质量数及配制:0.02mol/L高锰酸钾标准液配制:称取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制成1000mL ,临用前用草酸钠标定。
(2)Na2C2O4质量数:称取优级纯Na2C2O4 13.4g,用蒸馏水溶解后,定容至1L。
(3)标定数据:取5mL0.1mol/L的草酸和3mL10% H2SO4溶液于锥形瓶中,加热至(75~85)℃(见冒热气),趁热用KMnO4标准溶液滴定,刚开始反应较慢,滴入一滴KMnO4标准溶液摇动,待溶液褪色,再加第二滴KMnO4(此时生成的Mn2+起催化作用)。
随着反应速度的加快,滴定速度也可逐渐加快,但滴定中始终不能过快,,不断摇动或搅拌。
滴定至溶液呈现微红色并持续半分钟不褪色即为终点。
2KMnO4+5Na2C2O4+8H2SO4=2MnSO4+5Na2SO4+K2SO4+10 CO2↑+8H2O(4)KMnO4实际浓度:0.019mol/L3.样品滴定数据(二)结果计算1.换算系数(1mL KMnO4溶液相当于多少mg H2O2)2KMnO4+5H2O2+2H2SO4=K2SO4+MnSO4+5O2↑+2H2O2 5 2 1 1 5 21.9*10-5 4.75*10-5m(H2O2)=4.75*10-5*34*1000=1.615mg2.样品酶活计算(每克鲜重样品1min内分解H2O2的毫克数表示:mg H2O2/g•min)酶活力用每克鲜重样品1min内分解H2O2的毫克数表示酶活(mgH2O2/g·min)=式中:().A B VFW V tT-⨯⨯⨯⨯171A—对照KMnO4滴定毫升数;B—酶反应后KMnO4滴定毫升数;VT—酶液总量(ml);V1—反应所用酶液量(ml);F W—样品鲜重(g);1.7—1ml 0.02mol/L的KMnO4相当于1.7mg H2O2 酶活(mgH2O2/g·min)=0.235*50*1.7/(5.010*2.5*10)=0.159(mgH2O2/g·min)二、动力学常数的测定(一)原始数据(二)求出各管反应前的底物浓度[S]0和反应速度V0(三)以1/V0对1/[S]0作图(用excel作图)(四)求出Km(mol/L)和Vmax(mmol/min)求得线性关系为y=1.3921x+0.0111所以V max=1/0.0111=8.654*10-2K M=1.205*10-1第四部分:课后研讨题1.总结本实验操作过程的注意事项。
植物生理指标测定

(6)标准曲线的绘制:先求出吸光度值(y)依脯氨酸浓度(x)而变的回归方程式,再按回归方程式绘制标准曲线,计算2 mL测定液中脯氨酸的含量(ug/mL)。
2.样品的测定
(1)脯氨酸的提取:准确称取不同处理的待测植物叶片各0.5g,分别置大管中,然后向各管分别加人5mL3%的磺基水杨酸溶液,在沸水浴中提取10 min(提取过程中要经常播动),冷却后过滤于干净的试管中,滤液即为脯氨酸的提取液。
B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.205mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。加入10gPVP(聚乙烯吡咯烷酮)
(二)过氧化物酶活性测定
酶活性测定的反应体系包括:2.9 mL.0.05 mol/L磷酸缓冲液; 1.0ml.2%H2O2;1.0mL.0.05mol/L愈创木面和0.1mL酶液。用加热煮沸5min的酶成为对照,反应体系加人酶液后,立即于37C水浴中保温15min.然后迅速转人冰浴中,并加人2.0ml.20%三氯乙酸终止反应,然后,过虑(或5000xg离心10min),适当稀释.470mm波长下测定吸光度。
显色反应取试管(要求透明度好)4,2为样品测定管,2为对照管,按表39-1加入各溶液。
混匀后将1支对照管置于暗处其他管于4000lx日光反应20min(要求各管受光情况一致,反应室的温度高时时间可适当缩短,温度低时时间可适当延长)。
过氧化氢含量测定
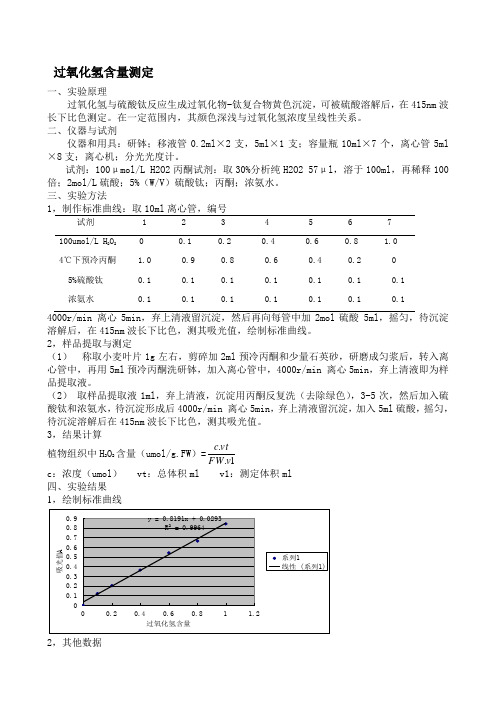
过氧化氢含量测定一、实验原理过氧化氢与硫酸钛反应生成过氧化物-钛复合物黄色沉淀,可被硫酸溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与过氧化氢浓度呈线性关系。
二、仪器与试剂仪器和用具:研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml ×8支;离心机;分光光度计。
试剂:100μmol/L H2O2丙酮试剂:取30%分析纯H2O2 57μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
三、实验方法1,制作标准曲线:取10ml离心管,编号试剂 1 2 3 4 5 6 7 100umol/L H2O2 0 0.1 0.2 0.4 0.6 0.8 1.04℃下预冷丙酮 1.0 0.9 0.8 0.6 0.4 0.2 0 5%硫酸钛 0.1 0.1 0.1 0.1 0.1 0.1 0.1浓氨水 0.1 0.1 0.1 0.1 0.1 0.1 0.14000r/min 离心5min,弃上清液留沉淀,然后再向每管中加2mol硫酸 5ml,摇匀,待沉淀溶解后,在415nm波长下比色,测其吸光值,绘制标准曲线。
2,样品提取与测定(1)称取小麦叶片1g左右,剪碎加2ml预冷丙酮和少量石英砂,研磨成匀浆后,转入离心管中,再用5ml预冷丙酮洗研钵,加入离心管中,4000r/min 离心5min,弃上清液即为样品提取液。
(2)取样品提取液1ml,弃上清液,沉淀用丙酮反复洗(去除绿色),3-5次,然后加入硫酸钛和浓氨水,待沉淀形成后4000r/min 离心5min,弃上清液留沉淀,加入5ml硫酸,摇匀,待沉淀溶解后在415nm波长下比色,测其吸光值。
3,结果计算植物组织中H2O2含量(umol/g.FW)=1..vFWvtcc:浓度(umol) vt:总体积ml v1:测定体积ml 四、实验结果1,绘制标准曲线2,其他数据FW=1.008g vt=7ml A(样品)=1.472 3,计算结果植物组织中H2O2含量(umol/g.FW)=1..vFWvtc=12.2314五、实验分析1,本次试验在研磨小麦叶片时,由于丙酮易挥发,所以研磨不充分,而且冲洗研钵时也不完全,导致样品的损失。
cat测定方法

二、氧化氢酶的活性测定--高锰酸钾滴定法[原理]过氧化氢酶属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
据此,可根据H202的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的H2O2溶液,经过酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的H2O2 5H2O2+2KMnO4+4H2SO4 5O2+2KHSO4+8H2O+2MnSO4[仪器和用具]研钵;三角瓶50ml4个;10ml酸式滴定管;恒温水浴锅;容量瓶25ml1个。
[试剂]10%H2SO4; 0.2molL-1磷酸缓冲液; 0.1molL-1高锰酸钾标准液;称取KmnO4(AR)克,用新煮沸泠却的蒸馏水配制成1000ml,用草酸溶液标定;:市售30%H202大约等于17.6m01L-1,取30%H202溶液5.68ml,稀释至于1000ml,用标准溶液(在酸性条件下)进行标定草酸:称取优级纯用蒸馏水溶解后,定容至1L。
[方法]1.酶液提取:取小麦叶片2.5g加入的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转入容量瓶中,用同一缓冲液定容,4000rmin-1离心15min,上清液即为过氧化氢酶的粗提液。
2.取50ml三角瓶4个(2个测定,2个对照),测定瓶中加入酶液,对照瓶中加入煮死酶液,再加入,同时计时,于30℃恒温水浴中保温10min,立即加入10%3.用L-1KMnO4标准溶液滴定H202,至出现粉红色(在30min内不消失)为终点。
4.结果计算:酶活性用每克鲜重样品1min内分解H202的毫克数表示:酶活()= 式中 A--对照KMn04滴定毫升数(ml)B----酶反应后KMnO4滴定毫升数(ml)VT----酶液总量(ml);V1----反应所用酶液量(ml)W-----样品鲜重(g)的KMnO4相当于.注意所用KMnO4溶液及H2O2溶液临用前要经过重新标定。
各生理指标测定方法要点

各生理指标的测定方法一、脯氨酸含量的测定1.茚三酮法1.1原理在正常环境条件下,植物体内游离脯氨酸含量较低,但在逆境(干旱、低温、高温、盐渍等)及植物衰老时,植物体内游离脯氨酸含量可增加10-100倍,并且游离脯氨酸积累量与逆境程度、植物的抗逆性有关。
用磺基水杨酸提取植物样品时,脯氨酸游离于磺基水杨酸的溶液中,然后用酸性茚三酮加热处理后,溶液即成红色,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下比色,从标准曲线上查出(或用回归方程计算)脯氨酸的含量。
1.2步骤试剂:(1)25%茚三酮:茚三酮------------0.625g冰乙酸------------15ml6mol/L磷酸--------10ml70°C水浴助溶;(2)6mol/L磷酸:85%磷酸稀释至原体积的2.3倍;(3)3%磺基水杨酸:磺基水杨酸------3g加蒸馏水至------100ml实验步骤:(1)称取0.1g样品放入研钵,加5ml 3%磺基水杨酸研磨成匀浆,100°C沸水浴15min;(2)冰上冷却,4000rpm离心10min;(3)提取液2ml+冰醋酸2ml+25%茚三酮2ml混合均匀,100°C沸水浴30min,冰上冷却;(4)加4ml甲苯混合均匀,震荡30s,静置30min;(5)以甲苯为空白对照,再520nm下测定吸光值。
1.3计算方法脯氨酸含量(μg/gFW)= X * 提取液总量(ml)/样品鲜重(g)*测定时提取液用量(ml)*10^6公式中:X-----从标准曲线中查得的脯氨酸含量(μg)提取液总量---------------------------5ml测定时提取液用量---------------------2ml问题及质疑:1.酸性体系下,脯氨酸与茚三酮加热反应后的最终产物为红色,再实验过程中,仅有少数时候能发现红色产物。
生理指标测定方案

一氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活力一、原理超氧化物歧化酶(superoxide dismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶,它催化下列反应: 2O2-+ 2H →H2O2+O2。
本反应产物H2O2可由过氧化氢酶进一步分解或被过氧化物酶利用。
本实验依据超氧化物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,超氧阴离子自由基可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
(一个酶活单位定义为将NBT的还原抑制到对照的一半(50%)时所需的酶量。
)二、材料、仪器设备及试剂(一)材料水稻或小麦叶片。
(二)仪器设备高速冷冻离心机,紫外分光光度计,日光灯(反应试管处照度为4000lx),试管数支。
(三)试剂(1)0.05mol/L(pH7.8)磷酸缓冲液 (PBS)。
配制方法:①母液A(0.2mol/L Na2HPO4):称取71.64g Na2HPO4·12H2O,用蒸馏水定容至1000ml 。
(配置溶液时需要用磁力搅拌器搅拌才能溶解。
)②母液B(0.2mol/L NaH2PO4):称取31.21g NaH2PO4·2H2O,用蒸馏水定容至1000ml 。
③配0.05mol/L(pH7.8)磷酸缓冲液:取91.5mlA母液+8.5mlB母液+蒸馏水定容到400ml (2)提取介质0.05mol/L(pH7.8)磷酸缓冲液,内含1%聚乙烯吡咯烷酮(PVP): 称取1g PVP用0.05mol/L(pH7.8)磷酸缓冲液 (PBS)定容到100ml(3)130mmol/L甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml。
小麦幼苗过氧化物酶ppt课件

■ 在浓缩胶中的三个主要作用角色:
甘氨酸: pH=8.9 负电荷 pI=5.96不带电荷
Cl-1:
蛋白质(酶):
小分子
大分子
■ 浓缩效应:
A
B
C
样
8.0
本
浓
缩 胶
6.7
离子缺乏空间
分
离
8.9
胶
V=I/S
+
+
三、实验材料、仪器和试剂:
1、实验材料:小麦幼苗
2、仪器、器皿:
(1)垂直板电泳装置
(电泳槽,玻璃板,胶条,电泳梳子,制胶架等);
(1)三个不连续性的表现: (2) 不连续系统中的三种物理效应:
(3) 浓缩效应产生的原因: ★
二、实验原理:
1、同工酶和电泳概念:
(1)同工酶指催化同一种化学反应,但其酶蛋白本身 的分子结构组成却有所不同的一组酶。
同工酶与生物的遗传,生长发育,代谢调节及抗性等 都有一定的关系,如过氧化物酶在细胞代谢过程中与呼吸 作用,光合作用,及生长素的氧化等都有关系,测定POD活 性或其同工酶,可以反映某一时期植物体内代谢变化。
(4)长链富含酰胺基团,使其成为稳定的亲水凝胶; (5)该结构不带电荷,在电场中电渗现象极为微小。
5、凝胶的质量决定因素:
(1)凝胶度: 是指100mg凝胶溶液中含有单体(Acr)和交联剂
(Bis)的总克数,用T%表示。 (2)交联度:
是指凝胶溶液中,交联剂(Bis)占单体(Acr) 和交联剂(Bis)总量的百分数,用C%表示。
四、实验步骤:
1、贮液的配制: 2、凝胶的制备:
2.1 胶板的制备: 2.2 分离胶的制备: 2.3 浓缩胶的制备:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
项目编号:
“研究创新实验”项目申请书
项目名称从小麦叶片中提取过氧化氢酶
项目负责人尹炳谦
年级、专业
联系电话
电子邮件 bq_yin@ 指导教师(姓名及职称)
填表日期 2011 年 10 月 6 日
国家级生物实验教学示范中心制表
填表说明
1、《研究创新实验项目申请书》要按顺序逐项填写。
填写内容要实事求是,讲究诚信,不能有雷同;表达要明确、严谨。
空缺项要填“无”。
2、格式要求:
(1)一律用A4纸打印,于左侧装订成册。
(2)字体:中文用宋体,英文和数字用Times New Roman字体,行距为1.5倍行距。
(2)一级标题:标题编排应采用“(一)、(二)、(三)”等依次分级编号,左起缩进2字符,宋体加黑,字号为小四号。
(3)二级标题:标题编排应采用“1、2、3、”等依次分级编号,左起缩进2字符,宋体加黑,字号为五号。
(4)内容:字号为五号,每段第一行左起缩进2字符。
3、申请参加“研究创新实验”项目团队人数为2-3人(1人为项目负责人,参与合作研究者1-2人)。
并在诚信承诺书上签名。
4、申请参加“研究创新实验”项目的个人或团队必须聘请教师作为项目指导教师,并请指导教师在申请书和诚信承诺书上签名。
5、八、九项不填。
6、“项目编号”由实验中心填写。
7、“研究创新实验诚信承诺书”单独一页。
研究创新实验诚信承诺书
实验项目:
开放实验室学生在遵守“学生实验守则”、“学生实验习惯评定方法”、“实验室开放管理规定”等各项规章制度的同时,并严格遵守以下各项规定:
1、能够在指导教师的指导下自主完成文献查阅与整理、方案设计、实验实施、数据处理和论文撰写等工作。
2、开放实验室学生必须填写“实验室开放记录簿”,进实验室须穿实验服。
3、在开放实验室实验所使用的材料、试剂、玻璃仪器和仪器设备不准带出(搬出)该实验室。
试剂使用后须放回原处,玻璃仪器使用后须刷洗干净并放回原处。
4、实验过程中须严格按仪器的操作规程使用仪器,并填写“仪器使用记录”。
实验后,须保证实验仪器、实验台面、试剂架及地面的清洁卫生,并填写“值日生工作完成登记簿”。
离开实验室时一定要关好水、电、煤气和门窗,保证实验室的安全。
5、要有严谨和务实的科研学风,按照“研究创新实验记录规定”认真如实记录;按照“研究创新实验论文撰写要求”撰写论文。
6、遵守“开放实验项目成果管理规定”。
严守实验项目的关键技术,不经指导教师允许,不得与企业、科研部门等洽谈与本项目有关的合作。
7、项目研究不得抄袭他人成果,不得弄虚作假,一经发现,创新实验成绩视为不及格。
8、按“项目进度安排”保质保量完成各项研究任务。
如实填写“研究创新实验项目进展表”,每月30日上交一次直至项目结题为止。
9、中心组织专家定期检查项目的进展情况,对未按进度要求完成实验者有权终止实验。
10、按时上交“研究创新实验项目申请书”、“研究创新实验论文”(打印版和电子版)和研究创新实验记录本。
11、晚上做完实验回寝室的同学一定要搭伴同行,保证同学的自身安全,否则责任自负。
项目组成员名单
实验地点:指导教师签字:管理教师签字:
国家级生物实验教学示范中心。
