有机化学反应-课件
2有机化学中的重排反应(上课使用)总结精品PPT课件

R C O NR N C O H 2 O R 2 NH
氮烯
异氰酸酯
氮转移一对电子与羰基成 键的时刻氮上缺电子。 紧接着R带着一对电子填补上来。
⑴霍夫曼(Hofmann)重排
酰胺与溴和碱的水溶液作用,放出CO2, 生成少一个碳 原子的胺, 称为霍夫曼重排(降解).
RCONH2 + Br2 + NaOH
RCOCHN2 + HCl
-重氮甲酮
⑵.阿恩特-埃斯特尔特(Arudt-Eistert) 反应
即,从羧酸经重氮甲酮生成高一级羧酸的方法。 (其中包含了Wolff重排。)
4. 缺电子氮重排(C→N)
• R-N:氮烯(乃春Nitrene)与卡宾类似,只是以N原子代换C原子。
可由叠氮分解得到,也可由N-卤代酰胺经-消去HX得到。 • N 原子参加的缺电子重排的基本模式:
1899 年,Baeyer 和Villiger 首次报道了利用过硫酸作氧化剂能 将环酮(如薄荷酮、香芹酮(樟脑)转化成相应的内酯,这就是 历史上最早的Baeyer-Villiger 氧化反应。现在Baeyer-Villiger 氧 化反应已成为酮或环酮转化成酯或内酯的统称。
常用的过氧酸有:H2SO5、MeCO3H、PhCO3H、HCO3H和 CF3CO3H等。现在文献报道的Baeyer-Villiger 氧化反应大多用 双氧水作为氧化剂,因双氧水还原后生成清洁的水,尽管双氧 水具有强腐蚀性,但用双氧水的拜尔-维立格反应仍不失为一 种既安全又符合现代社会绿色环保要求的好方法。
C H 3
H
H
P hC C O T s△H 3 C C C P h
C H 3 C H 3
C H 3 C H 3
苯的迁移速度为甲基的3000倍
有机硅化学反应PPT课件

组分名称
分子式
沸点(kpa)/℃ 质量分数(%)
甲基三氯硅烷
CH3SiCl3
66.4
三甲基氯硅烷 (CH3)3SiCl
57.9
5~15 3~5
甲基二氯硅烷 CH3SiHCl2
41.8
3~5
二甲基氯硅烷 (CH3)2SiHCl
35.0
~1
四甲基硅烷
(CH3)4Si
26.2
<1
四氯化硅
SiCl4
57.6
l339
Si-Br
309
C-Br
284
Si-I
234
C-I
213
21
1.硅键类型以及特性
硅键的离子化特征及键能
键型 Si-C Si-O Si-Cl Si-N Si-H
离子化 12% 50 % 30 % 30 % 2%
离子化键能(KJ/mol-1) 932
1014.2 796.2
1045
硅与非金属元素的原子形成共价键,而这些共价键具有一 定的离子化特征。讨论硅键活性时,要考虑反应机理以及两种 键能的大小。
二甲基二氯硅烷的分子式:
(CH3)2SiCl2 (或Me2SiCl2) 分子量:129.06 沸点:70.2℃
熔点:-76℃
d420: 1.0637 nD20: 1.4055 毒性: LC50. 930ppm/4H
闪点:-10℃
【火灾危险】易燃.遇水或水蒸汽迅速分解发热,产生有毒的腐蚀性烟雾.遇明
火易燃.遇强氧化剂有燃烧的危险.
7
生命硅直饮机
生命硅美肤机
生命硅美颜液
生命硅外用液
硅与人类历史的发展 石器时代 封建时代
8
有机化学课件
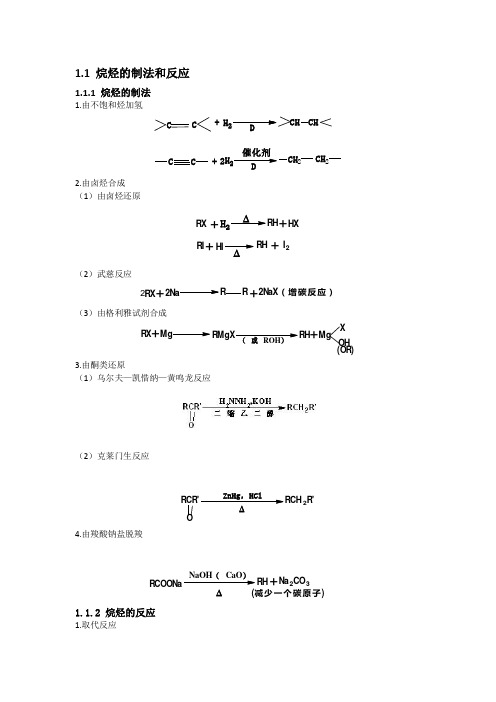
1.1 烷烃的制法和反应1.1.1 烷烃的制法1.由不饱和烃加氢C C+H 2CHCHCC+H 22D DCH 2CH 22.由卤烃合成 (1)由卤烃还原RX+H 2RHHX +RI HI+∆RH +I 2∆(2)武慈反应R X2+2N aRR2N aX (增碳反应)+ (3)由格利雅试剂合成RX+MgRMgX(或ROH )RH +MgX OH (OR)3.由酮类还原(1)乌尔夫—凯惜纳—黄鸣龙反应(2)克莱门生反应RCR'O2R'4.由羧酸钠盐脱羧NaOH (CaO )∆RH +Na 2CO 3(减少一个碳原子)1.1.2 烷烃的反应1.取代反应RH +X2光RX +HX (反应活性3'H>2'H>1'H>CH 4)例CH 3CH 2CH 3Cl 2光CH 3CH CH 3Cl+CH 3CH 2CH 2Cl(57%)(43%)2.氧化反应 (1)完全氧化CH 4+2O CO 2+2H 2O +热能(2)部分氧化RCH 2CH 2O 2,锰盐RCOOH +R'COOH (可制肥皂)4CH 4+O 21500C CH CH+2CO +7H 2O(3)裂化反应CH 3CH 2CH 2CH 3C H 2CH 2+C H 3CH 3+CH 3CH 2CH=CH 2+H 2+CH 4+CH 2CH 3(4)异构化反应CH 3CH 2CH 2CH 3AlBr 3 HBrCH 3CHCH 3CH 320%80%1.2 烯烃的制法和反应1.2.1烯烃的制法1 烷烃脱氢C C H H催化剂∆-H2C C (适合于简单烯烃,通常得混合物)CH3CH2CH2CH3Pt,500C CH3CH2CH=CH2+CH3CH3HH+CH3CH3H H+CH2=CHCH=CH2+H22.卤烷脱卤化氢C CX碱,热-HXC CHHHCl(CH3)3CO-K+3.醇脱水4.霍夫曼消除5.由炔烃加氢6.魏梯希反应1.2.2烯烃的反应1.烯烃的亲电加成(2)加水直接水合间接水合以上都符合马氏规律硼氢化-氧化反应(3)加卤素(4)加次卤酸2.烯烃的催化氢化CH3CH2H2,Pt CH3CH2CH33与碳烯加成CC+CC CC (X,Y=H,Cl,Br,I 或COOEt)+CHCl 3(CH 3)3COK+Cl4烯烃的氧化(1) 烯烃的环氧化C C+21O2CC OCH 2CH 2+21O 2O环氧丙烷C C+RCOOH C C O+RCOHCH 3CH CH 2+CH3OCH 2H 3CHCO+CH 3COOH(2) 高锰酸钾氧化C C稀KMnO OH C C (或OsO 4,H 2O 2)RCHCH KMnO R CO +CO 2+H 2OCH 3CH 2CH CH 2KMnO CH 3CH 2C O+CO 2+H 2OCR O+CR'OHORC RR C R'KMnOCH 3CHCCH 3CH 3KMnO 4CH 3COHO+CH 3CH 3O5烯烃的臭氧化反应C RR C R'+O 3OO COC RRR'H H 2ORO +CR'H ORCH 3CHCH CH 32Zn ,H 2OCH 3CHO +CH 3CH 3O6聚合反应nCH 2CH2>100℃,100MPaCH 2CH 2nn>100nCH 3CH CH 2烷基铝-三氧化钛50℃,1MPaCH3CH 2n7烯烃的a 氢原子反应(1) 卤代C Ha 氢+X 2C X+HX(或NBS)+NBSBr(2) 氧化烯烃的a氢易被氧化,在不同条件下,得到不同产物:CH 3CHCH 2+O 2CuO 370℃CH 2CHCHOCH 3CH CH 2+23O 磷钼酸铋 0.7~1.4MPa CH 2CHCOOHCH 3CHCH 2+NH 3+23O 2磷钼酸铋470℃2CHCN +3H 2O1.3 炔烃的制法和反应1.3.1 炔烃的制法1.金属炔化合物与卤烷反应RCC -Na ++R'XS N 2RCCR'+X -(1。
有机化学反应机理(总结最好的) (共143张PPT).ppt

CH3
OH
C-O+ CCHH33 -H+
CH3
O
C-OCH3 CH3
CH3
CH3 78%
仅有少量空阻大的羧酸按此反应碱性水解
双分子反应一 步活化能较高
O
H+
CH3C-OH
+OH CH3C-OH HOC2H5
按加成--消除机理进行 反应,是酰氧键断裂
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
OC2H5
-H2O 消除
+OH
-H+
CH3C-OC2H5
O CH3C-OC2H5
*2 碳正离子机理
实例:卤代烃溶剂解反应的反应机理(SN1)
进攻C+
CH3 CH3 C Br
CH3
慢 -Br-
CH3
CH3 C+
CH3
C2H5OH
快
-H+
CH3 +
CH3 C HOC2H5 CH3
CH3
CH3 C OC2H5
CH3
3 酯化反应
定义:羧酸与醇在酸的催化作用下失去一分子水 而生成酯的反应称为酯化反应
常用的催化剂有盐酸 、硫酸、苯磺酸等
n-C6H13 HO C H
CH3
(S)-2-辛醇
[]D= + 9.9o
构型翻转
n-C6H13 H C OH CH3
(R)-2-辛醇
[]D= - 9.9o
构型保持
如果一个反应涉及到一个不对称碳原子上的一根键的变化,则将新
键在旧键断裂方向形成的情况称为构型保持,而将新键在旧键断裂的相 反方向形成的情况称为构型翻转。这种构型的翻转也称为Walden转换。 在SN2反应中,得到构型翻转的产物。
有机化学-第17章-协同反应PPT课件

a + = b -c
例如:
+
-CN -C
+
-CN -O
+
NN -C
+
-C =N -C (腈叶利德)
+
-C =N -O
(氧化腈)
+
N =N -C
(重氮烷)
.
31
1,3-偶极化合物的结构特点
这类化合物都具有“在三个原子范围内包括4个电子的体系”
O3
-OO-O CH2N2
2C-H N-N RN3
1,3-偶极化合物的分子轨道的特点:
H
38
O
C6H5 H
O N C6H5
H+转移
O
O
C6H5
+
N
C6H5
H
O O
C6H5 N+ H
C6H5
.
39
O
C6H5
O
+
N
C6H5
+
H
正向1,3-偶极
H
COO3CH环加成反应
C=C
H3COCO
H
O O
C6H5
N
H
H
H3COOC
C6H5 COOCH3 H
逆向1,3-偶极 环加成反应
-O=C=O
H+转移
-NR-N-N
LUMO HOMO
与烯丙基负离
子具有类似的分
子轨道的特点。
.
32
2. 1,3-偶极环加成反应
定义:1,3-偶极化合物和烯烃、炔烃或相应衍生物生成五元 环状化合物的环加成反应称为1,3-偶极环加成反应。
O +O +
有机化学课件--第十八章协同反应

hυ 对 旋 ( 禁 阻 )
hυ 顺 旋 ( 允 许 )
ψ4 己 三 烯 的 光 照 环 合
其它含有4n+2个π电子体系的共轭多烯烃的电环 化反应的方式也基本相似。例如:
H
H
hυ
顺 旋 H
对 旋 H
2019/6/25
课件
16
18.2 环加成反应
两分子烯烃或共轭多烯烃加成成为环状化合物 的反应叫环加成反应。例如:
顺旋 允许的
2019/6/25
课件
对旋 禁阻的
12
丁二烯在激发态(光照)环化时,起反应的前线 轨道HOMO是ψ3 ,所以丁二烯在激发态(光照) 环化时,对旋允许,顺旋是禁阻。
hυ 对旋(允许)
2019/6/25
hυ 顺旋(禁阻)
课件
13
其他含有4n 个π电子的共轭多烯烃体系的电 环化反应的方式也基本相同。 例如:
允许
光照
禁阻
2019/6/25
课件
23
当双烯体带有给电子基、亲双烯体带有吸电子基时, 反应容易进行且产率高,并且主要生成1、2-和1, 4-位产物:
CO2CH3 C2H5O
+
CO2CH3
C2H5O
CO2CH3
次 C2H5O
CO2CH3
主
2019/6/25
课件
24
内向加成(endoaddition)规则:
O
O O
O
O O
O
O 3O — O — OC H 2 N 2C H 2 — N = NR N 3R — N — N = N
臭氧
2019/6/25
重氮甲烷
课件
叠氮化物
27
有机化学PPT课件

目录
• 有机化学简介 • 有机化学基础知识 • 有机化学反应 • 有机化学的应用 • 有机化学的未来发展
01 有机化学简介
有机化学的定义
总结词
有机化学是一门研究有机化合物 的组成、结构、性质、合成和反 应的学科。
详细描述
有机化学主要关注碳氢化合物及 其衍生物,即有机化合物,它们 是构成生命体的基本物质。
将有机化学与计算机科学、数学等学科交叉融合,利用计算机模拟和预测有机化学反应和 分子的性质,为有机化学研究和应用提供新的工具和手段。
THANKS FOR WATCHING
感谢您的观看
有机化学的发展历程
总结词
有机化学的发展经历了从天然有机化学到合成有机化学的演变,并不断推动着 人类社会的进步。
详细描述
早期的有机化学主要研究天然有机物,如动植物体内的化合物。随着科技的发 展,合成有机化学逐渐崛起,人们开始能够合成大量原本自然界不存在的有机 化合物,从而极大地丰富了人类的物质生活。
农业领域
1 2
农药合成
有机化学在农药合成中扮演着关键角色,通过设 计并合成新的农药分子,可以开发出更安全、更 有效的农药。
植物生长调节剂
有机化学也可用于合成植物生长调节剂,通过调 节植物生长代谢,提高作物产量和品质。
3
转基因作物
利用有机化学手段,可以修改作物的基因组,培 育出抗逆性更强、产量更高的转基因作物。
举例
乙醇被氧化生成乙醛。
04 有机化学的应用
医药领域
药物合成
有机化学在药物合成中发挥着重要作用,通过设计并合成新的有 机分子,可以开发出具有治疗作用的创新药物。
药物代谢
有机化学也涉及药物代谢的研究,了解药物在体内的代谢过程有助 于优化药物的疗效和降低副作用。
《有机化学人名反应》课件

人名反应的定义与重要性
定义
人名反应是指以科学家或化学家的名字命名的有机化学反应。这些反应通常具 有独特性、重要性或实用性。
重要性
人名反应是化学领域中的重要知识,掌握这些反应有助于理解有机化学的基本 原理,提高解决实际问题的能力。同时,人名反应也是化学领域中科学研究的 成果,体现了人类对化学反应的深入认识和探索。
一种重要的烷基化反应
详细描述
Friedel-Crafts反应是一种在芳香化合 物中引入烷基的亲电取代反应。通常 在路易斯酸(如AlCl3)催化下进行, 该反应广泛应用于有机合成中。
Wittig 反应
总结词
制备烯烃的经典方法
详细描述
Wittig反应是一种通过磷酸酯和醛之间的反应制备烯烃的方法。该反应涉及一个五元环 过渡态,生成具有特定立体化学特征的烯烃。
ቤተ መጻሕፍቲ ባይዱ
在材料科学中的应用
材料科学是一个跨学科的领域,涉及材料的设计、制备、性 能和应用。人名反应在材料科学中的应用主要涉及新型材料 的合成和改性。
通过人名反应,可以合成出具有优异性能和功能的新型材料 ,如高分子材料、陶瓷材料、复合材料等。这些材料在能源 、环境、信息等领域具有广泛的应用前景,为科技进步和社 会发展提供重要支持。
亲电取代反应
总结词
亲电取代反应是一种有机化学反应,其中亲电试剂进攻并取代反应物分子中的某 个基团。
详细描述
这类反应通常发生在苯环、芳香烃和杂环化合物的反应中,其中亲电试剂具有正 电性,能够进攻富电子的碳原子。常见的亲电取代反应包括:EAS reaction、 Elimination reaction等。
详细描述
这类反应通常发生在烯烃、炔烃和芳香烃的反应中,其中加成试剂能够与不饱和键结合形成新的键。 常见的加成反应包括:Diels-Alder reaction、Addition reaction等。
有机化学基本反应类型ppt课件

卤代烃是NaOH醇溶液+加热
2021精选ppt
38
有机反应类型——氧化反应
原理:有机物得氧或去氢 包括:
燃烧反应、被空气(氧气)氧化、(醇是去氢氧化) 被酸性KMnO4溶液氧化, 醛基的银镜反应和被新制Cu(OH)2悬浊液氧化 烯烃被臭氧氧化 (O3,Zn/HCl,双键断裂,原双键碳变为C=O)
一元羧酸和一元醇反应生成普通酯
二元羧酸和二元醇
○ 部分酯化生成普通酯和1分子H2O, ○ 或生成环状酯和2分子H2O, ○或生成高聚酯和2n H2O 羟基羧酸自身反应既可以部分酯化生成普通酯, 也可以生成环状酯,还可以生成高聚酯。如乳 酸分子
2021精选ppt
27
有机反应类型——酯化反应拓展
类型(联系书上提到的高分子材料):
乙烯型加聚 聚丙烯、聚苯乙烯、聚氯乙烯、
聚丙烯腈、聚甲基丙烯酸甲酯(有机玻璃)
1,3-丁二烯型加聚(破两头,移中间) 天然橡胶(聚异戊二烯)
氯丁橡胶(聚一氯丁二烯)
含有双键的不同单体间的共聚 乙丙树脂(乙烯和丙烯共聚),
丁苯橡胶(丁二烯和苯乙烯共聚)
2021精选ppt
种有机物相当于化合反应),只进不
出。
④加成前后的有机物的结构将发生变化,
烯烃变烷烃,结构由平面形变立体形;
炔烃变烯烃,结构由直线形变平面形;
⑤加成反应是不饱和化合物的较特有反应,
另外,芳香族化合物也有可能发生加成
反应。
2021精选ppt
14
有机反应类型——加成反应
和H2加成的条件一般是催化剂(Ni)+加热 和水加成时,一般在一定的温度、压强和催化剂
醛酮—醛酮与亚硫酸氢钠反应(有机化学课件)

CONTENT
01
醛、酮与饱和NaHSO3 的反应原理、特点
02
醛、酮与饱和NaHSO3 反应用途
01
醛、酮与饱和 NaHSO3的反 应原理、特点
醛、酮与饱和NaHSO3的反应原理、特点
反应原理
醛、酮和饱和亚硫酸氢钠发生可逆的亲核加成反应生成α-羟基磺酸钠,产物不
溶于饱和的亚硫酸氢钠,从溶液中析出结晶。
2. 与NaCN反应制取
羟腈化合物
NaCN
OH R CH CN Na2SO3
• 避免使用剧毒的HCN
醛、酮与饱和NaHSO3反应用途
应用
1. 鉴别醛、酮
2. 与NaCN反应制取 羟腈化合物
3. 分离、提纯醛、酮化合物
醛、酮与饱和NaHSO3反应用途
任务:如何分离3-戊酮和2-戊酮的混合物?
=
= =
A. 反应属于亲电加成 B. 反应速率:乙醛>苯乙酮>环己酮 C. 反应是可逆反应,产物中加入稀酸可以得到原来的醛、酮
小结
100% 80% 60% 40% 20%
100% 80% 60% 40% 20%
思考
设计方案 从山苍子油中提取柠檬醛。
R
OH
C
H
S O3N a
α-羟基磺酸钠
醛、酮与饱和NaHSO3的反应原理、特点
亲核试剂特点
1 亚硫酸氢钠是饱和溶液
保证亲核试剂有较大的浓度, 使可逆反应向右较大程度进行
生成的产物α-羟基磺酸钠在饱
和溶液中溶解度小,易沉淀
2 现配现用
易被空气中的氧气氧化生成硫酸钠
醛、酮与饱和NaHSO3的反应原理、特点
3-戊酮 2-戊酮
O
ene反应课件ppt

描述反应速率快慢的常数,可以 通过实验测定。
活化能
反应所需的最低能量,影响反应速 率。
反应机理
描述反应过程中各步骤的详细过程 和相互关系。
ene反应的立体化学
立体选择性
反应过程中生成的产物在空间结构上的选择性。
顺式加成与反式加成
烯烃与乙烯基负离子加成时,可以按照不同的空间构型进行加成, 生成不同的产物。
ene反应在材料科学中常被用于 合成具有特定结构和功能的材料 ,如聚合物、高分子材料、纳米
材料等。
ene反应可以用于合成具有特定 物理和化学性能的材料,如导电 材料、发光材料、生物相容性材
料等。
ene反应还可以用于合成具有特 殊结构和形状的材料,如碳纳米
管、石墨烯等。
04
ene反应的挑战与展望
ene反应面临的挑战
绿色合成方法研究
将ene反应与其他绿色合成方法 相结合,实现高效、环保的合成
目标。
感谢观看
THANKS
ene反应在药物合成中的应用
ene反应在药物合成中常被用于构建 关键的碳碳双键或环状结构,如合成 抗癌药物、抗生素、抗病毒药物等。
ene反应还可以用于药物分子的修饰 和改造,以提高药物的生物活性和药 效。
ene反应可以用于合成具有特定药效 基团的药物分子,如芳香醚类、烯胺 类等。
ene反应在材料科学中的应用
ene反应课件
目 录
• ene反应简介 • ene反应的原理 • ene反应的应用 • ene反应的挑战与展望
01
ene反应简介
ene反应的定义
01
ene反应,全称为烯烃复分解反 应,是一种有机化学反应,涉及 两个烯烃分子的相互交换。
有机化学课件--第十八章协同反应

协同反应的概念与特点
探讨协同反应的特点和与传统 反应的区别。
协同反应的意义和应用
解释协同反应在有机化学领域 的重要性和实际应用。
传统配对反应 vs 协同反应
1 传统配对反应的限制
和不足
2 协同反应的优势和特点 3 协同反应与传统配对
展示协同反应相比传统配对
反应的比较
讨论传统配对反应的局限性
反应的优势和特点。
比较协同反应和传统配对反
和存在的问题。
应的异同。
协同反应的类型
亲核-亲电协同反应
介绍亲核-亲电协同反应的机制和实例。
碱-酸协同反应
探讨碱-酸协同反应的原理和广泛应用。
金属协同反应
讲解金属催化的协同反应机制和应用案例。
自由基协同反应
介绍自由基协同反应的特点和相关反应类型。
协同反应机理
协同反应的基本机理
介绍协同反应在药物研发和 制造中的应用案例。
讨论协同反应在材料科学和 工程中的广泛应用。
结论与展望
协同反应的发展历程
回顾协同反应的发展历程和重要 里程碑。
协同反应的未来趋势
展望协同反应在未来有机化学领 域的发展趋势。
协同反应的创新与改 进
探讨如何进一步改进协同反应的 机制和应用方法。
以上就是有机化学课件--第十八章协同反应的 大纲,希望对你有所帮助!
有机化学课件--第十八章 协同反应
协同反应是有机化学中重要的概念,本章会介绍协同反应的特点、意义和应 用。我们将比较传统配对反应和协同反应的不同,并探讨协同反应的机理和 各种类型。最后,我们将了解协同反应在有机合成、化学制药和材料科学中 的实际应用。
简介
协同反应简介
介绍协同反应的定义和基本概 念。
加成和消除反应PPT课件(高等有机化学)

R2C CHR H X R2CCH2R X 有利
R2C
CHR H
X
X R2CHCHR
不利
R2CCH2R X
R2CHCHR X
当供电子基团与烯烃相连时:
Y
H
Cl C C H + Y
Cl C C H 或 Cl C C H
HH
HH (I)
YH (II)
形成的碳正离子和卤素的未共享电子对共轭,使
体系能量降低。
(3)共轭烯烃的加成反应
❖ 共轭烯烃的亲电加成也是朝形成相对稳定的中间体方向进行。
第一步反应,亲电试剂的亲电部分总是加到共轭链的一个末 端碳上,而不会加到共轭链的中间碳上。如1,3-丁二烯与 HCl反应:
CH2 CH CH CH2
CH2 CH CH
H2C CH CH CH2 + H+ 慢
H
(1)
× H2C CH CH CH2
(2) + Cl
H
(3)
快 CH2 CH CH CH2 + CH2 CH CH CH2
Cl H (4) Cl
H (5)
CH2 H (2)
❖ 第一步慢反应是H+或HCl分子的δ+ 端进攻共轭体系的末端碳 原子生成(2),而不是进攻共轭体系中间碳原子生成(3)。 因为碳正离子(2)比(3)稳定容易生成。第二步快反应是 碳正离子(2)与
影响反应机理的因素,消除反应的定向; E2反应中的立体化学(重点和难点)。 4、了解其它消除反应
二、教学课时: 2
一、亲电加成反应机理
(1)环正离子中间体(反式加成)
E
+
C=C
+ E+Y -
有机化学ppt课件完整版

氨基酸、蛋白质和多肽
氨基酸
构成蛋白质的基本单元,分为必需氨基酸和非必 需氨基酸。
蛋白质
由氨基酸通过肽键连接而成的高分子化合物,具 有多种生物功能。
多肽
由多个氨基酸通过肽键连接而成的化合物,生物 活性多样,包括激素、生长因子等。
脂类化合物
脂肪酸
构成脂肪的基本单元,分为饱和脂肪酸和不饱和脂肪酸。
甘油酯
原理。
现代时期
20世纪至今,以量子力学和统计 力学为基础,发展出了现代有机 化学的理论和方法,如分子轨道 理论、价键理论、反应机理理论
等。
有机化学与生产生活的关系
材料领域
合成纤维、塑料、橡胶等高分子材料广泛应用于服装、家 居用品、交通工具等领域。
医药领域
合成药物如抗生素、抗癌药物等对于治疗疾病具有重要意 义。同时,天然药物中提取的有效成分也是有机化学的研 究对象。
炔烃
炔烃的通式与结构特点
通式为CnH2n-2,含有碳碳三键。
炔烃的物理性质
与烷烃和烯烃相比,炔烃的物理性质有所不同。
炔烃的化学性质
主要包括加成反应、氧化反应、聚合反应等,与烯烃类似但也有所 不同。
芳香烃
01
02
03
04
芳香烃的结构特点
含有苯环或其他芳香体系的烃 类化合物。
芳香烃的分类
根据苯环上取代基的不同,可 分为苯、甲苯、二甲苯等。
感谢观看
01
分子式相同但连接方式不同,如正丁烷和异丁烷。
立体异构
02
分子式相同、连接方式也相同,但空间构型不同,如顺反异构
、对映异构等。
同分异构体的性质差异
03
由于结构上的差异,同分异构体在物理性质、化学性质以及生
高教版 有机化学 第十五章 周环反应 课件ppt

H CH3 H CH3
CH3
△
对旋
顺旋
HH CH3
6
(Z,E)-2,4-hexadiene
H
hv
对旋
H
H
H
△
H
80℃
顺旋
H
7
(乙)4n+2个π电子体系
CH3 H CH3 H
(Z,Z,E)-2,4,6-octatriene
△
CH3 H
H CH3
CH3 h ν
顺旋
对旋
H H CH3
CH3
CH3 H H CH3
N Ph N H COOR Ph
+
-
顺丁烯二酸酯
H ROOC
Ph C N NPh
Ph
+
-
N N Ph
反丁烯二酸酯
H ROOC
COOR H 30
对于某些1,3-偶极分子,当顺式加成按不 同方向时,生成两种异构体。
Ph H
H Ph H MeOOC N N H COOMe
C N N
-
+
H C C MeOOC
35
(甲)[1,n]移位反应
3 4
CH 2 [1,5] 氢移位 H △ CD 2
5
2 1
CD2H
CH3 C9H17
CH3 C9H17 7 H2CH 6 5 4 1 2 3
[1,7] 氢移位 HO
H2CH
HO
36
1
3 2 OAc H
1,3碳移位
D
CH3 2 CH3 1 5
300 C
CH 3
ψ
2
HOMO (顺旋成键)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.③④
B.①③⑤
C.②④ D.①③
有机化学中取代反应范畴很广。
下列反应中,属于取代反应范畴的是(AB)
A.CH3CH2OH+HBr CH3CH2Br+H2O
B.2CH3CH2OH CH3CH2OCH2CH3
+H2O
C.CH3CH2OH
CH2=CH2+H2O
D.2CH3CH2OH 2CH3CHO+2H2O
强调 某个有机物脱掉小分子,并形成不
饱和键即发生了消去反应
讲解
• 消去反应的产物与试剂类型紧密相关: 醇脱水制烯烃时用浓硫酸、氧化铝;卤 代烷脱去卤化氢时用NaOH或KOH的醇 溶液等碱性试剂;由邻二卤代烷脱去卤 素单质是用金属锌。
• 这是需要记忆的内容。
练习
• 写出下列转化所需试剂
C H 2— C H 3 B r
•
13、知人者智,自知者明。胜人者有 力,自 胜者强 。2021/3/32021/3/32021/3/32021/3/33/3/2021
•
14、意志坚强的人能把世界放在手中 像泥块 一样任 意揉捏 。2021年3月3日星期 三2021/3/32021/3/32021/3/3
•
15、最具挑战性的挑战莫过于提升自 我。。2021年3月2021/3/32021/3/32021/3/33/3/2021
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/3/32021/3/32021/3/33/3/2021 3:26:08 PM
•
11、越是没有本领的就越加自命不凡 。2021/3/32021/3/32021/3/3M ar-213- Mar-21
•
12、越是无能的人,越喜欢挑剔别人 的错儿 。2021/3/32021/3/32021/3/3Wednesday, March 03, 2021
B r
•讲解:根据以上反应可知, 利用醇或卤代烃等的消去反应可以在碳链上引入双键、 叁键等不饱和键。
二、有机化学中的氧化反应和还原反应
1、氧化反应 (1)定义:有机化合物分子中增加氧原子或减少氢原 的反应称为氧化反应。
(2)举例:2CH3CHO + O2 → 2CH3COOH 知识归纳:常见的氧化反应;
2CH3CH2OH + O2 → 2CH3CHO + 2H2O
—CH3 → —COOH
CH3CH=CH2 → CH3COOH + CO2
(3)醇发生氧化反应对分子结构的要求。 (4)有机反应中常见的氧化剂
氧气、高锰酸钾溶液、银氨溶液、臭氧、 新制氢氧化铜悬浊液等
2、还原反应 (1)定义:有机化合物分子中增加氢子或减 少氧原子的反应称为还原反应。
•
16、业余生活要有意义,不要越轨。2021/3/32021/3/3Marc h 3, 2021
•
17、一个人即使已登上顶峰,也仍要 自强不 息。2021/3/32021/3/32021/3/32021/3/3
谢谢观赏
You made my day!
我们,还在路上……
C H 2 C H 2浓 17硫 0。 酸 CC H 2 C H 2 +H 2O H O H
思考
• 以下反应是否为消去反应?
C H 3 — C H — C H 3N a O H /C 2 H 5 O H C H 2C H — C H 3+ H C l C l
C H 3 — C H — C H 3 + N a O H 乙 醇 C H 2 C H — C H 3 + N a C l+ H 2 O C l
第二章 第1节 有机化学反应类型
复习回顾:
请写出CH3—CH=CH2 、Cl2、H2O、 NaOH 等原料生成甘油的有关反应。
学习目标
1、从有机物的结构特征、常用试剂、反应特 征理解消去反应。
2、能够根据有机化学反应中碳原子的氧化数 是否变化以及加氧去氢、加氢去氧的角度 判断是氧化反应还是还原反应。
3、熟悉并判断主要有机反应类型。
设疑
• 乙烯的产量是一个国家石油化工水平的重 要标志,阅读课本实验室制取乙烯的反应。 此反应属于什么有机反应类型呢?
CH 2 CH 2浓 17硫 0。 酸 CCH 2 CH 2 +H 2O H O H
消去反应
讲授新课 ——三、消去反应
• 定义 :在一定条件下,有机化合物脱去 小分子物质(如H2O、HBr等)生成分子 中有双键或叁键的化合物的反应。
作业:
• 下面的反应都属于取代反应(不同于置换反应), 分别举个例子
• (1)卤代 • (2)硝化 • (3)磺化 • (4)卤代烃水解 • (5)醇与HX反应 • (6)酯化 • (7)酯的水解
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/3/32021/3/3Wednesday, March 03, 2021
( N aO H/C ) 2H H 5O 2 C HC H 2+ H B r
Z n C H 3 — C H — C H — C H 3( B r B r
) C H 3 — C HC H — C H 3
C H 3 — O C H H — B C rH — C H 3( 浓H2SO4) C H 3 — C HC — C H 3
(2)举例:CH3CHO + H2 → CH3CH2OH
(3)有机反应中常见的还原剂
氢气、氢化铝锂、硼氢化钠等
.有机物①CH2OH(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CH-CH2OH ④ CH2=CH-COOCH3 ⑤CH2=CH-COOH中 ,既能发生加成反应、酯化反应,又能 发生氧化反应的是(B)
