糖蛋白合成位置
糖蛋白与蛋白聚糖

➢ O-GlcNAc糖基化蛋白质的解离需要特异性 的 β-N- 乙 酰 氨 基 葡 萄 糖 酶 (O-GlcNAcase) 作 用,O-GlcNAc糖基化与去糖基化是个动态 可逆的过程。
➢ O-GlcNAc 糖 基 化 位 点 常 位 于 蛋 白 质 Ser/Thr磷酸化位点处或其邻近部位。糖基 化后即会影响磷酸化的进行,反之亦然。
➢ 蛋白聚糖的结构
核心蛋白 糖胺聚糖
糖胺
葡萄糖胺 半乳糖胺
糖醛酸
葡萄糖醛酸 艾杜糖醛酸
一、糖胺聚糖
糖胺聚糖(glycosaminoglycan, GAG)是 由己糖胺和己糖醛酸构成的重复二糖单位。
体内重要的糖胺聚糖(6种): • 硫酸软骨素类(chordroitin sulfates) • 硫酸皮肤素(dermatan sulfate) • 硫酸角质素(keratan sulfate) • 透明质酸(hyaluronic acid) • 肝素(heparin)和硫酸类肝素(heparan sulfate)
注意:糖基必须活化为UDP或GDP的衍生物
长萜醇-P-P聚糖的合成
3型N-聚糖的加工过程
复杂型
(三)O-连接糖蛋白
定义 糖蛋白聚糖中的N-乙酰半乳糖胺与
蛋白部分的丝/苏氨酸残基的羟基相连, 称为O-连接糖蛋白。
O-连接聚糖结构 由N-乙酰半乳糖胺和半乳糖构成核心
二糖,核心二糖可重复延长及分支,再接 上岩藻糖、N-乙酰葡萄糖胺等单糖。
细胞外由纤维状胶原、透明质酸、蛋白 聚糖和糖蛋白以不同比例组成的细胞间质。
分布在各组织细胞和细胞间的胞间隙或 胞间膜。
➢ ECM的主要成分:
① 结构蛋白,如:胶原 (collagen) ② 专一蛋白,如:纤连蛋白 (fibronectin, Fn)、
植物细胞高尔基体的作用与动物细胞一样吗

植物细胞高尔基体的作用与动物细胞一样吗植物细胞生物学的研究虽不及动物细胞生物学研究深入和成熟,但现有的工作已初步揭示了高尔基体在某些植物细胞中不参与糖蛋白的合成与运输。
最有力的证据是简令成等利用检测糖蛋白的分子探针ConA(伴刀豆球蛋白)标记冬小麦幼叶细胞糖蛋白的研究。
他们的结果表明:细胞中标志糖蛋白的标记反应物很明显地分布在质膜、内质网、核膜及液胞膜上,线粒体膜和质体膜上也有糖蛋白的分布,胞间连丝中普遍分布糖蛋白,而在高尔基体中仍然找不到糖蛋白的存在。
对高等植物腺细胞分化发育过程的研究结果表明,分泌物主要是蛋白质的细胞,以及分泌物中含有具识别作用糖蛋白的柱头细胞,在分泌盛期均无高尔基体参与分泌活动。
因此,可以推测:某些高等植物细胞内糖蛋白的生物合成地点和运输途径与动物细胞可能存在差异。
在植物细胞中,内质网腔中经糖基化的蛋白质可能不再输入高尔基体,而由内质网小泡直接输送到其他需要糖蛋白的部位。
在植物细胞的有丝分裂中,人们很早就注意到高尔基体分泌小泡与细胞板的形成有关。
随着研究的深入,已证实细胞壁中的非纤维素类多糖是由高尔基体合成和运输的。
在高尔基体的膜上已经发现了多种与多糖合成有关的酶,并且在植物细胞生命活动中,高尔基体在细胞壁形成时,活动旺盛。
此外,小麦体细胞胚发生的超微结构研究表明,小麦的早期胚性细胞中的细胞器主要是质体、核糖体、线粒体。
随着进一步发育,有细胞壁增厚的趋势,此时,细胞中出现了高尔基体和微管。
这些现象从侧面进一步证实了高尔基体在细胞壁形成中所发挥的重要作用。
19生物化学习题与解析糖蛋白、蛋白聚糖和细胞外基质

糖蛋白、蛋白聚糖和细胞外基质一、选择题〔一〕 A 型题1 .组成糖蛋白分子中聚糖的单糖不包括A .葡萄糖B .半乳糖C .甘露糖D .岩藻糖E .果糖2 .糖蛋白糖链合成场所为A .细胞膜B .细胞核C .细胞浆D .高尔基体与内质网E .溶酶体3 . N- 连接糖基化位点特定序列不行能是A . Asn-GLY-Ser/ThrB . Asn-Ala-Ser/ThrC . Asn-Val-Ser/ThrD . Asn-Leu-Ser/ThrE . Asn-Pro-Ser/Thr4 .不带有硫酸的糖胺聚糖是A .硫酸软骨素B .肝素C .硫酸角质素D .硫酸皮肤素E .透亮质酸5 .胶原中最多的氨基酸是A . SerB . ThrC . TyrD . GlyE . Val6 .细胞外基质中不含以下哪种蛋白A .胶原蛋白B .纤维蛋白C .蛋白聚糖D .纤连蛋白E .清蛋白7 .以下关于糖蛋白表达错误的选项是A .糖链所占分子的重量百分比一般在 2%—10%B .组成糖蛋白分子中聚糖的单糖有 7 种C .合成糖蛋白糖链必需有长萜醇参与D . N- 连接糖蛋白与 O- 连接糖蛋白合成的场所均是内质网和高尔基体E .糖链为分支糖链8 .以下关于蛋白聚糖的表达,错误的选项是A .蛋白聚糖由糖胺聚糖与核心蛋白共价连接B .蛋白聚糖分子中蛋白百分比小于聚糖C .蛋白聚糖分子中也含有 N- 或 O- 连接聚糖D .聚糖为直链型不分支E .先合成二糖单位,再延长糖链9 . N- 连接聚糖合成时所需糖基供体为A . UDP 或 GDP 衍生物B . UDP 或 CDP 衍生物C . ADP 或 GDP 衍生物D . TDP 或 GDP 衍生物E . ADP 或 TDP 衍生物10.胶原分子构造的表达错误的选项是A .结缔组织的主要蛋白质成分B .由 3 条右手α螺旋肽链合成C .分子组成中甘氨酸占 1 / 3D .三股螺旋的形成与脯氨酸和羟脯氨酸有关E .胶原中重复消灭的模序有 Gly-Pro- X11.以下有关纤连蛋白〔 Fn 〕的表达,错误的选项是A .血浆中 Fn 主要来自肝细胞B . Fn 为二聚体C . Fn 的一级构造由三种不同内在序列同源构造重复消灭而构成D . Fn 主要为 N- 连接糖蛋白E . Fn 对细胞的作用通过与胶原结合来完成12.以下关于层粘连蛋白〔 Ln 〕的表达错误的选项是A . Ln 是由三条多肽链通过盐键连接而成的B . Ln 是一种糖蛋白C .具有Ⅳ 型胶原结合的区域D .含有能与细胞外表受体结合的 RGD 模序E .主要存在于各组织的基底层〔二〕 B 型题A .长萜醇B .糖醛酸C .三股螺旋D .核心蛋白E .甘露糖1 .糖胺聚糖含有2 .蛋白聚糖含有3 .胶原蛋白含有4 .糖蛋白中聚糖的单糖有A .五糖核心B .核心蛋白C .核心二糖D .由葡萄糖和半乳糖构成的二糖单位E .甘油醛5 . N- 连接寡糖有6 . O- 连接寡糖有A .三股螺旋B .双螺旋C .二条多肽链D .三条多肽链E .一条多肽链7 .胶原蛋白含有8 .层粘连蛋白含有9 .纤连蛋白含有〔三〕 X 型题1 .胶原分子构造特点有A .含有三股右手螺旋B .甘氨酸占 1/3 、脯氨酸占 1/ 4C .无色氨酸D .半衰期短E .胶原中重复消灭的模序有 Gly-Pro- X2 .以下属于糖蛋白的有A .血型抗原B .凝血酶原C .胶原蛋白D .纤连蛋白E .层粘连蛋白3 .表达糖胺聚糖正确的选项是A .包括透亮质酸、肝素、硫酸软骨素B .由二糖单位重复连接而成C .与核心蛋白共价结合D .含有糖醛酸E .可分支二、是非题1.糖蛋白的聚糖主要有 N- 连接和 O- 连接型方式。
专题03 细胞的基本结构(解析版)

专题03 细胞的基本结构一、高考常考易错知识点总结易错点1 误认为植物细胞“系统的边界”是细胞壁点拨:植物细胞最外层是细胞壁,其主要成分是纤维素和果胶。
细胞壁不具有生命活性,而且是全透性的,因此植物细胞“系统的边界”是细胞膜而不是细胞壁。
易错点2 误认为所有生物膜均含糖蛋白点拨:糖蛋白只位于细胞膜的外侧,细胞器膜和细胞膜内侧不存在,可用于确定细胞膜内外的位置。
易错点3 错将“细胞代谢的控制中心”与“细胞代谢的中心”混淆点拨:细胞核是细胞代谢的控制中心,但不是细胞代谢的中心,因为细胞代谢的主要场所是细胞质基质。
易错点4 误认为核孔是随时敞开、大小分子都能进出的通道点拨:(1)核孔并非一个简单的通道而是由多种蛋白质组成的一个复杂而精细的结构,对进出核孔的物质具有严格的调控作用。
(2)物质进出细胞核并非都通过核孔。
核孔是大分子物质出入细胞核的通道。
易错点5 误认为不同细胞的细胞膜成分相同且一成不变点拨:(1)不同种类的细胞,细胞膜的成分及含量不完全相同,如动物细胞膜中含有一定量的胆固醇,而植物细胞膜中含量很少或没有。
(2)细胞膜的成分并不是不可变的。
例如,细胞癌变过程中,细胞膜的成分发生变化,糖蛋白含量下降。
易错点6 各种膜所含的蛋白质与脂质的比例同膜的功能有关点拨:功能越复杂的细胞膜,其蛋白质的种类和数量越多。
易错点7 混淆显微结构与亚显微结构点拨:(1)显微结构是光学显微镜下观察到的结构,如观察线粒体、叶绿体、液泡、细胞核、细胞壁,观察质壁分离与复原等。
(2)亚显微结构是指在电子显微镜下看到的结构——凡细胞中显示出线粒体内外膜、叶绿体内外膜及类囊体薄膜、核糖体、内质网、高尔基体、中心体、核膜等结构均属“亚显微结构”。
易错点8 误以为有细胞膜即为有“生物膜系统”点拨:生物膜系统是内质网、高尔基体、线粒体、叶绿体、溶酶体等细胞器膜和细胞膜、核膜等结构共同构成的细胞“膜系统”。
只有真核细胞才具备这样的生物膜系统,原核细胞只有细胞膜,没有核膜及各种细胞器膜,因而不具备生物膜系统。
糖蛋白

(3)Mucins have a high content of oLinked oligosaccharides and exhibit repeating amino acid sequences
三、生物合成
O-linked糖蛋白的生物合成 1. O-linked糖蛋白的生物合成 合成部位: ● 合成部位:内质网和高尔基器 ● O-Glycosylation 是在翻译后进行加工
O H
H
OH OH
GluNAc
Xyl
糖蛋白中糖的组成
糖蛋白多肽链常携带许多短的杂糖链。 糖蛋白多肽链常携带许多短的杂糖链 。 它们通常包括N 乙酰己糖胺和己糖( 它们通常包括N-乙酰己糖胺和己糖(常是 半乳糖和/或甘露糖) 半乳糖和/或甘露糖)。 该 链 末 端 成 员 常 常 是 唾 液 酸 (sialic acid)或 岩藻糖(L fucose)。 (Lacid)或L-岩藻糖(L-fucose)。 这种寡糖链常分支, 很少含多于15 15个单 这种寡糖链常分支 , 很少含多于 15 个单 体的,一般含2 10 10个单体 体的,一般含2—10个单体 糖链数目也变化很大。 糖链数目也变化很大。
Race: No predilection exists. Sex: I-cell disease is inherited as an autosomal recessive trait. Both sexes are affected equally. Age: Clinical manifestations can be present at birth or may present in the first few months of life.
56● figure 56-14
糖蛋白的作用

糖蛋白的感化含糖的蛋白质,由寡糖链与肽链中的必定氨基酸残基以糖苷键共价衔接而成.其重要生物学功效为细胞或分子的生物辨认,如卵子受精时精子需辨认卵子细胞膜上响应的糖蛋白.受体蛋白.肿瘤细胞概况抗原等亦均属糖蛋白.糖蛋白广泛消失于动物.植物及微生物中,种类繁多,功效广泛.可按消失方法分为三类:①可溶性糖蛋白,消失于细胞内液.各类体液及腔道腺体排泄的粘液中.血浆蛋白除白蛋白外皆为糖蛋白.可溶性糖蛋白包含酶(如核酸酶类.蛋白酶类.糖苷酶类).肽类激素(如绒毛膜促性腺激素.促黄体激素.促甲状腺素.促红细胞生成素).抗体.补体.以及某些发展因子.干扰素.抑素.凝聚素及毒素等.②膜联合糖蛋白,其肽链由疏水肽段及亲水肽段构成.疏水肽段可为一至数个,并经由过程疏水互相感化嵌入膜脂双层中.亲水肽段吐露于膜外.糖链衔接在亲水肽段并有严厉的偏向性.在质膜概况糖链一律朝外;在细胞内膜一般朝腔面.膜联合糖蛋白包含酶.受体.凝聚素及运载蛋白等.此类糖蛋白常介入细胞辨认,并可作为特定细胞或细胞在特定阶段的概况标记或概况抗原.③构造糖蛋白,为细胞外基质中的不溶性大分子糖蛋白,如胶原及各类非胶原糖蛋白(纤粘连蛋白.层粘连蛋白等).它们的功效不但仅是作为细胞外基质的结构成分起支撑.衔接及缓冲感化,更重要的是介入细胞的辨认.粘着及迁徙,并调控细胞的增殖及分化.寡糖链平日指由 2~10个单糖基借糖苷键连成的聚合体.糖蛋白的寡糖链多有分枝.因为单糖的端基碳(异头碳)原子有α.β两种构型,并且单糖分子中消失多个可形成糖苷键的羟基,是以,糖链构造的多样性超出多核苷酸及肽链.在糖链构造中可以贮存足够的辨认信息,从而在分子辨认及细胞辨认中起决议性感化.糖蛋白介入的心理功效包含凝血.免疫.排泄.内吞.物资转运.信息传递.神经传导.发展及分化的调节.细胞迁徙.细胞归巢.创伤修复及再生等.糖蛋白的糖链还介入保持其肽链处于有生物活性的自然构象及稳固肽链构造, 并付与全部糖蛋白分子以特定的理化性质(如润滑性.粘弹性.抗热掉活.抗蛋白酶水解及抗冻性等).糖蛋白与很多疾病如沾染.肿瘤.血汗管病.肝病.肾病.糖尿病以及某些遗传性疾病等的产生.成长有关.再者,细胞概况的糖蛋白及糖脂可“脱落”到四周情形或进入血轮回,它们可以作为平常的标记为临床诊断供给信息;患某些疾病时体液中的糖蛋白亦常有特异性或强或弱的转变,这可有助于诊断或预后的断定.糖蛋白还日益介入治疗.例如,针对特定细胞概况特异性糖构造的抗体可作为导向治疗药物的定向载体.应用糖类(单糖.寡糖或糖肽)抗沾染及抗肿瘤转移也已崭露头角.生物合成及降解糖蛋白的生物合成就蛋白质部分而言与一般排泄蛋白质雷同,在粗面内质网进行.糖链的生物合成在肽链延伸的同时和(或)以落后行.始于粗面内质网,经滑面内质网,完成于戈尔吉氏体,有的甚至在到达质膜后在那边最终完成.肽链的糖基化及糖链的延伸都在各类糖基转移酶的催化下进行.糖基转移酶有两个感化物.一个是活化情势的单糖,作为糖基的供体,另一个是肽链或寡糖链,作为糖基的接收体.糖基转移酶对供体及接收体皆有严厉的特异性.一种糖苷键由一种酶催化形成.糖链的构造及糖基分列次序无模板可循,而是由糖基转移酶的特异性(包含单糖基种类.端基碳构型.糖苷键衔接地位及接收体构造)及其感化的先后次序决议,是以是由基因经由过程糖基转移酶而间接掌握的,属于基因的次级产品.糖蛋白的降解可从糖链开端,亦可从肽链开端,糖蛋白肽链的降解同样是在各类蛋白水解酶的催化下进行的.糖链的水解由各类糖苷酶催化.糖苷酶分为外切及内切糖苷酸两大类.外切糖苷酶水解糖链非还原末尾的糖苷键,每次水解下一个单糖.这类糖苷酶重要消失于溶酶体中,介入糖蛋白.糖脂及蛋白聚糖的分化代谢.糖苷酶对于所水解的糖苷键及感化物的糖构造(有的不但请求必定的单糖,还请求必定的糖链构造)具有严厉的特异性.一条糖链的完整水解是在一系列糖苷酶依次感化下完成的,每种糖苷酶只能水解下来一个特定的单糖.假如缺乏一种糖苷酶,则下一步的糖苷水解被阻断,导致糖链水解不完整,而致分化代谢中央产品在细胞内聚积成为糖累积症.例如缺乏α-甘露糖苷酶或α-L岩藻糖苷酶可分离引起甘露糖苷或岩藻寡糖.糖肽的聚积.它们多为先本性酶缺掉所造成,属于遗传性疾病.血浆糖蛋白的降解在肝中进行,其非还原末尾唾液酸基直接掌握其消除率.内切糖苷酶可水解糖链中的糖苷键.常作为对象酶用于糖链构造的研讨.重要消失于微生物及植物中,动物组织中少见.其特异性十分严厉.除糖蛋白外,透明质酸及细菌壁胞壁酸的降解亦由内切糖苷酶(如透明质酸酶及溶菌酶)催化.生物学感化生物界种类繁多的糖蛋白履行着千差万此外生物学功效.如作为酶的糖蛋白催化体内的物资代谢;作为免疫分子的糖蛋白介入免疫进程;作为激素的糖蛋白介入体内心理.生物化学运动的调节等等.糖蛋白中糖链的生物学感化是研讨的热门,很多问题还未解释.大致可归纳为直接或间接介入生物学功效两种情形.直接介入生物学功效方面的感化与细胞或分子的生物辨认有关;间接感化则在于保持全部分子的自然构象,保持必定的活性寿期及决议理化特征等.糖蛋白糖链最奇特的生物学感化是介入生物辨认.细胞辨认无论对于个别产生照样成体性命运动的保持都具有决议性意义.例如,同种受精决议于精子概况和卵透明带糖蛋白糖构造的互相辨认.细胞概况糖蛋白还介入早期胚胎发育进程中内细胞团及滋养层的形成及随后组织.器官形成进程中同类细胞在辨认基本上所产生的集合.胚胎发育需万能细胞进行分化.通细致胞迁徙及生物辨认,雷同的细胞在必定部位集合成团,最后成长为特定的器官.这些进程依附于特异性的细胞辨认及选择性的细胞粘合.糖蛋白糖链是细胞辨认及粘合的分子根据.在构造多样的糖链中存贮着足够的各类辨认信息.克制糖蛋白糖链的生物合成则胚胎发育中断.在胚胎发育的不合阶段及细胞增殖的不合时相细胞概况糖蛋白不竭产生转变.某些细胞概况糖蛋白可以作为不合发育阶段或不合生涯状况的标记.例如,神经细胞粘合分子(N-CAM),是一种消失于细胞概况的质膜糖蛋白,其糖链含有多个唾液酸基.多唾液酸链随发育而缩短,至成年时代消掉.糖链中唾液酸的这些变更对不合时代细胞间的互相感化有必定调节意义. N-CAM可能在胚胎发育中对细胞间互相作器具有广泛性重要意义,对神经细胞间的突触接洽及神经—肌肉衔接的树立更具有特别重要感化.在若干恶性肿瘤细胞概况亦发明具有多唾液酸糖链的N-CAM.细胞归巢在造血.毁血及淋巴细胞再轮回中必不成缺.在血中轮回的造血干细胞(来自卵黄囊)需到骨髓中进行增殖.分化;淋巴细胞在血流及淋巴样器官(脾.淋凑趣及扁桃体)间保持再轮回.血循中造血干细胞及淋巴细胞的归巢都是通细致胞概况的受体(亦属于凝聚素)来认别靶组织中糖链上的糖基而进行.年轻红细胞“归巢”入脾是因为其概况的带Ⅲ糖蛋白糖链游离末尾的唾液酸基大为削减,导致次末尾的半乳糖基吐露.它可与免疫球蛋白G 联合,从而可被脾内的吞噬细胞辨认并内吞.至于致病微生物沾染寄主细胞亦必须起首粘附于靶细胞.微生物与靶细胞间的特异性粘合感化不但可以解释为沾染寄主的选择性,并且已有很多证据标明这种特异性粘合是由糖蛋白糖链介导的.还有一些粘合分子是细胞外的游离成分,由互相感化的细胞产生或由远处的某些细胞产生,排泄至细胞外并输送至细胞间.这些粘合分子作为桥梁介导细胞间的辨认及粘合.如出血时血小板的集合是由两种细胞外糖蛋白及其在血小板膜上响应的受体糖蛋白介导的辨认及粘合.这两种糖蛋白是血浆中的血小板反响蛋白及纤维蛋白原.它们彼此之间亦产生特异性辨认及联合,并为其糖构造所介导.糖链亦介入细胞与细胞外基质的粘着感化.细胞外基质的重要成分都是含糖的蛋白质,如胶原.非胶原糖蛋白及蛋白聚糖等.在各类细胞概况则分离消失着特异性联合必定基质成分的受体糖蛋白.这种联合是有选择性的.例如,上皮细胞与基膜中的Ⅳ型胶原.层粘连蛋白及硫酸乙酰肝素蛋白聚糖联合;成纤维细胞与Ⅰ或Ⅲ型胶原.纤粘连蛋白联合;软骨细胞与Ⅱ型胶原.软骨粘连蛋白及硫酸软骨素蛋白聚糖联合.细胞外基质成分对细胞的增殖.分化.形态.代谢及迁徙有决议感化.这对胚胎发育.细胞分化及创伤修复是十分症结的.例如,造血干细胞只有在适于它们增殖及分化的骨髓基质中才干进行造血进程.骨髓的体外长期造就亦必须为其供给响应的造血情形.细胞与细胞外基质之间借助于必定糖构造的联合,在恶性肿瘤细胞的转移进程中亦具有决议性感化.细胞与其外情形中可溶性糖蛋白(如激素.抑素.干扰素.抗体.发展因子.细胞因子.毒素等等)的感化不单对细胞的增殖.分化.代谢及功效产生深入影响,并且对保持全部机体内情形的稳固具有重要意义.已有一些试验证实某些可溶性糖蛋白与细胞的感化由糖链介导.糖蛋白激素在去除糖链后,则生物学活性损掉.迄今发明的20种血型体系中的 160多种血型抗原完整或重要由糖蛋白及糖脂的寡糖决议.A型.B型及 O型血者的抗原决议簇分离是α-D-N乙酰氨基半乳糖基. α-D半乳糖基及α-L岩藻糖基.组织相容性抗原亦为糖蛋白.其抗原特异性与糖链构造有关.糖链与免疫的关系日益受到看重.已发明补体系统可在无特异性抗体消失的情形下被必定的糖链构造活化.不单各类免疫球蛋白都是糖蛋白,其糖链构造反抗原-抗体联合的特异性有必定影响;并且很多免疫介质,如淋巴因子.单核因子.帮助因子.克制因子.活化因子.趋化因子.毒性因子.干扰素.白细胞介素等及其在免疫细胞概况的受体都是糖蛋白.很多证据标明糖链介入其互相辨认和联合.干扰素亦与靶细胞概况的糖构造相联合.凝聚素是广泛消失于动物.植物及微生物中的一类蛋白质,它由非免疫门路产生并特异地与必定糖构造相联合.很多凝聚素本身亦为糖蛋白.各类凝聚素辨认与联合糖构造的特异性强弱不等.必定的凝聚素可凝聚必定种类的细胞,并可选择性地刺激细胞的有丝决裂.凝聚素的上述感化可被特定的单糖或寡糖或糖肽克制.细胞概况的糖蛋白或糖脂在体外可被必定的外源性凝聚素辨认并联合,有人称之为凝聚素的受体.凝聚素即经由过程其多价性及细胞概况受体而引起细胞凝聚.凝聚素可消失于体液中及细胞概况.在各类原核细胞及真核细胞生物中发明的凝聚素已多达百余种.其生物学功效庞杂而多样.但根本感化都是对细胞或游离分子进行辨认.例如,在鼠.兔及人的肝细胞质膜中有辨认半乳糖的凝聚素(肝凝聚素).血浆中的蛋白质多为以唾液酸为非还原末尾的 N糖苷糖蛋白.去唾液酸后吐露出次末尾的半乳糖基,可敏捷被肝细胞经由过程肝凝聚素辨认而联合,进而引起内吞,从而将去唾液酸血浆糖蛋白摄取,从血中消除并在溶酶体中降解.乃至其半寿期缩短至若干分钟.轻微肝炎.肝硬变及肝癌的组织中缺乏肝凝聚素,从而导致血中去唾液酸糖蛋白的聚积.别的,在肾.肠上皮,甲状腺及骨髓细胞概况亦发明联合半乳糖的凝聚素.在肝库普弗氏细胞及脾.肺巨噬细胞概况消失辨认和联合甘露糖及乙酰氨基葡萄糖的凝聚素.这些细胞概况凝聚素一旦与响应配体联合即可引起内吞,内吞后配体在溶酶体中被消化.而凝聚素本身可再轮回至细胞概况.糖蛋白糖链对引诱在粗面内质网合成的蛋白质到达预定部位有决议性感化.很多排泄蛋白质必须经由糖基化才干排泄到细胞外.若糖基化被阻断则不克不及排泄出去.溶酶体的各类水解酶在内质网及戈尔吉氏体合成后分散在初级溶酶体内,这亦由其糖链决议.所有各类溶酶体酶,除组织蛋白酶B1外,都是高甘露糖型糖蛋白,其某些甘露糖基产生6位磷酸化.这些带有[6]磷酸甘露糖(Man-6-P) 标记的溶酶体酶与定位在戈尔吉氏体膜腔面必定部位的受体相联合.这些受体现实上是特异性辨认Man-6-P 的凝聚素.经由过程这些分散散布在必定膜区的受体带有M-6-P标记的溶酶体酶被分散起来,再经由过程该膜区的发泡,从戈尔吉氏体形成膜内面挂着全套溶酶体酶的初级溶酶体.溶酶体膜含有高度糖基化(每条肽链上带10余条糖链)的糖蛋白,其糖链富含唾液酸,并朝向腔面.这些糖蛋白糖链不单可以防止溶酶体膜被溶酶体内的水解酶降解损坏,并且可以在溶酶体腔面形成低pH值情形,使溶酶体酶与膜受体的联合减弱,然后溶酶体酶的糖链产生脱磷酸.因为脱磷酸去除了可被膜受体识此外标记,各类水解酶遂游离于溶酶体囊腔内.当初级溶酶体与内吞泡融会后溶酶体酶即可水解经内吞进入细胞的大分子及细胞.组织碎屑.此外,在细胞概况亦消失特异性辨认Man-6-P的受体.可将排泄至细胞外的溶酶体酶结归并内化收受接管.细胞概况辨认 Man-6-P的受体只占细胞总受体量的10%,其余90%消失于溶酶体.戈尔吉氏体及内质网.人类罹患的一种罕见病,I-细胞(inclusion-cell)病系在细胞内聚积大量的高分子量糖复合物,可造成早天.其缺点主如果缺乏UDP-N乙酰氨基葡萄糖基转移酶,因而溶酶体酶缺乏Man-6-P标记.乃至其各类溶酶体水解酶不消失于溶酶体内而被排泄至细胞外.其溶酶体膜及细胞概况虽消失正常的辨认 Man-6-P的受体,却不克不及将自身的溶酶体酶按正常路线输送.但可将外源性正常的带标记的溶酶体酶收受接管并运至溶酶体.植物凝聚素常有不合程度的细胞毒性.毒性强的凝聚素有蓖麻毒素.相思豆毒素等.它们都辨认并联合含半乳糖的糖链.这些毒素由 A.B两个亚单位构成.B亚单位与细胞概况的糖基联合,A 亚单位进入胞质与核糖核蛋白体联合从而克制蛋白质生物合成,其感化道理相似于酶的催化感化,催化核蛋白体因子掉活.胞质中只需几个分子细胞毒凝聚素即可完整阻断蛋白质的合成.因而仅少少量即可置人于逝世地.将细胞毒凝聚素与抗肿瘤细胞的特异性抗体偶联,可定向杀伤体内的肿瘤细胞.有些糖蛋白的糖链本身并没有直接的生物学功效.而可对肽链的加工及其构象施以掌握.一些多肽或蛋白质以伟大的前体情势在细胞内合成,然后被特异性蛋白酶水解释出成熟的有生物活性的分子,例如垂体的一些激素是以前体的情势生成的.前体上的糖链可掌握其在恰当的部位被蛋白酶水解,从而有用地产生生物活性成分.再如,若克制前胶原的糖链合成,则不克不及生成胶原.糖链又可以掌握肽链的折迭及稳固肽链的自然构象,去除糖链则某一区域的构象转变,影响其生物学活性.如免疫球蛋白G(IgG)去除糖链则与抗原联合的构象转变.此外,糖链还决议糖蛋白分子的理化性质,使其具有:①抗蛋白酶水解性,使糖蛋白分子在体内可保持必定的寿期.蛋白酶的糖链可呵护其肽链不被自家水解而保持催化活气.体液中的糖蛋白糖链可呵护其不至敏捷被体液中的各类蛋白酶水解而在必定的时代内保持其生物活性.很多种生物活性分子,如酶属此类.粘液中的糖蛋白糖链在呵护其自身不被水解的同时亦呵护了粘膜上皮细胞.②稳固性,不轻易产生热变性及冻融变性.③抗冻性,南极鱼的抗冻糖蛋白的密集式糖单位可防止冰晶形成而使鱼体在深低温海域不冻结.此外,粘液及滑液中的糖蛋白因为消失大量唾液酸化或硫酸化糖链而带有很多负电荷,乃至分子呈伸展状况并具有强亲水性,成为具有粘弹性的物资,起润滑呵护感化.糖蛋白分子的聚合才能亦为糖键所阁下.糖蛋白与肿瘤在肿瘤产生及成长(侵袭.转移)进程中细胞概况.细胞外基质及体液中的糖蛋白都有明显变更;克制体外造就的癌细胞的糖链合成,即可克制其在体内的试验性转移.尚未发明为一切肿瘤细胞所共有,而不为正常组织所有的肿瘤配合抗原,但已在很多种肿瘤组织细胞中发明为某种肿瘤所特有而不为响应正常分化组织所具有的肿瘤相干抗原.这些抗原常为在响应正常组织胚胎细胞一时性表达的糖蛋白.例如,癌胚抗原 (CEA)是分子量200KDd的糖脂蛋白质含糖50~60%.它消失于正常胎儿胃肠组织及消化道腺癌细胞概况,并可脱落进入血流,从而早期胃肠癌.胰腺癌.乳腺癌患者血中CEA含量即可升高.再如,甲胎蛋白(AFP)为分子量70KDa的糖蛋白.由胚胎的卵黄囊.肝及胃肠合成,是胎儿血中的重要蛋白质;70%的畸胎瘤及肝细胞癌患者血中AFP升高.肿瘤细胞概况的糖蛋白可全部地或部分地脱落,进入血轮回.是以可用于临床诊断及病情监测.这些脱落成分亦可中和寄主血中的抗体,减弱寄主机体的抗肿瘤才能.。
第十九章:糖蛋白

2 .N-连接寡糖结构 N-连接寡糖可分为三型;
①高甘露糖型
②复杂型
③杂合型:这三型 N-连接寡糖都有一个五糖核心,高甘露糖型在核
心五糖上连接了 2-9 个甘露糖,复杂型在核心五糖上可连接入 3、4
或 5 个分支糖链,宛如天线状,天线末端常连有 N-乙酰神经氨酸。
杂合型则共有二者的结构。
(二)O-连接糖蛋白
胶原蛋白由 3 条肽链以α 右手螺旋形成棒状结构。
富含甘氨酸(占 1/3)和脯氨酸(占 1/4),特含有羟赖氨酸和羟脯氨
酸,缺色氨酸和半胱氨酸,甚少酪氨酸。
三.纤连蛋白
定义
5 分钟
广泛存在于细胞外基质、基底膜和各种体液中的一种多功能糖蛋
白。多为二聚体形式,也有多聚体形式。
分布
细胞外基质、基底膜和各种体液。
教学内容 第十九章 糖蛋白、蛋白聚糖和细胞外基质
时间
大多数真核细胞都能合成一定类型的糖蛋白和蛋白聚糖,它们分 布于细胞表面、细胞内分泌颗粒和细胞核内,也可被分泌出细胞,构 成细胞外基质成分。糖蛋白和蛋白聚糖都由共价键相连接的蛋白质和 糖两部分组成。糖蛋白分子中的蛋白质重量百分比大于糖,而蛋白聚 10 分钟 糖中多糖链所占重量在一半以上,甚至高达 95%,两者的糖链结构也 不同。因此糖蛋白和蛋白聚糖在合成途径和功能上存在显著差异。
岩藻糖、N-乙酰葡萄糖胺等单糖。
二、糖蛋白寡糖链的功能
20 分钟
许多执行不同功能的蛋白质都是糖蛋白,糖蛋白中的寡糖链不但
能影响蛋白部分的构象、聚合、溶解及降解还参与糖蛋白的不能取代的。
(一)寡糖链对新生肽链的影响
1.不少糖蛋白的 N-连接寡糖链参与新生肽链的折叠并维持蛋白
共价连接到核心蛋白的多肽链上。
糖蛋白结构及作用

糖蛋白结构及作用糖蛋白是一种由糖基和蛋白质组成的复合物,广泛存在于细胞膜上和细胞外基质中。
它在细胞识别、信号转导、细胞黏附等生物学过程中起着重要作用。
糖蛋白的结构非常复杂多样,其糖基可以分为两类:O-糖和N-糖。
O-糖是通过O-糖基转移酶将糖基转移至蛋白质上形成的;而N-糖则是通过N-糖基转移酶将糖基转移至蛋白质上形成的。
这些糖基可以单独连接在蛋白质上,也可以以复杂的方式连接在一起形成多糖链。
糖蛋白的作用主要体现在以下几个方面:1. 细胞识别和黏附:糖蛋白通过其独特的糖基结构,与其他细胞或分子进行特异性的识别和黏附。
细胞表面的糖蛋白可以通过与配体结合,介导细胞间的相互作用和黏附,从而参与细胞迁移、细胞信号传递等重要生物学过程。
2. 细胞信号转导:糖蛋白可以作为细胞信号转导的重要分子参与进程。
例如,一些膜上糖蛋白可以通过其糖基结构与信号分子结合,激活特定的信号转导通路,进而调控细胞的生理和病理过程。
3. 免疫应答:糖蛋白在免疫应答中起着重要作用。
在免疫细胞表面,糖蛋白可以作为抗原的标志物,通过与免疫细胞表面的糖蛋白相互作用,激活免疫细胞,进而介导免疫应答。
4. 细胞外基质组织:糖蛋白是细胞外基质中的重要组成部分,参与形成和维持细胞外基质的结构和功能。
糖蛋白通过其独特的糖基结构,与其他细胞外基质分子相互作用,调控细胞外基质的合成、降解和重塑。
5. 药物靶点:由于糖蛋白在多种生物学过程中的重要作用,它们成为了药物研发的重要靶点。
通过针对糖蛋白的研究,可以开发出针对糖蛋白的抑制剂或激动剂,用于治疗与糖蛋白相关的疾病,如癌症、炎症和免疫系统疾病等。
总结起来,糖蛋白是一类重要的生物分子,其复杂的结构和多样的糖基使其具有丰富的功能。
糖蛋白通过参与细胞识别、信号转导、细胞黏附等生物学过程,调控细胞的生理和病理过程。
对糖蛋白的研究不仅有助于深入理解生命的基本过程,还为药物研发提供了新的思路和靶点。
02糖蛋白

病。
类风湿性关节炎患者血清IgG的N-聚糖链的种
类变化不大,但其Fc段N-聚糖链外链结构中的
末端Gal明显下降,从而使以GlcNAc为末端的 聚糖链比例增加,形成去半乳糖基的IgG亚型 IgG0,后者即可成为一种自身抗原。
IgA型肾病的典型病理改变是肾小球基底膜上
IgA1的单体和聚合体的大量沉积。
细胞信号转导、调节细胞粘附、维持或抑制细
胞生长等。
1. Molecular Structure of Proteoglycan 蛋白聚糖是由糖胺聚糖链与核心蛋白通过共价 键连接而成。
糖胺聚糖属于杂多糖类化合物,其典型的结构
特征是具有由氨基已糖与已糖醛酸或半乳糖
(Gal)交替排列形成的二糖重复单位。
⑴ 五糖核心结构:是一种共性结构,它由内侧
的两个GlcNAc和外侧的三个Man组成,称为 三甘露糖五糖核心。
Core Structure of Glycan with N-GlcNAc Linked Type
⑵ 外链结构:由连接在上述五糖核心外侧的糖基 构成。分为下列三型: ① 高甘露糖型:糖基全部由Man组成,可有
3.5 Glycoprotein and Malignant Neoplasm 恶性肿瘤细胞糖蛋白的聚糖链结构的改变是一 种普遍现象。其改变主要表现为: ① 天线数增加; ② 聚乳糖胺结构出现或增加; ③ 核心岩藻糖增加;
④ 出现偏二天线结构。
3.6 Glycoprotein and Autoimmune Disease 目前认为,类风湿性关节炎是一种与免疫球蛋 白IgG中N-聚糖链结构改变有关的自身免疫疾
1.2 Composition and Structure of Glycan in Glycoprotein 1.2.1 Glycan with O-GalNAc Linked Type
糖蛋白基本组成单位

糖蛋白基本组成单位糖蛋白是具有丰富的机械性质的一种蛋白质,是多肽链结构的重要组成部分。
它以氨基酸为基本单位构成,其中有八种氨基酸是必需的。
这八种氨基酸又称为“终止氨基酸”,即亮氨酸(Leu)、苏氨酸(Ser)、缬氨酸(Val)、精氨酸(Thr)、缠氨酸(Pro)、苯丙氨酸(Phe)、异亮氨酸(Ile)和脯氨酸(Met)。
糖蛋白是一种特殊的多肽链蛋白质,具有丰富的机械性质,可以帮助细胞和组织结构稳定,而且在许多生理过程中也发挥着重要作用。
糖蛋白的结构非常复杂,它是由多种均衡分子组成,每个分子都含有完整的肽链,由多种氨基酸组成的多肽链是糖蛋白的基本构造单元。
首先,其中有八种氨基酸是必需的,即亮氨酸、苏氨酸、缬氨酸、精氨酸、缠氨酸、苯丙氨酸、异亮氨酸和脯氨酸,它们共同构成了糖蛋白的基本单位。
其它一些氨基酸多是可选的,它们可以在糖蛋白的亚基中扮演重要的角色,例如终止氨基酸可以使糖蛋白的结构更加稳定,减少蛋白质的分解和合成,而非终止氨基酸(如甘氨酸)则可以增加蛋白质的活性。
此外,糖蛋白的基本单位还包括多种其它的单元,如抗原单位(hydrophobic residues),它们出现在糖蛋白的表面,可以结合蛋白质相互作用;另外,总抗原单位(antigenic determinants)也可能出现在表面,可以促进细胞与外界环境的免疫交互作用。
最后,还有一些特殊的抗原单位,如糖基化抗原单位(glycosylated antigenic determinants)和全氟化抗原单位(perfluorinatedantigenic determinants),它们可以促进细胞与外界分子的结合,从而发挥信号传导的作用。
因此,糖蛋白的基本组成单位包括亮氨酸、苏氨酸、缬氨酸、精氨酸、缠氨酸、苯丙氨酸、异亮氨酸和脯氨酸等八种必需氨基酸以及可选的非终止氨基酸,它们以多肽链的形式构成复杂的结构,而这些结构单元又包含了抗原单位、糖基化抗原单位和全氟化抗原单位等结构,它们可以参与细胞与外界环境的免疫反应,从而发挥重要的作用。
细胞合成的糖蛋白并不都是位于细胞膜的外表面

2016上饶二模试题1、元素和化合物是细胞结构和功能的物质基础,下列关于细胞化学组成的叙述,正确的是①ATP脱氧核苷酸线粒体外膜共有的组成元素是CHONP②细胞合成的糖蛋白均位于细胞膜的外表面,与细胞间相互识别有关③酶激素ATP和神经递质等都是细胞中的微量高效物质,作用后都立即被分解④蛋白质遇高温变性时,其空间结构被破坏,肽键数不变⑤叶肉细胞内的[H]都在光反应阶段产生,用于暗反应A、①②B、②③C、①④D、③⑤答案:C解析:细胞合成的糖蛋白不全分布在细胞膜的外表面,组织液及血浆中也有糖蛋白,酶作用后不是立即被分解的,叶肉细胞内的【H】有叶绿体光反应阶段产生的,也有氧呼吸过程中在细胞质基质及线粒体基质中产生的。
链接:1、糖蛋白是广泛存在于生物体内的由肽链和糖链通过共价键结合而形成的大分子。
糖蛋白包括酶、激素、载体、凝集素、抗体、糖被等。
糖蛋白通常分泌到体液中或定位于细胞膜外。
人血清的各类蛋白质中,50%是糖蛋白;鸡蛋蛋清的各类蛋白质中,95%以上是糖蛋白。
各类细胞表面上,大多存在着糖蛋白。
动、植物的分泌物和体液中有较多的糖蛋白。
顶体中也含糖蛋白。
2、组织液中也有糖蛋白。
组织液存在于组织间隙,绝大部分组织液呈凝胶状态,不能自由流动,因此不会因重力作用流到身体的低垂部位。
组织液包括基质和从毛细血管渗出的不含大分子的物质的黏性液体,基质是一种无色透明的胶状物质,化学成分主要是蛋白多糖、糖蛋白和水。
蛋白多糖是基质的主要成分,由少量蛋白质和大量氨基已糖多糖结合成的大分子复物,每个蛋白亚单位以蛋白质分子为轴心,共价地结合上许多多糖侧链。
3、处于细胞表面最外层的糖蛋白(糖被)的糖链储存着大量的生物识别信息,在细胞识别与粘合上有非常重要的作用。
细胞表面的糖链依细胞类型、分化阶段、功能状态及行为特点而发生变化。
细胞在发生恶性转化后,其表面的糖链亦发生显著变化,而这一变化在高转移性癌细胞中是有一定特点的。
在很多肿瘤中,细胞表面的多聚氨基乳糖结构的含量有明显增加。
1. 简述糖蛋白的n-连接寡糖链的结构及合成过程

1. 简述糖蛋白的n-连接寡糖链的结构及合成过程
摘要:
1.糖蛋白简介
2.N-连接寡糖链的结构
3.N-连接寡糖链的合成过程
4.总结
正文:
糖蛋白是一种具有糖基化修饰的蛋白质,广泛存在于细胞表面和分泌蛋白中。
糖蛋白的功能复杂,与其糖基化修饰密切相关。
在糖蛋白中,N-连接的寡糖链发挥着重要作用。
-连接寡糖链位于糖蛋白的蛋白质部分,其结构多样且具有高度异质性。
这些寡糖链由多个单糖分子通过糖苷键连接而成,其中最常见的是天冬酰胺(Asn)残基与糖基的连接。
在糖蛋白的合成过程中,N-连接寡糖链的生成是一个关键步骤。
-连接寡糖链的合成过程主要发生在内质网和高尔基体中。
首先,在核糖体上合成蛋白质时,天冬酰胺(Asn)残基与糖基转移酶作用,形成N-连接的寡糖链。
随后,这些寡糖链经过一系列糖基化修饰,如糖苷酶和糖基转移酶的作用,生成具有特定结构的寡糖链。
最后,糖蛋白经过高尔基体的加工和修饰,成熟为具有生物学功能的糖蛋白。
总之,糖蛋白中的N-连接寡糖链是在内质网和高尔基体中合成完成的。
这些寡糖链对糖蛋白的功能具有重要意义,如细胞识别、信号传导和分子间相互
作用等。
糖蛋白的合成途径

糖蛋白的合成途径
1. 翻译:
糖蛋白的合成起始于mRNA的转录,之后通过翻译作用转换
为蛋白质。
mRNA被核糖体识别并结合到细胞质中的核糖体上。
然后,tRNA中的氨基酸与mRNA上的密码子相互匹配,形成肽键,逐渐构建多肽链。
2. 糖基化:
在翻译完成后,多肽链可能会经过一系列糖基化修饰。
这些修饰反应通常在内质网中进行。
糖基化是通过酶催化的反应,在多肽链的特定残基上与糖分子结合。
3. 修饰:
修饰是指在糖蛋白合成过程中,通过酶的作用在多肽链上引入各种功能性基团。
例如,糖酰转移酶可以在多肽链上将酰基(如乙酰基和甲酰基)加入。
4. 折叠和处理:
糖蛋白合成完成后,它需要在内质网中正确折叠和加工,以获得其功能形式。
这个过程涉及到蛋白质伴侣(如chaperones),帮助糖蛋白正确折叠。
随后,糖蛋白可能会经过进一步的修饰,如磷酸化、甲基化等。
5. 运输和定位:
已经合成和加工的糖蛋白需要被运输到其目标细胞器或细胞膜上。
这个过程涉及到分子伴侣和转运蛋白的作用,确保糖蛋白能够准确定位到正确的位置。
总的来说,糖蛋白的合成途径涉及到转录、翻译、翻译后修饰、折叠和处理、运输和定位等一系列复杂的过程。
这些过程都需要多种酶、蛋白质伴侣和转运蛋白的协同作用。
第十一章糖蛋白与蛋白聚糖

② N-聚糖分型(三型)
高(寡)甘露糖型( high-or oligo-mannose type ): 五糖核心以外的糖基全部是 Man。 复合型(complex type):天线(antenna)连接GlcNAc、 Gal和 SA(NeuAc)或Fuc组成。
杂合型(hybrid type): 一半分子似复杂型,另一半分 子似高甘露糖型。
糖复合物:如糖蛋白(glycoprotein)、蛋白聚糖(proteoglycan)、
糖脂(glycolipids)。糖脂不属于蛋白质,了解不多。
糖蛋白或蛋白多糖中的单糖
生物界已发现200多种单糖,但只有11种出现在糖蛋白或蛋 白多糖中。 己糖: 半乳糖(Gal)、葡萄糖(Glc)、甘露糖(Man) 脱羟己糖:L-岩藻糖(Fuc) 己糖衍生物:乙酰氨基葡萄糖(GlcNAc).乙酰氨基半乳糖(GalNAc 戊糖:木糖(Xyl)、L-阿拉伯糖(Ara)
⑵ ⑶ ⑷
唾液酸化Lea(sLea)
⑸
见于2型糖链
常见的唾液酸化三糖外链 H-2抗原 无Fucα1,2者为Lex血 型抗原,有者为Ley
唾液酸化Lex(sLex)
⑹ ⑺ ⑻ ⑼
⑽
只存在于灵长类以下哺乳动物 存在于少数糖蛋白外链
N-聚糖的外链(天线)结构类型
⑾ ⑿
④N-聚糖的种属、组织和糖基化位点差异
糖链都有分支,大多存在于血浆蛋白,故称血浆蛋白型聚糖, 但在细胞膜和胞质中也普遍存在,可和O-GalNAc并存于同一 肽链上。
糖基组成除GlcNAc外,尚有Gal和Man。酸性N-聚糖的末端有 SA,中性糖链则一般以Gal或Fuc为末端。 少数的N-糖链含GalNAc和末端硫酸基团。
N-糖基化位点:
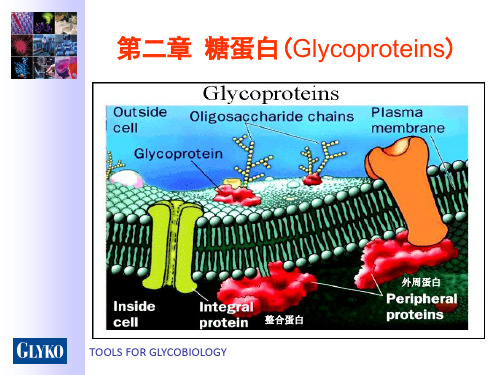
糖蛋白
TOOLS FOR GLYCOBIOLOGY
3、糖基的供体
游离单糖不能作为糖基转移酶所用的 糖基供体,一定要经过活化。 糖基供体,一定要经过活化。 常见的糖基活化方式有两种: 常见的糖基活化方式有两种: (1)核苷酸的形式 核苷酸的形式( (1)核苷酸的形式(UDP-GlcNAc) ) (2)磷酸长萜醇 磷酸长萜醇( (2)磷酸长萜醇(Dol-P)的形式 )
TOOLS FOR GLYCOBIOLOGY
(2)多萜醇寡糖前体向新生肽的转移 (2)多萜醇寡糖前体向新生肽的转移 多萜醇寡糖
寡糖基转移酶
TOOLS FOR GLYCOBIOLOGY
TOOLS FOR GLYCOBIOLOGY
(3) N-糖肽链的后加工 糖肽链的后加工
TOOLS FOR GLYCOBIOLOGY
TOOLS FOR GLYCOBIOLOGY
核心结构
高甘露糖型
复杂型
杂合型
N-连接糖链结构
TOOLS FOR GLYCOBIOLOGY
TOOLS FOR GLYCOBIOLOGY
实框内结构为所有N 糖链共同的核心五糖, 实框内结构为所有N-糖链共同的核心五糖,虚线框内结构为 高甘露糖型链共同的核心七糖。框外的结构随糖链而变化。 高甘露糖型链共同的核心七糖。框外的结构随糖链而变化。
TOOLS FOR GLYCOBIOLOGY
TOOLS FOR GLYCOBIOLOGY
第三节 糖蛋白的生物合成
一、概述 生物合成的特点 糖基的受体 糖基的供体 糖基转移酶
TOOLS FOR GLYCOBIOLOGY
1、生物合成的特点
糖链的生物合成和肽链、 糖链的生物合成和肽链、多聚核苷 酸的生物合成有本质的不同。 酸的生物合成有本质的不同。 肽链、 肽链、多聚核苷酸的生物合成基本 上都是有模板的, 上都是有模板的,而糖链的合成是 没有模板的, 没有模板的,糖涟的生物合成是由 糖基的受体、 糖基的受体、糖基的供体和糖基转 移酶这三类分子协调完成的。 移酶这三类分子协调完成的。
糖蛋白和糖肽的化学合成

未来的展望
发展高效合成方法
通过改进现有合成方法或开发新的合成策略,提高糖蛋白 和糖肽的合成效率。
01
拓展应用领域
随着糖蛋白和糖肽合成技术的发展,其 在药物开发、生物医学研究和疾病治疗 等领域的应用将进一步拓展。
02
03
加强跨学科合作
促进化学、生物学、医学等多学科的 交叉合作,共同推动糖蛋白和糖肽合 成领域的发展。
化学合成可以制备具有特定生物活性的糖蛋白和糖肽类似物或衍生物 ,用于药物开发和疾病治疗。
生物学研究
化学合成的糖蛋白和糖肽可用于研究生物体内的糖基化过程、糖基转 移酶的活性以及糖基化对蛋白质功能和细胞行为的影响。
工业生产
通过化学合成可以大规模制备具有特定功能的糖蛋白和糖肽,满足工 业生产的需要。
02
在材料科学领域的应用
生物材料表面修饰
通过化学合成方法在材料表面引入糖蛋白和糖肽,改善材 料的生物相容性和细胞亲和性,提高其在生物医学领域的 应用性能。
功能材料制备
利用糖蛋白和糖肽的特异性识别和结合能力,制备具有特 定功能的新型材料,如智能响应材料、生物分离材料等。
纳米材料制备
通过化学合成方法将糖蛋白和糖肽与纳米材料相结合,制 备具有优异性能的纳米复合材料,应用于药物传递、生物 成像等领域。
组合化学策略
糖基供体的设计与合成
01
设计并合成具有不同结构特点和反应活性的糖基供体,为组合
化学合成提供丰富的原料。
糖基化反应条件的优化
02
通过调整反应温度、pH值、溶剂等条件,提高糖基化反应的效
率和选择性。
自动化合成平台的建立
03
利用自动化合成平台,实现糖蛋白或糖肽的高效、快速合成。
细菌胞外糖蛋白合成阶段

细菌胞外糖蛋白合成阶段
细菌胞外糖蛋白的合成是一个复杂的过程,涉及多个阶段。
首先,在细菌细胞内,糖蛋白的合成通常开始于核糖体上的mRNA,这
些mRNA编码了糖蛋白的氨基酸序列。
随后,这些氨基酸序列被翻译
成蛋白质,并经过一系列后续修饰。
在这个过程中,信号肽通常会
指导新合成的蛋白质通过细胞膜,进入胞外空间。
一旦糖蛋白进入胞外空间,它们可能会经历一系列后续修饰,
包括糖基化。
糖基化是一种常见的修饰方式,可以增加蛋白质的稳
定性和功能。
在这个阶段,糖蛋白的糖链可能会被修饰,形成最终
的成熟糖蛋白结构。
除了糖基化之外,糖蛋白的合成阶段还可能涉及其他后续修饰,比如蛋白质的折叠和硫键的形成。
这些后续修饰可以影响糖蛋白的
最终结构和功能。
总的来说,细菌胞外糖蛋白的合成阶段涉及翻译、信号肽导向、后续修饰(包括糖基化和其他修饰)等多个步骤。
这些步骤共同确
保了糖蛋白在胞外空间中的正确结构和功能。
糖蛋白的合成

糖蛋白的合成嘿,朋友们!今天咱就来讲讲糖蛋白的合成,这可真是个神奇又有趣的事儿呢!你看啊,细胞就像一个超级大工厂,里面有各种各样的机器和工人在忙碌着。
而糖蛋白呢,就是这个工厂要生产出来的重要“产品”。
要合成糖蛋白,首先得有蛋白质这个“主角”呀。
蛋白质就像是盖房子的砖头,是基础呢!它在细胞这个大工厂里被制造出来,然后就等着被加工啦。
接着呢,就好像给砖头刷上漂亮的颜色一样,糖链要被连接到蛋白质上啦。
这可不是随便连的哦,得有专门的“工人”来操作。
这些“工人”就是酶啦,它们可厉害着呢,能准确地把糖链接到蛋白质的特定位置上。
这就好像是给一个雕塑精心雕琢细节一样,一点点地让糖蛋白变得完美。
而且哦,这个过程可不能出错,一旦出错,那可就麻烦啦,就像雕塑雕坏了一块,多难看呀!你说细胞咋这么聪明呢,能把这么复杂的事儿干得有条不紊的。
糖蛋白合成好了之后,可不是就摆在那里好看的哦,它们有大用处呢!它们就像是细胞的“小助手”,可以帮助细胞识别其他细胞或者物质。
想象一下,细胞的世界里,如果没有糖蛋白来帮忙识别,那不就乱套啦,谁也不认识谁,那可怎么行呢!而且啊,不同的糖蛋白还有不同的功能呢。
有些糖蛋白能让细胞黏在一起,就像小朋友手牵手一样;有些呢能帮助细胞传递信号,就像通讯员一样跑来跑去传达消息。
咱人体里有那么多细胞,每个细胞都离不开糖蛋白呀。
要是糖蛋白的合成出了问题,那可不得了啦,说不定就会生病呢。
所以说呀,糖蛋白的合成可真是太重要啦!咱们可得好好保护咱们的细胞,让它们能好好地工作,合成出健康的糖蛋白。
总之,糖蛋白的合成就是这样一个既神奇又重要的过程,它就像细胞世界里的一场精彩演出,每个角色都不可或缺,共同演绎着生命的奇妙!。
植物细胞高尔基体

植物细胞高尔基体
植物细胞高尔基体是一种细胞器,被称为细胞内的“邮局”,承担着蛋白质合成、修饰、分拣和运输等重要功能。
高尔基体由许多扁平的、呈半曲管状的膜囊构成,存在于细胞质中。
高尔基体具有以下重要功能:
1.糖蛋白的修饰与合成:高尔基体是合成和修饰糖蛋白的主
要场所。
在高尔基体内,通过糖基转移酶等酶的作用,对合成的蛋白质进行糖基化修饰,形成糖链。
这些糖链在蛋白质折叠、稳定性以及与其他分子的相互作用中起到重要作用。
2.蛋白质细胞分拣:高尔基体对蛋白质进行分类和标记,并
将它们进一步发送到目标位置。
根据目的地的不同,可能通过囊泡运输将蛋白质转运到细胞膜、内质网或其他细胞器中。
3.溶酶体和膜的修复与更新:高尔基体参与溶酶体的形成和
维持。
溶酶体是一种消化细胞内外的废弃物和病原体的囊泡,高尔基体通过将酶和其他成分发送到溶酶体中来维持其功能。
此外,高尔基体还参与细胞膜的修复和更新。
4.分泌蛋白质的合成与释放:高尔基体合成和存储大量的蛋
白质分子,其中包括很多用于细胞外分泌的蛋白质。
通过囊泡运输,这些蛋白质可以合成并最终释放到胞外,参与细胞信号转导、外泌体分泌等重要过程。
总的来说,植物细胞高尔基体在细胞内物质的合成、修饰和分拣过程中起到关键的作用。
它通过合成和修饰蛋白质、分拣和运输分子,维持了细胞的正常功能并参与了许多重要的生物过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
糖蛋白合成位置
糖蛋白是一种糖基化蛋白质,由蛋白质和糖分子组成。
它们在细胞膜、血管内皮细胞和胶原纤维中广泛存在,起到结构支持和细胞信号传导
的重要作用。
糖蛋白的合成需要通过一系列的化学反应和酶催化才能
完成,而这些反应主要发生在内质网和高尔基体内。
在细胞内,糖蛋白的合成主要发生在内质网中。
在这里,基础蛋白链
经过翻译后开始糖基化过程,即糖基转移酶催化将糖分子转移至蛋白
质分子上。
在糖基化过程中,糖分子会形成分支链,形成复杂的多糖
结构。
这一过程是一个高度组织化的过程,并且需要多个酶的相互作
用才能完成。
糖蛋白的产生具有可逆性,所以在内质网中糖蛋白的合成过程中,还
会发生质量控制的过程,即将产生错误的糖蛋白排除。
这一过程主要
由转移酶和信号识别和质量控制酶等组成。
内质网合成的未成熟的糖蛋白被转运到高尔基体,在这里进一步进行
修饰和加工。
高尔基体是一个膜系统,其中包括不同的逆流运输质,
其中某些有时被称为糖基转移酶。
这些酶进一步修饰糖蛋白中的糖链,形成复杂的糖蛋白结构。
在加工的过程中,糖蛋白的复杂度不断增加,包括糖分子的类型和数量。
在高尔基体内部,糖蛋白按照它们不同的标志和结构被进一步分泌,这个过程叫做分泌。
分泌的糖蛋白经过一系列的质量控制和验证;不合格的糖蛋白被运输到溶酶体溶解。
加工完成的糖蛋白被运输到其它细胞结构,例如细胞膜、外泌体或血管内皮细胞。
总的来说,糖蛋白的合成是一个复杂的化学反应过程,在内质网和高尔基体中发生。
这一过程需要多个酶、分子和逆流运输质共同作用,才能完成糖蛋白的组装和糖基化。
糖蛋白的结构和构成影响着其在生物学过程中的功能和信号传导。
对于研究疾病机制和开发药物,我们需要深入理解糖蛋白的合成和结构,以便能够精准干预相关的信号通路。
